摘要
α-突触核蛋白是一种小蛋白,对了解帕金森病及其相关疾病具有特殊意义。α-突触核蛋白不仅存在于帕金森病的路易体中,而且α-突触核蛋白基因突变可导致帕金森病的遗传性,而正常α-突触核蛋白表达可增加散发性或非家族性帕金森病的发病风险。散发性和家族性帕金森病的特征都是几组神经元的大量丧失,包括黑质的多巴胺能细胞,这是目前大多数对症治疗的目标。因此,我们预测α-突触核蛋白,特别是在其突变形式或表达水平增加的情况下,是一种有毒的蛋白质,因为它与神经元细胞死亡率的增加有关。这篇综述将讨论α-突触核蛋白被证明是有毒的实验背景。我还将概述关于α-突触核蛋白触发神经元损伤的机制,并确定目前我们在这一主题知识中的一些空白。最后,我们将讨论α-突触核蛋白毒性的治疗意义。
所有神经退行性疾病都有一个共同的现象:随着疾病的发展,神经元(通常是相对特定的群体)逐渐消失。在某些情况下,我们可以通过治疗患者的一些症状来部分缓解他们的症状。然而,由于我们不了解神经元死亡的底层机制,退化仍在无情地继续,旧的症状往往在新症状出现时失去反应。在疾病过程的最后,根据我们从疾病病理中收集到的信息,我们只剩下一些可能发生的事情的线索事后剖析样本。总的来说,神经退行性变的根本原因仍然不清楚,尽管罕见的基因变异是有帮助的,因为我们可以确定遗传突变是特定家族疾病的触发因素。
在这里,我将从一种蛋白质α-突触核蛋白的背景下讨论与帕金森病(PD)相关的细胞损失,它与该疾病有几个联系。在此过程中,我将概述我们所知道的蛋白质导致细胞死亡的方式。在此之前,有必要讨论PD是什么,以及它不是什么。
PD中的细胞死亡
人们常说帕金森病是第二常见的神经退行性疾病,是多巴胺神经元丧失的结果。第一个事实是无聊的,第二个事实只是故事的一部分。的确,PD患者纹状体中多巴胺的大量损失是由黑质致密部多巴胺能投射神经元的相对选择性损失造成的。生化测量和成像方法都表明,在临床帕金森症发生之前,纹状体多巴胺至少降低了70%,并随着时间的推移而恶化[1].这些对纹状体多巴胺耗损程度的估计,结合对大多数多巴胺能神经元在疾病过程结束时丢失的观察,暗示在帕金森病的整个过程中有大量的细胞死亡。不可能直接显示这一点,但对神经功能正常的人和非人灵长类动物的黑细胞数量的测量显示,随着年龄的增长,多巴胺神经元会缓慢渐进地丧失[2].这种观点认为,帕金森症是一种加速的,但仍然缓慢的细胞死亡表型,通常会随着衰老而出现[3.].
然而,虽然黑质中的多巴胺能神经元存在相对脆弱性[4],并不是所有的多巴胺细胞都受到PD的影响。例如,尽管腹侧被盖区投射到伏隔核的多巴胺能神经元确实退化了[5],与黑质致密部的多巴胺能神经元相比,这些细胞相对较少[6,7].
此外,并不是PD中所有受影响的神经元都是多巴胺能的。非运动症状是许多PD患者的严重问题,通常通过L-DOPA(3,4-二羟基- l -苯丙氨酸)替代疗法来治疗[8].在帕金森病中退化的非多巴胺能细胞的一个很好的例子是迷走神经背核中的胆碱能神经元[9].有人认为,非黑质区域的受累是PD复杂临床表现的基础[10].因此,尽管PD中细胞死亡有一定的特异性,但对任何特定的神经递质群或解剖区域都没有绝对选择性。还需要注意的是,黑神经元的丧失发生在不同的病理情况下[4黑细胞丢失本身就定义了临床术语帕金森症,而不是帕金森病。
当讨论PD中伴随细胞死亡出现的其他主要病理事件时,这一区别也很重要,如路易小体和路易神经突的形成。路易体是蛋白质和脂质的细胞内沉积物[11传统上用伊红染色,但现在对特定标记蛋白的抗体更敏感地识别它们[12].使用电子显微镜,路易体是具有可识别的核心和晕的纤维结构[13].路易氏病的范围现在被认为包括了患病大脑的许多区域[14例如,包括嗅球、中缝核、蓝斑核和迈耶内特基底核。此外,一些报告表明黑质并不是路易小体形成的第一个地方。15].这与每个区域的细胞损失程度之间的关系还没有很好地定义。在患有路易体(DLB,也被称为弥漫性路易体病或DLBD)的痴呆症中也可以看到路易体,这表明PD和DLBD通过共同的病理和可能共同的病因相互关联。
因此,帕金森病是一种伴随着路易小体形成的黑质细胞大量丢失的疾病。细胞丢失和路易体对帕金森病都不是绝对特异性的,但在目前的定义下,两者都是帕金森病诊断的必要条件[16].这篇综述将专注于细胞死亡,但重要的是要了解更多一点关于最常用的路易体标记;α-核蛋白。
α-Synuclein是PD过程的标记物
第一个以α-突触核蛋白命名的蛋白质家族成员是从电鳗的神经肌肉连接处克隆出来的[17].针对这种蛋白质的抗体同时标记了突触和细胞核,导致了突触核蛋白的命名。从斑胸草雀身上克隆出一种相关蛋白,该蛋白在学习鸣叫的过程中被上调,这是一个突触具有巨大可塑性的时期[18].在人类中,共有三个突触核蛋白家族成员(α-,β-,γ-),所有的突触核蛋白基因在物种内部和物种之间都相对保守[19].突触核蛋白基因是脊椎动物谱系所特有的,无论是单细胞生物(包括酵母)还是无脊椎动物(黑腹果蝇,秀丽隐杆线虫)有任何明显的突触核蛋白同源物。此外,灵长类α-突触核蛋白序列与其他脊椎动物突触核蛋白的不同之处在于,在53号位置上,一个苏氨酸被丙氨酸取代[20.].这两个关于突触核蛋白家族中进化关系的有趣事实对于理解一些已经探索了突触核蛋白的实验系统是很重要的。
α-突触核蛋白的正常功能尚不清楚。尽管它在大脑中表达量很高,特别是在神经元中,但它也存在于其他组织中,如造血细胞[21,22].α-突触核蛋白可与脂质结合[23在神经元中,与突触前囊泡有关[24,25和质膜,可能通过脂质筏[26].α-突触核蛋白与囊泡的结合受突触活性的调节,在神经元受到电刺激后,该蛋白与囊泡分离,只是缓慢地重新结合[27].然而,α-synuclein敲除小鼠仅表现出神经传递的微妙异常[28- - - - - -30.],这表明α-突触核蛋白在突触中起着非必要的作用。有证据表明,在存在活性氧或一氧化氮的条件下,这种调节作用可能更为重要[31,32],尽管其机制尚未完全确定。
在正常大脑中,α-突触核蛋白免疫染色显示整个神经泌的弥漫性反应模式与主要的突触定位一致[25].然而,在PD大脑中,α-synuclein抗体强烈染色路易体[33和路易神经突[34].由于这种敏感性,α-突触核蛋白染色现在比伊红或泛素染色更常用于这些结构。生化分析表明,α-突触核蛋白是路易体的主要蛋白质成分,可能是路易体纤维结构的一部分[35].沉积的,病理形式的α-突触核蛋白聚集,表现出比正常蛋白质更低的溶解性[36并可通过截断、硝化、泛素化和磷酸化在翻译后进行修饰[37- - - - - -40].
因此,α-突触核蛋白沉积到路易小体是PD疾病状态的一个标志。然而,因为我们需要路易体来诊断帕金森病,这并不是α-突触核蛋白参与疾病过程的特别有力的论据。同样需要注意的是,尽管我们不能确定路易体之前是否在最终死亡的细胞中形成,但发现路易体的单个神经元是那些在疾病过程中幸存下来的神经元(尽管它们仍然可能功能失调)。最近,有研究表明,将功能性多巴胺能神经元移植到PD患者的大脑中,作为一种治疗干预手段,可形成路易体[41,42,虽然这种情况并不经常出现[43].这些胚胎细胞在移植后仍然保持着明显的健康和功能,这表明PD大脑的环境使年轻的细胞也容易形成路易小体。
总之,现有的证据表明α-突触核蛋白是PD/DLB过程的标记物,但没有证明它具有因果作用。证据来自各种人类基因研究。
α-Synuclein可引起PD
在了解帕金森病方面的一个关键发现是,有报道称α-突触核蛋白基因中的A53T突变是显性遗传性疾病的病因[44].这是关于孟德尔基因可能是帕金森病病因的第一份明确报告,而在那之前,帕金森病一直被认为是一种非遗传疾病。有趣的是,发现的第一个突变是A53T,即人类的丙氨酸向在啮齿动物和许多其他物种中发现的祖先苏氨酸的逆转。此后,另外两个点突变,A30P [45]和E46K [46,在不同的家庭中都有报道。同样重要的是,尽管许多病例报告具有“PD”表型,但事实上,A53T和E46K中的一些患者[46的家族更广泛地参与突触核蛋白的沉积[47,48以及可能由非多巴胺能系统的这种参与程度导致的临床特征[49].
第二组重要病例是正常野生型等位基因的增殖SNCA该基因编码α-突触核蛋白。例SNCA重复具有脑干显性PD表型[50],而有三倍染色体的病例则有路易体病,这同样涉及到大脑的几个区域[51,52].对三倍复制过程中蛋白质水平的测量显示,血液中α-突触核蛋白的水平会翻倍,在发现路易小体的大脑皮层中,蛋白质的水平和沉积也会增加[21].因此,即使没有序列变异,α-突触核蛋白的剂量也可能是路易体病的诱因。
第三个遗传证据来自于α-突触核蛋白基因周围的常见变异与零星PD的终生风险相关的报道。启动子区域,特别是Rep1多态重复[53基因3'端多态性与PD相关[54].虽然目前还不清楚这些风险变异是如何影响PD终身发病率的,但似乎它们增加了大脑中α-突触核蛋白的水平。
总的来说,人类遗传数据强烈支持α-突触核蛋白在PD/DLBD中的因果作用。路易体是因果关系还是因果关系尚不清楚,但它们确实支持α-突触核蛋白是散发性PD和遗传性PD之间的重要联系这一观点。各种证据表明α-突触核蛋白是一种潜在的毒性蛋白,满足PD病因的要求[55].现在的问题是,α-突触核蛋白是如何、在什么情况下是有毒的,我们能对此做些什么吗?
α-突触核蛋白何时何地有毒?
鉴于细胞损失是人类PD的主要事件,结合α-突触核蛋白在疾病中起因果作用的证据,我们有理由推断α-突触核蛋白对人类神经元是有毒的。时间过程很可能是漫长的,最有可能的解释是,有异步的细胞死亡,导致相对脆弱的神经元种群缓慢耗尽。然而,观察人类大脑中的细胞死亡是不可能的,因此我们不得不求助于实验模型来证实或反驳α-突触核蛋白有毒的观点。
酵母模型可能是用来显示人类α-突触核蛋白表达引起毒性事件的最简单的系统。在生长和固定期培养中,α-突触核蛋白表达增加限制细胞生长[56- - - - - -65].这些实验对于确定这种蛋白质的毒性作用的途径非常有用。α-突触核蛋白的毒性也已被证实果蝇,其中多巴胺能神经元细胞损失已被报道[66- - - - - -73,尽管这个结果有点争议[74的影响是适度的。蠕虫秀丽隐杆线虫也可以用来证明α-突触核蛋白可以破坏一个完整的,在活的有机体内,设置[75- - - - - -80].联系这三个模型系统的是,它们都显示了α-突触核蛋白在有机体中正常不存在的表达的有害影响。对这些数据的一种解读是,至少就持续数天到数周的毒性而言,蛋白质的正常功能可能与此无关。
α-突触核蛋白通常存在于哺乳动物细胞培养模型中。两个常用的系统是初级神经元,包括腹侧中脑的多巴胺能培养,或成神经细胞瘤衍生细胞系。表明α-突触核蛋白最显著作用的实验包括蛋白质瞬时表达的实验,例如从病毒载体中[81- - - - - -86],或由诱导启动子系统控制表达[87- - - - - -89],尽管一些作者报告了在类似情况下缺乏毒性[90].在中脑培养物中,多巴胺神经元的毒性高于其他细胞[81],这可能与PD中黑人神经元的相对脆弱性有关。一些实验很好地表明,野生型和突变型蛋白质之间的差异实际上是剂量的问题,随着表达水平的增加,正常蛋白质变得与显性突变体一样具有毒性[89].
尽管这些基于细胞的模型对理解机制有潜在的帮助,但这些模型被从它们的在活的有机体内与疾病的预期进展数年相比,患者往往在几天内出现细胞损失。一种较为完整的方法是利用转基因技术在小鼠中枢神经系统的不同部位表达α-突触核蛋白。其中一些模型显示毒性,特别是在脊髓中,但没有黑细胞损失或损失不大[91- - - - - -97].一些模型确实显示了α-突触核蛋白的积累和不溶性[例如,]36,91,93,98]],尽管真正的路易体是否形成还不确定。因此,迄今报道的大多数小鼠模型都能更好地理解α-突触核蛋白沉积,而不是单纯的细胞毒性。为什么会出现这种情况尚不清楚,但有趣的是,与小鼠α-突触核蛋白敲除的转基因模型交叉会加剧表型[99- - - - - -101,这表明老鼠蛋白的存在以某种不确定的方式限制了损伤。由于缺乏能够完全捕捉人类表型的理想PD小鼠模型,限制了我们目前对α-突触核蛋白毒性的研究。虽然这是一个值得追求的目标,但鉴于老鼠寿命的限制和老鼠与人之间生理上的差异,创建这样一个理想的老鼠模型可能非常具有挑战性。
传统转基因的另一种替代方法是使用病毒载体将α-突触核蛋白直接传递到小鼠黑质[102,老鼠[103- - - - - -106或非人类灵长类动物[107- - - - - -109].在这些方法中,显著的细胞损失和α-突触核蛋白沉积被注意到。细胞损失的程度没有人类帕金森病那么剧烈,行为影响也同样不大。然而,这里的关键观察是α-突触核蛋白可以诱导毒性在活的有机体内使用脊椎动物,在几个星期的时间过程中,允许一些解剖机制。
综上所述,所有这些证据都表明α-突触核蛋白可以在多种情况下诱导毒性,从简单的生物体到灵长类动物黑质的多巴胺神经元。目前尚不清楚是否所有这些情况都与人类疾病直接相关,因为细胞损失可能更持久,但作为一个实际问题,这样的模型至少提供了一个机会来检查α-突触核蛋白触发神经元死亡的机制。
为什么α-突触核蛋白是有毒的?
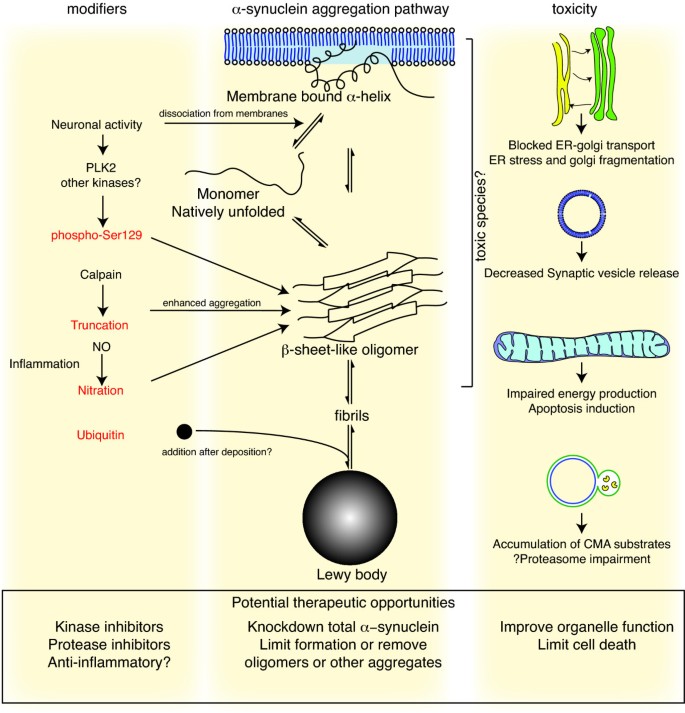
上述一些模型系统已被用于探讨α-突触核蛋白引起细胞死亡的机制。这些通常可以按蛋白质本身的各个方面进行分类,蛋白质对生物系统的影响(见图)1).附录1强调了与这个关键问题相关的一些关键观察结果。
α-突触核蛋白毒性事件.中间的面板显示了蛋白质聚集的主要途径。单体α-突触核蛋白在溶液中原生展开,但也能以α-螺旋形式结合到膜上。这两种物种似乎在细胞内处于平衡状态,尽管这尚未得到证实。从在体外结果表明,展开的单体可以先聚合成小的低聚体,然后再聚合成高分子量的不溶性原纤维。在细胞环境中,有一些证据表明脂质的存在可以促进低聚物的形成:α-突触核蛋白也可以形成环状的孔状结构,与细胞膜相互作用。α-突触核蛋白沉积到路易小体等病理结构中可能是某些神经元发生的晚期事件。左边是这个过程中已知的一些修正器。神经元的电活动改变了α-突触核蛋白与囊泡的联系,也可能刺激polo样激酶2 (PLK2),该激酶已被证明可以磷酸化α-突触核蛋白的Ser129位点。其他激酶也被认为参与其中。除了磷酸化、通过蛋白酶(如钙蛋白酶)的截断,以及硝化(可能通过炎症过程中出现的一氧化氮(NO)或其他活性氮物种),所有这些都修饰共核蛋白,使其具有更高的聚集倾向。在路易体上添加泛素(如黑点所示)可能是沉积的次要过程。右边是一些α-突触核蛋白介导毒性的拟议细胞靶点,包括(从上到下)er -高尔基体运输、突触囊泡、线粒体和溶酶体和其他蛋白水解机制。在上述每一种情况下,都有人提出α-突触核蛋白具有有害的作用,如下箭头所示,尽管目前尚不清楚其中任何一种对神经元毒性是必要的还是充分的。
α-突触核蛋白的蛋白质化学及其毒性研究
α-突触核蛋白具有很强的自缔合倾向在体外[110,111],因此,毒性潜在驱动力的一个主要候选者是聚集物种的形成。关于这一观点的一个重要问题是,哪些物种存在于细胞/组织中。低聚种可从细胞中分离[112- - - - - -114并源自human [21]和小鼠(野生型和α-突触核蛋白转基因)的大脑[115].在细胞和大脑中,低聚物特别见于膜富集部分[112,115],表明脂质环境对低聚物形成可能有影响。在一些模型中也发现了更高分子量的形式[116,尤其是在氧化应激后[117或暴露于小鼠的炎症触发物[One hundred.].α-突触核蛋白沉积的免疫反应性在转基因[91- - - - - -97或病毒式模式[102- - - - - -109].然而,聚集α-突触核蛋白的观察本身并不能证明聚集是重要的;正如路易体所讨论的,所有这些都证明了沉积的发生,而不是它的因果关系。
最近的一些研究试图回答这个问题,主要是使用基于细胞的方法。例如,在SY5Y细胞中,一些α-synuclein的寡聚形式触发钙的进入和毒性[118].有趣的是,不同种类的低聚物表现出不同的毒性,这表明并非所有的低聚物都是相同的。然而,本实验的性质是在细胞外添加α-突触核蛋白,这与细胞的病理生理情况可能相关,也可能不相关。由于α-突触核蛋白是细胞内的,似乎更有可能在细胞内形成聚集。路易体中纤维的存在支持了这一论点。然而,α-突触核蛋白最终会进入细胞外培养基[119在没有细胞的环境中,聚集的条件可能更适合。细胞外α-突触核蛋白的相关性是一个重要的问题,移植神经元中的路易体观察也提出了这个问题[41,42以及随之而来的“宿主移植物传递”假说。
一些研究试图解决细胞内α-突触核蛋白聚集是否有助于毒性。例如,一些成像技术表明,在活细胞的环境中,α-突触核蛋白可以形成小的低聚体,很可能以反平行构型[114,120这种低聚物可能与细胞毒性有关。
这些方法已被用于证明热休克蛋白(Hsps)的过表达可以减轻低聚物的形成和毒性[114,120,121].在活的有机体内, Hsps可以抑制α-synuclein在酵母中的毒性作用[59和在苍蝇里[67].这些研究是否构成了毒性需要聚合的正式证据尚不清楚,因为对这些数据还有其他的理论解释。例如,一种正式的可能性是,单体α-突触核蛋白是有毒的,因此,任何直接结合该蛋白的蛋白质都可以限制毒性。应该指出的是,α-突触核蛋白单体可能具有毒性的机制还未被探索,但同样,也没有证据表明毒性是绝对需要聚集的。或者,Hsps可能限制了初始聚集下游的有害事件,因此既不能作为支持或反对聚集在α-突触核蛋白毒性中的作用的证据。有趣的是,在果蝇模型中Hsp的表达降低了神经元毒性,而α-synuclein阳性包涵体的数量没有变化[67].
总的来说,这些考虑表明α-突触核蛋白具有蛋白质聚集能力,可以沉积在各种形式的包涵体中在活的有机体内但没有足够的证据表明聚集或沉积对毒性是必要的或充分的。事实上,一些证据表明,毒性可以与沉积分离,包括;在一些模型中未沉积的毒性细胞观察[81];α-突触核蛋白不同处理方法对苍蝇模型毒性和包体的差异影响[66,67];α-突触核蛋白的沉积在一些小鼠模型中没有明显的毒性作用[例如,]36]]。因此,该领域的一个关键挑战是了解蛋白质聚集是否与α-突触核蛋白的毒性作用有关。一种可能解决这个问题的方法是分离各种聚集的蛋白质,并在神经元内表达它们。从技术角度来看,这可能是非常困难的,而且总有可能小的聚集会产生大的聚集,从而混淆解释。另一种可能的方法是开发试剂,限制特定聚合物种的生物可用性,并利用这些试剂来探测哪些制剂在完整细胞中是有毒的。例如,针对聚合α-突触核蛋白的重组单链Fv抗体片段已被描述[122,123那可能会有帮助。
α-突触核蛋白具有许多附加的性质和聚集的倾向。一些已报道的翻译后修饰也被探索为可能的毒性介质。例如,针对Ser129位点磷酸化的α-突触核蛋白的抗体非常适合识别人脑中的路易氏病变[38],这表明Ser129磷酸化要么是沉积的一个因果事件,要么代表了蛋白质沉积后的一种常见修饰。因此,有几个小组已经制作了不能在这个残基(S129A)或伪磷酸化模拟物(S129D, S129E)上修饰的α-突触核蛋白版本,并确定了表达的毒性作用。在果蝇模型中,S129A的毒性较小,但与野生型蛋白相比,其形成包涵体的趋势增加[66].S129D的磷化效果相反,即毒性增加但夹杂物减少。相比之下,在大鼠中使用病毒过表达的类似实验显示了相反的结果,即S129A大大增加了表达的毒性作用[124].在哺乳动物细胞培养中,S129A形成包涵体的趋势减弱[125].
乍一看,这些结果似乎表明,与无脊椎动物相比,哺乳动物中与毒性相关的α-突触核蛋白的行为是相反的,需要注意的是,无脊椎动物中不正常存在这种蛋白质。然而,由于一些考虑因素,解释是复杂的。首先,α-突触核蛋白的表达水平对毒性是至关重要的,这在人类的案例中得到了证明,在三倍复制的情况下,蛋白水平的差异是2倍,在复制的情况下是1.5倍。其次,最近的数据表明,与真正磷酸化的野生型蛋白相比,磷酸化的S129D/E α-synuclein变体具有不同的生物物理特性[126].总的来说,这些考虑提出了一些重要的警告关于α-突触核蛋白聚集、毒性等浓度依赖行为的性质比较。
了解α-突触核蛋白磷酸化的另一种方法是确定介导磷酸化转移事件的激酶。酪蛋白激酶II和GRK2/5已被证明可以磷酸化α-突触核蛋白在体外或者在细胞中,在酵母中起作用[64和苍蝇[66]分别表明它们至少是活跃的在活的有机体内.最近,polo样激酶家族,特别是PLK2,已被证明具有活性在体外而且在活的有机体内在产生pS129 α-synuclein [127].PLK2的有趣之处在于,已知它对神经元活动有反应[128],提示神经元表型和α-突触核蛋白毒性之间可能存在联系。然而,目前尚不清楚PLK2抑制剂或基因敲除是否会限制α-synuclein的毒性作用在活的有机体内.这样的实验在一些物种中是可行的,如PLK2同系物存在于小鼠和苍蝇中,酵母中至少有一个马球激酶。
已有报道的α-突触核蛋白还有许多其他修饰,其中一些修饰在病理情况下比在正常情况下更常见,如硝化或截断。α-突触核蛋白的截断与较高的聚集倾向有关[129- - - - - -131].表达截断α-突触核蛋白的转基因小鼠有大量细胞损失[101尽管至少在一个系中,这是一种发育型而不是退行性表型[132].同样,由于毒性的窗口非常狭窄,不同的线之间的比较是困难的。截断过程中出现的一个问题是这些物种是在哪里产生的。α-突触核蛋白主要通过溶酶体途径降解[133,134,包括伴侣介导的自噬[135],溶酶体组织蛋白酶在蛋白质水解中很重要。因此,在溶酶体中发现了一些被截断的物种,它们似乎不太可能对细胞造成损伤。然而,α-突触核蛋白也是细胞质钙蛋白的底物[136- - - - - -139],因此更有可能产生细胞质毒性的截断种。因此,需要一些细节来证明哪些被截去的物种介导毒性,如果它们中确实有任何一种会。
氧化应激,包括神经递质多巴胺,与α-突触核蛋白聚集增加有关[89,140].多巴胺本身可能与α-突触核蛋白的毒性作用有关在体外[89],尽管这种机制不能解释为什么非多巴胺能神经元在疾病过程中早期死亡。α-Synuclein的表达可增强对氧化和硝化应激的敏感性[141,142,尽管在某些情况下它也可以起到保护作用[143].在大多数情况下,聚合的作用是不清楚的。
综上所述,α-突触核蛋白具有可能影响其毒性作用的聚集和翻译后修饰等特性。目前还不清楚毒性是否需要这些,一些结果还需要解决,例如关于S129磷酸化的工作。然而,还有一个更大的问题,那就是:突触核蛋白对负责其毒性作用的神经元有什么影响?
生物系统中α-突触核蛋白毒性的调节因子
一些来自细胞系统的相关数据已经在之前进行了回顾[144并将在这里讨论跨多个模型的例子。
推测α-突触核蛋白可能与其他生物分子相互作用介导毒性。因为α-突触核蛋白可以与脂质结合,膜是一个可能的目标。在体外, α-synuclein可形成孔状结构[145,146],以及从多系统萎缩(一种共核病)患者的大脑中分离出的共核蛋白环状环[147].表达α-突触核蛋白的细胞阳离子通透性增加[148]和从培养细胞制备或从肾上腺髓质分离的囊泡显示儿茶酚胺渗漏[149].这些事件可能与质膜或囊泡表面的非特异性孔或类似结构的形成一致。
由于α-突触核蛋白与突触囊泡结合,突触传递可能是突触核蛋白毒性的直接或间接靶点。其中一个例子来自于一项研究,该研究表明A30P α-突触核蛋白改变了原代细胞和嗜铬细胞中含有儿茶酚胺的囊泡的胞出[150].此处的作用可能发生在胞吐的后期,在囊泡膜融合之前[150].
α-突触核蛋白对囊泡功能的作用可能介导毒性的进一步证据来自酵母中的抑制筛选[63].在同一个体中,这类缺陷可定位于内质网(ER)-高尔基泡质运输中的一个阻滞[151].支持这一观点的是,有证据表明内质网应激[87和高尔基体碎裂[152在哺乳动物细胞系统中。
Rab1是一种影响囊泡动力学的GTPase,过表达至少能部分挽救α-突触核蛋白在酵母、蠕虫和哺乳动物细胞中的毒性作用[151].因此,α-突触核蛋白的一些毒性作用在物种间是保守的,包括对泡囊运输的损伤,这可能表现为神经元突触前泡囊释放的损伤。
也有人认为,包括线粒体在内的其他膜细胞器也受到α-突触核蛋白的影响[87,88,153].最近的数据表明,至少在某些条件下,α-突触核蛋白的一部分可以定位于线粒体[154- - - - - -157].α-突触核蛋白的表达增加了细胞对鱼藤酮的敏感性,鱼藤酮是一种线粒体复合物I抑制剂[78,158].此外,在酵母模型中,a-突触核蛋白毒性需要完整的线粒体功能,尽管也应该注意到,在相同的情况下,移除线粒体也具有相当的破坏性[57].α-突触核蛋白与线粒体相互作用并引起线粒体损伤的机制尚未完全解决,鉴于线粒体在凋亡途径中的中心作用,可能这种作用是次要的诱导凋亡。据报道,α-突触核蛋白水平的升高可触发各种细胞类型的凋亡[159- - - - - -161].在突触核蛋白毒性的酵母模型中也发现了一些凋亡标记物[59].α-突触核蛋白毒性可通过caspase抑制剂或敲低caspase-12来挽救[87].caspase-3的激活已在转基因小鼠中报道过[162caspase-9已在小鼠病毒模型中被报道过[102和老鼠[106].然而,这些研究显示只有少数caspase阳性细胞,因此凋亡是否是表达α-synuclein的细胞死亡的唯一方式尚不清楚。
α-突触核蛋白可与溶酶体的膜结合[135]和抑制溶酶体功能[163和伴侣介导的自噬[135].最近的研究结果表明,CMA与转录因子MEF2D的调控有关,且该调控可被α-突触核蛋白的表达破坏,导致神经元死亡[164].作为蛋白质转换失调的另一个例子,α-突触核蛋白(特别是α-突触核蛋白低聚物)也可以抑制蛋白酶体[81,88,163,165- - - - - -167],尽管尚不清楚预测的蛋白酶体底物的改变翻转是否发生在活的有机体内[168].
一般的原理是,α-突触核蛋白的表达可以影响多个系统,如果它们之间有一个共同的主题,很可能是α-突触核蛋白可以结合脂质。一些证据表明脂质结合可以促进低聚物的形成[115,145,169].因此,这种解释将一种主要的蛋白质异常与该蛋白质的细胞靶点联系起来。如别处所讨论[144],确定哪些是真正的主要事件,哪些是次要事件仍然是一个挑战。虽然这种区分是一个智力问题,但如果我们想要限制PD的疾病进程,它也可能与决定细胞死亡的哪些方面有关。
潜在的治疗方法与α-突触核蛋白毒性有关
这里的一个关键问题是决定是尝试靶向蛋白质还是靶向介导细胞损伤的过程。两者的吸引力各有不同的原因,尽管两者也都很困难(见图)1附录2是关键的下一步步骤)。
如果有一种致病的α-突触核蛋白聚集形式,那么一种策略将是针对该物种。如果我们提出不溶性纤维是有毒的,那么‘纤维破坏剂’将是前进的道路[综述在[111]],但如果可溶性寡聚物破坏细胞,我们就会想要阻止它们的形成或鼓励它们的周转。如上所述,纤维和低聚物都可以在不同的模型中找到,单独或两者都可能是有毒的。对于低聚物,如果不同形式的低聚物具有不同的毒性,情况就更加复杂[118],这表明我们可能需要小心哪一个我们的目标是低聚物。
或者,我们可以不知道哪些物种是重要的,并尝试减少所有α-突触核蛋白的表达。有报道称,增加自噬可以帮助清除聚集倾向的蛋白质,包括α-突触核蛋白[170].反义方法可能也有帮助,据报道在大鼠[171和老鼠[172大脑)。这种方法基于这样一种想法,即α-突触核蛋白对人类的中枢神经系统功能确实是不可或缺的,就像它在小鼠中一样[28,30.],但也许即使是蛋白质水平的适度下降也足以减缓PD的进展。
我们也可以尝试改变α-突触核蛋白的修饰,特别是如果这些修饰是针对致病形式的。例如,PLK2作为Ser129激酶的例子[127如果能够开发出足够特异性的激酶抑制剂,可能会提供一种方法来验证这种残基的磷酸化是发病机制的关键。再次,假设特异性可以实现,阻断其他修饰,如截断或亚硝基化可能是有趣的——后者可能是抗炎方法的一般规则的一部分。然而,这种方法只有在修饰确实针对致病形式并对细胞毒性做出积极贡献(即在过程中不是旁观者)时才会有帮助。
最后,我们可能针对α-突触核蛋白的一种或多种与毒性相关的细胞效应。这样做的好处可能是不去管这种蛋白质,如果事实证明α-突触核蛋白在人脑中具有特定的功能,这可能是有用的。当然,困难在于理解为什么这种蛋白质是有毒的,尽管Rab1 [151,173)表明这是一个可处理的问题,至少在原则上是这样。
结论
细胞死亡是帕金森病病理的重要组成部分。尽管这一过程是一个神秘的过程,但有毒蛋白质的主要嫌疑人是α-突触核蛋白。假设毒性确实是由蛋白质的异常形式引起的,包括正常基因的表达增加,那么有两个主要方面可能是治疗的目标。首先,蛋白质容易聚集,抗聚集化合物,或者简单限制净表达水平的方法可能是有帮助的。其次,有许多分子事件主要围绕膜或细胞器相互作用,可能导致毒性,这些也可能是治疗的目标。未来的工作应该致力于探索这些可能性,以及开发具有更强细胞死亡信号的模型,以更准确地表示PD中看到的神经元实质性损失。
附录1:主要观察结果
α-突触核蛋白在PD和相关疾病中的作用被病理学和遗传学数据的收敛所强调。因为PD的部分病理表型涉及神经元的细胞死亡,特别是黑质致密部多巴胺神经元的死亡,这表明α-突触核蛋白可能是一种有毒的蛋白质。为了支持这一论点,在各种实验系统中进行了以下关键观察:
-纯在体外α-突触核蛋白缺乏构象抑制,容易促进不适当的聚集。这可以通过突变、浓度增加或与蛋白质病理沉积相关的几种蛋白质修饰来增强在活的有机体内.α-突触核蛋白还能结合脂质和细胞膜在体外
-在多种物种中,α-synuclein的表达可促进毒性事件。其中包括酵母菌、蠕虫和苍蝇等生物,这些生物中没有α-突触核蛋白的同系物,这表明无论其正常功能如何,这种蛋白质都可能是有毒的。
哺乳动物细胞培养的数据也支持α-突触核蛋白的毒性作用,特别是对多巴胺能细胞。结果完好无损在活的有机体内这些系统是混合的,在一些转基因小鼠模型中毒性仅限于脊髓,而在啮齿类动物和非人灵长类动物中通过病毒介导的过表达对多巴胺能神经元产生中度毒性作用。
-目前所涉及的机制尚不清楚,但与几种细胞膜的结合可能导致中毒事件。
附录2:关键的下一步步骤
在我们对α-突触核蛋白病理生物学的理解应用于治疗开发之前,需要解决以下关键问题:
-我们需要更好地理解α-突触核蛋白的正常功能,这样我们就可以评估它在哺乳动物中枢神经系统中可能发挥的毒性作用,从而突出限制该蛋白表达或功能的潜在有害影响。
-我们需要清楚地确定是哪些细胞途径导致了蛋白质的病理效应。在酵母模型中已经进行了一些伟大的工作,强调了囊泡运输的中断,但现在重要的是确定神经元中的类似过程是什么,以及这是否足以解释该系统中的α-突触核蛋白毒性。
-我们需要开发一种模型,其中有一种损伤可以更好地接近人类PD中看到的细胞丢失的严重程度。随着疾病的发展,这将允许对涉及毒性的途径进行更严格的测试。加速时间进程是有帮助的,而且可能是必要的,但病理应该与人类PD相似,在模型的某个点上,黑人神经元应该受到影响,但不一定是首先或唯一的影响。
缩写
- 下文/ DLBD:
-
路易体痴呆/弥漫性路易体病
- 呃:
-
内质网
- 左旋多巴:
-
3, 4-dihydroxy-L-phenylalanine
- 帕金森病:
-
帕金森病。
参考文献
Brooks DJ:帕金森病的早期诊断。中华医学杂志。1998,44:S10-18。10.1002 / ana.410440107。
朱毅,Kordower JH:猴子和人类α -突触核蛋白年龄相关的增加与黑纹状体多巴胺缺失相关:这是帕金森病的目标吗?神经生物学杂志2007,25:134-149。10.1016 / j.nbd.2006.08.021。
Thal DR, Del Tredici K, Braak H:正常大脑衰老和疾病中的神经退行性变。科学老龄化知识环境。2004,2004:pe26-10.1126/sageke.2004.23.pe26。
Dickson DW:帕金森病的选择性脆弱性与细胞死亡机制之间的联系。中华流行病学杂志,2007,17(4):319 - 319。10.2353 / ajpath.2007.061011。
赫希EC:帕金森病的生物化学与多巴胺能系统的特别参考。中华神经科学杂志1994,9:135-142。10.1007 / BF02816113。
Chung CY, Seo H, Sonntag KC, Brooks A, Lin L, Isacson O:中脑多巴胺能神经元的细胞类型特异性基因表达揭示了其脆弱性和保护的分子。中国生物医学工程学报,2005,14:1709-1725。10.1093 /物流/ ddi178。
钙、衰老和帕金森氏症中的神经元脆弱性。中华神经杂志,2007,6:933-938。10.1016 / s1474 - 4422(07) 70246 - 6。
Langston JW:帕金森氏综合症:帕金森氏症只是冰山一角。中华医学杂志,2006,29(5):591-596。10.1002 / ana.20834。
Gai WP, Blumbergs PC, Geffen LB, Blessing WW:帕金森病中年龄相关性迷走神经背侧神经元丢失。神经病学杂志,1992,42:2106-2111。
杰林格KA:帕金森病的尸检研究——是否有可能检测出特定症状的大脑区域?中华神经科学杂志,1999,56:1-29。
Gai WP,袁海霞,李晓强,Power JT, Blumbergs PC, Jensen PH:路易小体中α -突触核蛋白、泛素和脂类共定位和分离的原位和体外研究。中华神经科学杂志,2000,32(4):326 - 326。10.1006 / exnr.2000.7527。
Lennox G, Lowe J, Morrell K, Landon M, Mayer RJ:抗泛素免疫细胞化学在弥漫性路易体病检测中的敏感性高于常规技术。中华神经外科杂志。1989,52:67-71。10.1136 / jnnp.52.1.67。
Gibb WR, Scott T, Lees AJ:帕金森病的神经元包涵体。中华医学杂志。1991,6:2-11。10.1002 / mds.870060103。
Braak H, Del Tredici K, Rub U, de Vos RA, Jansen Steur EN, Braak E:散发性帕金森病的脑病理分期。神经生物学杂志,2003,24:197-211。10.1016 / s0197 - 4580(02) 00065 - 9。
Del Tredici K, Rub U, De Vos RA, Bohl JR, Braak H:帕金森病的病理从大脑的哪里开始?中华神经病学杂志,2002,29(4):426 -426。
特发性帕金森病临床诊断的准确性:100例临床-病理研究。中华神经外科杂志,1992,55:181-184。10.1136 / jnnp.55.3.181。
Maroteaux L, Campanelli JT, Scheller RH:突触核蛋白:一种定位于细胞核和突触前神经末梢的神经元特异性蛋白。神经科学杂志,1988,8:2804-2815。
George JM, Jin H, Woods WS, Clayton DF:一种在斑胸草雀鸣叫学习关键期调节的新蛋白质的表征。神经学报,1995,15:361-372。10.1016 / 0896 - 6273(95) 90040 - 3。
George JM:突触核蛋白。中国生物医学工程学报,2002,30 (3):366 - 366
Hamilton BA: α - synuclein A53T替代与帕金森病相关,也标志着旧世界和新世界灵长类的分化。基因组学,2004,43:739-742。10.1016 / j.ygeno.2003.09.016。
Miller DW, Hague SM, Clarimon J, Baptista M, Gwinn-Hardy K, Cookson MR, Singleton AB: SNCA位点三倍性家族性帕金森病患者血、脑α -突触核蛋白的变化。神经病学杂志,2004,62:1835-1838。
Scherzer CR、Grass JA、Liao Z、Pepivani I、Zheng B、Eklund AC、Ney PA、Ng J、McGoldrick M、Mollenhauer B、Bresnick EH、Schlossmacher MG: GATA转录因子直接调控帕金森病相关基因α -突触核蛋白。美国国家科学研究院。2008, 35(5): 557 - 557。10.1073 / pnas.0802437105。
Jo E, McLaurin J, Yip CM, St George-Hyslop P, Fraser PE: α -突触核蛋白膜相互作用与脂质特异性。中国生物医学工程学报,2000,29(3):369 - 369。10.1074 / jbc.M004345200。
Withers GS, George JM, Banker GA, Clayton DF:培养大鼠海马神经元突触前末梢突触蛋白(突触核蛋白,NACP)的延迟定位。《大脑科学》1997,99:87-94。10.1016 / s0165 - 3806(96) 00210 - 6。
Irizarry MC, Kim TW, McNamara M, Tanzi RE, George JM, Clayton DF, Hyman BT:人类中枢神经系统老年斑(NACP)非a β成分前体蛋白的表征。中华神经科杂志,1996,32(5):589 - 589。
Fortin DL, Troyer MD, Nakamura K, Kubo S, Anthony MD, Edwards RH:脂质木条介导α -突触核蛋白的突触定位。神经科学杂志,2004,24:6715-6723。10.1523 / jneurosci.1594 - 04.2004。
Fortin DL, Nemani VM, Voglmaier SM, Anthony MD, Ryan TA, Edwards RH:神经活性控制α -突触核蛋白的突触积累。神经科学杂志,2005,25:10913-10921。10.1523 / jneurosci.2922 - 05.2005。
Abeliovich A, Schmitz Y, Farinas I, Choi-Lundberg D, Ho WH, Castillo PE, Shinsky N, Verdugo JM, Armanini M, Ryan A, Hynes M, Phillips H, Sulzer D, Rosenthal A:缺乏α -synuclein的小鼠显示黑纹状体多巴胺系统功能缺陷。神经学报,2000,25:239-252。10.1016 / s0896 - 6273(00) 80886 - 7。
Steidl JV, Gomez-Isla T, Mariash A, Ashe KH, Boland LM:突变α -突触核蛋白转基因小鼠的短期海马突触可塑性改变。神经科学杂志,2003,14:219-223。10.1097 / 00001756-200302100-00012。
Cabin DE, Shimazu K, Murphy D, Cole NB, Gottschalk W, McIlwain KL, Orrison B, Chen A, Ellis CE, Paylor R, Lu B, Nussbaum RL:缺乏α -突触核蛋白的小鼠突触囊泡耗竭与突触对长时间重复刺激的反应减弱相关。神经科学杂志,2002,22:8797-8807。
Martin ED, Gonzalez-Garcia C, Milan M, Farinas I, Cena V: α -突触核蛋白敲除小鼠海马切片突触传递的应激源相关损伤。中华神经科学杂志2004,20:3085-3091。10.1111 / j.1460-9568.2004.03801.x。
Liu S, Ninan I, Antonova I, Battaglia F, Trinchese F, Narasanna A, Kolodilov N, Dauer W, Hawkins RD, Arancio O: α - synuclein可长期增加神经递质释放。王志强。2004,23:476 - 476。10.1038 / sj.emboj.7600451。
Spillantini MG, Schmidt ML, Lee VM, Trojanowski JQ, Jakes R, Goedert M:路易小体中的α -突触核蛋白。自然学报,1997,388:839-840。10.1038/42166。
Takeda A, Mallory M, Sundsmo M, Honer W, Hansen L, Masliah E:神经退行性疾病中NACP/ α -突触核蛋白的异常积累。中华流行病学杂志,1998,32(4):367-372。
Crowther RA, Daniel SE, Goedert M:从帕金森病大脑黑质分离的α -突触核蛋白丝的特征。中华神经科学杂志,2000,29(4):381 - 381。10.1016 / s0304 - 3940(00) 01440 - 3。
Kahle PJ, Neumann M, Ozmen L, Muller V, Odoy S, Okamoto N, Jacobsen H, Iwatsubo T, Trojanowski JQ, Takahashi H, Wakabayashi K, Bogdanovic N, Riederer P, Kretzschmar HA, Haass C:在转基因小鼠模型中概述了α -突触核蛋白在人类路易斯病中的选择性不溶性。中华流行病学杂志,2001,29(4):394 - 394。
Anderson JP、Walker DE、Goldstein JM、DE Laat R、Banducci K、Caccavello RJ、Barbour R、Huang J、Kling K、Lee M、Diep L、Keim PS、Shen X、Chataway T、Schlossmacher MG、Seubert P、Schenk D、Sinha S、Gai WP、Chilcote TJ: Ser-129磷酸化是家族性和散发性路易体病中α -synuclein的主要病理修饰。中国生物医学工程学报,2006,29(3):359 - 359。10.1074 / jbc.M600933200。
Fujiwara H, Hasegawa M, Dohmae N, Kawashima A, Masliah E, Goldberg MS, Shen J, Takio K, Iwatsubo T: α - synuclein在synuclein病病变中的磷酸化。细胞生物学杂志,2002,4:160-164。10.1038 / ncb841。
Giasson BI, Duda JE, Murray IV, Chen Q, Souza JM, Hurtig HI, Ischiropoulos H, Trojanowski JQ, Lee VM:在共核病病变中,选择性α -突触核蛋白氮化与神经退行性变相关的氧化损伤。科学通报,2000,29(5):985-989。10.1126 / science.290.5493.985。
Tofaris GK, Razzaq A, Ghetti B, Lilley KS, Spillantini MG:路易体α -突触核蛋白泛素化是一种病理事件,与蛋白酶体功能损害无关。中国生物医学工程学报,2003,29(4):455 - 457。10.1074 / jbc.M308041200。
Kordower JH, Chu Y, Hauser RA, Freeman TB, Olanow CW:长期胚胎黑素移植治疗帕金森病的路易体样病理。中华医学杂志,2008,14:504-506。10.1038 / nm1747。
Li JY, Englund E, Holton JL, Soulet D, Hagell P, Lees AJ, Lashley T, Quinn NP, Rehncrona S, Bjorklund A, Widner H, Revesz T, Lindvall O, Brundin P:帕金森病患者移植物神经元中的路易小体提示宿主-移植物疾病的增殖。中华医学杂志,2008,14:501-503。10.1038 / nm1746。
Mendez I、Vinuela A、Astradsson A、Mukhida K、Hallett P、Robertson H、Tierney T、Holness R、Dagher A、Trojanowski JQ、Isacson O:多巴胺神经元植入帕金森病患者体内14年无病理变化。中华医学杂志,2008,14:507-509。10.1038 / nm1752。
聚合体MH、Lavedan C、Leroy E、Ide SE、Dehejia A、Dutra A、Pike B、Root H、Rubenstein J、Boyer R、Stenroos ES、Chandrasekharappa S、Athanassiadou A、Papapetropoulos T、Johnson WG、Lazzarini AM、Duvoisin RC、Di Iorio G、Golbe LI、Nussbaum RL:帕金森病家族α -synuclein基因突变。科学通报,1997,27(4):447 - 447。10.1126 / science.276.5321.2045。
Kruger R、Kuhn W、Muller T、Woitalla D、Graeber M、Kosel S、Przuntek H、Epplen JT、Schols L、Riess O:帕金森病α -突触核蛋白基因Ala30Pro突变中国农业科学,1998,18:106-108。10.1038 / ng0298 - 106。
Zarranz JJ, Alegre J, Gomez- esteban JC, Lezcano E, Ros R, Ampuero I, Vidal L, Hoenicka J, Rodriguez O, Atares B, Llorens V, Gomez Tortosa E, del Ser T, Munoz DG, de Yebenes JG: α -synuclein的新突变E46K导致帕金森和路易体痴呆。中华医学杂志。2004,55:164-173。10.1002 / ana.10795。
Duda JE, Giasson BI, Mabon ME, Miller DC, Golbe LI, Lee VM, Trojanowski JQ: Contursi亲缘中α -突触核蛋白与tau脑病理的并发性。神经病理学杂志,2002,104:7-11。10.1007 / s00401 - 002 - 0563 - 3。
Yamaguchi K, Cochran EJ, Murrell JR, Polymeropoulos MH, Shannon KM, Crowther RA, Goedert M, Ghetti B: 1例α -突触核蛋白基因A53T突变的弥漫性louy体病中大量神经包体和微液泡改变。神经病理学杂志,2005,11:298-305。10.1007 / s00401 - 005 - 1042 - 4。
Markopoulou K, Dickson DW, McComb RD, Wszolek ZK, Katechalidou L, Avery L, Stansbury MS, Chase BA: SNCA A53T家族性帕金森病的临床、神经病理和基因型变异。家族性帕金森病的变异性。神经病理学杂志,2008,116:25-35。10.1007 / s00401 - 008 - 0372 - 4。
chartierer - harlin MC、Kachergus J、Roumier C、Mouroux V、Douay X、Lincoln S、Levecque C、Larvor L、Andrieux J、Hulihan M、Waucquier N、Defebvre L、Amouyel P、Farrer M、Destee A: α -突触核蛋白位点复制是家族性帕金森病的病因。《医学杂志》2004,364:1167-1169。10.1016 / s0140 - 6736(04) 17103 - 1。
Singleton AB、Farrer M、Johnson J、Singleton A、Hague S、Kachergus J、Hulihan M、Peuralinna T、Dutra A、Nussbaum R、Lincoln S、Crawley A、Hanson M、Maraganore D、Adler C、Cookson MR、Muenter M、Baptista M、Miller D、Blancato J、Hardy J、Gwinn-Hardy K: α - synuclein位点三倍性引起帕金森病。科学通报,2003,32(4):531 - 536 / 536。
Fuchs J, Nilsson C, Kachergus J, Munz M, Larsson EM, Schule B, Langston JW, Middleton FA, Ross OA, Hulihan M, Gasser T, Farrer MJ:一个瑞典大谱系SNCA复制和三倍性引起的表型变异神经病学杂志,2007,68:916-922。wnl.0000254458.17630.c5 10.1212/01.。
Maraganore DM、de Andrade M、Elbaz A、Farrer MJ、Ioannidis JP、Kruger R、Rocca WA、Schneider NK、Lesnick TG、Lincoln SJ、Hulihan MM、Aasly JO、Ashizawa T、Chartier-Harlin MC、Checkoway H、Ferrarese C、Hadjigeorgiou G、Hattori N、Kawakami H、Lambert JC、Lynch T、Mellick GD、Papapetropoulos S、Parsian A、Quattrone A、Riess O、Tan EK、Van Broeckhoven C: α -synuclein基因启动子可变性与帕金森病的协同分析。《美国医学协会杂志》上。2006, 29(6): 661-670。10.1001 / jama.296.6.661。
Mueller JC、Fuchs J、Hofer A、Zimprich A、Lichtner P、Illig T、Berg D、Wullner U、Meitinger T、Gasser T: α -突触核蛋白多个区域与帕金森病相关。中华神经科杂志,2005,57:535-541。10.1002 / ana.20438。
Cookson MR:帕金森病的生物化学。生物化学学报,2005,34(4):359 - 361。10.1146 / annurev.biochem.74.082803.133400。
Brandis KA, Holmes IF, England SJ, Sharma N, Kukreja L, DebBurman SK: α - synuclein裂变酵母模型:浓度依赖性聚集,无质膜定位或毒性。中华分子神经科学杂志,2006,28:179-191。10.1385 / JMN: 28:2:179。
Buttner S, Bitto A, Ring J, Augsten M, Zabrocki P, Eisenberg T, Jungwirth H, Hutter S, Carmona-Gutierrez D, Kroemer G, Winderickx J, Madeo F:衰老酵母α -突触核蛋白毒性需要功能性线粒体。中国生物医学工程学报,2008,29(4):359 - 361。10.1074 / jbc.M708477200。
Dixon C, Mathias N, Zweig RM, Davis DA, Gross DS: α -突触核蛋白通过分泌途径靶向质膜并诱导酵母毒性。遗传学报,2005,17(4):347 - 359。10.1534 / genetics.104.035493。
Flower TR, Chesnokova LS, Froelich CA, Dixon C, Witt SN:热休克防止α -共核蛋白诱导的帕金森病酵母模型细胞凋亡。中华分子生物学杂志,2005,32(4):371 - 371。10.1016 / j.jmb.2005.06.060。
梁洁,Clark-Dixon C, Wang S, Flower TR, Williams-Hart T, Zweig R, Robinson LC, Tatchell K, Witt SN:利用酵母菌鉴定出新的α -共核蛋白毒性抑制因子。中国分子生物学杂志,2008,17:3784-3795。10.1093 /物流/ ddn276。
Outeiro TF, Lindquist S:酵母细胞提供了α -突触核蛋白生物学和病理生物学的见解。科学通报,2003,32(4):359 - 359。10.1126 / science.1090439。
Sharma N, Brandis KA, Herrera SK, Johnson BE, Vaidya T, Shrestha R, Debburman SK: α - synuclein芽出芽酵母模型:蛋白酶体受损和氧化应激增强毒性。中华神经科学杂志,2006,28:161-178。10.1385 / JMN: 28:2:161。
Willingham S, Outeiro TF, DeVit MJ, Lindquist SL, Muchowski PJ:增强突变亨廷顿蛋白片段或α -突触核蛋白毒性的酵母基因。科学通报,2003,32(3):359 - 359。10.1126 / science.1090389。
Zabrocki P, Bastiaens I, Delay C, Bammens T, Ghillebert R, Pellens K, De Virgilio C, Van Leuven F, Winderickx J:酵母模型中α -突触核蛋白的磷酸化、脂质筏相互作用和转运。生物化学学报2008,1783:1767-1780。10.1016 / j.bbamcr.2008.06.010。
Zabrocki P, Pellens K, Vanhelmont T, Vandebroek T, Griffioen G, Wera S, Van Leuven F, Winderickx J:酵母中α -突触核蛋白的聚集及其与蛋白tau的协同毒性。中华医学杂志,2005,32(4):394 - 394。10.1111 / j.1742-4658.2005.04571.x。
陈丽娟,陈丽娟。α -突触核蛋白磷酸化控制帕金森病果蝇模型的神经毒性和包涵体形成。神经科学杂志,2005,8:657-663。10.1038 / nn1443。
陈海燕,陈晓燕,李晓燕,李晓燕,陈晓燕:帕金森病果蝇模型中α -突触核蛋白毒性的伴侣蛋白抑制作用。科学通报,2002,29(5):563 - 566。10.1126 / science.1067389。
Park SS, Lee D:在α -突触核蛋白转基因果蝇神经元培养中多巴胺能神经元的选择性丧失和路易体样聚集的形成。中华神经科学杂志,2006,23:2908-2914。10.1111 / j.1460-9568.2006.04844.x。
Haywood AF, Staveley BE:帕金森氏病的果蝇模型中,帕金森氏病减少了突变阿尔法突触核蛋白诱导的变性。中国生物医学工程学报,2006,29(5):561 - 561。10.1139 / g06 - 011。
Periquet M, Fulga T, Myllykangas L, Schlossmacher MG, Feany MB:聚集α -突触核蛋白介导体内多巴胺能神经毒性。神经科学杂志,2007,27:3338-3346。10.1523 / jneurosci.0285 - 07.2007。
Kontopoulos E, Parvin JD, Feany MB: α -突触核蛋白在细胞核内作用,抑制组蛋白乙酰化,促进神经毒性。中华医学杂志,2006,15:3012-3023。10.1093 /物流/ ddl243。
果蝇帕金森氏病的药理防治。中华医学杂志,2002,8:1185-1186。10.1038 / nm1102 - 1185。
fany MB, Bender WW:帕金森病的果蝇模型。自然学报,2000,404:394-398。10.1038 / 35006074。
Pesah Y, Burgess H, Middlebrooks B, Ronningen K, Prosser J, Tirunagaru V, Zysk J, Mardon G:全挂载分析显示果蝇α - synuclein错表达后多巴胺能神经元数量正常。创世纪,2005,41:154-159。10.1002 / gene.20106。
Kuwahara T, Koyama A, Koyama S, Yoshina S, Ren CH, Kato T, Mitani S, Iwatsubo T:系统RNAi筛选揭示了内吞通路在转α -synuclein的线虫神经元功能障碍中的参与。中国分子生物学杂志,2008,17:2997-3009。10.1093 /物流/ ddn198。
van Ham TJ, Thijssen KL, Breitling R, Hofstra RM, Plasterk RH, Nollen EA:线虫模型识别衰老过程中α -突触核蛋白包涵体形成的遗传修饰因子。科学通报,2008,4:e1000027-10.1371/journal.pgen.1000027。
Kuwahara T, Koyama A, Gengyo-Ando K, Masuda M, Kowa H, Tsunoda M, Mitani S, Iwatsubo T:家族性帕金森突变α -synuclein导致转基因秀丽隐杆线虫多巴胺神经元功能障碍。中国生物医学工程学报,2006,29(3):334- 334。10.1074 / jbc.M504860200。
Ved R, Saha S, Westlund B, Perier C, Burnam L, Sluder A, Hoener M, Rodrigues CM, Alfonso A, Steer C, Liu L, Przedborski S, Wolozin B:遗传修饰α -synuclein、parkin和d -1诱导的线虫线粒体脆弱性和拯救的相似模式。中国生物医学工程学报,2005,29(4):459 - 459。10.1074 / jbc.M505910200。
施普林格W, Hoppe T, Schmidt E, Baumeister R:一株溶解性改变的秀丽隐杆线虫Parkin突变体,α -突触核蛋白聚集与蛋白质毒性应激相关。中国生物医学工程学报,2005,31(4):359 - 359。10.1093 /物流/ ddi371。
李文华,李文华,李文华,李文华,李文华,李文华,李文华,李文华,李文华,李文华。研究了人体α -突触核蛋白表达对秀丽隐杆线虫多巴胺能神经元损失和运动障碍的影响。中华神经医学杂志,2003,32(5):561 - 561。10.1046 / j.1471-4159.2003.01809.x。
Petrucelli L, O’farrell C, Lockhart PJ, Baptista M, Kehoe K, Vink L, Choi P, Wolozin B, Farrer M, Hardy J, Cookson MR: Parkin保护与突变α -突触核蛋白相关的毒性:蛋白酶体功能障碍选择性影响儿茶酚氨基能神经元。神经学报,2002,36:1007-1019。10.1016 / s0896 - 6273 (02) 01125 - x。
Zach S, Bueler H, Hengerer B, Gillardon F:细胞培养中病毒过表达α -突触核蛋白引起的显性神经病变。细胞与神经生物学杂志,2007,27:505-515。10.1007 / s10571 - 007 - 9141 - 5。
周巍,Hurlbert MS, Schaack J, Prasad KN, Freed CR:人α -突触核蛋白过表达导致大鼠原代培养和永生化中脑来源细胞多巴胺神经元死亡。大脑科学,2000,866:33-43。10.1016 / s0006 - 8993(00) 02215 - 0。
周伟,Schaack J, Zawada WM, Freed CR:人α -突触核蛋白过表达导致人原代中脑培养中多巴胺神经元死亡。脑科学,2002,926:42-50。10.1016 / s0006 - 8993(01) 03292 - 9。
在氧化应激过程中,DJ-1上调谷胱甘肽合成,抑制A53T α -突触核蛋白毒性。中国生物医学工程学报,2004,24(4):455 - 457。10.1074 / jbc.M507124200。
刘峰,Hindupur J, Nguyen JL, Ruf KJ, Zhu J, Schieler JL, Bonham CC, Wood KV, Davisson VJ, Rochet JC:甲硫氨酸亚砜还原酶A保护多巴胺能细胞免受帕金森病相关损伤。中华放射生物学杂志,2008,45:242-255。10.1016 / j.freeradbiomed.2008.03.022。
Smith WW, Jiang H, Pei Z, Tanaka Y, Morita H, Sawa A, Dawson VL, Dawson TM, Ross CA:内质网应激和线粒体细胞死亡途径介导A53T突变α -共核蛋白诱导的毒性。中国生物医学工程学报,2005,31(4):381 -381。10.1093 /物流/ ddi396。
Tanaka Y, Engelender S, Igarashi S, Rao RK, Wanner T, Tanzi RE, Sawa A, V LD, Dawson TM, Ross CA:诱导表达突变α -突触核蛋白降低蛋白酶体活性,增加对线粒体依赖性凋亡的敏感性。中华医学杂志,2001,10:919-926。10.1093 /物流/ 10.9.919。
徐军,高永春,李芳杰,宋伟,金丽伟,杨克纳BA: α -突触核蛋白多巴胺依赖性神经毒性:帕金森病选择性神经退行性变的机制。中华医学杂志,2002,8:600-606。10.1038 / nm0602 - 600。
Ko LW, Ko HH, Lin WL, Kulathingal JG, Yen SH:过表达的野生型α -突触核蛋白聚集物对人神经细胞无毒。中华神经科杂志,2008,32(4):394 - 394。10.1097 / NEN.0b013e31818c3618。
Giasson BI, Duda JE, Quinn SM, Zhang B, Trojanowski JQ, Lee VM:表达A53T人α -突触核蛋白的小鼠神经α -突触核蛋白病变伴严重运动障碍。神经学报,2002,34:521-533。10.1016 / s0896 - 6273(02) 00682 - 7。
Kahle PJ, Neumann M, Ozmen L, Muller V, Jacobsen H, Schindzielorz A, Okochi M, Leimer U, Putten van Der H, Probst A, Kremmer E, Kretzschmar HA, Haass C:野生型和帕金森病相关突变α -突触核蛋白在人和转基因小鼠大脑中的亚细胞定位。神经科学杂志,2000,20:6365-6373。
Lee MK, Stirling W, Xu Y, Xu X, Qui D, Mandir AS, Dawson TM, Copeland NG, Jenkins NA, Price DL:人α -突触核蛋白介导的家族性帕金森病相关Ala-53—> Thr突变导致转基因小鼠中α -突触核蛋白聚集的神经退行性疾病。美国国家科学研究院。2002, 99: 8968-8973。10.1073 / pnas.132197599。
Masliah E, Rockenstein E, Veinbergs I, Mallory M, Hashimoto M, Takeda A, Sagara Y, Sisk A, Mucke L: α -突触核蛋白小鼠的多巴胺能损失和包涵体形成:神经退行性疾病的意义。科学通报,2000,29(3):359 - 359。10.1126 / science.287.5456.1265。
Matsuoka Y, Vila M, Lincoln S, McCormack A, Picciano M, LaFrancois J, Yu X, Dickson D, Langston WJ, McGowan E, Farrer M, Hardy J, Duff K, Przedborski S, Di Monte DA:表达酪氨酸羟基化酶启动子驱动的人α -突触核蛋白的转基因小鼠缺乏黑质病理。神经生物学杂志,2001,8:535-539。10.1006 / nbdi.2001.0392。
Richfield EK, Thiruchelvam MJ, corey - slechta DA, Wuertzer C, Gainetdinov RR, Caron MG, Di Monte DA, Federoff HJ:野生型和突变的人α -突触核蛋白在转基因小鼠中的行为和神经化学效应。中华神经科杂志,2002,32(5):354 - 354。10.1006 / exnr.2002.7882。
Putten van der H, Wiederhold KH, Probst A, Barbieri S, Mistl C, Danner S, Kauffmann S, Hofele K, Spooren WP, Ruegg MA, Lin S, Caroni P, Sommer B, Tolnay M, Bilbe G:表达人类α -突触核蛋白小鼠的神经病理学。神经科学杂志,2000,20:6021-6029。
Kahle PJ、Neumann M、Ozmen L、Muller V、Jacobsen H、Spooren W、Fuss B、Mallon B、Macklin WB、Fujiwara H、Hasegawa M、Iwatsubo T、Kretzschmar HA、Haass C:转基因小鼠少突胶质细胞α -突触核蛋白的过度磷酸化和不溶性。《环境科学》2002,3:583-588。10.1093 / embo-reports / kvf109。
Cabin DE, Gispert-Sanchez S, Murphy D, Auburger G, Myers RR, Nussbaum RL: SNCA缺失背景下表达A53T SNCA的小鼠共核病变加重。神经生物学衰老。2005,26:25-35。10.1016 / j.neurobiolaging.2004.02.026。
高敏敏,Kotzbauer PT, Uryu K, Leight S, Trojanowski JQ, Lee VM:神经炎症和α -突触核蛋白氧化/硝化与多巴胺能神经退行性变相关。神经科学杂志,2008,28:7687-7698。10.1523 / jneurosci.0143 - 07.2008。
Tofaris GK, Garcia Reitbock P, Humby T, Lambourne SL, O'Connell M, Ghetti B, Gossage H, Emson PC, Wilkinson LS, Goedert M, Spillantini MG:截断人类α -突触核蛋白(1-120)转基因小鼠黑质和嗅球多巴胺能神经细胞的病理变化:与路易斯体障碍的关系。神经科学杂志,2006,26:3942-3950。10.1523 / jneurosci.4965 - 05.2006。
St Martin JL、Klucken J、Outeiro TF、Nguyen P、Keller-McGandy C、Cantuti-Castelvetri I、Grammatopoulos TN、Standaert DG、Hyman BT、McLean PJ: α -突触核蛋白靶向过表达诱导小鼠黑质多巴胺能神经元丢失和伴侣蛋白mRNA上调中华神经化学杂志,2007,30(4):449- 457。
Kirik D, Rosenblad C, Burger C, Lundberg C, Johansen TE, Muzyczka N, Mandel RJ, Bjorklund A:黑纹状体系统α -突触核蛋白靶向过表达诱导帕金森样神经退行性变。神经科学杂志,2002,22:2780-2791。
Lauwers E, Debyser Z, Van Dorpe J, De Strooper B, Nuttin B, Baekelandt V:慢病毒载体介导的α -突触核蛋白过表达诱导鼠脑神经病理和神经退行性变。脑疾病杂志,2003,13:364-372。
罗比安科,李德杰,施耐德,戴格隆,埃比斯切,P:帕金森病大鼠慢病毒模型中的α -突触核病变和选择性多巴胺能神经元丢失。美国国家科学研究院。中国科学(d辑:自然科学版),2004,28(3):356 - 356。10.1073 / pnas.152339799。
Yamada M, Iwatsubo T, Mizuno Y, Mochizuki H: α -突触核蛋白在大鼠黑质过表达导致多巴胺能神经元丧失,α -突触核蛋白磷酸化和caspase-9激活:与帕金森病的病理变化相似。中华神经化学杂志,2004,31:451-461。10.1111 / j.1471-4159.2004.02728.x。
Eslamboli A, Romero-Ramos M, Burger C, Bjorklund T, Muzyczka N, Mandel RJ, Baker H, Ridley RM, Kirik D:人类α -突触核蛋白在灵长类动物中脑中过度表达的长期后果。大脑科学,2007,30:799-815。10.1093 /大脑/ awl382。
Kirik D, Annett LE, Burger C, Muzyczka N, Mandel RJ, Bjorklund A:病毒载体介导的人α -突触核蛋白过表达诱导的黑纹状体α -突触核蛋白病:一种新的帕金森病灵长类模型。美国国家科学研究院。2003, 30(4): 455 - 457。10.1073 / pnas.0536383100。
安田T,宫内S,北川R,和田K, Nihira T, Ren YR, Hirai Y, Ageyama N, Terao K, Shimada T, Takada M, Mizuno Y, Mochizuki H: α -突触核蛋白毒性的神经元特异性及Parkin共表达在灵长类动物中的作用。神经科学学报,2007,32(4):447 - 447。10.1016 / j.neuroscience.2006.09.052。
Uversky VN:蛋白质变色龙:α -突触核蛋白的构象可塑性,一种参与神经退行性疾病的紊乱蛋白。中国生物医学工程学报,2003,29(4):371 - 371。
α -突触核蛋白聚集的神经病理学、生物化学和生物物理学。中华神经化学杂志,2007,32(4):347 - 347。
Lee HJ, Choi C, Lee SJ:膜结合的α -突触核蛋白具有较高的聚集倾向和诱导胞质形态聚集的能力。中国生物医学工程学报,2002,27(4):371 - 371。10.1074 / jbc.M107045200。
Esteves AR, Arduino DM, Swerdlow RH, Oliveira CR, Cardoso SM:氧化应激参与帕金森病混合患者α -突触核蛋白低聚。抗氧化氧化还原信号。2008
Outeiro TF, Putcha P, Tetzlaff JE, Spoelgen R, Koker M, Carvalho F, Hyman BT, McLean PJ:活细胞中毒性低聚α -突触核蛋白的形成。PLoS ONE。2008, 3: e1867-10.1371/journal.pone.0001867。
Sharon R, Bar-Joseph I, Frosch MP, Walsh DM, Hamilton JA, Selkoe DJ: α -突触核蛋白高可溶性低聚物的形成受脂肪酸调节,并在帕金森病中增强。神经学报,2003,37:583-595。10.1016 / s0896 - 6273(03) 00024 - 2。
李洪杰,李淑娟:胞质α -突触核蛋白聚集物的表征。纤维的形成与细胞内包涵体的形成过程密切相关。中国生物医学工程学报,2002,27(4):473 - 476。10.1074 / jbc.M208192200。
Ostrerova-Golts N, Petrucelli L, Hardy J, Lee JM, Farer M, Wolozin B: A53T α -synuclein突变增加铁依赖性聚集和毒性。神经科学杂志,2000,20:6048-6054。
Danzer KM, Haasen D, Karow AR, Moussaud S, Habeck M, Giese A, Kretzschmar H, Hengerer B, Kostka M:不同种类的α -突触核蛋白低聚物诱导钙流入和播撒。神经科学杂志,2007,27:9220-9232。10.1523 / jneurosci.2617 - 07.2007。
李洪杰,李淑娟,李淑娟:α -突触核蛋白及其聚集物在囊内的定位和胞外分泌。神经科学杂志,2005,25:6016-6024。10.1523 / jneurosci.0692 - 05.2005。
Klucken J, Outeiro TF, Nguyen P, McLean PJ, Hyman BT:荧光寿命成像检测细胞内新型α -突触核蛋白低聚物。王学军,2006,30(5):559 - 561。10.1096 / fj.05 - 5422 com。
于芳,徐辉,卓敏,孙丽,董安,刘鑫:α -突触核蛋白聚集对氧化还原状态和多巴胺水平的损伤及hsp70的预防作用。生物化学学报,2005,31(4):388 - 388。10.1016 / j.bbrc.2005.03.148。
Emadi S, Barkhordarian H, Wang MS, Schulz P, Sierks MR:人抗α -突触核蛋白低聚物单链抗体片段的分离,抑制聚集和防止α -突触核蛋白诱导的毒性。中华分子生物学杂志,2007,32(3):354 - 354。10.1016 / j.jmb.2007.02.089。
Emadi S, Liu R, Yuan B, Schulz P, McAllister C, Lyubchenko Y, Messer A, Sierks MR:抑制α -突触核蛋白与人单链抗体片段的聚集。生物化学,2004,43:2871-2878。10.1021 / bi036281f。
Gorbatyuk OS, Li S, Sullivan LF, Chen W, Kondrikova G, Manfredsson FP, Mandel RJ, Muzyczka N:人α -突触核蛋白Ser-129磷酸化状态决定帕金森病大鼠模型神经退行性变。美国国家科学研究院。2008, 35(5): 763-768。10.1073 / pnas.0711053105。
Smith WW, Margolis RL, Li X, Troncoso JC, Lee MK, Dawson VL, Dawson TM, Iwatsubo T, Ross CA: α -synuclein磷酸化增强SH-SY5Y细胞中嗜酸性细胞质包涵体的形成。神经科学杂志,2005,25:5544-5552。10.1523 / jneurosci.0482 - 05.2005。
Paleologou KE, Schmid AW, Rospigliosi CC, Kim HY, Lamberto GR, Fredenburg RA, Lansbury PT, Fernandez CO, Eliezer D, Zweckstetter M, Lashuel HA: Ser-129位点的磷酸化抑制α -synuclein的纤颤,而非磷酸化修饰物S129E/D。中国生物医学工程学报,2008,29(3):394 - 394。10.1074 / jbc.M800747200。
Inglis KJ, Chereau D, Brigham EF, Chiou SS, Schobel S, Frigon NL, Yu M, Caccavello RJ, Nelson S, Motter R, Wright S, chid, Santiago P, Soriano F, Ramos C, Powell K, Goldstein JM, Babcock M, Yednock T, Bard F, Basi GS, Sham H, Chilcote TJ, McConlogue L, Griswold-Prenner I, Anderson JP: polo样激酶2 (PLK2)在中枢神经系统中磷酸化α -synuclein在丝氨酸129处。生物化学杂志,2008
Seeburg DP, felu - mojer M, Gaiottino J, Pak DT, Sheng M: CDK5和polo样激酶2在突触活性升高时的稳态可塑性中的关键作用。神经科学学报,2008,38(5):571-583。10.1016 / j.neuron.2008.03.021。
Hoyer W, Cherny D, Subramaniam V, Jovin TM:由109-140氨基酸组成的酸性c端区对体外α -突触核蛋白聚集的影响。生物化学,2004,43:16233-16242。10.1021 / bi048453u。
Li W, West N, Colla E, Pletnikova O, Troncoso JC, Marsh L, Dawson TM, Jakala P, Hartmann T, Price DL, Lee MK:聚集促进α -突触核蛋白c端截断是一种正常的细胞过程,并在家族性帕金森病相关突变中增强。美国国家科学研究院。中国科学(d辑),2005,38(4):366 - 366。10.1073 / pnas.0406976102。
Liu CW, Giasson BI, Lewis KA, Lee VM, Demartino GN, Thomas PJ: α -突触核蛋白的截断和蛋白酶体在α -突触核蛋白聚集中的沉淀作用:与帕金森病的发病机制有关。中国生物医学工程学报,2005,29(4):359 - 359。10.1074 / jbc.M501508200。
若松M,石井A,岩田S,坂神J, Ukai Y,小野M, Kanbe D,村松S,小林K,岩田subo T,吉本M:截短的人α -突触核蛋白过表达诱导小鼠黑胺神经元选择性丢失。神经生物学杂志。2008,29:574-585。10.1016 / j.neurobiolaging.2006.11.017。
Paxinou E, Chen Q, Weisse M, Giasson BI, Norris EH, Rueter SM, Trojanowski JQ, Lee VM, Ischiropoulos H:细胞内硝化损伤诱导α -突触核蛋白聚集。神经科学杂志,2001,21:8053-8061。
Webb JL, Ravikumar B, Atkins J, Skepper JN, Rubinsztein DC: α - synuclein被自噬和蛋白酶体降解。中国生物医学工程学报,2003,29(5):559 - 561。10.1074 / jbc.M300227200。
Cuervo AM, Stefanis L, Fredenburg R, Lansbury PT, Sulzer D:伴侣蛋白介导的自噬对突变α -突触核蛋白降解的影响。科学通报,2004,29(4):359 - 359。10.1126 / science.1101738。
duenty BM, Warner LR, Hou ST, Jiang SX, Gomez-Isla T, Leenhouts KM, Oxford JT, Feany MB, Masliah E, Rohn TT: α -突触核蛋白的calpain -切割:连接蛋白水解过程与疾病相关聚集。中华流行病学杂志,2007,30(4):394 - 394。10.2353 / ajpath.2007.061232。
Kim HJ, Lee D, Lee CH, Chung KC, Kim J, Paik SR: α -突触核蛋白的Calpain-resistant fragment(s)调控20S蛋白酶体的突触核蛋白裂解活性。中国生物化学学报,2006,29(4):347 - 347。10.1016 / j.abb.2006.08.019。
Mishizen-Eberz AJ, Guttmann RP, Giasson BI, Day GA, Hodara R, Ischiropoulos H, Lee VM, Trojanowski JQ, Lynch DR: calpain I在体外对α -突触核蛋白正常和病理形态的不同切割模式。中华神经化学杂志,2003,32(4):339 - 339。10.1046 / j.1471-4159.2003.01878.x。
Mishizen-Eberz AJ, Norris EH, Giasson BI, Hodara R, Ischiropoulos H, Lee VM, Trojanowski JQ, Lynch DR: calpain对α -突触核蛋白的切割:降解纤维化和硝化α -突触核蛋白的潜在作用。生物化学,2005,44:7818-7829。10.1021 / bi047846q。
Cappai R、Leck SL、Tew DJ、Williamson NA、Smith DP、Galatis D、Sharples RA、Curtain CC、Ali FE、Cherny RA、Culvenor JG、Bottomley SP、Masters CL、Barnham KJ、Hill AF:多巴胺通过独特的折叠途径促进α -突触核蛋白聚集成抗sds的可溶性低聚物。王学军,2005,32(4):359 - 359。
姜红,吴玉春,中村M,梁阳,Tanaka Y, Holmes S, Dawson VL, Dawson TM, Ross CA, Smith WW:帕金森病基因突变增加细胞对应激的易感性:突变α -突触核蛋白增强H(2)O(2)-和sin -1诱导的细胞死亡。神经生物学老化。2006
Prasad JE, Kumar B, Andreatta C, Nahreini P, Hanson AJ, Yan XD, Prasad KN:在分化成神经细胞瘤细胞中,α -突触核蛋白的过表达降低了活力,增强了对前列腺素E(2),过氧化氢和一氧化氮供体的敏感性。中华神经科学杂志,2004,26(4):426 - 426。10.1002 / jnr.20058。
Quilty MC, King AE, Gai WP, Pountney DL, West AK, Vickers JC, Dickson TC: α -突触核蛋白在神经元对慢性氧化应激的反应中上调,并与神经保护相关。中华神经科学杂志,2006,29(4):359 - 361。10.1016 / j.expneurol.2005.10.018。
Cookson MR, Brug van der M:细胞系统和α -突触核蛋白的毒性机制。中华神经科杂志,2008,29(5):559 - 561。10.1016 / j.expneurol.2007.05.022。
朱敏,李娟,Fink AL: α -突触核蛋白与膜的结合影响双分子层的结构、稳定性和纤维的形成。中国生物医学工程学报,2003,29(3):394 - 394。10.1074 / jbc.M305326200。
Volles MJ, Lansbury PT:原纤维α -突触核蛋白对帕金森病相关突变敏感,并通过孔样机制发生。生物化学,2002,41:4595-4602。10.1021 / bi0121353。
Pountney DL, Lowe R, Quilty M, Vickers JC, Voelcker NH, Gai WP:来自纯化的多系统萎缩内含物的环状α -突触核蛋白物种。中华神经化学杂志,2004,30(4):359 - 359。10.1111 / j.1471-4159.2004.02533.x。
Furukawa K, Matsuzaki-Kobayashi M, Hasegawa T, Kikuchi A, Sugeno N, Itoyama Y, Wang Y, Yao PJ, Bushlin I, Takeda A:突变α -synuclein诱导的质膜离子通透性促进神经细胞变性。中华神经化学杂志,2006,32(4):366 - 366。10.1111 / j.1471-4159.2006.03803.x。
Mosharov EV、Staal RG、Bove J、Prou D、Hananiya A、Markov D、Poulsen N、Larsen KE、Moore CM、Troyer MD、Edwards RH、Przedborski S、Sulzer D: α -突触核蛋白过表达增加胞质儿茶酚胺浓度。神经科学杂志,2006,26:9304-9311。10.1523 / jneurosci.0519 - 06.2006。
Larsen KE, Schmitz Y, Troyer MD, Mosharov E, Dietrich P, Quazi AZ, Savalle M, Nemani V, Chaudhry FA, Edwards RH, Stefanis L, Sulzer D: PC12和染色质细胞中α -突触核蛋白过表达通过干扰胞吐的晚期步骤破坏儿茶酚胺的释放。神经科学杂志,2006,26:11915-11922。10.1523 / jneurosci.3821 - 06.2006。
Cooper AA、Gitler AD、cashkar A、Haynes CM、Hill KJ、Bhullar B、Liu K、Xu K、Strathearn KE、Liu F、Cao S、Caldwell KA、Caldwell GA、Marsischky G、Kolodner RD、Labaer J、Rochet JC、Bonini NM、Lindquist S: α -synuclein阻断er -高尔基交通,Rab1挽救帕金森模型神经元损失。科学通报,2006,32(3):324-328。10.1126 / science.1129462。
Gosavi N, Lee HJ, Lee JS, Patel S, Lee SJ:高尔基体碎裂发生在具有前纤原α -突触核蛋白聚集体的细胞中,并先于纤原包涵体的形成。中国生物医学工程学报,2002,27(4):394 - 394。10.1074 / jbc.M208194200。
Hsu LJ, Sagara Y, Arroyo A, Rockenstein E, Sisk A, Mallory M, Wong J, Takenouchi T, Hashimoto M, Masliah E: α -synuclein促进线粒体缺陷和氧化应激。中华医学寄生虫病杂志,2004,19(4):371 - 371。
李伟伟,杨锐,郭锦江,任慧敏,查小林,程建军,蔡德芳:α -突触核蛋白在小鼠中脑线粒体中的定位。神经杂志,2007,18:1543-1546。
Cole NB, Dieuliis D, Leo P, Mitchell DC, Nussbaum RL:细胞内酸化促进α -突触核蛋白的线粒体易位。Exp Cell Res. 2008, 314: 2076-2089。10.1016 / j.yexcr.2008.03.012。
Nakamura K, Nemani VM, Wallender EK, Kaehlcke K, Ott M, Edwards RH: α -突触核蛋白构象的光学报告揭示了与线粒体的特定相互作用。神经科学杂志,2008,28:12305-12317。10.1523 / jneurosci.3088 - 08.2008。
李晓燕,李晓燕,李晓燕,李晓燕,等:α -突触核蛋白的线粒体输入和积累对人多巴胺能神经元培养和帕金森病脑复合体I的影响。中国生物医学工程学报,2008,29(3):394 - 394。10.1074 / jbc.M710012200。
Orth M, Tabrizi SJ, Schapira AH, Cooper JM: α -突触核蛋白在HEK293细胞中的表达增强了线粒体对鱼藤酮的敏感性。中华神经科学杂志,2003,32(4):329 - 332。10.1016 / s0304 - 3940(03) 00941 - 8。
Saha AR, Ninkina NN, Hanger DP, Anderton BH, Davies AM, Buchman VL: α -突触核蛋白诱导神经元死亡。中华神经科学杂志,2000,12:3073-3077。10.1046 / j.1460-9568.2000.00210.x。
Stefanova N, Klimaschewski L, Poewe W, Wenning GK, Reindl M: α -突触核蛋白过表达诱导胶质细胞死亡。中华神经科学杂志,2001,29(4):339 - 339。10.1002 / jnr.1171。
金松、全百思、许超、林培生、安TB、徐志华、金海生、朴春春、崔世盛、赵世盛、李文杰、徐英华:α -突触核素在帕金森病外周血淋巴细胞中的表达改变诱导细胞凋亡。王志强。2004,18:1615-1617。10.1096 / fj.03 - 1391 com。
Martin LJ, Pan Y, Price AC, Sterling W, Copeland NG, Jenkins NA, Price DL, Lee MK:帕金森病α -突触核转基因小鼠发生神经元线粒体变性和细胞死亡。神经科学杂志,2006,26:41-50。10.1523 / jneurosci.4308 - 05.2006。
Stefanis L, Larsen KE, Rideout HJ, Sulzer D, Greene LA:在PC12细胞中表达A53T突变型而非野生型α -突触核蛋白可诱导泛素依赖性降解系统的改变、多巴胺释放的丧失和自噬细胞死亡。神经科学杂志,2001,21:9549-9560。
杨强,佘红,李梅,夏夏娇,毛卓:伴侣介导的自噬对神经元生存因子MEF2D的调控。科学通报,2009,29(4):447 - 447。10.1126 / science.1166088。
Snyder H, Mensah K, Theisler C, Lee J, Matouschek A, Wolozin B:聚合和单体α -突触核蛋白与S6'蛋白酶体蛋白结合并抑制蛋白酶体功能。中国生物医学工程学报,2003,29(4):359 - 359。10.1074 / jbc.M208641200。
Lindersson E, Beedholm R, Hojrup P, Moos T, Gai W, Hendil KB, Jensen PH: α -突触核蛋白丝和低聚物对蛋白酶体的抑制作用。中国生物医学工程学报,2004,29(4):434 - 434。10.1074 / jbc.M306390200。
Emmanouilidou E, Stefanis L, Vekrellis K:细胞产生的α -突触核蛋白低聚物靶向并破坏26S蛋白酶体。神经生物学老化,2008
陈琳,Thiruchelvam MJ, Madura K, Richfield EK:老龄人α -突触核蛋白转基因小鼠的蛋白酶体功能障碍。神经生物学杂志,2006,23:120-126。10.1016 / j.nbd.2006.02.004。
Cole NB, Murphy DD, Grider T, Rueter S, Brasaemle D, Nussbaum RL:帕金森病蛋白α -突触核蛋白的脂滴结合和寡聚特性。中国生物医学工程学报,2002,27(4):344- 352。10.1074 / jbc.M108414200。
Sarkar S, Davies JE, Huang Z, Tunnacliffe A, Rubinsztein DC:一种新型mtor独立自噬增强剂海藻糖加速突变体Huntingtin和{α}-Synuclein的清除。中国生物医学工程学报,2007,32(5):561 - 561。10.1074 / jbc.M609532200。
王晓燕,王晓燕,王晓燕,王晓燕。慢病毒介导的RNAi抑制人α -突触核蛋白的体外和大鼠脑内表达。中华神经科杂志,2006,32(4):369 - 371。10.1016 / j.expneurol.2005.12.024。
Lewis J, Melrose H, Bumcrot D, Hope A, Zehr C, Lincoln S, Braithwaite A, He Z, Ogholikhan S, Hinkle K, Kent C, Toudjarska I, Charisse K, Braich R, Pandey RK, Heckman M, Maraganore DM, Crook J, Farrer MJ:使用裸siRNA在体内沉默α -synuclein。中华神经科杂志,2008,3:19-10.1186/1750-1326-3-19。
Gitler AD, Bevis BJ, Shorter J, Strathearn KE, Hamamichi S, Su LJ, Caldwell KA, Caldwell GA, Rochet JC, McCaffery JM, Barlowe C, Lindquist S:帕金森病蛋白α -突触核蛋白破坏细胞内稳态。美国国家科学研究院。2008, 35(4): 447 - 447。10.1073 / pnas.0710685105。
确认
这项研究得到了美国国立卫生研究院(NIH)内部研究项目的支持。
作者信息
作者和隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有相互竞争的利益。
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利与权限
本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(http://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
α-突触核蛋白与神经元细胞死亡。摩尔神经退化49(2009)。https://doi.org/10.1186/1750-1326-4-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1750-1326-4-9
关键字
- 黑质
- 帕金森病
- 多系统萎缩
- 路易体
- 多巴胺神经元