摘要
人类核型通常是通过经典的细胞遗传学(条带)技术来研究的。要完成这个过程,必须获得有丝分裂细胞的中期染色体。这导致不可能分析所有的细胞类型,不可能对细胞进行适度的评分,也不可能将从几十个有丝分裂细胞中提取的细胞遗传学数据外推到整个生物体,这表明所有剩余的细胞都具有这些基因组。然而,这远非如此,因为染色体异常可以发生在任何细胞沿个体发育。由于真核生物的体细胞更有可能处于间期,因此研究有丝分裂后细胞和更大细胞群的问题的解决方案是间期细胞遗传学,由于分子细胞遗传学的成就(即荧光的发展),间期细胞遗传学已或多或少适用于特定的生物医学任务原位杂交——FISH,多色带——MCB)。然而,许多间期分子细胞遗传学方法仅限于研究特定的基因组位点(区域),可用于鉴定染色体异常(非整倍体、多倍体、缺失、倒位、复制、易位)。此外,这些技术是在给定细胞的超染色体水平上建立核基因组组织的生物学作用和模式的独特可能性。这里需要指出的是,由于技术限制,这个问题还没有完全解决。尽管如此,一些最先进的分子细胞遗传学技术(即多色间期FISH或间期染色体特异性MCB)允许在分子分辨率下显示间期染色体的完整性。因此,尽管在研究人类间期染色体的过程中遇到了许多困难,分子细胞遗传学确实为细胞周期各个阶段的基因组组织、结构和行为提供了高分辨率的单细胞分析。
介绍
目前,据估计,每年进行的细胞遗传学和分子细胞遗传学分析不少于100万次,这代表了若干医学领域的标准护理和许多患有先天性畸形、精神疾病、癌症或生殖问题的患者的常规临床检查[1]。分子细胞遗传学技术已被反复证明在诊断中是有效的,并被认为是染色体带带的一种有价值的补充甚至替代方法[2- - - - - -4]。此外,当代生物医学基础研究广泛应用分子细胞遗传学技术[5- - - - - -7]。浏览最受欢迎的科学资源无疑会返回数万篇文章,其中至少提到一种分子细胞遗传学技术(更多细节请参阅[3.]和多色荧光原位杂交的网页http://www.med.uni-jena.de/fish/mFISH/mFISHlit.htm由德国耶拿的Thomas Liehr博士管理)。因此,可以肯定的是,分子细胞遗传学在当前生物医学中的作用再怎么估计也不为过。
分子细胞遗传学具有两个主要优势:(i)能够以极高的分辨率提供全基因组的芯片扫描或单个特殊基因组位点的可视化[4,6,8];(ii)在DNA (RNA)序列水平上分析单细胞基因组组织、结构和行为的能力[7,9,10]。两者都被不断用于生物医学研究和人类染色体异常的分子诊断[2- - - - - -13]。当分析从大量细胞中分离出来的混合DNA时,第一个优势是显而易见的。因此,这种方法很少用于单细胞分析也就不足为奇了[10,14]。分子细胞遗传学技术的第二个优点一直被强调[3.,5- - - - - -13],但更常用于研究有丝分裂细胞通过中期染色体分析[3.,7,10,12]。然而,真核生物的细胞更可能处于间期。因此,在对基因组组织、结构和行为的调查中,细胞生命的基本部分往往超出了研究人员的范围。至于染色体异常的分子诊断,可以注意到间期分析也很少应用。将间期细胞遗传学排除在诊断和研究之外的解释可能是缺乏可重复性和低分辨率。间期细胞核基因组结构研究综述[j]15- - - - - -19]和体细胞基因变异[7,10,12,20.- - - - - -29]以及间期细胞遗传学的发展[30.- - - - - -35]将揭示这些没有证据支持的假设,并将表明精心设计这些技术的实验室能够毫无困难地解决不同的实践和研究任务[3.,7,12- - - - - -35]。因此,似乎倾向于使用间期分子细胞遗传学技术的原因与其说是“技术不发达”,不如说是“宣传不足”。
通过对分子细胞遗传学的大量评论,我们发现间期人类染色体可视化的技术和理论方面的偶尔描述。因此,我们不得不得出结论,在现代生物医学文献中,对间期分子细胞遗传学的关注不足。此外,应用程序的技术方面甚至很少得到解决。为了填补这一空白,我们试图对目前应用的分子细胞遗传学技术进行概述,特别强调它们研究人类间期染色体的技术能力。
分子细胞遗传学技术及其对间期染色体单细胞分析的分辨率和潜力
绝大多数分子细胞遗传学技术是基于杂交的。目前分子细胞遗传学的发展有两个基本平台:荧光原位杂交(FISH)和比较基因组杂交(CGH) [3.,36染色体DNA的肽核酸(PNA)探针分析[37,38]。或者,另一种技术使用引物原位标记(PRINS)反应[37,38]。所有这些技术的分辨率和卓越水平都是根据细胞遗传学条带分析建立的,在这种情况下,这仍然是黄金标准[36]。单细胞分子细胞遗传学分析可以通过分析中期板或通过分析间期细胞核进行。长期以来,使用几种检测技术(如光谱核型- SKY或多色FISH - MFISH)和不同的DNA探针组(染色体计数/着丝粒,位点特异性,全涂,显微解剖)研究中期板是成功的[2,3.,5- - - - - -7,9- - - - - -13,30.,36,39- - - - - -46]。一般来说,如果加以改进,几乎所有这些技术都可以应用于间期细胞,但这种“技术转移”需要付出巨大的努力[2,3.,7,10,12,13,30.- - - - - -33,35,47]。通常,所有提供间期细胞核基因组位点可视化的分子细胞遗传学分析被称为间期FISH或I-FISH [35]。表格1概述了用于中期和间期分析的分子细胞遗传学技术,特别注意研究单细胞的分辨率和修饰。列出所有已知的分子细胞遗传学方法似乎是不可能的,但即使是对这些技术的简短描述(表1)1)显示分子细胞遗传学能够在细胞周期的所有阶段对染色体结构和行为进行高分辨率分析,然而,更经常用于检测中期染色体失衡和重排,或在CGH分析中使用总DNA进行探测[2- - - - - -7,10- - - - - -14,19- - - - - -54]。此外,我们试图在单细胞染色体分析应用的背景下审查上述每一种方法。
鱼
FISH提供了许多研究全基因组或特定基因组位点(区域)的可能性[2- - - - - -7,10- - - - - -13,36,39- - - - - -41]。探针主要决定分子细胞遗传学技术的分辨率[3.]。无论分子特性和序列修饰模式(即LNA(锁定核酸)或PNA探针)如何,详细信息请参见[3.,13,37,38]),用于分子细胞遗传学分析的探针可以根据检测到的DNA序列的模式进行分类。这种分类包括重复序列DNA(着丝粒和端粒)、位点特异性、全染色体绘制(wcp)探针[3.,55]。
FISH可以绘制重复的基因组序列,可以用着丝粒(染色体枚举或染色体特异性)或端粒DNA探针进行。端粒分析是生物医学研究的一个重要领域[56]。通常使用具有TTAGGG重复序列基序的DNA或PNA探针[3.,56]。这些检测需要覆盖癌症和衰老研究(端粒生物学)的大范围,但似乎不太适用于诊断[3.]。使用端粒探针进行I-FISH分析仅在少数核组织研究中被描述[57]。相反,I-FISH与着丝粒DNA探针的应用是医学遗传学、肿瘤学和生殖医学诊断的重要组成部分[1- - - - - -3.,5,7,10,12,13,20.- - - - - -30.,35- - - - - -38,41,42,44,46,55,58- - - - - -61]。此外,这些探针的应用早已被证明在染色体生物学研究基因组组织(染色体和核)、进化、健康和疾病的行为和变异等领域的研究中是非常有价值的[2,3.,7,10,12,13,20.- - - - - -30.,35,41,42,44,55,62- - - - - -67]。这些DNA探针的流行通常归因于接近100%的杂交效率,因为它可以绘制高度重复的DNA,以及着丝粒人类DNA的染色体特异性,允许在间期分析单个同源染色体对[7,10,30.,35]。此外,由于胞内异色DNA在个体间的极端差异,这种分析允许应用定量FISH (QFISH),可以用于解决染色体中期和间期分析中遇到的许多问题[32,35,59]。相关检测的潜力很难通过其基因组分辨率来确定(表2)1),因为着丝粒DNA探针的应用表明,与可视化的基因座相比,分析包含更大的基因组位点的现象[3.,7,10]。在间期细胞遗传学方面,I-FISH与染色体枚举探针可以在大量细胞群体中检测数量染色体不平衡(非整倍体和多倍体)[7,10,12,20.- - - - - -30.,35,41,42,60]。在少数情况下,类似的方法也适用于染色体异常的中期细胞遗传学分析[58,63,64,68]。这些探针的信号数量应该与每个间期细胞核的同源染色体数量相同[3.,7,10,20.- - - - - -30.,33,35,41,42,46]。然而,情况并非总是如此[7,10,23- - - - - -33,35]。这是使用着丝粒DNA探针的I-FISH的主要缺点,然而,使用位点特异性DNA探针(位点特异性BAC探针或BAC探针contigs)的FISH成功地解决了这一问题[13]。
FISH使用位点特异性DNA探针(YACs, BACs, PACs, cosmids)通常用于绘制染色体区域,其中断点位于[3.,5,13,61]。此外,这些探针可用于诊断已知的微缺失和微重复综合征[1,3.,13,27]、植入前遗传学诊断中的非整倍体和复发性染色体异常[48- - - - - -50]、产前诊断[3.,13,47]、肿瘤细胞遗传学分析[1- - - - - -3.,5,13,36,27,50],拷贝数变化的精度[8]。作为研究小于1mb的基因组位点的一种有价值的方法,带有位点特异性探针的I-FISH经常被用于研究基因的核组织及其对转录活性的影响[16- - - - - -18,69]。然而,相对中等的杂交效率(<70%)阻碍了这种方法在许多生物医学研究和诊断领域的应用[7,10]。后者不涉及应用这些类型探针的许多FISH诊断程序(例如,在常规血液学和肿瘤诊断的情况下)。对于诊断问题,这种方法的截断率在92%至98%之间[13]。
使用wcp的FISH是MFISH(24色FISH)和SKY [2,13,39,40]。这些方法对于癌症细胞遗传学和在某些情况下诊断体质染色体异常是有价值的[2,5,6,13,36]。对于间期染色体的分析,MFISH/SKY几乎不适用。然而,一项研究通过24色MFISH同时显示了成纤维细胞间期细胞核和前期中期莲座中的所有染色体[70]。此后,这些方法从未被考虑用于相关分析。wcp探针的二至五色检测已多次用于中期染色体结构改变的分子细胞遗传学诊断[1- - - - - -3.,5- - - - - -7,13,36,61]和间期细胞核基因组组织的研究[15,57,66,70- - - - - -72]。使用wcp探针的I-FISH问题太大,无法与其他间期分子细胞遗传学诊断技术竞争。7,10,33]。
通过对染色体位点进行显微解剖,获得一组产生多色伪g带的探针,提出了一种用于分析中期染色体的高分辨率分子细胞遗传学技术,称为MCB(多色带)[43]。后者一直被证明适用于鉴定染色体结构异常和基因组组织[2,13,36,43,45,61,73]。这种技术的一种改进,最近被称为间期染色体特异性MCB (ICS-MCB),它在单个细胞核上产生同源染色体对的MCB,已被证明对研究人类间期染色体组织和变异(健康和疾病中的体细胞基因组变异和染色体不稳定性)有效[3.,7,10,13,19,23,24,26- - - - - -29,31,33- - - - - -35,74,75]。除了不能同时分析几对同源染色体和分析的相对复杂性外,ICS-MCB没有主要的局限性。此外,这是获得整个间期染色体完整性的独特方法[23,33,35]。
最高的分子细胞遗传学分辨率是纤维FISH (~2.3 kb) [52,76]。这种方法最初是为高分辨率绘制克隆DNA片段而设计的。后者被发现可用于研究基因组组织(中期染色体)、转录停滞和基因组重排(包括基因序列中的大量缺失)[51,52,76]。虽然这项技术是基于从间期细胞核中获得DNA纤维,但它不能归因于I-FISH。纤维FISH单细胞分子细胞遗传学分析(特别是大细胞群分析)非常复杂。
全息
由于CGH比较个体基因组之间的数量差异,因此其应用仅限于分析染色体(基因组)位点的损失/增益,而无需直接显示染色体[4,77]。阵列CGH可以提供核苷酸水平的分辨率,但仍然不太适用于研究细胞的染色体。然而,一些报道已经证明,在微解剖间期细胞核上使用标准CGH或阵列CGH可以检测着床前胚胎单细胞中的染色体畸变[14,53,54]。这种方法适用于染色体生物学其他领域无用的不平衡基因组重排,这需要染色体DNA的可视化[10]。基于cgh的单细胞分析在分子诊断和体细胞基因组变异调查中的潜力仍有待估计。
PNA和PRINS
PNA和PRINS都可以成功地应用于人类染色体的研究[3.,7,10,13,37,38]。PNAs被认为比传统的分子细胞遗传学DNA探针有几个优点,这是它们更小的尺寸的结果[38]。尽管如此,缺乏可用性使研究人员无法进行评估原位与PNA探针杂交进行中期或间期分子细胞遗传学研究。此外,这些探针通常仅限于研究着丝粒和端粒重复染色体DNA。
与FISH和CGH不同,PRINS是基于另一种生化过程(聚合酶反应)[37]。这使得对新发现现象的病例对照研究能够排除杂交可能产生的假设误差[24]。通常,PRINS显示的结果与FISH几乎相同。因此,没有明显的兴趣用PRINS代替基于fish的技术,特别是考虑到它的本质局限性:可用的探针是围绕着中心/异染色质区域的寡核苷酸和很少的共染色质区域(可重复性差!)[3.,7,24,37]。
所有旨在分析间期染色体的研究的关键过程是可视化。换句话说,缺乏直接的(显微镜下的)DNA可视化使得所有这些研究都不完整。这在研究单细胞的染色体组织时变得更加明显。正如我们所看到的,只有基于fish的技术提供了在单个细胞中检测整个染色体或极小尺寸的特定基因组位点的可能性。因此,为了对人类间期染色体进行有效的研究,可以使用I-FISH协议。我们的下一部分综述了I-FISH的应用领域以及它的优点和局限性。
I-FISH:优势与局限
i - fish和所有其他基于fish的方法一样,大约需要三个步骤来完成:(i)获得细胞悬液或为分析进行另一种活检准备;(2)变性/杂交;(iii)杂交结果的显微视觉/数字分析[13,35,78]。第一阶段不受I-FISH的任何限制,因为人体有机体的任何细胞类型都可以进行这种分析[7,35,78]。与经典细胞遗传学(分析中期染色体)相比,这被认为是间期分子细胞遗传学技术的本质优势——能够分析所有组织(细胞)类型中的染色体[3.,7,13,20.- - - - - -36]。传统上,I-FISH被认为仅限于分析特定的基因组位点[2,3.,7,13]。然而,一些修饰,如ICS-MCB,可以看到间期染色体的完整性[23,24,26- - - - - -29,31,33- - - - - -35,74]。如前所述,ICS-MCB仍然存在局限性,即每次分析只能研究一对同源染色体(中期染色体分析允许可视化细胞的所有染色体),然而,它是可视化细胞核中整个带状染色体的独特方法[23,33]。I-FISH的变性和杂交步骤与基于fish的中期方法相同[13,35]。因此,在间期分子细胞遗传学研究中,没有额外的缺陷可以归因于这些程序。通常对I-FISH结果进行评分通过传统的目视分析[35,79]。然而,应用数字分析研究间期染色体有许多可能性。这些包括但不限于QFISH,信号共定位分析(由于间期核易位导致的基因融合的肿瘤细胞遗传学研究),ICS-MCB(染色体结构可视化),增加FISH结果可见性,自动信号检测[79]。此外,基于FISH的多色分析(SKY、MFISH、多探针interpahse FISH或MFISH)也需要数字分析,这些分析通常通过同时分析多个目标来增加FISH应用的潜力。2,3.,12,13,20.- - - - - -30.,35,36,80]。结合上述几种技术(mFISH,每次检测2-5个探针(颜色),QFISH和ICS-MCB)已经成为一种综合方法的基础,被证明是在间期超分子水平上进行分子诊断和基因组/染色体研究的最高效率[7,10,12,13,20.- - - - - -30.,32,33,35,41,60,78,81]。FISH结果评估的类型(即视觉或数字)取决于分析的类型,或者更准确地说,取决于DNA探针的特征(每次反应的探针数量和DNA序列亲和力)和检测。因此,为了获得概述,可以这样细分I-FISH技术。表格2给出这样的概述。
I-FISH与着丝体探针
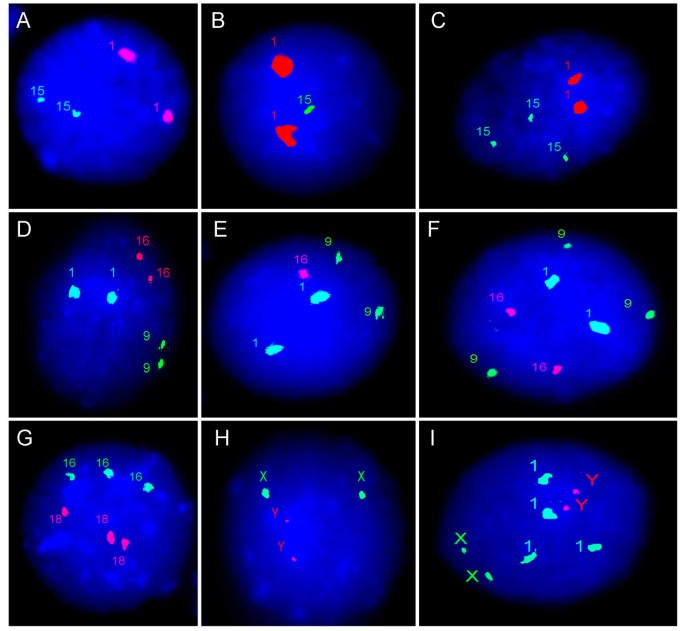
I-FISH与着丝体探针高度适用于不同领域的生物医学研究和诊断[7,10,13,20.- - - - - -22,30.,35,41,58- - - - - -60,81,82]。该方法最常见的应用是鉴定间期细胞核中的数量染色体异常(非整倍体和多倍体)1)。后者是产前/产后诊断、癌症诊断/预后、体细胞基因组变异调查所必需的[7,10,20.- - - - - -22,30.,35,82]。从表中可以看出2,着丝粒DNA探针杂交效率接近100% [7,10,30.,35]和染色体特异性DNA序列形成了染色体周围/异色区域(除了染色体5和19、13和21、14和22共享的阿尔法体DNA) [30.,35,41,42,44,83是这项技术所具有的优势的根本来源。近中心粒dna的异型性可以产生缺乏信号,从而导致I-FISH检测不可能应用。幸运的是,这种极端的异型性(着丝粒DNA变异)在一般人群中是罕见的[32,35,59,84- - - - - -86]。
I-FISH与位点特异性探针
I-FISH与位点特异性探针的间期分子细胞遗传学研究通常应用于植入前、产前和产后诊断以及癌症细胞遗传学(图2)2) [2,3.,13,36,47- - - - - -50]。虽然多次被指出对于检测由染色体间易位引起的基因融合(癌症生物标志物)具有重要意义[49,87- - - - - -89]并可用于植入前诊断[48- - - - - -50],这种I-FISH修改有相当大的缺点。首先,位点特异性探针的杂交效率通常在40% - 70%之间[7,10]。这有可能产生假阳性或假阴性数据[7,28]。此外,它还需要使用探针来检测“特征良好”的基因组DNA序列(即已定位的致癌基因、微缺失或微重复区域内的基因/基因组位点)[3.]。因此,使用这些DNA探针来检测癌细胞中众所周知的染色体重排的方法很少,这并不奇怪[87- - - - - -89]而在临床人群中更罕见的是缺失/重复[1,3.,8,50,90- - - - - -92]。然而,使用位点特异性探针的FISH几乎是可视化间期细胞核中小于1mb的DNA序列的唯一方法。在mFISH检测中同时使用着丝粒和位点特异性探针(图2)3.)有时可用于诊断和调查细胞间(体细胞)基因组变异[7,20.,28,46,48]。
I-FISH与wcp
人们普遍认为,使用wcp进行FISH染色体绘制对于鉴别间期染色体的数量和结构是完全无用的(图2)4) [3.,7,10,13,33,35,80]。然而,间期染色体结构的基础研究通常是使用I-FISH和wcp进行的。这些探针可以可视化染色体区域及其相对于核室的定位(图2)4 b) [57,70- - - - - -72,85,93]。在过去的二十年中,I-FISH-wcp方法几乎是研究间期基因组组织的唯一方法[72]。一些研究提出在间期MFISH反应中使用完整的wcp集[70,93]。尽管如此,这些技术在绘制染色体区域(体积)的能力上都是有限的(表1)2) [33]。
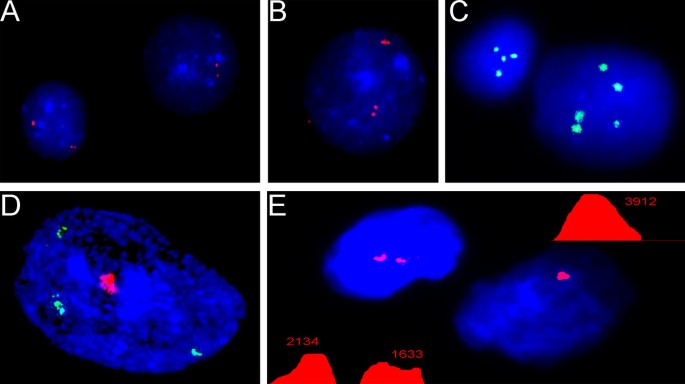
7号和21号染色体有两个wcp的I-FISH。(一)不明确的染色体区域既不能提供关于染色体数量的信息,也不能提供关于染色体结构的信息(染色体7 -绿色信号;21号染色体——红色信号),而这个个体呈现出常规的不平衡t(7;21);更多细节见Vorsanova et al. 2008 [64];(B)从共济失调-毛细血管扩张脑分离的细胞的间期细胞核中的染色体区域(染色体7 -绿色信号;第14号染色体——红色信号);注意不可能确定染色体的数目。
ICS-MCB
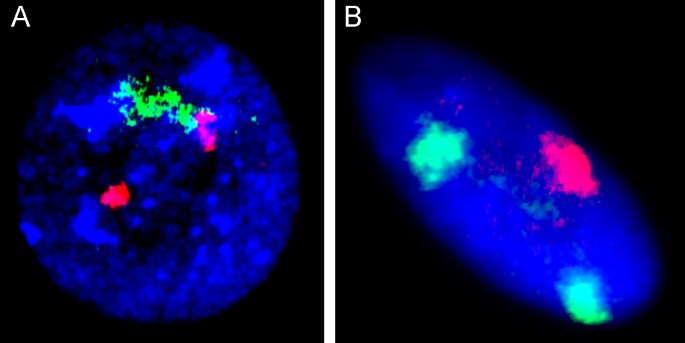
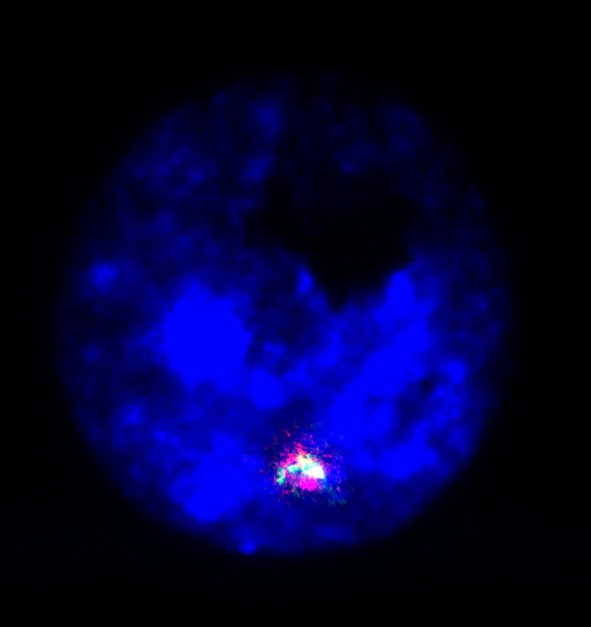
为了可视化完整的同源间期染色体对,必须生成MCB。应用ICS-MCB时,间期带状染色体表现为中期染色体。因此,这种I-FISH方法解决了细胞遗传学长期存在的局限,即获取中期染色体[23,31- - - - - -35]。数字5给出了从阿尔茨海默病大脑分离的间期细胞核中检测非整倍体的例子[28]。ICS-MCB可广泛应用于体细胞基因组变异、染色体间期结构和功能组织、超分子疾病机制的基础研究[3.,7,10,12,13,19,23,24,26- - - - - -29,31,33- - - - - -36,73- - - - - -75,79- - - - - -81]。显然,这种技术的唯一缺点是不能同时分析多个同源染色体对[23,33]。
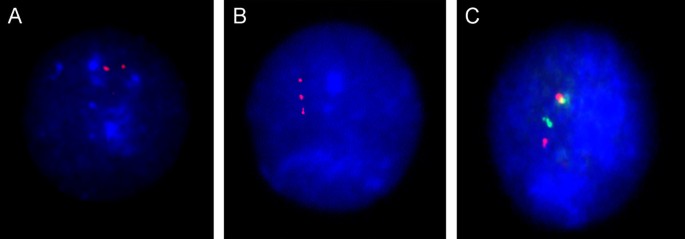
I-FISH应用中存在几个普遍的问题。正如我们已经提到的,杂交效率的差异使不同探针组的同时应用变得复杂[7]。例如,位点特异性探针的信号可能会因为wcp或着心性探针信号的高亮度而被遗漏。在这里,最明显的解决方案是ICS-MCB的应用[33,35]。然而,一些间期方案,主要与分子肿瘤细胞遗传学相关,被证明是有效的诊断目的[1,13,36,87,88]。细胞周期S期的DNA复制是I-FISH应用的另一个主要问题[7,47]。尽管在现有文献中有关于这种类型的I-FISH伪影的建议,但FISH分析可能会受到复制信号外观的阻碍。这主要与位点特异性DNA探针有关,然而,在使用着丝粒探针的I-FISH中也注意到这一点[7,10,22,35,47)(图6 a - c)。可被认为是间期假阳性染色体异常的众多伪影的另一个来源是核组织。在这种情况下,细胞核中最有问题的染色体排列模式与染色体位点关联有关[94,95]。考虑到许多细胞类型倾向于表现出基因组位点的核内关联/配对,这显著影响了I-FISH结果,这一点变得更加重要6 d) [20.,32,35,95]。尽管相关困难经常发生,但QFISH很容易解决问题(图1)6 e) [23,24,28,32,35,95]。
I-FISH与着丝粒/位点特异性DNA探针的问题。(一)和(B)特定基因组位点的复制(LSI21探针)——一些细胞核表现出复制信号,而在一些细胞核中则不明显;注意信号之间的距离可以大于一个信号的直径;(C)X染色体四染色体组中信号(DXZ1)的异步复制;请注意,很难对右核的信号数量做出明确的结论;(D)用着丝粒/位点特异性DNA探针检测1号染色体的双色FISH显示了从成人大脑分离的细胞核中的染色体关联;注意,不可能确定染色体的数量;(E)QFISH显示同源染色体的着丝粒区有关联,但没有单体或染色体丢失(更多详情见[32])。
在结束基于间期fish的技术列表时,要提到免疫- fish。该方法结合免疫组织化学检测蛋白质和FISH可视化DNA (RNA)靶点[96- - - - - -98]。免疫- fish被发现适用于癌症研究/诊断(同时免疫表型和单细胞遗传分析)、染色体结构和组织的研究、移植研究以及超分子疾病机制的鉴定[28,29,96- - - - - -One hundred.]。数字7展示了用于研究成人大脑神经元细胞间期染色体的免疫- fish [28,29]。
在列举了已知的间期分子细胞遗传学方法后,重点介绍了它们的具体应用。目前,需要使用I-FISH的生物医学领域主要有:核内染色体(基因组)组织分析;体细胞(细胞间和组织间)基因组变异的鉴定;分子细胞遗传学诊断。下面,对这些应用程序进行简要描述。
间期基因组组织
间期的空间染色体组织已被反复证明是许多关键细胞内过程的驱动力。研究表明,间期染色体的特定排列可能与基因组活性、正常/异常细胞分裂、减数分裂和有丝分裂期间发生的染色体重排有关[7,15- - - - - -17,69,19,70- - - - - -72,75,93,One hundred.,101]。为了获得间期基因组组织的综合视图,需要应用多种方法。在这些研究中起主导作用的是I-FISH [7,80,72,93]。在这种情况下,i - fish方法可以用于间期染色体分析的几种应用:(i)鉴定染色体定位及其与其他核室(核核,Cajal体,核斑等)的关系- i - fish与wcp,间期MFISH或ICS-MCB [19,31,23,33,35,34,70- - - - - -72,74,93];(ii)研究特定基因组位点的相互关联定位(即整个染色体或其区域的关联)与它们的行为(转录/复制活性)之间的相关性,以阐明核组织及其驱动力的功能意义——I-FISH与着丝粒、位点特异性和wcp、mFISH/QIFSH或ICS-MCB [7,19,31,23,33,35,32,34,57,66,69,72,74,75,93- - - - - -95,One hundred.];(iii)分析与基因组、表观基因组和蛋白质组变化相关的染色体行为,以描述特定间期染色体结构的可能后果(即癌症中发生的体细胞染色体突变)——I-FISH与着丝粒、位点特异性和wcp、mFISH/QIFSH、ICS-MCB和immune - fish [7,15- - - - - -19,34,69,71,72,74,75,93- - - - - -95,One hundred.,101]。空间染色体组织的I-FISH分析的额外复杂性与细胞核的结构保存有关。值得注意的是,一些研究者报道了固定类型对I-FISH结果的依赖性[72,93],而其他人则没有[71]。尽管存在这些争论,I-FISH空间基因组分析的另一种选择可能是悬浮FISH (S-FISH)技术[102]。这种方法的优势在于可以从任何人体组织中研究三维(3D)保存的细胞核,而其他3D保存技术需要特定的细胞培养条件。后者使I-FISH失去了它的主要优势。总之,我们得出结论,全面描述核组织的功能意义需要应用几乎所有已知的间期分子细胞遗传学技术。
体细胞基因组变异
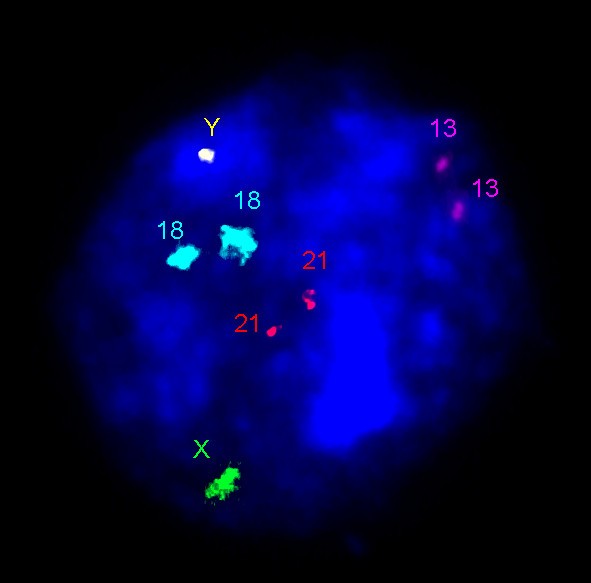
在过去的五年中,基因组变异——人类健康和病理多样性的来源——已成为当前生物医学研究的一个主要焦点。人类基因组的变异参与了进化和疾病途径,被认为是旨在揭示疾病机制和物种起源的研究的主要目标[103]。在描述了个体间基因组多样性的高比率之后不久,人们就假设相关过程——体细胞基因组变异——是细胞间基因组差异的起源。此外,细胞基因组的体细胞变异被认为是复杂人类疾病的一种机制[7,10,12]。后者已被神经和精神疾病的高分辨率间期分子细胞遗传学(分子神经细胞遗传学)研究部分证实[7,20.- - - - - -29]。越来越多的证据表明,体细胞基因组变异对关键生理过程的贡献已被用于进一步假设细胞间基因组变异在正常/异常人类宫内发育(包括外源性效应)、癌变、组织特异性病理(即靶向神经变性)、复杂疾病中的性别差异、对衰弱性神经疾病分子治疗的反应等方面的新作用。21,22,24,28,29,104- - - - - -109]。总之,这构成了单细胞生物学领域未来研究的基础。所有这些成就都是间期分子细胞遗传学大量发展的结果。为了证明这一点,我们想参考人体组织中随机(散发性或本底)非整倍体水平的测定(表1)3.) [20.- - - - - -24,59,28,29,35,81,109- - - - - -112]。通过这些数据,很难避免这样的结论:如果应用高分辨率I-FISH方法,非整倍体率将变得更加合理。此外,个体间基因组变异可以通过双亲起源测定FISH (pod-FISH)技术在间期检测[113]。总之,I-FISH可以作为在微观和亚微观水平上研究基因组变异的必要补充。
分子细胞遗传学诊断
利用I-FISH进行染色体畸变的分子细胞遗传学鉴定已在本文中提到。在此,我们想就医学细胞遗传学的更具体问题作一些补充评论,并再次表明研究间期细胞核中的染色体对分子癌和产前诊断具有深远的影响[114,115]。显然,要参考所有使用I-FISH的研究几乎是不可能的。在这里,我们更倾向于描述在I-FISH引入和用于诊断目的时遇到的几个困难。新引入的间期技术(即ICS-MCB)仅用于研究目的,因此尚未对诊断有效性进行测试。尽管限制了这些I-FISH协议的实际应用,但相关的缺点可以很容易地通过未来的研究消除。另一个问题来自染色体镶嵌的诊断。现时并没有普遍接受的镶嵌图案定义指引或标准[7,10,35]。尽管有些尝试(详情见[35]),关于这个话题还没有达成共识。解决方案将是一项大规模的研究,旨在揭示未受影响的人体组织中的体细胞基因组变异。希望类似的研究已经开始了[20.- - - - - -24,59,28,29,35,81]。最后,关于同一个体的中期和间期诊断分析之间的相关性,仍然没有数据或建议。换句话说,人们对哪些数据更有效仍然知之甚少。结构观点认为染色体中期分析更为精确。另一方面,马赛克需要大量的细胞群来分析。当试图描述复杂的、隐藏的(神秘的)或动态的镶嵌现象时,解决这个问题变得更加困难。在这种情况下,中期分析对于所有细胞系的彻底定义是必不可少的,因为简单的I-FISH分析无法精确确定每个细胞系的百分比[116,117]。此外,一些研究需要获得额外的数据,如染色体的亲本起源或一些表观遗传特征,以进行更彻底的确认或排他性诊断。要获得这个机会,请申请QFISH [32]或pod-FISH [112]。
人们普遍认为,分子细胞遗传学诊断应使用一组技术进行[1- - - - - -10]。它可以是使用不同平台的分子细胞遗传学技术的组合(即FISH+CGH),也可以是在复杂嵌合或平衡结构染色体异常的情况下连续的中期和间期FISH分析。因此,无论分子间期细胞遗传学领域取得了重大进展,I-FISH技术仍然是中期细胞遗传学或基于阵列CGH的全基因组筛选方法的补充。唯一的例外是,在间期和植入前遗传学诊断中,很少有用于鉴定已知癌症相关易位的靶向检测。因此,就诊断潜力而言,I-FISH应该得到更彻底的分析,以在基因检测程序中占据当之无愧的地位。
结论及未来发展方向
在健康和疾病的不同组织/细胞类型中,人类间期染色体的结构和行为特性在很大程度上仍然未知。迄今为止,在染色体间期生物学的遥远相关领域只有零碎的数据,没有一个完整的染色体行为和排列沿细胞周期的观点。对间期染色体可视化的分子细胞遗传学技术的概述表明,对几乎所有人类组织的染色体进行高分辨率分析确实存在强大的技术基础。间期分子细胞遗传学的发展推动了I-FISH应用的三个主要方向,这为定义细胞核中时空染色体排列的功能后果提供了可能性,阐明了这种巨大的细胞间基因组多样性(体细胞基因组变异)的作用,并为医学遗传学和肿瘤学提出了新的诊断解决方案。I-FISH是研究人类所有细胞类型、细胞周期的所有阶段以及分子和超分子分辨率下基因组的变化和行为的独特方法。因此,间期分子细胞遗传学的发展为遗传学、细胞和分子生物学、基因组/分子医学开辟了广阔的前景。考虑到研究人类间期染色体的技术方面的数据,我们得出结论,这一生物医学方向有可能为人类遗传学和细胞生物学领域的基础和应用生物医学研究提供革命性的解决方案。这无疑是间期分子细胞遗传学技术(即mFISH、QFISH、ICS-MCB、S-FISH、pod-FISH、immune - fish等)结合的结果,这些技术已经在当前生物医学领域产生了一些发现。
参考文献
Gersen SL, Keagle MB;临床细胞遗传学原理。第二版。托托瓦,新泽西州:Humana出版社;2005.
Liehr T, Claussen U:临床遗传学和肿瘤细胞遗传学中人类染色体特征的多色fish方法。咕咕叫基因组学2002年,3:231 - 235。10.2174 / 1389202023350525
约洛夫IY,沃萨诺娃SG,尤洛夫YB:最近的分子细胞遗传学专利。近期Pat DNA基因测序2008年,2:6 - 15。10.2174 / 187221508783406585
Bejjani BA, Shaffer LG:当代分子细胞遗传学的临床应用。年Rev基因组学2008年,9:71 - 86。10.1146 / annurev.genom.9.081307.164207
Liehr T, Starke H, Weise A, Lehrer H, Claussen U:多色FISH探针装置及其应用。Histol Histopathol2004年,19:229 - 237。
斯派彻先生,卡特NP:新的细胞遗传学:模糊了分子生物学的界限。Nat Rev Genet2005年,6:782 - 792。10.1038 / nrg1692
约洛夫IY,沃萨诺娃SG,尤洛夫YB:哺乳动物神经细胞的染色体变异:已知的事实和有吸引力的假设。Int Rev Cytol2006年,249:143 - 191。10.1016 / s0074 - 7696 (06) 49003 - 3
卡特NP:利用DNA微阵列分析拷贝数变异的方法和策略。Nat麝猫2007年,39:S16-S21。10.1038 / ng2028
列夫斯基JM,歌手RH:基因表达和普通细胞的神话。细胞生物学趋势2003年,13:4 - 6。10.1016 / s0962 - 8924 (02) 00002 - 8
约洛夫IY,沃萨诺娃SG,尤洛夫YB:细胞间基因组(染色体)变异导致体细胞嵌合体:机制和后果。咕咕叫基因组学2006年,7:435 - 446。10.2174 / 138920206779116756
伊曼纽尔BS, Saitta SC:从显微镜到微阵列:解剖复发性染色体重排。Nat Rev Genet2007年,8:869 - 883。10.1038 / nrg2136
约洛夫IY,沃萨诺娃SG,尤洛夫YB:染色体嵌合是全球性的。摩尔Cytogenet2008年,1:26.10.1186 / 1755-8166-1-26
Liehr老师:荧光原位杂交(FISH) -应用指南。柏林,海德堡:施普林格;2009.
Vanneste E, Voet T, Le Caignec C, Ampe M, Konigs P, Mellote C, Debrock S, Amyere M, Vikkula M, Schuit F, Fryns JP, Verbeke G, D'Hooghe T, Moreau Y, Vermeesch JR:染色体不稳定在人类卵裂期胚胎中很常见。Nat地中海2009年,15:577 - 583。10.1038 / nm.1924
Cremer T, Cremer M, Dietzel S, Muller S, Solovei I, Fakan S:染色体区域-功能性核景观。当前观点细胞生物学2006年,18:307 - 316。10.1016 / j.ceb.2006.04.007
葛泽S,马特奥斯-朗格拉克J,范德瑞尔R:间期三维基因组组织及其与基因组功能的关系。Semin细胞发育生物学2007年,18:707 - 714。10.1016 / j.semcdb.2007.08.007
Schneider R, grosschel R:核结构、基因组组织和基因表达的动力学和相互作用。基因开发2007年,21:3027 - 3043。10.1101 / gad.1604607
刚铎A,奥尔森R:染色体三维串扰。自然2009年,461:212 - 217。10.1038 / nature08453
Manvelyan M, Hunstig F, Bhatt S, Mrasek K, Pellestor F, Weise A, Simonian I, Aroutiounian R, Liehr T:人类精子的染色体分布——三维多色带研究。摩尔Cytogenet2008年,1:25.10.1186 / 1755-8166-1-9
Yurov YB, Vostrikov VM, Vorsanova SG, Monakhov v, Iourov y:精神分裂症死后脑多色荧光原位杂交作为鉴定神经精神疾病低水平染色体非整倍体的方法。大脑的开发2001年,2317(1): 186 - 190。10.1016 / s0387 - 7604 (01) 00363 - 1
Vorsanova SG, Kolotii AD, Iourov y, Monakhov v, Kirillova EA, Soloviev IV, Yurov YB:间期FISH分析揭示了自然流产中染色体镶嵌现象高频率的证据。细胞化学2005年,53:375 - 380。10.1369 / jhc.4A6424.2005
Yurov YB, Iourov IY, Monakhov v, Soloviev IV, Vostrikov VM, Vorsanova SG:FISH间期研究揭示了发育和成人大脑非整倍体频率的变化。细胞化学2005年,53:385 - 390。10.1369 / jhc.4A6430.2005
Iourov IY, Liehr T, Vorsanova SG, Kolotii AD, Yurov YB:人脑有丝分裂后细胞间期染色体的多色显带(MCB)显示。染色体Res2006年,14:223 - 229。10.1007 / s10577 - 006 - 1037 - 6
Yurov YB, Iourov IY, Vorsanova SG, Liehr T, Kolotii AD, Kutsev SI, Pellestor F, Beresheva AK, Demidova IA, Kravets VS, Monakhov VV, Soloviev IV:人脑发育中的非整倍体和限制性染色体嵌合体。《公共科学图书馆•综合》2007年,2:e558。10.1371 / journal.pone.0000558
Yurov YB, Vorsanova SG, Iourov IY, Demidova IA, Beresheva AK, Kravetz VS, Monakhov VV, Kolotii AD, Voinova-Ulas VY,戈尔巴乔夫NL:不明原因的自闭症通常与低水平的马赛克非整倍体有关。J Med Genet2007年,44:521 - 535。10.1136 / jmg.2007.049312
Yurov YB, Iourov IY, Vorsanova SG, Demidova IA, Kravetz VS, Beresheva AK, Kolotii AD, Monakchov VV, Uranova NA, Vostrikov VM, Soloviev IV, Liehr T:精神分裂症的大脑表现出低水平的非整倍体,包括1号染色体。Schizophr Res2008年,98:137 - 147。10.1016 / j.schres.2007.07.035
约洛夫IY,沃萨诺娃SG,尤洛夫YB:脑疾病的分子细胞遗传学和细胞基因组学。咕咕叫基因组学2008年,9:452 - 465。10.2174 / 138920208786241216
刘建军,刘建军,李建军,刘建军;正常人、阿尔茨海默病和共济失调-毛细血管扩张脑的非整倍体:差异表达和病理意义。一般人说2009年,34:212 - 220。10.1016 / j.nbd.2009.01.003
Iourov IY, Vorsanova SG, Liehr T, Kolotii AD, Yurov YB:增加的染色体不稳定性显著破坏神经基因组的完整性和介导小脑变性在共济失调-毛细血管扩张的大脑。Hum Mol Genet2009年,18:2656 - 2669。10.1093 /物流/ ddp207
刘建军,刘建军,刘建军,刘建军,刘建军。使用菁氨酸和荧光素染料的高分辨率荧光原位杂交:用直接荧光标记的阿尔法DNA探针进行超快速染色体检测。哼麝猫1996年,97:390 - 398。10.1007 / BF02185780
Lemke J, Claussen J, Michel S, Chudoba I, Muhlig P, Westermann P, Sperling K, Rubtsov N, Grummt UW, Ullmann P, Kromeyer-Hauschild K, Liehr T, Claussen U:人类5号染色体间期的dna结构。我是热内吗2002年,71:1051 - 1059。10.1086/344286
刘建军,苏洛维耶夫4,沃沙诺娃SG,莫纳霍夫v,尤洛夫YB:应用于人分子细胞遗传学的荧光原位杂交(FISH)信号定量评估方法。细胞化学2005年,53:401 - 408。10.1369 / jhc.4A6419.2005
刘志强,李志强,刘志强,刘志强;间期染色体特异性多色带(ICS-MCB):一种分析间期染色体完整性的新工具。Biomol英格2007年,24:415 - 417。10.1016 / j.bioeng.2007.05.003
Manvelyan M, Hunstig F, Mrasek K, Bhatt S, Pellestor F, Weise A, Liehr T:人类、大猩猩和白手长臂猿的第18、19、21和22号染色体在三维保存的间期细胞核中的位置。摩尔Cytogenet2008年,1:9.10.1186 / 1755-8166-1-9
刘建军,刘建军,刘建军,刘建军;间期FISH:细胞间基因组变异和体细胞染色体嵌合的检测。在荧光原位杂交(FISH) -应用指南。编辑:Liehr T. Berlin,海德堡:施普林格Verlag;2009:301 - 311。full_text
Liehr T, Claussen U:分子细胞遗传学技术的最新进展。Curr Mol Med2002年,2:283 - 297。10.2174 / 1566524024605725
佩莱斯特·F:PRINS和原位PCR方案。方法:第二版。2006年,334:1 - 243。
Pellestor F, Paulasova P, Andreo B, Lefort F, Hamamah S:多色PRINS和多色PNA。细胞基因基因组研究2006年,114:263 - 269。10.1159 / 000094211
Schrock E, du Manoir S, Veldman T, Schoell B, Weinberg J, Ferguson-Smith MA, Ning Y, Ledbetter DH, Bar-Am I, Soenksen D, Garini Y, Ried T:人类染色体的多色光谱核型。科学1996年,273:494 - 497。10.1126 / science.273.5274.494
斯派克先生,巴拉德GS,沃德DC:用组合多氟FISH对人类染色体进行核型分析。Nat麝猫1996年,12:368 - 375。10.1038 / ng0496 - 368
Soloviev IV, Yurov YB, Vorsanova SG, Malet P, Zerova TE, Buzhievskaya TI:双色原位杂交对α -卫星染色体13、21个cosmid克隆的特异性进行快速筛选。Tsitol麝猫1998年,32:60 - 64。
索洛维耶夫IV, Yurov YB, Vorsanova SG, Marcais B, Rogaev EI, Kapanadze BI, Brodiansky VM, Yankovsky NK, Roizes G:人13、21、22号染色体cosmid文库α-卫星DNA荧光原位杂交分析Rus J Genet1998年,34:1247 - 1255。
Liehr T, Heller A, Starke H, Rubtsov N, Trifonov V, Mrasek K, Weise A, Kuechler A, Claussen U:基于显微解剖的所有24条人类染色体的高分辨率多色带。内科医学杂志2002年,9:335 - 339。
尼采A,罗基M,斯塔克H,海勒A,费德勒W,乌洛达斯卡I,朗卡雷维奇IF,比森V,克劳森U,利尔T:一种新的标记染色体多色fish鉴定方法:着丝体特异性多色fish (cenM-FISH)。哼麝猫2001年,108:199 - 204。10.1007 / s004390100459
Liehr T, Weise A, Heller A, Starke H, Mrasek K, Kuechler A, Weier H- ug, Claussen U:基于YAC/ bac探针和区域特异性微解剖DNA文库的多色染色体显带(MCB)。细胞基因基因组研究2002年,97:43-50。10.1159 / 000064043
Baumgartner A, Weier JF, Weier H-UG;染色体特异性DNA重复探针。细胞化学2006年,54:1363 - 1370。10.1369 / jhc.6A6974.2006
刘建军,刘建军,刘建军,刘建军,刘建军,刘建军。用位点特异性cosmid和cosmid连接探针对复制后细胞进行间期荧光原位杂交产前诊断21三体。Prenat成岩作用1995年,15:237 - 248。10.1002 / pd.1970150307
冯俊,Weier H-UG, Pedersen RA:利用光谱成像技术检测间期细胞的结构和数量染色体异常。细胞化学2001年,49:797 - 798。
Stumm, Wegner R-D, Bloechle M, Eckel H:间期M-FISH商业探针在产前和PGD诊断中的应用细胞基因基因组研究2006年,114:296 - 301。10.1159 / 000094217
Lu CM, Kwan J, Baumgartner A, Weier JF, Wang M, Escudero T, Munne S, Zitzelsberger HF, Weier H-UG:DNA探针池快速描绘染色体断点。细胞化学2009年,57:587 - 597。10.1369 / jhc.2009.953638
Weier H-UG,王敏,Mullikin JC,朱勇,程建峰,Greulich KM, Bensimon A, Gray JW:定量DNA纤维制图。Hum Mol Genet1995年,4:1903 - 1910。10.1093 /物流/ 4.10.1903
威尔H-UG:用于组装高分辨率物理地图的DNA纤维制图技术。细胞化学2001年,49:939 - 948。
Wells D, Delhanty JDA:利用全基因组扩增和单细胞比较基因组杂交技术对人类着床前胚胎进行全面的染色体分析。Mol Hum repd2000,6:1055 - 1062。10.1093 / molehr / 6.11.1055
Le Caignec C, Spits C, Sermon K, De Rycke M, Thienpont B, Debrock S, Staessen C, Moreau Y, Fryns JP, Van Steirteghem A, Liebaers I, Vermeesch JR:阵列CGH单细胞染色体失衡检测。核酸类2006年,34:e68。10.1093 / nar / gkl336
麦克尼尔N,里德T:鉴定复杂染色体重排的新型分子细胞遗传学技术:技术及其在分子医学中的应用。专家Rev Mol Med2000,2:1 - 14。10.1017 / S1462399400001940
朗斯多普公司总经理奥伯特·G:端粒和衰老。杂志牧师2008年,88:557 - 579。10.1152 / physrev.00026.2007
李建军,李建军,李建军,李建军,李建军,李建军,李建军。人类和小鼠淋巴细胞细胞核中着丝粒和端粒的三维排列。染色体Res2003年,11:485 - 502。10.1023 /: 1025016828544
Vorsanova SG, Yurov YB, Ulas VY, Demidova IA, Kolotii AD, Gorbatchevskaia NL, Beresheva AK, Soloviev IV:Rett综合征(RTT)的细胞遗传学和分子细胞遗传学研究:回顾性分析俄罗斯RTT患者队列(调查57名女孩和3名男孩)。大脑的开发2001年,23:S196-S201。10.1016 / s0387 - 7604 (01) 00347 - 3
Vorsanova SG, Iourov IY, Beresheva AK, Demidova IA, Monakhov VV, Kravets VS, Bartseva OB, Goyko EA, Soloviev IV, Yurov YB:21号染色体不分离,阿尔法DNA变异和唐氏综合症的社会遗传特征。Tsitol麝猫2005年,39(6): 30-36。
Vorsanova SG, Iourov IY, Demidova IA, Kirillova EA, Soloviev IV, Yurov YB:自然流产胎儿的嵌合和多重数目染色体失衡。Tsitol麝猫2006年,40(5): 28 - 30。
Vorsanova SG, Iourov IY, Voinova-Ulas VY, Weise A, Monakhov VV, Kolotii AD, Soloviev IV, Novikov PV, Yurov YB, Liehr T:部分单体7q34-qter和21pter-q22.13由于隐性不平衡易位t(7;21),但不是整个21号染色体的单体:一个病例报告和文献回顾。摩尔Cytogenet2008年,1:13.10.1186 / 1755-8166-1-13
Yurov YB:克隆重复DNA序列的原位杂交和人类染色体的鉴别染色。公牛Exp生物医学1984年,97:643 - 647。10.1007 / BF00808254
Vorsanova SG, Yurov YB, Alexandrov IA, Demidova IA, Mitkevich SP, Tirskaya AF:18p-综合征:一例罕见病例及18号染色体特异性阿尔法体DNA序列原位杂交诊断。哼麝猫1986年,72:185 - 187。10.1007 / BF00283945
Vorsanova SG, Yurov YB, Kurbatov MB, Kazantseva LZ:易位t(1;17)(q12;q25),临床表现为1q近端缺失:用1号染色体特异性卫星DNA探针原位杂交鉴定。哼麝猫1990年,86:173 - 174。10.1007 / BF00197700
She X, Horvath JE, Jiang Z, Liu G, Furey TS, Christ R, Graves T, Gulden CL, Alkan C, Bailey JA, Sahinalp C, Rocchi M, Haussler D, Wilson RK, Miller W, Schwartz S, Eichler EE:人类基因组中着丝粒过渡区的结构和进化。自然2004年,430:857 - 864。10.1038 / nature02806
索洛维I, Schermelleh L, During k, Engelhardt A, Stein S, Cremer C, Cremer T:人类细胞周期和有丝分裂后着丝点定位的差异。Chromosoma2004年,112:410 - 423。10.1007 / s00412 - 004 - 0287 - 3
李建军,李建军,李建军,李建军,李建军,李建军,李建军。来自不同染色体的阿尔法DNA高效率地形成新生小染色体。染色体2005年,13:411 - 422。10.1007 / s10577 - 005 - 0979 - 4
Vorsanova SG, Iourov IY, Demidova IA, Kolotii AD, Soloviev IV, Yurov YB:中心周反转inv(7)(p11q21.1):报告两例及基因型-表型相关性。Tsitol麝猫2006年,40(3): 45-48。
Shopland LS, Lynch CR, Peterson KA, Thornton K, Keeper N, van Hase J, Stein S, Vincent S, Molloy KR, Kreth G, Cremer C, Bult CJ, O'Brien TP:根据基因分布模式在初级基因组序列中的连续染色体区域的折叠和组织。J细胞生物学2006年,174:27-38。10.1083 / jcb.200603083
Bolzer A, Kreth G, Solovei I, Koehler D, Saracoglu K, Fauth C, Muller S, Ellis R, Cremer C, Speicher MR, Cremer T:人类男性成纤维细胞细胞核和前期中期玫瑰花中所有染色体的三维图谱。公共科学图书馆杂志2005年,3:e157。10.1371 / journal.pbio.0030157
Croft JA, Bridger JM, Boyle S, Perry P, Teague P, Bickmore WA:人类细胞核中染色体的位置和形态的差异。J细胞生物学1999年,145:1119 - 1131。10.1083 / jcb.145.6.1119
克里默T,克里默C:染色体领地的兴起、衰落和复活:一个历史的视角。第二部分。20世纪50年代至80年代染色体领地的衰落和复活。第三部分。染色体区域和功能性核结构:从20世纪90年代到现在的实验和模型。组织化学2006年,50:223 - 272。
Kosyakova N, Weise A, Mrasek K, Claussen U, Liehr T, Nelle H:所有人类染色体的染色体带的有层次组织的分裂。摩尔Cytogenet2009年,2:4.10.1186 / 1755-8166-2-4
魏斯A,斯塔克H,海勒A,克劳森U,利尔T:证据间期DNA去浓缩横向染色体轴:多色带分析。内科医学杂志2002年,9:359 - 361。
Manvelyan M, Kempf P, Weise A, Mrasek K, Heller A, Liehr A, Hoffken K, Friecke HJ, Sayer HG, Liehr T, Mkrtchan H:用三维分子细胞遗传学检测骨髓细胞8号和21号染色体的优先共定位。内科医学杂志2009年,24:335 - 341。
吕春明,王敏,Greulich-Bode K, Weier JF, Weier HUG:定量DNA纤维制图。在荧光原位杂交(FISH) -应用指南。编辑:Liehr T. Berlin,海德堡:施普林格Verlag;2009:269 - 291。
Pinkel D, Albertson DG:比较基因组杂交。年Rev基因组学2005年,6:331 - 354。10.1146 / annurev.genom.6.080604.162140
刘建军,刘建军,刘建军,刘建军。染色体PRINS标记的脑组织制备。方法:2006年,334:123 - 132。
Iourov IY:显微镜和成像系统。在荧光原位杂交(FISH) -应用指南。编辑:Liehr T. Berlin,海德堡:施普林格Verlag;2009:75 - 84。full_text
利尔·T·埃德:人类细胞遗传学中的多色FISH。细胞基因基因组研究2006年,114:183 - 389。10.1159 / 000095450
约洛夫IY,沃萨诺娃SG,尤洛夫YB:发育和成人大脑神经干细胞非整倍体的检测。电子生物学2008年,4:36-42。
Vorsanova SG, Yurov YB, Deryagin GV, Soloviev IV, Bytenskaya GA:非整倍体的原位杂交诊断:间期细胞核分析。公牛Exp生物医学1991年,112:413 - 415。10.1007 / BF00841378
Lee C, Wevrick R, Fisher RB, Ferguson-Smith MA, Lin CC:人类着丝粒dna。哼麝猫1997年,100:291 - 304。10.1007 / s004390050508
Verma RS, Luke S:在间期FISH技术中,阿尔法体DNA序列的变异逃避了非整倍体的检测。基因组学1992年,14:113 - 116。10.1016 / s0888 - 7543 (05) 80291 - 5
李建军,李建军,李建军,李建军。用fish技术研究22号染色体的着丝体阿尔法体DNA异型性。中国麝猫1998年,53:231 - 232。
刘建军,刘建军,刘建军,刘建军,刘建军;克赖斯特彻奇(Ch1) 21号染色体两例新病例:21p-从头缺失的临床后果的证据。Tsitol麝猫2002年,36(1): 46-49。
辛克莱PB,格林AR,格雷斯C,纳切瓦EP:荧光原位杂交系统提高了BCR-ABL检测的灵敏度:三探针三色。血1997年,90:1395 - 1402。
米特尔曼F,约翰森B,马丁斯F;易位和基因融合对癌症成因的影响。Nat Rev2007年,7:233 - 245。10.1038 / nrc2091
Virgili A, Brazma D, Reid AG, Howard-Reeves J, Valgañón M, Chanalaris A, De Melo VAS, Marin D, Apperley JF, Grace C, Nacheva EP:费城负的FISH映射BCR / ABL1积极的CML。摩尔Cytogenet2008年,1:14.10.1186 / 1755-8166-1-14
Kucheria K, Jobanputra V, Talwar R, Ahmad ME, Dada R, Sivakumaran TA:人类分子细胞遗传学:诊断、预后和疾病管理。致畸致癌物,诱变剂供应1:225 - 233。
Halder A, Jain M, Kabra M, Gupta N:Mosaic 22q11.2微缺失综合征2例诊断及临床表现摩尔Cytogenet2008年,1:18.10.1186 / 1755-8166-1-18
Portnoi MF:微重复22q11.2:一种新的染色体综合征。Eur J Med Genet2009年,52:88 - 93。10.1016 / j.ejmg.2009.02.008
Walter J, Joffe B, Bolzer A, Albiez H, Benedetti PA, Muller S, Speicher MR, Cremer T, Cremer M, Solovei I:在3d保存的间期细胞核上,FISH显示了许多颜色。细胞基因基因组研究2006年,114:367 - 378。10.1159 / 000094227
克鲁格C,奥斯本CS:揭开染色体间相互作用的帷幕。趋势麝猫2006年,22:637 - 639。10.1016 / j.tig.2006.09.008
约洛夫IY,沃萨诺娃SG,尤洛夫YB:原位杂交信号的荧光强度谱描绘了人类间期细胞核内的基因组结构。Tsitol麝猫2008年,42(5): 3 - 8。
Speel EJM, Herbergs J, Ramaekers FCS, Hopman AHN:结合免疫细胞化学和荧光原位杂交,同时检测肿瘤细胞的细胞周期、基因组和表型参数。细胞化学1994年,42:961 - 966。
马扎伊斯B,沃萨诺娃SG,罗伊斯G,尤洛夫YB:人类21号染色体中阿尔法体DNA变异和着丝粒大小的分析:反对阿尔法体卫星DNA减少病理意义的证据。Tsitol麝猫1999年,33(1): 25-31。
Dundas SR, Boyle S, Bellamy CO, Hawkins W, Garden OJ, Ross JA, Bickmore W:档案人肝移植活组织双y染色体染色及免疫荧光染色。细胞化学2001年,49:1321 - 1322。
杨峰,邵c, Vedanarayanan V, Ehrlich M:与面肩肱肌营养不良相关的4q亚端粒区域的细胞遗传学和免疫- fish分析。Chromosoma2004年,112:350 - 359。10.1007 / s00412 - 004 - 0280 - x
Zinner R, Teller K, Versteeg R, Cremer T, Cremer M:生物化学符合核结构:多色免疫- fish用于染色体片段和不同组蛋白甲基化差异表达基因位点的共定位分析。Adv酶调节2007年,47:223 - 241。10.1016 / j.advenzreg.2007.01.005
Meaburn KJ, Gudla PR, Khan S, Lockett SJ, Misteli T:乳腺癌中疾病特异性基因重新定位。J细胞生物学2009年,187:801 - 812。10.1083 / jcb.200909127
Steinhaeuser U, Starke H, nietzsche A, Lindenau J, Ullmann P, Claussen U, Liehr T:悬浮(S)-FISH,间期核的新技术。细胞化学2002年,50:1697 - 1698。
张峰,顾伟,Hurles ME, Lupski JR:人类健康、疾病和进化中的拷贝数变异。年Rev基因组学2009年,10:451 - 81。10.1146 / annurev.genom.9.081307.164217
Iourov IY, Yurov YB, Vorsanova SG:镶嵌X染色体非整倍性可以帮助解释自闭症的男女比例。地中海的假设2008年,70:456.10.1016 / j.mehy.2007.05.037
沃萨诺娃SG,尤洛夫YB,约洛夫IY:母亲吸烟与自然流产中花叶性非整倍体的关系。地中海的假设2008年,71:607.10.1016 / j.mehy.2008.05.027
约洛夫IY,沃萨诺娃SG,尤洛夫YB:发育染色体不稳定是儿童脑癌的可能原因。地中海的假设2009年,72:615 - 616。10.1016 / j.mehy.2008.12.003
Yurov YB, Iourov IY, Vorsanova SG:染色体不稳定性介导的神经退行性变提示共济失调-毛细血管扩张症治疗发展策略的改变。地中海的假设2009年,73:1075 - 1076。10.1016 / j.mehy.2009.07.030
Yurov YB, Vorsanova SG, Iourov y:脑老化的GIN'n' in假说:解读个体发育过程中体细胞遗传不稳定性和神经非整倍体的作用。摩尔Cytogenet2009年,2:23.10.1186 / 1755-8166-2-23
Hulten MA, Patel SD, Tankimanova M, Westgren M, Papadogiannakis N, Johnson AM, Iwarsson E:关于21三体唐氏综合症的起源。摩尔Cytogenet2008年,1:21.10.1186 / 1755-8166-1-21
古登巴赫M, Koschorz B, Bernthaler U,格林T, Schmid M:性染色体丢失与衰老:人类间期细胞核的原位杂交研究。我是热内吗1995年,57:1143 - 1150。
Geigl JB, Langer S, Barwisch S, Pfleghaar K, Lederer G, Speicher MR:与衰老相关的基因表达模式和染色体变化分析。癌症Res2004年,64:8850 - 8557。0008 - 5472. - 10.1158 / - 04 - 2151
张建军,李建军,张建军,张建军,张建军,张建军。在肝细胞癌去分化过程中增加染色体不稳定性诱导非整倍体。美国国家科学促进会2004年,101:1309 - 1314。10.1073 / pnas.0305817101
Weise A, Gross M, Mrasek K, Mkrtchyan H, Horsthemke B, Jonsrud C, Von Eggeling F, Hinreiner S, Witthuhn V, Claussen U, Liehr T:亲本起源测定荧光原位杂交在单细胞水平上区分同源人类染色体。内科医学杂志2008年,21:189 - 200。
李海涛,齐格勒。间期核快速产前诊断:程序和截止率。细胞化学2005年,53:289 - 291。10.1369 / jhc.4B6394.2005
Nicholson JM, Duesberg P;癌细胞的核型起源和进化。癌症基因细胞基因2009年,194:96 - 110。10.1016 / j.cancergencyto.2009.06.008
carira IM, Mascarenhas A, Matoso E, Couceiro AB, Ramos L, Dufke A, Mazauric M, Stressig R, Kosyakova N, Melo JB, Liehr T:三个不寻常但细胞遗传学相似的病例,有多达五种不同的细胞系,涉及18号染色体的结构和数字异常。细胞化学2007年,55岁:1123 - 1128。10.1369 / jhc.7A7244.2007
刘建军,刘建军,刘建军,刘建军,刘建军,刘建军,刘建军。动态镶嵌现象表现为生长迟缓和外生殖器异常的男性儿童的等心Y染色体的丢失、获得和重排。细胞基因基因组研究2008年,121:302 - 306。10.1159 / 000138903
致谢
本文谨献给Ilya V Soloviev博士。Thomas Liehr博士(德国耶拿)因我们富有成效的合作而得到认可,使我们能够介绍ICS-MCB的例子(图1)5)。作者得到DLR/BMBF (RUS 09/006)和Philip Morris USA, Inc.的支持。
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
SGV, YBY和IYI撰写了手稿。所有作者都阅读并批准了最终的手稿。
权利和权限
开放获取本文由BioMed Central Ltd.授权发表。这是一篇开放获取的文章,在知识共享署名许可(https://creativecommons.org/licenses/by/2.0),允许在任何媒体上不受限制地使用、分发和复制,前提是正确引用原创作品。
关于本文
引用本文
杨建军,杨建军,刘建军,等。人类间期染色体的分子细胞遗传学研究进展。摩尔Cytogenet3., 1(2010)。https://doi.org/10.1186/1755-8166-3-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1755-8166-3-1
关键字
- 比较基因组杂交
- 胚胎植入前遗传学诊断
- 肽核酸
- 间期核
- 肽核酸探针


评论
查看存档的评论(1)