- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
下丘脑FGF11的沉默可以防止饮食引起的肥胖gydF4y2Ba
分子的大脑gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba,文章号:gydF4y2Ba75gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
成纤维细胞生长因子11 (FGF11)是细胞内成纤维细胞生长因子家族的一员。在这里,我们报道了FGF11在代谢调节中的核心作用。慢病毒注射gydF4y2BaFgf11gydF4y2Ba进入小鼠下丘脑弓状核的shRNA减少了体重增加和脂肪量,增加了棕色脂肪组织产热,并改善了高脂肪饮食条件下的葡萄糖和胰岛素不耐受。gydF4y2BaFgf11gydF4y2Ba在表达npy的神经元中表达,而gydF4y2BaFgf11gydF4y2Ba击倒率显著降低gydF4y2BaNpygydF4y2Ba表达和投射,导致室旁核酪氨酸羟化酶表达增加。机械地,FGF11调节gydF4y2BaNpygydF4y2Ba通过糖原合成酶激酶3-cAMP反应元件结合蛋白途径表达。我们的研究确定了下丘脑FGF11在代谢调节中的生理意义,以应对营养过剩,如高脂肪饮食。gydF4y2Ba
简介gydF4y2Ba
由于能量摄入与消耗不平衡而引致的肥胖及超重,在过去几十年已大幅增加[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].成纤维细胞生长因子家族由22个成员组成,根据其作用机制可分为细胞内生长因子(iFGFs)、典型旁分泌和自分泌生长因子以及内分泌生长因子[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].虽然规范的和内分泌的FGF通过FGF受体(FGFRs)分泌进入循环,但fgff如FGF11-FGF14独立于FGFRs起作用[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba].越来越多的证据表明,一些FGFs在调节能量平衡(包括葡萄糖、脂质代谢和食物摄入)方面起着关键作用,这表明FGFs是治疗肥胖的治疗靶点[gydF4y2Ba4gydF4y2Ba].中枢给药内分泌FGF亚家族FGF19可降低神经元共表达神经肽Y (NPY)和刺鼠相关肽(NPY/AgRP)的神经元活性,从而改善高脂饮食小鼠的糖代谢并降低体重[gydF4y2Ba7gydF4y2Ba].单次脑室内注射FGF19可提高葡萄糖处理率,改善葡萄糖耐量gydF4y2Baob / obgydF4y2Ba小鼠缺乏负责产生瘦素的基因而变得严重肥胖[gydF4y2Ba8gydF4y2Ba].脂肪细胞特异性FGF21是内分泌FGF亚家族,敲除小鼠在适应性产热过程中表现出对白色脂肪组织褐变的抑制,肥胖大鼠中央输注FGF21增加胰岛素诱导的肝脏葡萄糖生成和糖异生表达的抑制,从而增加能量消耗和胰岛素敏感性。[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].FGF1基因敲除小鼠在高热量膳食喂养后表现出异常的脂肪组织扩张和严重的糖尿病表型,野生型小鼠中央给药FGF1抑制食物摄入并抑制含有fgfr1的葡萄糖敏感神经元[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]gydF4y2Ba
最近,有报道称FGF11与HIF-1α相互作用诱导缺氧[gydF4y2Ba13gydF4y2Ba),而gydF4y2BaFgf11gydF4y2Ba敲低降低过氧化物酶体增殖物激活受体γ的表达,从而抑制脂肪生成[gydF4y2Ba14gydF4y2Ba].然而,FGF11的功能,特别是其在调节全身代谢中的核心作用,仍然未知。gydF4y2Ba
下丘脑是大脑中最重要的区域之一,控制新陈代谢,包括食物摄入、葡萄糖和能量代谢[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba].位于下丘脑弓状核(ARC)的两个主要神经元群在调节代谢中起着重要作用:(i)促食性NPY/AgRP共表达神经元,促进合成代谢[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba],以及(ii)共同表达前阿皮黑色素皮质素(POMC)和可卡因和安非他明调控转录本(CART)的厌食症神经元,诱导分解代谢[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].这些神经元整合外周信号,传递给室旁核(PVN)的二级神经元,并将多个信号传递到其作用区域,如孤束核、迷走神经背侧运动核、后脑腹外侧髓质,从而在能量代谢的调节中发挥不可或缺的作用[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].大量研究表明,NPY/AgRP共表达神经元对代谢功能至关重要,包括食物摄入、能量消耗和产热[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
在这里,我们发现了中心的作用gydF4y2BaFgf11gydF4y2Ba降低涉及全身代谢的多个参数。本研究有助于我们理解FGF11在ARC中的代谢作用,强调FGF11是治疗肥胖的潜在靶点。gydF4y2Ba
材料与方法gydF4y2Ba
动物模型gydF4y2Ba
雄性C57BL/6小鼠从Koatech购买,并将(每笼一只)置于单独通风的笼子中,在一个温度和湿度可控的房间中进行12小时的光/暗循环(从7:00到19:00亮灯),自由取水和正常饮食(NCD) (LabDiet, Inc., 38057)或HFD (60% kcal来自脂肪;Research diet, Inc., D12492)。如前所述,在黑暗周期开始之前,每天观察食物摄入量和体重[gydF4y2Ba29gydF4y2Ba].将小鼠分为以下各组:对照组shRNA注射C57BL/6小鼠组(shCon);上海gydF4y2BaFgf11 -gydF4y2Ba表达shRNA注射C57BL/6小鼠组(shgydF4y2BaFgf11gydF4y2Ba).gydF4y2Ba
产生慢病毒gydF4y2Ba
lentii - x 293 T细胞(Clontech, 632180)接种于100 mm培养皿上,转染psPAX2包装质粒(6 μg)、pMD2。Genvelope plasmid (2 μg), and GPIZ constructs (8 μg, green fluorescent protein (GFP), carrying either control (Dharmacon, RHS4346) orFgf11gydF4y2Ba-使用TurboFect (Thermo Scientific, R0531),按照制造商的说明进行定向shRNA。为了防止脱靶效应,两种不同的shRNA质粒同时针对A和B亚型gydF4y2BaFgf11gydF4y2Ba(Dharmacon, VGM5520-200406248和VGM5520-200407071)通过对6种不同的shRNA质粒进行小鼠测试后选择gydF4y2BaFgf11gydF4y2Ba.如前所述,收集含有慢病毒的培养基,并通过0.45 μm注射器过滤器(Millipore, SLHV033RS)过滤[gydF4y2Ba29gydF4y2Ba].为了获得浓缩的病毒,在相同的超清离心管(Beckman, 344058)中以43,000 ×进行连续4轮超离心gydF4y2BaggydF4y2Ba在4°C下放置120分钟[gydF4y2Ba30.gydF4y2Ba].最后离心后,微丸在生理盐水中轻轻重悬。用流式细胞术测定慢病毒原液滴度[gydF4y2Ba31gydF4y2Ba];对照病毒为6.76 × 10gydF4y2Ba10gydF4y2Ba和sh的gydF4y2BaFgf11gydF4y2Ba表达慢病毒为6.62 × 10gydF4y2Ba10gydF4y2Ba国际单位/毫升。将浓缩的病毒进行混合,并在−80°C保存。gydF4y2Ba
立体定位手术gydF4y2Ba
7周龄C57BL/6小鼠驯化一周,术前25分钟以体重为单位10ml /kg的Zoletil、Rumpun和生理盐水混合麻醉。慢病毒注射速度为0.5 μ l/min (1.32 × 10gydF4y2Ba8gydF4y2BaIU/2 μl(每侧2 μl),使用微升注射器(Hamilton, 7768),使用以下坐标:布雷玛后方1.4 mm;腹部6.2毫米;0.35毫米双侧瞄准弧线[gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
胰岛素耐量试验(ITT)和葡萄糖耐量试验(GTT)gydF4y2Ba
注射病毒4周后进行ITT,注射病毒5周后进行GTT。小鼠习惯于在每次耐受试验前3天每天腹腔注射等渗生理盐水。所有程序于10:00开始,并参照一般程序进行[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].对于ITT, 6只空腹小鼠注射1.0 U胰岛素/kg (Sigma, Cat#I9278),并在指定时间从尾静脉采血,使用葡萄糖监测仪(Roche, Accu-Chek Active meter)测量血糖。GTT采用16只禁食h的小鼠,通过i.p.注射1.5 g/kg葡萄糖(Sigma, Cat#G8270)进行,血糖评估与ITT相同。gydF4y2Ba
棕色脂肪组织(BAT)温度测定gydF4y2Ba
为了评估BAT的产热作用,使用了红外摄像机(FLIR E60, FLIR系统公司),红内分辨率为320 × 240像素。为了排除压力引起的产热,老鼠被忽略了一个小时,同时可以自由活动。每轮测量每只小鼠的BAT温度至少3次,并使用5轮每轮的平均温度进行分析。gydF4y2Ba
测定产热,OgydF4y2Ba2gydF4y2Ba消费(签证官gydF4y2Ba2gydF4y2Ba)有限公司gydF4y2Ba2gydF4y2Ba生产(VCOgydF4y2Ba2gydF4y2Ba)、呼吸交换率(RER)和总运动能力gydF4y2Ba
ARC后两周gydF4y2BaFgf11gydF4y2Ba使用综合实验动物监测系统(CLAMS)的代谢室进行间接量热;哥伦布仪器)。小鼠被单独安置,在代谢室中自由获得水和高热量食物。驯化后,产生热量,VOgydF4y2Ba2gydF4y2Ba, VCOgydF4y2Ba2gydF4y2Ba使用Oxymax系统(哥伦布仪器公司)测量,RER和运动能力。签证官gydF4y2Ba2gydF4y2Ba, VCOgydF4y2Ba2gydF4y2Ba, 24 h内每12 min评估一次产热量,并归一化至体重;RER以VCO计算gydF4y2Ba2gydF4y2Ba/签证官gydF4y2Ba2gydF4y2Ba.通过测量红外光束的中断(X束和z束的总中断)来确定移动活动。gydF4y2Ba
原位杂交gydF4y2Ba
原位杂交同时检测gydF4y2BaFgf11gydF4y2Ba而且gydF4y2BaNpygydF4y2Ba在ARC中使用RNAscope荧光多路试剂盒(Advanced Cell Diagnostics;ACD)。3只小鼠的大脑被解剖,并迅速嵌入FSC 22冷冻切片介质(Lecia, 3801480)并在干冰上冷冻。新鲜冷冻冠状切片(20 μm)在低温恒温器(Lecia, CM3050S)上切割,双标记mRNAgydF4y2BaFgf11gydF4y2Ba(ACD, 701)和gydF4y2BaNpygydF4y2Ba(ACD, 313321-C2)遵循制造商的协议。的gydF4y2BaFgf11gydF4y2Ba反义探针定位于小鼠的888-1891区域gydF4y2BaFgf11gydF4y2Ba转录本变体1 (NM_010198.3),但与所有其他转录本变体(NM_001291104.2, NM_001362623.1, NM_001362624.1)具有交叉反应。的gydF4y2BaFgf11gydF4y2Ba阴性对照使用sense探针(ACD, 843141),阴性对照探针(ACD, 320751)识别dihydrodipicolinate reductase, DapB(一种细菌转录本),并与目标探针并行使用。荧光原位杂交图像使用最大信号分离的LSM 780或LSM 800共聚焦激光扫描显微镜(Carl Zeiss)拍摄。gydF4y2Ba
免疫组织化学gydF4y2Ba
脑组织的处理、包埋、冷冻切片和免疫荧光染色如前所述[gydF4y2Ba34gydF4y2Ba].一抗羊抗npy (1:1000;Abcam, ab6173)和小鼠抗th (1:1000;免疫之星,22941)- 1:1000。使用以下二抗(均为1:500):cy3偶联驴抗羊IgG (1:500;Jackson ImmunoResearch, 713-165-147)和AlexaFluor 488偶联抗小鼠IgG (1:500;杰克逊免疫研究所,715-545-150)。切片在室温下用1 μg/mL Hoechst 33342 (Invitrogen, H3570)在磷酸盐缓冲盐水中孵育5分钟,进行核染色,装在载玻片上,用vectasshield安装介质覆盖(Vector Laboratories, H-1000)。每只小鼠(总共至少3只)3 - 5个ARC或PVN切片使用最大信号分离的LSM 780或LSM 800进行分析。gydF4y2Ba
免疫荧光强度测量gydF4y2Ba
对图像采集和处理强度进行标准化设置,以相对定量NPY和TH荧光。为了获得ARC和PVN中NPY免疫荧光强度的值,在图像上绘制每个区域的形态边界。对于TH神经元的TH免疫荧光强度,用相应的灰度TH免疫荧光图像绘制细胞类型特异性轮廓。使用Image J软件(美国国立卫生研究院)进行单次荧光强度测量。每个小鼠下丘脑区域的NPY荧光强度均来自六个独立测量值。每个TH神经元的TH荧光强度从四个独立的测量中平均。用从0到3的任意单位绘制NPY和TH的荧光强度。计数与TH阳性神经元相邻1.5 μ m内的npy阳性轴突末梢,计数npy阳性钮扣数。gydF4y2Ba
RT-PCR定量分析mRNA表达gydF4y2Ba
使用Trizol试剂(Invitrogen, 15596018)从细胞和组织中分离总RNA。将RNA颗粒溶解在无核酸酶的水中(Promega, P1193),使用NanoDrop分光光度计(DeNovix, DS-11)测定总RNA浓度。总RNA,反应缓冲区,和GoScript逆转录酶(Promega A5004)涨跌互现总量的20μl和逆转录进行了热循环(Bio-Rad C1000)在25°C 5分钟,42°C 60分钟,15分钟70°C。实时PCR进行SYBR绿色PCR设备(豆类生物技术、RR820A) qPCR机(Bio-Rad CFX96) 40周期(95°C 10年代,60°C 30年代)。以下引物被集成的DNA合成技术:gydF4y2Ba车gydF4y2Ba向前,5“-CGAGAAGAAGTACGGCCAAGTCC-3”;gydF4y2Ba车gydF4y2Ba相反,5“-GGAATATGGGAACCGAAGGTGG-3”;gydF4y2BaDio2gydF4y2Ba向前,5“-TGCCACCTTCTTGACTTT-3”;gydF4y2BaDio2gydF4y2Ba相反,5“-GTTTCCGGTGCTTCTTAACC-3”;gydF4y2BaFgf11gydF4y2Ba向前,5“-TCGTCACCAAACTGTTCTGC-3”;gydF4y2BaFgf11gydF4y2Ba相反,5“-GCCATGTAGTGACCCAGCTT-3”;gydF4y2BaGapdhgydF4y2Ba向前,5“-ATCACTGCCACCCAGAAGAC-3”;gydF4y2BaGapdhgydF4y2Ba相反,5“-ACACATTGGGGGTAGGAACA-3”;gydF4y2BaNpygydF4y2Ba向前,5“-CAGAAAACGCCCCCAGAA-3”;gydF4y2BaNpygydF4y2Ba反向,5 ' -AAAAGTCGGGAGAACAAGTTTCATT -3 ';gydF4y2BaPgc1αgydF4y2Ba向前,5“-AGCCGTGACCACTGACAACGAG-3”;gydF4y2BaPgc1αgydF4y2Ba相反,5“-GCTGCATGGTTCTGAGTGCTAAG-3”;gydF4y2BaPomcgydF4y2Ba向前,5“-GAACAGCCCCTGACTGAAAA-3”;gydF4y2BaPomcgydF4y2Ba相反,5“-ACGTGGGGGTACACCTTCAC-3”;gydF4y2BaPrdm16gydF4y2Ba向前,5“-CCGCTGTGATGAGTGTGATG-3”;gydF4y2BaPrdm16gydF4y2Ba相反,5‘-GGACGATCATGTGTTGCTCC-3’。用delta-delta Ct法分析各靶基因相对mRNA表达量,归一化至gydF4y2BaGapdhgydF4y2Ba.gydF4y2Ba
抗体和化学试剂gydF4y2Ba
目的蛋白用以下抗体进行免疫印迹:phospho-AKT (Ser473;细胞信号传导技术[CST], 4060), AKT (CST, 9272), β-catenin活性(CST, 8814), β-catenin (CST, 9582), phospho-CAMKII (Thr286;CST, 12716), CAMKII (CST, 3362), phospho-CREB (Ser133;CST, 9198),磷酸化creb (Ser129;MyBioSource, MBS9406211), CREB (CST, 9197), phospho-ERK (Thr202/Thr204, 4370), ERK (CST, 9107), phospho-FOXO1 (Ser256;CST, 9461), FOXO (CST, 2880), GAPDH (CST, 2118),磷酸化gsk α和β (Tyr279和Tyr216;BD Biosciences, 612313),磷酸化gsk α和β (Ser21和Ser9;CST, 8566), GSKα和β (CST, 5676), HA-tag (CST, 3724), phospho-STAT3 (Tyr705;CST, 9145)和STAT3 (CST, 12640)。当有指示时,用2-脱氧-d -葡萄糖(2DG; Sigma, D6134) to induce glucoprivation; 2DG was dissolved in DPBS (Corning, 21-031-CVR) or saline. 6-Bromoindirubin-3'-oxime (BIO; Sigma, B1686) was dissolved in dimethyl sulfoxide (Sigma, M81802).
西方墨点法gydF4y2Ba
细胞在50 mM Tris-HCl, pH 7.4, 250 mM蔗糖(Bioshop, SUC507), 5 mM焦磷酸钠,1 mM EDTA, 1 mM EGTA, 1% Triton X-100 (Sigma, T8787), 0.1 mM苯甲脒(Sigma, B6506), 1 mM DTT, 0.5 mM PMSF (Sigma, P7626), 50 mM NaF,蛋白酶抑制剂鸡尾酒(Calbiochem, 535,140)和磷酸酶抑制剂鸡尾酒(Sigma, P5726)中裂解。裂解物在sds -聚丙烯酰胺凝胶中溶解,并在PVDF膜(Millipore, IPVH00010)上在转移缓冲液(25 mM Tris碱,pH 7.4, 192 mM甘氨酸,10%甲醇)中在20 V下吸附35分钟。用5%脱脂牛奶堵塞膜1小时,并与适当的一抗在室温或4℃下孵育1小时过夜。用TBST缓冲液(20 mM Tris [Bioshop, TRS001], 125 mM NaCl [Bioshop, SOD001], 0.1% Tween 20 [Sigma, P1379])洗涤3次后,每个膜用适当的酶标连接二抗(抗小鼠:CST, 7076S;抗兔:Thermo Scientific, NCI1460KR),并用ECL溶液(Thermo Scientific, NCI4080KR;Advansta, K-12045-D50)根据制造商的说明。使用ImageJ软件测量和量化带强度。gydF4y2Ba
细胞系gydF4y2Ba
胚胎小鼠下丘脑mHypoE-N41 (N41;Cellutions Biosystems Inc., CLU121)和mHypoE-N43/5 (N43/5;Cellutions Biosystems Inc., CLU127)细胞系保存在DMEM (Sigma, D5796)中,加入10%胎牛血清(Hyclone Laboratories Inc., SH30919.03)和1%青霉素/链霉素(Hyclone Laboratories Inc., SV30010), 37°C。gydF4y2Ba
2DG和0-mM葡萄糖处理gydF4y2Ba
分别将2DG添加到25-mM葡萄糖DMEM (Welgene, LM001-07)或0-mM葡萄糖DMEM (Welgene, LM001-56)中进行糖纯化(2DG)或葡萄糖剥夺(无葡萄糖)。lentii - x 293T (Clontech, 632180)细胞保存在DMEM (Hyclone Laboratories Inc., SH30243)中,条件与下丘脑细胞株相同。gydF4y2Ba
核转染gydF4y2Ba
将N41和N43/5细胞接种于6孔板,用ON-TARGETplus小鼠打乱或转染gydF4y2BaFgf11gydF4y2BasiRNA由4种不同的siRNA组成。打乱的siRNAs (100 nM;Dharmacon, d - 001810-10-05)或gydF4y2BaFgf11gydF4y2BasiRNAs (100 nM;按照制造商的说明,使用Lipofectamine 3000转染Dharmacon, L-045551-01-0010) 48小时。gydF4y2Ba
统计分析gydF4y2Ba
所有数据均以均数±均数标准误差(SEM)报告。统计学意义由双侧检验gydF4y2Bat -gydF4y2Ba检验或双向方差分析(ANOVA),然后使用GraphPad Prism 8进行Tukey多重比较检验;gydF4y2BapgydF4y2Ba值< 0.05为有统计学意义。gydF4y2Ba
结果gydF4y2Ba
下丘脑弧gydF4y2BaFgf11gydF4y2Ba抑制肥胖gydF4y2Ba
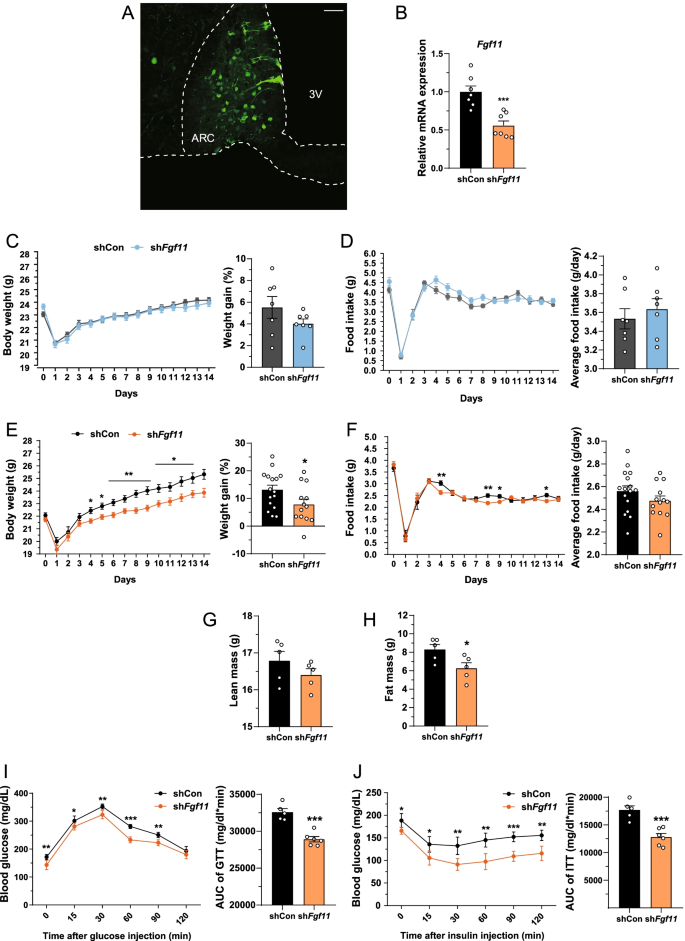
的中心表达gydF4y2BaFgf11gydF4y2Ba,我们进行了测试gydF4y2BaFgf11gydF4y2BamRNA在多个大脑区域的表达,并发现它在下丘脑,海马体,皮层和小脑表达(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。考虑到下丘脑ARC是控制新陈代谢的关键大脑区域[gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba],我们监测注射sh后的各种代谢参数gydF4y2BaFgf11gydF4y2Ba携带和表达gfp的慢病毒进入ARC免疫组化证实ARC慢病毒成功靶向(图。gydF4y2Ba1gydF4y2Ba)弧。gydF4y2BaFgf11gydF4y2BaARC的显著降低证实了敲除gydF4y2BaFgf11gydF4y2BamRNA水平与非沉默shRNA对照的比较(图。gydF4y2Ba1gydF4y2BaB)。弧gydF4y2BaFgf11gydF4y2Ba敲除对非传染性疾病喂养小鼠的体重或摄食量没有影响(图2)。gydF4y2Ba1gydF4y2BaC, D)。然而,ARC显著降低了hfd喂养小鼠的体重增加gydF4y2BaFgf11gydF4y2Ba从慢病毒注射后4天开始敲除(图。gydF4y2Ba1gydF4y2BaE). ARC的食物摄入量gydF4y2BaFgf11gydF4y2Ba在敲除小鼠后,喂食HFD的小鼠体内也出现了短暂的下降(图。gydF4y2Ba1gydF4y2BaF). HFD没有变化gydF4y2BaFgf11gydF4y2BamRNA表达水平直到12周,但在HFD 16周时升高(附加文件)gydF4y2Ba1gydF4y2Ba:图S2)。而稀薄的ARC质量gydF4y2BaFgf11gydF4y2Ba喂食高热量食物的敲除小鼠保持不变,脂肪量大幅减少(图。gydF4y2Ba1gydF4y2BaG, H).在GTT和ITT中,ARCgydF4y2BaFgf11gydF4y2Ba与对照组相比,饲喂HFD的敲除小鼠显示出更高的葡萄糖清除率和胰岛素敏感性,表明ARCgydF4y2BaFgf11gydF4y2Ba在HFD条件下,敲低改善了整体的系统葡萄糖稳态(图。gydF4y2Ba1gydF4y2BaI, J).总之,这些结果表明ARCgydF4y2BaFgf11gydF4y2BaKnockdown可以预防肥胖,包括超重、脂肪增加和葡萄糖代谢的衰减。gydF4y2Ba
Fgf11gydF4y2Ba在ARC中的敲除可以降低体重和脂肪量,并改善hfd喂养小鼠的葡萄糖代谢。成年雄性C57/BL6小鼠双侧注射表达sh的慢病毒后喂HFD 14 dgydF4y2BaFgf11gydF4y2Ba和绿色荧光蛋白进入ARC。gydF4y2Ba一个gydF4y2BaARC冠状切面。GFP提示慢病毒感染。gydF4y2BaBgydF4y2BamRNA表达gydF4y2BaFgf11gydF4y2Ba在微解剖ARC样品中注入shgydF4y2BaFgf11gydF4y2Ba表达慢病毒。gydF4y2BaCgydF4y2Ba实验期间非传染性疾病喂养小鼠的体重和增重情况。gydF4y2BaDgydF4y2Ba非传染性疾病喂养小鼠的食物摄入量和平均食物摄入量。gydF4y2BaEgydF4y2Ba实验期间hfd喂养小鼠的体重和增重情况。gydF4y2BaFgydF4y2Bahfd喂养小鼠的食物摄入量和平均食物摄入量。gydF4y2BaGgydF4y2Ba瘦质量和gydF4y2BaHgydF4y2Ba脂肪量。gydF4y2Ba我gydF4y2Ba葡萄糖耐量试验(GTT)和gydF4y2BaJgydF4y2Ba慢病毒注射后胰岛素耐量试验。数据为均值±SEM;双尾gydF4y2BatgydF4y2Ba-test用于统计分析。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01和***gydF4y2BapgydF4y2Ba< 0.001(非沉默shRNA对照与shgydF4y2BaFgf11gydF4y2Ba).N = 5-16只/组gydF4y2Ba
弧gydF4y2BaFgf11gydF4y2Ba敲低能增强hfd喂养小鼠的BAT产热作用gydF4y2Ba
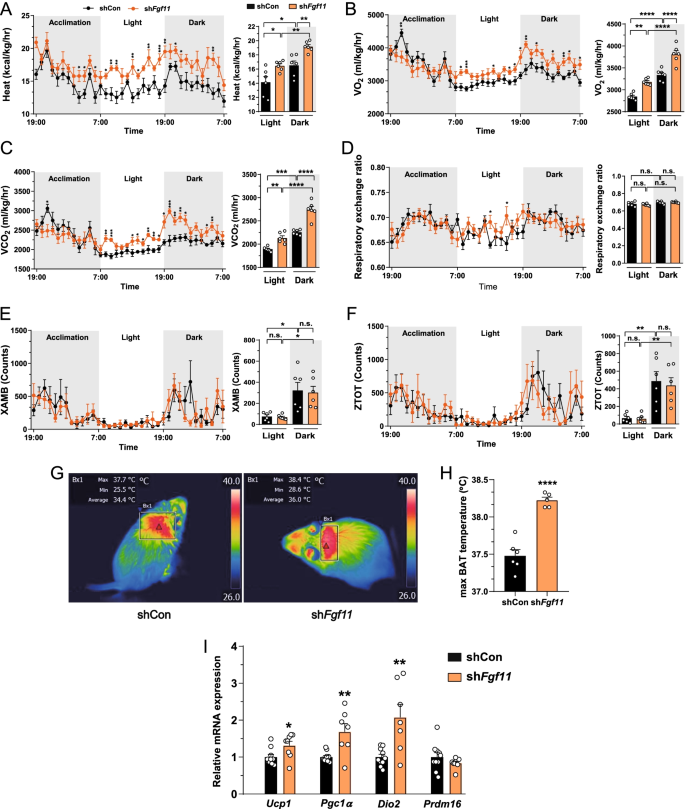
评价ARC治疗效果gydF4y2BaFgf11gydF4y2Ba降低能量消耗,我们分析了不同的代谢参数,包括热量产生,OgydF4y2Ba2gydF4y2Ba消费(签证官gydF4y2Ba2gydF4y2Ba)有限公司gydF4y2Ba2gydF4y2Ba生产(VCOgydF4y2Ba2gydF4y2Ba),呼吸交换比(RER),和运动活动使用间接代谢量热法。弧gydF4y2BaFgf11gydF4y2Ba敲低hfd喂养的小鼠会增加热生成,VOgydF4y2Ba2gydF4y2Ba、VCOgydF4y2Ba2gydF4y2Ba与对照组小鼠在光照和暗期比较(图;gydF4y2Ba2gydF4y2Baa - c)。弧gydF4y2BaFgf11gydF4y2Ba敲低不影响RER或运动活动(图。gydF4y2Ba2gydF4y2BaD-F)。ARC不影响hfd喂养小鼠的运动能力gydF4y2BaFgf11gydF4y2Ba敲低,BAT产热作用的激活可能有助于增加热量的产生。果然,电弧的BAT温度gydF4y2BaFgf11gydF4y2Ba饲喂HFD的敲除小鼠的蛋白质水平明显高于对照组(图2)。gydF4y2Ba2gydF4y2BaG, H)。gydF4y2BaFgf11gydF4y2Ba敲除小鼠的产热基因mRNA表达增加,包括gydF4y2BaUcp1gydF4y2Ba,gydF4y2BaPgc1αgydF4y2Ba,gydF4y2BaDio2gydF4y2Ba与对照小鼠相比(图;gydF4y2Ba2gydF4y2BaI).综合来看,这些数据表明ARCgydF4y2BaFgf11gydF4y2Ba击倒增加热量产生,OgydF4y2Ba2gydF4y2Ba消费和COgydF4y2Ba2gydF4y2Ba并通过增加产热基因的表达来增加BAT活性。gydF4y2Ba
弧gydF4y2BaFgf11gydF4y2Ba击倒增加热量产生,VOgydF4y2Ba2gydF4y2Ba, VCOgydF4y2Ba2gydF4y2Ba和BAT产热作用,而不改变运动活动。成年雄性C57BL/6小鼠双侧注射sh后喂HFD 2周gydF4y2BaFgf11gydF4y2Ba-表达慢病毒进入ARCgydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaFgydF4y2Ba发热,VOgydF4y2Ba2gydF4y2Ba, VCOgydF4y2Ba2gydF4y2Ba, RER,总活性gydF4y2BazgydF4y2Ba-轴(ZTOT),在gydF4y2BaxgydF4y2Ba设在(XAMB)。gydF4y2BaGgydF4y2Ba- - - - - -gydF4y2BaHgydF4y2Ba术后第14天BAT温度及最高BAT温度红外图像。gydF4y2Ba我gydF4y2BaARC后第14天4种典型生热标记物的mRNA表达gydF4y2BaFgf11gydF4y2Ba敲除基因:Ucp1, Pgc1α, Dio2, Prdm16。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001,和****gydF4y2BapgydF4y2Ba< 0.0001(非沉默shRNA对照与shgydF4y2BaFgf11gydF4y2Ba).N = 5-10只/组gydF4y2Ba
由ARC引起的从ARC到PVN的NPY投影减少gydF4y2BaFgf11gydF4y2Ba敲低增加了hfd喂养小鼠PVN TH的表达gydF4y2Ba
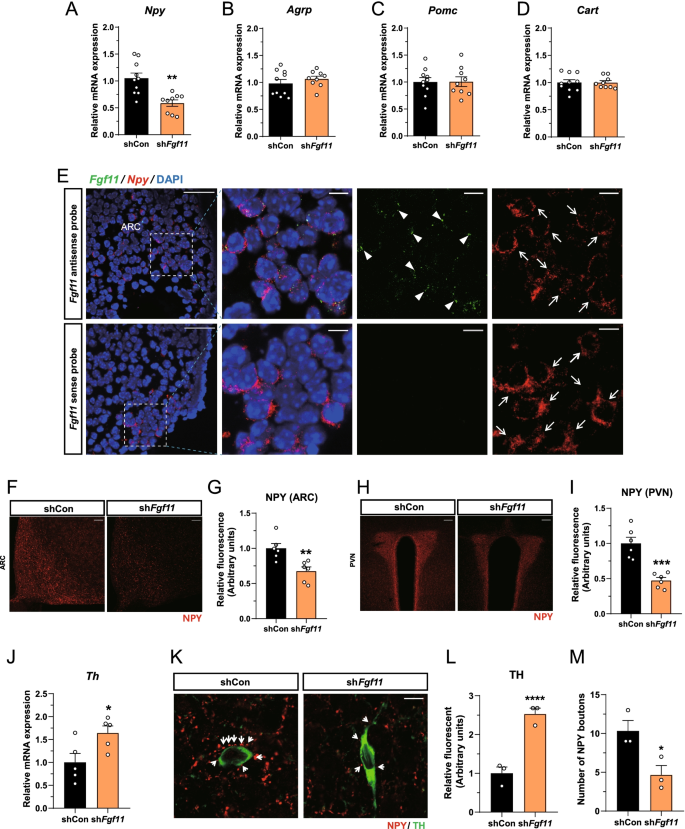
目的:阐明ARC中BAT生热作用增强的机制gydF4y2BaFgf11gydF4y2Ba我们研究了下丘脑神经肽NPY、AgRP、POMC和CART的变化,这些肽与能量消耗和产热有关[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].这些神经肽中,只有gydF4y2BaNpygydF4y2BamRNA表达显著降低gydF4y2BaFgf11gydF4y2Ba在hfd喂养的小鼠中敲除(图;gydF4y2Ba3.gydF4y2Ba模拟)。gydF4y2BaFgf11gydF4y2Ba非传染性疾病喂养小鼠的基因敲除也减少了gydF4y2BaNpygydF4y2BamRNA表达,而其他神经肽保持不变(附加文件gydF4y2Ba1gydF4y2Ba:图S3)。我们确定FGF11是否在表达npy的神经元中表达。原位杂交结果表明gydF4y2BaFgf11gydF4y2BamRNA分散在ARC中,所有gydF4y2BaNpygydF4y2Ba包含mrna阳性的神经元gydF4y2BaFgf11gydF4y2BamRNA,表明gydF4y2BaFgf11gydF4y2Ba在NPY神经元中表达(图;gydF4y2Ba3.gydF4y2BaE). NPY的免疫反应性在ARC和PVN中均降低gydF4y2BaFgf11gydF4y2Ba击倒小鼠(图gydF4y2Ba3.gydF4y2Ba.外:我)。由于ARC NPY过表达通过降低PVN中TH的表达来降低BAT的产热作用[gydF4y2Ba28gydF4y2Ba],我们假设ARCgydF4y2BaFgf11gydF4y2Baknockdown通过降低ARC NPY表达,诱导PVN TH表达激活BAT产热作用。PVNgydF4y2BaThgydF4y2BaARC组mRNA表达明显升高gydF4y2BaFgf11gydF4y2Ba在高热量饮食条件下,应激小鼠比对照组小鼠(图;gydF4y2Ba3.gydF4y2BaJ)。gydF4y2Ba
ARC中NPY表达降低gydF4y2BaFgf11gydF4y2Ba敲低降低了NPY投射到PVN,增加了hfd喂养小鼠PVN TH的表达。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaDgydF4y2BaARC后喂HFD 2周小鼠神经肽表达gydF4y2BaFgf11gydF4y2Ba可拆卸的。gydF4y2BaEgydF4y2BamRNA原位杂交的代表性共焦图像gydF4y2BaFgf11gydF4y2Ba而且gydF4y2BaNpygydF4y2Ba在ARC中进行相应的DAPI核反染色。的gydF4y2BaFgf11gydF4y2Ba感官探针作为阴性对照。箭头显示gydF4y2BaFgf11gydF4y2BamRNA-positive细胞。箭头表示gydF4y2BaNpygydF4y2BamRNA-positive细胞。比例尺= 20 μm。gydF4y2BaFgydF4y2Ba冠状剖面的ARC和gydF4y2BaGgydF4y2BaARC后喂高脂饲料2周小鼠的ARC相对免疫荧光定量gydF4y2BaFgf11gydF4y2Ba可拆卸的。gydF4y2BaHgydF4y2BaPVN冠状切面和gydF4y2Ba我gydF4y2BaARC后喂HFD 2周小鼠PVN的相对免疫荧光定量gydF4y2BaFgf11gydF4y2Ba可拆卸的。切片进行NPY免疫染色;非沉默shRNA对照和sh的共聚焦显微镜采集设置相同gydF4y2BaFgf11gydF4y2Ba.规模的酒吧gydF4y2BaFgydF4y2Ba50μm,gydF4y2BaHgydF4y2Ba100μm。gydF4y2BaJgydF4y2BaThgydF4y2BaARC的PVN显微解剖样本中mRNA的表达gydF4y2BaFgf11gydF4y2Ba敲除小鼠喂HFD 2周。gydF4y2BaKgydF4y2Ba在注射非沉默shRNA对照或2周后,PVN中NPY和TH的代表性共聚焦双免疫染色图像gydF4y2BaFgf11gydF4y2BashRNA进入ARC和gydF4y2BalgydF4y2BaTH的相对免疫荧光定量。箭头表示npy免疫反应钮扣。比例尺= 5 μm。gydF4y2Ba米gydF4y2Ba与TH神经元相邻的npy阳性轴突末梢数目。*gydF4y2BapgydF4y2Ba< 0.05和**gydF4y2BapgydF4y2Ba< 0.01(非沉默shRNA对照与shgydF4y2BaFgf11gydF4y2Ba).N = 3-10只/组gydF4y2Ba
接下来,调查PVN是否增加gydF4y2BaThgydF4y2BamRNA表达是ARC导致NPY表达降低的直接后果gydF4y2BaFgf11gydF4y2Ba我们通过免疫组化鉴定PVN TH神经元是否受ARC NPY神经元支配,以及是否受ARC NPY表达的影响。NPY和TH的双重免疫染色显示,喂养NCD小鼠的PVN TH阳性神经元在其躯体和树突中与NPY免疫反应的钮突接触(附加文件)gydF4y2Ba1gydF4y2Ba:图S4),表明PVN TH神经元受ARC NPY神经元支配。PVN中th阳性细胞体的免疫反应性增强gydF4y2BaFgf11gydF4y2Ba而与PVN th阳性神经元相邻的npy阳性轴突末梢的数量和免疫反应性降低gydF4y2BaFgf11gydF4y2Ba击倒(无花果。gydF4y2Ba3.gydF4y2Bakm)。这些数据证明了ARCgydF4y2BaFgf11gydF4y2Ba敲低降低了ARC NPY的表达,从而上调了PVN TH的表达,从而增加了BAT的产热性。gydF4y2Ba
FGF11调节gydF4y2BaNpygydF4y2Ba表达npy的下丘脑细胞的基因表达gydF4y2Ba
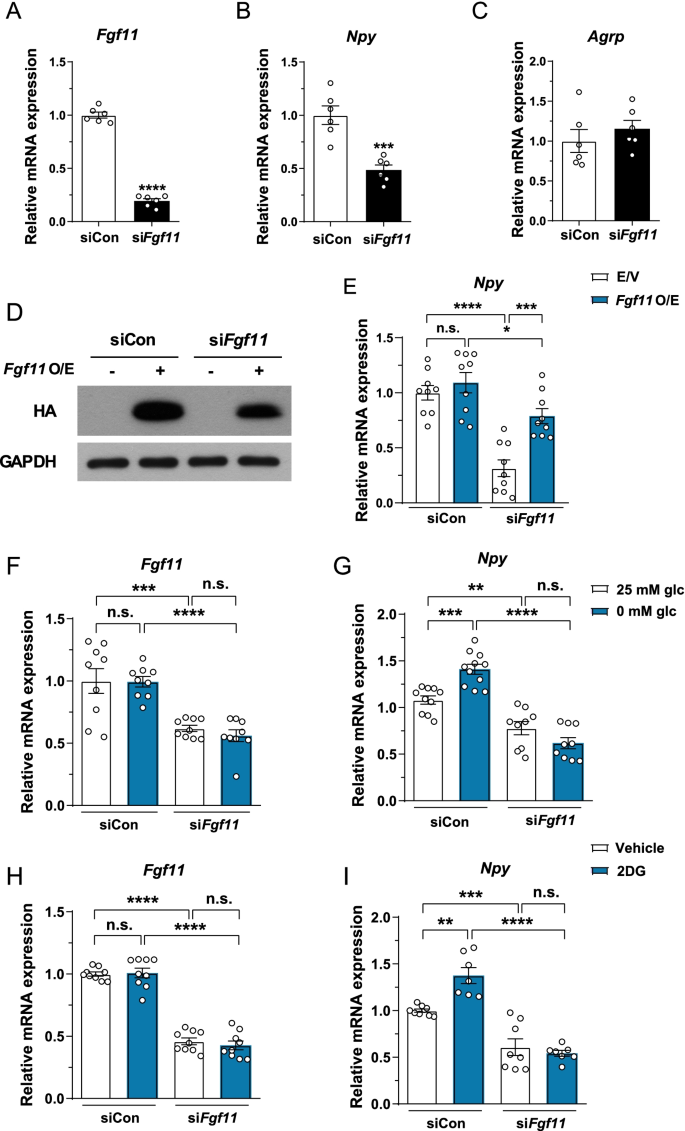
我们进一步评估了FGF11在调控中的作用gydF4y2BaNpygydF4y2Ba共表达NPY和AgRP的下丘脑细胞系N41的基因表达。gydF4y2BaFgf11gydF4y2Baknockdown显著降低了mRNA的表达gydF4y2BaNpygydF4y2Ba但不是gydF4y2BaAgRPgydF4y2Ba在N41细胞中(图;gydF4y2Ba4gydF4y2Baa - c)。另一方面,gydF4y2BaFgf11gydF4y2Ba在共表达的N43/5细胞中敲除gydF4y2BaPomcgydF4y2Ba而且gydF4y2Ba车gydF4y2Ba没有影响任何一个基因的表达(附加文件gydF4y2Ba1gydF4y2Ba:图S5)。值得注意的是,过度表达gydF4y2BaFgf11gydF4y2Ba获救gydF4y2BaFgf11gydF4y2Ba击倒引起的减少gydF4y2BaNpygydF4y2BamRNA表达(图;gydF4y2Ba4gydF4y2BaD, e)。自gydF4y2BaNpygydF4y2Ba低葡萄糖可用性诱导表达[gydF4y2Ba29gydF4y2Ba,我们测试了是否gydF4y2BaFgf11gydF4y2Ba可拆卸的变弱gydF4y2BaNpygydF4y2Ba在低糖条件下,如无葡萄糖培养基或2DG处理下的基因诱导。而gydF4y2BaFgf11gydF4y2BamRNA表达不变,gydF4y2BaNpygydF4y2Ba在无葡萄糖培养基和2DG处理下,mRNA表达均显著增加(图2)。gydF4y2Ba4gydF4y2Ba外:我)。葡萄糖利用率低gydF4y2BaNpygydF4y2Ba基因表达被钝化gydF4y2BaFgf11gydF4y2Ba在无葡萄糖培养基中敲除(图;gydF4y2Ba4gydF4y2BaG),与2DG处理时相同(图;gydF4y2Ba4gydF4y2BaI).在小鼠中,gydF4y2BaFgf11gydF4y2Ba在禁食条件下mRNA表达保持不变(附加文件gydF4y2Ba1gydF4y2Ba:图S6)。综合来看,这些数据表明gydF4y2BaFgf11gydF4y2Ba调节gydF4y2BaNpygydF4y2Ba下丘脑N41细胞的基因表达。gydF4y2Ba
FGF11调节gydF4y2BaNpygydF4y2Ba基因的表达。siRNA-mediatedgydF4y2BaFgf11gydF4y2Ba在共表达NPY/AgRP的下丘脑细胞中进行敲除。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BaCgydF4y2BamRNA表达gydF4y2Ba一个gydF4y2BaFgf11gydF4y2Ba,gydF4y2BaBgydF4y2BaNpygydF4y2Ba,gydF4y2BaCgydF4y2BaAgRPgydF4y2Ba后gydF4y2BaFgf11gydF4y2Ba在N41细胞中敲除。gydF4y2BaDgydF4y2BaN41细胞转染空载体(E/V)或ha标记的FGF11和gydF4y2BaFgf11gydF4y2Ba免疫印迹法证实过表达和敲低。gydF4y2BaEgydF4y2BaNpygydF4y2Ba后mRNA表达gydF4y2BaFgf11gydF4y2Ba可拆卸的,gydF4y2BaFgf11gydF4y2Ba超表达(O / E)。N41细胞暴露于0 mM葡萄糖(glc)培养基中gydF4y2BaFgf11gydF4y2Ba的mRNA表达gydF4y2BaFgydF4y2BaFgf11gydF4y2Ba而且gydF4y2BaGgydF4y2BaNpygydF4y2Ba测量。用2DG处理N41细胞gydF4y2BaFgf11gydF4y2BamRNA的表达gydF4y2BaHgydF4y2BaFgf11gydF4y2Ba而且gydF4y2Ba我gydF4y2BaNpygydF4y2Ba被评估。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001,和****gydF4y2BapgydF4y2Ba< 0.0001, n = 6-11gydF4y2Ba
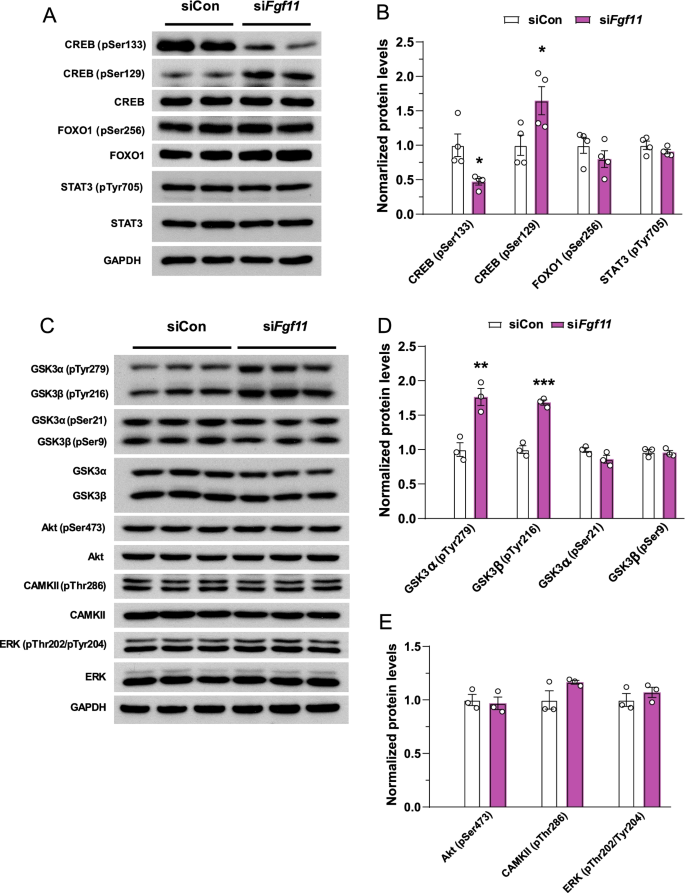
Fgf11gydF4y2Ba敲除会降低CREB活性,但会增加下丘脑细胞中的GSK3活性gydF4y2Ba
鉴定fgf11依赖的调控分子gydF4y2BaNpygydF4y2Ba基因调控,我们研究了转录因子的变化gydF4y2BaNpygydF4y2Ba表达后gydF4y2BaFgf11gydF4y2Ba可拆卸的。考虑到gydF4y2BaNpygydF4y2Ba表达受CREB、叉头盒蛋白O1、转录信号转换器和转录激活因子等多种转录因子调控3 [gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba],我们通过检查这些转录因子的磷酸化变化来评估它们的活性。免疫印迹分析显示,这些转录因子均未受影响gydF4y2BaFgf11gydF4y2Ba除CREB磷酸化外的敲除(图;gydF4y2Ba5gydF4y2BaA、B);CREB Ser133位点的磷酸化是激活性的,而Ser129位点的磷酸化是抑制性的[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].我们发现CREB在Ser133位点的磷酸化降低,而在Ser129位点的磷酸化增加gydF4y2BaFgf11gydF4y2Ba敲低,表明CREB活性明显降低gydF4y2BaFgf11gydF4y2Ba在下丘脑细胞(图;gydF4y2Ba5gydF4y2BaA, B).接下来,通过gydF4y2BaFgf11gydF4y2Ba我们检测了GSK3、蛋白激酶B、Ca的磷酸化水平gydF4y2Ba2 +gydF4y2Ba/钙调素依赖性蛋白激酶II,以及细胞外信号调节激酶,因为已知这些激酶可调节CREB的活性[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba,gydF4y2Ba52gydF4y2Ba].只有GSK3在Tyr279和Tyr216位点(分别对应于GSK3 α和β的活性形式)的磷酸化增加,而GSK3 Ser21和Ser9位点的磷酸化没有改变gydF4y2BaFgf11gydF4y2Ba击倒(无花果。gydF4y2Ba5gydF4y2Ba值得注意的是,已知控制GSK3 Tyr216残基磷酸化的FYN和PYK2的磷酸化没有变化(附加文件)gydF4y2Ba1gydF4y2Ba:图S7) [gydF4y2Ba53gydF4y2Ba].其他上游激酶的磷酸化不受影响gydF4y2BaFgf11gydF4y2Ba击倒(无花果。gydF4y2Ba5gydF4y2BaC和E)。这些数据表明可能性gydF4y2BaFgf11gydF4y2Ba可能通过调节GSK3酪氨酸磷酸化来调节CREB活性。gydF4y2Ba
Fgf11gydF4y2Ba敲除共表达NPY/AgRP的下丘脑细胞,会增加CREB,降低GSK3活性。N41细胞转染非沉默siRNA对照或sigydF4y2BaFgf11gydF4y2Ba48小时。gydF4y2Ba一个gydF4y2BaN41细胞的Western blot: NPY的转录因子。gydF4y2BaBgydF4y2Ba免疫印迹定量。gydF4y2BaCgydF4y2Ba西方对CREB活动监管机构的印迹。gydF4y2BaDgydF4y2Ba,gydF4y2BaEgydF4y2Ba免疫印迹的定量。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001(非沉默siRNA对照与si对照gydF4y2BaFgf11gydF4y2Ba).N = 3或4gydF4y2Ba
Fgf11gydF4y2Ba通过gsk3依赖的CREB活性调节NPY mRNA的表达gydF4y2Ba
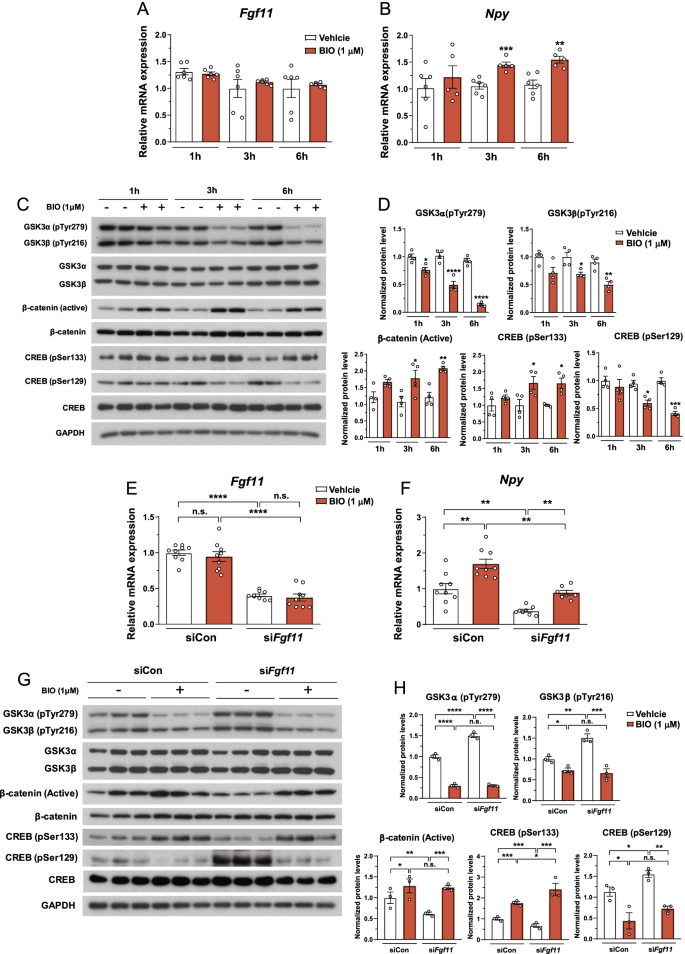
GSK3α和GSK3β抑制有利于CREB 133位点的磷酸化[gydF4y2Ba54gydF4y2Ba].GSK3β通过磷酸化CREB Ser129降低CREB结合活性[gydF4y2Ba46gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].以确定是否gydF4y2BaFgf11gydF4y2Baknockdown通过GSK3降低CREB活性,我们用BIO (GSK3抑制剂)处理N41细胞[gydF4y2Ba55gydF4y2Ba,gydF4y2Ba56gydF4y2Ba].BIO治疗无影响gydF4y2BaFgf11gydF4y2BamRNA表达增加gydF4y2BaNpygydF4y2BamRNA表达随时间变化(图;gydF4y2Ba6gydF4y2BaA, B). BIO通过降低酪氨酸磷酸化和增加β-catenin积累来证实GSK3的抑制作用,β-catenin是GSK3底物,可被β-catenin破坏复合物降解[gydF4y2Ba57gydF4y2Ba(图。gydF4y2Ba6gydF4y2Ba此外,BIO显著提高了CREB的活性,这可以通过CREB Ser133磷酸化的增加和CREB Ser129磷酸化的减少来证明(图3)。gydF4y2Ba6gydF4y2BaC, D)。gydF4y2Ba
FGF11调节gydF4y2BaNpygydF4y2BaNPY/AgRP共表达下丘脑细胞中gsk3依赖CREB调控的基因表达。用二甲基亚砜(载体)或BIO (1 μM)处理N41细胞1、3或6 h。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2BamRNA表达gydF4y2BaFgf11gydF4y2Ba而且gydF4y2BaNpygydF4y2BaBIO处理后。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2BaBIO处理后GSK3、β-catenin和CREB的Western blot检测。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001,和****gydF4y2BapgydF4y2Ba< 0.0001(对照生物制剂)。n = 4-6。gydF4y2BaEgydF4y2Ba- - - - - -gydF4y2BaHgydF4y2BaN41细胞转染非沉默siRNA对照或sigydF4y2BaFgf11gydF4y2Ba48 h后再用载体或BIO处理6 h。gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2BamRNA表达gydF4y2BaFgf11gydF4y2Ba而且gydF4y2BaNpygydF4y2Ba后gydF4y2BaFgf11gydF4y2Ba生物处理击倒。gydF4y2BaGgydF4y2Ba,gydF4y2BaHgydF4y2BaGSK3、β-catenin和CREB的Western blot检测gydF4y2BaFgf11gydF4y2Ba生物处理击倒。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.01, ***gydF4y2BapgydF4y2Ba< 0.001,和****gydF4y2BapgydF4y2Ba< 0.0001, n = 3-9gydF4y2Ba
以调查是否减少gydF4y2BaNpygydF4y2BamRNA表达后gydF4y2BaFgf11gydF4y2Ba敲低是由于gsk3依赖的CREB活性,gydF4y2BaFgf11gydF4y2Ba-knockdown N41细胞用BIO处理。抑制gydF4y2BaNpygydF4y2Ba下的mRNA表达gydF4y2BaFgf11gydF4y2BaBIO挽救了击倒(图;gydF4y2Ba6gydF4y2BaE, F). BIO显著降低gydF4y2BaFgf11gydF4y2Ba敲低诱导的GSK3酪氨酸磷酸化,与β-catenin的积累相反(图2)。gydF4y2Ba6gydF4y2BaG, H)。重要的是,伴随着的恢复gydF4y2BaNpygydF4y2Ba表达时,CREB活性降低gydF4y2BaFgf11gydF4y2Ba通过抑制GSK3, pSer133水平的增加和pSer129水平的降低可以恢复敲低(图5)。gydF4y2Ba6gydF4y2BaG, H)。这些数据表明FGF11调节gydF4y2BaNpygydF4y2Ba通过gsk3依赖的CREB活性表达基因。gydF4y2Ba
讨论gydF4y2Ba
fgf是调节能量平衡的关键角色之一。然而,与其他fgff相比,FGF11在代谢中的功能仍然是未知的。在这里,我们报告了下丘脑FGF11的敲除改善了高脂肪条件下的代谢特征。gydF4y2Ba
目前尚不清楚FGF11在调节葡萄糖稳态中的作用。我们的研究表明,在下丘脑中抑制FGF11可以改善葡萄糖和胰岛素耐受不良。先前的研究指出,抑制下丘脑NPY上游信号通路可增加胰岛素分泌[gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba]和NPY神经元特异性胰岛素受体缺陷小鼠的葡萄糖稳态受损[gydF4y2Ba60gydF4y2Ba].虽然需要进一步的研究来阐明下丘脑FGF11调节葡萄糖代谢和胰岛素敏感性的机制,但NPY神经元中的FGF11可能参与胰岛素功能的葡萄糖稳态。gydF4y2Ba
不同于其他FGF家族,如规范FGF和内分泌FGF, FGF11家族,如FGF12、13和14的表达局限于下丘脑薄壁组织,包括背内侧核、腹内侧核和ARC,而不是tananycytes [gydF4y2Ba61gydF4y2Ba].我们证明了FGF11在下丘脑表达,特别是在ARC的NPY神经元中。这种表达模式反映了FGF11家族不通过FGF受体介导其作用的特征,因为下丘脑中的FGF受体主要表达在β-tanycytes中[gydF4y2Ba61gydF4y2Ba].gydF4y2Ba
我们发现FGF11可以调节gydF4y2BaNpygydF4y2Ba通过调节下丘脑中gsk3依赖的CREB活性来表达基因。GSK3的活性主要由其丝氨酸磷酸化控制GSK3α中的Ser21和GSK3β中的Ser9 [gydF4y2Ba48gydF4y2Ba].GSK3的丝氨酸磷酸化促进了其n端尾部作为假底物的作用,阻碍了引物底物的结合[gydF4y2Ba62gydF4y2Ba].GSK3酪氨酸磷酸化(GSK3α中的Tyr 279和GSK3β中的Tyr216)在翻译过程中通过自磷酸化发生,并与激酶活性增加有关[gydF4y2Ba63gydF4y2Ba].有趣的是,gydF4y2BaFgf11gydF4y2Ba在我们的研究中,敲低GSK3在丝氨酸残基上的磷酸化不受影响,但改变了Tyr279和Tyr216位点的磷酸化。因此,FGF11可能参与调节GSK3α和GSK3β的酪氨酸磷酸化,从而调节GSK3活性。gydF4y2Ba
目前尚不清楚哪些生理条件调节基因表达gydF4y2BaFgf11gydF4y2Ba.在我们的研究中,我们首先证明了下丘脑gydF4y2BaFgf11gydF4y2Ba基因表达在16周高热量饮食组显著增加,但禁食组没有。根据之前的一项研究,在高热量饮食16周后,肥胖的全部特征都出现了。gydF4y2Ba64gydF4y2Ba].因此,的表达式gydF4y2BaFgf11gydF4y2Ba可以在生理条件下调节,如完全发育的肥胖,尽管尚不清楚是否增加gydF4y2BaFgf11gydF4y2Ba基因表达是肥胖发展的原因或结果。考虑到下丘脑FGF11在全身代谢中的作用,很可能在gydF4y2BaFgf11gydF4y2Ba基因表达与肥胖的进展有关。未来的研究需要阐明的机制(s)由下丘脑gydF4y2BaFgf11gydF4y2Ba是由HFD或其他生理条件调节的。gydF4y2Ba
另一点是gydF4y2BaFgf11gydF4y2Ba敲低N41细胞中FYN或PYK2等激酶的活性并没有改变,这些激酶被认为可以调节GSK3的活性[gydF4y2Ba53gydF4y2Ba].FGF11不是激酶[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba],具有n端核定位信号,与核内HIF-1α直接作用[gydF4y2Ba13gydF4y2Ba].我们在N41细胞中的免疫沉淀分析表明,FGF11不直接结合GSK3(数据未显示)。FGF11可能间接调控GSK3的酪氨酸磷酸化。虽然还需要进一步的研究来了解FGF11如何调节GSK3的磷酸化以及相关的调控机制,但我们的研究结果揭示了FGF11在调节GSK3磷酸化中的未知作用gydF4y2BaNpygydF4y2Ba基因在ARC中的表达,FGF11在HFD条件下调节BAT的产热。gydF4y2Ba
弧gydF4y2BaFgf11gydF4y2Ba在我们的研究中,食用HFD的小鼠的抑制会短暂地减少食物摄入量。的显著下降gydF4y2BaNpygydF4y2BaARC基因表达gydF4y2BaFgf11gydF4y2Ba敲低有助于诱导PVN TH的表达,从而调节BAT的产热作用,而不是减少食物摄入量。来自ARC的NPY通过交感神经输出在PVN中酪氨酸羟化酶的继电器调节BAT的产热[gydF4y2Ba28gydF4y2Ba].因此,ARC引起体重大幅度下降gydF4y2BaFgf11gydF4y2Ba击倒可能归因于BAT生热作用增加的能量消耗。gydF4y2Ba
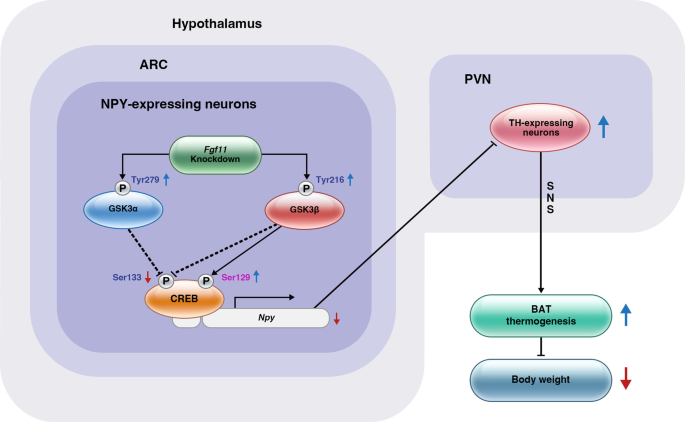
我们证明了ARC中的FGF11通过调节在能量平衡中发挥作用gydF4y2BaNpygydF4y2Ba对BAT产热和体重的影响(见图1)gydF4y2Ba7gydF4y2Ba).FGF11在ARC中的沉默通过下调BAT的产热和能量消耗而增加gydF4y2BaNpygydF4y2Ba,克服能量过剩,改善HFD条件下的肥胖表型。下丘脑FGF11在身体代谢调节中的核心作用的描述扩展了我们对FGF11生物学功能的理解。总的来说,我们的研究强调了FGF11作为治疗肥胖的潜在治疗靶点的重要性。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- 2 dg:gydF4y2Ba
-
Deoxy-D-glucosegydF4y2Ba
- AgRP:gydF4y2Ba
-
Agouti-related肽gydF4y2Ba
- 弧:gydF4y2Ba
-
下丘脑弓形核gydF4y2Ba
- 蝙蝠:gydF4y2Ba
-
棕色脂肪组织gydF4y2Ba
- 购物车:gydF4y2Ba
-
可卡因和安非他明管制的记录gydF4y2Ba
- CAMKII:gydF4y2Ba
-
CagydF4y2Ba2 +gydF4y2Ba/钙调素依赖性蛋白激酶IIgydF4y2Ba
- 分子:gydF4y2Ba
-
CAMP反应元件结合蛋白gydF4y2Ba
- Dio2:gydF4y2Ba
-
碘甲状腺原氨酸脱碘酶2gydF4y2Ba
- 兵:gydF4y2Ba
-
细胞外信号调节激酶gydF4y2Ba
- FGF:gydF4y2Ba
-
成纤维细胞生长因子gydF4y2Ba
- FGFR:gydF4y2Ba
-
成纤维细胞生长因子受体gydF4y2Ba
- FOXO1:gydF4y2Ba
-
叉头盒蛋白O1gydF4y2Ba
- GAPDH:gydF4y2Ba
-
甘油醛3-磷酸脱氢酶gydF4y2Ba
- GSK3α:gydF4y2Ba
-
糖原合成酶激酶3gydF4y2Ba
- GSK3β:gydF4y2Ba
-
糖原合成酶激酶-3gydF4y2Ba
- GTT:gydF4y2Ba
-
葡萄糖耐量试验gydF4y2Ba
- 哈:gydF4y2Ba
-
人流感血凝素gydF4y2Ba
- HFD:gydF4y2Ba
-
高脂肪饮食gydF4y2Ba
- iFGF:gydF4y2Ba
-
细胞内FGFgydF4y2Ba
- ITT公司:gydF4y2Ba
-
胰岛素耐量试验gydF4y2Ba
- 非传染性疾病:gydF4y2Ba
-
Normal-chow饮食gydF4y2Ba
- NPY:gydF4y2Ba
-
神经肽YgydF4y2Ba
- Pgc1α:gydF4y2Ba
-
过氧化物酶体增殖物激活受体γ辅激活剂1- αgydF4y2Ba
- POMC:gydF4y2Ba
-
Pro-opiomelanocortingydF4y2Ba
- Prdm16:gydF4y2Ba
-
PR域包含16gydF4y2Ba
- PVN:gydF4y2Ba
-
下丘脑室旁核gydF4y2Ba
- STAT3:gydF4y2Ba
-
信号换能器和转录激活子3gydF4y2Ba
- Ucp1:gydF4y2Ba
-
解偶联蛋白1gydF4y2Ba
参考文献gydF4y2Ba
赫鲁比A,胡FB。肥胖的流行病学:一幅大图。药物经济学。2015;33:673 - 89。gydF4y2Ba
Malik VS, Willet WC, Hu FB。近十年的全球肥胖趋势,风险因素和政策含义。内分泌杂志2020;16:615-6。gydF4y2Ba
成纤维细胞生长因子信号通路。《生物科学》2015;4:215-66。gydF4y2Ba
刘伟,刘志强,刘志强,刘志强,等。成纤维细胞生长因子在代谢调控中的信号传递。前内分泌(洛桑)。2015; 6:193。gydF4y2Ba
Wiedlocha A, Sorensen V.纤维细胞生长因子的信号、内化和细胞内活性。中国生物医学工程杂志,2004;26(6):344 - 344。gydF4y2Ba
张欣,鲍琳,杨玲,吴强,李松。细胞内成纤维细胞生长因子在神经发育和功能中的作用。中国生命科学,2012;gydF4y2Ba
马celin G, Jo YH,李旭,Schwartz GJ,张勇,邓乃杰,等。FGF19的中枢作用降低了下丘脑AGRP/NPY神经元的活性,改善了葡萄糖代谢。Mol Metab. 2014; 3:19-28。gydF4y2Ba
Morton GJ, Matsen ME, Bracy DP, Meek TH, Nguyen HT, Stefanovski D,等。FGF19在大脑中的作用诱导胰岛素非依赖性葡萄糖降低。中国临床医学杂志,2013;gydF4y2Ba
Fisher FM, Kleiner S, Douris N, Fox EC, Mepani RJ, Verdeguer F,等。FGF21在适应性产热过程中调节pgc -1 α和白色脂肪组织的褐变。基因工程学报2012;26:271-81。gydF4y2Ba
张志刚,张志刚,张志刚。FGF21对大鼠下丘脑-垂体-甲状腺轴和能量代谢的影响。中国生物医学工程学报,2018;gydF4y2Ba
杨克,徐建敏,阿特金斯,阿赫玛迪安,李鹏,怀特,等。PPARgamma-FGF1轴是适应性脂肪重塑和代谢稳态所必需的。大自然。2012;485:391-4。gydF4y2Ba
Hanai K, Oomura Y, Kai Y,西川K, Shimizu N,森田H,等。酸性成纤维细胞生长因子在饲养调节中的中心作用。中华医学杂志。1989;26:R217-23。gydF4y2Ba
李国强,李俊华,李建华,郑志勇。缺氧诱导的FGF11与hif -1 α相互作用并增强其稳定性。FEBS Lett. 2017; 591:348-57。gydF4y2Ba
李坤,郑志勇,安玉杰,李志华,严海生。FGF11通过调节PPARgamma调节因子的表达影响3T3-L1前脂肪细胞分化。FEBS Open Bio. 2019; 9:769-80。gydF4y2Ba
Timper K, Bruning JC。下丘脑回路调节食欲和能量稳态:肥胖的途径。机械工程学报。2017;10:679-89。gydF4y2Ba
李志强,李志强,李志强,等。下丘脑黑素皮质神经元控制食物摄入和能量代谢的分子和细胞调控。摩尔精神病学,2014;19:52 - 61。gydF4y2Ba
Hahn TM, Breininger JF, Baskin DG, Schwartz MW。Agrp和NPY在空腹激活下丘脑神经元中的共表达。神经科学。1998;1:271-2。gydF4y2Ba
Broberger C, Johansen J, Johansson C, Schalling M, Hokfelt T.神经肽Y/刺豚鼠基因相关蛋白(AGRP)在正常、厌食和味精处理小鼠中的脑回路。中国科学院学报(自然科学版),1998;gydF4y2Ba
杨亚文,杨晓明,杨晓明,杨晓明。前体黑素皮质素缺乏小鼠肥胖模型的研究。医学杂志1999;5:66 - 70。gydF4y2Ba
罗格G,琼斯D,休伯特GW,林Y,库哈尔MJ。CART肽:调节体重、奖励等功能。神经科学,2008;9:747-58。gydF4y2Ba
Coll AP, Farooqi IS, Challis BG, Yeo GS, O 'Rahilly S.原黑色素皮质素和能量平衡:来自人类和小鼠遗传学的见解。中国临床内分泌杂志,2004;gydF4y2Ba
Hermes SM, Mitchell JL, Aicher SA。在大鼠脑中,孤束核中的大多数神经元不向多个自主神经靶点发送侧支投射。神经科学进展。2006;19(3):349 - 349。gydF4y2Ba
Larsen PJ, Hay-Schmidt A, Mikkelsen JD。大鼠下丘脑外侧区和视前外侧区到下丘脑室旁核的传出连接。中华神经外科杂志,1994;gydF4y2Ba
黄燕,林霞,林生。神经肽Y与代谢综合征:临床治疗干预策略的最新进展。前沿细胞发育生物学。2021;9:695623。gydF4y2Ba
Morton GJ, Schwartz MW。NPY/AgRP神经元与能量稳态。中华医学杂志2001;25(增刊5):556 - 562。gydF4y2Ba
恩斯特伦·路德L,佩雷拉MMA,德·索利斯AJ,芬瑟劳H,布吕宁JC。NPY介导AgRP神经元的快速摄食和葡萄糖代谢调节功能。Nat Commun. 2020;11:442。gydF4y2Ba
李志强,李志强,李志强。弓状核AgRP神经元对能量消耗的控制:神经回路、信号通路和血管紧张素。Curr Hypertens代表2018;20:25。gydF4y2Ba
石玉春,刘杰,林志,张华,翟林,Sperk G,等。弓形NPY通过PVN中酪氨酸羟化酶神经元的继电器控制交感神经输出和BAT功能。中国生物医学工程学报,2013;gydF4y2Ba
吴涛,赵浩,赵志华,余文文,金志强。下丘脑ampk诱导的自噬通过调节NPY和POMC的表达来增加食物摄入量。自噬。2016;12:2009-25。gydF4y2Ba
Ichim CV, Wells RA。连续几轮超离心浓缩制备高滴度病毒制剂。《翻译医学》2011;9:137。gydF4y2Ba
Tiscornia G, Singer O, Verma IM。慢病毒载体的生产和纯化。Nat Protoc 2006; 1:241-5。gydF4y2Ba
穆尼亚帕,李山,陈华,权俊杰。目前评估体内胰岛素敏感性和胰岛素抵抗的方法:优点、局限性和适当使用。中华内分泌杂志。2008;294:E15-26。gydF4y2Ba
Ayala JE, Samuel VT, Morton GJ, Obici S, Croniger CM, Shulman GI,等。描述和执行小鼠葡萄糖稳态代谢试验的标准操作规程。机械工程学报。2010;3:525-34。gydF4y2Ba
李俊,金凯,赵志华,裴志勇,O 'Leary TP, Johnson JD,等。在下丘脑室旁核合成的胰岛素调节垂体生长激素的产生。JCI Insight, 2020。gydF4y2Bahttps://doi.org/10.1172/jci.insight.135412gydF4y2Ba.gydF4y2Ba
Joly-Amado A, Cansell C, Denis RG, Delbes AS, Castel J, Martinez S,等。下丘脑弓状核和周围基质的控制。临床内分泌代谢杂志2014;28:725-37。gydF4y2Ba
Varela L, Horvath TL. POMC和AgRP神经元中的瘦素和胰岛素通路调节能量平衡和葡萄糖稳态。EMBO rep 2012; 13:1079-86。gydF4y2Ba
Burke LK, Darwish T, Cavanaugh AR, Virtue S, Roth E, Morro J等。AGRP神经元中的mTORC1在调节小鼠适应性能量消耗中整合了食物相关的外感受和内感受线索。Elife》2017。gydF4y2Bahttps://doi.org/10.7554/eLife.22848gydF4y2Ba.gydF4y2Ba
Harno E, Gali Ramamoorthy T, Coll AP, White A. POMC:激素加工的生理力量。物理Rev. 2018; 98:2381-430。gydF4y2Ba
李志强,李志强,李志强,等。C75是一种脂肪酸合酶抑制剂,通过下丘脑amp活化蛋白激酶减少食物摄入量。中国生物化学杂志,2004;29(1):1 - 6。gydF4y2Ba
金淑娟,朴玉玉,张pg,南宫C,崔玉生,元成昌,等。下丘脑Foxo1在调节食物摄入和能量稳态中的作用。神经科学。2006;9:901-6。gydF4y2Ba
Ropelle ER, Pauli JR, Prada P, Cintra DE, Rocha GZ, Moraes JC,等。抑制下丘脑Foxo1表达减少饮食诱导肥胖大鼠的食物摄入量。中国生物医学工程学报。2009;gydF4y2Ba
凯琳·CB,龚琳,徐伟华,姚峰,Hockman K, Morton GJ,等。信号换能器和转录激活器(stat)结合位点,而不是stat3,是禁食诱导刺鼠相关蛋白信使核糖核酸转录所必需的。《Mol Endocrinol》2006;20:2591-602。gydF4y2Ba
全Y, Aja S, Ronnett GV, Kim EK。d -手肌醇聚糖通过AKT-FoxO1通路调节下丘脑神经肽的表达减少食物摄入量。生物化学生物物理学报,2016;470:818-23。gydF4y2Ba
王慧,徐娟,郑伟。cAMP反应元件结合蛋白(CREB)在精神分裂症病理生理中的作用。《神经科学》2018;11:255。gydF4y2Ba
Parker D, Ferreri K, Nakajima T, LaMorte VJ, Evans R, Koerber SC,等。通过直接机制,CREB在Ser-133位点的磷酸化诱导与CREB结合蛋白形成复合物。细胞生物学杂志1996;16:694-703。gydF4y2Ba
菲奥尔CJ,威廉姆斯JS,周ch,王qm,罗奇PJ,安德里萨尼OM。camp介导的基因表达控制需要CREB341 Ser129位点的二次磷酸化。糖原合成酶激酶-3在基因表达控制中的作用。《生物化学杂志》1994;gydF4y2Ba
林荣志,陈杰,胡忠文,Hoffman BB。cAMP反应元件结合蛋白的磷酸化和α - 1肾上腺素能受体转录的激活。中国生物化学杂志,1998;gydF4y2Ba
张志刚,张志刚,张志刚。糖原合成酶激酶-3 (GSK3)的研究进展。药理学杂志2015;148:114-31。gydF4y2Ba
潘文杰,李国强,李国强。PI3K/Akt和CREB调控成人神经海马祖细胞增殖分化。神经生物学。2007;67:1348-61。gydF4y2Ba
Grimes CA, Jope RS. CREB DNA结合活性被糖原合成酶激酶-3 β抑制,锂促进。神经化学杂志2001;78:1219-32。gydF4y2Ba
闫旭,刘娟,叶铮,黄娟,何峰,肖伟,等。camkii介导的CREB磷酸化参与Ca2+诱导的BDNF mRNA转录和电刺激促进的神经突生长。PLoS ONE。2016; 11: e0162784。gydF4y2Ba
裴俊杰,王世杰,王世杰,王世杰,等。ERK和PKA之间的相互作用对于Ca2+刺激creb依赖的转录和ERK核易位是必要的。神经元。1998;21:869 - 83。gydF4y2Ba
梅杰,李志强,李志强,等。糖原合成酶激酶的药理抑制剂研究进展药理学杂志2004;25:471-80。gydF4y2Ba
Silva-Garcia O, Rico-Mata R, Maldonado-Pichardo MC, Bravo-Patino A, Valdez-Alarcon JJ, Aguirre-Gonzalez J,等。糖原合成酶激酶3 α是在感染牛内皮细胞中调控转录因子核因子- κ B和cAMP反应元件结合的主要亚型gydF4y2Ba金黄色葡萄球菌gydF4y2Ba.前沿免疫。2018;9:92。gydF4y2Ba
曾志刚,李志刚,李志刚。GSK-3抑制剂BIO促进哺乳动物心肌细胞增殖。化学生物学,2006;13:957-63。gydF4y2Ba
曹辉,褚勇,吕霞,邱鹏,刘超,张辉,等。GSK3抑制剂- bio调节胰腺间充质干细胞(iPMSCs)的增殖。PLoS ONE。2012; 7: e31502。gydF4y2Ba
李J, K金,于西南,金埃克。Wnt3a通过下丘脑的Wnt/ -连环蛋白信号增加NeuroD1来上调脑源性胰岛素。《Mol Brain》2016;9:24。gydF4y2Ba
Konner AC, Bruning JC。代谢紊乱的选择性胰岛素和瘦素抵抗。《生物医学杂志》2012;16:44 - 52。gydF4y2Ba
陆凯,赫佐格,史永昌。NPY体系对能量稳态的调节。内分泌代谢杂志2015;26:125-35。gydF4y2Ba
陆凯,张林,王强,邓杰,祁勇,等。胰岛素通过NPY神经元控制食物摄入和能量平衡。Mol Metab. 2017; 6:574-84。gydF4y2Ba
Kaminskas B, Goodman T, Hagan A, Bellusci S, Ornitz DM, Hajihosseini MK.成纤维细胞生长因子调节下丘脑坦尼细胞和能量平衡核功能的内源性参与者的特征。神经内分泌杂志,2019;31:e12750。gydF4y2Ba
Frame S, Cohen P, Biondi RM。一个常见的磷酸盐结合位点解释了GSK3独特的底物特异性及其磷酸化失活。Mol Cell, 2001; 7:1321-7。gydF4y2Ba
胡em,周富强。GSK3信号在神经发育中的作用。神经科学。2010;11:539-51。gydF4y2Ba
王春春,廖建科。饮食引起的肥胖和胰岛素抵抗的小鼠模型。方法Mol生物学,2012;821:421-33。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了题为“开发基于海洋蛋白质的生物医学材料”的研究项目的支持(大韩民国海洋和渔业部)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
EKK和JHC构想并设计了实验。JHC, KK, CHC和JL进行了实验。EKK, JHC, KK和CHC对数据进行分析和解释,并对手稿进行编辑。EKK和JHC根据所有作者的意见撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有的动物程序和实验都是根据大邱庆北科学技术学院的机构动物保护和使用委员会进行的。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称不存在利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
Fgf11 mRNA的中心分布。gydF4y2Ba图S2。gydF4y2BaHFD饲喂后下丘脑Fgf11 mRNA表达。gydF4y2Ba图S3。gydF4y2Ba敲低Fgf11对ARC中神经肽mRNA表达的影响。gydF4y2Ba图S4。gydF4y2Bancd喂养小鼠PVN中NPY和TH的代表性共聚焦双免疫染色图像。gydF4y2Ba图S5。gydF4y2Ba敲除Fgf11后POMC/CART共表达细胞中神经肽mRNA的表达。gydF4y2Ba图S6。gydF4y2Ba禁食对下丘脑Fgf11 mRNA表达的影响。gydF4y2Ba图S7。gydF4y2BaNPY/AgRP共表达细胞中敲除Fgf11后GSK3上游激酶的磷酸化gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
赵,j.h.,金,K,赵,H.C.gydF4y2Baet al。gydF4y2Ba下丘脑FGF11的沉默可以防止饮食引起的肥胖。gydF4y2Ba摩尔的大脑gydF4y2Ba15gydF4y2Ba, 75(2022)。https://doi.org/10.1186/s13041-022-00962-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13041-022-00962-3gydF4y2Ba
关键字gydF4y2Ba
- 成纤维细胞生长因子11gydF4y2Ba
- 神经肽YgydF4y2Ba
- 下丘脑gydF4y2Ba
- 弓状核gydF4y2Ba
- 棕色脂肪组织gydF4y2Ba
- 生热作用gydF4y2Ba
- 肥胖gydF4y2Ba