摘要
背景
erbb2阳性乳腺癌的特点是具有高度侵袭性的表型和对标准治疗的反应性降低。虽然已经设计了特定的erbb2靶向治疗,但只有一小部分患者对这些治疗有反应,其中大多数最终复发。这种特别具有攻击性和无反应或复发患者的存在促使人们寻求新的治疗方法。本研究的目的是确定大麻素是否可能构成一种治疗erbb2阳性乳腺肿瘤的新治疗工具。我们在一个成熟的、临床相关的erbb2驱动的转移性乳腺癌模型MMTV-neu小鼠中分析了它们的抗肿瘤潜力。我们还分析了一系列87例人类乳腺肿瘤中大麻素靶点的表达。
结果
我们的结果表明,Δ9-四氢大麻酚,大麻中最丰富和有效的大麻素,以及JWH-133,一种非精神药物2受体选择性激动剂,减少MMTV-neu小鼠的肿瘤生长,肿瘤数量和肺转移的数量/严重程度。肿瘤的组织学分析表明,大麻素抑制癌细胞增殖,诱导癌细胞凋亡,并损害肿瘤血管生成。大麻素的抗肿瘤作用至少部分依赖于对促肿瘤Akt通路的抑制。我们还发现91%的erbb2阳性肿瘤表达非精神性大麻素受体CB2.
结论
综上所述,这些结果为使用基于大麻素的疗法治疗erbb2阳性乳腺癌提供了强有力的临床前证据。
背景
乳腺癌约占每年新诊断癌症的30%。其中近三分之一过度表达ErbB2酪氨酸激酶受体(人类中的Her2,大鼠中的Neu),这是EGF受体家族的一员[1].它们的配体与细胞内结构域的磷酸化诱导受体同源或异二聚,导致促进细胞增殖和生存的关键信号通路的激活,包括磷脂酰肌醇3-激酶(PI3K)/Akt通路和ERK/MAPK级联。尽管尚未发现ErbB2的特定配体,但该受体是家族中首选的异源二聚体伙伴[2].erbb2过表达的乳腺肿瘤具有非常严重的临床病程和生存率降低的特点,这主要是由于其组成细胞的低分化、高增殖和高侵袭性[2].所有这些特征使得过度表达erbb2的肿瘤对常规治疗的反应较弱。治疗这些肿瘤的最新进展之一是使用人源化中和性单克隆抗体对抗ErbB2(曲妥珠单抗)[3.].尽管这一策略非常成功,但约75%的erbb2过表达肿瘤患者对曲妥珠单抗无反应,近15%的有反应者最终发生转移[4].大量无反应和复发患者的存在促使人们寻求新的治疗方法。
大麻素(大麻及其衍生物的活性化合物)的治疗潜力几个世纪前就已为人所知。越来越多的证据表明,它们可能对各种病理情况有益,如疼痛、炎症、饮食失调和脑损伤等[5,6].大麻素通过结合并激活特定的G蛋白偶联受体来发挥其大部分作用。到目前为止,两种大麻素受体,即CB1和CB2它们都是从哺乳动物组织中克隆和鉴定的,它们之间的主要区别在于它们的组织表达模式。因此,当CB1受体无处不在,其最高的存在发现在中枢神经系统,CB2受体的表达主要局限于免疫系统的特定元素[5,6].在过去的十年里,越来越多的证据表明大麻素可能对治疗癌症有用。这些化合物在不同的细胞培养和癌症动物模型中发挥抗增殖、促凋亡、抗血管生成和抗侵袭作用[7,8].在这里,我们使用了erbb2驱动的转移性乳腺癌的基因工程动物模型(MMTV-neu小鼠)来分析大麻素在这种特别侵袭性病理中的抗肿瘤潜力。这些动物在激素敏感的小鼠乳腺肿瘤病毒长末端重复序列(MMTV-LTR)启动子的控制下表达大鼠ErbB2癌基因(neu) [9].neu在乳腺上皮选择性过表达导致局灶性乳腺肿瘤在长潜伏期(5-12个月)后自发发展[9].本文(i)的结果显示,erbb2阳性的侵袭性人类乳腺肿瘤表达CB2受体,(ii)证明Δ9-四氢大麻酚(THC)和非精神药物大麻酚2大麻素受体激动剂JWH-133在erbb2阳性转移性乳腺癌临床相关模型中显著降低肿瘤进展,并且(iii)阐明了大麻素抗肿瘤作用的机制在活的有机体内.
结果
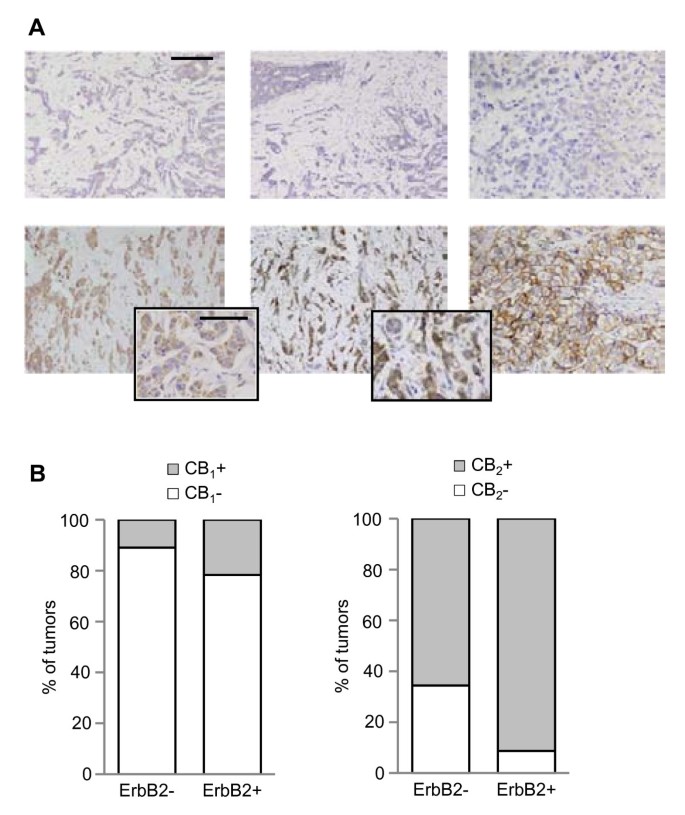
人类erbb2阳性乳腺肿瘤表达CB2大麻素受体
我们首先分析了erbb2阳性的人类乳腺肿瘤是否表达大麻素靶标(即大麻素受体)。我们对CB进行免疫组化分析1和CB2组织微阵列检测87例3级浸润性乳腺导管癌和6例非肿瘤乳腺样本中的受体。CB1仅14%的肿瘤(12/87)检测到免疫反应性,该受体表达与ErbB2表达之间未发现相关性(p = 0.198,图。1).相反,CB2受体染色在72%的肿瘤(63/87)中明显,它与ErbB2表达显著相关,因为在91%的ErbB2阳性肿瘤中观察到它(21/23,p = 0.018,图。1).此外,我们没有检测到显著的CB1或CB2非转化乳腺组织中的受体免疫反应性(数据未显示)。
大麻素在乳腺癌MMTV-neu模型中发挥抗肿瘤作用
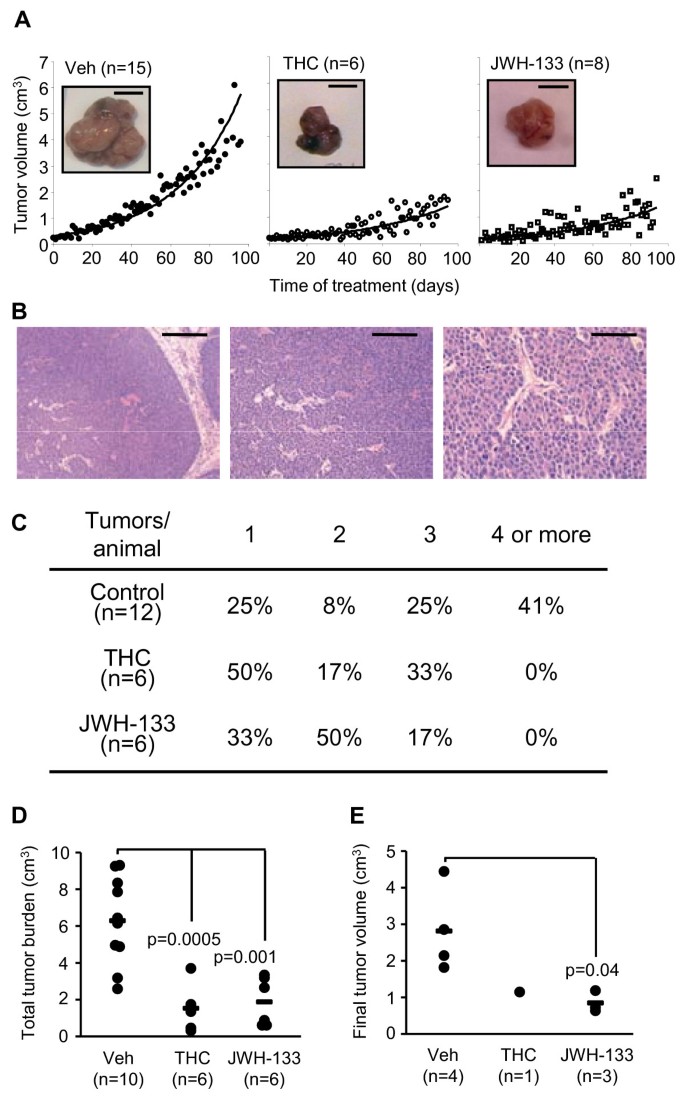
然后,我们在一个成熟的、临床相关的erbb2驱动转移性乳腺癌动物模型MMTV-neu小鼠中分析了大麻素对肿瘤进展的影响。我们首先观察到我们的MMTV-neu菌落在长潜伏期后发生乳腺肿瘤,与之前报道的相似[9].特别是,50%的女性在第36周时患了肿瘤1:图S1A)。大鼠ErbB2转基因(neu)在肿瘤中的过表达被实时定量PCR验证(附加文件1:图S1B)。用大麻素治疗,无论是四氢大麻酚(THC),从丰度和效力来看,主要来自大麻的大麻素,还是JWH-133,一种合成的大麻素2受体选择性激动剂,强烈减缓肿瘤生长(图。2),在治疗结束时导致较小的病变(附加文件1:图S2)。然而,这些化合物并没有改变肿瘤的组织形态学特征。因此,三个不同的实验组产生了局灶性、导管性、实性、血管化良好的乳腺肿瘤,周围为非侵袭性增生性乳腺上皮(图2)。2 b).我们还观察到mmtv - nue来源的肿瘤表达CB1和CB2大麻素受体mRNA(由实时定量PCR测定,数据未显示)和蛋白质(附加文件1:图S3)。
大麻素抑制乳腺肿瘤生长在活的有机体内以及每只动物产生的肿瘤数量.(A)每只动物出现第一个肿瘤的体积时间过程(比例尺:1cm)。(B) mmtv - nue来源的乳腺肿瘤组织病理学的代表性图像(H&E染色)。比例尺(从左到右):200 μm、100 μm、50 μm。(C)在治疗结束(90天)时,每个实验组中有1、2、3、4个或更多肿瘤的动物的百分比。(D)大麻素或载体治疗90天后确定的总肿瘤负荷(每只动物的总肿瘤体积)。(E)肿瘤出现后40天,肿瘤体积出现在第二、第三或之后的位置。大麻素治疗组的规模小是因为很少有第二或第三个肿瘤出现得早,足以在治疗结束前持续40天(在第一个肿瘤出现90天后)。
有趣的是,大麻素不仅会损害肿瘤的生长,而且还会阻止肿瘤的产生本身.因此,虽然41%的载体治疗动物发展了4个或更多的肿瘤(多达6个),但大麻素治疗的动物从未发展超过3个肿瘤(图。2摄氏度, p < 0.05)。因此,大麻素显著降低了总肿瘤负荷(图。二维).在这些动物中,后续肿瘤的出现也有延迟。因此,在载体处理、四氢大麻酚处理和jwh -133处理的动物中,第二个肿瘤产生的平均潜伏期分别为33、46和54天。如方法部分所述,每只动物中只有第一个肿瘤用大麻素在瘤周治疗。然而,我们发现大麻素在那些出现在第二位的肿瘤中具有显著的生长抑制作用(图2)。2 e).
大麻素影响肿瘤细胞增殖、肿瘤细胞存活和肿瘤血管生成
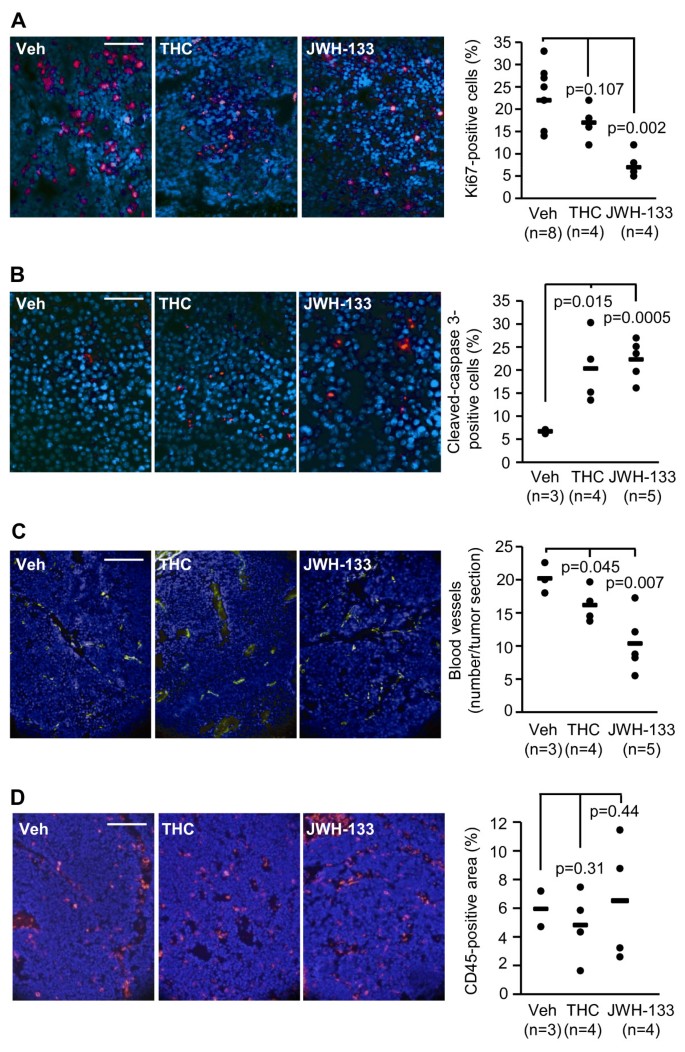
接下来,我们分析了癌细胞的增殖潜力,发现THC和JWH-133都降低了癌细胞的增殖潜力,正如大麻素治疗的肿瘤中ki67阳性细胞数量减少所表明的那样(图2)。3).大麻素也增加了肿瘤内分裂(活性)caspase 3阳性细胞的数量,表明这些化合物通过凋亡诱导癌细胞死亡(图。3 b).肿瘤血管化也受到大麻素的损害,因为通过CD31染色确定,THC和JWH-133都减少了肿瘤中的血管数量(图3)。3 c).为了评估免疫反应对大麻素抗肿瘤作用的可能贡献,我们通过免疫荧光分析了肿瘤中的免疫浸润程度。在所有样本中,肿瘤内cd45阳性细胞(除红细胞和血小板外的分化造血细胞)的比例都很低,各组间无明显差异(图2)。3 d).这些数据表明,大麻素治疗不影响免疫细胞浸润到肿瘤实质。
大麻素可以减少乳腺癌在肺部的转移
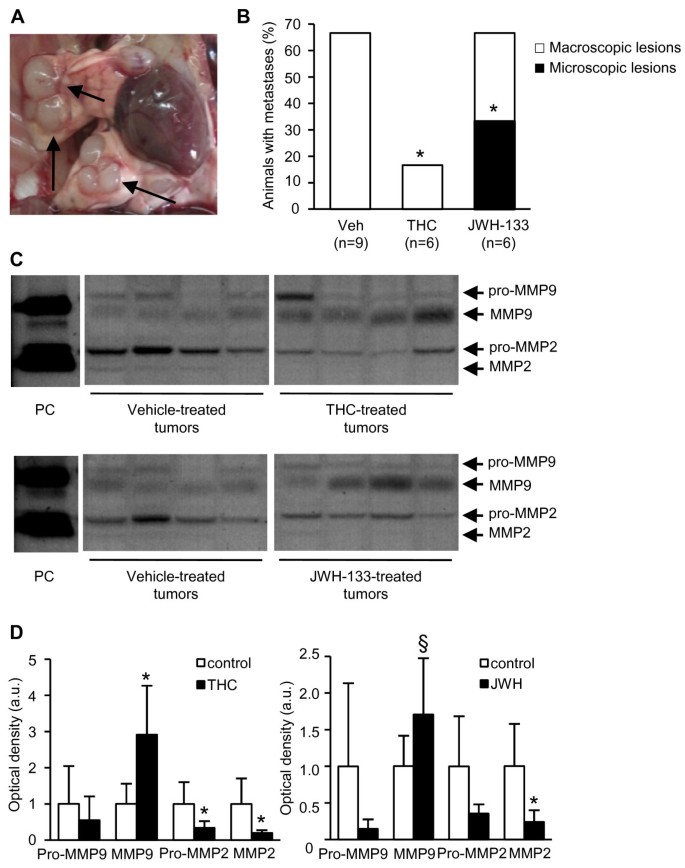
先前有报道称,携带肿瘤的MMTV-neu动物在肺部发生转移的比例很高[9].具体来说,我们检测到肺转移(图。4)在67%的载体处理的MMTV-neu动物中(图;4 b).细胞形态、肿瘤结构和neu转基因mRNA在这些肺结构中的过表达证实了病变的转移性(图2)。S1C和D)。THC降低了肺转移动物的百分比(图。4 b).虽然JWH-133并没有降低这一比例,但它显著降低了病变的程度。因此,实验组中有一半的转移只能通过显微镜分析检测到(图2)。4 b).正如观察到的原发性乳腺肿瘤,大麻素治疗没有改变转移的组织病理学,三个实验组表现出相似的实体腺癌(附加文件)1:图S1C)。在任何实验组(数据未显示)分析的其他器官(脑、脾、肝、肾-通过组织学分析-和骨骼-通过x射线)中均未发现转移迹象。
大麻素可以抑制乳腺癌向肺部的转移在活的有机体内.(A)转移性肺结节(箭头所指)。(B)发生肺转移的动物比例。肉眼可见宏观转移,只有H&E染色才能检测到微观病变。后一种病变仅在jwh -133处理的动物中发现。(C)载体和大麻素治疗肿瘤的明胶酶谱。每个实验组有4个代表性肿瘤。PC:阳性对照(phorbol酯PMA刺激H71080细胞的条件培养基)。箭头指向根据阳性对照和预期MMP分子量的潜在MMP (pro-MMP)和活性MMP带。显示了同一凝胶的非连续部分。 Graphs show the densitometric analysis of MMP2 and MMP9 activities. Data are expressed in arbitrary units. *, p < 0.05vsvehicle-treated肿瘤;§,p = 0.068vsvehicle-treated肿瘤。
细胞外基质的降解是转移过程中至关重要的一步,特别是在肿瘤细胞的内渗和外渗过程中[10].基质金属蛋白酶(MMPs)长期以来一直与这一过程有关,因为它们能够降解细胞外基质的成分。为了分析大麻素是否影响MMP活性,我们进行了明胶酶谱分析。在THC-和jwh -133治疗的肿瘤中,MMP2活性降低,而大麻素治疗的MMP9活性增强。4摄氏度).THC-和jwh -133诱导的MMP2活性降低伴随着MMP2 mRNA水平的降低(附加文件)1:图S4A)。相反,大麻素并没有改变MMP9转录本的数量(附加文件1:图S4A),并增强其蛋白水平(附加文件1:图S4B),表明它们在转录后调节MMP9。
Akt下调参与大麻素抗肿瘤作用
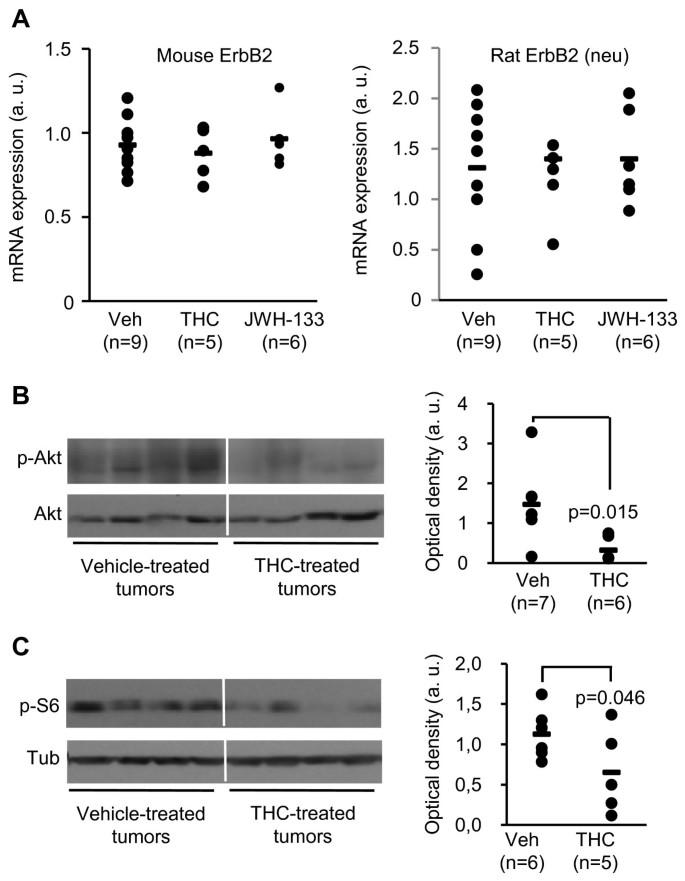
我们接下来的目标是描述大麻素抗肿瘤作用的机制。现已证实,几种类型的人类癌症与通过ErbB成员的信号解除调控有关[1].特别是,ErbB2过表达与肿瘤大小、转移潜力增加和组织学分级较高相关,这意味着ErbB2赋予肿瘤细胞强大的增殖和生存优势[11].为了评估大麻素是否调节内源性ErbB2和大鼠ErbB2前庭的表达(在我们的动物模型中异位表达),我们对THC和JWH-133处理进行了实时定量PCR检测。然而,没有检测到明显的变化(图。5).
由ErbB2激活的中心细胞内信号通路是PI3K/Akt通路,其在乳腺癌中的重要性得到了临床研究的证实,这些研究表明Akt在大多数ErbB2过表达肿瘤中被激活[11].我们观察到在thc处理的MMTV-neu肿瘤中Akt活化降低(图。5 b)以及磷酸化S6核糖体蛋白水平的降低[Akt/哺乳动物雷帕霉素靶标(mTOR)通路激活的解读]12]](无花果。5度).为了确定Akt抑制在大麻素抗肿瘤作用中的重要性,我们对从MMTV-neu乳腺肿瘤中分离出来的细胞系N202.1A进行了不同的实验[13].THC和JWH-133抑制了N202.1A细胞增殖(图;6)2受体依赖的方式,如预防大麻素作用施加的CB2受体选择性拮抗剂SR144528,但不被CB1受体选择性拮抗剂SR1417166 b).同样,THC和jw -133显著降低了n202.1 a来源的异种移植物的生长速度,而SR144528则阻止了这一影响(图2)。6摄氏度).THC还降低了两种不同的erbb2过表达的人类乳腺癌细胞系的细胞增殖(附加文件)1:图S5),提示人类erbb2阳性乳腺肿瘤细胞可能对大麻素的抗肿瘤作用也很敏感。N202.1A细胞显示Akt激活的剂量依赖性降低(图。6 d).有趣的是,肉豆蔻酰化(即组成型激活)形式的Akt过表达(图。6 e)抑制了THC的抗增殖作用(图;6 f).为了进一步支持Akt在大麻素抗肿瘤作用中的重要性,在裸鼠中使用稳定表达肉豆蔻酰化Akt或相应空载体(pBABE)的N202.1A细胞进行皮下异种移植。如图所示。6克(左图),THC显著降低了pbabe转染的n202.1 a源性肿瘤的生长。相反,活化Akt的过表达阻止了THC对肿瘤进展的影响(图。6克,右侧面板)。JWH-133也观察到了同样的效果。6小时).
Akt下调参与大麻素抗肿瘤作用.(A和B) N202.1A细胞对(A) THC或JWH-133浓度增加或(B) 6 μM THC或10 μM JWH-133与2 μM SR141716 (SR1)和/或SR144528 (SR2)作用48小时的存活率。数据以载体处理细胞的%表示,设置为100%。(C)用THC(左图)或JWH-133(右图)处理的n202.1 a源性异种移植物的生长,同时添加或不添加SR2。(D)通过Western blot检测THC刺激N202.1A细胞中Phospho-Akt和phospho-S6核糖体蛋白(p-S6)的水平。以总Akt和α-微管蛋白水平归一化。(E)用豆蔻酰化Akt (pBABE- myr -Akt)或相应的空载体(pBABE)逆转录转导N202.1A细胞中的Phospho-Akt和总Akt水平。(F) pBABE-或myr- akt -转导的N202.1A细胞在THC暴露72小时后的细胞活力。(G和h)用THC (G)、JWH-133 (h)或相应载体治疗的pBABE-N202.1A来源的肿瘤(左图)和myr- akt -N202.1A来源的肿瘤(右图)体积的时间过程。*, p < 0.05;**, p < 0.01vs载体处理的细胞或肿瘤;#, p < 0.05;##, p < 0.01vs大麻素单独处理的细胞(B)或vs四氢大麻酚处理的pbabe转导细胞(F)。
讨论
异常的ErbB2表达和/或功能会产生高度侵袭性的肿瘤,对常规化疗的耐药性增加,结果较差。虽然抗erbb2单克隆抗体曲妥珠单抗的使用显著提高了这些患者的生存期,但只有25%的患者对这种治疗有反应,大多数有反应的患者最终复发[14].此外,该抗体的使用与重要的心脏毒性副作用(严重充血性心力衰竭和左室射血分数降低)有关[14].因此,应广泛努力寻找治疗erbb2阳性乳腺肿瘤的新药物。我们的研究结果表明,在自发激发的过度表达erbb2的乳腺肿瘤中,大麻素抑制肿瘤的产生、生长、血管化和转移。尽管基于大麻素的单一疗法可能对erbb2阳性乳腺肿瘤有效,但分析这些化合物与其他抗癌疗法联合使用的效果将是有趣的。因此,值得注意的是,曲妥珠单抗作为目前为止对erbb2阳性肿瘤最相关的靶向治疗,作为一线药物使用时的中位总体缓解适中,与其他化疗药物联合使用时,疗效明显增强[14].此外,Akt过度激活已在很大比例的原发性人类乳腺癌中被检测到,其中与曲妥珠单抗耐药性增强有关[14,15].我们的研究结果表明,Akt的下调参与了大麻素的抗肿瘤作用。该激酶是PI3K/Akt/mTOR信号通路的中心节点,激活细胞生存、细胞生长、细胞增殖、血管生成以及细胞迁移和侵袭等关键过程[12].因此,该通路是抗癌药物的一个有吸引力的靶点,事实上,mTOR、PI3K和Akt抑制剂的临床试验已经/正在进行中[3.].
大麻素的抗肿瘤潜能已被证实在体外在癌症的动物模型中[7,8].这些化合物抑制乳腺癌细胞增殖在体外通过包括细胞周期阻滞在内的过程[16- - - - - -21]、激素和生长因子受体调节[18,22,23],细胞凋亡诱导[17,20.,21].的在活的有机体内迄今为止所采用的方法大多基于异种移植模型[20.,21],这些都是有用但有限的工具。这些模型依赖于免疫缺陷小鼠异位或原位癌细胞系的繁殖,缺乏患者肿瘤的关键特征,如肿瘤的实际结构和与肿瘤微环境(包括非癌周围组织、血管和免疫细胞)的相互作用,以及遗传异质性减弱[24].与异种移植动物相比,在本研究中使用的突变小鼠中,肿瘤在长潜伏期后自发出现,招募并生成血管,并穿透血管导致远处转移[9].这些特征与人类病理更加相似,使MMTV-neu小鼠成为erbb2驱动的乳腺癌临床相关模型。
值得注意的是,据我们所知,这是第一份支持大麻素不仅阻碍肿瘤生长,还阻碍肿瘤产生的报告。最近,Qamri及其同事和DuBois及其同事通过使用两种不同的癌症遗传模型,证明JWH-133延缓了乳腺肿瘤的出现[21]和CB的损失1受体加速肠腺瘤生长[25],分别和伊佐等.观察到高内源性大麻素水平和大麻素激动剂HU-210减少了小鼠结肠癌前病变的发展[26].这些数据和我们的数据表明,内源性大麻素系统具有对抗肿瘤发生的生理保护作用,这与该系统有助于维持健康和疾病的稳态的一般观点一致[6].
本文提供的数据表明大麻素可调节MMP活性。特别是,我们报告了大麻素对MMP2的抑制和MMP9的激活。尽管MMPs由于其降解细胞外基质的能力传统上与转移有关,但最近已经表明,该家族的几个成员在癌症进展的不同阶段提供了保护作用[27].其中一种抗肿瘤基质金属蛋白酶是MMP9,它由我们系统中的大麻素激活。虽然这种MMP可能促进某些实验性肿瘤的血管生成开关[例如:28]],临床研究证实了MMP9过表达与乳腺癌良好预后的相关性[29].这种保护作用可能源于其产生血管生成抑制剂的能力,如血管抑制素和肿瘤抑制素[27].这里显示的大麻素对MMP2的抑制,与Bifulco和同事先前在甲状腺癌细胞中报道的一致[30.和我们的神经胶质瘤研究小组[31],考虑到这种金属蛋白酶的高肿瘤水平与乳腺癌的不良预后相关,可能具有特殊的相关性[32].此外,乳腺肿瘤中MMP2水平的升高与ErbB2基因扩增和/或过表达有关[33].此外,Massagué和同事最近发现MMP2是介导乳腺癌转移到肺部的信号基因之一[34],即我们动物模型中的靶向转移器官。
基于大麻素使用的潜在抗肿瘤疗法可能受到其众所周知的精神作用的限制,如头晕、口干、疲劳、肌肉无力、兴奋、肌痛和心悸[6,35].尽管基于大麻素的疗法的收益/风险比可能很高,但应该采取不同的策略来避免或至少最小化其副作用。因为大部分——如果不是全部的话——大麻素的精神作用是由中央CB的激活产生的1受体(5,6],一个合理的方法是瞄准CB2受体选择性。这里,我们已经证明了CB2-选择性激动剂JWH-133与四氢大麻酚(一种CB1/ CB2-混合激动剂)减少肿瘤的产生和进展。此外,我们的结果还(i)表明,高级别erbb2阳性的人乳腺肿瘤表达CB的比例升高2受体,以及(ii)其中表达CB的比例非常低1受体。综上所述,这些数据表明CB活化2在这种特殊的患者群体中,治疗乳腺肿瘤将是一种有效的策略,而不会引发精神活性反应。肿瘤侵袭性与CB的相关性2受体在乳腺癌中的表达已被报道:缺乏雌激素或孕激素受体的肿瘤,与辅助治疗的低反应率相关,表达较高的CB2水平高于类固醇受体阳性病变[17].此外,erbb2阳性肿瘤也有CB升高2受体mRNA水平与低侵袭性和高反应性erbb2阴性对应物相比[17].有趣的是,该受体在未转化的乳腺组织中几乎不表达[数据在此和[17,21]]。
结论
总之,我们在erbb2阳性乳腺癌临床相关动物模型中获得的结果表明,这些高侵袭性和低反应性肿瘤可以用非精神活性CB有效治疗2-选择性激动剂而不影响周围的健康组织。
方法
组织微阵列分析
用10%多聚甲醛(PFA)固定3级浸润性乳腺导管癌87例,非肿瘤乳腺组织6例,石蜡包埋。组织芯片中分别包含两个具有代表性的组织核(直径1毫米)。该系列的主要临床病理及分子特征已有报道[36].组织切片在暴露于一抗之前进行热诱导抗原提取步骤。Anti-CB1受体抗体由肯·麦基博士,印第安纳大学,印第安纳州和抗- cb慷慨捐赠2受体抗体来自Affinity Bioreagents/Thermo Fisher Scientific, Rockford, Illinois。根据制造商说明,使用HercepTest (Dako, Carpenteria, CA)评估ErbB2表达。以DAB为显色剂,采用LSAB法(DAKO)进行免疫检测。在阴性对照中,一抗被省略或替换为不相关的抗体。两名独立的病理学家(J.P.和g.m. b)回顾了病例,当超过25%的肿瘤细胞显示出相应抗体的强烈免疫染色时,大麻素受体被评分为阳性。ErbB2染色评分根据HercepTest制造商的指导原则:0和1+为阴性,2+和3+为阳性,为ErbB2过表达。
动物和治疗
所有涉及动物的程序都是在康普顿斯大学动物实验委员会的批准下根据欧洲官方法规进行的。FVB/N-Tg(MMTVneu)202只Mul/J小鼠(通常被命名为MMTV-neu小鼠)来自杰克逊实验室(Bar Harbor, Maine)。女性每周两次触诊乳腺结节,在每只动物中发现第一个肿瘤时开始大麻素治疗。Δ9-四氢大麻酚(THC, The Health Concept, Richelbach, Germany)和jw -133 (John W. Huffman, Clemson University, South Carolina捐赠)分别用DMSO(分别为0.2 mg/μL和0.02 mg/μL)制备,并在添加5% BSA的PBS中稀释(肿瘤≤1000mm为100 μL/剂)3.对>1000 mm肿瘤200 μl/剂3.).大麻素瘤周治疗(0.5 mg THC或0.05 mg JWH-133/只/天,每周两次)持续90天,并且只治疗每只动物的第一个肿瘤。期间常规用外卡尺测量肿瘤,体积计算为(4π/3) ×(宽度/2)2×(长度/ 2)。治疗结束时,处死动物,收集肿瘤和器官。将肿瘤分为四部分:1)制备用于免疫荧光染色的组织切片[冷冻在tissue - tek (Sakura Finetek Europe, Zoeterwoude,荷兰)],2)制备用于苏木精-伊红染色的组织切片(固定在缓冲的4% PFA中),3)蛋白质提取(快速冷冻)和4)RNA分离(快速冷冻),并在-80°C保存直到分析(PFA固定的肿瘤部分除外,保存在室温下)。PFA固定脑、脾、肝、肾、肺。在异种移植实验中,皮下注射5 × 10诱导6周龄无胸腺雌性小鼠(Harlan Interfauna Iberica, Barcelona, Spain)皮下肿瘤5N202.1A细胞。当肿瘤达到ca.100毫米3.四氢大麻酚(THC) (0.5 mg/只/天)、JWH-133 (50 μg/只/天)、SR144528 (50 μg/只/天)、大麻素和SR144528的组合或载体处理3周,每周3次,测量,并按上述方法加工。在Akt相关实验中,一半动物注射稳定表达豆角酰化Akt的N202.1A细胞(N202.1A- pbabe - mir -Akt),另一半动物注射稳定表达相应空载体的N202.1A细胞(N202.1A- pbabe)。肿瘤用四氢大麻酚、JWH-133或载体治疗,并按照N202.1A异种移植的描述进行处理。
转移检测
目视分析收集的器官是否有宏观转移。通过对pfa固定石蜡包埋苏木精-伊红染色切片进行组织学分析来确定显微转移。使用常规x线设备(diagnostic 93,飞利浦医疗系统,埃因霍温,荷兰)和乳房x线摄影卡带(柯达MIN-R 2000屏幕卡带)和胶片(柯达MIN-R S胶片)(伊士曼柯达公司,罗切斯特,纽约)拍摄x线片以评估骨转移的存在。
细胞培养和活力
N202.1A细胞由Vincenzo Bronte博士(Istituto Oncologico Veneto, Padova, Italy)提供。该细胞系是从mmtv - nue来源的肿瘤中建立的[13].BT474、MDA-MB-231、MCF-7和SkBr3人类乳腺癌细胞、Jurkat人类白血病细胞和U373人类胶质母细胞瘤细胞来自ATCC-LGC (Barcelona, Spain)。所有细胞株都保存在添加10%胎牛血清(FBS)的DMEM中。在大麻素挑战之前,将细胞转移到低浓度(0.5%)fbs培养基中。根据制造商的说明,用3-4,5-二甲基噻唑-2,5-二苯四唑溴化噻唑蓝试验(Sigma,圣路易斯,密苏里州)测定细胞活力。
质粒,转染和感染
逆转录病毒感染使mir - akt稳定表达。N202.1A细胞用来自Phoenix生态细胞的上清液转导4小时,这些细胞之前转染了携带ha标记的myr-Akt的逆转录病毒载体(由马萨诸塞州哈佛大学的Pier P. Pandolfi博士提供)或相应的空结构物(pBABE)。用嘌呤霉素选择感染细胞。
免疫荧光分析
将Tissue-tek包埋的肿瘤切片固定在PFA中,并与anti-CB孵育1受体,anti-CB2受体,抗cd31 (Pharmingen/BD Biosciences,圣何塞,加利福尼亚州),抗cd45 (Pharmingen/BD Biosciences),抗ki67 (Neomarkers/Lab Vision,弗里蒙特,加利福尼亚州)或抗切割caspase 3(细胞信号技术,丹佛斯,马萨诸塞州)抗体。兔二级抗抗体AlexaFluor 594和AlexaFluor 488来自Invitrogen公司(Carlsbad, California)。细胞核用Hoescht 33342 (Invitrogen)染色。荧光图像使用Metamorph Premier Offline软件(Molecular Devices, Sunnyvale, California)获取。用ImageJ软件计算血管大小。
实时定量PCR (RTQ-PCR)和逆转录酶PCR (RT-PCR)
RNA用Trizol Reagent (Invitrogen)分离,包括DNase消化步骤,Real Star Kit (Durviz, Valencia,西班牙),cDNA用Transcriptor逆转录酶(Roche Applied Science, Penzberg,德国)获得。RTQ-PCR扩增引物为:小鼠CB1受体,义5'-GGGCAAATTTCCTTGTAGCA-3',反义5'-GGCTCAACGTGACTGAGAAA-3';鼠标CB2受体,义5'-ATTCAGGAGATCTGTTAAGACAAGG-3',反义5'-GACATCTATGAAGTTGAGGCAGTG-3';小鼠MMP2,义5'- gcgcttctcgaatccat -3',反义5'- gggtatccatctccatgctc -3';小鼠MMP9,义5'- acgacatagacggcatcca -3',反义5'- GCTGTGGTTCAGTTGTGGTG-3';大鼠ErbB2 (neu),义5'-GCTCAGAGACCTGCTTTGGA-3',反义5'-AGGAGGACGAGTCCTTGTAGTG-3';小鼠ErbB2,义5'-AACAGCTCGGAGACCTGCTA-3',反义5'-GTAGTGGGCACAAGCCTCA-3'。探针来自通用探针库(Roche应用科学)。以多种18S RNA为参考(义5'- GCTCTAGAATTACCACAGTTATCCAA-3',反义5'- AAATCAGTTATGGTTCCTTTGGTC-3')。RT-PCR所用引物为:小鼠MMP2,义5'- TCTGCGATGAGCTTAGGGAAAC-3',反义5'- gacatacatctttgcaggagacaag -3';鼠标MMP9,义5'- ggacgacgtgggctacgt -3',反义5'- CACGGTTGAAGCAAAGAAGGA-3'。GAPDH作为参考(义5'-GGGAAGCTCACTGGCATGGCCTTCC-3',反义5'-CATGTGGGCCATGAGGTCCACCAC-3')。
Western blot分析
来自肿瘤和细胞系的细胞裂解物进行SDS-PAGE,蛋白质转移到聚偏氟乙烯膜上。用以下抗体培养印迹:anti-CB1受体,anti-CB2受体(Affinity Bioreagents),抗mmp9 (Chemicon International INC, Temecula, California),抗erbb2 (Santa Cruz Biotechnology, Santa Cruz, California),抗phospho- akt (Ser473),抗akt,抗phospho- s6核糖体蛋白(Cell Signaling)和抗α-微管蛋白(Sigma)。使用Amersham增强化学发光检测试剂盒(GE Healthcare, Uppsala, Sweden)获得荧光图,使用Quantity One软件(Bio-Rad)进行密度分析。
MMP活性测定
采用明胶酶谱法测定MMP2(明胶酶A)和MMP9(明胶酶B)活性。简单地说,SDS-PAGE在0.1%明胶的存在下运行,用含有2.5% Triton X-100的缓冲液洗涤,并在37°C下在50 mM Tris pH 7.5, 150 mM NaCl, 10 mM氯化钙中孵育过夜2, 0.1% Triton X100。然后用考马西蓝染色凝胶,并通过上述密度分析定量消化带。
统计分析
常规采用学生纽曼-基尔斯检验的事后分析方差分析。为了分析转移和每只动物的肿瘤数量,Pearson Х2使用Test。确定免疫组化(CB1和CB2表达)和临床病理(ErbB2)数据,Х2采用耶茨修正法或费雪精确检验法。使用SPSS for Windows程序(SPSS, Inc., Chicago, IL, version 17.0)进行分析。所有p值都是双面的。除非另有说明,数据均以均数±s.e.m表示。
参考文献
Baselga J, Swain SM: ERBB2和ERBB3的研究进展。中华癌症杂志,2009,9:463-475。10.1038 / nrc2656
孙晓明,王晓明,王晓明,等。erbb2基因诱导乳腺癌的研究进展。中华癌症杂志,2007,7:389-397。10.1038 / nrc2127
Di Cosimo S, Baselga J:乳腺癌靶向治疗:我们现在在哪里?中华肿瘤学杂志,2008,44:379 - 379。10.1016 / j.ejca.2008.09.026
Hynes NE, Lane HA: ERBB受体和癌症:靶向抑制剂的复杂性。中华癌症杂志,2005,5:341-354。10.1038 / nrc1609
Di Marzo V:针对内源性大麻素系统:增强还是减少?中国药物学杂志,2008,7:438- 438。10.1038 / nrd2553
Pertwee RG:利用大麻素受体激动剂作为药物的新兴策略。中国药物学杂志,2009,29(3):349 - 349。10.1111 / j.1476-5381.2008.00048.x
大麻素:潜在的抗癌剂。中华癌症杂志,2003,3:745-755。10.1038 / nrc1188
Sarfaraz S, Adhami VM, Syed DN, Afaq F, Mukhtar H:大麻素治疗癌症:进展和希望。癌症决议,2008,68:339-342。0008 - 5472. - 10.1158 / - 07 - 2785
王志刚,王志刚,王志刚,王志刚。转基因小鼠乳腺上皮中神经原癌基因的表达与转移性疾病的相关性研究。美国国家科学研究院。1992, 29(3): 377 - 382。10.1073 / pnas.89.22.10578
钱伯斯AF,新郎AC,麦克唐纳IC:癌细胞在转移部位的扩散和生长。中华肿瘤学杂志,2002,23(2):366 - 366。10.1038 / nrc865
Moasser MM:癌基因HER2:其信号转导功能及其在人类癌症发病机制中的作用。中国生物医学工程学报。2007,26:6469-6487。10.1038 / sj.onc.1210477
Manning BD, Cantley LC: AKT/PKB信号:导航下游。电子学报,2007,29(3):344 - 344。10.1016 / j.cell.2007.06.009
Nanni P, Pupa SM, Nicoletti G, De Giovanni C, Landuzzi L, Rossi I, Astolfi A, Ricci C, De Vecchi R, Invernizzi AM: p185(neu)蛋白是转基因乳腺癌肿瘤和锚泊独立生长所必需的,而不是细胞增殖。中华肿瘤学杂志,2002,23(3):357 - 357。10.1002 / 1097 - 0215 (20000715) 87:2 < 186:: AID-IJC5 > 3.0.CO; 2
Dean-Colomb W, Esteva FJ: her2阳性乳腺癌:赫赛汀及其他药物。中华癌症杂志,2008,44:2806-2812。10.1016 / j.ejca.2008.09.013
Hutchinson JN, Jin J, Cardiff RD, Woodgett JR, Muller WJ: Akt-1 (pkb - α)的激活可促进erbb -2介导的乳腺肿瘤发生,但抑制肿瘤侵袭。癌症法案2004,64:3171-3178。10.1158 / 0008 - 5472. - 03 - 3465
Caffarel MM, Moreno-Bueno G, Cerutti C, Palacios J, Guzman M, Mechta-Grigoriou F, Sanchez C: JunD参与了Delta(9)-四氢大麻酚对人乳腺癌细胞的抗增殖作用。中国生物医学工程学报。2008,27:5033-5044。10.1038 / onc.2008.145
Caffarel MM, Sarrio D, Palacios J, Guzman M, Sanchez C: delta9 -四氢大麻酚通过调控Cdc2抑制人乳腺癌细胞周期进展。癌症法案,2006,66:6615-6621。10.1158 / 0008 - 5472. - 05 - 4566
De Petrocellis L, Melck D, Palmisano A, Bisogno T, Laezza C, Bifulco M, Di Marzo V:内源性大麻素anandamide抑制人乳腺癌细胞增殖美国国家科学研究院。1998, 35(4): 379 - 379。10.1073 / pnas.95.14.8375
Laezza C, Pisanti S, Crescenzi E, Bifulco M:在人乳腺癌细胞中,Anandamide抑制Cdk2并激活Chk1导致细胞周期阻滞。清华大学学报(自然科学版),2006,29(4):344 - 344。10.1016 / j.febslet.2006.09.074
Ligresti A, Moriello AS, Starowicz K, Matias I, Pisanti S, De Petrocellis L, Laezza C, Portella G, Bifulco M, Di Marzo V:植物大麻素的抗肿瘤活性,重点研究大麻二酚对人乳腺癌的影响。中国药物学杂志,2006,29(3):344 - 344。10.1124 / jpet.106.105247
Qamri Z, Preet A, Nasser MW, Bass CE, Leone G, Barsky SH, Ganju RK:合成大麻素受体激动剂抑制乳腺癌肿瘤生长和转移。中华癌症杂志,2009,8:317 - 329。1535 - 7163. - 10.1158 / mct - 09 - 0448
Melck D, De Petrocellis L, Orlando P, Bisogno T, Laezza C, Bifulco M, Di Marzo V:内源性大麻素抑制神经生长因子Trk受体和催乳素受体可抑制人乳腺癌和前列腺癌细胞增殖。中华内分泌杂志,2000,29(4):344 - 344。10.1210 / en.141.1.118
Melck D, Rueda D, Galve-Roperh I, De Petrocellis L, Guzman M, Di Marzo V: cAMP/蛋白激酶A通路和丝裂原活化蛋白激酶参与anandamide在人乳腺癌细胞中的抗增殖作用中国农业科学,1999,30(4):344 - 344。10.1016 / s0014 - 5793 (99) 01639 - 7
Frese KK, Tuveson DA:最大化小鼠癌症模型。中华癌症杂志,2007,7:645-658。10.1038 / nrc2192
王东,王华,宁伟,王伟,王伟,王伟,杜波依斯RN:大麻素受体1缺失加速肠道肿瘤生长。癌症决议案,2008,68:6468-6476。10.1158 / 0008 - 5472. - 08 - 0896
Izzo AA, Aviello G, Petrosino S, Orlando P, Marsicano G, Lutz B, Borrelli F, Capasso R, Nigam S, Capasso F, Di Marzo V:增加内源性大麻素水平减少小鼠结肠癌前病变的发展。中华药理学杂志,2008,44(3):349 - 349。10.1007 / s00109 - 007 - 0248 - 4
Lopez-Otin C, Matrisian LM:蛋白酶在肿瘤抑制中的新角色。中华癌症杂志,2007,7:800-808。10.1038 / nrc2228
Mira E, Lacalle RA, Buesa JM, de Buitrago GG, Jimenez-Baranda S, Gomez-Mouton C, Martinez AC, Manes S:分泌MMP9比结合在肿瘤细胞表面的组成型活性MMP9更有效地促进血管生成。中国生物医学工程学报,2004,29(3):344 - 344。10.1242 / jcs.01035
Scorilas A, Karameris A, Arnogiannaki N, Ardavanis A, Bassilopoulos P, Trangas T, Talieri M:基质金属蛋白酶-9在人乳腺癌中的过表达:淋巴结阴性患者的潜在有利指标。中华肿瘤学杂志,2001,34(4):344 - 344。10.1054 / bjoc.2001.1810
Pisanti S, Borselli C, Oliviero O, Laezza C, Gazzerro P, Bifulco M:内源性大麻素anandamide的抗血管生成活性:与其抑制肿瘤疗效的相关性。中国生物医学工程学报,2007,27(3):344 - 344。10.1002 / jcp.20954
Blazquez C, Salazar M, Carracedo A, Lorente M, Egia A, Gonzalez-Feria L, Haro A, Velasco G, Guzman M:大麻素通过下调基质金属蛋白酶-2表达抑制胶质瘤细胞侵袭。癌症决议2008,68:1945-1952。0008 - 5472. - 10.1158 / - 07 - 5176
杜德克,李志强,李志强:蛋白酶与肿瘤转移的临床意义。中华医学杂志,2005,17:545-550。10.1097/01. cco.0000180435.39614.63
Jezierska A, Motyl T:基质金属蛋白酶-2参与乳腺癌进展:一个小综述。中华医学杂志,2009,15:RA32-40。
Minn AJ, Gupta GP, Siegel PM, Bos PD, Shu W, Giri DD, Viale A, Olshen AB, Gerald WL, Massague J:介导乳腺癌肺转移的基因。自然科学学报,2005,36(4):518-524。10.1038 / nature03799
Guzman M, Duarte MJ, Blazquez C, Ravina J, Rosa MC, Galve-Roperh I, Sanchez C, Velasco G, Gonzalez-Feria L: delta9 -四氢大麻酚治疗复发性多形性胶质母细胞瘤的初步临床研究。中华肿瘤学杂志,2006,29(3):349 - 349。10.1038 / sj.bjc.6603236
Natrajan R, Lambros MB, Rodriguez-Pinilla SM, Moreno-Bueno G, Tan DS, Marchio C, Vatcheva R, Rayter S, Mahler-Araujo B, Fulford LG: 3级浸润性导管乳腺癌的Tiling路径基因组分析。中国临床癌症杂志,2009,15:2711-2722。10.1158 / 1078 - 0432. - ccr - 08 - 1878
确认
我们非常感谢Vincenzo Bronte博士(Istituto Oncologico Veneto, Fondazione IRCCS, Padova, Italy)捐赠的N202.1A细胞。我们也要感谢我们实验室的成员,特别是María Salazar, Sonia Hernández-Tiedra和Marta Cifali,他们对这项工作的技术支持和批判性讨论。这项研究得到了来自Fondo de Investigaciones Sanitarias (PI080253给CS, PI086080971给JP), Ministerio de Ciencia e Innovación (SAF2006-00918给MG, SAF2007-63075给GMB, SAF2008-00649给SM), RETICS (RD06/0020/0013给JP), Fundación Mutua Madrileña(给CS和GMB), Consejería de Innovación Junta de Andalucía(给JP), Marató TV3基金会(053132给SM)和GW Pharmaceuticals/Otsuka Pharmaceuticals(给CS)的资助。MMC是Fundación Ferrer para la Investigación奖学金的获得者。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
MMC参与了实验设计,并进行了动物处理、样本收集和处理(MMP活性测定、定量pcr、Western blot分析、免疫荧光实验和细胞培养方法)和统计分析。CA和EP-G参与动物处理、样品采集、定量pcr和Western blot分析。EM参与了本研究的设计,并进行了免疫荧光实验。CC参与了动物处理和免疫荧光实验。JMF对动物肿瘤和转移进行了组织病理学分析。GM-B执行并分析了人体样本的组织微阵列。IG-R通过磁共振成像分析MMTV-neu小鼠的转移。JP对人类乳房样本进行了组织病理学表征。SM参与了研究的设计。MG对研究的概念和设计做出了贡献,并对手稿进行了批判性的修改。 CS conceived the study, elaborated its design, coordinated the research and wrote the manuscript. All authors read and approved the final manuscript.
电子辅助材料
12943 _2010_711_moesm1_esm.pdf
附加文件1:数字S1-S5.补充图1:MMTV-neu小鼠自发发生乳腺肿瘤和肺转移。补充图2:大麻素抑制乳腺肿瘤生长在活的有机体内补充图3:mmtv -neu来源的肿瘤表达大麻素受体补充图4:大麻素调节MMP2和MMP9的表达补充图5:人类erbb2阳性乳腺癌细胞系对大麻素敏感(PDF 258 KB)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
卡夫雷尔,m.m.,安德拉达斯,C.,米拉,E.。et al。大麻素通过抑制Akt抑制erbb2驱动的乳腺癌进展。摩尔癌症9, 196(2010)。https://doi.org/10.1186/1476-4598-9-196
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1476-4598-9-196
关键字
- 曲妥珠单抗
- ErbB2表达式
- 浸润性乳腺导管癌