摘要
背景
转座因子(te)是病毒起源的重复序列,几乎占人类基因组的一半。这些元素在细胞内受到严格控制,如果被激活,它们可以引起基因调控和免疫病毒反应的变化,这些变化与人类几种慢性炎症性疾病有关。由于氧化剂是te的有效激活剂,并且氧化损伤是与特发性肺纤维化(IPF)相关的主要危险因素,我们假设te可能参与基因表达的调节,从而导致IPF病例的炎症。IPF是一种致命的肺部疾病,涉及肺泡组织逐渐被纤维化疤痕取代以及下呼吸道炎症细胞的积累。虽然已知IPF的发生是年龄、环境风险因素(即氧化应激)和遗传之间复杂相互作用的结果,但这些因素对该疾病的相对贡献仍不清楚。为了确定TEs是否与IPF相关,我们比较了从健康供体和IPF患者获得的肺细胞的基因转录谱和TEs。
结果
我们使用已发表的包含24名受试者(16名供体和8名IPF患者)的大量RNA-seq数据集(包括每个受试者的三种肺细胞类型)以及包含16名受试者(8名供体和8名IPF患者)的scRNA-seq数据集来量化TE和基因表达水平。
我们在IPF患者的肺泡II型肺细胞和肺泡巨噬细胞中发现TE失调的证据。此外,IPF中LINE1家族元件的激活与TE细胞调节因子(MOV10、IFI16、SAMHD1和APOBECG3)、干扰素刺激基因(ISG15、IFI6、IFI27、IFI44和OAS1)、趋化因子(CX3CL1和CXCL9)和白细胞介素(IL15RA)的表达增加有关。我们还提出TE抑制可能参与先前报道的IPF候选基因(MUC5B、CHL1、SPP1和MMP7)的调控。
结论
基于我们的研究结果,我们提出TE抑制在基因表达调控中起着重要作用,也可以促进炎症过程的募集和免疫平衡的破坏,从而导致IPF的慢性炎症。
背景
超过一半的人类基因组是由称为转座因子(te)的重复序列组成的。基因组的这些重复区域被组织成DNA转座子和反转录转座子,前者通过剪切和粘贴机制繁殖,后者通过复制和粘贴机制移动[1,2].反转录转座子是人类中最常见的te,它们进一步分为长末端重复序列(LTR)超家族,包括内源性逆转录病毒(ERV),以及非LTR超家族,包括短插入元件(SINEs)和长插入元件(LINEs)。这些超家族中的每一个都包含不同的重复序列家族,只有来自L1、Alu和SVA家族的非ltr元件仍然可以在人类基因组中转座[3.].TE转位可以通过多种不同的方式破坏基因组的稳定,包括基因破坏、基因转录调节和mRNA加工等多种机制[4,5].考虑到TEs的病毒起源,它的过度表达也可以模拟病毒感染,从而引发先天免疫反应,导致慢性炎症[6,7].尽管TE活性在体细胞的转录和转录后水平受到严格调控,但由于DNA甲基化、组蛋白修饰或参与TE调控的基因突变的变化,可能会发生异常[8,9,10].值得注意的是,细胞因子水平升高和TE表达增加引起的慢性炎症与多种人类疾病有关,包括多发性硬化症、系统性狼疮、侧索硬化症、Rett综合征、aicardii - gouti
IPF是一种不可治疗的炎症性肺部疾病,涉及肺泡组织逐渐被纤维化疤痕取代以及下呼吸道炎症细胞的积累[13].ipf相关基因变异的检测增强了我们对遗传风险因素在疾病风险中所起作用的理解。然而,IPF的根本原因尚不清楚,关于危险因素(如吸烟、病毒感染、氧化应激、年龄)和遗传之间的复杂相互作用如何导致IPF发病的关键问题仍然存在[14].该发病机制的一个重要特征是上皮细胞群的转移,即I型肺泡(AT1)上皮细胞受损,上皮表面被II型肺泡(AT2)上皮细胞和细支气管上皮细胞填充。IPF患者的下呼吸道主要由肺泡巨噬细胞(AMs)和中性粒细胞组成,它们是细胞防御的第一反应者,在吸收通过呼吸系统机械屏障的有害颗粒方面起着重要作用。当被激活时,AMs会自发释放出有毒的氧化剂(即H2O2),这对肺泡脆弱的结构造成了持续的氧化负担,因此,这是IPF病例中AT2上皮细胞损伤的最重要机制之一[15,16].
因为氧化剂是TEs的有效活化剂[17],我们假设,暴露于氧化应激环境会在肺细胞中营造一个宽松的环境,从而释放出te,而te会改变邻近基因的表达,并且由于其“病毒模仿”的潜力,也会导致慢性炎症。为了验证这一假设,我们使用了已发表的来自健康供体和肺纤维化患者的肺细胞转录组谱[18].之所以选择这一数据,是因为它允许对与疾病高度相关的细胞内的单个细胞群中的TE活性进行分析。我们利用AT2、AM和全肺细胞的大量RNA测序数据确定了IPF患者TE的上调,并利用单细胞RNA测序(scRNA-seq)数据证实了单个细胞簇中L1 TE家族TE活性的上调。这是第一个调查并将TE活动与IPF联系起来的研究。此外,该研究表明TE抑制可能参与了先前报道的IPF候选基因的调控,并且活性TE可能参与IPF病例下呼吸道的永久性炎症。
结果
TE表达的增加与细胞TE抑制剂的激活和先天免疫反应呈正相关,与IPF中的自噬呈负相关
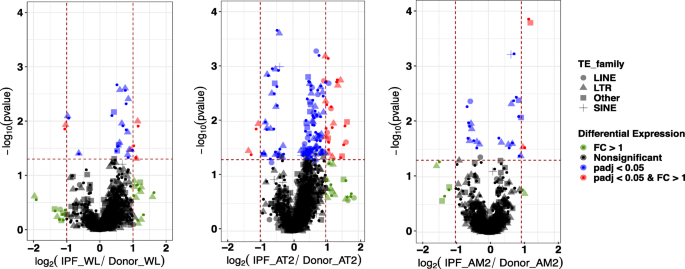
为了确定TE在IPF中的表达变化,我们从先前发表的14份供体肺活检的大量RNA测序报告中量化了TE的表达,并将其与8名移植受者的外植体进行了比较[18[补充表]1)。我们首先比较了流式细胞术分类的am、AT2和全肺细胞(WLs)中IPF患者和供者TE家族的基因表达和表达。TE家族被定义为在整个基因组中具有相似序列的TE群体(亚家族),因此,它们的表达是按此类群体的数量平均的。
TE家族的表达变化最大的是AT2细胞(72个向上,22个向下),最大数量的变化出现在ltr -TE中(图2)。1、表1,2及补充表2a - c)。代表不同细胞类型混合物的WL表现出18个TE亚家族差异(14个向上,4个向下),最大数量的变化再次出现在ltr -TE中。最后,AMs中的TE活性具有17个TE亚家族差异(11个上升,6个下降),主要是在ltr中。还发现了一些其他TE表达变化,代表DNA转座子,这些转座子在人类TE家族中较少。基因表达变化趋势与TE变化相同,AT2细胞表达量最高(4131),WL细胞次之(1170),AMs细胞次之(1033)(表1)1和2)。我们做了Fisher精确检验[19]来评估差异表达的亚家族是否在WL、AT2或AM细胞中富集,我们没有发现任何显著的富集(表2)2)。有趣的是,在人类中负责大部分反转录转位活性的LINE元件仅在AT2细胞中上调(图2)。1、表1和2)。为了证实我们的发现,我们还使用REdiscoverTE[20.],并验证了AT2细胞中TE变化最多,且各个亚家族的变化相似(补充图)1、补充表2d)。AT2细胞是IPF损伤的主要靶点,AT2细胞衰老和炎症过程对纤维化肺疾病的发展至关重要[21,22,23,24,25].此外,LINE TE家族,特别是自主(从基因间区域表达,即不是从基因区域表达,因此不依赖于基因表达)L1HS亚家族的上调,对衰老相关炎症有明确的影响[6,7].因此,我们首先测试了AT2细胞中自主L1HS亚家族上调的证据。为了区分自主TE表达与与宿主基因共表达或内含子保留,我们使用REdiscoverTE[20.].该计算工作流程旨在根据基因组位置(内含子、外显子和基因间)在家族水平上分离reads,并专门模拟自主TE表达。我们观察到IPF细胞外显子区差异表达的TE家族最多(65个),其次是基因间区(57个)和内含子区(32个)(补充表)3.如果只考虑sin, LINE和LTR家族,则A-D)。考虑到区分自主表达和宿主基因表达的短测序读取的技术挑战,我们将分析限制在基因间区域的差异表达[20.,26].我们在IPF细胞的基因间区检测到16个LINE亚家族、38个LTR家族和3个SINE家族的过表达(补充表)3.C).这些都是进化上古老的te [27];它们被排除在这个特殊的分析之外,因为它们在细胞衰老过程中与炎症的关系在功能上还没有得到证实。重要的是,L1HS家族仅在IPF细胞的基因间区显著上调,而L1HS家族代表了人类特异性和逆转录能力强的TE元件。2a、补充表3.C) (30.].这表明L1HS的自主表达可能与IPF中涉及的细胞过程有关。在AT2中观察到类似的差异基因间TE表达模式乡绅定量方法(详见材料与方法)(补充表)3.D和表3.E).各组间L1HS表达量乡绅量化方法差异仅显著(p= 0.037, logFC = 1.16),但经过多次测试校正后没有(调整后的BH p = 0.11)。(补充图2)。这种差异是不同的绘图和量化方法的结果乡绅和REdiscoverTE。
TE家族在个体细胞类型和全肺组织中的表达变化。一个全肺组织(WL)的大量rna测序。b流式细胞术分选肺泡II型细胞(AT2)的大量rna序列分析。c流式细胞术分选肺泡巨噬细胞(AM)的大量rna序列。的读取计数来确定TE表达式乡绅工具套件,而差异表达分析使用DESeq2x轴表示日志2IPF患者与供者TE亚家族表达的比值。y轴表示调整后的值p基于-log的-value10。红色表示fold expression change (FC) > 1且p.adjust < 0.05的TE亚家族(用两条纵虚线和横虚线表示)。蓝色为调整后的tep-value (p.adjust < 0.05, BH adjusted),绿点代表FC > 1的te。黑色表示没有显著的p.调整值或FC高于1的变化。不同的形状代表不同的TE族
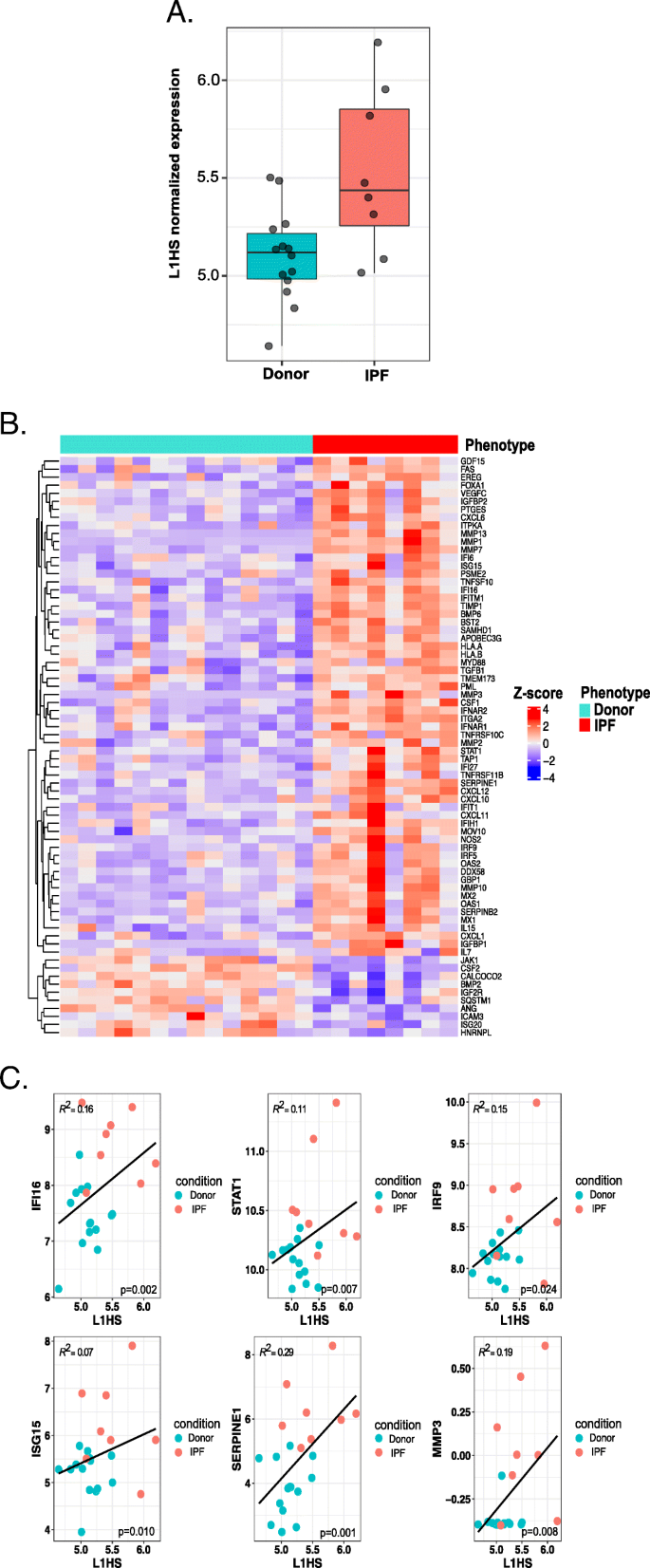
在AT2细胞中,L1HS基因间表达与IPF表型和与L1HS活性功能相关的基因表达相关。一个L1HS在供体和IPF样品中的基因间表达REdiscoverTE方法。绿色:供体样本。红色:IPF样品。x轴表示组;y轴表示对数归一化L1HS表达式值。各组间L1HS表达差异有统计学意义DESeq2分析(p = 0.001)。b与L1HS活性功能相关的四个基因组差异表达基因热图[28,29: I型干扰素(IFN-I, 84个基因中有33个)、衰老相关分泌表型基因(SASP, 85个基因中有34个)、L1转录调控基因(2个基因中有1个)和L1转录后调控基因(17个基因中有6个)。热图颜色表示对数归一化基因表达的z分数。y轴代表四个基因集。样品按其表型在x轴上分组。cL1HS与功能上与L1HS活性相关的基因共表达相关的例子来自四个基因集:if - i途径(DDX58, IFI16, STAT1, IRF9, ISG15),衰老相关分泌表型(SASP)基因(MMP3, SERPINE 1), L1转录调节基因(FOXA1)和L1转录后调节基因(SAMHD1, MOV10, APOBEC3G, CALCOCO2)。图中显示了AT2细胞中作为因变量(y轴)的对数归一化基因表达与作为自变量(x轴)的L1HS的线性关系。表型组(IPF/供体)作为协变量纳入模型。(模型:基因表达∼L1HS表达+组(IPF/Donor)。颜色代表表型(绿色:供体;红色:IPF),灰线为线性模型的最佳拟合。R2给出了各基因- l1hs关系的线性模型拟合值。各关系的BH p调整值(p) < 0.05;p表示基因表达与L1HS表达的关系。所有基因检测结果汇总在补充表中4c
AM和WL细胞也检测了L1HS基因间表达,在IPF和供体细胞之间未检测到差异表达(数据未显示)。
TE受到多种机制的严格控制,包括TE启动子甲基化,以及参与TE转录和转录后控制的抑制性宿主因子[31].这些控制点的改变可能会激活TEs并引起经常伴有炎症的病理状态[6,11,20.,32].然而,IPF中细胞向疾病状态的转化也由这些过程补充[21,22,33].因此,我们确定了L1HS的上调与与L1HS活性功能相关的基因表达之间是否存在关联[31,34].我们从已发表的文献中检测了四个基因集:I型干扰素(IFN-I, 84个基因)、衰老相关分泌表型(SASP)基因(85个基因)、L1转录调控基因(2个基因)和L1转录后调控基因(17个基因)。
其中共有73个基因在IPF细胞和供体细胞之间存在差异表达;4组188个基因中,63个基因表达上调,10个基因表达下调(图2)。2c和补充表4c)。我们的线性模型分析显示,L1HS与60个不同于IPF和供体细胞的基因之间存在显著关联(补充表)4C)。
在这里,我们强调了L1HS与一些众所周知的功能重要基因之间的相关性。我们观察到L1HS与叉头盒A1 (FOXA1)转录因子(TF)呈正相关,这对L1HS的表达至关重要;这一发现进一步证明了L1HS在IPF细胞中的活性表达(图2)。2b和c,补充表4C) (6].然而,在细胞质中降解L1 RNA中起重要作用的转录后调节因子CALCOCO2 (NDP52) [35],在IPF患者中下调,与L1HS的表达呈负相关(图2)。2b和c,补充表4C).这可能提示IPF细胞中不受控制的L1HS积累。参与IFN-I反应的基因(如DDX58 (RIG-I)、IFI16、STAT1、IRF9、ISG15),对L1胞浆积累的识别和炎症过程的下游激活也显示出与L1HS呈正相关[31(图。2b和c,补充表4这进一步表明IPF细胞的炎症过程与L1HS表达增加有关。
我们还测试了作为L1HS转录后调节因子的基因,发现其中三个在IPF细胞中呈正相关(图2)。2[a] [c] [c,APOBEC3G],补充表4- c) [31].其中一些L1抑制剂(即, samhd1, mov10,和APOBEC3G)被ifn激活[28].因此,干扰素信号的增加可能激活了这些L1抑制剂,以对抗AT2细胞中L1HS的高表达。
最后,在IPF细胞中,SASP标记(如SERPINE1和MMP3)也与L1HS呈正相关[6(图。2c、补充表4- c)。这是特别有趣的,因为先前的研究表明,在IPF AT2衰老细胞中SERPINE1增加[36].根据IPF患者和动物模型的研究结果,MMP3表达的增加也是IPF发病的关键[37].我们发现供体细胞中MMP3的表达极低,而IPF细胞中MMP3的表达水平很高,这与L1HS呈正相关。这进一步表明,IPF患者的衰老细胞也表现出L1HS活性的增加。
基因座水平的TE表达与IPF相关,也具有细胞类型特异性
通过在细胞中积累内在表达的TEs来诱导细胞衰老中的免疫反应并不是TEs的唯一有害影响。事实上,TEs可以提供不同的启动子或聚腺苷化信号,以及不同的剪接受体和供体位点,这可以强烈地改变宿主的基因表达模式[5,38].此外,一些基于TE与近端基因表达之间关联的方法已被开发为检测疾病候选基因的潜在工具[39].
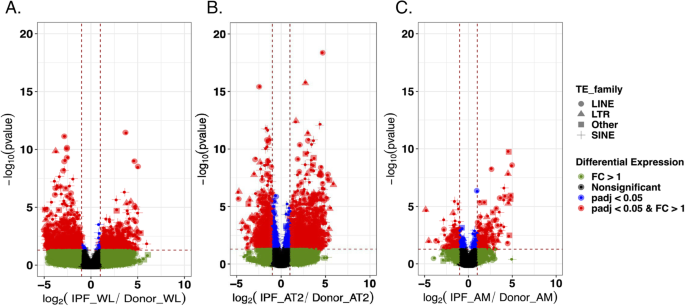
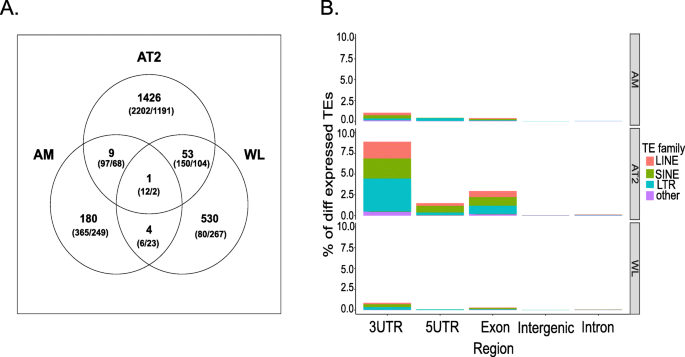
在这里,我们的目的是确定基因附近或基因内的位点特异性TE表达是否可以解释该基因的表达差异,以及供体和IPF细胞之间的关系是否不同。我们量化了三种细胞类型中所有TE家族个体基因组位置TE表达的变化,并将这些差异与邻近基因表达联系起来。我们再次在AT2细胞中发现了最多的变化(1489个向上,1149个向下),而WL也有大量的变化,代表了1341个TE位点(588个向上,753个向下)(图2)。3.、补充表5)。最后,在AM中发现359个TE位点(193个向上,166个向下)表征TE活性。我们首先将每一种细胞类型中IPF患者和健康供者之间的上调TE位点变化以及基因变化相交(图2)。4a).该分析显示,大多数变化是独特的,仅存在于单个细胞类型中(AT2 = 1426, AM = 180, WT = 530),尽管AT2和WL之间有53个TE变化,WL和AM之间有4个,AM和AT2之间有9个,而三个比较中有一个变化是共同的。这表明TE活性对AT2和AM细胞的潜在强烈影响可能会影响与IPF相关的基因表达,而在分析异质WL细胞群时未检测到这一点。不同细胞类型之间共有的基因表达变化数量也呈现出类似的趋势,其中AT2中表达的基因数量最多(3826),其次是AM(822)和WT(644)(图2)。4一个)。
细胞类型和全肺组织中IPF患者与供者TE位点的差异调节。一个全肺组织的大量rna测序。b流式细胞术分选肺泡II型细胞(AT2)的大量rna序列分析。c流式细胞术分选肺泡巨噬细胞(AM)的大量rna序列。的读取计数来确定TE表达式乡绅工具套件,而差异表达分析使用DESeq2x轴表示日志2IPF患者与供者TE基因座表达的比值。y轴表示调整后的值p基于-log的-value10。红色表示折叠表达变化(FC) > 1, p.adjust < 0.05 (BH调整)的TE位点(用两条垂直虚线和水平线表示)。蓝色为调整后的tep-value (p.adjust < 0.05),绿点表示FC > 1的te。黑色表示没有显著的p.adjust值变化或FC高于1的变化。不同的形状代表不同的TE族
接下来,我们检查了TE在基因组区域的变化分布。为此,所有差异表达的TE变化被归类为属于5'UTR, 3'UTR,外显子,内含子或基因间区域。这些分析揭示了与三种比较(AT2、AM和WL)所观察到的相同的变化模式。4b、补充表5),其中3'UTR区域的TE转录变化最多,而内含子和基因间区域的TE转录变化最少。与外显子以及外显子-内含子、外显子-5 ' utr和外显子-3 ' utr区域重叠的TE变化被排除在进一步的分析之外,因为它们最有可能与转录噪声有关。
TE的表达与几种IPF候选基因的表达相关
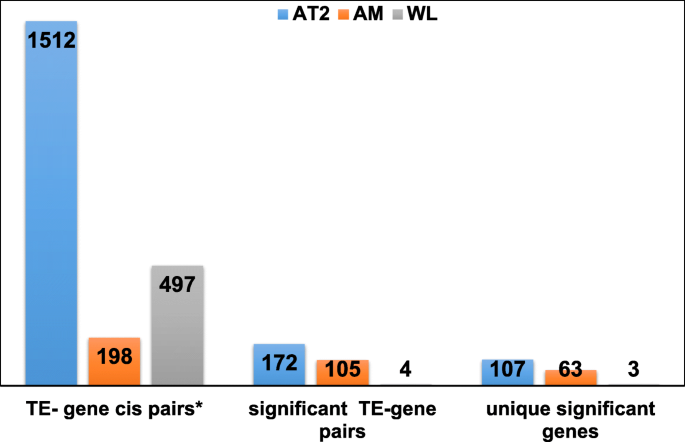
为了进一步说明位点特异性TE的重要性,我们测试了基因内和基因间TE上调位点(不包括外显子)对基因转录调控的影响。由于每个基因与每个TE位点的两两比较发现了大量变化,其中一些变化难以解释,因此我们将重点放在与其相邻基因匹配的TE(顺式相互作用)上,并研究TE表达是否预测附近基因的表达。AT2细胞中有1512对(在3826个基因和2638个TEs之间进行的10,092,988次试验中,有7.80%是显著对),AM细胞中有198对(在822个基因和359个TEs之间进行的295,098次试验中,有1.4%是显著对),WL细胞中有497对(在644个基因和1341个TEs之间进行的863,604次试验中,有0.04%是显著对)符合cis标准(图2)。5, TE-基因顺式对*)。我们共鉴定出172、105和4对显著的基因- te对(p< 0.05),分别与我们在AT2、AM2和WL中的cis子集相比较。在某些情况下,有多个TE与同一基因的表达有关。因此,我们进一步将差异分类为转录与te显著相关的独特基因的数量。这种分类导致在AT2细胞中共鉴定出107个基因,在AM细胞中鉴定出63个基因,在WL细胞中鉴定出3个基因,这些基因具有与TEs相关的转录模式,并且在IPF患者与健康供者之间存在差异(图2)。5)。有趣的是,尽管在WL比较中存在大量te基因对,但只观察到非常少的显著差异(3),这再次表明在异质细胞群体中可能遗漏了重要的特征。我们对AT2细胞中与TE表达相关的基因进行了基因本体富集分析,确定了纤毛运动以及轴突和细胞器组装相关过程(FDR < 0.05)(表1)3.)。这表明te的激活可以导致可能参与细胞身份改变的基因的激活。在AM细胞中,te相关基因的表达与免疫相关的细胞过程有关。
在AT2细胞中发现的与基因调控相关的te大部分位于内含子(75),其次是3 ' utr区(82)、基因外(12)和5'UTR区(3)(补充表)6一、表4)。SINE (Alu)元件在AT2细胞中最常被发现与基因表达相关,它们大多嵌入在基因的3'UTR区域。几个被发现与TEs显著相关的基因代表了重要的IPF候选基因,这些基因已在多个全基因组关联研究或与IPF相关的功能研究中被鉴定出来[41].例如,我们发现IPF患者和健康供者之间TE (chr11|1,253,519|1,253,937|MLT1C: erv1 - malr:LTR)的表达变化为3.88倍,位于33和34外显子之间,这与IPF中MUC5B基因的高表达显著相关(补充表)6此外,IPF组MUC5B与TE表达的关系与供体组明显不同(图2)。6A, p.调整= 0.0284)。这表明TEs在该基因的调控中发挥了潜在的作用,而该基因又在粘蛋白排泄中发挥了重要作用,并在IPF发病机制中发挥了重要作用[42,43].值得注意的是,我们发现了三个核心IPF基因标记之一,即细胞粘附分子L1样(CHL1)基因与L1PA6 TE (chr3|367,661|374,053|L1PA6:L1:LINE)之间的关联(补充表)6然而,另外两个te (chr3|391,232|391,535|AluSz:Alu:SINE, chr3|408,347|408,547|MIRc:MIR:SINE|342)也显示出与CHL1表达的显著关联。为了确定哪一种te对CHL1基因表达的贡献最大,我们在线性模型中使用了所有三种te,然后计算了它们在影响CHL1表达方面的相对重要性。包含所有三个te的模型解释的方差比例为86.09%。此外,每个TE解释了约20%的方差,而代表表型的组协变量解释了约25%的方差,从而表明每个TE对CHL1基因表达的贡献相似。在IPF组和供体组中,L1PA6- CHL1关系的相关斜率也有显著差异(图2)。6a, p.adjust = 0.0019),另外两个te (AluSz, MIRc)与CHL1相关。这进一步表明IPFs中邻近te可能调控CHL1。
serpin家族B成员3 (SERPINB3)是另一个重要的IPF候选基因,我们发现IPF患者和健康供者之间基因表达变化4.23倍,这与LINE TE元件(chr18|63,651,629|63,653,187|L1MA8:L1:LINE)的4.21倍变化相关(补充表)6A).该元件位于基因下游约2kb处。谷胱甘肽s -转移酶α 2 (GSTA2)在IPF患者中也表现出上调,其表达与位于该基因下游783 bp的LTR5A TE (chr6|52,748,278|52,749,305|LTR5A:ERVK:LTR)相关。6a、补充表6A)。尽管TEs显著预测SERPINB3和GSTA2基因的表达,但相关性斜率检验表明,IPF和供体之间的关系没有显著差异(图2)。6A, p.adjust = 0.1260, p.adjust = 0.9227)。然而,TE表达的显著差异导致IPF中这些基因的基因表达显著差异,提示它们在疾病中的作用。
AM细胞中TE位点的分析主要确定了基因表达与SINE元件(56)之间的关联,其次是LINE(26)、LTR(6)和其他17个元件(如DNA转座子)之间的关联(补充表)6B)。所有家族的大部分元件都在3'UTR区域内被激活,我们没有在基因外发现任何与基因表达相关的元件(表1)4)。我们发现趋化因子CCL22的表达与位于5'UTR和3'UTR区域的三个SINE元件(chr16|57,364,478|57,364,778|AluSq2:Alu:SINE, chr16|57,364,806|57,365,101|AluSz:Alu:SINE, chr16|57,365,617|57,365,740|AluJo:Alu:SINE)有关(补充表)6B).这种趋化因子有助于肺泡巨噬细胞的激活,并随后导致IPF患者的肺损伤[44].模型预测CCL22表达的方差解释比例为93.71%,其中AluSz (3'UTR)解释~ 29%,AluJo (3'UTR)和AluSq2 (5'UTR)分别解释~ 27%和~ 24%。IPF和供体的相关斜率也显著不同,这两种元素为IPF患者中TEs激活对CCL2的强调节提供了额外的证据(图2)。6b,仅显示AluSq2元素的图,p.adjust = 0.0237)。我们还发现,在IPF组中,内含子(chr14|22,843,913|22,844,208|AluSx1:Alu:SINE)和3'UTR区域(chr11|102,520,549|102,520,704|L2c:L2:LINE)的TE表达上调与基质金属蛋白酶(MMP14和MMP7)的上调显著相关(补充表)6B). MMPs是肺细胞迁移和组织修复的重要参与者,与IPF发病有关[45].在这里,我们建立了两种MMPs与TEs的相关性,并进一步确定了IPF和供体之间MMP7的显著te基因相关斜率差异,进一步证实了MMP7在IPF中的差异调节(图2)。6B, p.调整= 0.0156)。
我们还能够将一些先前与IPF相关的其他基因与TE表达联系起来,包括3'UTR区域的骨桥蛋白(SPP1) (Chr4: 87979662-87,979,893)和5'UTR区域的白细胞介素1受体拮抗剂(IL1RN) (chr2|113,133,292|113,133,561|Charlie18a:hAT-Charlie:DNA)(补充表)6B).已知这两种基因在IPF AM细胞中都有高水平表达,而先前报道的免疫组织化学结果证实,这些标记物在供体组织中不表达[18].我们的研究还发现IPF中这些基因及其邻近TE位点的显著上调。
然而,对于这两个TE基因对,供体和IPF之间的回归斜率并没有不同,这表明这些基因可能与TE表达没有直接关系(图2)。6b, SPP1的p.adjust = 0.1739, IL1RN的p.adjust = 0.8381)。
ScRNA-seq分析证实了纤维化人肺中多个细胞群的TE变化
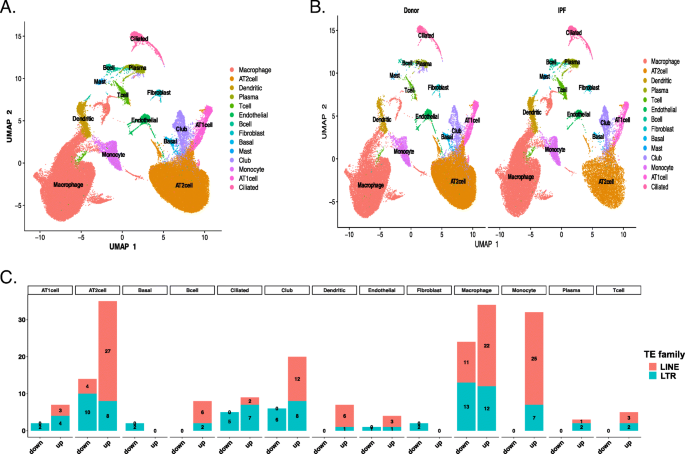
我们还分析了先前发表的一个数据集,该数据集涉及通过scRNA-seq技术生成的8名供体和8名IPF患者[18].共获得77,517个单细胞和22,009个基因。我们根据每个集群中已建立的标记的表达将每个集群分配给一种细胞类型(补充图)3.),并确认了以下细胞类型:上皮细胞(肺泡II型细胞(AT2)、肺泡I型细胞(AT1)、纤毛细胞、基底细胞和俱乐部细胞)、免疫细胞(肺泡巨噬细胞(AMs)、单核细胞、B细胞、浆肥大细胞、树突状细胞和T细胞)和间充质细胞(成纤维细胞和内皮细胞)(图2)。7a).两种表型之间细胞的分布和特性相似(图2)。7b、补充表5A)。为了确认IPF患者AM2和AT2细胞中TE活性的差异,以及确定TE在其他细胞类型中是否存在差异,我们在供体和IPF患者之间就每种细胞类型中的TE亚家族进行了差异基因表达(DGEs)分析(补充表)7B). IPF患者与供者对鉴定出的各TE亚家族及个体肺细胞类型中所有基因的DGEs分析结果见补充表7C,总结在图中。7c.我们发现,与多种细胞类型的供者相比,IPF患者中两个TE家族(LINE和LTR)的转录增加(p.adjust < 0.05, lfc > 0)。与我们在RNA批量分析中发现的TE上调一致,我们在单细胞转录组中发现了27个显著上调的L1亚家族和8个显著上调的LTR亚家族。同样,22个LINE亚家族和12个LTR亚家族在AM细胞中被发现上调(图2)。7c).此外,我们还在IPF患者的单核细胞中检测到上调,在俱乐部细胞、纤毛细胞、B细胞、树突状细胞、AT1细胞、T细胞、内皮细胞和浆细胞中也检测到少量亚家族的上调。
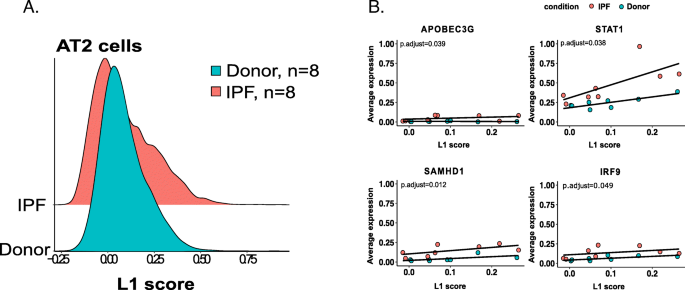
除了确定多个亚家族的变化外,我们还对确定L1亚家族的总表达与AT2细胞中IPF之间是否存在关联感兴趣,如通过bulk RNA-seq鉴定的那样。因此,我们计算了代表每种细胞类型中上调L1家族的平均表达的L1评分。通过比较健康供者与IPF患者的L1评分,发现纤维化患者的AT2细胞L1评分明显较高,提示其可能参与了IPF的发病机制(图2)。8a).为了进一步确认L1活性(L1评分)与te相关基因在IPF患者和健康供者之间的关系是否存在差异,我们检测了来自四个基因集的188个基因中的123个表达基因。我们在AT2细胞中发现了27个显著的TE调控和炎症反应相关基因(p.adjust< 0.05)(如APOBE3G、STAT1、SAMHD1、IRF9)(补充表)7D,无花果。8b).这一观察结果表明,独立数据集scRNA-seq也证实了L1上调可能促进IPF患者AT2细胞的炎症反应。单细胞RNA测序是一种强大的方法,但只能从cDNA模板的一端产生短读数,限制了高度相似的TE序列的定位。因此,没有对scRNA序列数据集进行位点特异性TE表达。
AT2细胞L1评分差异分布及其与细胞因子的关系一个来自8个纤维化肺(红色)和8个供体肺(绿色)的AT2细胞L1评分差异(p= 1.18 -e09,n每个表型组= 8)。使用所有表达的L1元件计算每个细胞的L1评分,并使用Wilcoxon秩和检验确定L1评分在表型之间分布的显著性。计算是使用修拉(v3) R包。b相关图显示AT2细胞中TE L1评分与个体TE相关基因之间的关系。AT2细胞中基因表达对L1评分反应的差异采用lm函数R、TE L1分数(自变量)和log2转化基因表达(因变量)。为了确定L1评分和平均基因表达之间的关系在IPF和供者之间是否存在差异,我们使用了t检验。的p使用Benjamini和Hochberg (BH)检验对多次测试的值进行校正。重要的p显示-值(p.adjust < 0.05)
讨论
IPF中的TEs和炎症
TEs的下调可引起转录和翻译后水平的变化,涉及基因表达的变化,进而募集免疫信号通路,可能导致病理[5,46,47,48].我们的研究表明te可能参与IPF,我们发现证据表明te在纤维化肺的AT2细胞中显著上调。除了TE在AT2 IPF细胞中的过度表达外,我们还发现TE的失调可能进一步被自噬基因CALCOCO2 (NDP52)的表达减少所促进,NDP52是已知的检测和去除至少一个TE RNA家族(L1)的关键受体。功能失调的自噬先前也与IPF有关,这表明它促进了AT2细胞的上皮-间质转化,从而导致纤维化[49].此外,自噬体去除TE的失败会导致细胞质TE积累,从而导致基因组不稳定和炎症[35,反过来又可以为指规数作出贡献。
众所周知,肺纤维化伴随着先天和适应性免疫反应;然而,炎症在该疾病中的作用仍不清楚[33].我们认为,L1HS在AT2细胞中的激活和积累可能是病毒细胞传感器和先天免疫系统(巨噬细胞)激活的重要触发因素,从而导致免疫平衡的破坏,从而导致IPF的慢性炎症。许多与TEs相关的炎症相关过程之前也被描述为促进IPF (IFI6、IFI27、IFI44、OAS1、IL15RA、CX3CL1和CXCL9)(补充表)4-C),并且已知它们参与成纤维细胞激活和细胞外基质的积累[50].此外,我们在我们的单细胞数据分析中证实了其中的一些过程,这也显示了AT2细胞中最高的TE LINE上调,以及它与IPF患者炎症反应相关的一些基因(即IRF9, STAT1)的相关性。
与年龄相关的IPF发病进一步证明TEs可能参与IPF并与炎症反应有关。事实上,IPF在60岁或以上的人群中最为普遍,部分是由衰老细胞介导的[21,51].AT2细胞中基因间L1HS的上调与SASP标记物(即MMP3和SERPINE1)正相关,表明IPF细胞衰老可能对L1HS的激活很重要。细胞衰老相关炎症的主要触发因素之一是由年龄相关的表观遗传标记丢失激活L1 te [6,52].根据这些发现,我们的研究表明FOXA1 TF可以结合去甲基化L1启动子,从而诱导L1HS表达(图1)。2b-c,补充表4c)。这可能会导致ssDNA细胞质传感器(即IFI16)的激活,该传感器负责通过cGAS-cGAMP-STING途径发出信号,并可能诱导干扰素相关的变化和年龄相关的炎症[6,7].事实上,在IPF细胞中,许多inf - 1相关基因上调并与L1HS表达相关(补充表)4c)。这支持了先前报道的细胞衰老和IPF AT2细胞炎症的重要性及其与L1HS上调的潜在相互作用[25,53].我们希望未来的工作能够揭示IPF中TE激活的其他机制。
TE基因座的表达与IPF相关基因的表达相关
炎症反应并不是不受控制的TE整体表达的唯一结果,因为单个TE位点的活性也可以在调节邻近基因的表达中发挥重要作用[48].我们的数据表明,在IPF患者的AT2和AM细胞中,几个基因附近的TE表达与基因表达相关。值得注意的是,其中一些基因先前与IPF有关。例如,MUC5B启动子变异是与凝胶形成粘蛋白增加相关的主要IPF危险因素之一,粘蛋白在支气管中产生粘膜宿主防御功能障碍,因此对IPF至关重要[54].我们观察到te可能参与了该基因的调控,这是基于嵌入该基因内含子区域的te在IPF患者中的显著高表达。其他与TEs相关的例子包括CHL1基因,根据以往的研究,CHL1基因在区分IPF患者和健康对照组方面表现出> 0.8的特异性和0.9的敏感性,这意味着它是一个潜在的IPF药物靶点[55].虽然目前还没有研究将CHL1中的TE与IPF联系起来,但之前的研究已经提出,CHL1中的L1P6 TE可以作为L1反义启动子,从而驱动嵌合转录物的转录[56].我们的研究还表明,L1P6的上调可以解释约25%的CHL1表达,这表明该基因可能在CHL1中发挥潜在的调节作用,从而参与IPF。与控制蛋白水解相关的基本基因之一(SERPINB3) [34],以及先前与IPF相关的GSTA2基因[57],显示了来自基因外te的潜在调控。这两个基因的te都位于靠近AT2基因的下游(在2kb以内),虽然以前没有在其他研究中描述过,但它们可能具有AT2细胞特异性调节功能。虽然大多数TE变化是在AT2细胞中发现的,但AM细胞也显示TE与金属蛋白酶(MMP7和14)、白细胞介素(IL15RA)、趋化因子(CCL22)和骨桥蛋白(SPP1)相关,这些都与IPF的发生有关[45].
虽然这些免疫相关基因(如CCL22、IL15RA)的表达与AM细胞中的位点特异性TE表达相关,但它们的调节也可能是AT2细胞炎症引起的下游调节的结果。AM也是呼吸系统防御的重要角色,包括吸收有害颗粒和感染因子[58].这些过程可能引发基因组不稳定(即去甲基化),并直接激活AM中的TEs及其邻近基因。
我们研究中与相邻基因表达相关的TE位点表达变化主要位于各自基因的3'UTR区、内含子区或5'UTR区。先前的研究表明,te可以在基因区域中发现,并通过充当或干扰不同组织中的调控元件来影响基因调控[59].特别是,我们确定的通常嵌入和表达在3'UTR区域的SINE (Alu)元件由于其大小(300 bp)而优先位于基因丰富的区域。嵌入的Alu序列可以作为顺式元件调节宿主基因的翻译,也可以参与microRNA调控网络和许多其他调控过程[60].这些序列在调节肺细胞内基因中的作用以及它们与IPF疾病的关系尚未确定。
te有时保留在内含子内,并在转录本被处理之前被转录,或者它们有时根本不被拼接出来,正如对LINE元件的详细研究所表明的那样[61].内含子内保留的te可能来自未预处理的RNA,因此可能代表转录噪声而不是生物信号。因此,必须指出的是,我们的研究在量化可靠的、独立转录的TE位点方面存在局限性。
我们已经确定的显著关联并不必然意味着给定的TE确实对附近基因的转录有主导作用。特定基因的转录变化也会影响附近te的表达,或者te可能根本不会影响基因表达,因为基因表达可能是下游调控的结果[38,39].因此,应该对已确定的候选基因座进行功能验证。除了这些限制之外,我们可以在AT2和AM细胞中检测到可能与IPF相关的特定信号,并在单细胞数据分析中重复。此外,虽然只对少数患者进行了检查,但我们从同一患者身上获得的三种细胞类型的分析表明,最强的信号发生在AT2细胞中,已知AT2细胞在IPF中受损。因此,本研究确定了许多候选基因座,用于进一步的功能研究。
最后,吸烟已被确定为发生IPF的一个重要危险因素[62].有趣的是,我们对TE位点相关基因表达的GO项分析突出了一些基因的富集(111个基因中有8个;p< 0.0178) [63].本前期研究比较了吸烟者和非吸烟者小气道上皮(SAE)细胞的基因表达,发现本研究中与TE表达相关的8个基因(GSTA2、ITGA2、KRT19、MS4A8、MUC20、MUC5B、SCGB1A1、SNTN)在吸烟者中也出现了异常表达。SAE是大多数吸烟引起的肺部疾病早期表现的主要部位[64].因此,我们的观察可能表明,香烟烟雾引起的氧化应激也是一种重要的te激活剂[65],而且,它在指规数发展的早期阶段可能很重要,这一假设应该得到进一步的验证。
结论
综上所述,我们的研究结果表明TE表达与已知的IPF关键过程之间存在密切联系。然而,TE的失调在多大程度上驱动IPF,或者TE激活是否代表发病机制的副作用,仍不清楚。然而,我们很容易推测,由衰老(表观遗传标记的丢失)和损伤(氧化应激)引起的TE去甲基化结合,伴随着功能失调的自噬,可能导致永久性炎症和位点特异性基因表达的变化,这可能在遗传易感个体中IPF的发展中发挥关键作用。此外,我们的研究结果指出了治疗的潜在新场所。此外,他们还对TEs在其他由损伤和炎症引起的肺部疾病(如慢性阻塞性肺疾病)中的作用提出了质疑。
材料与方法
数据
这些样本的详细描述已在以前发表过,并在补充表中提供1[18]。我们使用了来自14名供体和8名肺纤维化患者的样本,其中有关于AT2、AM和WL细胞的大量RNA测序数据。简而言之,提取RNA,使用poly(a)富集(NEBNext Ultra RNA, New England BioLabs)制备RNA-seq文库,并测序为单端75碱基对reads (Illumina NextSeq 500)。我们还分析了来自同一研究中分别获得的8名供体和8名IPF患者的单细胞数据集。该数据使用Chromium单细胞控制器(10x Genomics)上的3 ' V2化学试剂盒生成,并使用Illumina HiSeq 4000测序。所有用于样品处理和测序的方法先前已被描述[18].
使用大量RNA-seq定量基因表达和TE活性
原始测序数据从dbGAP数据库(phs001750.v1.p1)下载,然后使用乡绅一套工具,整合了基因表达和TE表达的比对和表达计数[26].我们将原始RNA-seq读数映射到GRCh38/hg38(2013年12月发布)版本的人类基因组组装,该版本从UCSC基因组FTP站点下载(ftp://hgdownload.cse.ucsc.edu/goldenPath/hg38/bigZips/chromFa.tar.gz),并根据TE家族和TE位点确定了转录变化。来确认观察到的变化乡绅,我们也用REdiscoverTE整套工具(http://research-pub.gene.com/REdiscoverTEpaper/) [20.].REdiscoverTE以基因组区域(内含子、外显子和基因间)分离的TE家族为基础,测定转录变化。在差异基因表达分析之前,通过校准te和基因表达矩阵来解释不同细胞类型(WL, AM, AT2)中读取数的任何潜在差异[20.].
的优势REdiscoverTE它可以专门模拟自主TE表达。比较这两种方法(REdiscoverTE和乡绅)进行基因组区域水平的分析,我们使用REdiscoverTE的外显子、内含子和基因内区域的注释,并将由乡绅每个个体的基因座。这使我们能够比较两种方法在基因组区域中聚集的TE家族的差异表达。对于这两种TE量化方法,我们使用相同的下游方法来确定差异表达的TE家族,如下所述。
将样本间的计数归一化,并采用DESeq2进一步采用Benjamini和Hochberg (BH)校正法测定TE表达的意义p值(66].火山地块是用ggplot2R中的函数。
为了确定细胞中差异表达TE位点的基因组位置,我们从UCSC数据库表中下载了每个基因的3'UTR、5'UTR、内含子和外显子区域的bed文件注释[67].我们进一步将差异上调的TE与不同基因组区域的TE床文件坐标相交GenomicRanges[68最后,我们使用BEDTOOLS功能确定了差异表达te的基因间区域(在3'UTR, 5'UTR,内含子和外显子区域没有重叠的区域)的位置以及它们与最近基因的距离最亲密的[29].
基因表达与TE表达的关系
我们首先将L1HS亚家族与差异表达的te相关基因(人工整理的基因列表,包括I型干扰素(IFN-I, 84个基因)、衰老相关分泌表型(SASP)基因(85个基因)、L1转录调控基因(2个基因)和L1转录后调控基因(17个基因))之间的关系进行了关联[6,31]使用线性模型(lmIPF组和供体组之间的这种关系的差异使用f检验进一步检验自动阀其中TE亚家族表达为自变量,基因表达为因变量。表型(IPF/供体)也作为协变量包括在模型中。
为了确定TE表达是否与邻近基因表达相关,我们使用线性模型(lm),其中每个位点的TE表达作为自变量,基因表达作为因变量,考虑表型(IPF或供体)作为一个因素。与外显子重叠或位于外显子-内含子、外显子-5 ' utr或外显子3'UTR区域的te被排除在这些分析之外。我们只测试了顺式te基因对,因为大多数te要么在基因的50kb内,要么在基因区域内。我们使用多重检验校正(bh校正)来定义显著te基因对p值(p-value <0.05) [66].对AT2、AM和WL数据执行相同的测试。用f检验确定各组(IPF或供体)回归斜率的差异自动阀函数,结果用ggplot2R中的函数。
当多个与目标基因相邻的TE(在50 kb距离内)的表达与基因表达相关时,我们使用R包计算每个TE的相对重要性relaimpo1000次引导[69].我们进一步使用STRING数据库对与TE表达相关的基因进行了基因本体富集测试[40].
scRNA-seq法检测TE活性
单细胞转录物图谱
单细胞RNA-seq数据的原始读数从dbGAP (phs001750.v1.p1)下载[18].
下载TE注释库乡绅GRCh38/hg38(2013年12月发布)基因组,以及TE参考。利用Chromium 10x工作流程和Chromium 10x Cell Ranger单细胞软件套件(http://software.10xgenomics.com/single-cell)。
TE的亚族表示来自TE家族的序列组(LINE、sin和ltr),它们在重复次数方面足够不同,从而允许唯一的读映射。差异表达分析只考虑和计算唯一的序列。差异的数量定义为TE亚家族的数量。单元格标签与已发布的数据矩阵相匹配,以便使用与先前发布的帐户相同的单元格[18].由cell ranger产生的过滤特征矩阵计数在随后的分析中使用R包修拉[70].
ScRNA-seq集群
下游单细胞分析使用功能在两个修拉package V3和r3.5 [70].首先,我们将8名健康供体和8名IPF患者的细胞与GEO (GSE122960)上公布的过滤数据集进行匹配[18].在此过程中,我们总共回收了77,517个细胞。为了比较不同患者和不同肺细胞类型的表达数据,我们将数据与IntegrateData方法确定数据集之间的锚点FindIntegrationAnchors函数。22,009个鉴定基因的归一化是基于每个细胞的唯一分子标识符(UMIs)的总数,乘以一个比例因子(10,000),然后进行对数变换。接下来,我们对前2000个可变基因进行了主成分分析(PCA),然后使用该方法提供的均匀流形近似和投影(UMAP)降维方法,使用前20个PCA分量将细胞投影到二维地图上RunUMAP函数。为了鉴定肺组织中的细胞类型,我们使用基于k -最近邻(KNN)图的聚类算法对所有IPF患者和供体细胞进行聚类FindNeighbors函数。最后,我们使用FindClusters函数(分辨率参数= 0.5)建立细胞簇,而基于常规细胞标记基因确定簇的身份[18].使用非参数Wilcoxon秩和检验和Bonferroni校正对IPF患者和供体之间的差异基因和TE亚家族表达进行分析。此外,我们比较了IPF患者和供者的每个细胞L1 TE亚家族的总表达(L1评分)addModuleScore函数和Wilcoxon秩和检验。为了计算每个细胞的L1分数,我们使用了70个L1亚家族的平均表达量。接下来,我们测试了L1评分与TE相关基因之间的关系(来自已知的L1防御和抗病毒干扰素刺激基因的四个基因集的188个基因中的123个表达基因)。对IPF患者和供者的每个L1评分和基因对进行线性模型拟合lm函数用R表示,用t检验确定两组回归线的差值自动阀R中的函数。
数据和材料的可用性
Reyfman等收录了本研究中产生或分析的所有数据。[18]发表的文章及其补充资料文件。原始的基因组学读取和详细的患者数据可以从GSE122960数据集和dbGAP数据库(phs001750.v1.p1)中获得,尽管由于dbGAP政策的限制,在可用性方面存在限制。数据访问从dbGAP(项目#21807)获得。
参考文献
Seberg O, Petersen G.一个统一的真核转座因子分类系统应该反映其系统发育。医学学报,2009;10(4):276。https://doi.org/10.1038/nrg2165-c3。
刘建军,刘建军,刘建军,等。人类基因组的初步测序和分析。自然。2001;409(6822):860 - 921。https://doi.org/10.1038/35057062。
Mills RE, Bennett EA, Iskow RC, Devine SE。哪些转座因子在人类基因组中是活跃的?趋势研究。2007;23(4):183-91。https://doi.org/10.1016/j.tig.2007.02.006。
转座因子与调控网络的演化。地理学报,2008;9(5):397-405。https://doi.org/10.1038/nrg2337。
Bourque G, Burns KH, Gehring M, Gorbunova V, Seluanov A, Hammell M,等。关于转座元素你应该知道的十件事。中国生物医学工程学报,2018;19(1):199。https://doi.org/10.1186/s13059-018-1577-z。
De Cecco M, Ito T, Petrashen AP, Elias AE, Skvir NJ, Criscione SW,等。L1驱动衰老细胞中的IFN并促进与年龄相关的炎症。大自然。2019;566(7742):73 - 8。https://doi.org/10.1038/s41586-018-0784-9。
李建军,李建军,李建军,等。衰老野生型小鼠和sirt6缺陷小鼠的LINE1基因下调可引发炎症。中国生物医学工程学报,2019;29(4):871 - 875。https://doi.org/10.1016/j.cmet.2019.02.014。
古迪耶JL, Kazazian HH Jr.逆转录转座子的重新研究:抑制和恢复寄生虫。细胞。2008;135(1):23-35。https://doi.org/10.1016/j.cell.2008.09.022。
Baylin SB, Herman JG, Graff JR, Vertino PM, Issa JP。DNA甲基化的改变:肿瘤的一个基本方面。中华癌症杂志,1998;72:141-96。
Deniz O, Frost JM, Branco MR.作者更正:DNA修饰对转座因子的调控。中国生物医学工程学报,2019;20(7):432。https://doi.org/10.1038/s41576-019-0117-3。
王晓明,王晓明。转座因子与神经系统疾病的关系。中华神经科学杂志,2019;10:894。https://doi.org/10.3389/fneur.2019.00894。
王晓明,王晓明。转座因子及其在复杂肺部疾病中的潜在作用。中华呼吸杂志,2013;14(1):99。https://doi.org/10.1186/1465-9921-14-99。
Barratt SL, Creamer A, Hayton C, Chaudhuri N.特发性肺纤维化(IPF):综述。中华临床医学杂志,2018;7(8):201。
Kaur A, Mathai SK, Schwartz DA。特发性肺纤维化发病、预后和治疗的遗传学。前地中海(洛桑)。2017; 4:154。https://doi.org/10.3389/fmed.2017.00154。
王志强,王志强,王志强,等。肝纤维化的临床研究进展。中华医学杂志,2012;18(7):1028-40。https://doi.org/10.1038/nm.2807。
Camelo A, Dunmore R, Sleeman MA, Clarke DL。特发性肺纤维化的上皮:打破屏障。前沿医药,2014;4:173。
Giorgi G, Marcantonio P, Del Re B.氧化应激对人神经母细胞瘤细胞LINE-1逆转录的影响。中国生物医学工程学报,2011;31(3):383 - 391。https://doi.org/10.1007/s00441-011-1289-0。
Reyfman PA, Walter JM, Joshi N, Anekalla KR, mcquatty pimentel AC, Chiu S,等。人肺的单细胞转录组学分析为肺纤维化的病理生物学提供了见解。[J]中华呼吸与急救医学杂志,2019;19(12):1517 - 1536。https://doi.org/10.1164/rccm.201712-2410OC。
Mehta CR, Patel NR, Tsiatis AA。用有序分类数据进行精确显著性检验以建立治疗等效性。生物识别技术,1984;40(3):819 - 25。https://doi.org/10.2307/2530927。
孔勇,Rose CM, Cass AA, Williams AG, Darwish M, Lianoglou S,等。肿瘤中的转座因子表达与免疫浸润和抗原性增加有关。生态学报,2019;10(1):5228。https://doi.org/10.1038/s41467-019-13035-2。
Schafer MJ, White TA, Iijima K, Haak AJ, Ligresti G, Atkinson EJ,等。细胞衰老介导纤维化肺疾病。生态学报,2017;8(1):14532。https://doi.org/10.1038/ncomms14532。
王晓明,王晓明,王晓明,等。慢性阻塞性肺疾病肺老化与特发性肺纤维化的关系。[J] .中华呼吸与急救杂志,2012;36(4):391 - 391。https://doi.org/10.1164/rccm.201202-0282PP。
Lehmann M, Korfei M, Mutze K, Klee S, Skronska-Wasek W, Alsafadi HN,等。体外抗衰老药物作用于肺泡上皮细胞功能,减轻实验性肺纤维化。中国生物医学工程学报,2017;35(2):563 - 567。
Sisson TH, Mendez M, Choi K, Subbotina N, Courey A, Cunningham A,等。ⅱ型肺泡上皮细胞靶向损伤诱导肺纤维化。[J] .中国呼吸与急救杂志,2010;31(3):563 - 568。https://doi.org/10.1164/rccm.200810-1615OC。
姚晨,关霞,Carraro G, Parimon T,刘霞,黄刚,Mulay A, Soukiasian HJ, David G, weight SS,等。肺泡2型细胞衰老驱动进行性肺纤维化。[J] .呼吸与危重症杂志;2013;31(6):779 - 779。
杨文荣,Ardeljan D, Pacyna CN, Payer LM, Burns KH。SQuIRE揭示了穿插重复表达的位点特异性调控。核酸学报,2019;47(5):e27。https://doi.org/10.1093/nar/gky1301。
刘建军,刘建军,刘建军。转座因子科,种群结构和物种起源。生物医学进展,2011;6(1):44。https://doi.org/10.1186/1745-6150-6-44。
余强,Carbone CJ, Katlinskaya YV,郑宏,郑坤,罗明,等。I型干扰素控制长分散元件-1的增殖。生物化学学报,2015;29(16):10191-9。https://doi.org/10.1074/jbc.M114.612374。
昆兰AR,大厅IM。BEDTools:一套灵活的工具,用于比较基因组特征。生物信息学,2010,26(6):841 - 2。https://doi.org/10.1093/bioinformatics/btq033。
Brouha B, Schustak J, Badge RM, Lutz-Prigge S, Farley AH, Moran JV,等。热l15占人类逆转录的大部分。科学通报,2003;30(9):598 - 598。https://doi.org/10.1073/pnas.0831042100。
古蒂杰。限制逆转录转座子:综述。暴徒的DNA。2016; 7(1): 16。https://doi.org/10.1186/s13100-016-0070-z。
郑海,崔建军,李EA.胃肠道肿瘤中L1逆转录的免疫特征相关。基因工程学报,2018;28(8):1136-46。https://doi.org/10.1101/gr.231837.117。
张晓明,张晓明,张晓明,等。炎症免疫对IPF发病机制的影响。中华呼吸医学杂志,2019;47(1):79 - 91。https://doi.org/10.1016/j.rmed.2018.12.015。
Lunardi F, Villano G, Perissinotto E, Agostini C, Rea F, Gnoato M,等。SERPIN B3过表达促进小鼠上皮细胞增殖和肺纤维化。实验室研究,2011;91(6):945-54。https://doi.org/10.1038/labinvest.2011.1。
郭辉,Chitiprolu M, Gagnon D, Meng L, Perez-Iratxeta C, Lagace D,等。自噬通过降解反转录转座子RNA来支持基因组的稳定性。生态学报,2014;5(1):5276。https://doi.org/10.1038/ncomms6276。
蒋超,刘刚,luchardt T, Antony V,周勇,Carter AB,等。丝氨酸蛋白酶1通过激活p53-p21-Rb通路诱导肺泡II型细胞衰老。衰老细胞学报,2017;16(5):1114-24。https://doi.org/10.1111/acel.12643。
Yamashita CM, Dolgonos L, Zemans RL, Young SK, Robertson J, Briones N,等。基质金属蛋白酶3是肺纤维化的中介。中华疾病杂志,2011;39(4):1733-45。https://doi.org/10.1016/j.ajpath.2011.06.041。
王志强,王志强。可转座因子表达的研究进展。地理学报,2020;21(12):721-36。https://doi.org/10.1038/s41576-020-0251-y。
王晓明,王晓明,王晓明,等。转座因子对水稻水稻基因表达的影响。PeerJ。2019; 7: e8192。https://doi.org/10.7717/peerj.8192。
Szklarczyk D, Gable AL, Lyon D, Junge A, Wyder S, Huerta-Cepas J,等。STRING v11:覆盖范围增加的蛋白质关联网络,支持全基因组实验数据集的功能发现。核酸学报,2019;47(D1): D607-13。https://doi.org/10.1093/nar/gky1131。
马丁内斯FJ, Collard HR, Pardo A, Raghu G, Richeldi L, Selman M,等。特发性肺纤维化。高分子学报,2017;3(1):17074。https://doi.org/10.1038/nrdp.2017.74。
Seibold MA, Wise AL, Speer MC, Steele MP, Brown KK, lloyd JE等。MUC5B启动子多态性与肺纤维化。中华医学杂志,2011;31(6):1503-12。https://doi.org/10.1056/NEJMoa1013660。
Hunninghake GM, Hatabu H, Okajima Y, Gao W, Dupuis J, Latourelle JC,等。MUC5B启动子多态性与肺间质性异常。中华医学杂志,2013;32(3):391 - 391。https://doi.org/10.1056/NEJMoa1216076。
Yogo Y, Fujishima S, Inoue T, Saito F, Shiomi T, Yamaguchi K,等。巨噬细胞来源的趋化因子(CCL22)、胸腺和激活调节的趋化因子(CCL17)和CCR4在特发性肺纤维化中的作用。中国生物医学工程学报,2009;10(1):80。https://doi.org/10.1186/1465-9921-10-80。
陈建军,陈建军,陈建军,等。基质金属蛋白酶在特发性肺纤维化发病机制中的作用。呼吸学报,2016;17(1):23。https://doi.org/10.1186/s12931-016-0343-6。
沙玛R,罗迪克N, Burns KH, Taylor MS.人LINE-1在培养细胞和人体组织中的免疫检测。方法:中华医学杂志,2016;14:261 - 80。https://doi.org/10.1007/978-1-4939-3372-3_17。
付款人LM,伯恩斯KH。人类遗传疾病中的转座因子。中国生物医学工程学报,2019;20(12):760-72。https://doi.org/10.1038/s41576-019-0165-8。
张建军,张建军,张建军,等。转座因子调控活动:从冲突到利益。学报,2017;18(2):71-86。https://doi.org/10.1038/nrg.2016.139。
Hill C, Li J, Liu D, Conforti F, breereton CJ, Yao L,等。自噬抑制介导的上皮-间质转化增强了肺纤维化的局部肌成纤维细胞分化。细胞死亡杂志,2019;10(8):591。https://doi.org/10.1038/s41419-019-1820-x。
陈晓明,陈晓明。趋化因子/细胞因子在特发性肺纤维化中的作用。生物质化学工程学报,2006;3(4):357-63。https://doi.org/10.1513/pats.200601-010TK。
张建军,张建军,张建军,等。特发性肺纤维化的临床研究进展。[J] .呼吸与危重症杂志,2006;17(7):811 - 816。https://doi.org/10.1164/rccm.200602-163OC。
Pal S, Tyler JK。表观遗传学和衰老。科学进展,2016;2(7):e1600584。https://doi.org/10.1126/sciadv.1600584。
陈鹏,姚晨,陈平。肺泡上皮II型细胞在特发性肺纤维化中的作用。中国生物医学工程学报,2010;21(7):2269。
Helling BA, Gerber AN, Kadiyala V, Sasse SK, Pedersen BS, Sparks L,等。MUC5B在特发性肺纤维化中的表达调控。[J] .中华呼吸杂志,2017;37(1):91-9。https://doi.org/10.1165/rcmb.2017-0046OC。
王勇,叶丽娟,陈健,McCormack FX, Madala SK, Jegga AG。无监督基因表达分析确定ipf严重程度相关特征,相关基因和生物标志物。中华医学杂志,2017;17(1):133。https://doi.org/10.1186/s12890-017-0472-9。
Criscione SW, Theodosakis N, Micevic G, Cornish TC, Burns KH, Neretti N,等。人类L1反义启动子驱动转录物的全基因组特征。中国生物医学工程学报,2016;17(1):463。https://doi.org/10.1186/s12864-016-2800-5。
王铮,朱军,陈峰,马磊。加权基因共表达网络分析发现特发性肺纤维化相关的关键基因和通路。中华医学杂志,2019;25:4285-304。https://doi.org/10.12659/MSM.916828。
Thorley AJ, Ford PA, Giembycz MA, Goldstraw P, Young A, Tetley TD。脂多糖刺激的原代人肺泡II型上皮细胞和巨噬细胞对细胞因子释放和白细胞迁移的差异调节中国生物医学工程学报,2009;32(1):444 - 444。https://doi.org/10.4049/jimmunol.178.1.463。
Garcia-Perez JL, Widmann TJ, Adams IR。转座因子对哺乳动物发育的影响。发展。2016;143(22):4101 - 14所示。https://doi.org/10.1242/dev.132639。
陈丽丽,杨玲。基因表达的替代调控。细胞生物学进展,2017;27(7):480-90。https://doi.org/10.1016/j.tcb.2017.01.002。
Deininger P, Morales ME, White TB, Baddoo M, Hedges DJ, Servant G等。一种L1位点表达的综合方法。核酸学报,2017;45(5):e31。https://doi.org/10.1093/nar/gkw1067。
Baumgartner KB, Samet JM, Stidley CA, Colby TV, Waldron JA。吸烟:特发性肺纤维化的危险因素。[J]中华呼吸与急救杂志。1997;16(1):1 - 8。https://doi.org/10.1164/ajrccm.155.1.9001319。
刘建军,刘建军,刘建军,等。人小气道上皮转录组的RNA-Seq定量分析。生物医学工程学报,2012;13(1):82。https://doi.org/10.1186/1471-2164-13-82。
Hogg JC, Chu F, Utokaparch S, Woods R, Elliott WM, Buzatu L,等。慢性阻塞性肺疾病小气道阻塞的性质。中华医学杂志,2004;35(6):344 - 344。https://doi.org/10.1056/NEJMoa032158。
Bollati V, Baccarelli A, Hou L, Bonzini M, Fustinoni S, Cavallo D,等。暴露于低剂量苯的受试者DNA甲基化模式的变化。中华癌症杂志,2007;37(3):876 - 880。https://doi.org/10.1158/0008-5472.CAN-06-2995。
Love MI, Huber W, Anders S.使用DESeq2对RNA-seq数据的折叠变化和离散度进行调节估计。基因工程学报,2014;15(12):550。https://doi.org/10.1186/s13059-014-0550-8。
Karolchik D, Hinrichs AS, Furey TS, Roskin KM, Sugnet CW, Haussler D,等。UCSC表浏览器的数据检索工具。核酸研究。2004;32(数据库版):D493-6。https://doi.org/10.1093/nar/gkh103。
Lawrence M, Huber W, Pages H, Aboyoun P, Carlson M, Gentleman R,等。用于计算和注释基因组范围的软件。科学通报,2013;9(8):e1003118。https://doi.org/10.1371/journal.pcbi.1003118。
Grömping R中线性回归的相对重要性:包的相关性。[J] .计算机科学,2006;17(1):1 - 27。
张建军,张建军,张建军,等。单细胞数据综合集成。Cell. 2019;177(7): 1888-902。https://doi.org/10.1016/j.cell.2019.05.031。
致谢
我们要感谢dbGap和Reyfman等人。[18]来提供这些数据。这个数据集的来源在一份手稿中有详细的描述https://www.atsjournals.org/doi/10.1164/rccm.201712-2410OC。我们要感谢参与数据收集的所有机构和创始机构,如下所述。这项研究得到了退伍军人管理局拨款BX000201和国防部拨款PR141319的部分支持。我们要感谢西北大学范伯格医学院的Ernest S. Bazley气道疾病教授和Mabel Greene Myers医学-风湿病学教授。这项研究部分是通过基因组计算集群(基因组节点探索)提供的计算资源和工作人员的贡献来支持的,该集群由范伯格医学院、遗传医学中心、范伯格生物化学和分子遗传学系、教务长办公室、研究办公室和西北信息技术共同支持。基因组学计算集群是西北大学高性能计算设施Quest的一部分,旨在推进基因组学研究。下一代测序在Illumina HiSeq 4000上由NUSeq核心设施进行,该设施由西北大学遗传医学中心、Feinberg医学院和大学研究办公室的共享和核心设施提供支持。西北大学流式细胞仪设备、高级显微镜中心和病理核心设备由NCI癌症中心支持基金P30 CA060553资助,该基金授予Robert H Lurie综合癌症中心。
资金
Mahboubeh R. Rostami获得T32 HL094284支持。
作者信息
作者及单位
贡献
M.B.设计了这项研究,进行了数据分析,并撰写了手稿。核磁共振进行单细胞数据分析并撰写手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:补充图1。
复制TE家族在个体细胞类型和全肺组织中的表达变化REdiscoverTE方法。A. WL的大量rna测序。B. AT2细胞的大量rna测序。C. AM的大量rna测序。的读取计数来确定TE表达式REdiscoverTE工作流,并使用DESeq2x轴表示日志2IPF患者与供者TE亚家族表达的比值。y轴表示调整后的值p基于-log的-value10。红色表示折叠表达变化(FC) > 1, p.adjust < 0.05 (BH调整)的TE亚家族(用两条垂直虚线和水平线表示)。蓝色为调整后的tep-value (p.adjust < 0.05),绿点表示FC > 1的te。黑色表示没有显著的p.调整值或FC高于1的变化。不同的形状代表不同的TE族。
附加文件2:补充图2。
L1HS在供体和IPF样品中的基因间表达乡绅方法。绿色:供体样本。红色:IPF样品。x轴表示组,y轴表示所有基因间L1HS位点计数的对数归一化表达值(见材料和方法)。组间L1HS无显著差异,由DESeq2分析(p= 0.037, p.adjust =0.11)。
附加文件3:补充图3。
表达的细胞标记物特征图,用于UMAP图中细胞类型的鉴定。细胞类型分为上皮细胞(肺泡II型细胞(AT2)、肺泡I型细胞(AT1)、纤毛细胞、基底细胞和俱乐部细胞)、免疫细胞(肺泡巨噬细胞(AM)、单核细胞、B细胞、浆肥大细胞、树突状细胞和T细胞)和间充质细胞(成纤维细胞和内皮细胞)。
附加文件4:补充表1。
在大量RNA-seq和scRNA-seq分析中使用的样品摘要。每行表示样本ID,而列表示原始出版物中报告的组织学类型,年龄,性别,种族,吸烟史和表型[18].所有纤维化样本分组并一起分析,如表(分析表型)所示。HP:过敏性肺炎;ILD:间质性肺病;IPF:特发性肺纤维化;NA:不可用;SSc:系统性硬化。可以从原始手稿中获得额外的样本描述。
附加文件5:补充表2。
基于不同细胞的IPF患者与供者TE家族差异分析综述乡绅和REdiscoverTE分析。A.全肺(WL)组织乡绅B.肺泡II型(AT2)细胞乡绅。C.肺泡巨噬细胞(AM)乡绅。D.全肺(WL)组织REdiscoverTEE.肺泡II型(AT2)细胞REdiscoverTE。F.肺泡巨噬细胞(AM)REdiscoverTE。列表示重复分类、TE表达式基均值(baseMean)、log2fold change (log2FoldChange), lfcSE (log fold standard error), stat (Wald statistics;利物浦/标准错误),p-value, p.adj .调整的p值)。只有显著上调的家族被显示出来。G.所有变化的总结REdiscoverTE分析。
附加文件6:补充表3。
基于基因组区域和AT2细胞的IPF患者与供者TE家族差异分析综述乡绅和REdiscoverTE分析。A. AT2细胞外显子区TE的差异表达RediscoverTE。B. AT2细胞内含子区TE的差异表达RediscoverTE。C. AT2细胞基因间区TE的差异表达RediscoverTE。获得的所有变更摘要乡绅和REdiscoverTE。E. AT2细胞基因间区TE的差异表达乡绅。只显示了显著的TE家族。列表示重复分类,TE表达式基均值(baseMean), log2fold change (log2FoldChange), lfcSE (log fold standard error), stat (Wald statistics;利物浦/标准错误),p-value, p.adj .调整的p值)。
附加文件7:补充表4。
AT2细胞中L1HS及其功能相关基因的差异分析及相关性综述。A.人工整理的已知属于L1HS防御和抗病毒干扰素刺激基因的基因列表[25,39].B. AT2细胞中所有显著差异表达基因列表,并附有L1HS相关基因的功能注释。只有重要的基因被显示出来。列表示基因名称、基因表达基数均值(baseMean)、log2fold change (log2FoldChange), lfcSE (log fold standard error), stat (Wald statistics;利物浦/标准错误),p-value, p.adj .调整的p值)。C. L1HS相关基因表达与L1HS相关性线性模型检验综述。的p价值1表示基因表达与L1HS-locus表达的关系p价值2-表示两组(IPF组和供体组)回归斜率的差异。的p-值校正采用Benjamini和Hochberg (BH)检验和p.调整1和p.adjust2)。模型:基因表达∼L1HS表达+组(IPF/Donor)。
附加文件8:补充表5。
IPF患者与供者不同细胞TE位点及基因差异分析综述A.全肺(WL)组织,B.肺泡II型(AT2)细胞。C.肺泡巨噬细胞(AM)。列表示基因表达基础均值(baseMean), log2fold change (log2FoldChange), lfcSE (log fold standard error), stat (Wald statistics;利物浦/标准错误),p-value, p.adj .调整的p值)。基因名称旁边的正负号表示基因的方向。
附加文件9:补充表6。
所有te基因位点对的线性模型检验总结。A. AT2线性模型分析总结。B. AM线性模型分析总结。日志之间的关联2-变换后的TE表达式(自变量)和log2-转化基因表达(因变量)采用线性模型检验。显示了基因、TE位点、与基因的距离以及TE位点的基因组区域。的p价值1表示基因表达与相邻te位点表达的关系p价值2-表示两组(IPF组和供体组)回归斜率的差异。的p-值校正采用Benjamini和Hochberg (BH)检验和p.调整1和p.adjust2)。
附加文件10:补充表7。
scRNA-seq中单个细胞类型的基因和TEs差异分析综述。表格5A.每个单元格类型中每个主题的单元格编号。B.所有细胞类型中IPF与供体的差异表达基因。Avg_logFC:平均日志折叠变化;p-value:根据Wilcoxon秩和检验计算;p.adjust:调整p-value基于使用数据集中所有基因的Bonferroni校正;pct.1: IPF患者中表达该基因的细胞比例;Pct.2:供体中表达该基因的细胞比例。C.不同细胞类型的IPF患者与供体样本中TE家族的差异表达。D. IPF患者与供者之间的差异表现为L1评分与te相关基因表达的相关性。测试了在RNA批量测序中鉴定的126个基因子集。对每个L1分数和基因对进行线性模型拟合。的p-value采用t检验计算;p.调整是本杰明和霍赫伯格(BH)调整p价值。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Rostami, M.R, Bradic, M.在特发性肺纤维化中,肺细胞中转座因子的下调与炎症反应和基因激活有关。移动DNA12, 14(2021)。https://doi.org/10.1186/s13100-021-00241-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13100-021-00241-3