摘要
纯的、可溶性的和功能性的蛋白质在现代生物技术中有很高的要求。天然蛋白质来源很少能满足数量、易于分离或价格的要求,因此重组技术往往是选择的方法。重组细胞工厂经常用于生产用于下游纯化和加工的蛋白质制剂。Eschericia杆菌是一种常用的宿主,因为它通过其相对简单、廉价和快速的高密度培养、众所周知的遗传学和大量可用的兼容分子工具促进蛋白质表达。尽管有这些特性,重组蛋白的表达与大肠杆菌由于宿主经常导致不溶性和/或无功能的蛋白质。在这里,我们回顾了克服这些障碍的新方法,这些策略侧重于以未修饰的形式控制目标蛋白的表达,或通过使用表达性和溶解性标签进行修饰。
简介
像肠杆菌这样的微生物大肠杆菌是蛋白重组表达的杰出工厂。一种用于生产重组蛋白的表达系统大肠杆菌通常涉及一个质粒和一个菌株的结合大肠杆菌[1].重组蛋白表达的主要目的往往是在细菌细胞中获得高度积累的可溶性产物。这种策略并不总是被宿主的代谢系统所接受,在某些情况下会遇到细胞应激反应。在重组系统中遇到的另一个反应是目标蛋白积累成称为包涵体的不可溶聚集物。这些聚集的蛋白质通常是错误折叠的,因此没有生物活性[2].
在正常细胞条件下,细胞质蛋白质的一个子集能够自发折叠[3.]而容易聚集的蛋白质需要存在大量分子伴侣,这些分子伴侣与新生多肽链可逆相互作用,以防止折叠过程中的聚集[4].因此,细菌细胞中过表达的重组蛋白聚集可能是由于折叠中间体的高浓度积累或分子伴侣的低效处理造成的。对于容易聚集的重组蛋白的有效折叠,目前还没有通用的方法。1].
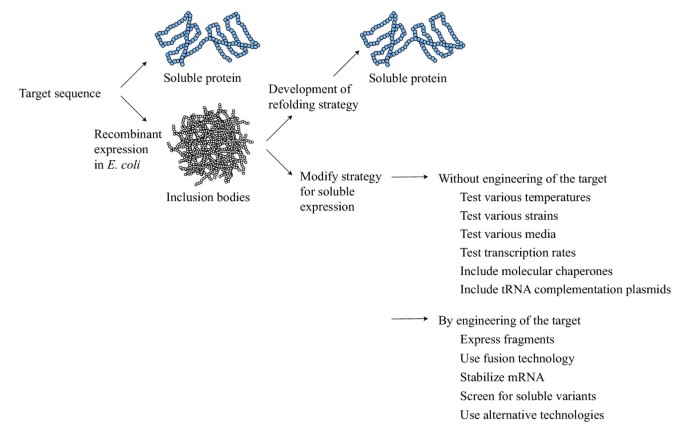
文献描述了许多将蛋白质从包涵体重定向到可溶性细胞质部分的方法(图1).总的来说,它们可以分为蛋白质从包涵体重新折叠的过程[5]以及修改表达策略以获得可溶性表达的程序。在这篇综述中,我们着重于开发的方法可溶性表达大肠杆菌细胞质。从包涵体重新折叠在许多情况下被认为是不可取的,但有时是选择的方法。主要障碍是回收率低,需要优化每个目标蛋白的复折叠条件,再溶解过程可能会影响复折叠蛋白的完整性。此外,纯化高表达可溶性蛋白比从包涵体中重折叠和纯化成本更低,耗时更久。因此,最大限度地以可溶性形式生产重组蛋白是一种有吸引力的替代方案在体外重折叠过程。用于介导可溶性表达的方法可分为避免修饰目标的方法和设计目标序列的方法(图2)1).
避免修改目标的策略
一些蛋白质通过其催化特性直接影响宿主的细胞代谢,但在一般情况下,重组蛋白的表达会引起“代谢负担”。代谢负担定义为为维持和表达外源DNA而从宿主代谢中提取的资源量(原料和能量)[6].包涵体的形成是对变性蛋白质积累的反应。代谢负担和包涵体的形成没有直接联系,但都是决定细胞产生可溶性重组蛋白能力的主要因素。由于变性蛋白的积累和代谢负担可以由一些环境因素控制,我们能够部分地控制可溶性蛋白的形成在活的有机体内.
蛋白质在低温下的表达
一个众所周知的技术来限制在活的有机体内重组蛋白的聚合包括在低温下培养[7].这一策略已被证明有效地提高了许多困难蛋白的溶解度,包括人干扰素α-2、枯草菌素E、蓖麻毒素a链、细菌荧光素酶、Fab片段、β-内酰胺酶、水稻脂氧合酶L-2、大豆氧合酶L-1、卡那霉素核素基转移酶和兔肌糖原磷酸化酶(见[8]以及其中引用的参考文献)。
聚合反应通常在较高的温度下是有利的,因为决定聚合反应的疏水相互作用具有强烈的温度依赖性[9].温度降低的一个直接后果是在过表达条件下诱导的热休克蛋白酶的部分消除[10].此外,活性和表达的数量大肠杆菌伴侣在30°C左右时增加[11,12].这些因素部分解释了在低温下正确折叠的稳定性和潜力的增加。
然而,突然降低培养温度会抑制复制、转录和翻译[13].在载体中用于重组蛋白表达的传统启动子在效率方面也受到强烈影响[14].当使用中强或弱启动子或部分诱导强启动子时,也可达到类似的转录效果。低诱导水平已被发现可导致较高数量的可溶性蛋白质[15].这是细胞蛋白质浓度降低的结果,有利于折叠。然而,细菌的生长减少,从而导致生物量的减少。
在低温下优化重组蛋白表达的不同策略如下。
系统基于cspA启动子是为蛋白质在低温下的表达而开发的[16].的cspA启动子在低温下被高度诱导,在37℃及以上被很好地抑制。编码有毒的TolAI-β-内酰胺酶融合蛋白的序列大肠杆菌并在37°C下迅速降解cspA启动子。温度降至15或23°C可以消除融合蛋白的降解,37°C时与表达相关的毒性表型被抑制。这表明,该系统是一个有价值的工具,以生产蛋白质包含膜跨结构域或其他不稳定的基因产物大肠杆菌.
最近提出了一种在4°C下允许蛋白质表达和折叠的原理[17].这一原理是基于目标蛋白与来自嗜冷细菌的伴侣蛋白的共表达。两个伴侣蛋白(Cpn60和Cpn10来自Oleispira南极洲RB8T)允许大肠杆菌在4°C下快速生长[12].一个酯酶o .南极洲RB8TCpn60和Cpn10在大肠杆菌在4°C。与37°C下培养制备的酶相比,该方法使纯化酯酶的比活性提高了180倍。结果表明,低温有利于重组蛋白的折叠,该系统可作为重组蛋白在大豆细胞质中表达和正确折叠的工具大肠杆菌.
大肠杆菌用于提高可溶性表达的菌株
许多专门的宿主菌株已经被开发出来,以克服与高水平蛋白质表达相关的代谢负担。
两个大肠杆菌突变株对难溶重组蛋白的可溶性表达有显著贡献。C41(DE3)和C43(DE3)是一种在亲本菌株BL21(DE3)中无法高水平表达的一些球状蛋白和膜蛋白的过表达突变体[18].F的表达式1Fo这些菌株的ATP合成酶亚基b膜蛋白,特别是C43(DE3),伴有胞内膜增殖,包涵体缺失[19].这些菌株现在被阿维迪斯公司商业化http://www.avidis.fr已发表了大量关于它们在难表达蛋白中的应用的报告[20.- - - - - -23].最近的一项研究报道,编码毒性蛋白的质粒在C41(DE3)中,尤其是在C43(DE3)中,稳定性有所增加[24].
半胱氨酸大肠杆菌细胞质通过硫氧还蛋白还原酶和戊氧还蛋白的途径积极地保持还原。来自Novagen的Origami菌株改进了异种蛋白质的二硫键依赖折叠。中断trxB而且气油比基因编码的两种还原酶,允许形成二硫键在大肠杆菌细胞质。的trxB(Novagen AD494)和trxB /气油比(Novagen Origami)的阴性菌株大肠杆菌在几种表达情况下被选中[25- - - - - -27].在缺乏硫氧还蛋白还原酶的菌株中,目标蛋白的折叠和二硫键的形成通过与硫氧还蛋白融合而增强(trxB) [28].细胞质中过表达的胞外折叠酶DsbC进一步刺激二硫键的形成[27].
改良培养策略以获得可溶性蛋白
生产重组蛋白最简单的方法是批量培养。在这里,生长所需的所有营养物质从一开始就得到供应,在这一过程中对生长的控制是有限的。这种限制通常会导致生长介质的变化,如pH值和溶解氧浓度的变化以及底物消耗。此外,各种代谢途径的抑制产物积累。在批量培养中,细胞密度和产量水平只是中等。
在饲料批量栽培中,能源的浓度可以根据消耗的速度进行调整。还可以调节其他几个因素,以获得每生物量目标蛋白的最大生产水平。通过流式细胞仪监测本征光散射的变化,可以跟踪包涵体的形成[29].这允许在检测到低水平的包涵体时实时优化生长条件,并且可以潜在地避免包涵体的形成[30.].
某些蛋白质的折叠需要一种特定的辅因子的存在。在培养基中加入这种辅助因子或结合伙伴可显著提高可溶性蛋白的产量。这在血红蛋白的重组突变体中得到了证明,当血红素过量时,可溶性产物的积累得到了改善[31].类似地,观察到格罗多宾溶解度增加50%大肠杆菌在0.1 mM Mg的存在下培养重组体2 +[32].影响重组蛋白可溶性表达的一个重要因素是培养基的组成和优化。虽然这主要是通过试验和错误来实现的,但它仍然可能是有益的。
分子伴侣驱动重组蛋白的折叠
预防包涵体形成的一种可能的策略是分子伴侣的共过表达。这种策略是有吸引力的,但不能保证伴侣提高重组蛋白的溶解度。大肠杆菌编码伴侣蛋白,其中一些驱动折叠尝试,而另一些则阻止蛋白质聚集[4,11,33].一旦新合成的蛋白质离开大肠杆菌核糖体与触发因子伴侣相关联[34].新合成的蛋白质上暴露的疏水斑块通过与触发因子的结合免受意外的分子间或分子内相互作用,从而防止过早折叠。蛋白质从触发因子释放后,可以开始或继续折叠成原生状态。以非原生和聚集倾向构象捕获的蛋白质是DnaK和GroEL的底物。DnaK (Hsp70伴侣家族)通过减少错误折叠蛋白质的聚集和促进蛋白质水解来阻止包涵体的形成[11].涉及DnaK和ClpB的双伴侣系统(Hsp100伴侣家族)介导蛋白质的增溶或分解[35].GroEL (Hsp60伴侣家族)在可溶性和不可溶性蛋白质组分之间进行蛋白质转运,并积极参与分解和包涵体的形成。小热休克蛋白lbpA和lbpB保护热变性蛋白不可逆聚集,并已发现与包涵体相关[36,37].
在几个实例中,伴侣编码基因和重组靶蛋白同时过表达被证明是有效的。重组中触发因子的共同过表达阻止了小鼠内皮抑素、人氧调节蛋白ORP150、人溶菌酶和豚鼠肝转谷氨酰胺酶的聚集[38,39].可溶性表达进一步被GroEL-GroES和DnaK-DnaJ-GrpE伴侣系统和触发因子共同过表达所刺激。39].伴侣系统是合作的,最有利的策略是共同表达属于GroEL、DnaK、ClpB和核糖体相关触发因子家族的伴侣[40- - - - - -42].
相互作用伙伴和蛋白质折叠
蛋白质不溶性大肠杆菌细胞质与蛋白质表面疏水残基的分布有一定的关系。因此,在缺乏合适的结合伙伴时,异质多聚体蛋白亚基的可溶性表达有时会出现包涵体形成。
可溶性表达大肠杆菌噬菌体T4基因23产物(主要衣壳蛋白)的表达需要基因31产物(噬菌体共伴侣蛋白gp31)的共表达[43].正确的相互作用伙伴的表达使gp23能够正确折叠并在细胞质中形成长规则结构大肠杆菌.
另一项研究报告了通过表达每个亚基(信息素a和C)作为硫氧还蛋白的融合来纯化异二聚体复合物[44].当硫氧还蛋白被蛋白水解去除时,每个亚基在溶液中保持可溶性,只有在另一个亚基存在的情况下。
总之,互动伙伴有潜在的好处在活的有机体内目标蛋白的溶解度。参与复杂结构的多种蛋白质共表达的新系统使这种策略成为可能[1].
涉及工程靶蛋白的策略
目标蛋白并不总是通过上述策略以可溶性形式表达。本综述的最后一部分讨论了错误折叠的蛋白质如何被设计或推动进化和选择以获得可溶性表达。
融合蛋白技术
在重组蛋白纯化中使用亲和标签有着悠久的传统。它们不仅被用于开发通用纯化策略。亲和标签已被观察到提高蛋白质产量,以防止蛋白质水解和增加溶解度在活的有机体内[1,45].
迄今为止最有效的增强溶解性的蛋白质是大肠杆菌麦芽糖结合蛋白和大肠杆菌氮利用物质A (NusA)。MBP (40 kDa)和NusA (54.8 kDa)作为增强溶解度的伙伴,特别适合于易于形成包涵体的蛋白质的表达。虽然许多蛋白质是高可溶性的,但它们并非都是有效的溶解度增强剂。大肠杆菌在溶解度增强特性的比较中,MBP被证明是比高可溶性GST和硫氧还蛋白更有效的溶解度伙伴[46].溶解度增强是来自许多生物体的麦芽糖糊精结合蛋白(MBPs)的共同特征,其中一些甚至比大肠杆菌MBP [47].MBP增强溶解度的精确机制尚未发现。然而,MBP可以作为伴侣,通过其表面的溶剂暴露的“热点”相互作用,稳定否则不溶的乘客蛋白[48,49].通过添加附加标签,可以提高MBP促进融合伙伴溶解度的能力。不同配置的MBP融合蛋白已被建议用于高通量蛋白表达和纯化[50].
威尔金森和哈里森提出了一个模型的溶解度百分比的理论计算重组蛋白表达在大肠杆菌细胞质(51].用于计算此索引的web服务器在http://www.biotech.ou.edu.威尔金森-哈里森模型和实验数据表明NusA是非常有利的溶解度伙伴[52].NusA的主要优点除了良好的溶解性外,还在于其高表达性。MBP和NusA都已被用于可溶性高不溶性单链抗体的细胞质大肠杆菌[48,53].文献中有大量MBP和NusA作为功能性溶解增强剂的例子[54- - - - - -57].
天然分子伴侣已被用作溶解度增强剂包括脯氨酸顺反式异构酶[58],硫氧还蛋白[59]和dsbA [60].
融合伙伴如MBP和NusA是相对较大的蛋白质。我们最近建议使用翻译起始因子IF2的高可溶性n端片段(17.4 kDa)作为溶解度伙伴[61].小伙伴的使用减少了获得一定数量分子所需的能量,减少了空间位阻,简化了NMR等下游应用。另一种相对较小的蛋白质,barnase被认为发挥伴侣样功能在活的有机体内而且在体外当融合到IgG轻链可变结构域的c端时[62].
最近的一项研究表明,Pfg27的17残基c端延伸导致可溶性表达数倍增强[63].多项研究表明,蛋白质末端残基的性质可以在蛋白酶的识别和后续作用中发挥作用[64,65].因此,蛋白质的末端延伸可能间接地保护它们免受与部分蛋白质水解降解相关的变性/错误折叠。也有人认为肽延伸的大净电荷增加了新生多肽之间的静电斥力,因此增强了它们的正确折叠[66].
采用筛选策略,以高通量的方式选择有利的融合伙伴。在这样的系统中,超过80%的测试蛋白质显示出高水平的可溶性产物表达,与8个融合伙伴中的至少一个,包括NusA, intein,硫氧还蛋白,His-tag, MBP,钙调蛋白结合蛋白和谷胱甘肽- s转移酶[67].这些结果得到了另一项类似研究的支持[68].
可溶性变异的筛选和选择
结构和功能基因组学和蛋白质组学是基因功能评价的重要组成部分。以高通量的方式表达和纯化适当折叠的蛋白质是这些研究的关键要素。一些不同的方法,以高通量筛选可溶性表达产物最近已被描述。
通过对目标蛋白进行工程改造,可以提高目标蛋白的内在折叠率、稳定性和溶解性。在结构信息可用的情况下,通过合理的位点定向诱变提高了表达蛋白的溶解度[69].一个更普遍的方法是通过定向进化找到更多可溶的变种。在这种情况下生成的库包括随机点突变,删除和片段[70].生成的突变体通过感兴趣蛋白质的功能或更一般的筛选来筛选溶解度。基于生物活性的筛选意味着必须为研究的每一种新蛋白质开发一种新的测定方法。此外,在许多情况下,所研究的蛋白质或蛋白质结构域根本没有显示出任何已知的活性。一般筛选包括融合报告方法、应力报告方法和直接方法,因此通常是高通量方法的首选。
荧光的大肠杆菌表达与gfp基因融合的靶基因的细胞与单独表达的靶基因的溶解度有关[71].因此,蛋白质折叠大肠杆菌可以通过定向进化方法通过筛选荧光突变体对特定靶蛋白进行改进。这种方法进化出了三种不溶性蛋白质,包括Pyrobaculum aerophilum甲基转移酶、酒石酸脱水酶β-亚基和核苷二磷酸激酶分别可溶50%、95%和90% [72].GFP报告系统进一步用于筛选相互作用伙伴对不溶性目标的溶解。整合宿主因子β在GFP上游的融合导致聚集,而结合伙伴(整合宿主因子α)的共表达则显著增加荧光[73].
类似的方法是使用选择压力。通过将目标蛋白与氯霉素乙酰转移酶(CAT)融合,在氯霉素含量逐渐升高的培养基上选择了更多可溶性融合蛋白突变体[74].此外,选择压力(融合到卡那霉素磷酸转移酶)被用于一个系统,旨在获得由cDNA片段编码的可溶性蛋白,以高通量方法[75].
另一种融合报告方法使用β-半乳糖苷酶α肽作为lacZα互补筛选的融合伙伴,其中不活跃的lacZΩ被提供在反式.活性β-半乳糖苷酶可在α肽变得可溶并通过与lacZΩ结合而恢复酶活性时被检测到[76].
当重组表达的蛋白质错误折叠时,会诱导宿主细胞产生先天反应。这种反应可以通过转录来监测大肠杆菌当错误折叠的蛋白质表达时上调的启动子。研究发现,小热休克蛋白ibpA的启动子可与lacZ融合,可作为错误折叠蛋白的报告子[77].本报告能区分可溶性、部分可溶性和不可溶性重组蛋白。基因筛选和定向进化在其他地方进一步审查[78].
可溶性融合蛋白不一定具有生物活性和正确折叠。一些报道表明,与未融合蛋白相比,融合蛋白的可溶性制剂具有较低的生物活性[79].结果表明,HPV癌蛋白E6与MBP融合形成由折叠的MBP和错误折叠的E6组成的可溶性多聚体。通过筛选单分散性,优化表达条件可以避免这些“可溶性包涵体”[79].
选择策略
已经开发了一些与传统融合伙伴和选择方法截然不同的策略,以潜在地拯救重组蛋白,使其免于在细胞中发生错误折叠大肠杆菌细胞质。
开发了一种基于人工油体的系统,并以一种由油酸蛋白和GFP组成的融合蛋白[80].表达的融合蛋白存在于不溶性的细胞部分,但在纯化的包涵体中加入三酰甘油和磷脂后可被重组为油体。利用工程因子Xa裂解位点和离心法可将GFP从油体中分离出来。
一个在活的有机体内基于大肠杆菌核糖体最近被提出[81].目标蛋白被解救出来在活的有机体内通过融合到核糖体蛋白L23而聚集。融合蛋白在一株大肠杆菌缺乏必需的L23核糖体蛋白。这允许目标蛋白与高可溶性核糖体颗粒的共价偶联。具有偶联靶蛋白的核糖体随后可通过离心方法分离,靶蛋白通过位点特异性蛋白酶裂解以高度富集的形式释放。
结论
我们综述了从植物中获得可溶性和功能性蛋白制剂的最新进展大肠杆菌重组。该方法的一个子集集中于缓解细胞应激,这是对宿主细胞在单一或少数蛋白质高表达过程中所经历的极端代谢情况的反应。第二种方法侧重于通过目标蛋白与特定肽标签的结合来提高表达蛋白的溶解度和结构稳定性。现代表达策略的一个共同特征是遗传工具箱中工具的巧妙组合,但也不断重新考虑蛋白质表达交易中公认的范例。
参考文献
Sørensen HP, Mortensen KK:大肠杆菌重组表达的先进遗传策略。中国生物医学工程学报,2005,29(4):531 - 531。10.1016 / j.jbiotec.2004.08.004。
Villaverde A, Carrio MM:蛋白质聚集在重组细菌:包涵体的生物学作用。生物工程学报,2003,25(3):366 - 366。10.1023 /: 1025024104862。
Anfinsen CB:控制蛋白质链折叠的原则。科学通报,2003,19(3):344 - 344。
傅海涛,张志刚,张志刚:细胞质中的分子伴侣蛋白:从新生链到折叠蛋白。科学通报,2002,29(3):344 - 344。10.1126 / science.1068408。
Middelberg A:制备性蛋白质再折叠。生物技术,2002,20:437-10.1016/S0167-7799(02)02047-4。
Bentley WE, Kompala DS:重组细菌培养中蛋白质合成的最佳诱导。中国科学(d辑),1999,29(1):1- 8。
可溶性重组蛋白在细菌中的生产。生物技术。1989, 7: 1141-1148。
Vasina JA, Baneyx F:低温下易聚集重组蛋白的表达:大肠杆菌cspA和tac启动子系统的比较研究。中国生物医学工程学报,1997,19(4):457 - 457。10.1006 / prep.1996.0678。
kifhaber T, Rudolph R, Kohler HH, Buchner J:体外和体内蛋白质聚集:折叠和聚集动力学竞争的定量模型。生物技术学报,1999,9:825-829。10.1038 / nbt0991 - 825。
Chesshyre JA, Hipkiss AR:低温稳定干扰素a-2对抗甲基嗜氧菌和大肠杆菌的蛋白质水解。中国生物医学工程学报,1998,31(3):344 - 344。10.1007 / BF00262455。
莫格·A,梅耶MP, Deuerling E:蛋白质折叠机制:分子伴侣及其在生物技术中的应用。化学与生物工程学报,2002,30(3):344 - 344。10.1002 / 1439 - 7633所(20020902)< 807::AID-CBIC807 > 3.0.CO;通透。
Ferrer M, Chernikova TN, Yakimov MM, Golyshin PN, Timmis KN:伴侣蛋白控制大肠杆菌在低温下的生长。中国生物工程学报,2003,29(4):344 - 344。10.1038 / nbt1103 - 1266。
肖MK, Ingraham JL:大肠杆菌在生长的最低温度附近合成大分子。中华微生物学杂志,2004,27(3):357 - 357。
Vasina JA, Baneyx F:大肠杆菌冷休克启动子cspA转录控制下低温下重组蛋白的表达。环境科学与技术,1998,28(3):344 - 344。
Weickert MJ, Doherty DH, Best EA, Olins PO:大肠杆菌外源蛋白生产的优化。中国生物医学工程学报,1996,7:494-499。10.1016 / s0958 - 1669(96) 80051 - 6。
Mujacic M, Cooper KW, Baneyx F:大肠杆菌低温蛋白表达的冷诱导克隆载体:在毒性和蛋白水解敏感融合蛋白生产中的应用。基因工程学报,1999,38(3):344 - 344。10.1016 / s0378 - 1119(99) 00328 - 5。
Ferrer M, Chernikova TN, Timmis KN, Golyshin PN:一种基于伴侣蛋白的新型大肠埃希菌温度敏感酯酶的表达。环境科学学报,2004,29(4):349 - 349。10.1128 / aem.70.8.4499 - 4504.2004。
Miroux B, Walker JE:大肠杆菌中蛋白质的过度生产:突变宿主允许高水平合成一些膜蛋白和球状蛋白。中华生物医学杂志,1996,26(3):349 - 349。10.1006 / jmbi.1996.0399。
Arechaga I, Miroux B, Karrasch S, Huijbregts R, de Kruijff B, Runswick MJ, Walker JE:伴随着F(1)F(o) ATP合酶B亚基大规模过度生产的大肠杆菌新胞内膜的特征。中国生物医学工程学报,2000,29(3):344 - 344。10.1016 / s0014 - 5793(00) 02054 - 8。
Steinfels E, Orelle C, Dalmas O, Penin F, Miroux B, Di Pietro A, Jault JM:枯草芽孢杆菌中多药样atp结合盒式转运体YvcC在大肠杆菌中的高效过量生产。生物化学学报,2002,27(1):1-5。
Smith VR, Walker JE:固定化金属离子亲和层析纯化和折叠重组牛羟戊二酸/苹果酸载体。中国生物医学工程学报,2003,29(4):349 - 349。
Arechaga I, Miroux B, Runswick MJ, Walker JE:大肠杆菌F1F(o)- atp酶亚基a的过表达被uncB基因转录本的不稳定性所抑制。中国农业科学,2003,29(4):457 - 457。10.1016 / s0014 - 5793 (03) 00677 - x。
Sørensen HP, Sperling-Petersen HU, Mortensen KK:在大肠杆菌中表达的重组热稳定性蛋白的生产:蛋白质合成的完成是瓶颈。中国生物医学工程学报,2003,26(3):344 - 344。10.1016 / s1570 - 0232 (02) 00689 - x。
Dumon-Seignovert L, Cariot G, Vuillard L:重组蛋白在大肠杆菌中的毒性:BL21(DE3), C41(DE3)和C43(DE3)过表达的比较。中国生物医学工程学报,2004,37(3):344 - 344。10.1016 / j.pep.2004.04.025。
Lehmann K, Hoffmann S, Neudecker P, Suhr M, Becker WM, Rosch P:花生主要过敏原Ara h 2在大肠杆菌中的高产表达、纯化和鉴定。中国生物医学工程学报,2003,31:250-259。10.1016 / s1046 - 5928(03) 00190 - 6。
李志强,李志强,李志强,李志强,李志强:一种来自杜氏藻的耐盐α型碳酸酐酶在大肠杆菌中的功能表达。中国生物医学工程学报,2003,28:151-157。10.1016 / s1046 - 5928(02) 00683 - 6。
贝塞特PH, Aslund F, Beckwith J, Georgiou G:大肠杆菌细胞质中含有多个二硫键的蛋白质的高效折叠。自然科学进展,1999,26(3):366 - 366。10.1073 / pnas.96.24.13703。
李志强,李志强,李志强,等。硫氧还蛋白在大肠杆菌细胞质中的作用。中国生物工程学报,2004,18(4):457 - 457。10.1093 / emboj / 17.19.5543。
Fouchet P, Manin C, Richard H, Frelat G, Barbotin JN:流式细胞术对重组大肠杆菌批量培养和连续培养中DNA和RNA含量的研究;光散射参数。中国生物医学工程学报,1994,29(4):344 - 344。10.1007 / BF00178494。
Lewis G, Taylor IW, Nienow AW, Hewitt CJ:多参数流式细胞仪在重组大肠杆菌分批发酵工艺研究中的应用。中华微生物学杂志,2004,31:311-322。10.1007 / s10295 - 004 - 0151 - 8。
Weickert MJ, Pagratis M, Glascock CB, Blackmore R:在血红素过剩的大肠杆菌中提高可溶性重组血红蛋白积累的突变。环境科学学报,1999,29(3):344 - 344。
杨强,徐娟,李敏,雷霞,安龙:可溶性蛇毒酶gloshedobin在金属离子存在下在大肠杆菌中的高水平表达。生物工程学报,2003,25(3):357 - 357。10.1023 /: 1023067626846。
许志刚,李志刚,李志刚:分子伴侣蛋白在体内、体外折叠过程中的作用。生物化学学报,1996,27(3):344 - 344。
Deuerling E, Patzelt H, Vorderwulbecke S, Rauch T, Kramer G, Schaffitzel E, Mogk A, Schulze-Specking A, Langen H, Bukau B: Trigger Factor和DnaK具有重叠的底物池和结合特异性。中国生物医学工程学报,2003,29(3):344 - 344。10.1046 / j.1365-2958.2003.03370.x。
Schlieker C, Bukau B, Mogk A:分子伴侣在大肠杆菌细胞质中预防和逆转蛋白质聚集:对其在生物技术中的适用性的影响。中国生物工程学报,2002,26(3):344 - 344。10.1016 / s0168 - 1656(02) 00033 - 0。
Kuczynska-Wisnik D, Kedzierska S, Matuszewska E, Lund P, Taylor A, Lipinska B, Laskowska E:大肠杆菌小热休克蛋白IbpA和IbpB在极端热休克时阻止体内变性内源性蛋白的聚集。微生物学学报,2002,38(3):357 - 357。
Kitagawa M, Miyakawa M, Matsumura Y, Tsuchido T:大肠杆菌小热休克蛋白,IbpA和IbpB,保护酶免受热和氧化剂的失活。中国生物医学工程学报,2002,29(4):457 - 457。10.1046 / j.1432-1033.2002.02958.x。
Ikura K, Kokubu T, Natsuka S, Ichikawa A, Adachi M, Nishihara K, Yanagi H, Utsumi S:折叠调节剂的共过表达提高了重组豚鼠肝脏谷氨酰胺转胺酶在大肠杆菌中的溶解性。生物工程学报,2002,32:189-205。10.1081 / pb - 120004130。
Nishihara K, Kanemori M, Yanagi H, Yura T:触发因子过表达抑制重组蛋白在大肠杆菌中的聚集。环境科学学报,2000,26(3):344 - 344。10.1128 / aem.66.3.884 - 889.2000。
Amrein KE, Takacs B, Stieger M, Molnos J, Flint NA, Burn P:从产生细菌伴侣GroES和GroEL的大肠杆菌表达系统中纯化重组人p50csk蛋白酪氨酸激酶。中国科学:自然科学,2004,19(2):349 - 349。
Nishihara K, Kanemori M, Kitagawa M, Yanagi H, Yura T:伴侣共表达质粒:DnaK-DnaJ-GrpE和GroEL-GroES在协助日本雪松花粉Cryj2过敏原在大肠杆菌中的折叠中的差异和协同作用。环境科学与技术,1998,29(4):489 - 497。
hold D, Yaeger K, Novy R:大肠杆菌扩展相容性的新共表达载体。创新。2003, 18: 4-6。
Kurochkina LP, Mesyanzhinov VV:噬菌体T4基因31和23产物的共表达。生物化学(Mosc)。1999, 44(4): 454-458。
在大肠杆菌中获得具有生物活性的重组异二聚体蛋白的新方法。中国生物医学工程学报,2003,27(3):344 - 344。10.1016 / s1570 - 0232(02) 00720 - 1。
Makrides SC:在大肠杆菌中实现高水平基因表达的策略。微生物学通报,1996,30(4):344 - 344。
Kapust RB, Waugh DS:大肠杆菌麦芽糖结合蛋白在促进其融合的多肽的溶解度方面具有不同寻常的效果。中国生物医学工程学报,1999,8:1668-1674。
Fox JD, Routzahn KM, Bucher MH, Waugh DS:来自不同细菌和古生菌的麦芽糊精结合蛋白是有效的溶解度增强剂。中国农业科学,2003,27(3):344 - 344。10.1016 / s0014 - 5793 (03) 00070 - x。
Bach H, Mazor Y, shake S, shohaml - lev A, Berdichevsky Y, Gutnick DL, Benhar I:大肠杆菌麦芽糖结合蛋白作为重组胞内单链抗体的分子伴侣。中华分子生物学杂志,2001,312:79-93。10.1006 / jmbi.2001.4914。
Fox JD, Kapust RB, Waugh DS:大肠杆菌麦芽糖结合蛋白表面的单氨基酸取代可以对融合蛋白的溶解度产生深远影响。中国生物医学工程学报,2001,10:622-630。10.1110 / ps.45201。
Routzahn KM, Waugh DS:补充亲和标记对MBP融合蛋白溶解度的差异影响。中国生物医学工程学报,2002,23(3):344 - 344。10.1023 /: 1020424023207。
威尔金森DL,哈里森RG:预测重组蛋白在大肠杆菌中的溶解度。生物技术学报,1999,9:443-448。10.1038 / nbt0591 - 443。
Davis GD, Elisee C, Newham DM, Harrison RG:新的融合蛋白系统设计给大肠杆菌可溶性表达。生物工程学报,1999,29(3):344 - 344。
郑琳,鲍曼,李建平,等:细菌细胞质中功能性催化抗体ScFv-NusA融合蛋白的制备。J生物化学(东京)。2003, 34(3): 377 - 381。
Elizeev R, Alexandrov A, Gunter T: Bax p18型MBP融合蛋白的高产表达和纯化。中国生物医学工程学报,2004,34(3):344 - 344。10.1016 / j.pep.2004.01.015。
Smyth DR, Mrozkiewicz MK, McGrath WJ, Listwan P, Kobe B:具有大亲和力标签的融合蛋白的晶体结构。中国生物工程学报,2003,12:1313-1322。10.1110 / ps.0243403。
Ermolova NV, Cushman MA, Taybi T, Condon SA, Cushman JC, Chollet R: CAM诱导的Mesembryanthemum crystallinum中可溶性增强的植物peg -羧化酶激酶的表达、纯化和初步表征。中国生物医学工程学报,2003,29(3):344 - 344。10.1016 / s1046 - 5928(03) 00014 - 7。
吴建平,李志强,陈志强,陈志强:恶性疟原虫恶性蛋白酶-2在大肠杆菌中的可溶性表达。中国生物医学工程学报,2003,32:194-201。10.1016 / s1046 - 5928(03) 00225 - 0。
Ideno A, Furutani M, Iwabuchi T, Iida T, Iba Y, Kurosawa Y, Sakuraba H, Ohshima T, Kawarabayshi Y, Maruyama T:外源蛋白与古菌FK506结合蛋白融合在大肠杆菌中的表达。中国生物医学工程学报,2004,29(4):344 - 344。10.1007 / s00253 - 003 - 1459 - 4。
Jacquet A, Daminet V, Haumont M, Garcia L, Chaudoir S, Bollen A, Biemans R:重组弓形虫ROP2片段作为融合蛋白在细菌中的表达避免了不溶性和蛋白水解降解。中国生物医学工程学报,1999,17:392-400。10.1006 / prep.1999.1150。
张艳,阮文凯,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。中国生物医学工程学报,1998,29(3):357 - 357。10.1006 / prep.1997.0834。
Sørensen HP, Sperling-Petersen HU, Mortensen KK:链霉亲和素重组表达的良好溶解度伙伴。中国生物医学工程学报,2003,32:252-259。10.1016 / j.pep.2003.07.001。
Matsev SP, Tsybovsky YI, Stremovskiy OA, Odintsov SG, Balandin GT, Arosio P, Kravchuk ZI, Deyev SM:抗铁蛋白抗体VL结构域与barnase融合可增强溶解性和pH稳定性。蛋白质工程学报,2004,17:85-93。10.1093 /蛋白质/ gzh011。
王晓明,陈晓明,陈晓明,王晓明,等:恶性疟原虫性分期特异性蛋白在大肠杆菌中过表达的末端残基对蛋白折叠和溶解的影响。中国生物医学工程学报,2002,29(4):457 - 457。10.1046 / j.1432-1033.2002.03237.x。
Silber KR, Keiler KC, Sauer RT: Tsp:一种尾特异性蛋白酶,可选择性降解具有非极性c端蛋白。中国科学:自然科学,2001,29(3):366 - 366。
Bowie JU, Sauer RT:保护蛋白免于细胞内蛋白水解的c端延伸的鉴定。中国生物医学工程学报,1998,26(4):457 - 457。
张艳,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。高负电荷肽延伸抑制过表达蛋白聚集。中国生物医学工程学报,2004,36(3):344 - 344。10.1016 / j.pep.2004.04.020。
石佩萍,龚文敏,陈建昌,叶春春,王海杰,王廷峰:可溶性重组蛋白的高通量筛选。中国生物工程学报,2002,11:1714-1719。10.1110 / ps.0205202。
Hammarström M, Hellgren N, van den Berg S, Berglund H, Härd T:在大肠杆菌中快速筛选作为融合蛋白产生的提高溶解度的人类小蛋白。中国生物工程学报,2002,11:313-321。10.1110 / ps.22102。
Dale GE, Broger C, Langen H, D´arcy A, Stuber D:通过合理设计氨基酸替代品提高蛋白质的溶解度。中国生物工程学报,2004,27(3):344 - 344。
范丽娜,李志刚,李志刚:定向酶进化。中国生物工程学报,2001,12:545-551。10.1016 / s0958 - 1669(01) 00261 - 0。
王丽娟,王丽娟,王丽娟,等。绿色荧光蛋白在蛋白质折叠检测中的应用。中国生物工程学报,1999,17:691-695。10.1038/10904。
Pedelacq JD, Piltch E, Liong EC, Berendzen J, Kim CY, Rho BS, Park MS, Terwilliger TC, Waldo GS:结构基因组学中的可溶性蛋白工程。中国生物工程学报,2002,30(4):344 - 344。10.1038 / nbt732。
王华,崇生:细菌蛋白质偶联折叠和结合的可视化及异二聚物的纯化。自然科学进展,2003,30(4):349 - 349。10.1073 / pnas.0236088100。
Maxwell KL, Mittermaier AK, Forman-Kay JD, Davidson AR:增加蛋白质溶解度的简单体内试验。中国生物工程学报,1999,8:1908-1911。
Nakayama M, Ohara O:利用可转换载体筛选大肠杆菌随机片段cdna产生的可溶性重组蛋白的系统。生物化学学报,2003,32(3):344 - 344。10.1016 / j.bbrc.2003.10.193。
韦格里,李文杰,李文杰,王文杰,王文杰,王文杰:利用基因标记蛋白的结构互补监测蛋白质在体内的溶解性和折叠。生物技术学报,2001,19:131-136。10.1038/84389。
李志强,李志强,王志强,王志强,等。基因表达对重组蛋白表达的影响。中国生物工程学报,2002,15:153-160。10.1093 /蛋白质/ 15.2.153。
Waldo GS:蛋白质溶解性的遗传筛选和定向进化。中国生物化学杂志,2003,7:33-38。10.1016 / s1367 - 5931(02) 00017 - 0。
Nomine Y, Ristriani T, Laurent C, Lefevre J, Weiss E, Trave G:融合蛋白单分散的优化策略:在重组HPV E6癌蛋白纯化中的应用。中国生物工程学报,2001,14:297-305。10.1093 /蛋白质/ 14.4.297。
彭春,陈建峰,陈敏,陈金华,陈建昌:用人工油体纯化大肠杆菌重组蛋白的研究。中国生物工程学报,2004,27(3):531 - 531。10.1016 / j.jbiotec.2004.03.013。
Sørensen HP, Kristensen JE, Sperling-Petersen HU, Mortensen KK:核糖体共价偶联聚合蛋白的可溶性表达。生物化学学报,2004,29(3):319 - 319。10.1016 / j.bbrc.2004.05.081。
确认
K.K.M由丹麦自然科学研究委员会(Danish Natural Science Research Council)和嘉士伯(Carlsberg)资助。21-03-0592, 21-04-0149 ANS-0987/40和ANS-1649/40)。
作者信息
作者及隶属关系
相应的作者
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
关于本文
引用本文
杨晓明,陈晓明,陈晓明,等。重组蛋白在植物细胞质中的可溶性表达大肠杆菌.微细胞事实4, 1(2005)。https://doi.org/10.1186/1475-2859-4-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1475-2859-4-1
关键字
- 重组蛋白
- 包涵体
- 融合的合作伙伴
- 麦芽糖结合蛋白
- 小热休克蛋白