摘要
快速诊断测试(RDTs)恶性疟原虫富组氨酸蛋白2 (HRP2)一直是疟疾诊断的重要工具,特别是在缺乏高质量显微镜的资源有限的环境中。恶性疟原虫缺失的寄生虫pfhrp2编码这种抗原的基因现在已经在亚洲、非洲和南美洲的几十个国家被发现,新的报告显示在一些选定的地区存在很高的缺失率。确定基于hrp2的快速诊断是否适合在一个地方继续使用,重点调查和/或地方病监测活动恶性疟原虫人口是需要的。各种调查和实验室方法已用于确定寄生虫HRP2表型和pfhrp2基因型和通过这些不同方法收集的数据需要在适当的调查和分析中加以解释。HRP2抗原的表达可以使用即时快速检测或基于实验室的免疫分析来评估,但确认缺失(或突变)pfhrp2需要更密集的实验室分子分析,大型调查尤其需要严格而实用的数据收集新工具和策略。由于疟疾诊断战略通常是在国家一级制定的,因此可能需要进行涵盖广泛地理区域和大量人口的具有全国代表性的调查和(或)监测。这里讨论的当代测定表型和基因型评价恶性疟原虫HRP2状态,考虑他们的优点和缺点,并强调与高效诊断政策决策所需的及时和资源意识工作流相关的关键概念。
背景
疟疾由疟原虫数千年来,物种一直困扰着人类,塑造着人类基因组。然而,直到19世纪晚期,随着显微镜和染色技术的进步,才出现了这种寄生虫的识别和可视化来确认感染。由于世界卫生组织(世卫组织)改变政策,要求在使用抗疟疾药物之前对所有年龄组的疟疾感染进行寄生虫学确认,因此,21世纪头十年开始广泛部署抗原检测疟疾快速诊断试验[1,2,3.,4].快速诊断检测已被证明是疟疾诊断、病例管理和流行病学监测的重要资产疟原虫血期感染的寄生虫学诊断存在抗原靶点[5].目前,最敏感和特异的RDT靶点是恶性疟原虫富组氨酸蛋白2 (HRP2),在血期感染时由裂殖子大量表达和释放[6,7].由于本病的优势和临床重要性恶性疟原虫在撒哈拉以南非洲地区以及高质量显微镜获得有限的情况下,许多国家目前使用仅检测HRP2的快速诊断检测作为其主要疟疾诊断检测方法[8].富含组氨酸的蛋白3 (HRP3)抗原与HRP2同源,由HRP2编码pfhrp3基因在13号染色体上,而pfhrp2在第8号染色体上发现[9,10].两种基因都在端粒下区域附近[11],其中通常发生重组。虽然在HRP3中也发现了许多相同的单克隆抗体表位[12],该蛋白的长度短得多,仅在较高的寄生虫密度下才会产生阳性RDT结果[13].
删除pfhrp2该基因最初是在培养适应的寄生虫中发现的,但人们认为这些突变体在自然环境中无法有效地建立人类感染。这是非常令人惊讶的,当一个很大的百分比恶性疟原虫2003年至2008年在秘鲁收集的分离株缺乏pfhrp2和/或pfhrp3(pfhrp2/3),其中HRP2-RDT的使用基本不存在[14].这种基因缺失的高流行率导致世界卫生组织建议在秘鲁使用针对替代抗原的测试或高质量显微镜诊断疟疾,并紧急绘制邻近国家和南美洲以外其他国家基因缺失的寄生虫的图谱[15].这份秘鲁报告发表于2010年,恶性疟原虫的缺失的种群pfhrp2/3已在疟疾流行地区的不同地区得到确认,令人担忧的是,在许多严重依赖基于hrp2的快速诊断的国家中[16) (apps.who.int /疟疾/地图/威胁)。然而,这些缺失的流行严重到最近才改变了厄立特里亚、吉布提和埃塞俄比亚的疟疾诊断策略,按照下面列出的世卫组织建议。以前的研究结果pfhrp2秘鲁、巴西、哥伦比亚、苏里南的缺失也导致这些国家优先考虑除HRP2以外的RDT目标恶性疟原虫诊断(16].99%的临床疟疾发生在撒哈拉以南非洲,因为恶性疟原虫,由于替代诊断方法的数量非常有限,需要令人信服的证据来证明当前基于hrp2的RDT诊断策略的改变是合理的。
世卫组织目前建议,如果当地流行疟疾,各国应改变其疟疾诊断政策pfhrp2缺失导致假阴性RDT导致症状恶性疟原虫感染率超过5% [17].对于大多数恶性疟原虫这种改变意味着从基于hrp2的单抗原RDT转向单寄生虫乳酸脱氢酶(Pan-pLDH) RDT,恶性疟原虫-特异性pLDH (Pf-pLDH) RDT,或多抗原检测(HRP2 + Pan-pLDH和/或Pf-pLDH)。尽管高缺失流行率的发现将使放弃仅hrp2的RDTs的决定更加直接,但已观察到的更常见的情况是低且主要是地理异质性的流行率pfhrp2有症状感染的缺失[18,19,20.,21,22,23,24],并有季节性波动[25].对于这些日益常见的情况,需要更严格的抽样,以便在国家一级获得准确和精确的流行率估计数,以供决策之用。此外,在全国范围内更换快速诊断诊断工具是一个极具挑战性的过程,涉及召回和/或销毁快速诊断诊断工具,由于供应商数量有限和成本增加,再培训卫生保健工作者,持续的绩效监测和其他后勤挑战,选择和分发替代性高质量快速诊断诊断工具可能更难获得[26].因此,不应轻易作出更改快速诊断方法的决定,而必须以准确、及时的监测数据和准确的流行率估计数为依据pfhrp2/3个缺失导致HRP2-RDTs阴性。
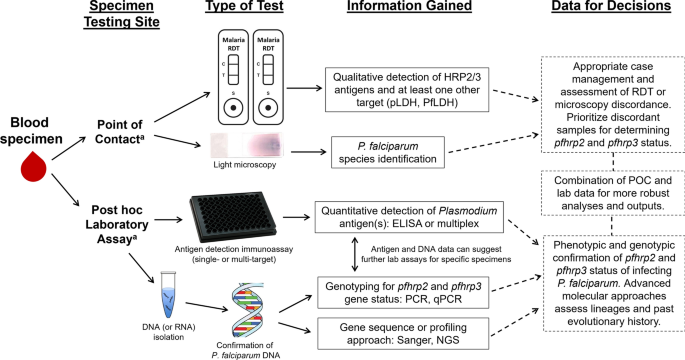
为了提高质量pfhrp2/3世卫组织在2019年发布了指导国家疟疾控制规划的标准调查议定书[17].该方案包括关于明确界定的调查人群、标准化抽样方法、伦理考虑以及确认缺失和估计流行率的技术程序的建议。这些建议和该领域日益增长的共识证实了严格的实验室方法确认缺失的重要性。2014年发表了一套准确报告基因缺失的建议[27并为基因缺失的实验室分析提供了技术指导。虽然这些建议提高了实验室结果的质量[16],计划修订和扩大这些建议,以适应近年来建立和越来越多地使用的新技术和方法。这里概述了目前可用的实验室分析,用于确认pfhrp2/3并考虑如何在HRP2诊断的基于数据的决策中最好地利用它们。图中列出了以下分析的数据收集类型和测试工作流程的总结。1.
HRP2抗原的表型筛选
检测血液中的HRP2(和HRP3)抗原恶性疟原虫被感染者可在护理点(15-30分钟内)或在实验室环境中进行数百次市售快速诊断,使用指尖刺取的毛细血管血。目前的商业和内部疟原虫抗原检测实验室免疫分析包括酶联免疫吸附试验、化学发光试验和珠基试验[7].这三种分析方法都可以以高通量格式应用于多种生物标本类型,以便在一个标准工作日内收集数百个血液样本的实际数据。同类最佳的常规HRP2-RDTs的分析灵敏度估计约为1.0 ng/mL血液[28],但实验室免疫分析已公布的定量下限低于0.01 ng/mL [7].而RDTs主要用于恶性疟原虫流行地区可能仅针对HRP2检测该寄生虫,少数地区也针对其他寄生虫恶性疟原虫特异性抗原,Pf-pLDH,或者可能只包括单一的非特异性泛pldh靶点。目前的HRP2 elisa仍为单靶点格式,可用的化学发光和珠基分析具有多种格式的优势,允许同时检测HRP2与其他疟原虫抗原。对个体生物标本进行HRP2存在/不存在的大规模表型筛选可以作为一种高通量经济工具,为HRP2的存在提供初步证据pfhrp2中的删除恶性疟原虫通过与非hrp2靶点的“不一致”来区分人群,无论这是抗原靶点还是其他指标恶性疟原虫感染。这种方法特别适用于大型调查和需要培训和依赖卫生工作者进行筛选的领域pfhrp2/3使用两个单独的rddt (HRP2靶向和Pf-pLDH或Pan-pLDH靶向)或HRP2 RDT和显微镜检查的缺失被认为是不可行的。
进一步描述有用的不一致诊断概要如下:
- 1.
恶性疟原虫镜检证实的血期寄生虫预计具有足够高的寄生虫密度,可用于基于高质量hrp2的快速诊断检测[5].因此,如果恶性疟原虫在血液涂片上可见寄生虫血症,但HRP2-RDT阴性,样本将被标记为不和谐。
- 2.
RDT检测HRP2和Pf-pLDH(或Pan-pLDH)可能会提供不一致的结果,如果pLDH为阳性,而HRP2为阴性。根据地方病的情况,Pan-pLDH +/ hrp2结果也可以解释为与其他疾病的感染疟原虫物种。
- 3.
通过在护理点环境外的实验室分析,不一致性可以通过阳性来识别恶性疟原虫(以前的镜检,非HRP2- rdt结果,或PCR阳性),但实验室检测HRP2为阴性。此外,如果采用多重抗原检测试验,对HRP2的结果为阴性,但对其他的结果为阳性疟原虫目标抗原可以标记为不和谐抗原。
尽管有强有力的初步证据pfhrp2/3上述三种不一致谱中的任何一种都可以提供缺失,确认基因缺失或功能缺失突变需要使用分子分析。然而,使用实验室免疫测定的表型表征为评估RDT不一致的其他常见原因提供了机会,包括RDT质量差(产品质量差和/或存储条件差)、操作人员错误、寄生虫密度低或非恶性疟原虫感染疟原虫,除其他因素外[21].应该注意的是,由于基因缺失而导致的检测结果不一致通常是由同时缺失双基因的寄生虫引起的pfhrp2而且pfhrp3基因。根据所使用的抗体抗原筛选免疫分析,寄生虫只有缺失pfhrp2基因(或pfhrp3基因)可能有足够的HRP2或HRP3抗原,在表型筛选时触发阳性结果,而不会被确定为“不一致”。由于监测的主要目的是确定缺乏寄生虫引起的RDT假阴性结果的比率pfhrp2/3基因,抗原筛查(特别是使用基于hrp2的rdt)不仅有助于关注最相关的样本,而且还提供了有关有症状患者人群中HRP2-RDT假阴性结果率的直接证据。
分子确认pfhrp2而且pfhrp3基因
常规PCR
常规PCR是最常用的检测方法pfhrp2/3删除。基本的热循环器和凝胶电泳设备的广泛可用性使其能够在不同的实验室环境中使用。在秘鲁的现场分离株中首次证明的缺失所使用的方法涉及每个外显子的两个扩增pfhrp2/3每个基因在一个单独的反应中,然后在琼脂糖凝胶上显示PCR产物[14].PCR引物和条件起源于一篇早期报道基因多样性的文章pfhrp2/3基因(29].没有扩增出外显子的样本pfhrp2/3基因被认为是一个可能的原因pfhrp2/3删除。因为读数是缺乏PCR产物,所以如果这些基因存在,证明PCR反应中有足够的高质量的寄生虫DNA来产生产物是至关重要的。基因组DNA的质量控制是通过扩增至少两个与外显子2扩增子大小相似的其他单拷贝基因来实现的pfhrp2/3 (例如,msp1而且msp2或glurp).为了补充这种方法,其他人也使用了寄生虫密度截止值(例如,≥100个寄生虫/µL)来防止在低DNA模板设置中错误分类缺失[30.].侧翼基因序列扩增pfhrp2/3基因也被用来为基因缺失提供支持性证据[14,27].迄今为止,常规PCR方法,使用轻微变化的引物序列和PCR条件,已被普遍用于提供实验室确认pfhrp2/3许多涉及全球各地寄生虫基因型的研究中的缺失。本方法与其他PCR检测和分类方法的优缺点pfhrp2/3基因总结见表1.
外显子1pfhrp2而且pfhrp3基因容易出现假扩增,有时会扩增另一个基因的外显子1,因为两个基因之间的外显子1序列高度同源[30.,31].由于内含子中的AT-rich重复,有效地扩增外显子1也是一项挑战;将延伸温度从72℃降低到60℃已被证明可以提高外显子1扩增的PCR效率[30.].最近,建立了一种传统的一步PCR方法来扩增全长pfhrp2基因的单一PCR反应[31].该分析检测的缺失pfhrp2包括一个外显子或两个外显子,克服了外显子1的假扩增,减少了所需的PCR反应次数。然而,这种一步PCR检测方法的95%置信下限估计分别为133个寄生虫/µL,来自全血和干血斑点现场样本。检测灵敏度低于常规PCR扩增单个外显子[30.],这可能是由于高AT含量内含子的扩增效率降低,从而产生更长的扩增子。
这些经验证实了在个别实验室中进行仔细的分析优化和质量控制以防止误分类的重要性。几种条件不断提高传统PCR的性能pfhrp2/3删除特性概述如下:
- 1.
使反应中的DNA模板最大化。优选地,每25µL反应5-10µL基因组DNA(如果使用DBS,从三个6毫米冲孔中提取)。
- 2.
利用高质量的热启动DNA聚合酶来增加基因缺失的检测灵敏度和准确性。由于试剂的商业可用性可能因地区而异,并且每个实验室都存在固有的细微差异,因此应根据实验室小组的内部验证确定最佳聚合酶的选择。
- 3.
总是包含适当的控制。除了通常的无模板控件(NTC)和一个恶性疟原虫积极的控制,是很重要的pfhrp2 -删除,pfhrp3 -分别删除菌株对照,如Dd2和HB3培养菌株。这是很重要的,因为一些常用的PCR检测已被证明可以扩增副同源pfhrp2或pfhrp3由于两个基因外显子1的序列同源性,在某些条件下的基因[30.].
- 4.
在进行嵌套测定或评估低寄生虫密度样品时要小心。半巢式和巢式PCR可提供较高的扩增灵敏度pfhrp2而且pfhrp3从寄生虫密度低的样本中提取。然而,这些方法也增加了交叉污染的风险和复杂的实验室工作流程。相反,许多最近的实验室分析使用了45个循环的单轮PCR,而不是嵌套PCR [30.,32,33,34,35],并使用寄生虫密度截断来选择具有足够目标浓度的样本,以降低假阴性结果的风险[36].这种方法在有症状个体的研究中效果很好,因为有症状患者的寄生虫密度普遍较高,单轮PCR结果良好。这也符合世卫组织的建议,即优先对有症状的患者进行基因缺失监测,并能够在病例管理期间评估假阴性RDT患病率。
- 5.
在进行删除调用之前,确保有足够的寄生虫DNA模板。最后pfhrp2/3只有当PCR未能扩增出这些基因中的任何一个外显子,但成功扩增出至少两个单拷贝基因时(使用具有相同扩增周期数的测定),才应发出删除调用。此外,要求寄生虫密度≥100个寄生虫/µL可以降低因低寄生虫DNA浓度下PCR失败而导致误分类缺失的风险。在每个板上建议的阈值附近的低寄生虫密度的阳性对照也提供了PCR敏感性的对照。
- 6.
在应用于现场样品之前验证测定结果。与所有的分子分析一样,验证任何的性能都是必要的pfhrp2或pfhrp3在每个实验室使用该检测方法进行检测。实验室试剂、用户和设备的差异会影响PCR性能,特别是在低寄生虫密度浓度时。至少,每个实验室应该首先验证他们的pfhrp2/3PCR检测采用连续稀释的、特征明确的复制物恶性疟原虫DNA。例如,一个实验包括五个重复pfhrp2 -删除(例如:Dd2),pfhrp3 -删除(例如:HB3),以及pfhrp2/3 -在100,000、10,000、1000、100、10和1个寄生虫/µL中分别检测完整的(例如:3D7)菌株DNA,可以深入了解在不同寄生虫密度下的检测极限和可重复性。分析验证的结果可以提高出版物中提出的结果的可信度,特别是估计的较低检测限和选择缺失调用的寄生虫密度阈值的理由。
多重实时PCR
最近开发的多重实时PCR检测方法pfhrp2/3与传统PCR相比,基因提供了提高通量和降低成本的机会,列于表中2.引物/探针部位pfhrp2/3附加文件中概述了常规和qPCR检测中的基因1.这些基于探针的分析可以同时放大pfhrp2,pfhrp3,另一个疟原虫基因,内部控制基因(通常是人类管家基因)。现有的多路复用pfhrp2/3real-time PCR检测靶外显子1-2和/或外显子2使用稍有不同的引物和探针目标,产生不同的扩增子大小。除了pfhrp2/3,迄今为止发表的三种检测方法针对不同的寄生虫基因:pfldh[37],pfrnr2e2[38),而pfbtub[39].的pfldh,pfrnr2e2,pfbtub基因均为单拷贝,最适合作为报告pfhrp2/3基因型的参考。基因像cytb(类似于18S rRNA基因,每个基因组有4-8个拷贝),是一个多拷贝基因(每个基因组30-100个拷贝)[40],用恶性疟原虫线粒体。由于检测限度的差异,使用多拷贝基因来验证足够的寄生虫DNA模板会增加错误删除调用的风险,特别是在低寄生虫密度的情况下,因此不鼓励使用。
指挥时的重要注意事项pfhrp2/3多重实时PCR基因分型:
- 1.
在应用于现场样品之前验证测定结果。的pfhrp2/3多重实时PCR检测应首先在实验室进行验证,使用特征良好的实验室菌株阳性对照或已知的样品pfhrp2/3应用于未知样品之前的状态。
- 2.
在实验室使用测定法时,一定要确定测定法的可靠检测限度。通过对已知寄生虫密度的纯化DNA进行连续稀释,确定实验室中实时PCR检测的限度是很重要的,以确保它们不受操作人员或试剂差异的影响。
- 3.
仔细确定阴性结果的阈值线和周期阈值(Ct)截止值。在一定数量的PCR循环后,该荧光阈值应大于每个检测板上的NTC,并高于该检测的检测限。例如,分析通常被限制在35个周期内,以避免因周期时间延长而产生假信号的风险。任何在人基因靶点上没有荧光信号或在NTC上有高荧光信号(低Ct)(≤35)的PCR实验都应无效并重复。
- 4.
利用人类管家基因评估样本完整性。使用人类管家基因扩增作为指导,以决定一个样本是否足以解释(阳性人类DNA信号)或无效(无人类DNA信号)和需要重复。
- 5.
包括适当的控制。在每个检测板上包括单基因缺失的实验室培养控制:pfhrp2-deleted(例如:Dd2菌株)和pfhrp3-deleted(例如:HB3菌株)。由于引物的交叉结合无法被监测,因此仅使用一个带有双重缺失的阳性对照是不理想的。此外,包括一个NTC和pfhrp2/3 -完整的阳性对照,如恶性疟原虫国际DNA标准PfINT [41],或特征良好的恶性疟原虫已知寄生虫血症的野生型对照。
- 6.
多克隆感染中的缺失调用:确保所有靶标的PCR效率相似,并调整阈值,使各靶标的周期阈值归一化。确认标准阳性对照(最好是PfINT)的Ct值设置方式与内参基因相同,pfhrp2,pfhrp3在开始分析多克隆感染中缺失的数据之前。在优化PCR效率和仔细调整所有靶标的Ct值后,在以缺失的寄生虫为优势菌株的多克隆感染中,如果与参考株(如:pfldh),pfhrp2或pfhrp3≥3。
实时PCR检测包括单拷贝的寄生虫参考基因靶标,如pfldh而且pfrnr2e2更适合于探测pfhrp2/3多克隆感染中的缺失,特别是当内参基因的扩增效率与之相似时pfhrp2/3.目前实时PCR检测报告pfhrp2/3 -在多克隆感染中,缺失菌株的出现频率低至1%(次要克隆),而高至80%(主要克隆)[37].然而,多克隆感染中检测缺失的能力可能因实验室而异,在将其用作监测工具之前,在实验室中使用实验室菌株DNA混合物或特征良好的多克隆感染验证实时PCR检测的性能是很重要的。
多路复用pfhrp2/3包括内部扩增控制的PCR分析不需要重复井或运行。为了确保删除调用的可信度,应该重复没有人类DNA信号或Ct值> 30.0的样本。还建议对所有有初始PCR证据的缺失样本重复检测。
数字多聚酶链式反应
数字PCR (dPCR)是另一种可用于检测的新兴技术pfhrp2/3基因缺失。在这种方法中,反应被划分为基于微流体的dPCR中的室或液滴数字PCR (ddPCR)中的液滴。由于反应被划分为大约20,000个液滴,并且扩增发生在单个分区中,dPCR适用于DNA目标的绝对定量,包括检测pfhrp2/3多克隆感染中的缺失[42].不同的研究表明,使用dPCR对目标DNA的定量受到液滴体积的影响,而这又因制造商和实验室而异[43].液滴体积也已被证明受到所使用母料类型的影响[44].dPCR法检测血吸虫病的适用性研究pfhrp2/3删除的内容应包括检测限度、重复性、再现性、液滴体积、混合母料(超级混合料)以及分析和诊断敏感性的最低信息。对于希望在实验室中使用这些新测定方法的小组,诊断敏感性和特异性以及定量准确性应与传统PCR和/或实时qPCR进行验证,以确保具有可比性。
新一代测序
的pfhrp2而且pfhrp3基因位于8号和13号染色体的次端粒区域附近,在那里经常发生包括缺失在内的基因组重排。这些缺失事件通常涉及包含许多基因的大(~ 20 kb)染色体片段,包括pfhrp2而且pfhrp3[45,46].在全基因组测序(WGS)唾手可得之前,一种检测侧翼基因存在/缺失的策略pfhrp2而且pfhrp3被使用,为周围染色体缺失提供了支持证据pfhrp2而且pfhrp3位置(14,47].Sanger测序扩增pfhrp2而且pfhrp3片段也被用于描述这些基因中发生的部分缺失[26],并了解这些基因在基因完整的寄生虫种群中的序列结构和遗传多样性[29,48].
近年来,WGS已被用于确认染色体上的基因缺失和重新排列染色体上缺失断点的特征。恶性疟原虫WGS涉及使用几种测序平台之一对样本中的单个DNA分子进行测序,最常见的是使用短测序读取,然后将其映射到参考基因组,或通过染色体重新组装成连续序列。这种方法提供了识别或确认的机会pfhrp2/3删除,描述pfhrp2而且pfhrp3基因组序列中的缺失模式(例如:大小,断点的位置),并研究缺失菌株的遗传多样性[20.,46,49,50,51].然而,高复杂性和重复性的性质恶性疟原虫端粒下使组装区域变得具有挑战性pfhrp2而且pfhrp3分别位于染色体8和13上。因此,大多数恶性疟原虫基因组研究将这些区域排除在分析之外。PacBio或Oxford Nanopore Technologies提供的长读测序方法有可能克服这些挑战,但迄今为止,它们在端粒下和端粒组装方面的应用在很大程度上仅限于培养适应的寄生虫[11].
最近开发的一种基于扩增子的深度测序方法使用分子反转探针(MIPs)来扩增数百个目标pfhrp2,pfhrp3,以及它们的侧翼基因在一次反应中[36].当应用于样品收集期间大pfhrp2/3在埃塞俄比亚的缺失调查中,这种方法能够低成本、高通量地绘制缺失断点区域,并识别有利于进化选择的遗传特征pfhrp2/3 -删除寄生虫。然而,其他方法,如传统或实时PCR更适合用于初始缺失筛查,以估计患病率,因为MIP捕获在较低的寄生虫密度(< 1000个寄生虫/ μ L)不一致,但提供了更详细的缺失或寄生虫菌株的特征。
参考实验室和测试在资源有限环境下的实际考虑
能力建设和将这些技术应用于疟疾流行地区对于这些监测工作的长期可持续性、及时收集数据和报告结果以及国家利益攸关方的参与至关重要。但是,在可能的情况下,这一能力应是现有非疟疾相关工作的补充,即利用分子分析进行传染病监测和(或)病例管理。在最近的2014-2016年西非埃博拉疫情期间,建立实验室能力支持跨疾病应用的必要性已变得非常明显[52],以及当前的SARS-CoV-2大流行[53,54].同样,基于实验室的高通量免疫分析技术可以筛查疟疾抗原,也可以用于检测其他蛋白质——来自其他病原体的抗原、人抗体或细胞因子和免疫因子[7].同样,核酸扩增、检测和测序技术也不是专门针对pfhrp2/3并可支持其他疟疾和传染病监测活动。
虽然建设综合实验室基础设施和能力应该是一个共同的目标,但在不同的环境中可能存在实际限制,阻碍了先进平台的使用。然而,最先进的技术并不一定是必需的pfhrp2/3缺失监测和基因缺失确认。实际上,与世界卫生组织协议中提出的HRP2和Pf-pLDH测试线比较反应性的双rdt测试算法可以在任何地方建立,而不管实验室能力如何[17].此外,通过RDT对血液标本进行检测可以在护理点进行,也可以将血液保存在冷藏下,以便稍后在另一种情况下通过RDT对HRP2进行检测。这种实用而经济的有症状的人的筛选可以提供强有力的表型证据恶性疟原虫不产生HRP2和HRP3抗原的感染,需要分子研究来阐明pfhrp2/3基因型(18,55,56].
放大pfhrp2/3基因和结果评估可以最简单地使用传统或多重实时PCR检测。用于这些分析的试剂和DNA存储只需要4°和- 20°的冷单元,而热循环仪或实时PCR机只需要可靠的电源。琼脂糖凝胶和扩增曲线结果的读数和数据解释并不复杂,并为基因目标的扩增产生二元阳性/阴性结果。然而,正确的结果解释只能通过对每个分析板或反应进行适当的控制以及在临床样本上使用之前对分析进行仔细的验证来完成。使用如上所述的适当的实验室工作流程和控制,科学家可以对基因扩增结果有很高的信心。一般情况下,放大其他单拷贝恶性疟原虫基因和包含NTC和特征良好的分析孔恶性疟原虫压力与pfhrp2/3需要删除[27].
在未知样本筛选开始之前,对新测定方法进行验证或在其他实验室验证这些测定方法的性能至关重要,并且在对未知因素进行估计之前是强制性的pfhrp2/3可以删除。应考虑检测的可重复性和检测能够检测到的抗原或DNA的估计水平。重组疟原虫抗原可用于免疫分析验证,真阴性血液可从非当地居民获得[21].由已知的恶性疟原虫基因型(培养或现场分离)可以帮助比较实验室之间的DNA测定性能,并验证该测定是否适合在特定环境中使用。对于分子检测,世卫组织提供了一项疟疾核酸扩增疟疾分子外部质量保证规划(WHO malaria NAAT EQA),能够仔细监测PCR性能并获得特征明确的检测疟原虫样品,包括pfhrp2/3已删除的寄生虫[57].
目前的差距pfhrp2实验室数据的缺失监测和新实验室技术的部署需要克服
多种因素会导致错误pfhrp2/3缺失基因分型结果列于表中3..当不止一个恶性疟原虫菌株感染单个个体时,存在寄生虫pfhrp2(和/或pfhrp3)删除可以被屏蔽。抗原检测试验对哪种无关紧要恶性疟原虫基因型会产生HRP2(或其他)抗原,因此如果血液中有足够的HRP2/HRP3, RDT或基于实验室的抗原测试将返回阳性结果,而不管一个菌株是否有缺失pfhrp2和/或pfhrp3[21,58].类似地,传统的PCR检测将扩增存在的基因目标,而不管它是否来自显性基因恶性疟原虫劳损或小劳损。因此,如果在多克隆感染中存在产生hrp2的寄生虫,它可能会掩盖hrp2的存在pfhrp2-使用表型或基因型分析的缺失菌株[24].因此,在混合毒株感染常见的高传播地区,基因缺失的真正流行率为恶性疟原虫人口可能被低估了。然而,血液中足够的HRP2仍然会引发阳性的HRP2- rdt,从而提供适当的病例管理,而不管患者体内存在多少(或哪种)基因型。此外,世卫组织推荐的转向非hrp2诊断的阈值是基于由HRP2-RDTs引起的假阴性的百分比pfhrp2/3删除,而不是有多少人感染的百分比pfhrp2 -删除恶性疟原虫基因型(17].
自横向流动快速诊断技术发展以来,HRP2抗原血症的持续时间已被证明要长得多恶性疟原虫寄生虫病持续数周至数月[6,59,62,63],虽然这不是观察到的其他疟原虫抗原(63,64].从临床角度来看,这意味着一个人可能因为最近成功治疗而检测出HRP2阳性恶性疟原虫感染,虽然他们目前疾病的病因可能是其他原因。监察pfhrp2/3删除,这一现象将有最大的影响抗原血症作为代理疟原虫可能掩盖了基因型缺失的寄生虫感染。如果病人真的感染了恶性疟原虫如果HRP2不表达,但先前感染的抗原仍存在于血液中,那么HRP2快速检测和实验室免疫分析都可能在没有怀疑的情况下将这种感染错误地归类为野生型pfhrp2/3删除。这种情况可能更多地发生在高传播期和/或在由混合毒株引起的HRP2抗原血症可能持续数月的全流行环境中恶性疟原虫感染(25].
大部分地区调查存在pfhrp2/3常驻中的删除恶性疟原虫人们发现了令人鼓舞的结果很少,或者没有,恶性疟原虫感染pfhrp2/3 -删除寄生虫和何时恶性疟原虫一旦发现感染,高HRP2/HRP3抗原水平将引发阳性HRP2- rdts [16,18,19,20.,21,22,24,34,56,65].然而,真正具有代表性的调查(或监测系统)需要在国家层面上推动疟疾诊断政策,需要涉及来自多个地方的代表性研究地点,并且传播环境每次筛查都要招募数百名疑似疟疾病例参与者[17].此外,缺失基因型的克隆扩增可能在一个区域非常集中[36],如果没有对这些受影响的位点进行采样,这些基因型可能会被遗漏。
结论
越来越多的报告描述恶性疟原虫的删除(或其他空突变)pfhrp2而且pfhrp3疟疾流行国家的基因。因为这些删除被认为是在恶性疟原虫在全球范围内发现了这些基因缺失的寄生虫,因此有理由认为大多数寄生虫种群中都存在这些基因缺失的寄生虫。最重要的问题不是这些缺失是否存在于寄生虫种群中,而是它们的流行程度是否高到足以影响HRP2-RDTs检测的可靠性恶性疟原虫特定国家的疟疾诊断战略。具有缺失的低水平和空间异质性的寄生虫模式将需要更大的样本量来获得准确和精确的估计。现在有多种实验室策略来支持这些努力,以确定HRP2表型和缺失基因型。低成本筛查工具将有助于使大规模调查和监测更加实际,在流行县建立实验室能力是实现的一个基本目标。实验室策略的选择应根据当地的技术和后勤考虑,并必须优先考虑严谨性和可重复性。
数据和材料的可用性
不适用。
改变历史
2022年9月11日
这篇文章自最初发表以来已被更正;详情请参阅所附的勘误表。
9月14日
缩写
- Ct:
-
循环阈值
- ELISA:
-
酶联免疫吸附试验
- HRP2:
-
富组氨酸蛋白2
- HRP3:
-
富含组氨酸的蛋白质3
- LDH:
-
乳酸脱氢酶
- MIP:
-
分子反转探针
- 全国过渡委员会:
-
没有模板控制
- 聚合酶链反应:
-
聚合酶链反应
- RDT:
-
快速诊断试验
- WGS:
-
全基因组测序
- 人:
-
世界卫生组织
参考文献
疟疾诊断:现在和未来。寄生虫学。2014;141:1873-9。
Odaga J, Sinclair D, Lokong JA, Donegan S, Hopkins H, Garner P.在疟疾流行地区管理发烧患者的快速诊断检测与临床诊断。Cochrane Database Syst Rev. 2014;4:CD008998。
李文杰,王志刚,王志刚。确保疟疾诊断的质量和可及性:如何实现?微生物学报。2006;4(9增刊):S7-20。
谁。疟疾指南。日内瓦:世界卫生组织;2021.
谁。世卫组织疟疾快速诊断检测产品检测结果:第8轮(2016-2018年)。日内瓦:世界卫生组织;2018.
Poti KE, Sullivan DJ, Dondorp AM, Woodrow CJ。HRP2:改变疟疾诊断,但需要注意。寄生虫学,2020;36:112-26。
Plucinski M, Aidoo M, Rogier E.疟疾抗原的实验室检测:疟疾研究、诊断和流行病学的有力工具。临床微生物学Rev. 2021;34: e0025020。
谁。《2021年世界疟疾报告》。日内瓦:世界卫生组织;2021.
Wellems TE, Walliker D, Smith CL, do Rosario VE, Maloy WL, Howard RJ,等。一个富含组氨酸的蛋白质基因标志着一个在基因杂交中被强烈偏爱的连锁群恶性疟原虫.细胞。1987;49:633-42。
张志刚,张志刚,张志刚,等。植物染色体断点的克隆与鉴定恶性疟原虫:在次端粒基因中,断裂和新端粒的形成频繁且随机发生。核酸决议1992;20:1491-6。
奥托TD, Bohme U,桑德斯M,里德A, Bruske EI, Duffy CW,等。长读程序集在地理上分散疟原虫恶性疟原虫分离物显示出高度结构化的亚端粒。Wellcome Open res 2018;3:52。
韦勒姆斯TE,霍华德RJ。同源基因在克隆分离物中编码两种不同的富组氨酸蛋白恶性疟原虫.美国国家科学研究院。1986; 83:6065-9。
Kong A, Wilson SA, Ah Y, Nace D, Rogier E, Aidoo M. HRP2和HRP3的交叉反应及其对基于HRP2的RDT应用的影响恶性疟原虫Hrp2基因缺失。Malar J. 2021;20:207。
李志强,李志强,李志强,等。的很大一部分P。恶性疟原虫秘鲁亚马逊地区的分离株缺乏pfhrp2和pfhrp3:对疟疾快速诊断测试的影响。PLoS ONE。2010; 5: e8091。
谁。世卫组织疟疾快速诊断检测产品检测结果:第3轮(2010-2011年)。日内瓦:世界卫生组织;2011.
汤姆逊R, Parr JB,程Q, Chenet S, Perkins M, Cunningham j恶性疟原虫缺乏富组氨酸蛋白2和3:一项系统综述。《公牛世界卫生器官》,2020;98:558-68。
谁。pfhrp2基因缺失的响应计划。日内瓦:世界卫生组织;2019.
McCaffery JN, Nace D, Herman C, Singh B, Sompwe EM, Nkoli PM,等。疟原虫falciparum pfhrp2和pfhrp3基因缺失在2017年至2018年登记的刚果民主共和国患者中。科学通报2021;11:22979。
Bharti PK, Chandel HS, Ahmad A, Krishna S, Udhayakumar V, Singh N. pfhrp2和/或pfhrp3基因缺失的患病率恶性疟原虫在印度8个高度流行的邦。PLoS ONE。2016; 11: e0157949。
Parr JB, Kieto E, Phanzu F, Mansiangi P, Mwandagalirwa K, Mvuama N,等。刚果民主共和国有症状疟疾快速诊断检测假阴性分析科学通报2021;11:6495。
普拉斯基MM,赫尔曼C,琼斯S,丁布R, Fortes F, Ljolje D,等。筛选Pfhrp2/3-deleted恶性疟原虫、非恶性疟原虫和低密度疟疾感染的多重抗原分析。中国传染病杂志2019;219:437-47。
Nsobya SL, Walakira A, Namirembe E, Kiggundu M, Nankabirwa JI, Ruhamyankaka E,等。pfhrp2和pfhrp3基因缺失在快速诊断试验阴性中不常见恶性疟原虫来自乌干达的分离株。Malar J. 2021;20:4。
Berzosa P, Gonzalez V, Taravillo L, Mayor A, roma - barja M, Garcia L,等。首次发现pfhrp2和pfhrp3基因缺失恶性疟原虫来自赤道几内亚。Malar J. 2020;19:99。
Koita OA, Doumbo OK, Ouattara A, Tall LK, Konare A, Diakite M,等。疟疾快速诊断检测的假阴性和hrp2基因富含组氨酸重复区缺失。中国热带医学杂志,2012;86:194-8。
沃森OJ, Verity R, Ghani AC, Garske T, Cunningham J, Tshefu A,等。季节变化的影响恶性疟原虫疟疾传播对pfhrp2基因缺失的监测。Elife. 2019;8: e40339。
李文杰,李志强,李志强,等。突变体流行病学恶性疟原虫在厄立特里亚,从基于hrp2的快速诊断疗法转向2年后,发现缺乏富组氨酸蛋白2/3基因的寄生虫。科学通报2021;11:21082。
程强,马志强,李志强,等。恶性疟原虫缺乏富组氨酸蛋白2和3的寄生虫:对准确报告的回顾和建议。杨晓明,2014;13:433。
Jimenez A, res - channer RR, Perera R, Gamboa D, Chiodini PL, Gonzalez IJ,等。目前最好的疟疾快速诊断检测方法的分析敏感性。玛拉尔。2017;16:128。
Baker J, McCarthy J, Gatton M, Kyle DE, Belizario V, Luchavez J,等。遗传多样性恶性疟原虫富组氨酸蛋白2 (PfHRP2)及其对基于PfHRP2的快速诊断测试性能的影响。中华传染病杂志,2005;
Parr JB, Anderson O, Juliano JJ, Meshnick SR.精简,基于pcr的pfhrp2-和pfhrp3-阴性检测恶性疟原虫.2018;17: 37。
张志刚,张志刚,张志刚,张志刚,等。一步PCR:一种检测pfhrp2缺失状态的新方法恶性疟原虫.PLoS ONE。2020; 15: e0236369。
帕尔JB, Verity R, dr . SM, Janko M, Carey-Ewend K, Turman BJ,等。Pfhrp2-deleted恶性疟原虫刚果民主共和国的寄生虫:一项全国横断面调查。中华传染病杂志,2017;16:36 - 44。
张志强,张志强,张志强,等。疟疾控制项目的主要威胁是恶性疟原虫缺乏富含组氨酸的蛋白质2,厄立特里亚。新兴感染杂志2018;24:462-70。
张志强,张志强,张志强,等。分子监测显示pfhrp2和pfhrp3基因缺失恶性疟原虫2017-2019年乌干达的寄生虫数量。Malar J. 2020;19:300。
张志刚,李志刚,李志刚,等。恶性疟原虫富含组氨酸的蛋白2和3基因在尼日利亚、苏丹和南苏丹的菌株中缺失。新兴感染杂志2021;27:471-9。
Feleke SM, Reichert EN, Mohammed H, Brhane BG, Mekete K, Mamo H,等。恶性疟原虫正在进化以逃避埃塞俄比亚的疟疾快速诊断测试。生物工程学报。2021;6:1289-99。
李志强,李志强,李志强,等。一种新的多重qPCR检测方法恶性疟原虫在多克隆感染中,富组氨酸蛋白2和3 (pfhrp2和pfhrp3)缺失。EBioMedicine。2020年,55岁:102757。
Schindler T, Deal AC, Fink M, Guirou E, Moser KA, Mwakasungula SM,等。采用多重qPCR方法检测猪瘟多株感染中pfhrp2和pfhrp3基因缺失恶性疟原虫.科学代表2019;9:13107。
李志强,李志强,李志强,等。利用新型高通量检测方法监测疟疾快速诊断检测方法受到的威胁恶性疟原虫Hrp2和hrp3缺失:一项横断面诊断准确性研究。EBioMedicine。2019; 50:14-22。
李志强,李志强,李志强,等。植物线粒体功能编码的染色体外DNA转录疟原虫yoelii.中国生物医学工程学报,1990;
Padley DJ, Heath AB, Sutherland C, Chiodini PL, Baylis SA,合作研究G.建立第一个世界卫生组织国际标准恶性疟原虫DNA核酸扩增技术(NAT)为基础的分析。马丽君,2008;7:139。
Vera-Arias CA, Holzschuh A, Oduma CO, Badu K, Abdul-Hakim M, Yukich J,等。恶性疟原虫高灵敏度和特异性数字PCR检测非洲和南美洲hrp2和hrp3基因缺失情况。medRxiv。2021.https://doi.org/10.1101/2021.06.01.21258117.
张晓东,张晓东,张晓东,等。液滴体积变异性是影响液滴数字PCR绝对定量准确性的关键因素。生物化学。2017;409:6689-97。
Emslie KR, McLaughlin JLH, Griffiths K, Forbes-Smith M, Pinheiro LB, Burke DG。液滴体积变异性及其对数字PCR拷贝数浓度测量的影响。《肛肠化学》2019;91:4124-31。
达里亚NV, Plouffe D, Bopp SE, Gonzalez-Paez GE, Lucas C, Salas C,等。亚马逊的基因组扫描恶性疟原虫显示亚端粒不稳定和克林霉素耐药寄生虫。基因组Res. 2010; 20:1534-44。
张志强,张志强,张志强,等。全球分析恶性疟原虫富组氨酸蛋白-2 (pfhrp2)和pfhrp3基因缺失使用全基因组测序数据和荟萃分析。《感染Genet Evol》2018;62:211-9。
李志强,李志强,李志强,等。多遗传来源的富组氨酸蛋白2基因缺失恶性疟原虫秘鲁的寄生虫。科学通报2013;3:27 7。
刘志强,刘志强,刘志强,等。遗传多样性和遗传亲缘性恶性疟原虫2019-2020年乌干达东部和西部地区无并发症疟疾患者的寄生虫数量,基于微卫星分型。马丽娜。2021;20:242。
吉本斯J,秦娟,马兰,王忠,王超,等。谱系特异性的扩展恶性疟原虫大湄公河次区域pfhrp2缺失的寄生虫。中国传染病杂志;2020;22(2):344 - 344。
疟疾根,Ahouidi A, Ali M, Almagro-Garcia J, Amambua-Ngwa A, Amaratunga C,等。的开放数据集恶性疟原虫全球7000个样本的基因组变异。威康开放决议2021;6:42。
Nolder D, Stewart L, Tucker J, Ibrahim A, Gray A, Corrah T,等。前往英国和爱尔兰的旅行者中恶性疟原虫疟疾病例的快速诊断检测失败:寄生虫的鉴定和特征。中华流行病学杂志(英文版);
李志强,王志强,王志强,王志强,等。联合移动新发疾病临床能力(JMEDICC)实验室方法:高后果病原体临床研究的能力。PLoS negel Trop, 2019;13: e0007787。
Shey M, Okeibunor JC, Yahaya AA, Herring BL, Tomori O, Coulibaly SO,等。非洲新型冠状病毒(SARS-COV-2)的基因组测序和诊断:我们走得有多远?Pan Afr Med J. 2020;36:80。
Dzinamarira T, Dzobo M, Chitungo I. COVID-19:非洲能力和应对展望。中国医学病毒学杂志,2020;92:2465-72。
罗吉尔,李志强,黄志强,等。恶性疟原虫埃塞俄比亚、肯尼亚、马达加斯加和卢旺达有症状的疟疾感染者的pfhrp2和pfhrp3基因缺失。新兴感染病。2022;28:6 8 - 16。
赫曼C,胡贝尔CS,琼斯S,斯坦哈特L,普卢斯基MM, Lemoine JF,等。通过珠基法检测多重疟疾抗原和PCR分子证实,在海地没有证据显示Pfhrp2和Pfhrp3缺失。玛拉尔。2019;18:380。
Cunningham JA, Thomson RM, Murphy SC, de la Paz AM, Ding XC, Incardona S,等。世卫组织疟疾核酸扩增试验外部质量评估方案:分发规划1至3的结果。马勒。2020;19:129。
普瑞斯基,丁布R, Candrinho B, Colborn J, Badiane A, Ndiaye D,等。使用快速诊断测试进行疟疾调查,并使用事后定量方法验证结果疟原虫恶性疟原虫富组氨酸蛋白2。马志刚,2017;16:451。
普拉斯基MM,丁布PR, Fortes F, Abdulla S, Ahmed S, Gutman J,等。治疗后HRP2清除率无并发症患者恶性疟原虫疟疾。中华流行病学杂志,2018;
Plucinski MM, Dimbu PR, Fortes F, Murphy SC, Smith NT, Cruz KR,等。不同快速诊断试验结果和HRP2抗原浓度的个体疟疾寄生虫密度。美国热带医学杂志2019;100:1202-3。
Watson OJ, Slater HC, Verity R, Parr JB, Mwandagalirwa MK, Tshefu A,等。对传播的驱动因素进行建模恶性疟原虫撒哈拉以南非洲地区hrp2基因缺失。电子生活。2017;6:e25008。
kabayinze DJ, Tibenderana JK, dong GW, Rwakimari JB, Counihan H. HRP2快速诊断方法的操作准确性和持久性抗原性比较恶性疟原虫乌干达高度流行地区的疟疾。马丽娜。2008;7:221。
Gerstl S, Dunkley S, Mukhtar A, De Smet M, Baker S, Maikere J.在高流行地区对五岁以下儿童疟疾快速诊断检测的评估,并随访假阳性pLDH检测结果恶性疟原虫疟疾地区,塞拉利昂。马志刚,2010;9:28。
普拉斯基MM,麦克尔罗伊PD,丁布PR,福特斯F, Nace D, Halsey ES,等。抗疟治疗后乳酸脱氢酶和醛缩酶的清除动态恶性疟原虫感染。寄生虫载体。2019;12:293。
蒲丽萍,朱丽娟,李丽娟,等。评估莫桑比克疟疾诊断中HRP2抗原检测的性能。临床微生物学杂志。2019。https://doi.org/10.1128/JCM.00875-19.
确认
不适用。
资金
这项工作得到了NIH R01AI132547 (JBP)的部分支持。这项工作得到了比尔和梅林达·盖茨基金会(投资ID: OPP1209843)的部分支持。根据基金会的授权条件,创作共用署名4.0通用许可已经被分配给作者接受的手稿版本,该版本可能由本次提交。KBB由威康基金会支持。
作者信息
作者及隶属关系
贡献
KBB、JBP、JC、QC和ER对本综述的发展做出了贡献。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
本报告中的发现和结论仅代表作者的观点,并不代表疾病控制和预防中心的官方立场。使用商品名称仅用于识别,并不意味着疾病控制和预防中心、公共卫生服务或美国卫生与公众服务部的认可。
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
JBP报告说,已从世卫组织和美国国立卫生研究院获得了与这项工作范围相关的研究支持。JBP还报告了吉利德科学公司的研究支持,雅培实验室的非财政支持,以及病毒学教育公司对病毒性肝炎和COVID-19研究的酬金,这些都不在当前工作范围内。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
巴希尔,k.b.,帕尔,j.b.,坎宁安,J。et al。筛选策略和实验室分析支持恶性疟原虫富组氨酸蛋白缺失监测:我们在哪里,需要什么。颧骨J21, 201(2022)。https://doi.org/10.1186/s12936-022-04226-2
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12936-022-04226-2
关键字
- 疟疾
- 快速诊断试验
- pfhrp2
- pfhrp3
- 基因缺失
- 实验室试验
- 监测
- 问题