摘要
肥胖是一种危及生命的代谢紊乱,容易使人患上其他疾病。在本研究中,研究了由某些细菌产生的细菌素nisin对基于选定参数的肥胖动物模型的影响。40只瑞士国立卫生研究院小鼠随机分为四组,每天分别服用安慰剂(生理盐水)或乳酸链球菌素(25、50或100 μg/kg, ip),持续8周。在整个实验过程中,所有组的小鼠都被喂食高糖饮食。每周测量体重和摄食量,实验结束时检测FBS、血清甘油三酯、胆固醇、高密度脂蛋白、低密度脂蛋白、肝酶水平,测定红细胞、白细胞计数、血红蛋白浓度、平均红细胞体积、平均血红蛋白、平均血红蛋白浓度。最后,使用逆转录-定量聚合酶链式反应(RT-qPCR)评估一些肥胖相关基因的表达水平,包括硬脂酰辅酶a去饱和酶-1 (SCD-1)、葡萄糖转运蛋白-4 (GLUT4)、锌指蛋白423 (zfp423)、422 (ap2)和肿瘤坏死因子-α (TNF-α)。实验结束后,喂食nisin的各组的体重、腹部脂肪和体重指数均明显低于对照组。以50 μg/kg菌素效果最好。nisin治疗后,SCD-1、GLUT4、422(ap2)和TNF-α的表达显著降低。在这些实验条件下,没有观察到其他研究参数的显著差异,也没有观察到nisin的毒性作用。 The results suggested that nisin could have antiobesity effects.
简介
肥胖和超重是指身体各个部位脂肪的过度积累。根据世界卫生组织(WHO)的定义,体重指数(BMI)为25至30公斤/米2.当BMI超过30 kg/m时2在美国,这种情况被称为肥胖。根据世界卫生组织的报告,每年有近400万人因肥胖引起的并发症而失去生命。肥胖和超重一度被认为是富裕社会的问题;然而,目前在中等和贫困社会中,越来越多的人正在处理这一现象[1].
肥胖会导致各种各样的健康问题,从心脏病到高血压,甚至癌症。除了增加骨骼系统的负担,特别是关节,这是超重的自然后果,白细胞介素-6 (IL-6)的生产从脂肪细胞易使个人肥胖的慢性轻度炎症状态。脂肪组织分泌的脂肪酸最终停留在肌肉和肝脏组织,这是胰岛素抵抗和糖尿病的初期阶段。此外,肥大脂肪细胞产生的雌激素可导致乳房增生,并最终导致乳房癌变[2].
在一段时间内,当能量供应的速度超过消耗的速度,足以使脂肪细胞中脂肪滴积聚时,就会发生超重和肥胖。这一过程有不同的原因,主要与饮食和体育活动模式有关。然而,饮食和体育活动的影响可因遗传因素和代谢状态而增强或减弱,如某些导致肥胖的遗传疾病所示[3.].人们对开发肥胖及其相关并发症的新疗法越来越感兴趣。在这方面,一些药物已经成功地获得了FDA的批准。然而,这些治疗也有一些副作用。其他草药也被引入,但存在信息空白,应通过进一步的研究来填补[4,5,6,7].
的微生物群指的是全身不同器官的微生物种群。这些微生物可能包括细菌、真菌和病毒。被研究得最多的角色的微生物群在人体健康是与肠道微生物群,特别是常驻细菌有关。健康肠道的细菌种群主要包括两个门:拟杆菌门和厚壁菌门。这些门和其他门在维持肠道完整性、免疫调节、抵御病原体和药物代谢方面发挥着至关重要的作用[8].多项研究表明,消化系统中微生物群的组成与身体组成/体重之间的关系[9].一项针对儿童的研究表明,受肥胖影响的儿童肠道内细菌种类的丰度较低[10].同样的观察结果在成年人身上也得到了证实。11].
细菌素,由某些细菌菌株产生和分泌的肽,似乎对体重的调节有重要影响。一项生物信息学研究表明,乳酸菌科的某些细菌素,即人类肠道的益生菌,可能对体重和肥胖产生一定的影响[12].最近的一项研究使用了益生菌中的细菌素气丝素Al . gasseri3T3-L1前脂肪细胞上的LA39显示一些与脂肪形成相关的基因表达显著降低[13].
Nisin是罗杰斯和惠蒂尔在1928年发现的一种细菌素,是一种含有34个氨基酸的3500-Da肽,具有杀菌特性。Nisin是在的指数生长阶段产生的乳酸菌lactis,亚种lactis;当细菌的生长停止时,肽的产生也停止了。14].Nisin长期以来一直作为防腐剂在食品工业中使用,它的商业规模用于包装食品。Nisin对革兰氏阴性菌有很强的抑制作用[15].因此,我们决定使用该细菌素进行实验,以评估其对体重、一些血清因子以及一些参与脂肪细胞发育和生长的重要基因的影响。
材料与方法
Nisin以平衡的2.5%氯化钠冻干粉的形式购买(Sigma-Aldrich,德国),并用含0.05%醋酸的生理盐水稀释。
动物与治疗
实验选择了40只健康的、出生6周、体重在25-45克的美国国立卫生研究院瑞士雄性小鼠。然后在研究开始前,让小鼠适应环境2周。根据马什哈德费尔多西大学动物伦理委员会的指导方针(IR.UM.REC.1400.250)对动物进行了处理。在整个实验过程中,老鼠都被关在单独的笼子里。小鼠被随机分为4组,每组10只:对照组接受安慰剂,试验组接受nisin 25、50和100 μg/kg / d(单次剂量),持续8周。实验开始前5天,小鼠被随意喂食高糖饮食(表1).为了准备饮食,在100°C下将450克糖溶解在100毫升蒸馏水中。将热稠糖浆与450克市售小鼠食物(Javaneh Khorasan Co., Mashhad)均匀混合。然后让它在室温下干燥。在每周结束时,测量每只动物的体重和食物摄入量。
抽样
第8周结束时,小鼠禁食12小时,用50 mg/kg硫喷妥钠麻醉,提取肠系膜脂肪,保存在液氮中,用于进一步的分子检测。从腹腔腔静脉采血。血清以3500 rpm离心分离,- 20°C保存,用于进一步生化分析。肾脏和脾脏的重量,小肠的长度,体重指数(体重公斤/鼻长米)^ 2)进行测量。
采用酶比色法测定血清参数,包括葡萄糖、胆固醇、甘油三酯、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、谷丙转氨酶(ALT)、天门冬氨酸转氨酶(AST)和碱性磷酸酶(ALP)(试剂盒:Pars Azmoon®,伊朗;系统:Autoanalyzer Alpha Classic®)。采用部分失败刷新法(Sysmex-XP-100)进行血细胞计数和血红蛋白相关测量。
RNA分离和基因表达
使用总RNA提取试剂盒(DENAzist Asia,伊朗)从肠系膜脂肪组织中提取总RNA。为了检验nisin对脂肪细胞特异性基因表达水平的影响,采用逆转录-定量聚合酶链式反应(RT-qPCR)检测了4个基因:硬脂酰辅酶a去饱和酶-1 (SCD-1)基因,调节不饱和脂肪酸产生的限速步骤,编码葡萄糖转运体-4 (GLUT4)基因作为葡萄糖进入脂肪细胞的主要转运体,编码锌指蛋白423 (zfp423)基因作为白色脂肪细胞分化和维持的决定因素,编码422(ap2)蛋白基因作为脂肪酸结合蛋白,随着前脂肪细胞向脂肪细胞的分化而增加。肿瘤坏死因子-α (TNF-α)基因的表达也被检测以评估任何可能的炎症反应。为了减少任何可能的DNA污染对RT-qPCR结果的影响,引物设计为外显子-外显子连接形式。由于塔塔结合蛋白(TBP)在脂肪细胞中具有较高的稳定性,因此被选为内参(管家)基因[16].引物清单及顺序见表2.
统计分析
使用GraphPad Prism Software version 9.4.1 (GraphPad Software Inc., USA)对图表进行统计分析和绘制。RT-PCR结果采用非参数Mann-Whitney检验。体重的比较采用了Benjamini、Krieger和Yekutieli的两阶段设置方法,然后采用双向方差分析进行。所有其他比较均采用单向方差分析,然后采用Dunnett多重比较检验。P数值小于0.05为有统计学意义。除非另有说明,所有数据均以均数±SEM表示。
结果
体重,总食物摄入量,肠系膜脂肪和BMI
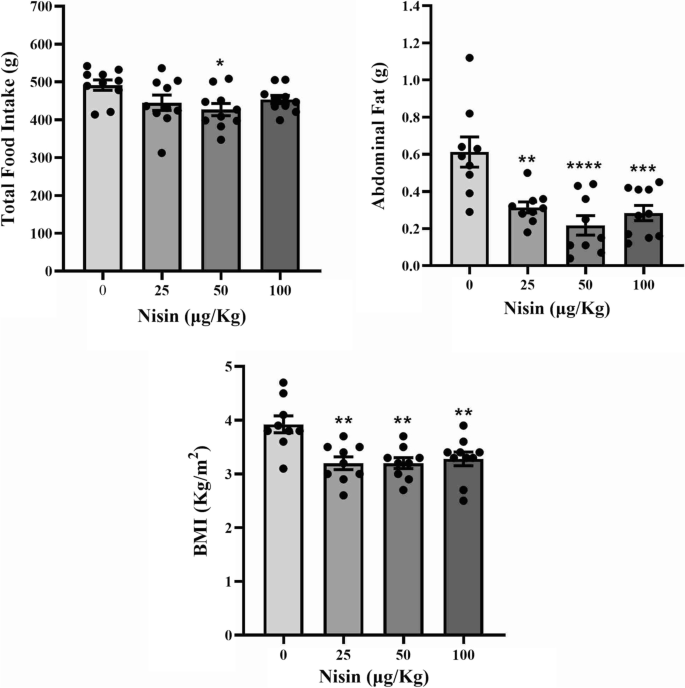
统计分析显示,与对照组相比,治疗组的体重显著下降。如表所示3.,三组都有明显的减肥效果,其中第三组效果最大。
只有第3组(50 μg/kg nisin)的采食量降低,其他各组均无显著变化(图2)。1).
腹部脂肪含量的变化更为显著,在所有三个治疗组中,腹部脂肪含量都急剧减少,其中3组效果最大(图3)。1).
nisin的另一个显著影响是BMI的改变,这在所有三个治疗组中都显著降低(图。1).
初步组织学评价
腹部脂肪细胞仪的初步结果显示,试验组脂肪细胞的大小显著减小。然而,在nisin处理过的动物中,标本数量很少,不允许有足够大的样本量进行统计比较。
PCR结果
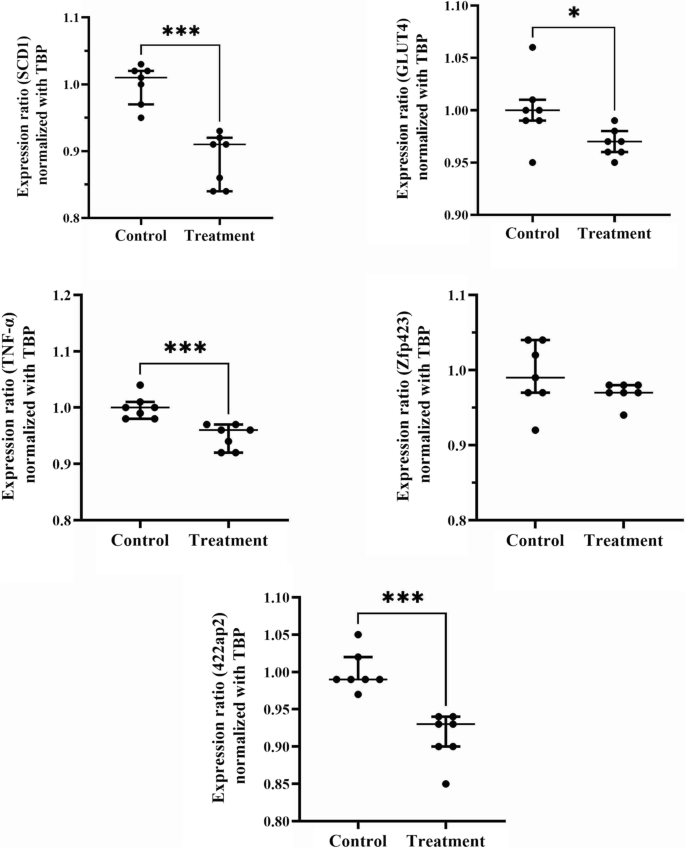
RT-qPCR数据显示,SCD-1、GLUT4、TNF-α、422ap2的表达水平明显降低,而zfp423的表达水平无明显变化(图2)。2).
器官,血液和血清的标记
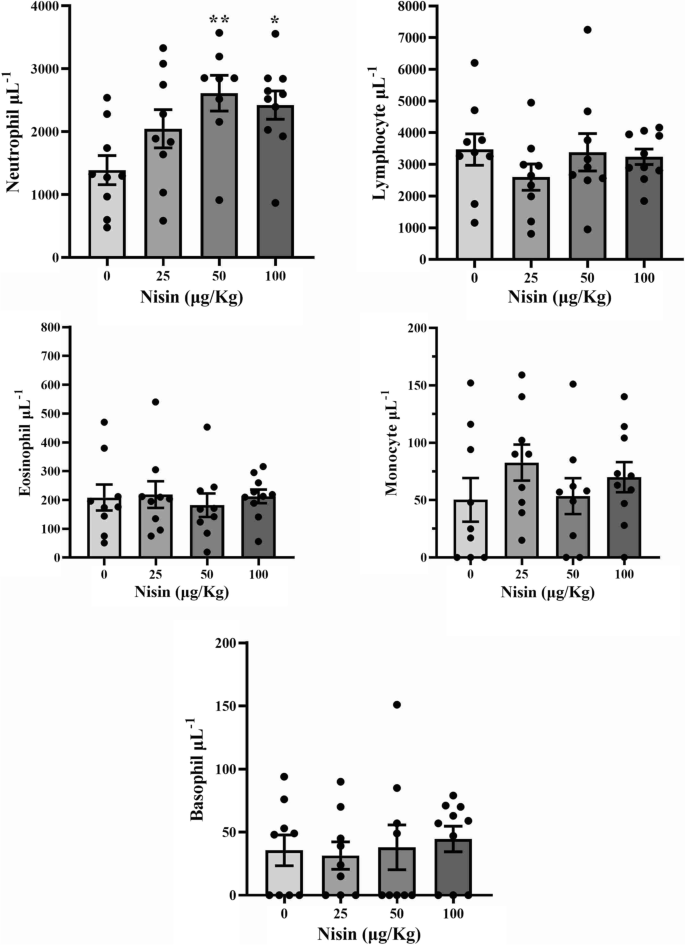
所研究的血清标志物(包括空腹血糖[FBS]、胆固醇、甘油三酯、HDL、LDL、AST、ALT和ALP)、小肠长度、肾脏和脾脏重量、红细胞和白细胞计数、血红蛋白浓度、填充细胞体积、平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)和平均红细胞血红蛋白浓度(MCHC)未显示任何显著变化(表2)4).
差异白细胞计数结果显示,50和100 μg/kg乳酸球蛋白组中性粒细胞数量显著增加。然而,其他比较没有产生统计学意义(图。3.).
讨论
以往对细菌素的研究主要集中在其抗菌性能及其作为食品防腐剂的潜在应用方面。例如,乳酸链球菌素的抗菌性能已被广泛研究,它已被广泛单独使用或与其他物质联合用作食品防腐剂[17].因此,一些研究评估了乳酸链球菌素的潜在毒性作用,但只测试了口服给药途径,这些研究主要支持该肽作为食品防腐剂的安全性,这导致其获得食品和药物管理局的批准[18,19].然而,目前还没有关于乳酸链球菌素对肥胖的潜在治疗作用的信息。该团队首先在实验室大鼠中使用nisin进行了初步研究,结果显示腹部脂肪含量显著降低(未发表结果)。因此,本研究决定使用乳酸链球菌素来评估其可能的抗肥胖活性。
结果表明,通过i.p.注射nisin治疗的动物体重显著减轻。只有一个治疗组的食物摄入量显著减少,所以这种效果可能是偶然的。但是,如果这一作用在今后的实验中得到证实,则可以认为是乳酸链球菌素发挥减肥作用的机制之一。在一项测定乳酸蛋白酶作为食品添加剂的生物活性的研究中,也发现了类似的食物摄入量减少的结果[20.].
在本研究中,nisin导致SCD-1表达水平急剧下降。硬脂酰辅酶a去饱和酶-1是棕榈油酸和油酸生产的限速酶,这两种重要的单不饱和脂肪酸在肝脏中产生。SCD-1基因被瘦素抑制,SCD-1的抑制可导致肥胖患者体重大幅下降[21].一项对高脂饮食喂养大鼠的研究表明,肥胖倾向大鼠的SCD-1产物棕榈油酸比例更高[22].与此一致的是,在本研究中,接受乳酸链球菌素的动物的体重、腹部脂肪含量和BMI显著降低。值得注意的是,据报道9-21周龄小鼠的平均BMI为3.52±0.11至3.57±0.02 g/cm2[23],远低于本研究中高糖饮食的对照组小鼠(3.92±0.16 g/cm)2).这些结果表明,乳酸链球菌素可以显著降低体内脂肪和体重。然而,用nisin治疗不影响血清甘油三酯和胆固醇的浓度,这表明nisin最显著的影响是对脂肪组织,而不是血清因子。根据目前的研究结果,乳酸链球菌素可能通过减少食物摄入来发挥其保护体重的作用,至少部分是这样。值得注意的是,SCD-1的高水平表达以及随后较高水平的单不饱和脂肪酸也与肥胖患者的癌症死亡率较高有关[24],使使用乳酸链球菌素作为健康保护剂更有好处。
在这项研究中,用nisin治疗导致GLUT4基因的表达显著减少,该基因编码葡萄糖的主要转运体进入脂肪细胞和骨骼肌细胞。二型糖尿病(T2D)患者脂肪细胞(而非骨骼肌细胞)中GLUT4的表达减少[25].GLUT4对葡萄糖摄取的损害是T2D发病的主要阶段。虽然在动物体内GLUT4的表达减少,但在FBS中没有观察到损害,这表明至少在8周的时间内,nisin没有增加糖尿病的风险。
炎症是T2D胰岛素抵抗发生和发展的关键因素。为了评估nisin对脂肪组织炎症反应的影响,我们检测了脂肪样本中TNF-α的表达水平。一般认为,肥胖患者血清TNF-α水平轻度升高。此外,从肥胖患者的脂肪组织中获得的TNF-α mRNA水平较高。另一方面,TNF-α水平的增加减少了脂肪细胞通过GLUT4对葡萄糖的摄取[26].此外,TNF-α刺激肝细胞死亡和脂肪肝疾病的进展。非酒精性脂肪性肝病(NAFLD)中脂肪组织炎症的减轻可改善肝脏状况[27].在本研究中,nisin导致脂肪组织中TNF-α的表达水平显著降低,因此从这个角度来看似乎是有益的。然而,还需要更多的实验来进一步评估这种效应。
锌指蛋白-423是前脂肪细胞分化和成熟的关键调节因子。该蛋白在前脂肪细胞中的表达导致过氧化物酶体增殖物激活受体γ (PARγ)细胞数量的增加,从而导致脂肪细胞的分化[28].缺失zfp423可使白色脂肪细胞进入米色脂肪细胞的路径,从而逆转饮食诱导的肥胖。米色脂肪细胞的产热程序启动器,早期b细胞因子2 (Ebf2),被激活的zfp423抑制,从而导致白色脂肪细胞命运的维持[29].在本实验中,Nisin没有显著改变zfp423的表达水平。这可能表明,nisin可能对脂肪细胞的命运没有任何显著影响,而只是通过抑制SCD-1和其他一些尚不清楚的机制来减少这些细胞中的脂肪堆积。
脂肪细胞蛋白422ap2通过诱导脂肪特异性基因CCAAT/增强子结合蛋白(C/EBP) β、C/EBPα和PPARγ表达。这种蛋白质是脂肪细胞的代表[30.].在nisin处理的细胞中,422ap2的表达水平显著降低,这是脂肪减少的一个指标。一般来说,由于422ap2不是一个命运决定因素,可以得出结论,脂肪组织保持其作为组织的身份;然而,它产生和储存脂肪的能力降低了。
在这项研究中,用nisin治疗增加了血液中性粒细胞的数量,但对其他白细胞没有显著影响。中性粒细胞增多,即循环中性粒细胞数量的增加,可由细菌产物如多肽进入血液引起[31].因为nisin是一种细菌肽,所以这种增加是可以预测的。
初步研究了肠外注射乳酸链球菌素对动物的一些潜在副作用。由于前期研究不足,本研究采用常规筛查方法,如全血计数、FBS、血清甘油三酯、胆固醇、HDL、LDL、肝酶水平等,监测小鼠总体健康状况。测试结果显示没有副作用。除了中性粒细胞增加外,这些动物的血液特征与对照组没有什么不同。值得注意的是,以前关于乳酸链球菌素作为一种食品补充剂可能产生不良影响的报道是相互矛盾的。虽然一些研究报告补充nisin没有不良影响[20.,32],亦有报告显示实验动物体重减轻及食物摄取量减少[19].由于没有关于乳酸链球菌素的生物利用度以及它是否从肠道吸收的信息,这些研究的结果可能无法外推到本研究,在本研究中,乳酸链球菌素是经肠外给药给动物的。
糖尿病是一种破坏性的代谢疾病,其特征是血糖水平持续升高,而FBS是预测糖尿病的重要标志,甚至比糖化血红蛋白(HbA1c)更可靠[33].在用nisin治疗8周后,FBS水平没有明显变化,这表明对身体管理葡萄糖水平的能力没有恶化的影响。
在现代社会,动脉粥样硬化是导致死亡的主要原因之一,而高血清胆固醇是这方面的主要危险因素之一[34].除了心血管疾病,胆固醇水平升高也与帕金森病有关[35]和一些神经疾病,如脑淀粉样变[36].Nisin没有引起血清胆固醇水平的变化,这表明在研究条件下没有相关的有害影响。
高水平的甘油三酯、低水平的高密度脂蛋白和高水平的低密度脂蛋白是潜在心血管风险的指标[37].也有一些证据表明,这些血清标志物的水平与某些类型癌症的风险之间存在联系。38].在本实验中,Nisin并未引起这些因子的血清浓度发生显著变化。
任何治疗药物最重要的安全问题之一是它的肝毒性。谷草转氨酶和谷丙转氨酶这两种酶被用来确定肝脏的损伤情况[39].两种酶的水平都没有变化,表明乳酸链球菌素可能没有肝毒性。
实验过程中红细胞、白细胞计数、血红蛋白浓度、MCV、MCH等贫血指标均保持正常,说明nisin可能不会对总体健康状况产生负面影响。
与其他研究的比较:目前的工作对现有知识有什么补充
很少有研究直接使用纯化的细菌素来评估其对肥胖的影响。本研究表明,益生菌产生的细菌素乳酸菌lactis可能有重要的抗肥胖作用。有一些关于其他细菌素抗肥胖作用的研究[13,40];然而,据我们所知,目前还没有关于nisin的报道。
研究优势与局限性
细菌素直接用于评估其对肥胖的影响是罕见的。细菌素很难提纯,而且很少有商业上可以大量使用的细菌素。这项研究是为数不多的使用纯化细菌素治疗肥胖的研究之一。虽然nisin对一些与脂肪合成相关的重要基因的表达水平有一定的影响,但缺乏前人的研究是本研究的主要局限性之一。例如,乳酸链球菌素的药代动力学尚不清楚,其潜在的肠道吸光度、半衰期、可能的生物降解、消除途径等有待进一步研究。在本研究中,只研究了少数剂量的nisin,并且只对其中一个治疗组进行了RT-PCR,而需要对更多剂量进行评估。此外,组织学研究是不可能的,因为在试验组中沉积的脂肪很少。事实上,本研究是该领域的初步研究,有必要在高脂肪/高糖饮食的动物中研究乳酸链球菌素的潜在抗肥胖作用。显然,采用正常饮食的额外对照组可以提供更好的比较。此外,对其他重要基因(如PPARγ)的评估和下游蛋白质的检测是未来研究中应该解决的其他缺陷。
结论
近几十年来,肠道菌群的生物学效应和临床意义已引起广泛关注。现在得出一个具体的结论还为时过早,但对于这些微生物产生的细菌素可能也是如此。一旦未来的研究填补了信息空白,这些肽可能对肥胖及其相关并发症具有治疗或预防应用。虽然治疗永远不能代替健康的生活方式,但在处理这个问题时,关注人体微生物群及其产品是一个不可低估的因素。
缩写
- ALT:
-
丙氨酸氨基转移酶
- 高山:
-
碱性磷酸酶
- AST:
-
天冬氨酸转氨酶
- 体重指数:
-
身体质量指数
- 的边后卫:
-
空腹血糖
- GLUT4:
-
葡萄糖transporter-4
- 糖化血红蛋白:
-
糖化血红蛋白
- 高密度脂蛋白:
-
高密度脂蛋白
- il - 6:
-
白细胞介素- 6
- 低密度脂蛋白:
-
低密度脂蛋白
- 妇幼保健:
-
平均红细胞血红蛋白
- MCHC:
-
平均红细胞血红蛋白浓度
- 公司:
-
平均微粒体积
- 非酒精性脂肪肝:
-
非酒精性脂肪肝
- PARγ:
-
过氧化物酶体增殖物激活受体
- RT-qPCR:
-
逆转录-定量聚合酶链反应
- SCD-1:
-
Stearoyl-CoA desaturase-1
- 真沸点:
-
tata结合蛋白质
- 肿瘤坏死因子-α:
-
肿瘤坏死因子
- T2D:
-
II型糖尿病
- 人:
-
世界卫生组织
- zfp423:
-
锌指蛋白-423
参考文献
谁。肥胖。世界卫生组织。https://www.who.int/health-topics/obesity_1.2022年11月9日访问。
布雷。肥胖的医学后果。中国临床内分泌杂志,2004;29(2):344 - 344。https://doi.org/10.1210/jc.2004-0535.
马丁内斯农协。体重调节:肥胖的原因。Proc Nutr Soc 2000; 59:337-45。https://doi.org/10.1017/s0029665100000380.
潘德亚PR, Lamichhane R, Lamichhane G, Lee KH, Lee HK, Rhee SJ,等。18KHT01,一种有效的抗肥胖多草药配方。Front Pharmacol. 2021;12:807081。https://doi.org/10.3389/fphar.2021.807081.
李世杰,钱德拉斯克兰,马祖anti CH, O'Connell JF, Egan JM, Kim Y.饮食姜黄素恢复饮食诱导的肥胖老年小鼠胰岛素稳态。老龄化(奥尔巴尼纽约)。2022; 14:225-39。https://doi.org/10.18632/aging.203821.
潘德亚PR, Lamichhane G, Lamichhane R,罗娟,李新军,李世杰,等。两种复方中药对高脂饮食诱导的肥胖小鼠C57BL/6J的抗肥胖作用Biomed Res Int. 2022; 2021:9120259。https://doi.org/10.1155/2022/9120259.
张永华,洪海海。天然抗肥胖化合物及其衍生物的研究进展在活的有机体内证据:一个小型回顾。欧洲医学化学。2022;237:114405。https://doi.org/10.1016/j.ejmech.2022.114405.
Jandhyala SM, Talukdar R, Subramanyam C, Vuyyuru H, Sasikala M, Nageshwar RD.正常肠道微生物群的作用。世界胃肠杂志。2015;21:8836-47。https://doi.org/10.3748/wjg.v21.i29.8787.
坎宁安AL,斯蒂芬斯JW,哈里斯DA。肠道菌群:肥胖病理生理的中心因素综述。脂类健康杂志2021;20:65。https://doi.org/10.1186/s12944-021-01491-z.
陈旭,张东,孙华,姜峰,沈勇,魏鹏,等。利用16S rRNA基因测序分析中国超重和肥胖儿童肠道菌群特征PeerJ。2021; 9: e11439。https://doi.org/10.7717/peerj.11439.
孙玲,马玲,马艳,张峰,赵晨,聂艳。肠道微生物在肥胖中的作用:发病机制、机制及治疗前景。蛋白质细胞,2018;9:397-403。https://doi.org/10.1007/s13238-018-0546-3.
Drissi F, Merhej V, Angelakis E, El Kaoutari A, Carrière F, Henrissat B,等。与体重增加或体重保护相关的乳酸菌种类的比较基因组学分析。《糖尿病杂志》2014;4:e109-e。https://doi.org/10.1038/nutd.2014.6.
Taghizad F, Kazerani HR, Dehghani H, Asoodeh A, Yaghubi DA。一种治疗肥胖的新方法:在3T3-L1细胞中使用细菌产品gassericin A。Obes Res临床实践。2021;15:499-505。https://doi.org/10.1016/j.orcp.2021.08.005.
德·阿劳兹LJ,约萨拉AF,马佐拉PG,彭纳TCV。Nisin生物技术的生产与应用综述。食品科学,2009;20:146-154。https://doi.org/10.1016/j.tifs.2009.01.056.
萨帕尼克A, sokoowska B, bryska M.乳酸菌在食品保鲜和安全中的作用。食物。2022;11:1283。https://doi.org/10.3390/foods11091283.
Almeida-Oliveira F, Leandro JG, Ausina P, Sola-Penna M, Majerowicz D.代谢性疾病小鼠脂肪组织定量PCR内参基因。Biomed Pharmacother, 2017; 88:948-55。https://doi.org/10.1016/j.biopha.2017.01.091.
punyaupa -path S, Phumkhachorn P, Rattanachaikunsopon P. Nisin的产生及其抑菌作用机制。Int J Curr Res Rev. 2015;7:47。
欧洲食品安全局食品添加剂和添加到食品中的营养来源小组(ANS),尤尼斯M, Aggett P,阿吉拉尔F,等。根据新的毒理学数据和建议的扩展使用,乳酸链球菌素(E 234)作为食品添加剂的安全性。欧洲食品安全局,2017;15:e05063。https://doi.org/10.2903/j.efsa.2017.5063.
萩原A,今井N,中岛H,户田Y,川边M,古川F,等。乳酸球菌亚种抗菌肽nisin A的90天口服毒性研究。在F344大鼠中。食品化学毒物。2010;48:2421-8。https://doi.org/10.1016/j.fct.2010.06.002.
王志强,王志强。食品添加剂的生物效应研究。I.-Nisin。食品农业科学,1962;13:32-42。https://doi.org/10.1002/jsfa.2740130106.
科恩,弗里德曼,j.m。瘦素和代谢控制:硬脂酰辅酶a去饱和酶-1 (SCD-1)的作用。杨晓明。2004;https://doi.org/10.1093/jn/134.9.2455S.
Cedernaes J, Alsiö J, Västermark Å, Risérus U, Schiöth HB。高脂饲料喂养易肥胖大鼠脂肪组织硬脂酰辅酶a去饱和酶1指数升高,亚油酸降低。脂质健康杂志2013;12:1-11。https://doi.org/10.1186/1476-511X-12-2.
Gargiulo S, Gramanzini M, Megna R, Greco A, Albanese S, Manfredi C,等。用双能x线吸收仪评估C57Bl/6J小鼠的生长模式和体成分。生物医学学报,2014;https://doi.org/10.1155/2014/253067.
Byberg L, Kilander L, Warensjö Lemming E, Michaëlsson K, Vessby B.在瑞典健康男性中,癌症死亡与血清中棕榈油酸含量高和SCD-1基因多态性有关。中华儿科杂志,2014;https://doi.org/10.3945/ajcn.113.065714.
脂肪细胞中GLUT4调节的分子机制。糖尿病代谢杂志,2014;40:400-10。https://doi.org/10.1016/j.diabet.2014.01.005.
Coppack西南。促炎细胞因子和脂肪组织。环境科学学报,2001;39:349 - 56。https://doi.org/10.1079/pns2001110.
脂肪组织在脂肪肝疾病中的作用。肝脏Res. 2018; 2:35-42。https://doi.org/10.1016/j.livres.2018.02.002.
陈晓明,张晓明,张晓明,等。Zfp423检测前脂肪细胞的转录控制。大自然。2010;464:619-23。https://doi.org/10.1038/nature08816.
邵m, Ishibashi J, Kusminski CM,王qa, Hepler C, Vishvanath L,等。Zfp423通过抑制米色细胞产热基因程序来维持白色脂肪细胞的特性。Cell Metab. 2016; 23:1167-84。https://doi.org/10.1016/j.cmet.2016.04.023.
唐qq,张建文,Lane MD.脂肪形成过程中C/EBPβ、C/EBPα和PPARγ序列基因启动子相互作用。生物化学生物物理学报,2004;319:235-9。https://doi.org/10.1016/j.bbrc.2004.04.176.
Jagels MA, Hugli TE。中性粒细胞增多的机制和介质。Immunopharm。1994;28:1-18。https://doi.org/10.1016/0162 - 3109 (94) 90034 - 5.
李志刚,李志刚,李志刚。抗菌肽乳酸球蛋白对大鼠生殖功能的影响。ISRN兽医科学2012;2011:828736。https://doi.org/10.5402/2011/828736.
Ghazanfari Z, Haghdoost AA, Alizadeh SM, Atapour J, Zolala F.一般人群糖化血红蛋白和空腹血糖检测的比较。国际预防医学杂志2010;1:187。
Rosberg V, Vishram-Nielsen JK, Kristensen AMD, Pareek M, Sehested TS, Nilsson PM,等。用人体测量方法代替血清总胆固醇进行简单的心血管风险分层:摩根前瞻性队列研究项目。之前的医学报告,2022;26:101700。https://doi.org/10.1016/j.pmedr.2022.101700.
De Lau LM, Koudstaal PJ, Hofman A, Breteler MM.血清胆固醇水平与帕金森病的风险。美国流行病学杂志。2006;164:998-1002。https://doi.org/10.1093/aje/kwj283.
Reed B, Villeneuve S, Mack W, DeCarli C, Chui HC, Jagust W低HDL和高LDL血清胆固醇与脑淀粉样变相关。《美国医学会神经杂志》2014;71:195。https://doi.org/10.1001/jamaneurol.2013.5390.
Jeppesen J, Hein HO, Suadicani P, Gyntelberg F.高tg -低HDL胆固醇和低密度脂蛋白胆固醇与缺血性心脏病发病率的关系:哥本哈根男性研究的8年随访中华心血管病杂志,1997;17:414 - 414。https://doi.org/10.1161/01.ATV.17.6.1114.
吴勇,辛杰,Loehrer EA,姜旭,袁强,Christiani DC,等。高密度脂蛋白、低密度脂蛋白和甘油三酯水平与上消化道癌症风险:跨血统孟德尔随机化研究中华临床医学杂志,2002,26(2):366 - 366。https://doi.org/10.1038/s41430-022-01078-6.
张晓明,王晓明,张晓明,等。成人肝脏疾病中ALT和AST的相关性研究。中华肝病杂志,2013;
白丽玲,陈晓明,陈晓明,陈晓明。益生菌乳酸菌中细菌素PJ4对高脂饮食诱导肥胖的影响。3生物技术,2020;10:355。https://doi.org/10.1007/s13205-020-02317-y.
致谢
我们感谢马什哈德Ferdowsi大学研究副主任的财政支持(批准号:3/55237)。
作者信息
作者及隶属关系
贡献
Al-Emarah MK和Elahi M:调查,实验进行,数据收集和分析。Kazerani HR:概念化、监督、审核和编辑、资金获取。监督,验证。Taghizad F:调查,写作和编辑。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Al-Emarah, m.k., Kazerani, h.r., Taghizad, F。et al。细菌产品nisin在NIH瑞士小鼠模型中的抗肥胖效果。脂类健康与危害22, 23(2023)。https://doi.org/10.1186/s12944-023-01788-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12944-023-01788-1
关键字
- 肥胖
- 乳酸链球菌肽
- 细菌素
- 微生物群