摘要
我们检测了内源性精氨酸抗利尿激素(AVP)的化学活化是否影响中枢nesfatin-1/NucB2神经元,使用的是先前生成的转基因大鼠系。生理盐水(1ml /kg)或氯氮平-NhM3Dq激动剂-oxide (CNO, 1 mg/mL/kg)皮下注射AVP-hM3Dq-mCherry转基因成年雄性大鼠(300-370 g),皮下注射CNO后食物和水的摄入量显著降低,昼夜节律异常。scc注射CNO后120 min,下丘脑和脑干nesfatin-1/ nucb2免疫反应神经元中Fos的表达比例显著增加。与对照组相比,脑室内注射奈斯法汀-1/ nucb2中和抗体后,内源性AVP化学发生激活诱导的食物摄入被抑制,且饮水量和昼夜节律没有任何改变。这些结果表明,内源性AVP的化学发生激活至少部分影响中枢nesfatin-1/NucB2神经元,并可能在转基因大鼠中发挥厌食性作用。
回顾重点
AVP的化学活化抑制了食物和水的摄入。
AVP的化学活化改变了昼夜节律性。
AVP激活中枢神经系统中的nesfatin-1神经元。
nesfatin -1中和抗体i.c.v.逆转了被抑制的食物摄入。
奈斯法汀-1中和抗体i.c.v.不改变昼夜节律。
背景
光遗传学和化学遗传学等新技术的发展已得到广泛应用。这些技术使我们能够研究神经元特异性的功能,因为我们可以特异性地操纵神经元[1,2].我们之前已经生成了一个转基因大鼠系,它只在精氨酸抗利尿激素(AVP)神经元中表达人毒碱受体(hM3Dq)和mCherry [3.].利用转基因大鼠,我们已经证明了内源性AVP的激活抑制了食物的摄入,尽管详细的机制还不清楚。
Nesfatin-1/NucB2,被鉴定为源于nucleobindin-2 (NucB2)的饱腹感分子[4],广泛分布于中枢神经系统[5].Nesfatin-1/NucB2通过瘦素独立通路调控催产素信号6].此外,nesfatin-1/ nucb2 -免疫反应(-ir)神经元与AVP-ir神经元在视上核(SON)和室旁核(PVN)中共定位[7].然而,AVP与nesfatin-1/NucB2之间的功能关系尚不清楚。
由于AVP和nesfatin-1/NucB2这两种分子都在SON和PVN中共表达,并发挥厌食性作用,我们推测内源性AVP可能参与了中枢神经系统中nesfatin-1/NucB2的激活,从而导致食物摄入的抑制。为了验证这一假设,我们研究了内源性AVP的化学活化,通过皮下注射氯氮平-N通过荧光免疫组化(FIHC)检测转基因大鼠CNS中nesfatin-1/NucB2的表达。神经元激活由Fos蛋白的表达决定,Fos蛋白通常被用作神经元活动的标记物[8],与nesfatin-1/NucB2-ir神经元共表达。为了进一步阐明AVP在中枢神经系统中的厌食性作用,本研究还研究了脑室内(i.c.v.)给药奈斯法汀-1/ nucb2中和抗体(-NA)对AVP神经元化学活化后摄食抑制的影响。
材料与方法
动物
将成年雄性AVP-hM3Dq-mCherry转基因大鼠(每只体重300-370 g)分组饲养(3只大鼠关在一个笼子里),在温度控制(23-25℃)的条件下,光照/暗循环12/12小时(07.00 h亮灯),所有大鼠自由获得标准鼠粮和自来水。实验前处理大鼠5 d,适应单笼环境3 d。所有实验均严格按照日本生理学会发布的实验动物使用和护理伦理准则进行,并得到职业与环境卫生大学(UOEH)动物护理与实验伦理委员会的批准(批准号:AE16-012)。
内源性AVP化学活化后的食物和水的摄入量
生理盐水(1ml /kg,大冢制药株式会社,日本东京)(n= 14)或CNO (1 mg/mL/kg,溶于0.9%无菌生理盐水)(n= 14)于暗周期(18.30 h)开始前30 min皮下注射,于授时因子时间(zeitgeber time, ZT) 12时19.00 h开始测量。在zt12、13、15、18、24/0和12测量食物和水的摄入量。CNO的用量参照前期研究确定[3.].
内源性AVP化学活化后的昼夜节律活动和核心体温
Nanotag®(Kissei Comtec, Matsumoto,日本),一种遥测探头,使我们能够测量每隔5分钟的运动活动和核心体温(CBT),在吸入七氟醚深度麻醉后,通过背侧入路腹腔内(i.p)植入大鼠(辉瑞日本,东京,日本)。术后允许他们恢复5天。
试验当日,生理盐水(1ml /kg) (n= 5)或CNO (1mg /kg/mL) (n= 5)于暗周期开始前30 min皮下注射,ZT 11.5。测量开始于19.00 h, zt12,持续24 h。
Fos和nesfatin-1/NucB2的FIHC
生理盐水(1ml /kg,n= 5)或CNO (1 mg/kg,n= 5),用三种混合麻醉剂(联合0.3 mg/kg美托咪定、4.0 mg/kg咪达唑仑、5.0 mg/kg布托啡诺)对大鼠进行深度麻醉。经心灌注0.1 M含肝素(1000 U/L)的磷酸盐缓冲液(PB) (pH 7.4)和溶解于0.1 M PB中含4%多聚甲醛(PFA)的固定剂。用4%的PFA在0.1 M PB中4°C固定大脑48小时。然后将组织脱水,在0.1 M PB的30%蔗糖中,在4℃下冷冻保护48小时。使用microtome (REM-700, Yamato Kohki Industrial co. ltd, Tokyo, Japan)切片30µm厚的连续切片。
切片用一抗溶液(豚鼠抗C - fos, Synaptic System, Goettingen, Germany, 1:500,稀释于0.1 M磷酸缓冲盐水中0.3% Triton X-100 (PBST);兔抗nucb2,西格玛-奥尔德里奇,密苏里州,美国,1:20 00,稀释于0.1 M PBST)。悬浮切片在PBST中洗涤两次后,用二抗(Alexa Fluor 488山羊抗豚鼠IgG, Abcam,剑桥,英国,1:1000稀释于PBST;Alexa Fluor 405驴抗兔IgG, Abcam,剑桥,英国,1:1000,0.1 M PBST稀释)。切片在PBS中冲洗两次,然后安装在载玻片上,并使用vectasshield (Vector Laboratories Co. Ltd, CA, USA)盖上。
本研究检查的细胞核如下:SON、PVN、弓状核(ARC)、下丘脑外侧区(LHA)、杏仁核中央区(CeA)、腹侧被盖区(VTA)、中缝背核(DR)、蓝斑核(LC)、后区(AP)、孤束核(NTS)吻侧和尾侧部分,以及延髓吻侧腹外侧(RVLM)。DR分为以下四个子区域;腹侧“翅膀”(DRvl)、背侧“翅膀”(DRd)、腹侧“翅膀”(DRv)和束间“翅膀”(DRi),因为每个亚核发挥不同的作用[9].这些核是根据大鼠脑图谱中给出的坐标确定的。10].显微照片是用一台一体机显微镜(BZ-X800, KEYENCE公司,大阪,日本)和一台荧光显微镜(尼康,东京,日本),使用适当的激发和发射滤波器,以及一台LSM880共聚焦激光显微镜(卡尔蔡司有限公司)拍摄的。从德国)。捕捉到的图像被印在一张扩大尺寸的纸上。然后,他们被蒙蔽,由两位不同的研究人员计算Fos-ir神经元(表现为圆形核)、nesfatin-1/NucB2-ir神经元(表现为细胞质神经元)和它们的双ir神经元,以避免歪曲结果。人工计数2个横截面(左、右,每个区域每只大鼠共4个核),并对结果取平均。为了防止重复计数,每次计数Fos-ir、nesfatin-1/NucB2-ir和double-ir神经元数量时,我们都检查了打印纸上的十字标记。
脑室内注射奈斯法汀-1/ nucb2中和抗体(-NA)
为了研究CNO诱导的食物摄入抑制是否是由于nesfatin-1/NucB2神经元的激活,我们在脑室内注射nesfatin-1/NucB2- na来阻断nesfatin-1/NucB2在s.c.注射CNO后的作用。
在大鼠侧脑室植入不锈钢导管。他们被三种混合麻醉剂深度麻醉(与0.3 mg/kg美托咪定、4.0 mg/kg咪达唑仑和5.0 mg/kg布托啡诺联合使用),然后置于立体定向框架中。将不锈钢导管(外径550 μm,长10mm)立体定向植入于以下坐标处:椎弓根后0.8 mm,中线外侧1.4 mm,左皮质表面下3.0 mm,使导管尖端位于左脑室上方1.0 mm。用2颗不锈钢锚定螺钉固定颅骨,用丙烯酸牙水泥固定套管。手术后,动物被处理了5天,分别安置在塑料笼子里,并让它们恢复7天。
在s.c.注射生理盐水(1ml /kg)或CNO (1mg /mL/kg)后,在导尿管末端1.0 mm处插入不锈钢注射器(外径300 μm),在暗周期开始前30分钟脑室内注射Vehicle(兔IgG, Sigma-Aldrich, MO, USA)或nesfatin-1/NucB2-NA(由Mori博士提供,兔体内生产),时间为11.5。Vehicle(8µg/4µL)或nesfatin-1/NucB2-NA(8µg/4µL)注入侧脑室的总体积为4 μL。本研究使用的nesfatin-1/NucB2-NA剂量参照前人研究确定[4,11].在测量期间,所有的老鼠都可以自由地获得食物和水。测量一直进行到开始后24小时(盐水s.c. +载药i.c.v.,n= 7;盐水s.c. + nesfatin-1/NucB2-NA i.c.v.,n= 8;CNO s.c +车辆i.c.v,n= 8;CNO s.c. + nesfatin-1/NucB2-NA i.c.v.,n= 10)。
统计分析
根据结果计算平均值±SEM。所有数据均采用单因素方差分析(one-way ANOVA),然后采用Bonferroni-type调整进行多重比较(JMP®15、SAS研究所有限公司,卡里,北卡罗来纳州,美国)。统计显著性设为P< 0.05。
结果
内源性AVP的化学活化抑制了食物和水的摄入,具有异常的昼夜节律性
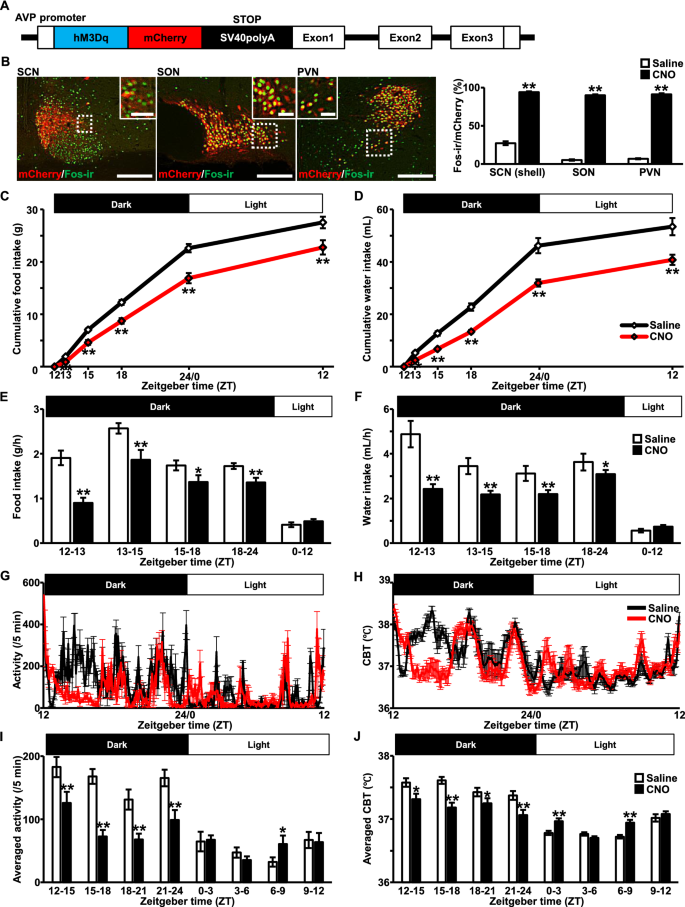
嵌合AVP-hM3Dq-mCherry BAC克隆转基因结构的示意图如图所示。1A).转基因大鼠脑中AVP启动子下特异性表达hM3Dq-mCherry [3.].的确,与生理盐水相比,在SCN、SON和PVN的mcherry阳性AVP神经元中,CNO在sc注射120分钟后观察到强烈的Fos诱导(图2)。1B),表明转基因鼠系中的hM3Dq正在发挥作用。结果的所有原始数据都表示在表(附加文件3.:表S1)。
内源性精氨酸抗利尿激素(AVP)的化学活化抑制了食物和水的摄入,具有异常的昼夜节律性。一个嵌合AVP-hM3Dq-mCherry BAC克隆转基因结构示意图。B皮下注射生理盐水(1ml /kg)或氯氮平后120 min mCherry神经元(红色)的fos免疫反应(-ir)(绿色)N-氧化物(CNO, 1 mg/mL/kg)在视交叉上核(SCN),视上核(SON)和室旁核(PVN)。数字图像取自CNO处理的大鼠。由白色虚线包围的矩形在每张图像中都被放大了。该图表示Fos在mCherry神经元中的表达百分比。比例尺,200 μm。放大图像中的比例尺,50 μm。数据以均数±SEM (n= 6,每人)。**P与生理盐水相比< 0.01。累积食物图表(C)和取水口(D以盐水或CNO为代表。在黑暗周期开始前30分钟皮下注射生理盐水或CNO, ZT为11.5。食品(E)和每小时的摄水量(F)也表示在每个图的下方。数据以均数±SEM (n= 14,每人)。*P< 0.05, **P与生理盐水相比< 0.01。身体活动(G)和核心体温(H)通过腹腔内植入的遥测探针(Nanotag®).在黑暗周期开始前30分钟皮下注射生理盐水或CNO, ZT为11.5。平均活动量(每5分钟)(我)和平均CBT (J),每隔3 h计算一次。数据以均数±SEM (n= 5,每人)。*P< 0.05, **P与生理盐水相比< 0.01
与生理盐水相比,CNO在s.c.注射后的第13、15、18、24/0和12 ZT的累积摄食量明显被抑制。1C).单位时间摄食量(g/h)由每个ZT单位的结果计算。分析显示,与生理盐水相比,CNO处理的大鼠在黑暗周期内单位时间的食物摄入量显著降低(图2)。1E)。与盐水相比,在s.c.注射CNO后的ZT 13、15、18、24/0和12日,累积水摄入量也被显著抑制(图。1D).单位时间的采水量(mL/h)由每个ZT单位的结果计算。与生理盐水相比,CNO处理的大鼠在黑暗周期内单位时间的饮水量和摄食量均显著降低(图2)。1F)。
CNO注射后,昼夜运动活动和CBT明显中断。1G, H),根据结果计算其单位时间(每3小时)的平均值。与生理盐水相比,CNO处理的大鼠在暗周期内单位时间的运动活动显著降低,在光周期内观察到异常行为(图。1c. c.注射CNO后,与运动活动相同,CBT节律模式异常,暗周期CBT较低,光周期CBT较高(图2)。1J).这些结果与之前的研究一致[3.].此外,我们证实,在本研究中使用的剂量下,CNO不影响成年雄性野生型大鼠的食物和水的摄入量,也不影响昼夜节律性(附加文件)1:图S1)。
内源性AVP化学活化后视上核(SON)、室旁核(PVN)和弓状核(ARC)内nesfatin-1/NucB2-ir神经元中Fos表达的共聚焦图像
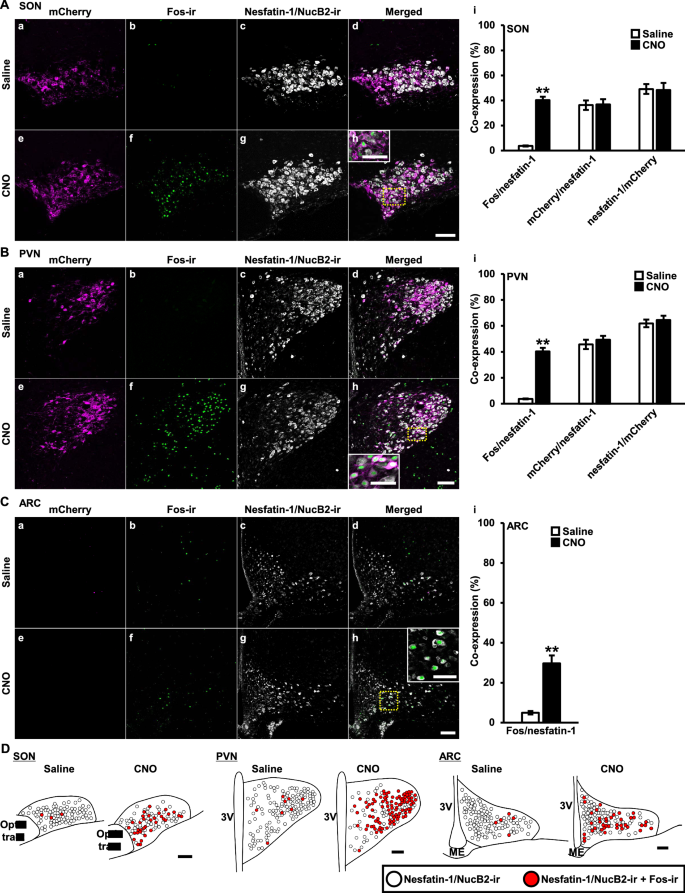
共聚焦激光显微镜观察发现Fos的免疫反应为圆形核,nesfatin-1/NucB2的免疫反应为细胞质沉淀。内源性mCherry蛋白仅在AVP神经元中被hM3Dq标记,在AVP神经元的膜和细胞质中均可见到。SON的共聚焦图像(图。2Aa-Ah), PVN(图。2Ba-Bh)和ARC(图。2Ca-Ch)分别表示。各核共焦图像右侧显示各核共表达百分比(图2)。2Ai, Bi, Ci)。
内源性AVP化学活化后视上核(SON)、室旁核(PVN)和弓状核(ARC)内nesfatin-1/NucB2-ir神经元中Fos表达的共聚焦图像。经生理盐水(1 mL/kg) (a-d)或CNO (1 mg/mL/kg) (e-h)皮下处理后120 min,获得转基因大鼠共聚焦图像。mCherry (a, e)(洋红色),Fos-ir (b, f)(绿色),nesfatin-1/NucB2-ir (c, g)(白色)及其合并后的SON (d, h)一个), PVN (B)和ARC (C)表示。由黄色虚线包围的矩形在面板中被放大(h) (一个- - - - - -C).计算每个核中表达内源性荧光或免疫反应性(i)的神经元的共表达(一个- - - - - -C).比例尺,200 μm。放大图像中的比例尺,50 μm。数据以均数±SEM (n= 5,每人)。**P与生理盐水相比< 0.01。D在盐水或CNO处理的SON、PVN和ARC中表达Fos的Nesfatin-1/NucB2-ir和Nesfatin-1/NucB2-ir神经元分别用白色圈和红色圈表示。比例尺表示200µm。3 v第三脑室,我中突
与生理盐水相比,CNO s.c.注射后120分钟,SON、PVN和ARC中nesfatin-1/NucB2-ir神经元中Fos的表达比例显著增加。与上次报告一致[7],大量的nesfatin-1/NucB2-ir神经元在SON和PVN中与mCherry标记的AVP神经元共定位,反之亦然。盐水和cno治疗组的共定位百分比相当(图2)。2人工智能,Bi)。由于AVP神经元在ARC中不表达,因此在ARC中未观察到mCherry(图2)。2Ca, Ce)。
为了更好地解释结果,还分别表示了SON、PVN和ARC(盐水或CNO处理)的功能映射图像(图2)。2D)。
内源性AVP化学活化后nesfatin-1/NucB2-ir神经元中Fos表达的功能定位
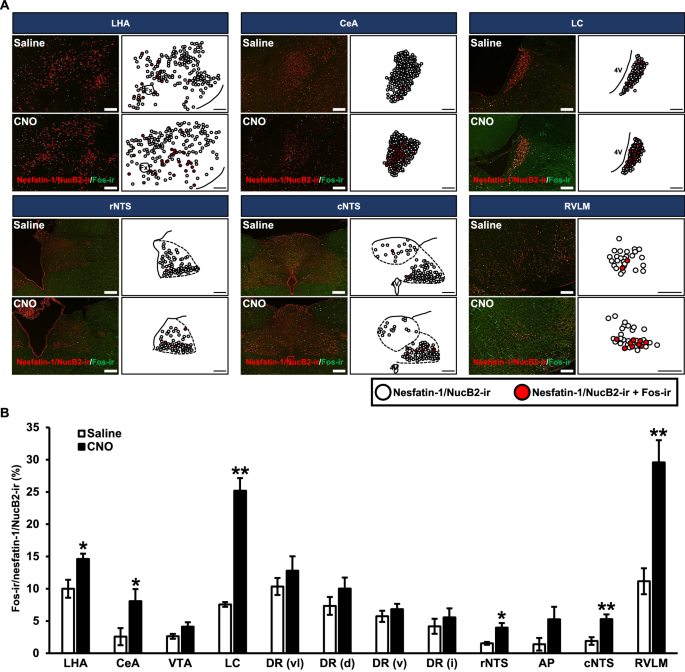
在nesfatin-1/NucB2-ir神经元中检查的Fos-ir核的数字图像和示意图被表示(图2)。3.A).在数字图像中,nesfatin-1/NucB2-ir神经元被识别为红色细胞质沉淀,Fos-ir表达神经元被识别为绿色细胞核。展示了nesfatin-1/NucB2-ir神经元的代表性功能映射图像以及表达Fos的nesfatin-1/NucB2-ir神经元的共定位图像,分别用白色圈和红色圈表示。图中所示为经scc注射CNO改变的nesfatin-1/NucB2表达的细胞核。在LHA、CeA、LC、rNTS、cNTS和RVLM中s.c.注射CNO后,观察到更多的nesfatin-1/NucB2-ir和Fos-ir(图2)。3.一个)。
内源性AVP化学活化后nesfatin-1/NucB2-ir神经元中Fos表达的功能定位。一个nesfatin-1/NucB2(红色)和Fos(绿色)在下丘脑外侧区(LHA)、杏仁核中央核(CeA)、蓝斑位点(LC)、脊骨结构核吻侧(rNTS)、脊骨结构核尾侧(cNTS)和延髓吻侧腹外侧(RVLM)的荧光免疫组化数字图像。每个示意图显示nesfatin-1/NucB2-ir神经元(白圈)和表达Fos的nesfatin-1/NcB2神经元(红圈)在每个核中的共定位。图像分别于大鼠静脉注射生理盐水或CNO后120 min获得。标尺表示200µm。外汇,穹窿;4V,第四脑室。BCNO刺激后120 min nesfatin-1/NucB2-ir神经元表达Fos-ir的百分比。数据以均值±SEM (n= 5,每人)。*P< 0.05, **P与盐水处理组相比< 0.01。VTA腹侧被盖区,博士中缝背核,美联社postrema领域。DR分为以下四个子区域;背侧(DRd),腹侧(DRv),腹侧“翅膀”(DRvl)和束间(DRi)
nesfatin-1/NucB2-ir神经元的百分比在VTA、DRvl、DRd、DRv、DRi和AP中具有可比性(图2)。3.B)。与盐水相比,在s.c.注射CNO后,LHA、CeA、LC、rNTS、cNTS和RVLM中均显著增加(图。3.B)。
我们还对AVP和nesfatin-1/NucB2进行了FIHC,以识别AVP神经元和/或nesfatin-1/NucB2阳性AVP神经元的轴突(附加文件)2:图S2)。在AVP化学活化后nesfatin-1/NucB2-ir神经元中Fos诱导的脑区观察到AVP-ir和/或nesfatin-1/NucB2-ir阳性AVP轴突。部分轴突仅对AVP有免疫反应。这些结果表明,AVP神经元以及nesfatin-1/NucB2-ir阳性AVP-ir神经元影响了SON和PVN以外的脑区nesfatin-1/NucB2-ir神经元,尽管这种方法无法确定轴突的起源(即SON或PVN)。
在i.c.v.注射奈斯法汀-1/ nucb2中和抗体(-NA)后,由AVP神经元化学活化引起的食物摄入抑制减弱,而不改变水摄入量和昼夜节律性
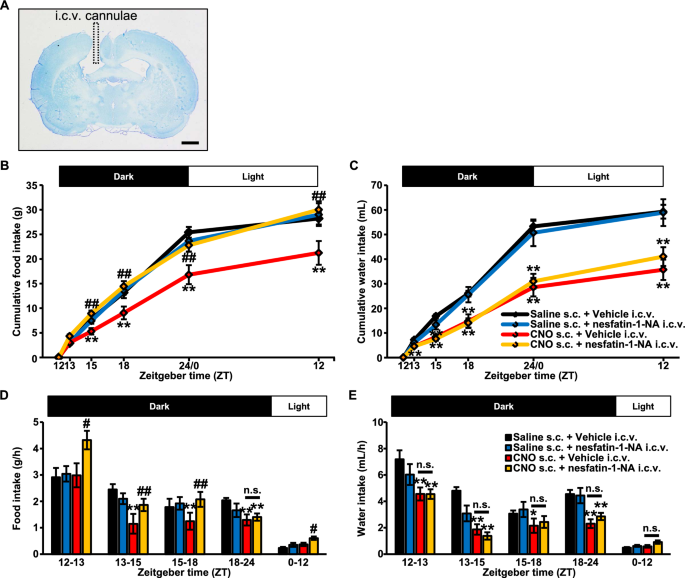
甲苯胺蓝染色的套管植入脑片如图所示。4A).将不锈钢套管植入侧脑室。插管不正确的大鼠排除在分析之外。
在i.c.v.注射nesfatin-1/ nucb2 -中和抗体(-NA)后,由AVP神经元化学活化引起的食物摄入抑制减弱,而不改变水的摄入量。一个面向侧脑室植入不锈钢套管的数字图像。对照组(8µg/4µL)或Nesfatin-1/ nucb2 -中和抗体(-NA)(8µg/4µL)在暗周期开始前30分钟静脉注射,ZT为11.5。脑室内注射后立即皮下注射生理盐水或CNO (1 mg/mL/kg)。测量开始于zt0。累积食物(g) (B)及饮水量(毫升)(C),以及单位时间的摄入量(g/h, mL/h) (D,E)根据结果计算。在测量期间,所有的老鼠都可以自由地获得食物和水。数据以均值±SEM(生理盐水s.c. +载体i.c.v.,n= 7;盐水s.c. + nesfatin-1/NucB2-NA i.c.v.,n= 8;CNO s.c +车辆i.c.v,n= 8;CNO s.c. + nesfatin-1/NucB2-NA i.c.v.,n= 10)。*P< 0.05, **P盐水s.c. +载药i.c.v. < 0.01。#P< 0.05,# #P< 0.01 vs. CNO s.c. + Vehicle i.c.v
I.c.v.注射nesfatin-1/NucB2-NA不影响s.c.盐水注射大鼠的食物摄入量和水摄入量(图2)。4B, C)。与累积食物和水摄入量相同,盐水处理大鼠单位时间的摄入量(g/h, mL/h)没有改变(图。4D, E)。
然而,在s.c.注射CNO治疗的大鼠中,nesfatin-1/NucB2-NA经i.c.v.注射后,被抑制的食物摄入量显著减弱(图2)。4脑室内注射nesfatin-1/NucB2-NA后,单位时间(g/h)的食物摄入量也显著增加(图2)。4D)。
值得注意的是,在i.c.v.给予nesfatin-1/NucB2-NA后,由s.c.注射CNO诱导的抑制水摄入量没有改变(图2)。4C).单位时间的饮水量也没有改变(图。4E)。
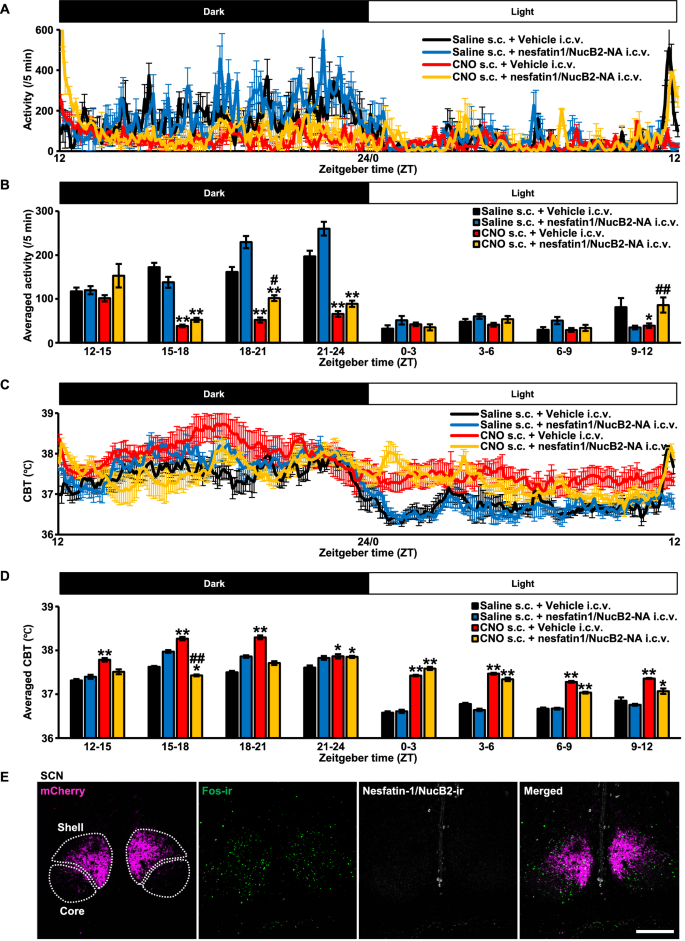
为了证实i.c.v.给予nesfatin-1/NucB2-NA不影响昼夜节律性,采用ip植入遥测探头测量昼夜运动活动和CBT,如上图所述(图2)。1G-J)。CNO注射后,昼夜运动活动和CBT明显中断,这与先前的结果一致(图2)。1G, H),然而,i.c.v.注射nesfatin-1/NucB2-NA对它们没有影响(图。5A, C)。分析显示,与生理盐水相比,CNO处理的大鼠单位时间(每3小时)的运动活动显著中断,但i.c.v.注射nesfatin-1/NucB2-NA没有显著改变(图2)。5B)。
i.c.v.注射nesfatin-1/ nucb2中和抗体(-NA)未改变昼夜节律。身体活动(一个)和核心体温(C)通过腹腔内植入的遥测探针(Nanotag®).对照组(8µg/4µL)或Nesfatin-1/ nucb2 -中和抗体(-NA)(8µg/4µL)在暗周期开始前30分钟静脉注射,ZT为11.5。脑室内注射后立即皮下注射生理盐水或CNO (1 mg/mL/kg)。测量开始于zt0。平均活动量(每5分钟)(B)和平均CBT (D)每隔3 h计算一次。数据以均数±SEM (n= 5,每人)。*P< 0.05, **P盐水s.c. +载药i.c.v. < 0.01。#P< 0.05,# #P< 0.01 vs. CNO s.c. + Vehicle i.c.v。E视交叉上核(SCN)内nesfatin-1/NucB2免疫组化分析
与运动活动一样,在s.c.注射CNO后观察到异常的昼夜节律CBT模式,但在i.c.v.注射nesfatin-1/NucB2-NA后没有改变(图2)。5D)。
在成年雄性AVP-hM3Dq-mCherry转基因大鼠的SCN中未观察到Nesfatin-1/NucB2免疫反应。5E).图像来自用CNO处理过的大鼠。这些结果表明,即使与AVP神经元共定位的nesfatin-1/NucB2-ir神经元可能与SON和PVN中AVP的化学活化一起受到刺激,nesfatin-1/NucB2或nesfatin-1/NucB2- na也不会直接影响它们的昼夜节律性。
讨论
这些数据表明,内源性AVP的化学活化影响了中枢nesfatin-1/NucB2通路,并在转基因大鼠中发挥厌食性作用。虽然这些数据并没有明确定义AVP在厌食症中的确切作用,但我们假设本研究中观察到AVP诱导的nesfatin-1/NucB2摄食抑制受到两种不同途径的影响。一个是SON中的AVP和PVN。这些核中的AVP神经元将其轴突发送到大脑的各个区域,并可能激活nesfatin-1/NucB2神经元。另一种是SCN中的AVP。SCN中的AVP神经元在维持昼夜节律性和引导环境光/暗周期方面发挥关键作用[12].事实上,昼夜节律紊乱会导致进食抑制[13].昼夜AVP合成在暗周期达到最低点[14].本研究在此时间点进行了AVP的化学活化,这可能会导致内在昼夜节律性的显著破坏,从而导致摄食抑制。
在本研究中转基因大鼠的SON和PVN中,约有40-60%的AVP-ir神经元与nesfatin-1/NucB2-ir神经元共定位。scc注射CNO后,90%以上的AVP神经元被激活。总之,SON和PVN中的一些nesfatin-1/NucB2神经元被AVP的化学活化激活。
Nesfatin-1/NucB2神经元激活PVN中的催产素神经元,并通过NTS中的前阿皮黑色素皮质素神经元发挥厌食作用[6].Price等人报道nesfatin-1/NucB2抑制ARC中的NPY神经元[15].因此,在PVN中激活nesfatin-1/NucB2神经元和ARC诱导的进食抑制是相容的。
CeA是参与摄食控制的重要细胞核之一[16].研究表明,杏仁核中的nesfatin-1/NucB2在降低胃动力方面起着重要作用[17].NTS中的Nesfatin-1/NucB2神经元对胃胀气敏感,可能参与饱腹感信号的传递[18].同样,LHA中的nesfatin-1/NucB2信号通路参与外周胃肠道传出信息和胃分泌的调节[19].由于化学活化后,在CeA、NTS和LHA中观察到nesfatin-1/NucB2-ir神经元数量增加,AVP可能通过CeA-、NTS-和LHA-nesfatin-1/NucB2通路发挥厌食作用。
Nesfatin-1/NucB2免疫反应性与神经肽Y和可卡因和安非他明调控转录本(CART)在人类LC和DR中共表达[20.].去甲肾上腺素和血清素(5-HT)产生的神经元分别定位于LC和DR,这些单胺参与了广泛的神经元活动,包括进食。RVLM是控制交感神经系统的核之一。RVLM接收来自下丘脑的神经元投射[21].推测AVP的化学活化作用影响了LC和RVLM的nesfatin-1/NucB2神经元,进而引起交感神经系统的摄食抑制。自主神经系统由交感神经和副交感神经组成。一般来说,自主神经系统的激活是矛盾的,当一个被激活时,另一个被抑制。22].促食神经肽,如神经肽Y、促食素和甘丙肽增加了食物摄入量,降低了交感神经活动。相反,产生厌食的神经肽,如胆囊收缩素(CCK-8)、促肾上腺皮质激素释放激素(CRH)、瘦素和CART抑制了食物摄入,增加了交感神经活动[23].许多研究表明,抑制副交感神经会降低胃肠动力,导致厌食症[24,25].另一方面,NamKoong等人报道了副交感神经的直接激活抑制了食物的摄入[26].因此,从目前的结果来看,摄食抑制与自主神经系统之间的因果关系尚不清楚,有待进一步的研究来明确。
我们利用c-Fos作为神经元激活的指标[8].值得注意的是,我们只能检测到激活的神经元,而不是那些潜在的抑制神经元。有可能通过抑制食源神经肽来实现摄食抑制。
Nesfatin-1/NucB2抑制水和食物的摄入量[27],这与我们的结果一致。然而,i.c.v.注射nesfatin-1/NucB2-NA并不能消除由AVP化学活化引起的水摄入抑制。AVP对水分摄入的影响可能比nesfatin-1/NucB2更强。此外,i.c.v.注射nesfatin-1/NucB2-NA不影响昼夜节律性。这些结果是合理的,因为即使食物摄入受到昼夜节律中断或AVP本身的抑制,AVP的化学发生激活最终导致nesfatin-1/NucB2神经元的激活,导致进食抑制。
目前尚不清楚SON和PVN中的AVP或nesfatin-1/NucB2是否影响细胞核中的nesfatin-1/NucB2神经元,而不是SON和PVN,因为化学发生激活可能同时激活SON和PVN中的AVP和nesfatin-1/NucB2神经元。此外,i.c.v.注射nesfatin-1/NucB2-NA取消了avp诱导的厌食症作用。可能是nesfatin-1/NucB2介导AVP神经元的厌食功能,而不是AVP神经元释放AVP。另一种合理的解释是,AVP也参与了厌食症的发生,但下游的nesfatin-1/NucB2至关重要。AVP受体拮抗剂的预处理,如V1a和V1b拮抗剂,将进一步阐明AVP对nesfatin-1/ nucb2诱导的摄食抑制的机制。
结论
总之,我们已经证明了内源性AVP的化学发生激活影响了转基因大鼠的nesfatin-1/NucB2通路。除了对摄食有影响外,AVP在代谢中也有重要作用[28].世界卫生组织报告称,目前肥胖流行,代谢综合征和2型糖尿病的发病率也相应增加。由于AVP具有内在的摄食行为调节作用,进一步阐明AVP在nesfatin-1/NucB2通路上的潜在机制,将有助于在未来发现潜在的代谢紊乱治疗靶点。
数据和材料的可用性
本研究中使用和分析的数据集可根据合理要求从相应作者处获得。
缩写
- 记者:
-
区域postrema
- 弧:
-
弓状核
- AVP:
-
精氨酸加压素
- 购物车:
-
可卡因和安非他明管制的记录
- 认知行为疗法:
-
核心体温
- CCK-8:
-
Cholecystokinin-8
- 东航:
-
杏仁核的中央核
- 碳氮氧:
-
氯氮平,N氧化
- 中枢神经系统:
-
中枢神经系统
- 碳纳米管:
-
孤束核的尾部部分
- CRH:
-
-促激素
- 博士:
-
中缝背核
- DRd:
-
中缝背侧部分
- DRi:
-
中缝背的束间部分
- DRv:
-
中缝背侧腹侧部分
- DRvl:
-
腹侧“翅膀”中缝背的一部分
- FIHC:
-
荧光免疫组织化学
- hM3Dq:
-
人M3毒蕈碱胆碱能gq偶联受体
- i.c.v。
-
Intracerebroventricularly
- i.p。
-
腹腔内
- 红外光谱:
-
免疫反应性的
- LC:
-
蓝斑
- 方面:
-
下丘脑外侧区
- 钠:
-
中和抗体
- 铅:
-
磷酸缓冲液
- PBST:
-
含0.3% Triton X-100的磷酸盐缓冲盐水
- PFA:
-
多聚甲醛
- PVN:
-
室旁核
- rNTS:
-
孤束核的吻侧部分
- RVLM:
-
口侧腹外侧延髓
- 南卡罗来纳州。
-
皮下
- 儿子:
-
视上核
- 区域:
-
腹侧被盖区
- ZT型:
-
授时因子时间
参考文献
张峰,张志刚,张志刚,张志刚,张志刚,张志刚(2005)神经活动的基因靶向光学控制。神经科学8:1263-1268。https://doi.org/10.1038/nn1525
Armbruster BN, Li X, Pausch MH, Herlitze S, Roth BL(2007)进化锁以适应钥匙,以创建由惰性配体有效激活的G蛋白偶联受体家族。美国国家科学院学报104:5163-5168。https://doi.org/10.1073/pnas.0700293104
Yoshimura M, Nishimura K, Nishimura H, Sonoda S, Ueno H, Motojima Y, Saito R, Maruyama T, Nonaka Y, Ueta Y(2017)内源性精氨酸加压素神经元抑制食物摄入的激活:通过使用具有DREADDs系统的新型转基因大鼠系。Sci代表。https://doi.org/10.1038/s41598-017-16049-2
Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K, Tsuchiya T, Monden T, Horiguchi K, Yamada M, Mori M(2006)下丘脑中nesfatin-1作为饱腹感分子的鉴定。自然443:709 - 712。https://doi.org/10.1038/nature05162
Goebel-Stengel M,王玲,Stengel A, Taché Y(2011)小鼠脑内nesfatin-1神经元定位及其功能意义。Brain Res 1396:20-34。https://doi.org/10.1016/j.brainres.2011.04.031
Maejima Y, Sedbazar U, Suyama S, Kohno D, Onaka T, Takano E, Yoshida N, Koike M, Uchiyama Y, Fujiwara K, Yashiro T, Horvath TL, Dietrich MO, Tanaka S, Dezaki K, Hashimoto K, Shimizu H, Nakata M, Mori M, Yada T(2009)脑室旁核中nesftin -1调控的催产素能信号通过瘦素独立的黑素皮质素途径引起厌食症。细胞金属底座。https://doi.org/10.1016/j.cmet.2009.09.002
Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T(2008)大鼠下丘脑室旁核和视上核中的Nesfatin-1神经元共同表达催产素和抗利尿激素,并通过再喂食被激活。内分泌学。https://doi.org/10.1210/en.2007-1276
Morgan JI, Cohen DR, Hempstead JL, Curran T(1987)癫痫发作后中枢神经系统c-fos表达的图谱。科学237:192 - 197。https://doi.org/10.1126/science.3037702
Prakash N, Stark CJ, Keisler MN, Luo L, Der-Avakian A, Dulcis D(2020)中缝背核血清素能可塑性表征快感缺乏的易感性和弹性。J >。https://doi.org/10.1523/JNEUROSCI.1802-19.2019
陈志强,陈志强(1998)大鼠大脑的三维定位,第4版。阿姆斯特丹,爱思唯尔
Yoshimura M, Matsuura T, Ohkubo J, Maruyama T, Ishikura T, Hashimoto H, Kakuma T, Mori M, Ueta Y (2014) nesfatin-1/NucB2在脱水性厌食症中的作用。Am J Physiol。https://doi.org/10.1152/ajpregu.00488.2013
Mieda M (2019) SCN中枢昼夜节律起搏器的网络机制:AVP神经元是否发挥了比预期更关键的作用?>。https://doi.org/10.3389/fnins.2019.00139
Challet E(2019)食物摄入的昼夜节律调节。内分泌学15:393-405。https://doi.org/10.1038/s41574-019-0210-x
Maruyama T, Ohbuchi T, Fujihara H, Shibata M, Mori K, Murphy D, Dayanithi G, Ueta Y(2010)精氨酸抗利尿激素增强的大鼠视交叉上核绿色荧光蛋白融合基因表达的日变化。肽。https://doi.org/10.1016/j.peptides.2010.08.010
Price CJ, Samson WK, Ferguson AV (2008) Nesfatin-1抑制弓状核中的NPY神经元。大脑决议1230:99-106。https://doi.org/10.1016/j.brainres.2008.06.084
Carter ME, Soden ME, Zweifel LS, Palmiter RD(2013)抑制食欲的神经回路的遗传鉴定。自然503:111 - 114。https://doi.org/10.1038/nature12596
徐玲,王强,郭峰,庞明,孙霞,高松,龚艳(2015)杏仁核基底内侧的Nesfatin-1信号通路通过黑素皮质素3/4受体调节胃胀气敏感神经元放电并降低胃动力。欧洲药典764:164-172。https://doi.org/10.1016/j.ejphar.2015.07.002
张志刚,张志刚,张志刚,张志刚。(2013)胃胀对大鼠神经细胞核素b2 /nesfatin-1表达的影响。Regul Pept 187:17-23。https://doi.org/10.1016/j.regpep.2013.10.001
徐玲,王辉,龚艳,庞敏,孙霞,郭峰,高松(2017)Nesfatin-1通过弓状核神经支配调节下丘脑外侧区黑色素集中激素反应性胃胀感神经元和胃功能。新陈代谢67:14-25。https://doi.org/10.1016/j.metabol.2016.10.010
Psilopanagioti A, Makrygianni M, Nikou S, Logotheti S, Papadaki H(2020)人类脑干中核素2/nesfatin-1的表达和与神经肽Y和可卡因和安非他明调控转录本的共定位。J Neuroendocrinol。https://doi.org/10.1111/jne.12899
Koganezawa T, Shimomura Y, Terui N (2008) RVLM神经元在内脏交感反射中的作用:一个小综述。Auton神经科学基础临床142:17-19
Giordano A, Song CK, Bowers RR, Ehlen JC, Frontini A, Cinti S, Bartness TJ(2006)白色脂肪组织缺乏明显的迷走神经支配和副交感神经支配的免疫组织化学证据。Am J物理291:1243-1255。https://doi.org/10.1152/ajpregu.00679.2005
Bray GA(2000)食物摄入和交感神经活动的相互关系:实验观察和临床意义。Int J Obes 24: S8-S17。https://doi.org/10.1038/sj.ijo.0801269
Travagli RA, Anselmi L(2016)迷走神经回路及其对胃运动的影响。Nat Rev胃肠醇肝13:389-401
曹鹏,刘敏(2006)食物摄入的胃肠调节。Princ Mol Med 117:513-517。https://doi.org/10.1007/978-1-59259-963-9_47
NamKoong C, Song WJ, Kim CY, Chun DH, Shin S, Sohn JW, Choi HJ(2019)化学操纵副交感神经(DMV)调节摄食行为和能量代谢。神经科学杂志712:134356。https://doi.org/10.1016/j.neulet.2019.134356
Yosten GLC, Redlinger L, Samson WK(2012)内源性nesfatin-1在控制饮水中的作用。神经内分泌杂志24:1078-1084。https://doi.org/10.1111/j.1365-2826.2012.02304.x
Yoshimura M, Conway-Campbell B, Ueta Y(2021)精氨酸加压素对代谢的直接和间接作用。肽142:170555。https://doi.org/10.1016/j.peptides.2021.170555
确认
不适用。
资金
本文由日本文部科学省(MEXT)的MY科研资助(C) (21K06779)和日本UOEH的MY青年科学家研究资助(UOEH)资助。
作者信息
作者及隶属关系
贡献
研究的概念与设计:MY、TM、MM、MK、YU。数据采集:KS, MY, NI, KB, HN, KN, YN。数据分析和解释:KS, MY。文章起草:KS, MY。批判性地修改文章的重要知识内容:KS, MY, BC-C, SL.和YU。提交版本的最终批准:MY和YU。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
所有实验均严格按照日本生理学会发布的实验动物使用和护理伦理准则进行,并得到UOEH动物护理和实验伦理委员会的批准(批准号:AE16-012)。
发表同意书
不适用。
相互竞争的利益
所有作者都声明他们没有相互竞争的经济利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
皮下注射氯氮平(CNO, 1 mg/kg)不改变成年雄性野生型(WT)大鼠的食物和水摄入量,也不改变昼夜节律活动和核心体温(CBT)。成年雄性WT大鼠(300-350 g)于黑暗期开始前30 min皮下注射生理盐水(1ml /kg, n=8)或CNO (1mg /kg, n=8)。服用CNO后,食物和水的摄入量没有改变。野生型大鼠的昼夜节律活动和CBT (n=5)均未被CNO干扰,表明CNO不影响这些行为。数据以均数±标准差表示。
附加文件2:图S2。
SON和PVN中的avp免疫反应神经元(-ir)和nesfatin-1/nNucB2-ir神经元将其树突发送到大脑的各个区域。对AVP和nesfatin-1/NucB2进行荧光免疫组化(FIHC),以揭示SON/PVN与其他脑区之间的神经元连通性。树突证实在下丘脑切片(A)。在LHA (B)、ARC (C)、CeA (D)、LC (E)和NTS (F)中观察到AVP-ir和/或AVP/nesfatin-1/NucB2-ir树突,其中在AVP化学活化后观察到nesfatin-1/NucB2-ir神经元中Fos的诱导。部分树突仅对AVP有免疫反应。比例尺为200 μm。红色、绿色和黄色箭头分别表示对AVP、nesfatin-1/NucB2有免疫反应的树突(绿色)和两者都有反应的树突(黄色)。缩写:视上核,SON;室旁核;下丘脑外侧区;杏仁核中央核(CeA); locus coeruleus, LC; nucleus tractus solitarius, NTS.
附加文件3:表S1。
结果的原始数据。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
真田,K,吉村,M,池田,N。et al。内源性精氨酸加压素的化学活化通过中枢nesfatin-1/NucB2通路产生厌食作用。物理科学71, 18(2021)。https://doi.org/10.1186/s12576-021-00802-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12576-021-00802-4
关键字
- Nesfatin-1 / NucB2
- 精氨酸加压素
- 下丘脑
- 喂养
- 转基因鼠
- DREADDs