- 原始论文gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
II类磷脂酰肌醇3-激酶α和β亚型是小鼠血管平滑肌Rho激活、收缩和血压调节所必需的gydF4y2Ba
生理科学杂志gydF4y2Ba体积gydF4y2Ba70gydF4y2Ba、物品编号:gydF4y2Ba18gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
II类磷脂酰肌醇3-激酶(PI3K), PI3K- c2 α和PI3K- c2 β,参与细胞过程,包括内吞作用、纤毛形成和自噬。然而,PI3K-C2α和PI3K-C2β在机体水平上的作用尚不清楚。我们发现,具有PI3K-C2α和PI3K-C2β平滑肌特异性KO的双敲除(KO)小鼠,而没有PI3K-C2α或PI3K-C2β单一KO小鼠,表现出动脉血压降低和分离主动脉环收缩反应的显著衰减。在野生型血管平滑肌细胞中,双敲低PI3K- c2α和PI3K- c2β而非单敲低PI3K均能显著抑制收缩,减少20 kda肌球蛋白轻链磷酸化、MYPT1和Rho活化,但不抑制细胞内CagydF4y2Ba2 +gydF4y2Ba动员。这些数据表明,PI3K-C2α和PI3K-C2β主要通过参与Rho激活在血管平滑肌收缩和血压调节中发挥冗余但必不可少的作用。gydF4y2Ba
介绍gydF4y2Ba
磷脂酰肌醇3-激酶(PI3K)是一种脂质激酶,可催化磷脂肌醇环D3位置的磷酸化,从而控制多种细胞过程,包括囊泡运输、细胞迁移、细胞增殖和细胞代谢[gydF4y2Ba1gydF4y2Ba]。哺乳动物共有8种PI3K亚型,根据其结构同源性、底物特异性和调控方式可分为三类(I类、II类和III类)[gydF4y2Ba2gydF4y2Ba]。I类PI3K在多种受体酪氨酸激酶和G蛋白偶联受体下游被激活,主要产生磷脂酰肌醇-3,4,5-三磷酸,介导细胞增殖、存活和迁移。通过这些作用,I类PI3K参与了癌症和过敏性疾病。第三类的独特成员Vps34负责自噬体和核内体中相当一部分磷脂酰肌醇-3-单磷酸,其中它控制吞噬体的形成以及核内体的对接和融合。II类PI3K包括PI3K-C2α (C2α)、PI3K-C2β (C2β)和PI3K- c2γ三个亚型,主要产生磷脂酰肌醇-3,4-二磷酸(PI(3,4)P)gydF4y2Ba2gydF4y2Ba),并参与细胞水平的内吞作用、自噬和纤毛形成[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]。C2α和C2β在各种器官和组织中普遍表达,而PI3K-C2γ的表达主要局限于肝脏、乳腺、睾丸和前列腺[gydF4y2Ba9gydF4y2Ba]。C2β在氨基酸序列上与C2α高度同源,并表现出与C2α相似的细胞迁移和生长活性。然而,与I类和III类PI3K相比,II类PI3K的生理功能仍然知之甚少。gydF4y2Ba
我们之前的研究表明,C2α对PI3K抑制剂wortmannin和LY294002明显不太敏感[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba],是膜去极化和受体激动剂诱导的离体血管条和血管平滑肌细胞收缩所必需的[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。此外,我们的研究表明,C2α参与了肌球蛋白轻链磷酸酶(MLCP)的Rho激活和Rho激酶依赖的肌球蛋白靶向亚基MYPT1的磷酸化,从而增加了20 kDa调节的肌球蛋白轻链(MLC)的磷酸化gydF4y2Ba20.gydF4y2Ba).我们进一步证明,在自发性高血压大鼠血管平滑肌中,C2α激活增强导致Rho活性增加、血管张力升高和高血压[gydF4y2Ba15gydF4y2Ba]。这些结果表明,C2α是血管平滑肌Rho活化和收缩的重要调控分子。gydF4y2Ba
为了更好地了解C2α在机体水平上的作用,我们产生了C2α-敲除(KO)小鼠,并分析了它们的表型。由于血管生成的严重缺陷,全球c2 α-纯合子KO小鼠是胚胎致死的[gydF4y2Ba3.gydF4y2Ba]。内皮特异性的C2α基因缺失再现了这种表型。与C2α相比,全球c2β纯合子KO小鼠明显正常[gydF4y2Ba16gydF4y2Ba]。因此,我们生成了具有或不具有全局C2β KO的平滑肌特异性C2α-缺失小鼠,以研究C2α和C2β在血管平滑肌收缩中的作用。我们的数据显示,C2α或C2β的单一KO对血管平滑肌收缩和血压没有影响,但与对照小鼠相比,C2α和C2β的双重KO导致血管平滑肌收缩明显减弱,Rho激活受损,血压下降。这些结果表明,C2α和C2β在小鼠血管平滑肌收缩和血压调节中具有重要的代偿作用。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
小鼠被安置在金泽大学动物设施的温度控制(24°C)的设施室中,在12小时/12小时的明暗循环中,在特定的无病原体条件下自由获得常规食物和水。所有小鼠实验均按照日本文部科学省管辖的“学术研究机构中正确进行动物实验及相关活动的基本准则”进行,并经金泽大学动物实验委员会批准。PI3K-C2α-floxed (C2αgydF4y2Ba液氧/液氧gydF4y2Ba)小鼠,PI3K-C2β-null (C2βgydF4y2Ba−/−gydF4y2Ba)小鼠和Rosa26-CAG-loxP-stop-loxP-tdTomato (R26-tdTomato)报告基因小鼠gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba17gydF4y2Ba]。生成平滑肌特异性条件C2α- ko小鼠,C2αgydF4y2Ba液氧/液氧gydF4y2Ba小鼠与SM22α-Cre转基因小鼠杂交(# 004746,Jackson实验室)。评价cre介导的重组效率,SM22α-Cre;生成R26-tdTomato小鼠。小鼠根据可接受的安乐死指南,通过腹腔注射过量的三种联合麻醉剂,美托咪定(ZENOAQ,福岛,日本),咪达唑仑(安斯泰来,东京,日本)和布托啡诺(明治精机制药,东京,日本)。通过对小鼠尾部活组织制备的基因组DNA进行PCR分析,对小鼠进行基因分型。gydF4y2Ba
主动脉切片免疫荧光染色gydF4y2Ba
将灌注固定的主动脉包埋于Tissue-Tek OCT复合物(Sakura Finetek, Tokyo, Japan)中,用含有0.1% Triton X-100、0.1% Tween 20、1%牛血清白蛋白和5%非免疫山羊血清的磷酸盐缓冲盐水在室温下阻断制备的切片1小时。主动脉冷冻切片采用以下一抗进行免疫荧光染色:小鼠单克隆抗α sma (#A5228, Sigma-Aldrich, St. Louis, MO, USA),小鼠单克隆抗sm22 α (#ab10135;Abcam, Cambridge, UK),兔多克隆抗平滑肌肌球蛋白重链11 (#ab53219;Abcam),兔多克隆抗c2α (#AP11855B, Abgent, San Diego, CA, USA),兔多克隆抗c2β (#sc-134766, Santa Cruz Biotechnology, Dallas, TX, USA)。切片用合适的Alexa-Fluor偶联二抗(Molecular Probes)处理,然后用4′,6-二氨基-2-苯基吲哚(DAPI)进行核染色。gydF4y2Ba
测量血压gydF4y2Ba
使用10至12周龄的雄性小鼠。在几次试验中,通过反复测量血压来训练小鼠,直到基础条件稳定下来,并监测到一致和稳定的读数。使用尾袖系统(Softron, Tokyo, Japan)记录有意识小鼠的收缩压、舒张压和平均血压与心率,如先前报道[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。gydF4y2Ba
测量主动脉环的等距张力gydF4y2Ba
从10 ~ 12周龄的对照小鼠和DKO小鼠中分离主动脉,清洗去粘连结缔组织,并按先前描述的方法在冷冻改良的Krebs-Henseleit缓冲液中切成3 ~ 4 mm宽的环[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。主动脉环置于收缩室中,温度37°C,通气95% OgydF4y2Ba2gydF4y2Ba和5% COgydF4y2Ba2gydF4y2Ba,用传感器(#UFERUM-203,岸本医疗器械,日本京都)测定等距张力,如前所述[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。以不同剂量的KCl和去甲肾上腺素(NA)(开曼化学)累积刺激主动脉环。当有指示时,用Rho激酶抑制剂Y-27632(10µM) (FUJIFILM Wako Pure Chemical, Osaka, Japan)预处理主动脉环。张力测量后,将主动脉环在4%福尔马林中固定,4°C过夜,石蜡包埋,然后横切和Azan染色,测定内侧平滑肌面积。通过在每个主动脉环上横断的内侧平滑肌区域来纠正张力。gydF4y2Ba
质粒gydF4y2Ba
增强型绿色荧光蛋白(GFP)标记的人PI3K-C2α (GFP- c2α)表达载体先前已被描述[gydF4y2Ba3.gydF4y2Ba]。人PI3K-C2β cDNA来源于K. Kitatani (Setsunan University) [gydF4y2Ba19gydF4y2Ba]。为了生成mcherry标记的PI3K-C2α (mCherry-C2α)和GFP-和mcherry标记的PI3K-C2β (GFP- c2β和mCherry-C2β),使用Prime STAR HS DNA聚合酶(Takara, Shiga, Japan)通过PCR扩增人PI3K-C2α和PI3K-C2β cDNA片段,并使用In-Fusion HD克隆试剂盒(Clontech, Mountain View, CA, USA)将其亚克隆到pmCherry-C1 (Takara)和pAcGFP1-N载体(Clontech, Mountain View, CA, USA)。RhoA-FRET传感器质粒载体pTriEx-RhoA-wt_mScarlet-i_SGFP2 (#85071, Addgene)和BFP-Rab5 (#49147;Addgene)分别从Dorus Gadella和Gia Voeltz中获得。gydF4y2Ba
主动脉平滑肌细胞gydF4y2Ba
采用酶分离法从4周龄小鼠主动脉中分离出小鼠主动脉平滑肌细胞。简单地说,在无菌条件下解剖主动脉,在37°C下,0.1%胶原酶(II型)(#LS004202, Worthington Biochemical, Lakewood, NJ, USA), 0.75单位/mL的elastase (III型)(#LS002279, Worthington Biochemical)和0.1%胰蛋白酶抑制剂(#LS003570, Worthington Biochemical)中孵生30分钟,然后在分离主动脉外膜后进一步孵生60分钟。通过Cell filters (100 μm) (#352360, BD Falcon)过滤,从未消化的组织中分离出分散的单细胞,500℃离心收集gydF4y2BaggydF4y2Ba将获得的细胞涂于层粘连蛋白(20 μg/mL in PBS) (FUJIFILM Wako Pure Chemical Corp., Cat no.;120-05751)镀膜玻璃底皿(MatTek,布拉迪斯拉发,斯洛伐克),生长培养基SmGM-2,其中含有5%胎牛血清(FBS)和生长因子补充剂(#CC-3182, Lonza, Walkersville MD, USA)。从Lonza (#CC-2571, Lonza)购买的人主动脉平滑肌细胞(HASM)也用SmGM-2镀在层粘胶蛋白涂层的盘子和载玻片上。细胞培养3 ~ 4天后,在Opti-MEM (Invitrogen/Thermo Fisher Scientific)中转染siRNA和Lipofectamine RNAiMAX (Invitrogen/Thermo Fisher Scientific), siRNA孵育细胞4 ~ 6 h, SmGM2中培养48 h。转染单个siRNA时siRNA浓度为50 nM(单转染),转染两个siRNA时siRNA浓度为25 nM(双转染)。我们的初步研究证实,单次转染25 nM和50 nM的sirna以及双次转染25 nM的sirna对我们感兴趣的蛋白质表达的抑制程度相似。siRNA的靶向序列为:人PI3K-C2α的5′-AAG GUU GGC ACU UAC AAG AAU-3′和人PI3K-C2β的5′-AAG CCG GAA GCU UCU GGG UUU-3′。对照siRNA序列为5′-AAU UCU CCG AACGUG UCA CGU-3′。我们使用Lipofectamine (Invitrogen/Thermo Fisher Scientific)在Opti-MEM中转染GFP-和mccherry标记的PI3K表达载体,然后在生长培养基中培养3-4天。细胞在添加0.1%无脂肪酸BSA (Sigma-Aldrich)的DMEM中缺乏血清和生长因子1至4小时,进行收缩实验,Western blot分析MLC的磷酸化gydF4y2Ba20.gydF4y2BaMYPT1和Rho成像分析。gydF4y2Ba
收缩和胞内游离钙的测定gydF4y2Ba2 +gydF4y2Ba浓度([CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba)血管平滑肌细胞gydF4y2Ba
细胞中装载了荧光CagydF4y2Ba2 +gydF4y2Ba指示剂fluo-8乙酰氧基甲基lester (AM) (2.5 μM)(分子探针)在Hank’s Balanced Salt Solution (HBSS)中37°C黑暗条件下30分钟,然后用无血清、无酚红的FluoroBrite DMEM (Gibco, Thermo Fisher Scientific)饥饿1小时。将细胞用FluoroBrite DMEM洗涤两次后,使用共聚焦显微镜(倒置IX70显微镜)在37℃下用FluoroBrite DMEM对细胞成像;奥林巴斯公司,东京,日本)配备了一个共聚焦磁盘扫描单元(CSU10,横河,东京,日本),如前所述[gydF4y2Ba13gydF4y2Ba]。采集和过程由iQ软件(Andor, Belfast, UK)控制。为了评估细胞收缩,测量了刺激诱导的平面细胞表面积的减少,通过Fluo-8荧光清晰地显示,并表示为刺激诱导的变化(∆gydF4y2Ba一个gydF4y2Ba的平面细胞面积比刺激前的平面细胞面积(gydF4y2Ba一个gydF4y2Ba0gydF4y2Ba) [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。刺激引起的[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba用荧光CagydF4y2Ba2 +gydF4y2Ba如前所述的Fluo-8指示器[gydF4y2Ba13gydF4y2Ba]。在488 nm光激发和510 nm光发射下,每10 s监测一次Fluo-8荧光的变化。计算离子霉素激发的荧光强度与基础强度之比。gydF4y2Ba
Rho活化的荧光共振能量转移(FRET)成像gydF4y2Ba
为了进行FRET成像分析,用RhoA-FRET传感器探针转染HASM [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba17gydF4y2Ba使用Amaxa核因子系统(龙沙),并将其镀在层粘胶涂层的玻璃底培养皿上。对于RhoA-FRET信号的测量,在基于倒置尼康Eclipse Ti2显微镜(Nikon Instrument, Tokyo Japan)的蜻蜓共聚焦系统(Andor)上进行了比率成像,该系统配备了Andor旋转盘单元和EMCCD相机(iXon DU888)。用离子霉素(IMC)(0.3µM)或内皮素-1 (ET-1)(1µM)刺激细胞,观察2分钟后作为基线信号。使用Andor iQ软件从GFP和FRET通道的图像生成伪色比图像。定量添加激动剂后3分钟每个细胞10个亚细胞区域的RhoA-FRET信号强度。表达离子霉素和内皮素刺激的荧光强度/基底强度之比。在一些实验中,评估了RhoA-FRET信号和蓝色荧光蛋白- rab5信号的共定位。gydF4y2Ba
细胞免疫荧光染色gydF4y2Ba
HASM在SmGM2中培养,温度37℃,CO含量5%gydF4y2Ba2gydF4y2Ba.采用传代数为5 ~ 6的细胞进行实验。用Dulbecco的磷酸盐缓冲盐水(PBS)冲洗细胞一次,在室温下用4%多聚甲醛在0.1 M磷酸盐缓冲液(pH 7.4)中固定10分钟,然后用0.3% TritonX-100在PBS中渗透15分钟或用90%冷冻甲醇渗透5分钟。在5%正常山羊血清(FUJIFILM Wako Pure Chemical co .)和0.3% TritonX-100在PBS中阻断后,用兔多克隆抗笼蛋白重链(1:400)(#ab21679,在4°C下过夜。洗涤后,细胞与合适的alexa - fluor -偶联二抗(Molecular Probes)在室温下孵育1小时。gydF4y2Ba
免疫印迹分析gydF4y2Ba
siRNA转染后48-72 h,用PBS快速洗涤细胞,刮入2x Laemmli的SDS样品缓冲液或RIPA裂解冰缓冲液中。测定MLC含量gydF4y2Ba20.gydF4y2BaMYPT1磷酸化后,快速冲洗细胞,加入含有10%三氯乙酸、150 mM NaCl、2 mM DTT和4 mM EGTA的冷冻停止缓冲液,然后刮入2× Laemmli的SDS样品缓冲液中。通过加入浓缩的Tris溶液来中和细胞裂解液的pH值。然后将细胞裂解液煮沸5分钟,并在15,000 rpm下离心5分钟。得到的上清液在8 - 15% SDS-PAGE上分离,然后使用Trans-Blot Turbo印迹系统(Bio-Rad, Hercules, CA, USA)电转移到聚偏二氟乙烯膜上(Immobilon-P, Millipore-Merck, Nottingham, UK)。阻断后,将膜与一抗在4°C下孵育过夜。所用抗体为:兔单克隆抗pi3k - c2α (1:1000) (#12402;CST),小鼠单克隆抗pi3k - c2 β (1:500) (#611342, BD Biosciences, San Diego, CA USA),兔多克隆抗mhc11 (1:1000) (#ab53219;Abcam),单克隆抗20kda肌球蛋白轻链(MLC)gydF4y2Ba20.gydF4y2Ba) (1:1000) (#M4401, Sigma-Aldrich),兔抗磷酸多克隆mlcgydF4y2Ba20.gydF4y2Ba(SergydF4y2Ba19gydF4y2Ba) (1:500) (#3671, CST),兔多克隆抗磷酸化mlcgydF4y2Ba20.gydF4y2Ba(用力推gydF4y2Ba18gydF4y2Ba/爵士gydF4y2Ba19gydF4y2Ba) (1:50 00) (#3674, CST),小鼠单克隆抗肌球蛋白轻链激酶(MLCK) (1:1000) (#M7905, Sigma-Aldrich),小鼠单克隆抗MYPT1(1:1000) (#612165, BD Biosciences),兔多克隆抗磷酸化MYPT1(ThrgydF4y2Ba853gydF4y2Ba) (1:1000) (#4563, CST),小鼠单克隆抗平滑肌特异性α-肌动蛋白(αSMA) (1:1000) (#A5228, Sigma-Aldrich),小鼠单克隆抗甘油醛3-磷酸脱氢酶(GAPDH) (1:1000) (#016-25523, FUJIFILM-Wako Pure Chemical),小鼠单克隆抗β-肌动蛋白(1:1000)(#010-27841,FUJIFILM-Wako Pure Chemical)。然后将膜与碱性磷酸酶偶联的二抗、抗兔免疫球蛋白(Ig) G抗体(1:1000)(#7054,CST)和抗小鼠IgG抗体(1:1000)(#7056,CST)孵育1小时,用硝基蓝四唑/5-溴-4-氯-3′-吲哚磷酸对甲苯胺(FUJIFILM Wako Pure Chemical)体系显色反应显示蛋白条带。使用Image Studio lite软件(LI-COR Biosciences, Lincoln, NB, USA)测定蛋白带强度,将内控GAPDH或β-actin的量归一化,并以对照细胞中值的百分比表示。gydF4y2Ba
统计分析gydF4y2Ba
采用Graphpad Prism软件8版进行统计分析。数据以均数±均数标准误差(SEM)表示。两组间的分析采用双尾未配对Student’s进行gydF4y2BatgydF4y2Ba以及。对于多组间的比较,除非另有说明,否则采用单因素或双因素方差分析和Bonferroni事后检验。gydF4y2BapgydF4y2Ba值< 0.05认为有统计学意义。gydF4y2Ba
结果gydF4y2Ba
C2α-和c2β -双敲除小鼠血压降低gydF4y2Ba
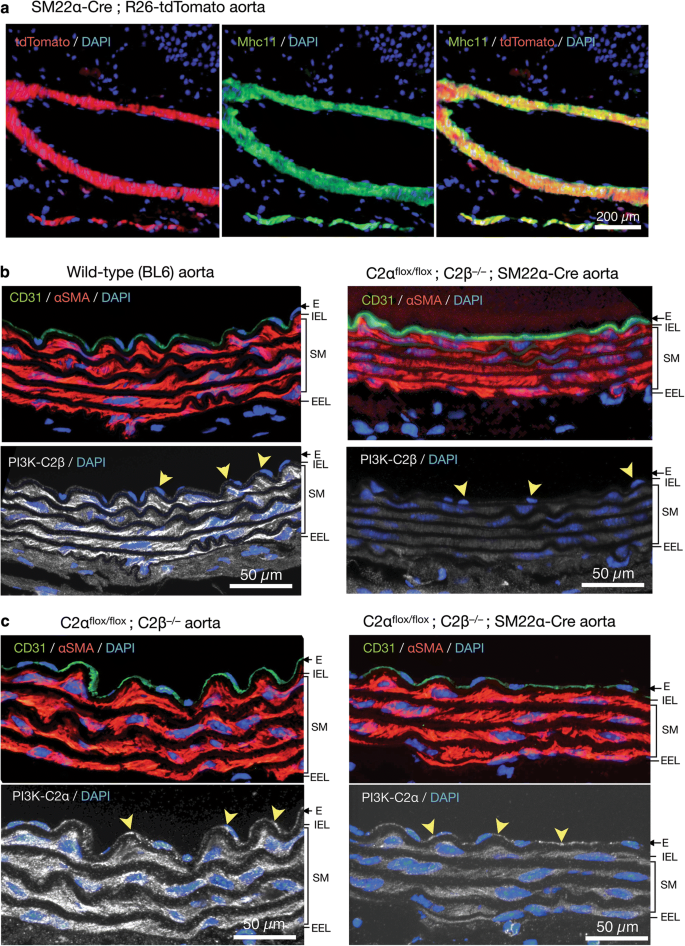
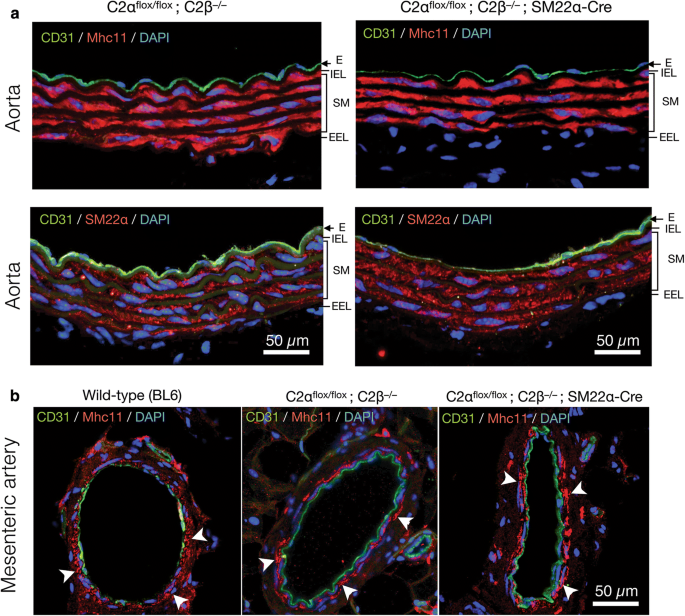
为了研究C2α和C2β基因缺失对血压和血管平滑肌收缩的影响,我们采用平滑肌特异性C2α敲除(C2α ko)小鼠,全局C2β敲除(C2β)小鼠gydF4y2Ba−/−gydF4y2Ba(C2βKO))小鼠,以及具有平滑肌特异性C2αKO和全局C2βKO的双敲除(DKO)小鼠,我们之前描述过[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。通过C2α交配产生平滑肌特异性C2α ko小鼠gydF4y2Ba液氧/液氧gydF4y2Ba和SM22α-Cre转基因小鼠。我们证实,SM22α启动子驱动的Cre表达有效地删除了R26-tdTomato报告基因构建中的floxed序列,导致tdTomato蛋白在主动脉平滑肌层中表达,该层也表达平滑肌特异性肌球蛋白重链亚型Mhc11,但在主动脉平滑肌层中不表达(图22)。gydF4y2Ba1gydF4y2Baa).主动脉切片免疫染色显示,C2β在野生型小鼠的平滑肌层中大量表达,在内皮层中少量表达,而在C2β ko小鼠中没有表达(图2)。gydF4y2Ba1gydF4y2Bab).对照C2α-floxed (C2αgydF4y2Ba液氧/液氧gydF4y2Ba)和C2βKO小鼠,C2α在主动脉内皮和平滑肌层均有表达,而在平滑肌特异性的C2α ko小鼠中,C2α在平滑肌层缺乏表达,而在内皮中不表达(图2)。gydF4y2Ba1gydF4y2Bac).我们使用平滑肌特异性蛋白Mhc11和SM22α以及内皮标志物CD31的免疫染色对DKO和对照小鼠的主动脉和肠系膜动脉进行了形态学研究(图31)。gydF4y2Ba2gydF4y2Baa, b). DKO小鼠和对照组小鼠的内侧平滑肌和内皮层相似,表明DKO小鼠的血管结构未受到损害。gydF4y2Ba
敲除小鼠主动脉平滑肌层C2α和C2β的缺失。gydF4y2Ba一个gydF4y2BaSM22α-Cre大鼠主动脉内侧平滑肌层tdTomato表达及肌球蛋白重链11 (Mhc11)的免疫荧光染色;R26-tdTomato报告小鼠。mhc11阳性细胞表达tdTomato蛋白。gydF4y2BabgydF4y2Ba内侧平滑肌层C2β和主动脉内皮C2α的缺失gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22αcre鼠标。采用抗c2 β、抗cd31和抗α sma抗体对主动脉壁切片进行免疫染色。在C2α中,内侧平滑肌层(SM)和内皮细胞(E)完全缺乏C2β的表达gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22α-Cre小鼠(右下),与野生型(BL6)小鼠(左下)不同。gydF4y2BaIELgydF4y2Ba内弹性层;gydF4y2Ba鳗鱼gydF4y2Ba外部弹性层。gydF4y2BacgydF4y2BaSM组织中C2α表达明显降低,主动脉E组织中C2α表达不明显gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22αcre鼠标。采用抗c2α、抗cd31和抗α sma抗体对主动脉壁切片进行免疫染色。在gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba,黄色箭头表示C2α中C2β的内皮缺失gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba而C2α在小鼠中不存在gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22α-Cre小鼠。在gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba细胞核用DAPI染色gydF4y2Ba
对照组和敲除小鼠主动脉和肠系膜动脉中平滑肌特异性蛋白的表达。gydF4y2Ba一个gydF4y2Ba对照大鼠主动脉平滑肌特异性蛋白Mhc11和SM22α的免疫荧光染色gydF4y2Ba液氧/液氧gydF4y2Ba;C2βgydF4y2Ba−/−gydF4y2Ba)和DKO (C2α)gydF4y2Ba液氧/液氧gydF4y2Ba;C2βgydF4y2Ba−/−gydF4y2Ba;SM22αcre)老鼠。SM层同样用抗mhc11和抗sm22 α抗体染色。gydF4y2BabgydF4y2Ba野生型(BL6)肠系膜动脉Mhc11的免疫荧光染色(左),C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba(中)和C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22α-Cre小鼠(右)。白色箭头表示Mhc11在SM中的表达相似。在gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba细胞核用DAPI染色gydF4y2Ba
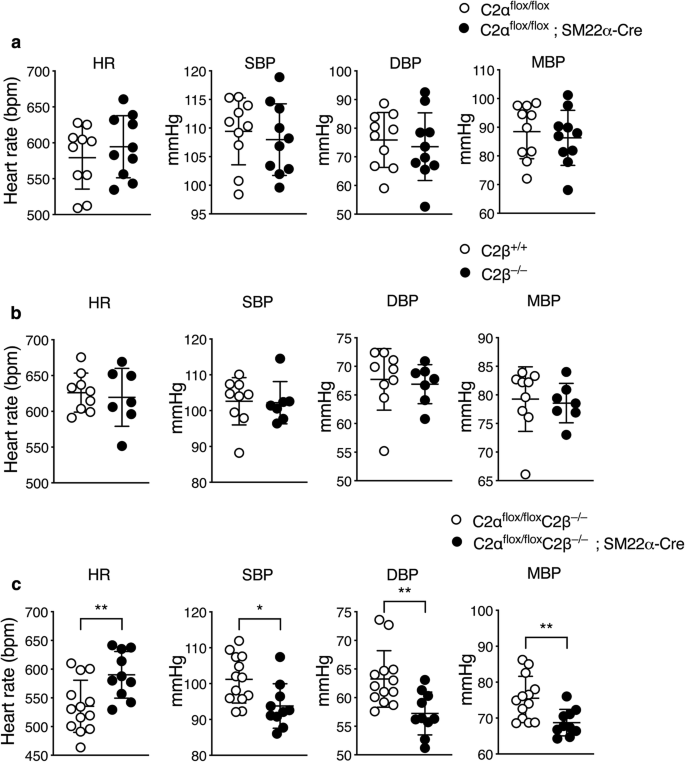
与对照组C2α相比,C2α - ko小鼠和c2β - ko小鼠的收缩压、舒张压和平均血压均无差异gydF4y2Ba液氧/液氧gydF4y2Ba和C2βgydF4y2Ba+/+gydF4y2Ba小鼠,分别为(图2)。gydF4y2Ba3.gydF4y2Baa, b)。相比之下,与对照组相比,DKO小鼠的收缩压、舒张压和平均血压水平较低gydF4y2Ba液氧/液氧gydF4y2Ba老鼠(图。gydF4y2Ba3.gydF4y2Bac)。gydF4y2Ba
DKO小鼠血压降低。心率(HR)、收缩压(SBP)、舒张压(DBP)和平均血压(MBP)gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BangydF4y2Ba= 10)和C2αgydF4y2Ba液氧/液氧gydF4y2Ba;SM22α-Cre小鼠(gydF4y2BangydF4y2Ba= 10) (gydF4y2Ba一个gydF4y2Ba野生型(C2β)gydF4y2Ba+/+gydF4y2Ba) (gydF4y2BangydF4y2Ba= 10)和C2βgydF4y2Ba−/−gydF4y2Ba(gydF4y2BangydF4y2Ba= 9)小鼠(gydF4y2BabgydF4y2Ba)和C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba(gydF4y2BangydF4y2Ba= 13)和C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22αcre (gydF4y2BangydF4y2Ba= 10)老鼠(gydF4y2BacgydF4y2Ba).gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.05,gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.01gydF4y2Ba
DKO小鼠主动脉环和主动脉平滑肌细胞收缩减弱gydF4y2Ba
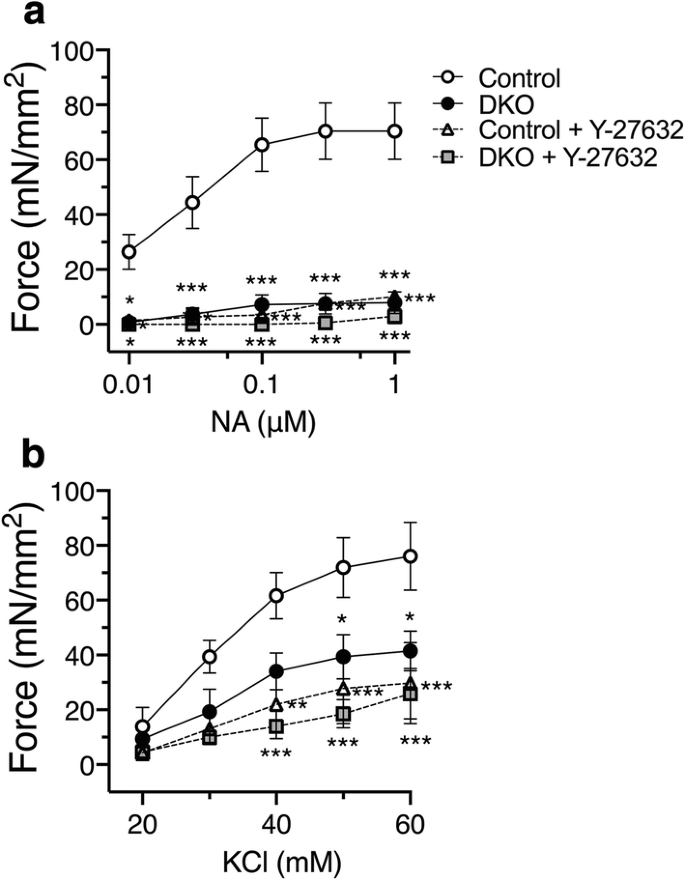
我们测定了NA-和kcl诱导的DKO和对照小鼠主动脉环的收缩反应。与对照组小鼠相比,DKO小鼠主动脉环中na诱导的剂量依赖性收缩明显减少(图2)。gydF4y2Ba4gydF4y2Baa)。与对照小鼠相比,kcl诱导的DKO小鼠收缩也有所减少(图2)。gydF4y2Ba4gydF4y2Bab)。gydF4y2Ba
DKO小鼠主动脉环收缩减弱。gydF4y2Ba一个gydF4y2Ba剂量依赖性去甲肾上腺素(NA)-和KClgydF4y2BabgydF4y2Ba由C2α引起的主动脉环等距收缩gydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2BaRho激酶抑制剂Y-27632(10µM)对小鼠(对照组)和DKO小鼠(gydF4y2BangydF4y2Ba=每组3人)。gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.05,gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.01和gydF4y2Ba★gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba与对照组小鼠环相比< 0.001gydF4y2Ba
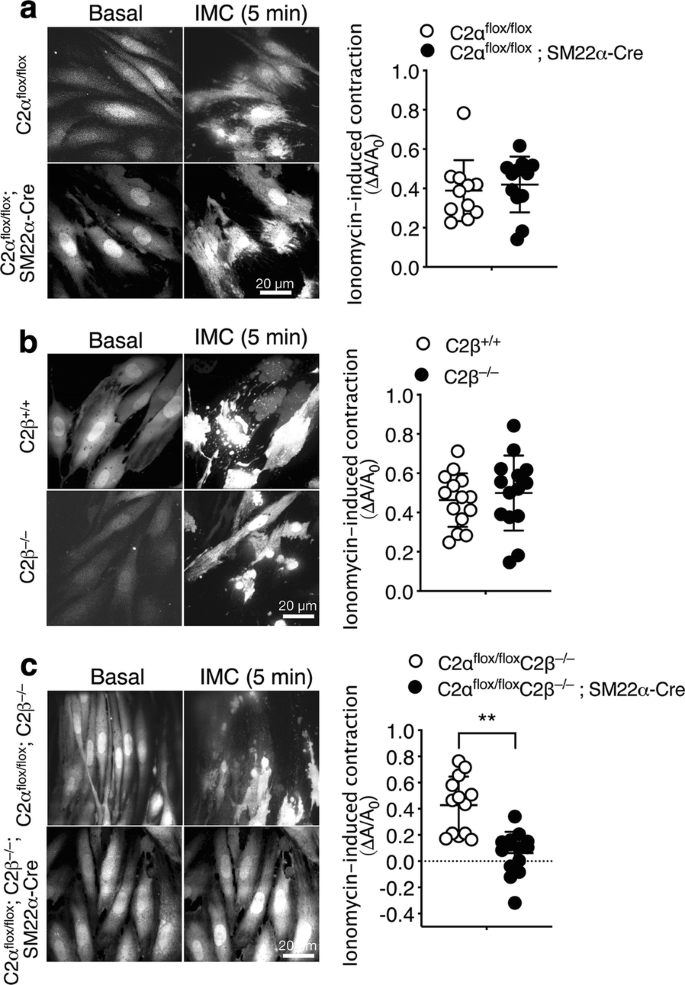
接下来,我们测定了从对照组和KO小鼠主动脉分离的MASM的收缩反应。将细胞装入Fluo-8,在荧光显微镜下观察细胞形状。CagydF4y2Ba2 +gydF4y2Ba离子载体离子霉素(IMC)被用作兴奋剂,因为在细胞培养分离过程中,MASM失去了对kcl膜去极化和受体激动剂(包括NA、5 -羟色胺和一种血栓素类似物)的反应性。碘霉素诱导对照小鼠的MASM明显收缩,细胞荧光荧光增加(图2)。gydF4y2Ba5gydF4y2Ba).为了量化细胞收缩,在每个细胞中确定平面细胞表面积的减少。与各对照组细胞相比,c2 α - ko细胞和c2 β - ko细胞表现出相似的imc诱导的收缩程度(图2)。gydF4y2Ba5gydF4y2Baa, b)。相反,与对照masm相比,DKO细胞的收缩明显减少(图2)。gydF4y2Ba5gydF4y2Bac).这些发现表明,收缩需要C2α或C2β,即C2α和C2β以冗余的方式参与MASM的收缩。gydF4y2Ba
从DKO小鼠分离的MASM的收缩减弱。用0.3µM离子霉素刺激负载fluo -8的MASM。加入离子霉素前后细胞平面表面积的差异(∆gydF4y2Ba一个gydF4y2Ba/gydF4y2Ba一个gydF4y2Ba0gydF4y2Ba),并与C2α进行比较gydF4y2Ba液氧/液氧gydF4y2Ba(gydF4y2BangydF4y2Ba= 11)和C2αgydF4y2Ba液氧/液氧gydF4y2Ba;SM22α-Cre小鼠(gydF4y2BangydF4y2Ba= 12) (gydF4y2Ba一个gydF4y2Ba野生型(C2β)gydF4y2Ba+/+gydF4y2Ba) (gydF4y2BangydF4y2Ba= 14)和C2βgydF4y2Ba−/−gydF4y2Ba(gydF4y2BangydF4y2Ba= 14)小鼠(gydF4y2BabgydF4y2Ba)和C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba(gydF4y2BangydF4y2Ba= 13)和C2αgydF4y2Ba液氧/液氧gydF4y2BaC2βgydF4y2Ba−/−gydF4y2Ba;SM22αcre (gydF4y2BangydF4y2Ba= 14)小鼠(gydF4y2BacgydF4y2Ba).细胞的代表性图像(左)和量化数据(右)显示。gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.01gydF4y2Ba
C2α和C2β均缺失的HASM收缩减弱gydF4y2Ba
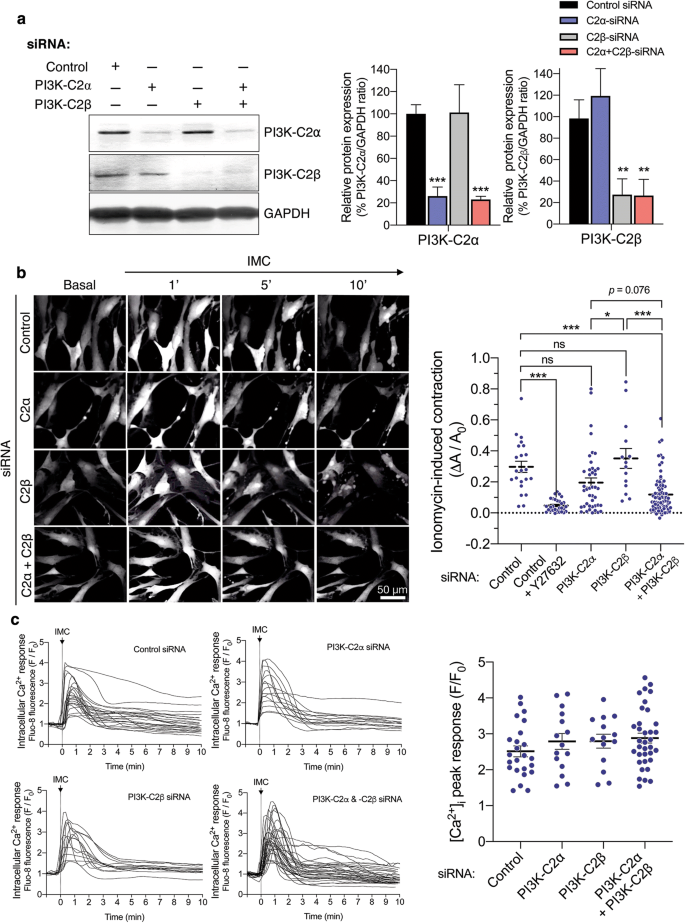
由于酶促分散法分离的细胞产量有限,MASM不适合进一步研究C2α和C2β的作用,因此我们利用了通过转染特异性sirna来去除C2α和C2β的hasm。C2α-和c2β特异性sirna都有效和特异性地减少了各自蛋白的表达75-80%(图2)。gydF4y2Ba6gydF4y2Baa). C2α-和C2β特异性sirna的结合有效抑制了C2α和C2β的表达。对照sirna转染的HASM对IMC反应强烈收缩(图2)。gydF4y2Ba6gydF4y2Bab和附加文件gydF4y2Ba1gydF4y2Ba:视频1)。单独C2α-或c2β -缺失的细胞均显示与对照HASM相似的收缩程度gydF4y2Ba2gydF4y2Ba:视频S2和附加文件gydF4y2Ba3.gydF4y2Ba:视频3)。相比之下,C2α-或c2β -双缺失的HASM与对照和单个C2α-或c2β -缺失的细胞相比,收缩明显减弱gydF4y2Ba4gydF4y2Ba:视频S4)。因此,与小鼠主动脉环和MASM的反应类似,HASM的完全收缩需要C2α或C2β,因此,C2α和C2β的消耗严重损害收缩。gydF4y2Ba
C2α-和c2β -缺失HASM收缩减弱。gydF4y2Ba一个gydF4y2Ba特异性sirna对HASM中C2α和C2β蛋白的敲除。用对照、C2α和C2β- sirna转染HASMs,进行C2α和C2β蛋白表达的Western blot分析。左图为Western blotting。中、右图为C2α和C2β蛋白表达的定量数据。gydF4y2BabgydF4y2BaC2α-和c2β -双衰竭HASM收缩减弱。IMC(0.3µM)诱导的收缩如图所示。gydF4y2Ba5gydF4y2Ba.部分对照sirna转染的HASM用Y-27632(10µM)预处理或未预处理5分钟,并用离子霉素刺激10分钟。如图所示为细胞的代表性图像(左)和定量数据(右)。gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.05和gydF4y2Ba★gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba在指示比较中< 0.001。gydF4y2BacgydF4y2Ba离子霉素诱导的[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba在HASM中转染对照、C2α和c2β - sirna。左图为[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba在离子霉素刺激的细胞中。对,[Ca]峰值响应的量化数据gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba
MLC的弱磷酸化gydF4y2Ba20.gydF4y2Ba和MYPT1在缺乏C2α和C2β的HASMs中gydF4y2Ba
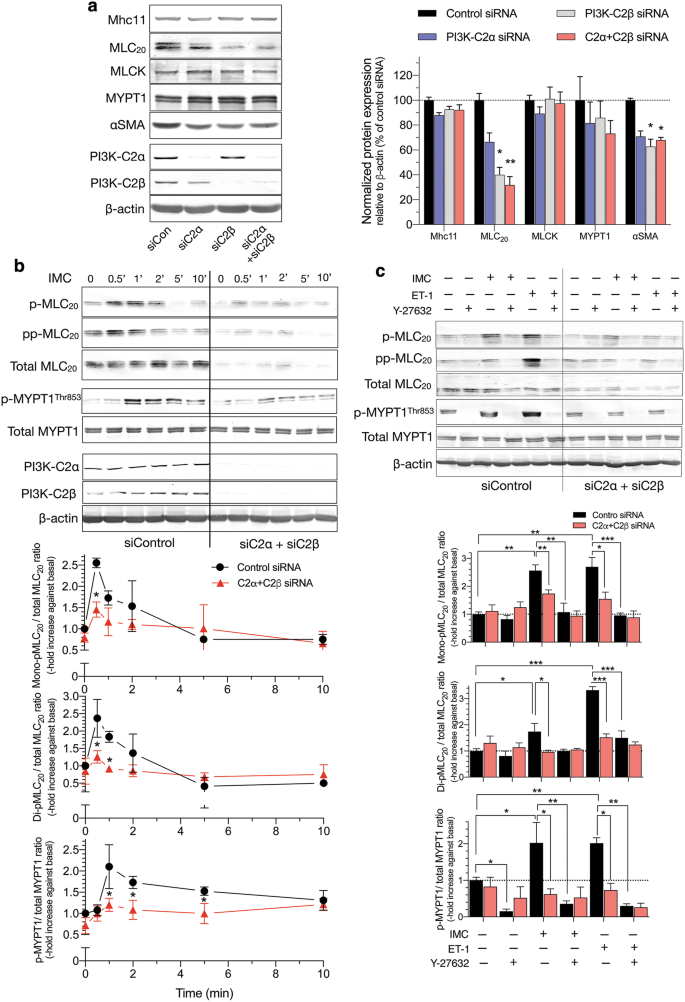
我们探索了C2α-和c2β -缺失HASM收缩减少的细胞内机制。C2α或C2β的单次消耗或C2α和C2β的双次消耗不影响imc诱导的细胞内游离Ca的增加gydF4y2Ba2 +gydF4y2Ba浓度([CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba),用Fluo-8测定CagydF4y2Ba2 +gydF4y2Ba指示器(无花果。gydF4y2Ba6gydF4y2Bac). C2α和C2β的缺失不影响平滑肌特异性肌球蛋白重链异构体Mhc11、MLCK或MYPT1的蛋白表达,但降低了MLC的表达gydF4y2Ba20.gydF4y2BaHASM中α - sma(图2)gydF4y2Ba7gydF4y2Baa). IMC诱导单核细胞(Ser)的时间依赖性增加gydF4y2Ba19gydF4y2Ba)-和di (ThrgydF4y2Ba18gydF4y2Ba,和爵士gydF4y2Ba19gydF4y2Ba)- MLC的磷酸化gydF4y2Ba20.gydF4y2Ba在HASM中(图2)gydF4y2Ba7gydF4y2Bab). C2α和C2β的双敲低显著降低了MLC的单磷酸化和二磷酸化gydF4y2Ba20.gydF4y2Ba当评估为MLC总量的校正值时gydF4y2Ba20.gydF4y2Ba.IMC也增加了MYPT1的磷酸化(图2)。gydF4y2Ba7gydF4y2Bac),表明IMC抑制MLCP活性。此外,Rho激酶抑制剂Y27632不仅能显著抑制imc诱导的收缩(图2)。gydF4y2Ba6gydF4y2Bab),以及MLC的单磷酸化和二磷酸化gydF4y2Ba20.gydF4y2Ba和MYPT1在HASM中的磷酸化(图2)。gydF4y2Ba7gydF4y2Bac),表明Rho激酶参与了imc诱导的MLCP抑制,MLCgydF4y2Ba20.gydF4y2Ba磷酸化和收缩。gydF4y2Ba
MLC的弱磷酸化gydF4y2Ba20.gydF4y2Ba和MYPT1在C2α-和c2β缺失的HASM中。gydF4y2Ba一个gydF4y2BaC2α和C2β敲低对HASM平滑肌特异性蛋白表达的影响。细胞转染对照、C2α和c2β - sirna,并进行Western blot分析。左边是Western blots。中、右图为Mhc11、MLC的量化数据gydF4y2Ba20.gydF4y2Ba, MLCK, MYPT1和αSMA。gydF4y2BabgydF4y2Ba减弱的MLC单磷酸化和二磷酸化gydF4y2Ba20.gydF4y2Ba以及C2α-和c2β -双缺失HASM中MYPT1的磷酸化。分别转染对照sirna、C2α- sirna和c2β - sirna,并用0.3µM离子霉素刺激HASM 10 min。gydF4y2Ba★gydF4y2BapgydF4y2Ba与转染sirna的对照组相比< 0.05。gydF4y2BacgydF4y2BaROCK抑制剂Y-27632对MLC单磷酸化和二磷酸化的影响gydF4y2Ba20.gydF4y2Ba以及C2α-和c2β -双缺失HASM中MYPT1的磷酸化。gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.05,gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba< 0.01和gydF4y2Ba★gydF4y2Ba★gydF4y2Ba★gydF4y2BapgydF4y2Ba在指示比较中< 0.001gydF4y2Ba
HASM中C2α和C2β的亚细胞定位gydF4y2Ba
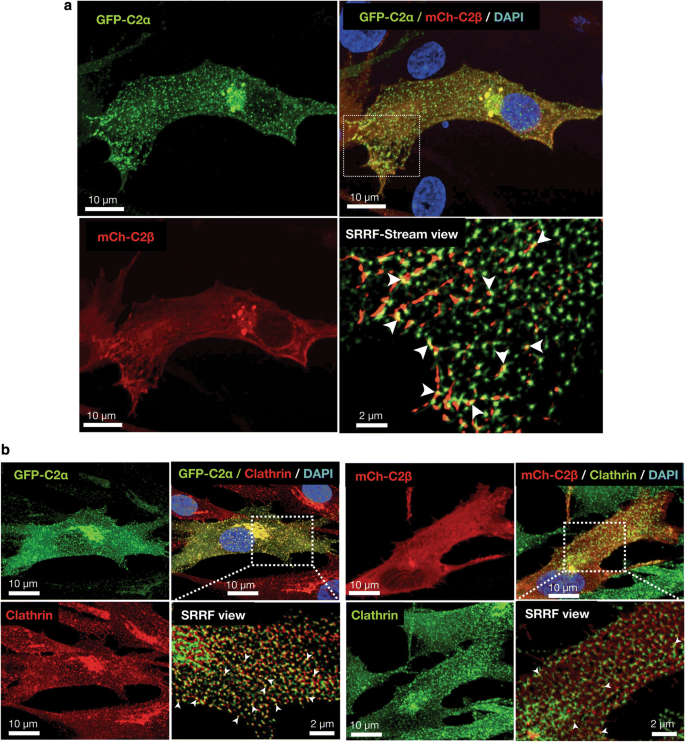
为了更深入地了解C2α和C2β在收缩信号传导中的作用,我们研究了C2α和C2β在hasm中的亚细胞定位。我们用gfp标记的C2α (GFP-C2α)和mcherry标记的C2β (mCherry-C2β)共转染HASMs,并用超分辨率径向波动(SRRF-Stream)模式共聚焦显微镜观察细胞。我们发现GFP-C2α在核周区域局部以细点和粗点的形式弥散分布,并在hasm的质膜处或附近有一些信号(图2)。gydF4y2Ba8gydF4y2BaA,左上和下视图)。mccherry - c2β呈纤维状分布在靠近质膜的外周细胞质区和核周粗点中,并与GFP-C2α共定位(图2)。gydF4y2Ba8gydF4y2BaA,右上方和下方视图)。在核周粗点和外周纤维定位中,mCherry-C2β与GFP-C2α共定位(图2)。gydF4y2Ba8gydF4y2BaA,右上和右下视图)。GFP-C2α和mCherry-C2β的亚细胞分布与人脐静脉内皮细胞相似[gydF4y2Ba5gydF4y2Ba]。我们之前观察到GFP-C2α和网格蛋白在人内皮细胞中的紧密共定位[gydF4y2Ba5gydF4y2Ba]。我们发现GFP-C2α和网格蛋白在HASMs中存在类似的共定位(图2)。gydF4y2Ba8gydF4y2Bab). mCherry-C2β也与网格蛋白共定位,但与GFP-C2α相比频率较低。这一发现也与人类内皮细胞的发现相似。gydF4y2Ba
HASM中C2α和C2β的亚细胞分布。gydF4y2Ba一个gydF4y2BaGFP-C2α和mCherry-C2β亚细胞分布的共聚焦图像。细胞共转染GFP-C2α和mCherry-C2β表达载体。GFP-C2α分布于弥漫性细点和核周粗点。mCh-C2β (mCh-C2β)分布于核周粗点和质膜。mCherry-C2β也呈网状扩散分布,并与GFP-C2α共定位(右下角箭头)。gydF4y2BabgydF4y2BaGFP-C2α和mCherry-C2β与网格蛋白的共定位。用GFP-C2α和mCherry-C2β表达载体共转染细胞,进行抗网格蛋白重链免疫荧光染色。细胞核用DAPI染色。PI3K- C2α和PI3K- c2β与网格蛋白重链共定位的频率较低,但与网格蛋白重链共定位的频率较低gydF4y2Ba
在C2α和C2β缺失的HASM中减弱Rho激活gydF4y2Ba
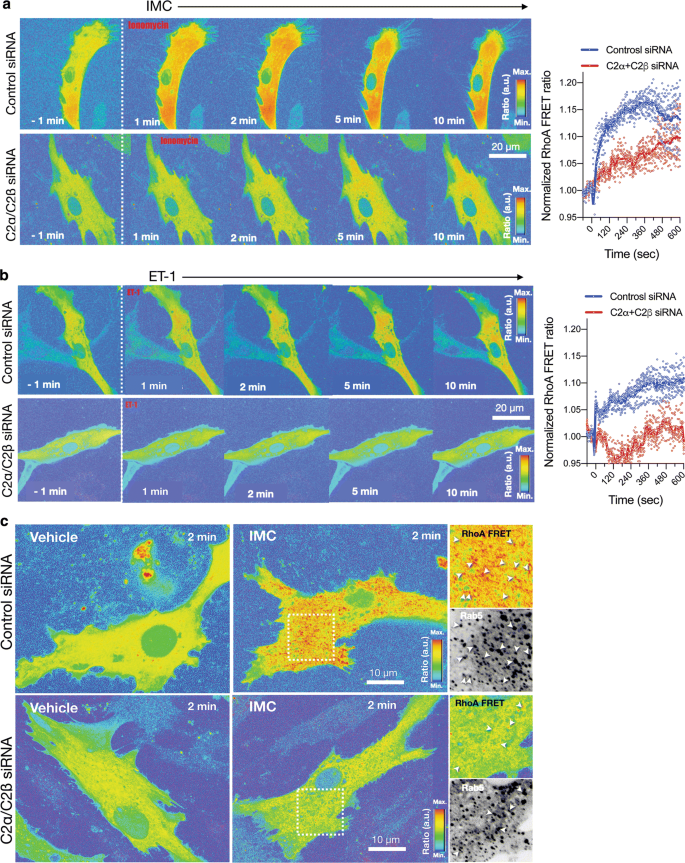
我们使用FRET成像技术确定了imc诱导的hasm中的Rho激活。IMC-和et -1诱导的Rho激活在1分钟内可检测到,主要在对照HASMs的细胞内室,并且它持续至少10分钟的观察时间(图2)。gydF4y2Ba9gydF4y2Baa、b和附加文件gydF4y2Ba5gydF4y2Ba:视频S5和附加文件gydF4y2Ba6gydF4y2Ba:视频6)。相反,在缺乏C2α和C2β的细胞中,IMC-和et -1诱导的Rho激活被明显抑制,在5至10分钟内,细胞内室仅观察到轻微的激活(图2)。gydF4y2Ba9gydF4y2Baa、b和附加文件gydF4y2Ba5gydF4y2Ba:视频S5和附加文件gydF4y2Ba6gydF4y2Ba:视频6)。在对照细胞中,Rho-FRET信号与早期核内体标记物Rab5部分共定位。在缺乏C2α和C2β的细胞中,细胞内rab5阳性和阴性位点的FRET信号都大大减弱(图2)。gydF4y2Ba9gydF4y2Bac).这些观察结果表明,C2α和C2β参与了细胞内室的Rho活化。gydF4y2Ba
C2α-和c2β -缺失HASM中减弱Rho激活的FRET成像。gydF4y2Ba一个gydF4y2BaC2α和C2β敲低对IMC(0.3µM)诱导的Rho激活表达的影响通过FRET成像在对照和C2α-和C2β-双缺失HASM中进行评估。左图为代表性图片。对,随时间变化的Rho-FRET信号的量化数据。gydF4y2BabgydF4y2BaC2α和C2β敲低对ET-1(1µM)诱导的Rho激活的影响,通过FRET成像在对照和C2α-和C2β-双耗尽HASM中进行评估。左图为代表性图片。对,随时间变化的Rho-FRET信号的量化数据。gydF4y2BacgydF4y2BaRhoA-FRET信号与早期核内体标志物Rab5的部分共定位。用BFP-Rab5表达载体转染细胞,测定RhoA-FRET信号与BFP-Rab5的共定位gydF4y2Ba
讨论gydF4y2Ba
在这项研究中,我们证明了II类PI3K的C2α和C2β在血压调节和血管平滑肌收缩中具有重要的冗余作用。具有平滑肌特异性C2α缺失和全局C2β缺失的小鼠并不致命,因此我们可以评估C2α和C2β在血压调节中的作用。C2α和C2β基因的双KO,但其中任何一个基因的单KO都不会导致动脉血压下降,这表明至少有一种C2α和C2β基因的异构体是维持血压所必需的。DKO小鼠血管平滑肌收缩能力减弱,提示血管平滑肌收缩减弱与DKO小鼠低血压有关。此外,Rho活化的衰减和由此产生的Rho激酶依赖性MLCP抑制,但Ca没有gydF4y2Ba2 +gydF4y2Ba可能是DKO小鼠血管收缩减弱和血压降低的原因。这些发现,加上我们最近观察到的C2α和C2β在子宫平滑肌收缩和分娩中必不可少的冗余作用[gydF4y2Ba17gydF4y2Ba],指出C2α和C2β在小鼠平滑肌收缩中激活Rho和Rho激酶途径的重要性。gydF4y2Ba
血管平滑肌张力是血压的主要决定因素,直接受血管平滑肌的收缩舒张状态调节,而血管平滑肌的收缩舒张状态受各种血管收缩舒张剂、交感神经活动、机械应力等因素的控制[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba]。与对照组小鼠相比,DKO小鼠主动脉环对NA和膜去极化的收缩反应明显减弱。平滑肌收缩是由Ca的两条主要信号通路介导的gydF4y2Ba2 +gydF4y2Ba依赖的MLCK激活(CagydF4y2Ba2 +gydF4y2Ba- mlck途径)和Rho-和Rho激酶依赖性MLCP抑制(Rho-MLCP途径)[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。[Ca]的增加gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba激活钙gydF4y2Ba2 +gydF4y2Ba/钙调素依赖性MLCK,导致MLCgydF4y2Ba20.gydF4y2Ba磷酸化,Rho激活其效应物Rho激酶,通过磷酸化MLCP的肌球蛋白靶向亚基MYPT1,从而抑制MLCP。Rho-MLCP通路和CagydF4y2Ba2 +gydF4y2Ba-MLCK通路协调有效地增加MLCgydF4y2Ba20.gydF4y2Ba磷酸化,因此在各种激动剂(包括NA,内皮素-1和血栓素A2)诱导的收缩中起关键作用。我们和其他人之前的研究表明,[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba膜去极化和Ca诱导gydF4y2Ba2 +gydF4y2Ba离子载体也导致平滑肌Rho-MLCP通路的激活[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba]。在C2α-和c2β -双缺陷血管平滑肌细胞中,Rho通路活性明显升高,而Ca通路活性不明显gydF4y2Ba2 +gydF4y2Ba通过Rho激活和MYPT1磷酸化状态的FRET成像来评估,与对照细胞相比,通路减弱。因此,Rho信号的衰减可能导致MLCP活性升高,从而导致MLC减少gydF4y2Ba20.gydF4y2Ba与对照细胞相比,C2α-和c2β缺陷血管平滑肌细胞的磷酸化和收缩。我们观察到MLC的表达降低gydF4y2Ba20.gydF4y2BaC2β单一缺乏或C2α/C2β双重缺乏的HASM中α - sma。目前尚不清楚C2β和C2α/C2β缺乏如何导致平滑肌特异性蛋白的下调,并有待进一步澄清。然而,它不太可能降低MLC的表达gydF4y2Ba20.gydF4y2Ba而α - sma可能参与了收缩的衰减,这是因为尽管MLC的减少,单次C2β的消耗并不能抑制收缩gydF4y2Ba20.gydF4y2BaαSMA的表达。gydF4y2Ba
在本研究中,我们发现CagydF4y2Ba2 +gydF4y2Ba-离子载体-离子霉素和内皮素-1主要在血管平滑肌细胞内诱导剧烈的Rho活化。Rho激活位点的细胞内定位与我们之前在小鼠子宫平滑肌细胞中的观察一致[gydF4y2Ba17gydF4y2Ba]和人血管内皮细胞[gydF4y2Ba3.gydF4y2Ba],以及其他人在其他类型细胞中的报告[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba]。我们的研究表明,至少有一部分Rho活化位点是rab5阳性结构,即早期内体。gydF4y2Ba
本研究清楚地表明,C2α和C2β是血管平滑肌细胞胞内室Rho激活所必需的。C2α和C2β如何参与早期核内体和其他细胞内结构的Rho激活?以往的研究[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba表明C2α优先定位于网格蛋白包被的凹坑和囊泡,在网格蛋白依赖的内吞作用中起着不可或缺的作用。C2α主要产生PI(3,4)PgydF4y2Ba2gydF4y2Ba[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba和招募PI(3,4)PgydF4y2Ba2gydF4y2Ba-结合结构域的蛋白质,包括SNX9,从而促进网格蛋白包被的凹坑的生长和成熟,并将其转化为网格蛋白包被的囊泡。与C2α相比,人们对C2β的功能作用和细胞内定位知之甚少。我们最近证明,C2β定位于外周细胞质区域的局灶丝状肌动蛋白(肌动蛋白斑块)和血管内皮细胞中网格蛋白包被的凹坑和囊泡,并且C2β和C2α对于网格蛋白依赖的液相内吞作用是必需的[gydF4y2Ba5gydF4y2Ba]。本研究表明,血管平滑肌细胞中C2β的细胞内分布与内皮细胞相似。Rho的活化由鸟嘌呤核苷酸交换因子(GEF)介导[gydF4y2Ba38gydF4y2Ba]。因此,GEF可能被募集到受刺激血管平滑肌细胞的早期内体和其他细胞内结构。在et -1刺激的血管平滑肌细胞中,II类PI3K可能是et -1结合受体内吞进入早期内体所必需的,而内吞受体反过来可能通过异源三聚体G蛋白G募集GEFgydF4y2Ba12/13gydF4y2Ba导致激活。当IMC刺激血管平滑肌细胞时,CagydF4y2Ba2 +gydF4y2Ba诱导的Rho活化机制起作用[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba27gydF4y2Ba]。CagydF4y2Ba2 +gydF4y2Ba-诱导的Rho激活可能由特定类型的GEF介导,而特定GEF的募集可能需要GEF分子本身的内吞过程或GEF的调节分子[gydF4y2Ba39gydF4y2Ba]。这些内吞过程可能依赖于PI3K-C2α和PI3K-C2β。需要进一步的研究来确定C2α和C2β在细胞内Rho激活中的确切作用。gydF4y2Ba
我们之前的研究表明,sirna介导的特异性敲除c2 α-可抑制大鼠主动脉血管平滑肌细胞的收缩[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba]。相反,本研究表明,单独敲低C2α不足以完全抑制小鼠和人血管平滑肌细胞的收缩,这可能表明C2β可以补偿小鼠和人血管平滑肌细胞由于C2α缺乏而引起的缺陷;C2β可以弥补PI(3,4)P的不足gydF4y2Ba2gydF4y2Ba在小鼠和人的血管平滑肌细胞中,而不是在大鼠的血管平滑肌细胞中,由于网格蛋白包被的凹坑和囊泡以及其他细胞内部位的C2α缺失而产生。是否C2β的表达水平或C2β亚细胞定位的差异导致了血管平滑肌收缩对C2α-和C2β依赖性的物种差异,目前尚不清楚。血管平滑肌收缩对C2α和C2β依赖的确切分子机制尚不清楚。gydF4y2Ba
因为RhoA-Rho激酶- mlcp通路是血管平滑肌收缩的主要收缩机制之一[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba26gydF4y2Ba], C2α和C2β在Rho-Rho激酶- mlcp通路中的新作用可能为了解高血压和血管痉挛等心血管疾病的病理生理学和新疗法的发展提供一些见解。例如,II类PI3K抑制剂抑制Rho激活,从而刺激血管平滑肌的MLCP,可能是开发新的抗高血压和解痉剂的候选药物。在细胞和分子水平上更好地理解C2α和C2β的作用是揭开人类II类PI3K的病理生理作用所必需的。gydF4y2Ba
结论gydF4y2Ba
本研究提示C2α和C2β在Rho-Rho激酶- mlcp通路调控、血管平滑肌收缩和血压调节中的重要作用。Ca需要C2α和C2βgydF4y2Ba2 +gydF4y2Ba-和受体激动剂在细胞内引起Rho活化。C2α和C2β在血管平滑肌收缩中起着必不可少的作用,但两者相互弥补。血管平滑肌中C2α-和c2β依赖性Rho激活的确切机制有待进一步研究。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本研究结果的数据可应通讯作者的合理要求提供。gydF4y2Ba
缩写gydF4y2Ba
- PI3K:gydF4y2Ba
-
磷酸肌醇3-kinasesgydF4y2Ba
- C2α:gydF4y2Ba
-
磷酸肌醇3-kinase-C2αgydF4y2Ba
- C2β:gydF4y2Ba
-
磷酸肌醇3-kinase-C2βgydF4y2Ba
- (CagydF4y2Ba2gydF4y2Ba+gydF4y2Ba]gydF4y2Ba我gydF4y2Ba:gydF4y2Ba
-
胞内游离钙gydF4y2Ba2gydF4y2Ba+gydF4y2Ba浓度gydF4y2Ba
- Cre:gydF4y2Ba
-
Cre重组酶gydF4y2Ba
- R26-tdTomato:gydF4y2Ba
-
Rosa26-CAG-loxP-stop-loxP-tdTomatogydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-Diamidino-2-phenylindolegydF4y2Ba
- 柯:gydF4y2Ba
-
基因敲除gydF4y2Ba
- DKO:gydF4y2Ba
-
双基因敲除gydF4y2Ba
- 烦恼:gydF4y2Ba
-
荧光共振能量转移gydF4y2Ba
- GEF:gydF4y2Ba
-
鸟嘌呤核苷酸交换因子gydF4y2Ba
- 哈佛商学院:gydF4y2Ba
-
汉克斯平衡盐溶液gydF4y2Ba
- 多层陶瓷gydF4y2Ba20.gydF4y2Ba:gydF4y2Ba
-
20kda肌球蛋白轻链gydF4y2Ba
- MLCK:gydF4y2Ba
-
肌凝蛋白轻链激酶gydF4y2Ba
- MLCP:gydF4y2Ba
-
肌凝蛋白轻链磷酸酶gydF4y2Ba
- IMC:gydF4y2Ba
-
IonomycingydF4y2Ba
- ET-1:gydF4y2Ba
-
Endothelin-1gydF4y2Ba
- 拿拿淋:gydF4y2Ba
-
去甲肾上腺素gydF4y2Ba
- π(3、4)PgydF4y2Ba2gydF4y2Ba:gydF4y2Ba
-
磷脂酰肌醇3 4-bisphosphategydF4y2Ba
- SRRF:gydF4y2Ba
-
超分辨率径向波动gydF4y2Ba
- VEGF:gydF4y2Ba
-
血管内皮生长因子gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- MASM:实现gydF4y2Ba
-
小鼠主动脉平滑肌细胞gydF4y2Ba
- 对比:gydF4y2Ba
-
人主动脉平滑肌细胞gydF4y2Ba
- αSMA:gydF4y2Ba
-
α-平滑肌肌动蛋白gydF4y2Ba
- 英国石油公司:gydF4y2Ba
-
血压gydF4y2Ba
参考文献gydF4y2Ba
Janku F, Yap TA, Meric-Bernstam F(2018)靶向PI3K通路在癌症中的作用:我们取得进展了吗?新约圣经,col . 15:273-291。gydF4y2Bahttps://doi.org/10.1038/nrclinonc.2018.28gydF4y2Ba
陈晓明,陈晓明,陈晓明,等(2019)细胞信号转导与细胞转运的关系。生物学报,20:515-534。gydF4y2Bahttps://doi.org/10.1038/s41580-019-0129-zgydF4y2Ba
Yoshioka K, Yoshida K, Cui H, Wakayama T, Takuwa N, Okamoto Y, Du W, Qi X, Asanuma K, Sugihara K, Aki S, Miyazawa H, Biswas K, Nagakura C,上野M, Iseki S, Schwartz RJ, Okamoto H, Sasaki T, Matsui O, Asano M, Adams RH, Takakura N, Takuwa Y(2012)内皮PI3K- c2α在血管生成和血管屏障功能中的重要作用。Nat Med 18:1560-1569。gydF4y2Bahttps://doi.org/10.1038/nm.2928gydF4y2Ba
王晓明,王晓明,王晓明,等(2019)PI3K在细胞生物学中的应用。《细胞生物学》29:39 - 359。gydF4y2Bahttps://doi.org/10.1016/j.tcb.2019.01.001gydF4y2Ba
李春华,李春华,李春华,李春华(2019)磷酸肌醇3-激酶PI3K-C2α和PI3K-C2β对血管内皮细胞胞浆蛋白依赖性的影响。[J] .中国生物医学工程学报(英文版)。gydF4y2Bahttps://doi.org/10.1007/s12576-018-0644-2gydF4y2Ba
Marat AL, Haucke V(2016)磷脂酰肌醇3-磷酸-在细胞信号传导和膜交通之间的界面。Embo [j] 35:561-579。gydF4y2Bahttps://doi.org/10.15252/embj.201593564gydF4y2Ba
walroth A, Koch PA, Marat AL, Krause E, Haucke V(2019)蛋白激酶N通过mTORC1调控溶酶体脂质开关促进营养信号传导。细胞生物学(21):1093 - 1101。gydF4y2Bahttps://doi.org/10.1038/s41556-019-0377-3gydF4y2Ba
Franco I, Gulluni F, Campa CC, Costa C, Margaria JP, Ciraolo E, Martini M, Monteyne D, De Luca E, germeng, Posor Y, Maffucci T, Marengo S, Haucke V, Falasca M, Perez-Morga D, Boletta A, Merlo GR, Hirsch E (2014) PI3K II类α控制空间限制性内体PtdIns3P和Rab11激活促进初级纤毛功能。Dev Cell 28:647-658gydF4y2Bahttps://doi.org/10.1016/j.devcel.2014.01.022gydF4y2Ba
Falasca M, Maffucci T . (2012) II类磷酸肌肽3-激酶的调控及细胞功能。生物化学学报,43(3):587 - 591。gydF4y2Bahttps://doi.org/10.1042/BJ20120008gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明(1997)人磷酸肌醇3-激酶的克隆与表达。生物化学,326:139-147。gydF4y2Bahttps://doi.org/10.1042/bj3260139gydF4y2Ba
Stein RC, Waterfield MD (2000) pi3激酶抑制:药物开发的靶标?《现代医学》6:37 - 357。gydF4y2Bahttps://doi.org/10.1016/s1357 - 4310 (00) 01770 - 6gydF4y2Ba
王宇,王吉冈,马志山,卓华,卓华,Sakurada S, Kayaba Y, Sugimoto N, Inoki I, Kimura T, Kuwaki T, Takuwa Y (2006) II类磷酸肌苷3-激酶α-异构体对血管平滑肌收缩和肌球蛋白磷酸酶的调控。中国生物医学工程学报(英文版)。gydF4y2Bahttps://doi.org/10.1042/BJ20051471gydF4y2Ba
李春华,李春华,李春华(2007)磷酸肌苷3-激酶α-异构体的研究进展gydF4y2Ba2 +gydF4y2Ba-诱导,Rho和Rho激酶依赖的肌球蛋白磷酸酶调控和离体血管平滑肌细胞收缩。生物医学杂志71:912-920。gydF4y2Bahttps://doi.org/10.1124/mol.106.032599gydF4y2Ba
马岩,吉冈K,大仓S, Takuwa N,杉本N,佐藤K, Takuwa Y (2007) CagydF4y2Ba2 +gydF4y2Ba5′-单磷酸环腺苷对Ca的抑制作用gydF4y2Ba2 +gydF4y2Ba血管平滑肌中磷酸肌苷3-激酶C2α、Rho和肌球蛋白磷酸酶的调控。[J]中国药理学杂志,32(3):917 - 916。gydF4y2Bahttps://doi.org/10.1124/jpet.106.111443gydF4y2Ba
石彦明,马泽赞,冈本耀,佐藤A,吉冈K, Maeda M, Kim I, Takuwa Y(2010)改进CagydF4y2Ba2 +gydF4y2Ba自发性高血压大鼠血管中磷酸肌肽3-激酶II类α异构体- rho轴的依赖性激活。高血压56:934 - 941。gydF4y2Bahttps://doi.org/10.1161/HYPERTENSIONAHA.110.160853gydF4y2Ba
Harada K, Truong AB, Cai T, Khavari PA (2005) II类磷酸肌肽3-激酶c2β在表皮分化中不是必需的。Mol细胞生物学,25:11122-11130。gydF4y2Bahttps://doi.org/10.1128/MCB.25.24.11122-11130.2005gydF4y2Ba
Sarker MAK, Aki S, Yoshioka K, Kuno K, Okamoto Y, Ishimaru K, Takuwa N, Takuwa Y (2019) II类PI3Ks α和β是小鼠rho依赖性子宫平滑肌收缩和分娩所需的。内分泌学160:235 - 248。gydF4y2Bahttps://doi.org/10.1210/en.2018-00756gydF4y2Ba
崔辉,Okamoto Y, Yoshioka K,杜伟,Takuwa N,张伟,Asano M, Shibamoto T, Takuwa Y(2013)鞘氨醇-1-磷酸受体2通过抑制内皮一氧化氮合酶对小鼠过敏性休克的影响。[J]中华过敏症杂志,32(2):344 - 344。gydF4y2Bahttps://doi.org/10.1016/j.jaci.2013.07.026gydF4y2Ba
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。(2016)神经酰胺对卵巢癌细胞运动的影响:神经酰胺对卵巢癌细胞运动的抑制作用。致癌基因35:2801 - 2812。gydF4y2Bahttps://doi.org/10.1038/onc.2015.330gydF4y2Ba
wth A, Wang S, Takefuji M, Tang C, Althoff TF, Schweda F, WettschureckOffermanns WNN (2016) g蛋白信号介导的血管平滑肌张力升高引起的年龄依赖性血压升高。心血管病杂志,109:131-140。gydF4y2Bahttps://doi.org/10.1093/cvr/cvv249gydF4y2Ba
Mendelsohn ME(2005)在高血压中,肾脏并不总是问题的核心。[J]中国临床医学杂志。gydF4y2Bahttps://doi.org/10.1172/JCI24806gydF4y2Ba
Guyenet PG(2006)血压的交感神经控制。神经科学学报7:35 - 346。gydF4y2Bahttps://doi.org/10.1038/nrn1902gydF4y2Ba
李春华,李春华,李春华(2001)血管平滑肌的Rho激活。[J] .中国生物医学工程学报,2011,31(1):571 - 578。gydF4y2Bahttps://doi.org/10.1152/ajpcell.2001.281.2.C571gydF4y2Ba
李建平,李建平,李建平(2004)肌球蛋白磷酸酶的研究进展。Mol细胞生物化学259:197-209。gydF4y2Bahttps://doi.org/10.1023/b:mcbi.0000021373.14288.00gydF4y2Ba
林丕杰,郭志刚,刘志刚,刘志刚(1998)肌球蛋白轻链激酶的功能域和结构基元。物理学报,164(4):471 - 482。gydF4y2Bahttps://doi.org/10.1111/j.1365-201x.1998.tb10699.xgydF4y2Ba
Somlyo AP, Somlyo AV (2003) CagydF4y2Ba2 +gydF4y2Ba平滑肌和非肌肉肌球蛋白II的敏感性:由G蛋白、激酶和肌球蛋白磷酸酶调节。物理Rev 83:1325-1358。gydF4y2Bahttps://doi.org/10.1152/physrev.00023.2003gydF4y2Ba
李建平,李建平,李建平,李建平,李建平(2003)gydF4y2Ba2 +gydF4y2BaRho和Rho激酶在膜去极化诱导和受体刺激诱导的血管平滑肌收缩中的依赖激活。Circ Res 93:548-556。gydF4y2Bahttps://doi.org/10.1161/01.RES.0000090998.08629.60gydF4y2Ba
杨建军,李建军,李建军,李建军,等(2004)KCl对气道平滑肌收缩的影响。[J] .中国医学杂志,2016,31(2):558 - 558。gydF4y2Bahttps://doi.org/10.1152/ajplung.00130.2004gydF4y2Ba
刘建军,刘建军,刘建军(2006)细胞迁移过程中RhoA活性的时空动态。自然440:1069 - 1072。gydF4y2Bahttps://doi.org/10.1038/nature04665gydF4y2Ba
马切克M,霍奇森L, Welch C, Elliott H, Pertz O, Nalbant P, Abell A, Johnson GL, Hahn KM, Danuser G(2009)细胞突出过程中Rho GTPase活性的协调。自然461:99 - 103。gydF4y2Bahttps://doi.org/10.1038/nature08242gydF4y2Ba
Ngok SP, Geyer R, Liu M, Kourtidis A, Agrawal S, Wu C, Seerapu HR, Lewis-Tuffin LJ, Moodie KL, Huveldt D, Baraban JM, Storz P, Horowitz A, Anastasiadis PZ (2012) VEGF和血管生成素-1通过调节Rho GEF Syx对细胞连接的拮抗作用。[J] .中国生物医学工程学报(英文版)。gydF4y2Bahttps://doi.org/10.1083/jcb.201207009gydF4y2Ba
吴C,霍洛维茨A(2011)膜交通作为细胞迁移和连接重塑的协调者。公共集成生物4:703-705。gydF4y2Bahttps://doi.org/10.4161/cib.17140gydF4y2Ba
Gaidarov I, Smith ME, Domin J, Keen JH (2001) II类磷酸肌苷3-激酶C2α在网格蛋白介导的膜转运中的活化作用。Mol Cell 7:43 - 449。gydF4y2Bahttps://doi.org/10.1016/s1097 - 2765 (01) 00191 - 5gydF4y2Ba
杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军。(2013)磷脂酰肌醇-3,4-二磷酸胞内同化的时空调控。自然499:233 - 237。gydF4y2Bahttps://doi.org/10.1038/nature12360gydF4y2Ba
Wallroth A, Haucke V(2018)内吞作用和内溶酶体系统中磷酸肌苷的转化。中国生物医学工程学报(英文版)29(3):1526 - 1535。gydF4y2Bahttps://doi.org/10.1074/jbc.R117.000629gydF4y2Ba
王晓明,王晓明,王晓明,等(2015)磷脂酰肌醇3-激酶ⅱ类α-异构体PI3K-C2α在内皮细胞转化生长因子β诱导的smad信号转导中的作用。[J] .中国生物医学工程学报,2009(5):444 - 444。gydF4y2Bahttps://doi.org/10.1074/jbc.M114.601484gydF4y2Ba
王晓明,王晓明,王晓明,等(2020)tgf - β受体胞内吞噬和Smad信号转导在synaptojanin1-、PI3K-C2α-和inpp4b介导的磷酸肌苷转化中的作用。Mol生物细胞。gydF4y2Bahttps://doi.org/10.1091/mbc.E19-11-0662gydF4y2Ba
Takuwa Y(2003)血管平滑肌兴奋性激动剂对Rho信号通路的调控。医学杂志538:67-75gydF4y2Ba
李春华,李春华,李春华,李春华,王勇,马志刚,杉本(2005)血管平滑肌肌球蛋白磷酸酶和肌球蛋白磷酸酶的钙依赖性调控。启16:13-21gydF4y2Ba
致谢gydF4y2Ba
我们感谢Chiemi Hirose女士的秘书协助,也感谢生理学系成员的支持和协助。gydF4y2Ba
资金gydF4y2Ba
本研究由日本文部科学省(25116711 ~ yt)和日本科学促进会(17K08532 ~ ky, 16K18988 ~ S.A, 16K15409 ~ ki, 17K08542 ~ nt, 15H04673 ~ yt)资助。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
SI, KY, SA和YT设计了这项研究。SI, KY, SA和HY进行了实验。KI帮助实验。SI, KY, SA和YT分析了数据。SI, KY, NT和YT撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
所有小鼠实验均经金泽大学动物实验委员会批准。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:视频S1。gydF4y2Ba
离子霉素诱导[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba对照sirna转染HASM的反应和收缩。对照sirna转染后,荧光CagydF4y2Ba2 +gydF4y2Ba用离子霉素(0.3µM)刺激HASM细胞1 min,观察细胞的收缩反应和[Ca . 8]的变化gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba连续监测反应10分钟(间隔10-s)。gydF4y2Ba
附加文件2:视频S2。gydF4y2Ba
离子霉素诱导[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2BaPI3K-C2α sirna转染HASM的反应和收缩。PI3K-C2α特异性sirna转染后,荧光CagydF4y2Ba2 +gydF4y2Ba用离子霉素(0.3µM)刺激HASM细胞1 min,观察细胞的收缩反应和[Ca . 8]的变化gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba连续监测反应10分钟(间隔10-s)。gydF4y2Ba
附加文件3:视频S3。gydF4y2Ba
离子霉素诱导[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2BaPI3K-C2β sirna转染HASM的反应和收缩。PI3K-C2β特异性sirna转染后,荧光CagydF4y2Ba2 +gydF4y2Ba用离子霉素(0.3µM)刺激HASM细胞1 min,观察细胞的收缩反应和[Ca . 8]的变化gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba连续监测反应10分钟(间隔10-s)。gydF4y2Ba
附加文件4:视频S4。gydF4y2Ba
离子霉素诱导[CagydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2BaPI3K-C2α和-C2β sirna转染HASM的反应和收缩。PI3K-C2α和-C2β特异性sirna转染后,荧光CagydF4y2Ba2 +gydF4y2Ba用离子霉素(0.3µM)刺激HASM细胞1 min,观察细胞的收缩反应和[Ca . 8]的变化gydF4y2Ba2 +gydF4y2Ba]gydF4y2Ba我gydF4y2Ba连续监测反应10分钟(间隔10-s)。gydF4y2Ba
附加文件5:视频S5。gydF4y2Ba
离子霉素刺激HASM中RhoA-FRET的延时成像。用RhoA-FRET探针表达载体和对照siRNA(左)或PI3K-C2α和-C2β特异性siRNA(右)转染HASM细胞,并在1分钟内用离子霉素(0.3µM)刺激。共聚焦显微镜监测RhoA-FRET信号10分钟(间隔10 s)。值得注意的是,在对照细胞中加入离子霉素导致RhoA的快速激活,而在C2α-和c2β -缺失的细胞中,离子霉素诱导的RhoA激活大大降低。gydF4y2Ba
附加文件6:视频S6。gydF4y2Ba
et -1刺激HASM中RhoA-FRET的延时成像。用RhoA-FRET探针表达载体和对照siRNA(左)或PI3K-C2α和- c2β特异性siRNA(右)转染HASM细胞,并在1分钟内用内皮素-1(1µM)刺激。共聚焦显微镜监测RhoA-FRET信号10分钟(间隔10 s)。注意,内皮素-1导致对照细胞中RhoA的快速激活,而内皮素-1诱导的RhoA激活在C2α-和c2β -缺失的细胞中显著降低。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
Islam, S., Yoshioka, K., Aki, S.。gydF4y2Baet al。gydF4y2BaII类磷脂酰肌醇3-激酶α和β亚型是小鼠血管平滑肌Rho激活、收缩和血压调节所必需的。gydF4y2Ba物理科学gydF4y2Ba70gydF4y2Ba, 18(2020)。https://doi.org/10.1186/s12576-020-00745-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12576-020-00745-2gydF4y2Ba
关键字gydF4y2Ba
- II类磷脂酰肌醇3-激酶gydF4y2Ba
- 血管平滑肌gydF4y2Ba
- 收缩gydF4y2Ba
- ρgydF4y2Ba
- 血压gydF4y2Ba