摘要
Vascular smooth muscle cell (VSMC) migration and the subsequent intimal thickening play roles in vascular restenosis.We previously reported that an exchange protein activated by cAMP 1 (Epac1) promotes platelet-derived growth factor (PDGF)-induced VSMC migration and intimal thickening.Because basic fibroblast growth factor (bFGF) also plays a pivotal role in restenosis, we examined whether Epac1 was involved in bFGF-mediated VSMC migration.bFGF-induced lamellipodia formation and migration were significantly decreased in VSMCs obtained from Epac1−−/与Epac1基因的小鼠相比+/+-VSMCs。在Epac1中,bfgf诱导的参与bfgf诱导的细胞迁移的Akt和糖原合成酶激酶3β (GSK3β)的磷酸化被减弱−−/-VSMCs。在Epac1中,插入大导线引起的内膜增厚减弱−−/小鼠,并伴有GSK3β磷酸化降低。这些数据表明,Epac1缺失可能通过Akt/GSK3β通路减弱bfgf诱导的VSMC迁移。
介绍
经皮冠状动脉介入治疗引起的血管损伤后发生的内膜增厚是一个主要的临床问题[1].这种增厚是伤口愈合的基本过程,在这个过程中,血管平滑肌细胞(VSMCs)向内腔迁移,并在动脉壁的最内层内增殖[2].虽然药物洗脱支架可以显著减少内膜增厚,但重复血运重建仍然相对常见[3.],明确的晚期支架血栓形成的风险已成为主要关注的问题[4].因此,阐明参与内膜增厚病理过程的分子机制是很重要的。
VSMC迁移是再狭窄的关键事件[2,5],并由动脉壁释放的细胞因子和生长因子介导[6,7].碱性成纤维细胞生长因子(bFGF)和血小板衍生生长因子(PDGF)-BB在血管损伤部位由内皮细胞、巨噬细胞和VSMCs释放[8].bFGF和PDGF-BB对VSMC迁移和随后的内膜增厚均有显著贡献[6,9].
我们之前证明了cAMP激活的交换蛋白(Epac)诱导VSMCs和其他细胞类型的迁移[10,11,12].当Epac1被沉默时,pdgf - bb诱导的VSMC迁移和机械损伤诱导的内膜增厚被减弱[13].另一项研究报道,在小鼠颈动脉结扎模型中,基因敲低Epac1基因可减少内膜增厚[14].然而,Epac1在bfgf诱导的VSMC迁移和内膜增厚中的作用尚不清楚。
bFGF激活磷酸肌肽3-激酶(pi3k)/蛋白激酶B (Akt)通路,促进细胞迁移[15,16,17,18].大鼠颈动脉球囊导管损伤后pi3k /Akt信号被激活[j]19].Epac also stimulates PI3 K/Akt signaling pathways in a variety of cell types [20.,21,22,23].在epac1缺失的VSMCs中,pi3kp110亚型的蛋白表达和Akt在Ser位点的磷酸化473显著减少[14].这些发现表明bFGF和Epac共享下游信号通路,即pi3k /Akt。因此,我们假设Epac1的下游信号参与了bfgf诱导的VSMC迁移和新生内膜形成。在这里,我们用Epac1原代培养的vsmc证明了Epac1缺乏对bfgf诱导的迁移的影响−−/(Epac1−−/-VSMCs)。
方法
试剂
抗fgfr1和抗磷酸化cofilin抗体购自Santa Cruz Biotechnology (San Diego, CA, USA)。抗叉头盒转录因子O1 (FOXO1)抗体购自abcam (Cambridge, MA)。抗糖原合成酶激酶3β (GSK3β),抗磷酸化GSK3β (Ser9),抗Akt,抗磷酸化Akt (Ser473),抗p70核糖体蛋白S6激酶(s6k),抗磷酸化s6k (Thr389)和抗磷酸化的fox01 (Ser256)抗体购自Cell Signaling公司(Beverly, MA, USA)。Hoechst 33342、罗丹明偶联抗f -肌动蛋白抗体、Alexa Fluor 488抗兔IgG抗体和Alexa Fluor 594抗兔IgG抗体购自Life Technologies (Carlsbad, CA, USA)。重组人bFGF蛋白购自Thermo Fisher Scientific (San Jose, CA, USA)。聚-l-赖氨酸购自Sigma (St. Louis, MO, USA)。弹性酶II-A型、胰蛋白酶抑制剂I-S型、牛血清白蛋白V、青霉素-链霉素溶液和Dulbecco改良Eagle培养基(DMEM)购自Sigma-Aldrich。II型胶原酶购自Worthington Biochemical (Lakewood, NJ, USA)。胶原酶病购自罗氏诊断公司(日本东京)。胎牛血清(FBS)购自Equitech-Bio (Kerrville, TX, USA)。Tissue-Tek OCT购自Sakura Finetek (Torrance, CA, USA)。
动物
所有的动物都是按照美国生理学会的指导原则来照顾的。实验经横滨市立大学动物实验伦理委员会批准(参考编号:F-A-14-108)。epac1缺陷小鼠的产生在之前有过描述[24].Epac1+/+和Epac1−−/通过杂合子杂交获得3-8月龄的同窝小鼠。
小鼠VSMCs的分离与培养
VSMCs were isolated from the thoracic aorta of mice using an explant method as previously described [13].简单地说,用100 mg/kg戊巴比妥(kyyoritsu Seiyaku, Tokyo, Japan)对小鼠实施安乐死后,分离主动脉。用含有弹性酶II- a型、胰蛋白酶抑制剂I-S型、牛血清白蛋白V型、胶原酶II型和胶原酶病的胶原酶混合物孵育主动脉,将培养基与外膜分离。然后将膜介质切成小片并镀在聚醚上l-赖氨酸包被培养皿。VSMCs在添加20% FBS和1%青霉素-链霉素的DMEM和添加5% CO的空气中生长237℃。实验使用10代内的细胞。
细胞迁移试验
如前所述,通过跟踪路径长度来评估细胞迁移[13].VSMCs血清饥饿48小时后,分别用或不加10 ng/ml bFGF处理细胞8小时。使用延时显微镜(TE2000 Eclipse, Nikon, Tokyo, Japan)测量VSMCs的路径长度。在跟踪过程中每隔20分钟记录一次图像,每帧对每个细胞的细胞核进行人工跟踪。我们进行了三个独立的实验,发现了统计上相似的结果。
免疫印迹
VSMCs在含150 mmol/l Na的裂解缓冲液中裂解和超声处理2有限公司3.[pH 11.0]和1 mmol/l EDTA。用免疫印迹法分析全细胞裂解物中的蛋白表达,方法如前所述[13].
免疫细胞化学
Immunocytochemistry was performed as previously described [13].简单地说,在12 mm玻璃罩上培养的VSMCs血清饥饿48 h,然后用DMEM单独(对照)或bFGF (10 ng/ml)刺激30 min。固定细胞与一抗在4℃下孵育过夜。DNA用赫斯特溶液染色。使用Nikon TE2000-E(东京,日本)进行形态计量学分析。
股动脉损伤模型
Transluminal mechanical injury of the femoral artery was induced by the insertion of a large wire (0.38 mm in diameter, C-SF-15-15, Cook, Bloomington, IN, USA) as previously described [13].伤后2周取动脉,包埋OCT复合物,液氮快速冷冻。冷冻切片保存在- 80°C直到使用。
免疫组织化学
如前所述进行免疫组化[13].冷冻组织切片与一抗在4°C下孵育过夜。用Tween 20/PBS洗涤3次,洗涤5分钟,然后用二抗孵育1小时。用Tween 20/PBS洗涤6次后,用Hoechst溶液染色。
统计分析
Data are expressed as mean ± standard error of the mean (SEM).采用未配对的Student’s进行统计分析t图中-test1c.图采用双向方差分析(ANOVA)和Bonferroni多重比较检验。1b,2b,3.b, d,4b, d. A的值p< 0.05为显著性。
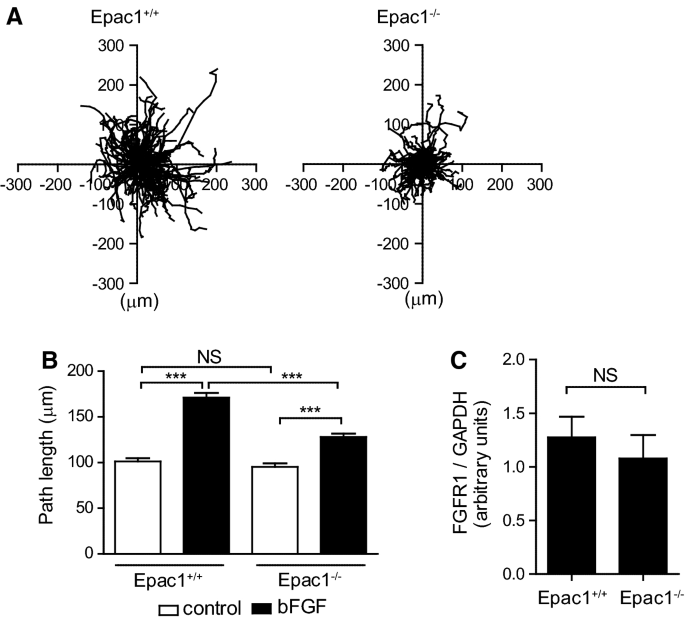
Epac1缺乏对bfgf诱导的VSMC迁移的影响。一个在bFGF (10 ng/ml)刺激下VSMC迁移8小时的分析。中心到端点。我们进行了三个独立的实验(Epac1+/+-VSMCs,n= 20, 71, 55;Epac1−−/-VSMCs,n= 23,40和64),并在实验中发现了类似的结果。显示所有数据的总和(Epac1)+/+-VSMCs,n= 146;Epac1−−/-VSMCs,n= 127)。BQuantification of total path length of VSMCs.Data were obtained from three independent experiments (Control Epac1+/+-VSMCs,n= 61, 135和65;Epac1+/+- bFGF治疗的vsmcs;n= 73, 129, 46;控制Epac1−−/-VSMCs,n= 26, 126, 41;Epac1−−/- bFGF治疗的vsmcs;n= 40, 105和21)。采用双向方差分析和Bonferroni多重比较检验的统计分析表明,所有实验的统计结果相似。显示所有数据的总和(Control Epac1+/+-VSMCs,n= 261;Epac1+/+- bFGF治疗的vsmcs;n= 248;控制Epac1−−/-VSMCs,n= 193;Epac1−−/- bFGF治疗的vsmcs;n= 166)。***p< 0.0001。NSindicates not significant.Cwestern blotting测定未刺激VSMCs中FGFR1蛋白的表达。n= 5。NS表示不重要
Epac1缺乏减少bfgf诱导的板足形成。一个VSMCs板足形成的代表性图像。上面板:肌动蛋白(红色的);中间面板:磷酸化cofilin (p-cofilin);绿色);较低的面板: merged images of F-actin and p-cofilin staining.箭头提示板足伴去磷酸化的cofilin。规模的酒吧, 30 μm.B板足伴去磷酸化cofilin的VSMCs数量的定量分析。板足阳性细胞率表示为细胞总数的百分比。n= 353 (control Epac1 .+/+-VSMCs), 196 (Epac1+/+- bFGF处理的vsmcs), 195(对照Epac1)−−/-VSMCs)、463 (Epac1 . c)−−/- bFGF治疗的vsmcs)。数据来自四个以上的独立实验。**p< 0.001;***p< 0.0001。NS表示不重要
结果
Epac1缺乏减弱bfgf诱导的VSMC迁移
我们研究了bFGF对Epac1 VSMCs的迁移作用+/+老鼠(Epac1+/+-VSMCs)和Epac1−−/老鼠(Epac1−−/-VSMCs)。监测细胞迁移8小时,得到细胞迁移路径(图2)。1a,补充片I和II)。在Epac1中,bfgf诱导的细胞迁移程度较小−−/-VSMCs比在Epac1+/+-VSMCs(无花果。1a, b).成纤维细胞生长因子受体1 (FGFR1)主要参与bfgf诱导的VSMC迁移[25].接下来,我们检测了Epac1缺失是否会影响FGFR1的表达;Epac1与FGFR1蛋白表达无差异+/+-和Epac1−−/-VSMCs(无花果。1c)。
Epac1缺乏减少bfgf诱导的板足形成
膜突出的板足在细胞迁移中起着重要作用[26].接下来,我们研究了Epac1缺乏对bfgf诱导的板足形成和cofilin去磷酸化的影响,cofilin在板足形成中起关键作用[26].免疫细胞化学显示bFGF显著增加板足形成,并伴有Epac1中cofilin的去磷酸化+/+-VSMCs,但不是在Epac1−−/-VSMCs(无花果。2).这些结果表明Epac1参与了bfgf诱导的板足形成。
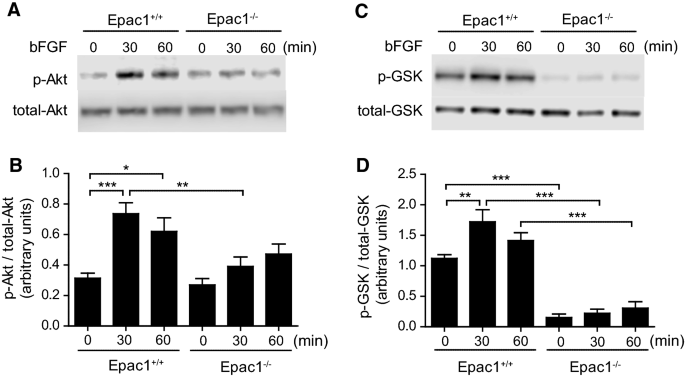
Epac1缺失可降低bfgf诱导的Akt和GSK3β磷酸化
据报道,bFGF激活pi3k /Akt通路,进而诱导GSK3β磷酸化,导致细胞迁移[27,28].值得注意的是,pi3k诱导Akt在Ser位点的磷酸化473,从而促进GSK3在Ser位点的磷酸化9,使GSK3β激酶活性失活[29].我们接下来评估了Akt在Ser473和GSK3β9被Epac1缺乏抑制。bFGF刺激增加了Epac1中Akt和GSK3β的磷酸化+/+这种作用在Epac1中被明显抑制−−/VSMCs(无花果。3.).Epac1的磷酸化无延迟性增强−−/观察VSMCs。
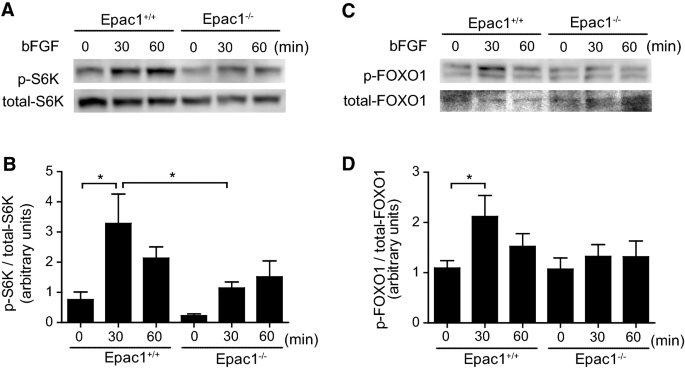
已经认识到,pi3k /Akt磷酸化可诱导s6k和FOXO1磷酸化,分别与蛋白质合成和细胞存活相关[30.,31].bFGF刺激增加了s6k在Thr位点的磷酸化389在Epac1+/+这种效应在Epac1中明显减弱−−/VSMCs(无花果。4a, b).丝氨酸位点fox01的磷酸化256bFGF刺激Epac1+/+VSMCs。这种作用在Epac1中减弱−−/VSMCs,虽然这种衰减没有达到显著性(图2)。4c, d)。
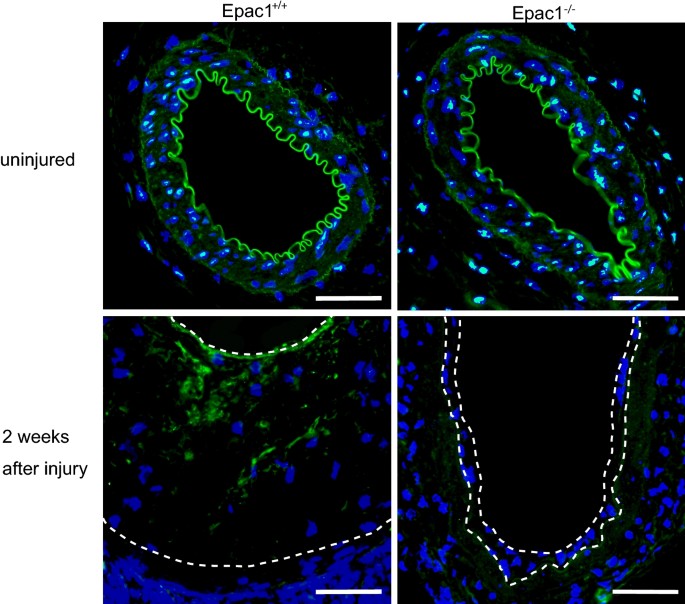
Epac1缺乏抑制内膜增厚和GSK3β磷酸化
在体外实验的基础上,我们研究了GSK3β在机械损伤诱导的Epac1内膜增厚中的磷酸化状态+/+和Epac1−−/老鼠。Epac1的股动脉形态无明显差异+/+或Epac1−−/小鼠在基础条件下(图上面板)。5).The insertion of a large wire into the femoral arteries induced prominent intimal thickening in Epac1+/+whereas this intimal thickening was attenuated in Epac1−−/小鼠(图下面板)5), which was consistent with the results of previous reports [13,14].免疫细胞化学显示Epac1内膜增厚区磷酸化的GSK3β表达减弱−−/mice compared to that in Epac1+/+小鼠(图下面板)5).
讨论
在本研究中,我们证明Epac1缺失可减弱bfgf诱导的VSMCs中Akt和GSK3β的磷酸化、细胞迁移和板足形成。Epac1缺乏可减少机械损伤引起的内膜增厚,并伴有GSK3β磷酸化降低。这些数据表明epac1介导的下游信号Akt/GSK3β参与了bfgf诱导的VSMC迁移。
bFGF是VSMC迁移和内膜增厚形成的主要调节剂。研究表明,抗bfgf IgG可使内膜增厚减少约50% [32].反义bFGF的腔内腺病毒基因转移对动脉内膜增厚的抑制作用显著[33].新出现的证据表明,bFGF和Epac激活了许多细胞结果,包括通过pi3k /Akt信号传导的迁移[14,15,16,17,18,20.,21,22,23].一项研究表明,Epac1通过bfgf介导的旁分泌信号通路增加内皮细胞的迁移[34].在本研究中,Epac1沉默通过抑制硫酸肝素链n -磺化抑制bFGF与FGFR的结合。然而,bFGF和Epac信号通路之间的相互作用在很大程度上是未知的。
本研究表明,在Epac1缺失的情况下,bfgf介导的Akt和GSK3β磷酸化以及VSMCs中的迁移明显减弱,这表明Epac1-与bfgf介导的下游信号传导之间存在关联。Epac1被cAMP直接激活并介导广泛的细胞反应[35,36].先前的一篇论文提出了bFGF刺激介导cAMP生成的机制[37].FGFR1激活PLCγ/二酰基甘油途径,增强Ca2+通过电压门控钙通道进入,钙离子2+/钙调素可以激活钙敏感的腺苷酸环化酶,产生cAMP [37].Although this paper proposed this signaling cascade, the concept was not supported by the experimental data.It is, however, recognized that bFGF is not directly involved in the elevation of the intracellular concentration of cAMP [38,39,40].Based on these findings, there is currently no evidence that bFGF-FGFR signaling directly regulates Epac1 activation.我们假设bfgf介导的下游信号通路与epac1介导的细胞内信号通路相互作用。We do not, however, know the exact molecular mechanisms of this interaction.需要进一步研究小G蛋白Rap和pi3k,以确定bFGF和Epac1信号通路如何相互作用。
在本研究中,我们在Epac1中发现了低水平的GSK3β磷酸化−−/-有或没有bFGF刺激的vsmcs。GSK3β普遍表达丝氨酸/苏氨酸激酶,在静息细胞中具有较高的基础活性。GSK3β在许多生物过程中发挥作用,包括细胞极性,微管动力学和细胞迁移[41,42,43].GSK3β失活在血管重塑中的重要性也有报道[44].在大鼠球囊导管损伤模型中,磷酸化的GSK3β(失活)在内膜增厚区表达明显增加,构成活性明显增强GSK3β基因转移导致内膜增厚形成减少[44].在内膜增厚形成过程中,VSMC的凋亡受到糖代谢上调的抑制,并与GSK3β的失活有关[j]。45].
Epac在GSK3β活化中的作用一直存在争议。使用骨骼肌细胞、海马切片和培养的小胶质细胞进行的研究表明,Epac对GSK3β的激活没有影响[46,47,48].然而,两篇论文显示Epac或Epac1在分离的大鼠心脏和黑色素瘤细胞中灭活GSK3β [27,49].Akt是一个主要的上游调控因子,通过磷酸化n端丝氨酸导致GSK3β失活9(29].Epac通过激活pi3k /Akt/GSK3β通路促进微管蛋白聚合[27].这些数据表明,Epac介导的GSK3β激活取决于细胞类型和Epac信号的上游。我们的数据显示,在基础条件下,Epac1和Epac1之间Akt的磷酸化程度相似+/+-和Epac1−−/-VSMCs, whereas the expression level of phosphorylated GSK3β was lower in Epac1−−/-VSMCs比在Epac1+/+-VSMCs。丝裂原活化蛋白激酶级联和Wnt通路是GSK3β的上游信号通路,以及pi3k /Akt轴[50,51].除了Akt激活外,可能还存在epac介导的激活GSK3β的上游信号。
GSK3β失活通过β-catenin在细胞核内的积累导致β-catenin信号通路的激活,从而调节基因表达和多种细胞活动,包括细胞迁移[52].据报道,bFGF通过GSK3β/β-catenin信号通路促进皮肤成纤维细胞迁移[15].在血管损伤后的内膜增厚部位检测到活性β-catenin水平升高,抑制β-catenin可减少损伤后新内膜的形成[53].这些数据提示β-catenin在VSMC迁移中的可能作用。连接GSK3β失活和VSMC迁移的机制需要在未来的研究中确定。
除细胞迁移外,Akt信号通路还分别通过Akt/ s6k和Akt/FOXO1信号通路调控蛋白合成和细胞存活或增殖[54].我们的数据表明,s6k介导的蛋白合成和fox01介导的细胞存活或增殖在Epac1中减弱−−/-VSMCs。尽管一些论文指出s6k和fox01参与了内膜增厚的形成[55,56]并且目前没有直接证据表明这些信号通路与血管内膜增厚形成之间存在因果关系,因此epac1介导的这些信号通路的调节对于未来的研究将是重要的。
综上所述,Epac1通过Akt/GSK3β磷酸化参与bfgf诱导的VSMC迁移。我们现在的研究和我们以前的研究[13]表明Epac1参与了PDGF-BB和bfgf介导的VSMC迁移。据报道,Epac1在损伤诱导的内膜增厚形成过程中上调[10], Epac1缺乏或Epac的药理抑制可减轻血管损伤小鼠模型的内膜增厚形成[13,14].Epac1可能是未来抑制血管内膜增厚治疗的靶点。
参考文献
施瓦兹(1997)展望系列:血管生物学中的细胞粘附。动脉粥样硬化和再狭窄中的平滑肌迁移。[J]中华临床医学杂志(英文版)
陈志强,陈志强(2000)内膜增生的分子机制。[J]病理学杂志190:300-309
Stolker JM, Kennedy KF, Lindsey JB, Marso SP, Pencina MJ, Cutlip DE, Mauri L, Kleiman NS, Cohen DJ, Investigators E(2010)在现实世界的临床实践中预测药物洗脱支架再狭窄:来自EVENT注册表的风险模型的推导和验证。中国心血管杂志,3:327-334
Finn AV, Joner M, Nakazawa G, Kolodgie F, Newell J, John MC, Gold HK, Virmani R(2007)晚期药物洗脱支架血栓形成的病理相关性:支架支架覆盖率作为内皮化的标志。循环115:2435 - 2441
Casscells W(1992)平滑肌和内皮细胞的迁移。再狭窄中的关键事件。循环86:723 - 729
Jackson CL, Reidy MA (1993) Basic fibroblast growth factor: its role in the control of smooth muscle cell migration.[J]病理学杂志143:1024-1031
Schroder K, Helmcke I, Palfi K, Krause KH, Busse R, Brandes RP (2007) Nox1 mediates basic fibroblast growth factor-induced migration of vascular smooth muscle cells.Arterioscler Thromb Vasc Biol 27:1736–1743
林德纳V, Lappi DA, Baird A, Majack RA, Reidy MA(1991)碱性成纤维细胞生长因子在血管病变形成中的作用。Circ Res 68:106-113
Lindner V(1995)碱性成纤维细胞生长因子和血小板衍生生长因子(b链)在动脉损伤后新生内膜形成中的作用。中国生物医学工程学报(增刊4):344 - 344
Yokoyama U, Minamisawa S, Quan H, Akaike T, Jin M, Otsu K, Ulucan C, Wang X, Baljinnyam E, Takaoka M, Sata M, Ishikawa Y(2008)血管内膜形成过程中Epac1表达上调及促进血管平滑肌细胞迁移。[J] .中华心脏杂志,2011,31 (3):555 - 557
(2008)前列腺素e2激活的Epac蛋白激酶对大鼠动脉导管新内膜形成的影响[J] .中国生物医学工程杂志,28 (3):379 - 379
杨建军,李建军,李建军,李建军,李建军(2008)环腺苷腺苷效应体Epac整合促纤维化和抗纤维化信号。美国科学进展105:6386-6391
Kato Y, Yokoyama U, Yanai C, Ishige R, Kurotaki D, Umemura M, Fujita T, Kubota T, Okumura S, Sata M, Tamura T, Ishikawa Y (2015) Epac1缺乏对血管平滑肌细胞迁移和新内膜形成的影响。动脉粥样硬化血栓血管生物学35:2617-2625
王H,罗比查乌克斯工作组,王Z,梅FC, Cai M, Du G,陈J,程X(2016)抑制Epac1抑制线粒体分裂和减少neointima形成引起的血管损伤。科学报告6:36 . 552
王欣,朱莹,孙晨,王婷,沈莹,蔡伟,孙健,迟磊,王慧,宋宁,牛超,沈健,丛伟,朱震,宣燕,李鑫,金玲(2017)皮肤成纤维细胞Wnt/ β -catenin通路对碱性成纤维细胞生长因子信号的反馈激活。前药房8:32
Schmidt A, Ladage D, Schinkothe T, Klausmann U, Ulrichs C, Klinz FJ, Brixius K, Arnhold S, Desai B, Mehlhorn U, Schwinger RH, stabb P, Addicks K, Bloch W(2006)基本成纤维细胞生长因子对人间充质干细胞迁移的影响。干细胞24:1750-1758
林释H, B,黄Y,吴J,张H, C林,王Z,朱J,赵Y,傅X,卢Z,李X,小J(2016)基本成纤维细胞生长因子促进黑素细胞迁移通过激活PI3 K / Akt-Rac1-FAK-JNK和ERK信号通路。生命68:735-747
Shimabukuro Y, Terashima H, Takedachi M, Maeda K, Nakamura T, Sawada K, Kobashi M, Awata T, Oohara H, Kawahara T, Iwayama T, Hashikawa T, Yanagita M, Yamada S, Murakami S(2011)成纤维细胞生长因子-2通过pi3k /AKT信号和CD44/透明质酸相互作用刺激牙周膜细胞定向迁移。[J] .中国生物医学工程学报,26 (2):893 - 893
Shigematsu K, Koyama H, Olson NE, Cho A, Reidy MA (2000) Phosphatidylinositol 3-kinase signaling is important for smooth muscle cell replication after arterial injury.动脉粥样硬化血栓血管生物学20:2373-2378
景辉,颜建辉,Ganea D(2004)前列腺素E2抑制CCL3/4表达的新信号通路。[J] .中国生物医学工程学报(英文版)
Namkoong S, Kim CK, Cho YL, Kim JH, Lee H, Ha KS, Choe J, Kim PH, Won MH, Kwon YG, shieb, Kim YM (2009) Forskolin通过pka依赖性VEGF表达和epac介导的pi3k /Akt/eNOS信号的协调交叉对话促进血管生成。Cell Signal 21:906–915
张建军,张建军,张建军,张建军(2009)腺苷对心肌成纤维细胞胶原合成的调控作用。[J] .中国生物医学工程学报,2011,31 (6):888 - 888
Baviera AM, Zanon NM, Navegantes LC, Kettelhut IC (2010) cAMP/Epac/ pi3k依赖通路参与肾上腺素对大鼠骨骼肌的抗蛋白水解作用。Mol Cell Endocrinol 315:104-112
铃木S, Yokoyama U, Abe T, Kiyonari H, Yamashita N, Kato Y, Kurotani R, Sato M, Okumura S, Ishikawa Y (2010) Epac在神经元和心肌细胞死亡调控中的差异作用。[J] .生物化学学报,28 (5):344 - 344
Rauch BH, Millette E, Kenagy RD, Daum G, Fischer JW, Clowes AW(2005)凝血素诱导的血管平滑肌细胞迁移和增殖需要Syndecan-4。中国生物医学工程学报,28 (2):444 - 444
Ghosh M, Song X, Mouneimne G, Sidani M, Lawrence DS, Condeelis JS (2004) Cofilin促进肌动蛋白聚合并定义细胞运动方向。科学304:743 - 746
Baljinnyam E, Iwatsubo K, Kurotani R, Wang X, Ulucan C, Iwatsubo M, Lagunoff D, Ishikawa Y (2009) Epac促进黑色素瘤细胞迁移的作用机制。[J] .中国生物医学工程学报,1997,19 (3):559 - 563
刘志超,王合生,张刚,刘宏,陈晓华,张峰,陈永元,蔡山,杜军(2014)AKT/GSK-3beta调控蜗牛的稳定性和转录,这对bfgf诱导的前列腺癌细胞上皮-间质转化至关重要。生物化学学报,1840:3096-3105
Cohen P, Frame S (2001) GSK3的复兴。生物学报2:769-776
李春华,李春华,李春华,等(1997)p70s6k的模块化磷酸化和活化。feb Lett 410:78-82
黄海,Tindall DJ(2007)动态FoxO转录因子。[J]中国生物医学工程学报(英文版)
Rutherford C, Martin W, Salame M, Carrier M, Anggard E, Ferns G(1997)血小板源性生长因子- bb和碱性成纤维细胞生长因子联合抗体对大鼠颈动脉球囊损伤新内膜反应的抑制作用。动脉粥样硬化130:45-51
Hanna AK, Fox JC, Neschis DG, Safford SD, Swain JL, Golden MA (1997) Antisense basic fibroblast growth factor gene transfer reduces neointimal thickening after arterial injury.[J]中华外科杂志,25:320-325
Baljinnyam E, Umemura M, Chuang C, De Lorenzo MS, Iwatsubo M, Chen S, Goydos JS, Ishikawa Y, Whitelock JM, Iwatsubo K (2014) Epac1通过fgf2介导的旁分泌信号传导促进内皮细胞和黑色素瘤细胞的迁移。色素细胞黑色素瘤Res 27:611-620
de Rooij, Zwartkruis FJ, Verheijen MH, Cool RH, Nijman SM, Wittinghofer A, Bos JL .(1998)环AMP直接激活的Rap1鸟嘌呤-核苷酸交换因子Epac
葛丽丽,王志强(2010)Epac:一种新的cAMP作用机制。医学杂志,vol . 50:355-375
Soto I, Rosenthal JJ, Blagburn JM, Blanco RE(2006)视神经切开术后应用成纤维细胞生长因子2通过激活ERK和PKA信号通路上调神经节细胞BDNF和TrkB。[J]中国生物医学工程学报(英文版)
杨建军,杨建军,杨建军,等(2000)蛋白激酶A在成纤维细胞生长因子2激活转录中的作用。美国科学进展97:168-173
Yoshimata T, Yoneyama A, Jin-no Y, Tamai N, Kamiya Y(1999)脱氢表雄酮对人主动脉平滑肌细胞丝裂原活化蛋白激酶的影响。生命科学65:431-440
Logan A, Logan SD(1991)在Balb/c 3T3细胞中,百日咳毒素对成纤维细胞生长因子刺激的有丝分裂的信号传导和抑制机制的研究。手机信号3:215-223
蒋宏,郭伟,梁鑫,饶勇(2005)神经元极性的建立和维持都需要积极的机制:GSK-3beta及其上游调节因子的关键作用。细胞120:123 - 135
Doble BW, Woodgett JR (2003) GSK-3:多任务激酶的交易技巧。[J] .中国生物医学工程学报(英文版)
Etienne-Manneville S, Hall A (2003) Cdc42调节gsk -3 β和大肠腺瘤性息肉病控制细胞极性。自然421:753 - 756
杨文辉,杨海明,杨海军,杨海军,Chae IH, Oh BH, Lee MM, Park YB, Choi yys, Kim HS, Walsh K(2003)血管平滑肌球囊损伤后糖原合成酶激酶-3 β基因转移维持细胞凋亡,抑制血管平滑肌细胞增殖,减少新生内膜形成。动脉粥样硬化血栓血管生物学23:1364-1369
Hall JL, Chatham JC, Eldar-Finkelman H, Gibbons GH(2001)血管平滑肌细胞凋亡抑制与内膜病变形成过程中糖代谢上调的关系。GSK3beta的作用。糖尿病50:1171 - 1179
Jensen J, Brennesvik EO, Lai YC, Shepherd PR(2007)肾上腺素和胰岛素对骨骼肌GSK-3 β的调节:PKA和PKB调节GSK-3不同池的证据。手机信号19:204-210
张建军,张建军,张建军,张建军。(2009)脑电应激对脑电应激的影响。[J]中国生物医学工程学报(英文版)
刘健,赵霞,曹军,薛强,冯霞,刘霞,张峰,于斌(2011)PKA和Epac在内毒素刺激的原代培养小胶质细胞中细胞因子产生的差异作用。[J]中华神经科学杂志,45 (5):391 - 391
李天明,林世忠,张国荣(2013)PKA和Epac通路介导n -乙酰半胱氨酸诱导的心肌梗死大鼠Connexin43保存。PLoS One 8:e71878
李建平,李建平,李建平(1993)糖原合成酶激酶-3 β的磷酸化失活:胰岛素和生长因子信号的新激酶连接。中国生物医学工程学报,2011,31 (1):393 - 398
王晓明,王晓明,王晓明,等。糖原合成酶激酶-3的细胞内信号通路的研究[J] .中国生物医学工程学报,1996,32 (5):526 - 536
王晓东,王晓东,王晓东,等(2006)Wnt信号转导:多通路、多受体和多转录因子。[J] .生物化学学报,28 (1):22429 - 22433
Riascos-Bernal DF, Chinnasamy P, Gross JN, Almonte V, Egana-Gorrono L, Parikh D, Jayakumar S, Guo L, Sibinga NES(2017)平滑肌β -catenin抑制血管损伤后新内膜的形成。动脉粥样硬化血栓血管生物学37:879-888
王志强,王志强,王志强,等(2007)AKT/PKB信号转导的研究。细胞129:1261 - 1274
朱丽华,黄丽,张欣,张鹏,张思敏,关华,张艳,朱学勇,田森,邓凯,李宏(2015)敏丁调节血管平滑肌细胞表型并阻止新生内膜形成。临床科学129:129-145
王燕,白燕,秦丽,张鹏,易涛,Teesdale SA,赵丽,Pober JS, Tellides G(2007)干扰素γ诱导人血管平滑肌细胞增殖和内膜扩张的磷脂酰肌醇3-激酶依赖性靶细胞雷帕霉素raptor复合物1的激活。Circ Res 101:560-569
致谢
作者感谢Yuka Sawada(横滨市立大学)的组织学分析。
资金
本研究由MEXT/JSPS KAKENHI (YK, JP17K08976;Uy, jp17k19403, jp16h05358, jp15h05761;YI, JPH1605300),武田科学基金会(YK),日本医学研究开发机构(AMED) (YI, 66890007, 66891153)和Kitsuen研究基金会(YI, 71890005)。
作者信息
作者及单位
相应的作者
电子补充资料
以下是电子补充材料的链接。
补充影片1 . Epac1+/+- 10 ng/ml bFGF刺激下vsmc迁移。(MPG 887 kb)
Supplemental movie II.Epac1−−/- 10 ng/ml bFGF刺激下vsmc迁移。(MPG 885 kb)
权利和权限
关于本文
引用本文
加藤,Y,横山,U,藤田,T。et al。Epac1缺乏抑制碱性成纤维细胞生长因子介导的血管平滑肌细胞迁移。物理科学69, 175–184 (2019).https://doi.org/10.1007/s12576-018-0631-7
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1007/s12576-018-0631-7
关键字
- 由cAMP 1激活的交换蛋白
- 内膜的增厚
- 碱性成纤维细胞生长因子
- 血管平滑肌细胞
- 迁移