摘要
当前的COVID-19大流行在全球范围内造成了严重的发病率和死亡率。有吸烟史的人感染COVID-19有严重的疾病结局。流行病学研究表明,老年和先前存在的疾病(高血压和糖尿病)导致COVID-19患者的严重疾病结局和死亡。有证据表明,SARS-CoV-2 (COVID-19病原体)膜突的S1结构域对SARS-CoV-2具有较高的亲和力血管紧张素转换酶2(ACE2)受体在宿主肺上皮上发现。同样,TMPRSS2蛋白酶已被证明对病毒激活至关重要,从而促进病毒吞噬。病毒进入已被证明会引起“细胞因子风暴”,涉及过度产生促炎细胞因子/趋化因子,包括IL-6、TNF-α、IFN-γ、IL-2、IL-7、IP-10、MCP-3或GM-CSF,吸烟会增加这种情况。未来的研究可以针对这些炎症免疫反应,以开发针对COVID-19的有效治疗方法。本文综述了在SARS-CoV2感染期间,吸烟和电子烟对炎症和免疫反应、蛋白酶和上皮通透性的作用,以及未来的研究方向,并提供了治疗的潜在靶点,特别是控制肺部细胞因子风暴。
简介
2019年12月,中国武汉市出现病因不明的肺炎症状,现在已成为全球卫生问题,并宣布为大流行。COVID-19的病原体SARS-CoV-2并非未知病原体。以前曾有两次由同一家族的成员(即Coronaviridae),即SARS及中东呼吸综合征[1].然而,目前的SARS-CoV2具有很强的传染性,具有更高的人传人倾向[2,3.].鉴于目前这种感染没有已知的治愈方法,快速筛查/检测、追踪和遏制是目前抗击大流行的最有效手段。这使得确定并发症风险较高的易感人群变得至关重要。据报道,一些SARS-CoV2感染导致急性呼吸窘迫综合征(ARDS)和严重疾病结局的病例发生在老年人(衰老伴免疫功能下降)或合并症患者中[4].流行病学数据显示,老年人和既往患有疾病(如糖尿病或高血压)的人在COVID-19患者中死亡率较高,而年轻和健康成年人则表现出不同的疾病倾向[5].此外,还有一些患者感染这种疾病的风险较高,例如癌症患者、移植患者或其他需要使用免疫抑制药物的患者,特别是呼吸系统疾病患者[6].具体来说,这种疾病(a)可能根本不表现出来;使患者成为病毒病原体的潜在携带者,(b)可能表现为“普通流感”,因此在进一步并发症出现之前无法诊断,(c)可能发展为需要住院治疗的严重疾病。因此,了解疾病发展和进展的确切模式,并确定可能感染疾病风险较高的人群至关重要。在这方面,有吸烟/吸电子烟史的人可能更有可能因感染COVID-19而患上严重疾病。然而,目前有关吸烟者/电子烟使用者感染SARS-CoV-2对健康的影响的重要数据很少或没有。在这篇小型综述中,我们提出了吸烟和/或电子烟会削弱肺部防御能力的证据,从而使个人更容易感染COVID-19,症状加重。
COVID-19和吸烟/电子烟
虽然没有直接证据表明吸烟者/吸电子烟者对COVID-19感染的易感性增加,但各种间接研究证明,与不吸烟者相比,这一人群出现严重症状和需要机械通气的风险更高。Liu等(2020)在分析武汉地区三家三级医院收治的患者重症结局相关因素时发现,有吸烟史的患者在进展组(症状严重)中明显高于改善组(症状恢复)(27.3% vs 3%) [4].同样,在中国疫情中心武汉,男性病死率(2.8%)也高于女性(1.7%)。在意大利和西班牙等疫情严重的地区,也出现了类似的趋势,在这些地区的几例COVID-19感染病例中,58%是男性。此外,男性更容易死于该病而死亡(72%)[7].其中一个主要原因是男性吸烟率(52.1%)高于女性(2.7%)[8,9].此外,吸烟者较不吸烟者更易患上呼吸道感染,其中流感、肺结核及肺炎的发病率较高[9];这支持了将这一人群视为高危人群的理由。
上皮细胞在炎症反应中的作用:ACE2和TMPSSR2
对COVID-19发病机制的研究指出,由于病毒清除延迟,吸烟者/电子烟使用者感染疾病的危险和最终的并发症。
SARS-CoV2属于冠状病毒家族,因成像上的冠状外观而得名。这一特征归因于一种具有两个功能域(s1和S2)的糖基化细胞表面刺突(S)蛋白。ACE2已被证明是SARS-CoV2病毒进入宿主细胞的位点。病毒加标包膜的S2结构域对肺上皮上的ACE2受体具有高亲和力。有趣的是,ACE2在吸烟者(可能包括电子烟吸烟者)和服用ACE阻滞剂的人(高血压和糖尿病患者)中表达较高,从而使他们容易患病[9].此外,男性中循环的ACE2更多,这为基于性别的疾病严重程度差异提供了证据[10].ACE2可能在生殖细胞中高度表达,即男性比女性表达更多。很可能与ACE2有关烟碱乙酰胆碱受体(nachr),特别是alpha7nAChR受体进一步支持吸烟/电子烟(尼古丁)状态可能在COVID-19的病理生理学中至关重要[11].ACE2受体(发育调节的)在肺上皮细胞,特别是II型肺细胞、杯状细胞、鼻上皮/纤毛细胞和口腔粘膜细胞上大量存在[12,13,14].最近的一项研究表明,干扰素刺激的SARS-CoV-2进入反应通过ACE2和TMPSSR2蛋白酶发挥作用[15].研究表明,ACE2在吸烟者和吸烟相关疾病(如COPD和IPF)患者的小气道上皮细胞中表达上调[15,16].虽然没有经过测试,但电子烟(尼古丁)可能有类似的影响,从而使这一群体更容易受到疾病的影响。
虽然ACE2对宿主的进入很重要,但宿主细胞蛋白酶的功能是激活病毒颗粒,从而促进病毒吞噬。在这方面,TMPRSS2蛋白酶非常重要,因为ACE2利用细胞丝氨酸蛋白酶TMPRSS2进行S蛋白启动和宿主细胞进入[17].研究表明,SARS-CoV-2入境相关蛋白酶TMPRSS2在鼻纤毛细胞和杯状细胞中高度表达。多个组织的单细胞RNA测序分析表明,只有一小部分ACE2+细胞表达TMPRSS2,这表明其他蛋白酶可能发挥类似作用。在这方面,组织蛋白酶B/L也被证明是重要的[14].有趣的是,体内和临床数据表明,吸烟导致组织蛋白酶B的表达增加,这增加了吸烟者对COVID-19感染易感性的可能性[16].另一种细胞蛋白酶furin可切割SARS-CoV-2刺突蛋白的S1/S2位点,这对病毒的细胞间传播至关重要[18].吸烟会降低控制“furin”活性的丝氨酸蛋白酶抑制剂(serpin)的有效性[19,20.].此外,有证据表明,在C57BL/6小鼠中,蛇缺乏归因于病毒(甲型流感)易感性的增加[21].综上所述,这些发现表明吸烟者/电子烟使用者感染COVID-19的可能性增加。
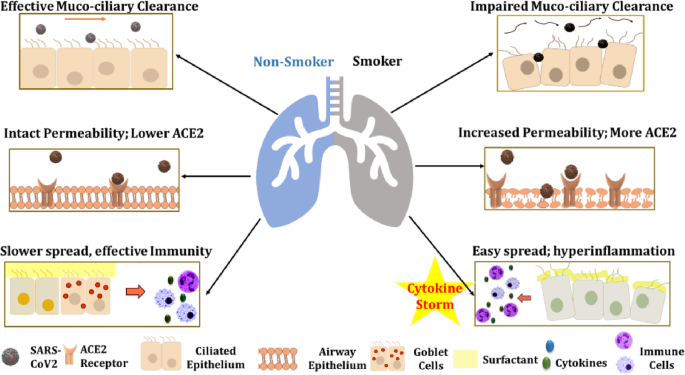
吸烟和吸电子烟还会影响紧密的屏障连接,导致上皮通透性增加(肺渗漏)。事实上,吸烟导致的结构变化包括;粘膜通透性增加,粘膜纤毛清除受损,细支气管周围炎症和纤维化(气道重塑);在吸烟者中对病毒的进入几乎没有抵抗,如图所示。1[22].
吸烟者/电子烟使用者对COVID-19易感性较高的因素。在正常人中,粘膜纤毛上皮和粘膜层是抵御外来病原体(在本例中为SARS-CoV2)的第一道防线。吸烟时,这一层被破坏,睫状体周围液(粘液;箭头所示),使它们更容易感染。吸烟者还显示ACE2受体(SARS-CoV2的结合位点)的表面表达较高,这允许病原体进入宿主细胞,并保护病毒免受宿主监测。在正常个体中,病毒感染可通过,(一个) II型肺细胞、杯状细胞、鼻上皮/纤毛细胞及口腔黏膜细胞释放的细胞因子,以及(b免疫细胞(巨噬细胞、中性粒细胞和淋巴细胞)在感染部位的浸润,以阻止进一步扩散。吸烟会削弱免疫系统,使病毒容易进入宿主细胞,病毒迅速繁殖,然后由宿主体内的“细胞因子风暴”引发高炎症反应,最终导致肺组织受损
吸烟/吸电子烟会导致肺部氧化应激和炎症反应,使吸烟者/吸电子烟者更容易受到细菌/病毒感染[23,24,25].氧化应激对上皮通透性和ACE2表达有不利影响,这可能对吸烟者/电子烟使用者产生严重影响[26,27].ACE2存在于多种亚型中,以肺部90 kDa和肾脏120 kDa为主[26].它可以通过氧化剂/羰基进行翻译后修饰。因此,由于吸烟或电子烟而产生的ROS可能会对ACE2/血管紧张素(1-7)/Mas轴产生不利影响[28].同样,香烟烟雾或电子烟气溶胶引起的氧化应激会导致上皮屏障功能障碍,从而增加膜的通透性和对病毒/细菌感染的易感性[28,29,30.(图。1).Covid-19相关基因,如ACE2和TMPRSS2在哮喘患者中受到影响,并与吸入糖皮质激素有关[31].这表明,COPD患者吸烟引起的类固醇抵抗可能会通过ACE2和TMPRSS2影响COVID-19的易感性。
SARS-CoV2感染最常见的并发症——急性呼吸窘迫综合征(ARDS)——是效应免疫细胞不受控制地释放促炎细胞因子/趋化因子导致的“细胞因子风暴”的结果[32].这些促炎介质包括IP-10、MCP-3、HGF、MIG、MIP-1α、IL-6、TNF-α、IFN-γ、IL-2、IL-7和GM-CSF。事实上,在使用体外模型研究对感染的转录反应时,Blanco-Melo等人发现,正常人类支气管上皮细胞中的SARS-CoV-2感染导致ifn介导的反应减少,同时细胞因子/趋化因子的产生增加,从而使病毒能够持续复制[33].值得关注的是,在慢性吸烟条件下,IL-6、TNF-α和其他促炎细胞因子的表达上调,而自然杀伤(NK)和CD8 T细胞的两种主要效应蛋白穿孔素和颗粒酶B的低表达水平也上调[34].此外,COVID-19患者的肺解剖显示肺毛细血管中有中性粒细胞浸润,纤维蛋白沉积,中性粒细胞外渗至肺泡间隙[35].这些观察结果表明,中性粒细胞细胞外陷阱(NETs)的形成可能导致COVID-19患者的器官损伤、肺重塑和死亡。有证据表明,吸烟影响中性粒细胞运输、NET形成、体液和细胞介导的免疫反应,如图所示。1.这可能最终导致急性呼吸窘迫综合征的易感性发展,进一步增加疾病的发病机制[35].
在这方面,重要的是要提到患有COPD或IPF等合并症的老吸烟者/电子烟使用者的易感性。已知老年患者更容易因SARS-CoV-2感染而发生肺炎和呼吸衰竭,这表明细胞衰老可能在COVID-19的疾病发病机制中发挥重要作用[35].研究表明,在老年/老年人中,调节蛋白如TRIB3 (NF-kappaB信号的负调节因子)和SIRT1(抗衰老和抗炎)的表达降低,使他们更容易感染[36,37].有趣的是,我们的研究小组发现,SIRT1在吸烟者和COPD患者肺部的表达降低了[37].这强调了SIRT1和衰老相关途径可能参与调节人类SARS-CoV-2的发病机制,从而使吸烟者/电子烟使用者感染的风险更高。此外,基因tribbles homolog 3 (TRIB3)在男性衰老过程中减少,其蛋白与病毒的核衣壳蛋白和RNA依赖聚合酶相互作用[36].
同样的情况也可能发生在使用电子烟的电子烟使用者身上。考虑到电子烟引起的肺部病理病例迅速增加,美国疾病控制与预防中心创造了“电子烟或电子烟产品使用相关肺损伤(EVALI)”这一术语,来描述急性肺损伤、急性纤维性肺炎、弥散性肺泡损伤或伴有细支气管炎的肺炎等情况。这种侮辱增加了电子烟使用者的潜在风险。相比之下,电子液体成分与肺表面活性剂,即二棕榈酰磷脂酰胆碱(DPPC)相互作用,这可能导致终端使用者的先天免疫反应。ENDS使用者气道脂质失调可使其更容易感染COVID-19 [38].此外,EVALI和COVID-19可能有相似之处,因为两者都发生间质性肺炎,导致ARDS [38].事实上,EVALI和COVID-19都以动脉氧饱和度降低和双侧肺炎为特征,因此很难检测这两种情况[39,40此外,考虑到许多COVID-19感染者并没有表现出任何疾病症状,具有EVALI的电子烟使用者有可能是COVID-19的无症状携带者[41].此外,还需要进行研究来验证COVID-19和电子烟与严重EVALI有关的假设。与EVALI相似,COVID-19患者BALF和外周血单个核细胞中几种细胞因子(CCL2/MCP-1、CXCL10/IP-10、CCL3/MIP-1A和CCL4/MIP1B)水平升高[42].
肺上皮细胞释放的外泌体/细胞外囊泡也有可能捕获SARS-CoV2及其各自的miRNA/RNA,从而引发对其他邻近细胞的细胞因子风暴,以响应吸烟[43].ACE2阳性细胞可能在病毒进入中发挥作用[44].外泌体可能是促炎的,或可用于肺部疾病的药理学研究[45,46].
治疗目标和方法
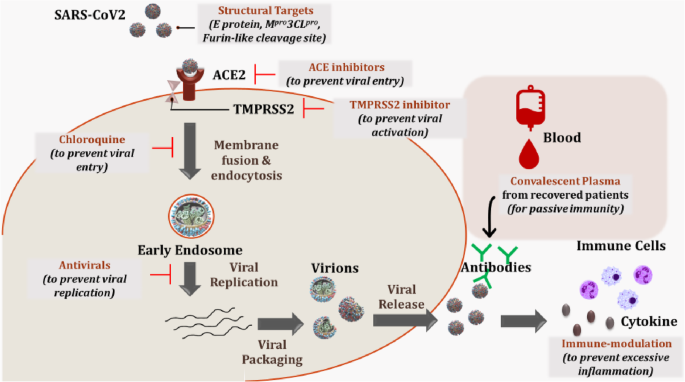
目前,对该病没有已知的治疗方法或疫苗,对该病的发病机制也知之甚少。目前正在努力设计一种抗SARS-CoV2感染的药物或疫苗[47].我们在表中根据作用机制回顾了其中一些方法1列出它们的优点和缺点。此外,图中描述了病毒进入宿主和调节其抗原性的潜在位点的图解表示。2.这些方法可以单独使用,也可以联合使用,以抗击病毒。
正在测试遏制SARS-CoV-2感染的潜在药物靶点和策略。SARS-CoV2对肺泡上皮II型肺细胞中大量存在的ACE2受体具有高度的结合亲和力。这可以被ACE抑制剂/ arb靶向。在与ACE2受体结合时,TMPRSS2蛋白酶裂解病毒S蛋白,并使病毒体进入细胞。在这里,病毒蛋白酶使内体膜的融合和病毒RNA(基因组)释放到宿主的细胞质。TMPRSS2抑制剂或抗疟疾药物(氯喹/羟氯喹)可防止这种吞噬。病毒RNA现在劫持宿主的翻译机制来表达病毒蛋白,并进一步实现病毒复制和包装。这是目前正在进行临床试验的各种抗病毒药物的作用部位。病毒RNA和蛋白质被包装成病毒粒子,最终被释放到细胞外空间,在那里它导致促炎细胞因子/趋化因子的释放和免疫细胞的浸润。据推测,COVID-19患者的疾病严重程度与免疫反应增强有关,因此免疫调节是预防严重后果的替代方法之一。 Alternate approaches like targeting viral structural targets or use of convalescent plasma to induce passive immunity are other strategies which are being explored at present
到目前为止出现的最重要的目标是ACE2。它是病毒附着在宿主细胞上的部位,也是可能受吸烟影响的肺上皮细胞病毒的第一个入口。因此,靶向ACE受体结合是遏制SARS-CoV2最流行的策略[9].然而,ACE2是肾素-血管紧张素系统的关键调节剂,目前尚不清楚其在COVID-19患者中的抑制作用。据认为,使用这些药物可能会加重病情。此外,由于ACE2多态性或异构体,一些个体可能在遗传上倾向于这种疾病,这可能很难使用这种方法进行监测[49].总体而言,目前尚无临床证据证明血管紧张素转换酶(ACE)抑制剂或血管紧张素II型1受体阻阻剂(arb)治疗COVID-19感染的有效性[60].
当ACE2与病毒S2结构域结合时,有各种膜蛋白酶的作用是激活病毒进入宿主细胞的内化。特别是TMPRSS2,已被证明在这方面至关重要。事实上,tmprss2介导的病毒激活和进入已被报道用于其他冠状病毒和流感病毒[50].体外研究发现,使用甲磺酸卡莫司他阻断TMPRSS2活性,可部分抑制SARS-CoV2进入肺上皮细胞,使其成为药物开发的潜在靶点[17].然而,不利的一面是,报告表明,在冠状病毒的情况下,TMPRSS2并不仅仅负责宿主细胞的进入。似乎许多其他蛋白酶(Cathepsin L, TTSP家族成员)也可以起到类似的作用[51].
抗疟疾药物氯喹和羟氯喹也在针对SARS-CoV2感染进行测试。由于羟氯喹已获得批准,并已证明该药物对COVID-19的有效性相对安全,因此已计划使用羟氯喹进行临床试验。早期临床研究支持羟−/氯喹在降低病毒载量和缩短疾病持续时间方面的疗效,但此类研究规模较小,且不可靠[52,53,54,61].
靶向SARS-CoV2结构可能是预防病毒感染的一种成功策略。在这方面,许多研究小组已经确定了一些潜在的病毒结构靶点,如SARS-CoV2蛋白酶、蛋白E或呋喃样S1/S2切割位点以及RNA聚合酶[57,58,59].然而,了解这种病毒结构独特性的研究正在进行中,使用这种方法开发一种潜在的药物可能需要一些时间。
抗病毒药物(如remdesivir和favipiravir)是另一组目前正在进行临床试验的药物,并显示出有希望的结果[62,63].这些药物的作用方式各不相同。例如,瑞德西韦是一种腺苷类似物,可以抑制RNA聚合酶,从而防止病毒复制。同样,favipiravir是RNA聚合酶诱变剂[55].防止病毒传播的另一种方法可能是针对宿主的免疫反应。研究表明,COVID-19患者遭受了以IL-6水平升高为特征的细胞因子风暴[47].在使用体外模型研究宿主对病毒的免疫反应时,降低的先天抗病毒防御加上旺盛的炎症细胞因子产生被证明。考虑到这一点,针对IL-6结合或IFN-1信号通路的免疫调节技术可能是预防感染的合适补救措施[33].类似地,已知HLA单倍型对人类感染的不同易感性负责。CD4+或CD8+T细胞识别病毒抗原,发起免疫反应。研究与抗sars - cov -2免疫发展相关的HLA位点以诱导保护性免疫可能是对抗病毒的一种有效方法[64].然而,这样的研究需要谨慎进行,因为免疫调节可能有严重的副作用[65].最后,几家制药公司正在测试使用恢复期血清,从康复患者的恢复期血浆中制备抗SARS-CoV2抗体制剂;但如表中所述,使用它有风险1[56].
结论与未来方向
总之,更好地识别易感人群(特别是有吸烟和电子烟史的人)及其早期检测,以及针对ACE2受体(及其异构体)、表面蛋白酶和其他免疫/炎症靶点,可能是管理这种大流行传播和进一步感染的主要改变因素。尽管许多问题仍未得到解答,需要在未来的研究中加以考虑。考虑到许多患有气道阻塞的吸烟者/戒烟者表现出类固醇耐药(例如,严重哮喘和慢性阻塞性肺病患者),必须重新考虑使用类固醇治疗COVID-19。目前尚不清楚疾病的严重程度是由于促炎反应的过度产生或抗炎介质(促炎介质)的减少,影响肺泡炎症,还是由于衰老肺部的分泌相关衰老表型(SASP)。衰老细胞可能含有RNA成分或RNA病毒可能劫持宿主细胞,并释放含有促炎miRNA和/或病毒基因组/刺突蛋白/ACE2受体的外泌体/细胞外囊泡。仔细检查巨噬细胞对COVID-19感染的反应,评估表型转换可能是未来的兴趣所在。NETs在肺泡炎症中的作用、上皮通透性的作用以及蛋白酶在SARS-Cov2上皮进入中的作用有待进一步研究。此外,这种感染对康复人群的健康影响仍然未知(例如,他们是否会在一段时间内发生更多的复发性感染和肺重塑/修复受损,导致肺纤维化)。鉴于ACE2多态性,遗传和表观遗传因素在控制疾病易感性中的作用(特别是在高血压患者中)是指导未来研究的另一个考虑因素。总的来说,了解SARS-CoV2感染与随后肺部细胞因子风暴肺炎的发病机制,并确定新兴的治疗策略,将为这种毁灭性疾病提供及时的治疗。
数据和材料的可用性
不适用。由于这是一篇综述文章,没有可用的数据。
缩写
- COVID-19:
-
2019冠状病毒病
- SARS-CoV2:
-
严重急性呼吸综合征冠状病毒
- ACE2:
-
血管紧张素转换酶2
- ARDS:
-
急性呼吸窘迫综合征
- 慢性阻塞性肺病:
-
慢性阻塞性肺疾病
- “非典”:
-
严重急性呼吸系统综合症
- 即:
-
中东呼吸综合征
- TMPRSS2:
-
跨膜蛋白酶丝氨酸2
- TTSP:
-
2型跨膜丝氨酸蛋白酶
- NET:
-
中性粒细胞细胞外陷阱
- HLA:
-
人白细胞抗原
参考文献
周峰,于涛,杜锐,范刚,刘勇,刘震,等。中国武汉成人COVID-19住院患者的临床病程和死亡危险因素:一项回顾性队列研究《柳叶刀》2020;395(10229):1054-62。
陈福宇、袁绍、郭锦辉、杜凯旺、朱宏、杨洁、邢飞、刘俊、叶志欣、潘永山R、蔡华威、罗锦辉S、陈锦辉、潘国文V、陈文敏、叶俊杰、蔡继鹏、郑志忠V、陈宏、许锦明C、袁锦勇。与2019年新型冠状病毒相关的家庭聚集性肺炎表明人传人:对家庭聚集性的研究。《柳叶刀》杂志。2020;395:514-23。
于萍,朱军,张震,韩艳,黄磊。2019新型冠状病毒感染相关的家族性聚集性感染,提示潜伏期潜在的人传人。中国传染病杂志,2020;
刘伟,陶志伟,雷伟,尹明丽,奎林,凌志,等。2019年新型冠状病毒病住院患者疾病转归相关因素分析中华医学杂志(英文版);2020;37(4):344 - 344。
杜勇,涂林,朱鹏,穆明,王锐,杨鹏,等。武汉市85例COVID-19死亡病例临床特征的回顾性观察研究Am J呼吸危重护理医院,2020年。https://doi.org/10.1164/rccm.202003-0543OC.
Salako O, Okunade K, Allsop M, Habeebu M, Toye M, Oluyede G,等。COVID-19疫情期间癌症护理的剧变。Ecancermedicalscience。2020;14:ed97。
黄超,王勇,李霞,等。中国武汉2019新型冠状病毒感染患者的临床特征[发表于《柳叶刀》,2020年1月30日]。《柳叶刀》2020;395(10223):497-506。
里皮G,亨利BM。主动吸烟与2019冠状病毒病(COVID-19)的严重程度无关。欧洲实习医学2020;75:107-8。
Brake SJ, Barnsley K, Lu W, McAlinden KD, Eapen MS, Sohal SS.吸烟上调血管紧张素转换酶2受体:新型冠状病毒SARS-CoV-2 (Covid-19)的潜在粘附位点。中华临床医学杂志2020;9(3):841。
Sama IE, Ravera A, Santema BT, van Goor H, ter Maaten JM, Cleland JGF,等。男性和女性心力衰竭患者循环血浆血管紧张素转换酶2浓度及肾素-血管紧张素-醛固酮抑制剂的影响。欧洲心脏杂志,2020;41:1810-7。
王q, Sundar I, Li D, Lucas J, Muthumalage T, McDonough S, Rahman I. nAChR α7受体介导电子烟诱导的肺部炎症和修复异常:nAChR α7在ACE2 Covid-19受体调控中的作用呼吸Res. 2020。https://doi.org/10.21203/rs.2.23829/v2.(预印)。
徐红,钟琳,邓洁,彭洁,丹红,曾旭,等。新型冠状病毒ACE2受体在口腔黏膜上皮细胞高表达。中华口腔医学杂志2020;12(1):8。
齐格勒CGK, Allon SJ, Nyquist SK,等。SARS-CoV-2受体ACE2是人类气道上皮细胞中的干扰素刺激基因,在组织中的特定细胞亚群中被检测到[2020年4月27日在线发表]。细胞。2020;s0092 - 8674(20) 30500 - 6。
宋娜克,黄宁,贝卡文C, Berg M, Queen R, Litvinukova M,等。SARS-CoV-2进入因子与先天免疫基因在鼻上皮细胞中高度表达。中华医学杂志2020;26(5):681-7。
梁建明,杨春霞,谭a, Shaipanich T, Hackett TL, Singhera GK,等。吸烟者和COPD患者小气道上皮组织中ACE-2的表达:对COVID-19的影响中国生物医学工程学报,2010;29(5):366 - 366。
史密斯JC,谢尔策JM。香烟烟雾会引发呼吸道上皮细胞亚群的扩张,这些细胞表达SARS-CoV-2受体ACE2。bioRxiv。2020.https://doi.org/10.1101/2020.03.28.013672.(预印)。
Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S,等。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。科学通报。2020;21(2):369 - 369。
Hoffmann M, Kleine-Weber H, Pohlmann S. SARS-CoV-2刺突蛋白的多碱基切割位点是感染人肺细胞的必要位点。中国生物医学工程学报,2015;29 (4):369 - 374 .e5。
罗克特,范·德马克,顾伊,施韦策,斯格阿,卡莫奇,等。香烟烟雾暴露和结构改变对α -1抗胰蛋白酶与caspases相互作用的影响。《医学杂志》2012;18:45 - 54。
刘刚,向勇,蔡振杰,等。α - 1抗胰蛋白酶波特兰,一种生物工程蛇毒蛋白高选择性呋喃:应用作为一种抗病原体。中国科学院学报(自然科学版),1998;26(3):344 - 344。
Dittmann M, Hoffmann HH, Scull MA, Gilmore RH, Bell KL, Ciancanelli M,等。一种蛇毒蛋白形成细胞外环境,以防止流感病毒成熟。细胞。2015;160(4):631 - 43。
Arcavi L, Benowitz NL。吸烟与感染。中华外科杂志2004;26(4):416 - 416。
Bauer CMT, Morissette MC, Stämpfli MR.吸烟对病毒感染的影响:将实验科学转化为影响COPD发病机制和COPD急性加重的临床。胸部。2013;143(1):196 - 206。
姚海涛,张晓明,张晓明,等。慢性阻塞性肺疾病发病机制中氧化/羰基应激、炎症和表观遗传学的研究进展。中国药物学杂志。2011;26(2):344 - 344。
黄志华,李志强,李志强,等。吸入电子烟会改变先天免疫和气道细胞因子,同时增加定植细菌的毒性。J Mol医学(Berl)。2016, 94(6): 667 - 79。
Wiener RS, Cao YX, Hinds A, Ramirez MI, Williams MC.血管紧张素转换酶2主要是上皮性的,在小鼠肺中受到发育调控。中国生物医学工程学报,2007;29(5):344 - 344。
孟杨,李涛,周广胜,陈勇,于超,庞明明,等。血管紧张素转换酶2/血管紧张素(1-7)/mas轴通过抑制nox4衍生的ros介导的RhoA/rho激酶途径来保护肺成纤维细胞迁移和肺纤维化。抗氧化氧化还原信号。2015;22(3):241-58。
Muthumalage T, Lamb T, Friedman MR, Rahman I.电子烟味豆荚诱导炎症、上皮屏障功能障碍和肺上皮细胞和单核细胞DNA损伤。科学通报2019;9(1):19035。
张志强,张志强,张志强,等。香烟烟雾诱导人表皮受体2依赖性上皮通透性变化。中国生物医学工程学报,2016;29(6):344 - 344。
Aghapour M, Raee P, Moghaddam SJ, Hiemstra PS, Heijink IH。慢性阻塞性肺疾病中气道上皮屏障功能障碍:吸烟暴露的作用。中国生物医学工程学报,2018;29(2):379 - 379。
Peters MC, Sajuthi S, Deford P, Christenson S, Rios CL, Montgomery MT,等。哮喘患者痰细胞中COVID-19相关基因:与人口统计学特征和皮质类固醇激素的关系[2020年4月29日在线出版前发布]。Am J呼吸危重护理医院,2020年。https://doi.org/10.1164/rccm.202003-0821OC.
李霞,耿敏,彭勇,孟l,陆松。COVID-19分子免疫发病机制与诊断。中国医药杂志。2020;10(2):102-8。
Blanco-Melo D, Nilsson-Payant BE, Liu W-C, Møller R, Panis M, Sachs D,等。SARS-CoV-2在体外、体外和体内系统中启动独特的转录签名。bioRxiv。2020.https://doi.org/10.1101/2020.03.24.004655.(预印)。
De Cunto G, Lunghi B, Bartalesi B, Cavarra E, Fineschi S,等。外周T细胞数量和功能的严重减少并不能对香烟烟雾诱导的小鼠肺气肿和支气管重塑提供保护。中国生物医学工程学报。2016;36(7):344 - 344。
巴内斯·布j,阿德罗孚,巴克斯特·斯托茨弗斯,等。针对COVID-19的潜在驱动因素:中性粒细胞细胞外陷阱。中华检验医学杂志,2020;21 (6):e20200652。https://doi.org/10.1084/jem.20200652.
de Moraes D, Paiva BVB, Cury SS,初级JPA, da Silva Mori MA, Carvalho RF。肺衰老过程中SARS-CoV与宿主蛋白相互作用的预测揭示了TRIB3在COVID-19中的潜在作用。bioRxiv。2020.https://doi.org/10.1101/2020.04.07.030767.(预印)。
Rajendrasozhan S, Yang SR, Kinnula VL, Rahman I. SIRT1是一种抗炎和抗衰老蛋白,在慢性阻塞性肺疾病患者肺部表达降低。中华呼吸急救杂志。2008;17(8):861-70。
Chand HS, Muthumalage T, Maziak W, Rahman I.电子烟或电子烟产品的肺毒性和病理生理学,使用相关的肺损伤。《前沿药典》2019;10:1619。
Salzman GA, Alqawasma M, Asad H.电子烟相关肺损伤(EVALI):一种爆炸性的美国流行病。中华医学杂志2019;116(6):492-6。
Marini JJ, Gattinoni L.对COVID-19呼吸窘迫的管理。《美国医学协会杂志》上。2020.2020年4月24日在线发布。https://doi.org/10.1001/jama.2020.6825.
甘地M,横尾DS,哈弗尔DV。无症状传播是当前控制Covid-19战略的致命弱点。英国医学,2020年。2020年4月24日在线发布。https://doi.org/10.1056/NEJMe2009758.
熊勇,刘勇,曹林,王东,郭明,蒋安,等。COVID-19患者支气管肺泡灌洗液和外周血单个核细胞的转录组特征新兴微生物感染。2020;9(1):761-70。
孙志强,李德华,李志强。慢性阻塞性肺疾病患者血浆来源的细胞外囊泡mirna作为循环生物标志物的小rna序列分析。中国生物医学工程学报。2019;26(1):457 - 457。
Gordon C, Gudi K, Krause A, Sackrowitz R, Harvey BG, strulovi - barel Y,等。循环内皮微粒作为吸烟者早期肺破坏的测量方法。中华呼吸急救杂志,2011;29(2):344 - 344。
肺疾病中的细胞外囊泡。胸部。2018;153(1):210 - 6。
马丽萍,李志强,李志强,等。间充质干细胞和间充质干细胞来源的外泌体对吸烟所致小鼠线粒体功能障碍的保护作用。毒物应用药物。2019;385:114788。
桑德斯JM, Monogue ML, Jodlowski TZ, Cutrell JB。2019冠状病毒病(COVID-19)的药物治疗综述《美国医学协会杂志》上。2020; 323:1824-36。
Gordon DE, Jang GM, Bouhaddou M,等。SARS-CoV-2蛋白相互作用图揭示了药物再利用的靶点。自然》2020。https://doi.org/10.1038/s41586-020-2286-9.
方琳,Karakiulakis G, Roth M.高血压和糖尿病患者感染COVID-19的风险增加吗?《呼吸医学》2020;8(4):e21。
Stopsack KH, Mucci LA, Antonarakis ES, Nelson PS, Kantoff PW。TMPRSS2和COVID-19:意外还是干预的机会?[2020年4月10日在线出版前发布]。癌症发现,2020年。https://doi.org/10.1158/2159-8290.CD-20-0451.
Simmons G, Zmora P, Gierer S, Heurich A, Pohlmann S. sars冠状病毒刺突蛋白的蛋白水解激活:抗病毒研究前沿的切割酶。中国生物医学工程学报,2013;30(3):344 - 344。
Savarino A, Boelaert JR, Cassone A, Majori G, Cauda R.氯喹对病毒感染的影响:一种对抗当今疾病的老药?《柳叶刀》感染杂志2003;3(11):722-7。
李志强,李志强,李志强,等。羟氯喹和阿奇霉素治疗COVID-19:一项开放标签非随机临床试验结果[2020年3月20日在线出版前发布]。国际抗菌药物杂志。2020;105949。https://doi.org/10.1016/j.ijantimicag.2020.105949.
Ledford H.氯喹的炒作正在破坏对冠状病毒治疗方法的研究。大自然。2020;580(7805):573。
董玲,胡松,高洁。新型冠状病毒病(COVID-19)治疗药物的发现。药物发现,2020;14(1):58-60。
Casadevall A,洛杉矶Pirofski。用于控制COVID-19的恢复期血清。J clinin Invest, 2020; 130:1545-8。
张磊,林丹,孙旭,Curth U, Drosten C, Sauerhering L,等。SARS-CoV-2主蛋白酶的晶体结构为设计改进的-酮酰胺抑制剂提供了基础。科学。2020;368:409-12。
Regla-Nava JA, Nieto-Torres JL, Jimenez-Guardeno JM, Fernandez-Delgado R, Fett C, Castano-Rodriguez C,等。具有E蛋白突变的严重急性呼吸综合征冠状病毒是减毒的和有希望的候选疫苗。中国病毒学杂志,2015;89(7):3870-87。
Coutard B, Valle C, de Lamballerie X, Canard B, Seidah NG, decly E.新型冠状病毒2019-nCoV的刺突糖蛋白含有相同分支的冠状病毒所没有的糠醛样裂解位点。Antivir Res. 2020;176:104742。
王晓明,王晓明,王晓明。2019冠状病毒病(COVID-19)感染和肾素血管紧张素系统阻滞剂。[2020年4月3日在线出版前发布]。JAMA Cardiol, 2020。https://doi.org/10.1001/jamacardio.2020.1282.
孙勇,孙志强,朱克,李志强,等。羟氯喹在新冠肺炎住院患者中的观察性研究。英国医学,2020年。2020年5月7日在线发售。https://doi.org/10.1056/NEJMoa2012410.
曹斌,王勇,文东,刘伟,王杰,范刚,等。洛匹那韦-利托那韦在重症Covid-19住院成人中的临床试验中华实用医学杂志,2015;29(4):344 - 344。
郭志刚,张志刚,张志刚,张志刚,等。同情地使用瑞德西韦治疗重症Covid-19患者。[2020年4月10日在线出版前发布]。南京大学学报(医学版)2020;https://doi.org/10.1056/NEJMoa2007016.
石勇,王勇,邵超,黄军,甘军,黄霞,等。COVID-19感染:免疫反应的观点。细胞死亡差异。2020;27(5):1451-4。
Bascones-Martinez A, Mattila R, Gomez-Font R, Meurman JH。免疫调节药物:口服和全身不良反应。中华口腔医学杂志。2014;19(1):e24-31。
确认
一个也没有。
资金
这项研究得到了美国国立卫生研究院R01 HL135613和R01 ES029177的支持。
作者信息
作者及隶属关系
贡献
GK:写作和编辑;GL:审查和编辑,IR:概念化,写作,审查和编辑。所有作者均已阅读并同意该手稿的出版版本。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
一个也没有。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Kaur, G., Lungarella, G.和Rahman, I.吸烟和电子烟导致的COVID-19易感性和肺部炎症风暴。J Inflamm17, 21(2020)。https://doi.org/10.1186/s12950-020-00250-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12950-020-00250-8
关键字
- 新型冠状病毒肺炎
- ACE2
- SARS-CoV2
- 吸烟
- 特许经销商
- 电子烟
- 炎症