摘要
目的
骨关节炎(OA)是一种常见的关节疾病,以软骨退变、滑膜炎症、骨赘和软骨下骨硬化为特征。本研究通过SIRT1/FOXO1途径探讨白藜芦醇(RES)对OA发病过程中细胞外基质(ECM)、自噬和凋亡的影响。
方法
在原代Wistar大鼠软骨细胞中添加10 ng/mL IL-1β,体外刺激OA软骨细胞微环境。采用Western blotting、免疫荧光、实时荧光定量PCR和透射电镜(TEM)进行分析。
结果
在IL-1β存在的情况下,RES增加了沉默信息调节因子(SIR) 1蛋白的表达和叉头转录因子(FOXO) 1的磷酸化水平。促进软骨细胞自噬,增加SOX9和aggrecan的表达,抑制软骨细胞凋亡和基质分解,保护软骨细胞免受IL-1β损伤。在加入SIRT1抑制剂或FOXO1抑制剂后,RES对软骨细胞的保护作用明显减弱。我们的结果表明,RES通过SIRT1/FOXO1途径调节OA软骨细胞的ECM代谢、自噬和凋亡,以改善il -1β诱导的软骨细胞损伤。
结论
RES通过激活SIRT1/FOXO1信号通路保护软骨细胞免受il -1β诱导的损伤,并在OA治疗中具有潜力。
简介
骨关节炎(OA)是一种慢性关节疾病,可导致慢性疼痛和关节功能受限。目前的治疗方案不能逆转骨性关节炎的进展,只能改善患者的关节疼痛。退行性软骨改变是骨性关节炎的主要病理改变[1,2,3.,4,5].正常情况下,软骨细胞外基质(ECM)代谢处于动态平衡状态。在OA中,软骨细胞分解代谢相关酶的活性增加,包括基质金属蛋白酶(MMPs)和A分解素和金属蛋白酶与血栓反应蛋白motif (ADAMTS) [6,7].慢病毒介导的SOX9过表达可下调一些分解代谢蛋白的水平,包括MMP13和ADAMTS5 [8].因此,维持或加强SOX9在软骨细胞中的表达可能是软骨组织再生或延缓OA进展的重要治疗方法。
关节软骨细胞自噬与凋亡的失衡是OA病理进展的重要组成部分,OA关节软骨细胞凋亡水平显著升高,自噬水平显著降低[9,10].自噬对维持细胞正常功能至关重要,主要通过调节细胞代谢和清除受损细胞器的细胞[11].因此,调节软骨细胞自噬与凋亡水平之间的平衡被认为是治疗OA的有效途径。
沉默信息调节因子(SIR)基因家族显著影响基因沉默、基因组稳定性和细胞寿命。SIRT1促进小鼠关节软骨细胞基质合成,提示其也是软骨代谢的干预靶点[12].叉头转录因子(FOXO)家族包括四个成员,FOXO1, FOXO3, FOXO4和FOXO6。其中,FOXO1对软骨细胞影响最大,在调节软骨细胞发育、衰老、氧化应激等方面具有重要功能[13].
白藜芦醇(RES)是多酚类化合物中最强的SIRT1激活剂[14],有必要进一步研究SIRT1和FOXO1在RES抗oa作用中的作用。本文通过体外模拟OA软骨细胞,研究RES对OA软骨细胞的影响。RES通过SIRT1/FOXO1通路对软骨的影响,为阐明骨性关节炎的发病机制,寻找有效的预防和治疗措施提供了理论依据。
材料与方法
临床软骨标本
3例骨性关节炎软骨组织取自武汉大学人民医院行膝关节或髋关节置换术的骨性关节炎患者。2名男性,4名女性,年龄61-76岁(平均年龄72.39±3.57岁),从股骨颈骨折行髋关节置换术的患者中获得正常软骨组织。所有患者均知情同意,研究获得武汉大学伦理委员会批准。
软骨细胞的处理和培养
我们从两周大的Wistar大鼠膝关节分离软骨细胞。双侧膝关节软骨组织提取,在无菌环境下用剪刀切割。将软骨浸泡在0.1%胰蛋白酶(Beyotime,上海,中国)中60分钟,然后在细胞培养箱中用0.2% II型胶原蛋白(Sigma,圣路易斯,密苏里州,美国)孵育过夜。收集消化后的细胞,重悬于软骨细胞培养基(DMEM/F-12)中进行培养(BI, Kibbutz Beit Haemek, Israel)。然后将培养基中的软骨细胞置于细胞培养箱中传代。随后使用第二代软骨细胞进行实验。为了抑制SIRT1/FOXO1信号通路,将血清饥饿软骨细胞分别用SIRT1抑制剂EX-527 (10 μM/mL)或FOXO1抑制剂AS (1 μM/mL)预处理6 h,然后在白藜芦醇(50 μM)存在或不存在的情况下暴露于IL-1β (10 ng/mL)中24 h。
透射电子显微镜(TEM)
细胞分为5组:IL-1β组、对照组、IL-1β + RES组、IL-1β + RES + AS组和IL-1β + RES + EX-527组。用2.5%戊二醛固定软骨细胞3-4小时,然后用细胞刮板刮除。然后,加入2.5%戊二醛,在4°C下浸泡2-4小时,然后用0.1 M磷酸盐缓冲液漂洗三次。将混合物在室温(20℃)下固定2小时,再次漂洗。最后依次进行脱水、渗透、包埋、切片、染色,并进行电镜检查(HITACHI, Japan/FEI, USA)。
免疫荧光染色
将软骨细胞在4%的多聚甲醛中固定20分钟,然后用PBS清洗,吸干,用磷酸Tween 20缓冲液(PBST)渗透20分钟。在室温下加入体积分数5%的胎牛血清白蛋白。滴加稀释的一抗胶原蛋白(Affinity, AF0135)(1:1500)和p-FOXO1 (Affinity, AF3416)(1:1000),然后在4℃孵育过夜。洗涤三次后,滴加稀释的山羊抗兔IgG抗体(Affinity, AF0135)(1:5000)。样品在37°C的湿箱中孵育1小时,用PBS洗涤三次。加入DAPI溶液,倒置荧光显微镜成像。实验分为三个重复。
实时定量PCR
分析aggrecan、MMP13、ADAMTS5、SOX9、SIRT1 FOXO1、LC3、ATG5、BAX、Beclin 1、caspase-3、Bcl-2 mRNA水平。采用TRIzol试剂(Ambion, China)提取细胞总RNA。cDNA合成试剂盒(VAZYME,南京,中国)用于合成互补链DNA。使用SYBR Premix ExTaq试剂盒(VAZYME,南京,中国)扩增目标基因。用于实时定量PCR的寡核苷酸引物见表1.
蛋白质提取和western blotting
western blotting检测软骨细胞中SIRT1、FOXO1、ADAMTS5、SOX9、aggrecan、caspase-3、p-FOXO1、BAX、MMP13、BCL-2蛋白表达水平。细胞培养24小时后,加入细胞裂解液溶解软骨细胞,然后提取蛋白,并使用BCA蛋白水平检测试剂盒(Beyoncé,中国)检测目标蛋白水平。蛋白质被分离并储存在−20°C。随后,电泳,转移,在温封闭溶液中浸泡1小时,并与一抗孵育过夜。清洗膜,用二抗(酶标羊抗兔,武汉博斯特生物科技有限公司)(1:5万)孵育1小时。再次洗涤后,化学发光检测蛋白,x射线曝光显影。以GAPDH作为内源性蛋白进行可视化和标准化。用ImageJ软件进行密度分析。在相同的实验条件下,该过程重复了三次。所使用的抗体信息列于表中2.
细胞增殖CCK-8试剂盒
使用Cell Counting Kit-8 (CCK-8, MCE, China)检测不同RES浓度对软骨细胞生长的影响。将软骨细胞分为6组,分别用0、25、50、100、200和400 μM的RES处理。软骨细胞以1 × 10浓度放置于96孔板中5在37°C的细胞培养箱中培养至第二天。然后用不同浓度的RES处理各组软骨细胞24小时。在RES处理前3小时将CCK-8溶液插入培养孔中,再孵育4小时。实验重复三次。
TUNEL分析
采用TUNEL分析检测软骨细胞凋亡情况。将软骨细胞分为对照组、IL-1β、IL-1β + RES、IL-1β + RES + AS、IL-1β + RES + EX-527组。TUNEL染色按照制造商说明书(Roche, IN, USA)进行。凋亡细胞在荧光显微镜下成像和测量。使用Image J 8.0从每个样本中随机选择三个切片的三个视场来量化阳性细胞的数量。
试剂
白藜芦醇(RES, no。R107315, CAS: 501-36-0,纯度99%),selisistat (EX-527, no.;S1541,纯度99%),AS1842856 (AS,编号:;88222, 99%纯度)采购自麦克林生物技术(中国上海)。
统计分析
所有实验重复三次。数据以均数±标准差表示。图表使用GraphPad Prism 8.0 (GraphPad Software Inc., CA, USA)生成。两组或多组之间的差异由Student 's进行检验t分别为检验或方差分析。值为p< 0.05为差异有统计学意义。
结果
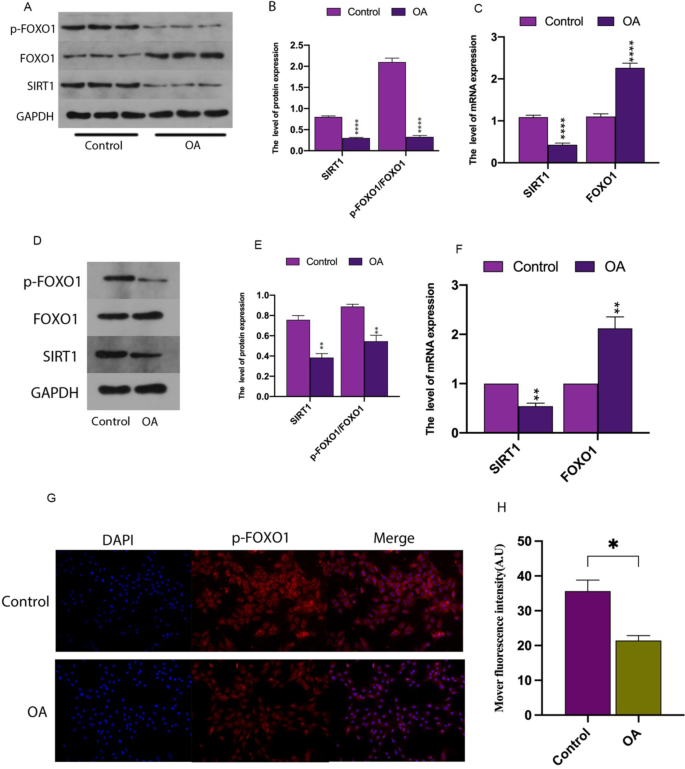
基于临床标本的OA软骨SIRT1/FOXO1通路下调
我们检测了SIRT1的表达水平(图2)。1A-C), FOXO1(图1A-C)和p-FOXO1(图;1A, B,在正常情况下(n= 3)和OA软骨(n= 3)组织使用实时定量PCR、蛋白印迹和免疫荧光技术证实SIRT1/FOXO1通路的低激活与OA的发生有关。此外,软骨细胞暴露于IL-1β (10 ng/mL) 24 h,以模拟体外OA微环境。如图所示,SIRT1的表达水平(图;1D-F), FOXO1(图;1D-F)和p-FOXO1(图;1D, E, G, H)与OA软骨的结果一致。以上结果提示SIRT1/FOXO1通路低表达与OA发生有关。
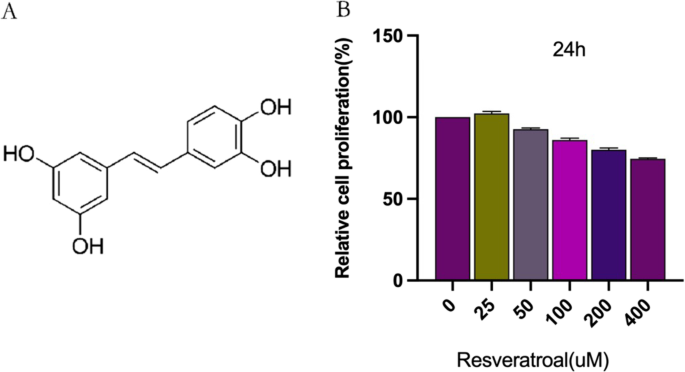
RES对软骨细胞增殖的影响
RES分子结构如图所示。2A.采用CCK-8法研究RES对软骨细胞的细胞毒性。如图所示。1B,用不同浓度(0、25、50、100、200和400 μ M)的RES处理软骨细胞24小时。选择对细胞无毒的最大RES浓度,定义为细胞存活率> 90%。这被发现是50µM(图。2B)。
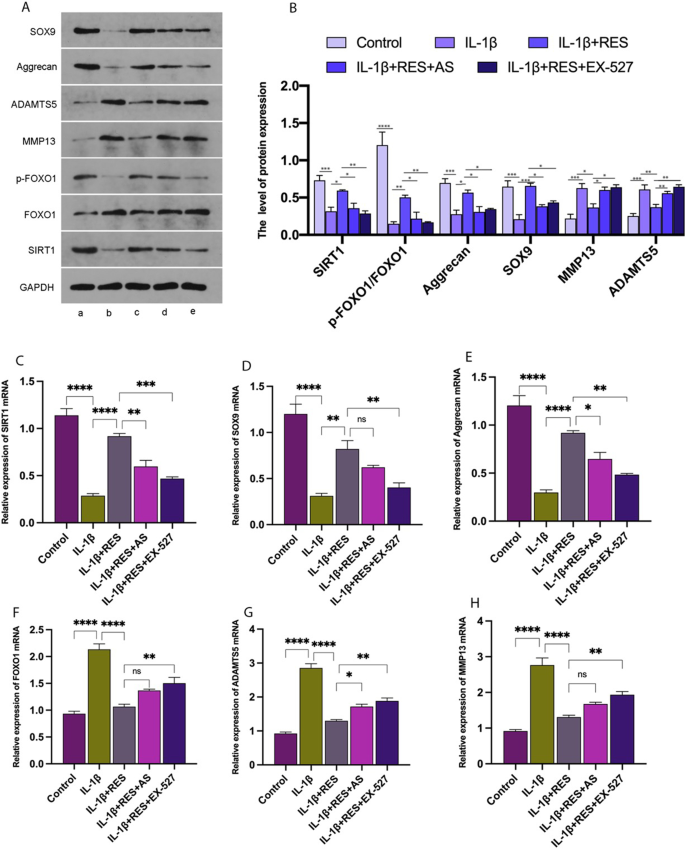
RES通过SIRT1/FOXO1途径减弱il -1β诱导的软骨细胞损伤
我们的研究发现RES激活了IL-1β培养的软骨细胞中的SIRT1,增加了p-FOXO1和FOXO1的表达。当il -1β培养的细胞受到RES、AS或RES和EX-527的影响时,SIRT1和p-FOXO1的蛋白和mRNA表达水平被抑制。令人惊讶的是,加入EX-527后,SIRT1和p-FOXO1蛋白的表达水平在软骨细胞中受到一定程度的抑制,提示SIRT1和FOXO1之间存在调控关系。通过检测MMP13、ADAMTS5、aggrecan和SOX9的表达,我们进一步研究了RES对il -1β诱导的软骨细胞的影响。实时荧光定量PCR和western blot结果显示聚合蛋白和mRNA水平(图2)。3.A, B, E)和SOX9(图。3.与对照组相比,il -1β诱导的软骨细胞A, B, D)显著降低;MMP13 mRNA和蛋白表达水平(图;3.A, B, H)和ADAMTS5(图。3.A, B, G)增加。与IL-1β诱导的软骨细胞相比,RES组(RES + IL-1β)聚集蛋白和mRNA的表达水平明显增强(图2)。3.A, B, E)和SOX9(图。3.A, B, D)。RES显著降低了MMP13蛋白和mRNA的表达水平(图。3.A, B, H)和ADAMTS5(图。3.A, B, G),归因于il -1β诱导的软骨细胞ECM分解的成功衰减。与RES组相比,在RES组中加入SIRT1抑制剂EX-527或FOXO1抑制剂AS可显著降低聚集蛋白和mRNA水平(图2)。3.A, B, E)和SOX9(图。3.A, B, D),并增加MMP13的mRNA和蛋白水平(图。3.A, B, H)和ADAMTS5(图。3.A, B, G)。RES对软骨细胞的保护作用明显减弱。由此可见,RES通过SIRT1/FOXO1通路有效缓解il -1β诱导的软骨细胞损伤,维持软骨细胞稳态。
RES通过SIRT1/FOXO1途径减弱il -1β诱导的软骨细胞损伤。一个Western blot结果显示靶蛋白SIRT1、FOXO1、p-FOXO1、aggrecan、SOX9、MMP13和ADAMTS5的表达与SIRT1/FOXO1通路和凋亡相关。B用GAPDH归一化方法定量SIRT1、FOXO1、p-FOXO1、aggrecan、SOX9、MMP13和ADAMTS5的相对表达量。C- - - - - -H采用实时荧光定量PCR检测软骨细胞中SIRT1、FOXO1、p-FOXO1、aggrecan、SOX9、MMP13、ADAMTS5 mRNA的表达水平。一个- - - - - -e分别对应对照、IL-1β、IL-1β + RES、IL-1β + RES + AS、IL-1β + RES + EX-527。AS = FOXO1抑制剂,EX-527 = SIRT1抑制剂。所有数据均以均数±SEM (n= 3), *p< 0.05;**p< 0.01;***p< 0.001;****p< 0.0001
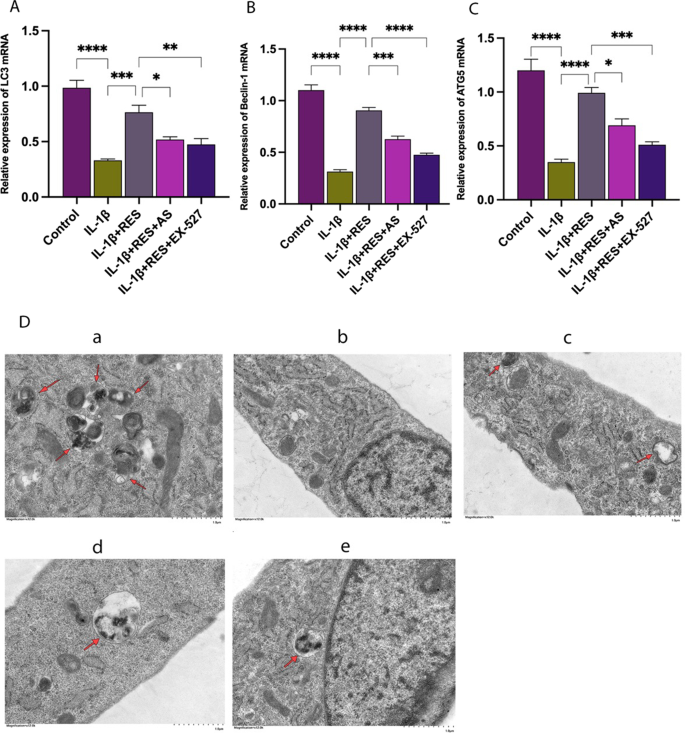
白藜芦醇通过SIRT1/FOXO1途径改善il -1β诱导的软骨细胞自噬
我们利用实时PCR和透射电镜研究了RES对il -1β组软骨细胞自噬水平的影响。自噬相关基因LC3的mRNA水平(图;4A), ATG5(图;4C)和Beclin 1(图;4B)与正常软骨细胞相比,il -1β诱导的软骨细胞明显减少。RES组(RES + IL-1β)与IL-1β组相比,IL-1β诱导的软骨细胞中自噬相关基因的表达水平显著升高。RES组添加EX-527或AS后,与RES组相比,RES显著降低了il -1β诱导的软骨细胞自噬相关基因的上调。透射电镜显示,IL-1β组细胞自噬体数量明显少于对照组。RES组细胞比il -1β处理组细胞显示出更多的自噬体,当加入SIRT1抑制剂或FOXO1抑制剂时,自噬体数量显著减少(图1)。4D).上述结果提示RES通过SIRT1/FOXO1途径促进软骨细胞自噬水平的恢复。
白藜芦醇通过SIRT1/FOXO1途径减弱il -1β诱导的软骨细胞凋亡
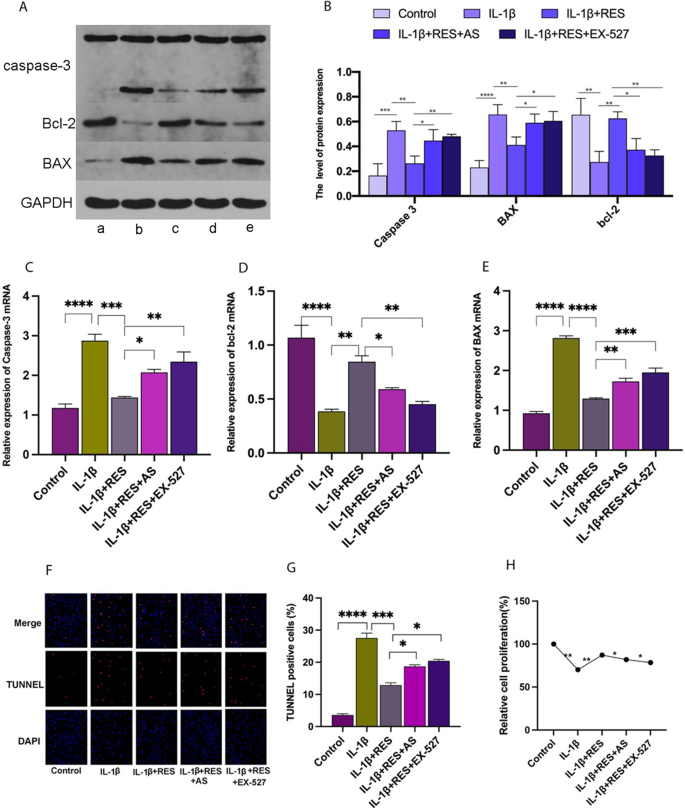
为了分析RES对软骨细胞凋亡的影响,我们采用了real-time PCR、western blot和TUNEL分析。实时荧光定量PCR和western blot结果显示,凋亡相关基因caspase-3的mRNA和蛋白水平均升高(图2)。5A-C)和BCL-2(图。5与正常软骨细胞相比,IL-1β组A, B, D)显著增加。相反,凋亡抑制基因BAX的表达(图。5A, B, E)减少。与IL-1β组相比,RES组(RES + IL-1β) IL-1β诱导的软骨细胞凋亡的增加明显减弱。与RES组相比,RES组添加EX-527或AS可显著增加il -1β诱导的软骨细胞凋亡水平。我们进行TUNEL(图。5F, G)研究软骨细胞凋亡的实验。CCK-8结果(图;5H)也显示RES可促进软骨细胞增殖,与上述结果一致。结果提示RES可通过SIRT1/FOXO1通路抑制il -1β诱导的软骨细胞凋亡。
RES对il -1β诱导的软骨细胞凋亡水平的影响一个Western blot检测显示BCL-2、BAX、caspase-3等与软骨细胞凋亡相关基因的表达。B通过GAPDH归一化,定量BCL-2、BAX和caspase-3的相对表达量。一个- - - - - -e分别对应对照、IL-1β、IL-1β + RES、IL-1β + RES + AS、IL-1β + RES + EX-527。C- - - - - -E采用实时荧光定量PCR检测软骨细胞caspase-3、BAX和BCL-2水平。HCCK-8检测各组软骨细胞增殖情况。F,GTUNEL检测各组软骨细胞增殖情况。所有数据均以均数±SEM (n= 3), *p< 0.05;**p< 0.01;***p< 0.001;****p< 0.0001
讨论
我们收集了三名OA患者和三名正常临床软骨组织的组织样本。分析证实,在OA关节软骨中SIRT1/FOXO1通路下调。RES通过激活SIRT1/FOXO1信号通路,逆转il -1β诱导的软骨ECM代谢中断与软骨细胞自噬和凋亡之间的不平衡。这些数据支持了RES可以通过激活SIRT1/FOXO1途径使OA软骨细胞受益的假设。
根据广泛的研究,骨性关节炎不能完全归咎于机械磨损,它也是一种慢性炎症性疾病[15].OA关节组织中IL-1β、IL-8、TNF-α、IL-6等多种促炎因子水平升高,其中IL-1β是最关键的促炎因子[16,17].随着骨性关节炎的进展,关节组织中IL-1β水平持续升高[18].在本研究中,与其他研究一样,使用IL-1β作为软骨细胞退变的诱导物,模拟OA患者的体内软骨退变模型[19,20.].
SIRT1/FOXO1通路在细胞代谢中起着重要作用,但关于SIRT1/FOXO1通路对OA软骨细胞影响的研究很少。前期研究已证实SIRT1激活对OA软骨细胞能量代谢的有益作用[21].RES激活SIRT1可改善棕榈酸盐诱导的炎症并减轻OA炎症损伤[22,23].研究表明,在骨骼肌和脂肪细胞中,SIRT1可调节FOXO1的表达[24,25,26,27].FOXO1在软骨细胞中高度表达,属于FOXO转录因子家族[28].同样,这项研究提供了令人信服的证据,表明SIRT1/FOXO1通路在软骨细胞中起关键作用,并可能介导OA的发生。用IL-1β培养的OA患者关节软骨细胞中SIRT1和P-FOXO1表达水平显著降低。此外,与正常软骨细胞相比,il -1β处理的软骨细胞ECM降解显著增加。添加RES后,SIRT1和p-FOXO1的表达水平显著升高,ECM降解相关基因的表达水平显著降低。此外,我们发现EX-537可以抑制SIRT1,下调SIRT1和p-FOXO1蛋白的表达。相比之下,AS阻断FOXO1后SIRT1蛋白表达没有改变,但p-FOXO1的表达水平受到一定影响。结果进一步支持SIRT1可以调节FOXO1活性,改善il -1β诱导的软骨细胞损伤。
自噬通过吞噬受损的蛋白质和细胞器来促进细胞器的更新,从而实现高效的细胞代谢[29].当细胞受到缺氧、饥饿或炎症的压力时,细胞自噬就会被触发,以避免细胞凋亡,维持细胞的代谢稳态[30.].Sasaki等研究表明OA软骨细胞自噬明显受到抑制[31].SIRT1/FOXO1通路在调控血管内皮细胞自噬中起重要作用[32].SIRT1/FOXO1途径诱导的自噬已被报道可促进能量缺乏心肌细胞的生存[33].因此,我们探索了SIRT1/FOXO1通路与软骨细胞自噬和凋亡之间的联系。我们发现,在il -1β诱导的软骨细胞中,自噬相关基因的表达显著降低,凋亡相关基因的表达增加。这导致了软骨细胞自噬和凋亡水平的显著失衡,当添加RES时,这种失衡被逆转。此外,抑制SIRT1或抑制FOXO1表达显著减弱了il -1β诱导的软骨细胞自噬和凋亡水平失衡的RES逆转。这提示RES可能通过SIRT1/FOXO1通路调节OA软骨细胞凋亡和自噬水平的平衡,从而延缓OA的进展。
结论
我们的临床标本实验结果证实了SIRT1/FOXO1通路在OA病理中的相关性。我们证明RES可以通过激活SIRT1/FOXO1通路对OA软骨细胞产生有益影响,其作用如下:(1)减轻OA软骨细胞的ECM分解;(2)促进OA软骨细胞自噬恢复;(3)抑制OA软骨细胞凋亡。以上结果提示RES可能是一种预防和治疗OA的有意义的药物。
数据和材料的可用性
支持本手稿结论的原始数据将由作者提供,毫无保留地提供给任何合格的研究人员。
参考文献
Hunter DJ, Bierma-Zeinstra S.骨关节炎。柳叶刀》。2019;393(10182):1745 - 59。
Ishidou Y, Matsuyama K, Sakuma D, Setoguchi T, Nagano S, Kawamura I, Maeda S, Komiya S老年患者髋关节骨关节炎最常见的是萎缩性,髋臼发育不良参数低,可能涉及骨质疏松症。骨质疏松。2017;12(1):30。
康仁,唐迪。自噬在胰腺癌发病机制及治疗中的作用。中华癌症杂志,2012;2(4):383-96。
姜山,金济,宋nr,郑sk, Lee MH, Park JS, Yeom MH, Bode AM, Dong Z, Lee KW.人参皂苷20- o - β - d -吡喃葡萄糖苷-20(S)-原醌二醇通过AMPK/JNK磷酸化诱导人黑色素瘤自噬和凋亡。PLoS ONE。2014; 9 (8): e104305。
孔东,闫颖,何晓霞,杨红,梁波,王洁,何颖,丁颖,余华。白藜芦醇对老年痴呆症抗氧化剂和雌激素作用机制的影响。生物医学杂志2019;2019:8983752。
Glasson SS, Askew R, Sheppard B, Carito B, Blanchet T, Ma HL, Flannery CR, Peluso D, Kanki K, Yang Z,等。在骨关节炎小鼠模型中,活性ADAMTS5的缺失可防止软骨退化。大自然。2005;434(7033):644 - 8。
孙辉,吴勇,潘震,于东,陈鹏,张旭,吴辉,张旭,安成,陈勇,等。吉非替尼用于表皮生长因子受体激活的骨关节炎亚人群治疗。EBioMedicine。2018; 32:223-33。
吕红,曾超,陈敏,连玲,戴艳,赵慧。慢病毒载体介导的Sox9过表达对il -1 β诱导的软骨细胞变性和凋亡的影响。中华临床病理学杂志,2015;8(9):10038-49。
McNulty MA, Loeser RF, Davey C, Callahan MF, Ferguson CM, Carlson CS。小鼠自然发生和手术诱导骨关节炎的组织病理学。骨关节炎。2012;20(8):949-56。
王晓明,王晓明,王晓明,王晓明。骨性关节炎中软骨细胞凋亡和自噬的生物标志物研究。国际分子化学杂志,2015;16(9):20560-75。
李文杰,李志刚,李志刚,自噬与细胞凋亡关系的研究进展。中国生物医学工程学报。2007;8(9):741-52。
邓智,李颖,刘红,肖松,李玲,田娟,程超,张刚,张峰。sirtuin 1及其激活物白藜芦醇在骨关节炎中的作用。2019.Biosci代表。https://doi.org/10.1042/BSR20190189.
Calnan DR, Brunet A. FoxO代码。致癌基因。2008;27(16):2276 - 88。
杨欣,姜涛,王勇,郭磊。SIRT1在白藜芦醇调控的骨质疏松大鼠成骨细胞自噬中的作用及机制。科学通报2019;9(1):18424。
风湿风湿病杂志,2016;12(10):580-92。
张志刚,张志刚,张志刚。骨关节炎促炎细胞因子在骨关节炎病理生理中的作用。风湿病杂志,2011;7(1):33-42。
王晓明,王晓明,王晓明,等。炎症因子和抗炎因子在骨关节炎发病机制中的作用。介质炎症。2014;2014:561459。
孙海霞,胡克泽,尹志生。抑制p38-MAPK信号通路抑制人类骨关节炎软骨细胞的凋亡和促炎细胞因子的表达。细胞因子。2017;90:135-43。
Corciulo C, Lendhey M, Wilder T, Schoen H, Cornelissen AS, Chang G, Kennedy OD, Cronstein BN。内源性腺苷维持软骨内稳态,外源性腺苷抑制骨关节炎进展。Nat Commun. 2017;8:15019。
李凯,张勇,张勇,姜伟,沈娟,徐松,蔡东,沈娟,黄斌,李敏,等。酪氨酸激酶Fyn通过激活-连环蛋白途径促进骨关节炎。中华神经外科杂志,2018;77(6):935-43。
陆燕,周玲,王玲,何松,任宏,周娜,胡哲。SIRT1在氧化应激下bmp2诱导的软骨分化和软骨维持中的作用。老龄化(奥尔巴尼纽约)。2020; 12(10): 9000 - 13所示。
Batshon G, Elayyan J, Qiq O, Reich E, Ben-Aderet L, Kandel L, Haze A, Steinmeyer J, Lefebvre V, Zhang H,等。血清NT/CT SIRT1比值反映早期骨关节炎和软骨衰老。中国生物医学工程学报,2015;29(3):344 - 344。
王超,姚震,张艳,杨艳,刘娟,石艳,张晨。二甲双胍通过激活AMPK/ sirt1介导的自噬来缓解骨关节炎模型小鼠软骨退化。Front Pharmacol. 2020;11:1114。
刘霞,郑华。Sirt1和FoxO1对饮食诱导肥胖大鼠下丘脑瘦素介导的交感神经激活和炎症的调控。中国心脏杂志,2018;10(14):e020667。
al - massadi O, Quinones M, Clasadonte J, Hernandez-Bautista R, Romero-Pico A, Folgueira C, Morgan DA, Kallo I, Heras V, Senra A,等。MCH调节SIRT1/FoxO1并降低POMC神经元活性,从而诱导贪食、肥胖和葡萄糖耐受不良。糖尿病。2019;68(12):2210 - 22所示。
黄霞,孙杰,陈刚,牛超,王勇,赵超,孙杰,黄华,黄松,梁勇,等。白藜芦醇通过SIRT1-FOXO1-c-Myc信号通路介导的血管生成促进糖尿病伤口愈合。《前沿药典》2019;10:421。
王艳,张玲,车霞,李伟,刘震,蒋娟。SIRT1/FoxO1/SREBP-1在子宫内膜癌孕激素耐药发生中的作用。中华妇产科杂志,2018;29(5):961-9。
李志强,李志强,李志强,等。sirtuins在哺乳动物生理调控中的作用。中国生物医学工程学报。2008;20(3):303-9。
尹红,吴红,陈艳,张娟,郑明,陈刚,李玲,卢强。自噬在自身免疫性疾病中的治疗与致病作用。前沿免疫。2018;9:1512。
齐藤,中岛。回顾:自噬在缺氧条件下体外滋养层功能中的作用。胎盘。2013;34(增刊):s79 - 84。
Sasaki H, Takayama K, Matsushita T, Ishida K, Kubo S, Matsumoto T, Fujita N, Oka S, Kurosaka M, Kuroda R.自噬调节人类软骨细胞骨关节炎相关基因表达风湿性关节炎。2012;64(6):1920-8。
林霞,欧阳松,志超,李鹏,谭旭,马伟,于俊,彭涛,陈霞,李林,等。重点研究血管内皮细胞的铁衰、焦衰、凋亡和自噬对动脉粥样硬化治疗的战略靶点。生物化学学报。2021;715:109098。
李志刚,李志刚,李志刚,李志刚。Sirt1对FoxO脱乙酰化的影响及其在心肌细胞自噬中的作用。Circ res 2010;107(12): 1470-82。
确认
不适用。
资金
本研究由国家自然科学基金(81071494)和湖北省科技厅(2015BCA316)资助。
作者信息
作者及隶属关系
贡献
CL进行了大部分实验。HX撰写文章初稿,XX和CW处理大部分数据,BQ和YH定稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
武汉大学人民医院伦理委员会对该研究进行了审查。已获得研究参与者的“知情同意”。《赫尔辛基宣言》中概述的指导方针得到了遵守。本研究的伦理许可编号为WDRY2020-K226。所有动物都被饲养在无病原体的环境中,随意喂食。护理和使用动物的程序由武汉大学人民医院伦理委员会批准,并遵守了有关道德使用动物的所有适用机构和政府法规。武汉大学人民医院实验动物福利伦理委员会已审核通过本研究,许可文号:WDRM20190517。
发表同意书
作者同意在杂志上发表文章。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
梁超,邢宏,王超。et al。白藜芦醇通过SIRT1/FOXO1信号通路保护il -1β诱导的软骨细胞损伤。矫形外科杂志17, 406(2022)。https://doi.org/10.1186/s13018-022-03306-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13018-022-03306-y
关键字
- 软骨细胞
- 细胞外基质
- 细胞凋亡
- 自噬
- 白藜芦醇
- 骨关节炎