摘要
背景
为应对癌症这一全球挑战,新癌症药物的研究和开发已成为重点。新药物通常在加速过程中被批准上市。尽管在治疗癌症方面取得了重大进展,但非传染性药物的整体附加值和高昂价格一直受到质疑。虽然新药物的市场许可是在欧盟层面授予的,但附加值评估、价格谈判以及购买或偿还决定都是由成员国做出的。本文探讨了芬兰评估和决定购买或偿还非传染性疾病治疗的做法。
方法
2019年和2020年,对26名公务员、医院员工、科学家以及癌症非政府组织和制药行业的代表进行了半结构化采访。转录后的访谈用Atlas进行归纳编码。并在3大主题和11个子主题下进行了专题分析。
结果
ncm的临床价值被认为是很高的,特别是对于某些类型的癌症的ncm。正确的患者选择很重要,但也很困难,并不是所有的非传染性疾病都能被视为增加价值。这些价格通常被认为非常高,导致人们对卫生系统的可持续性和公平性感到担忧。癌症患者对各医院区的非传染性医疗服务提供情况的差异以及接受门诊和住院治疗的患者的费用差异提出了公平关切。芬兰决定引进新药物的系统和程序是零碎的,涉及资源不足的评价机构对门诊护理和医院药品采取不同的方法。对于以证据为基础的引进决策,现有的科学证据往往有限。个别医院区有时不经国家机构评估就引进新国家医疗机构。这可能妨碍在使用一些非传染性药物之前对其进行适当评估,并导致医院获得非传染性药物的机会不平等。由于市场准入协议的迅速增加,定价越来越缺乏透明度。价格信息缺乏透明度,对负责在现有资源范围内公平获得具有成本效益的保健服务的当局构成了挑战。
结论
需要对国家引进制度进行强有力的改革。在国际上,需要努力提高价格透明度,修改市场批准制度内的激励措施,并在新药物市场批准后积累和评估具有可比价值和成本效益的证据。
背景
癌症是全球最大的健康挑战之一[1越来越多的人强调需要进行研究和开发,以发现更好的治疗方法。根据欧盟(欧盟)制药战略和癌症计划,欧盟致力于确保整个欧盟的患者在需要时能够获得高质量的治疗和新疗法[2].
药品要获准进入市场,首先必须获得市场许可。在欧盟,可以通过四种不同的方式授予市场许可,但新的癌症药物(ncm)的申请必须提交给欧洲药品管理局(EMA)(法规(EC) No 726/2004) [3.].EMA评估新药的安全性和有效性,但不评估其与其他现有药物相比的附加值,也不评估其成本效益。
为促进具有预期的重大公共卫生需求的新药的供应,制定了诸如加快批准程序、减轻证据要求以及通过孤儿药指定加强专利保护的范围(EC第141/2000号法规)等激励措施[4].ncm通常由EMA的加速评估程序进行评估。一些新药物药物有孤儿药名称[5].
某些癌症,如黑素瘤的医疗已取得重大进展[6,7,8]及小细胞肺癌[9,10,11].尽管如此,新nccm的整体附加值受到了质疑[4,12,13,14,15,16].此外,戴维斯等人。4]发现57%(39/69)的ema批准的nnc药物在进入市场时没有改善生存或生活质量的证据,并且在至少3.3年的随访后仍缺乏这些方面的决定性证据。国际上对非传染性药物的高成本、对成本效益、癌症治疗平等的影响以及对卫生保健系统整体可持续性的影响提出了严重关切[14,15,17].
有人对各国现有评估、采购和成本管理政策和做法的充分性提出了疑问,以确保可持续和公平地获得具有成本效益的癌症药物[15,16].欧盟努力加强目前的程序,包括通过欧洲委员会《卫生技术评估条例》(EU 2021/2282)。还在讨论各种旨在改善获取机会的跨国合作活动[18].
卫生保健的筹资和组织是欧盟成员国的国家权限,由它们决定公共资金用于药品的使用。药品的附加值、成本效益、估计所涉预算问题和资源可得性由欧盟成员国的指定机构估计,因此由成员国协商价格,并作出偿还和购买决定。已呼吁在欧盟成员国加强卫生技术评估机制,同时采用更复杂的定价和偿还系统[19].在芬兰,制药业、癌症非政府组织和一些癌症研究人员和机构已经发起运动,要求更快地引入非传染性药物,并提供更个性化的癌症护理。
本研究探讨了芬兰专家和利益相关者对国家癌症管理委员会的价值、国家癌症管理委员会的入门结构和过程以及国家癌症管理委员会对芬兰癌症护理的影响的观点。这项研究可能具有更广泛的意义,因为在有限的医疗条件下,确保快速和公平地获得具有成本效益的癌症药物以及确保定价透明度的挑战在国际上遇到并进行了辩论。
材料和方法
本研究基于对26位专家和利益攸关方的专题访谈,他们代表了与介绍药物有关的主要机构、科学家、非政府癌症相关组织(癌症非政府组织)和制药行业。
确定和联系需要面谈的人
首先,我们确定了参与引入新国家医学委员会及其授权的各种机构,以及利益相关方组织,如癌症非政府组织和制药公司或协会。然后,我们根据每个组织的正式工作描述,即他们在介绍药物过程中的工作,或他们在癌症非政府组织或制药公司或协会中的角色,确定了参加面试的人员。此外,还确定了从事药物政策相关工作的科学家。一些受访者,包括几名受雇于医院和大学的受访者,除了正式的工作职责外,他们还发表了与介绍新冠病毒相关的出版物和演讲。
首先通过电子邮件联系潜在的受访者,并附上研究描述和面试邀请。在预定的访谈前发送书面知情同意书,在访谈开始时签署,或在电话访谈结束时通过电子邮件确认。本研究采访的26人的特征描述在表中1.
26名受访者按他们目前的主要职位进行了分类,尽管许多人之前或目前在多个专业类别中有职位。例如,一些人在大学和大学医院同时担任职务。公务员、医院雇员和科学家被统称为专家,癌症非政府组织和制药行业代表被统称为利益攸关方。
4人拒绝了采访请求,2人没有回复。在那些拒绝参加的人中,有一个非政府组织的代表不想参加,理由是在管理医疗协议(MEAs)成为可能后,进入非传染性疾病治疗中心没有任何问题;对两名癌症非政府组织代表的采访是应受访者的要求重新进行的,只让一名原始受访者参与;两名代表医药政策业务方面的公务员找不到合适的时间接受采访。
进行采访
半结构化访谈由主题问题列表辅助(见附加文件)1对于主题问题),针对每一组受访者以及特定受访者的工作描述和专业知识进行了稍微定制,并根据以前的面试信息添加了一些额外的问题。访谈探讨了受访者的观点(1)关于在现代癌症护理中使用非传染性药物的价值,包括临床意义、成本和保健影响;(2)关于引入非传染性药物的过程,本研究将其定义为在门诊和医院护理中引入非传染性药物的结构、过程和参与者,直至决定购买或偿还。此外,讨论了对未来癌症护理和研发(R&D)环境的看法,这些讨论的结果将单独报告。
除有三次是通过电话进行的外,所有访谈都是由同一个人(EO)进行的。每次面谈持续约一小时(平均63分钟)。在2019年3月至10月期间进行了采访,只有一次是在两届会议期间(2019年12月和2020年2月)进行了采访,另一次是在2020年10月对一名受访者进行了第二次简短采访,以澄清第一次采访中出现的问题。
分析访谈
除了一次使用笔记外,所有的采访都被记录下来。EO使用Atlas对访谈进行归纳编码。代码分为11个子主题和3个子主题(Table . ti)2)(参见查普曼等人。[20.)。访谈数据使用科学论文、药物政策论文以及相关组织的网站和通俗杂志上的文章(其中一些是由受访者自己识别的)进行三角分析,以获取更多信息。对特定受访者的引用连同每条引用前一段的草稿一起发送给受访者,并根据收到的回复作出了一些额外的修改。
结果
对新规的价值的看法
ncm的临床意义
接受采访的专家一致认为,近年来癌症治疗有了显著改善。许多以前没有治疗方法的情况,如进展中的癌症,现在都有了治疗方法。针对癌细胞的治疗也更加具体。在治疗多种癌症方面取得了重大进展,特别是黑素瘤、淋巴瘤、卵巢癌以及某些乳腺癌和肺癌。
“对于一些过去被认为是完全绝望的疾病,个体患者甚至有了非常显著的延长生存时间。”(医院员工)
许多受访者提到了免疫肿瘤学方面的重大进展和口服治疗的增加。虽然口服治疗能够实现门诊护理,但有人提到,由于副作用,一些非传染性疾病也可能需要在医院进行更长时间的随访。
ncm通常为非常特定和小的患者群体提供了改进的治疗。现有的新疗法需要新的技能。他们还呼吁建立新的基础设施,包括非常具体的诊断方法,以发现那些将受益于任何特定的NCM的患者,因为即使只有一部分受益,所有人都暴露于潜在的副作用。
人们普遍认为,并不是所有的新nccm都能增加价值。一些人坚持认为,尽管这些承诺是巨大的,但它们目前往往没有兑现。一些非政府组织代表提到,给危重癌症患者带来希望可能是进行NCM的一个原因,即使对疗效的期望很低。
新型的成本
许多接受采访的专家认为,目前许多新型药物的价格太高,对社会来说甚至是机会主义的,特别是考虑到关于其有效性的数据稀缺。他们一致认为,价格、成本效益和机会成本需要讨论,即使很难。癌症非政府组织强调,在这样的讨论中需要一个强有力的病人视角。
“我认为ncm进入市场的价格非常高。那么这个社会,即使是这样一个富裕的社会,特别是当癌症越来越普遍,寿命越来越长的时候,还能承受多久的成本,并对需求做出反应呢?”(公务员)
可以从不同的角度考虑费用:每人所有药物的费用、每人每种药物的费用、引进国家药品管理办法所涉及的预算问题以及与药物效果有关的费用,通常以质量调整生命年(QALY)的费用计算。质量保证措施、费用和所涉预算问题原则上由国家评估机构药品定价委员会(PPB)、芬兰药品管理局(Fimea)和芬兰保健选择委员会(Cohere)审议,而医院似乎更关注每个病人的费用和所涉预算问题。在所有评估中,费用通常只考虑单一药物,而不考虑治疗。
“让这有点荒谬的是,这些病人通常有——不仅仅是一种药——但他们通常有五、六种其他的药,这些药也非常昂贵。”(医院员工)
受访者被问及他们对QALY的可接受成本的看法。所有人都强调,QALY的价格没有官方的上限,尽管似乎存在一些非官方的上限指导方针。被提到最多的费用是30 - 4万欧元,两名受访者提到的价格范围稍低,几人提到的是5万欧元,一名医院员工提到的是10万欧元。
接受采访的专家强调,如果目标人群很小,或者没有其他治疗方法,就可以接受相当高的质量aly价格,非传染性疾病的情况经常是这样。但也有人指出,随着时间的推移,非传染性药物的适应症往往会变得更广泛,从财务的角度来看,这可能是有问题的,但根据一位专家的说法,这是制药业深思熟虑的战略的一部分。一位专家强调,对于一次性治疗,如Car-T治疗,对显著延长预期寿命或甚至治愈有很高的期望,NCM的较高成本是可以接受的。相反,另一位专家表示,一些人认为,对生命的后期阶段来说,高成本是可以接受的,因为使用是短期的。关于非传染性药物治疗的价值的另一个问题是,没有足够的手段来选择最有可能从中受益的患者,因此显著降低了成本效益。
“所以,如果十分之一的人受益很大,十分之三的人受益不大,其余的人则完全没有受益,但所有人都受到了不利影响,所以在某种程度上,我们无法为所有十个……(公务员)支付全额费用。”
每名患者每年的非传染性药物治疗费用显然超过3 - 4万欧元,几乎是一种惯例。一位专家提到,一枚NCM可延长约4个月的寿命,费用为7万欧元。其中三人提到,一个NCM的成本高达50万欧元。关于一个大学医院区,有人提到,所涉预算最高的20种药品中有18种是新药物,约占医院药品总预算的35%。由于非传染性药物的价格通常超过其他药物可以接受的价格,两位专家提出了一种可能性,即为支付非传染性药物设立一个特别基金。
关于癌症治疗可持续性和公平性的观点
保健的总体可持续性和各类病人之间的公平是特别令人关切的问题,特别是考虑到老龄人口的需求日益增加和保健许多领域的严重差距。虽然药品目前不是专门护理支出的主要部分,但非传染性药物价格的急剧上涨引起了严重关切。人们承认,卫生保健的优先次序是必要的,也是困难的。
“医疗资源不可能永远增加……在某些情况下,将预期寿命增加一个月可能非常有价值。”在其他情况下,它可能只是一个结束时间,充满了副作用和昏迷,价格可能是10万欧元。如果你想用这些钱在初级卫生保健上还能做些什么,比如1500次看医生或别的什么,所以你可能会想到这些问题,如果你考虑机会成本的话。”(公务员)
认识到有必要改善初级保健和专门保健之间的合作,以确保早期诊断、综合治疗和及时启动姑息治疗。甚至有人说,有时即使对一个本应给予姑息治疗的病人使用非传染性药物的决定,也可能受到治疗和姑息治疗之间融合不良的影响,使病人和医生都难以作出改变。
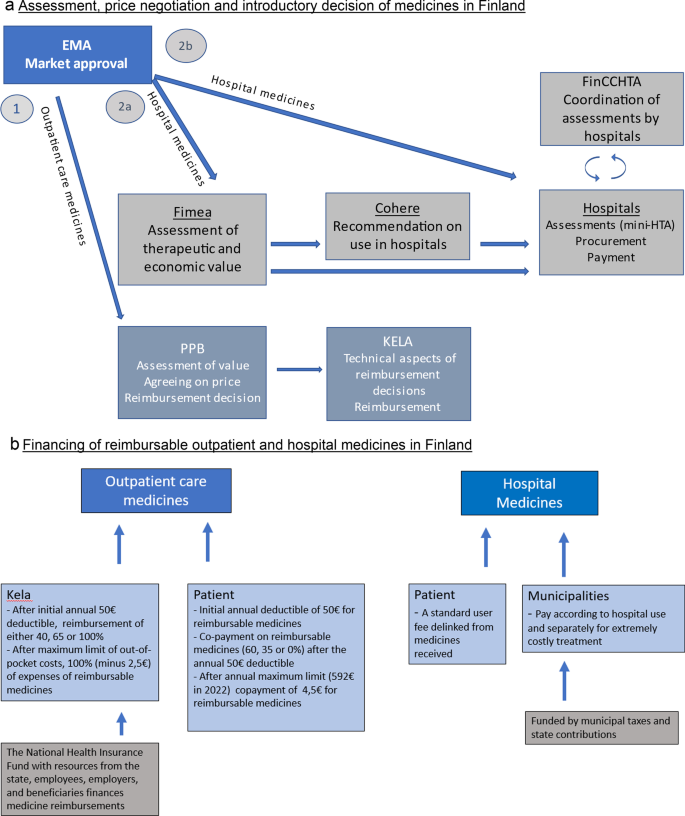
对患者来说,非处方药的费用取决于该治疗是在医院进行的,还是作为门诊治疗的一部分,如果是门诊治疗的一部分,则取决于药品的报销情况(图2)。1b).许多受访者认为,目前的双通道制度和不同比例的报销导致了患者的nnc医疗费用的差异,这造成了癌症患者之间的重大不平等。
几位受访者提出了目前癌症护理不平等的问题,特别是由于各医院在提供各种非传染性疾病治疗方面存在差异,导致了癌症护理的显著地域不平等。
“我认为这是一个原则上的问题,医院区自己可以选择他们引进的药物。我认为这是一个非常大的不平等问题,一个非常大的问题。(癌症非政府组织代表)
介绍新型农村
对EMA市场批准新生物制剂的看法
在EMA的加速评估程序下,ncm通常被批准上市,其中一些带有孤儿药名称。它们通常用于非常小的患者群体,它们的批准基于有限的证据。
“由于药物用于患者的数量越来越少,EMA的上市许可的证据越来越少。一项上市许可申请可能只基于20或50名患者,而且研究也越来越单一。”(公务员)
在研发的早期阶段给予市场批准,实际上也可能将注意力从EMA转移到国家和地方机构。
“过去,EMA因处理上市许可的时间过长而受到批评。市场准入是一个问题。现在EMA在某种程度上加快了这一进程并将其向前推进。当然,定价当局也在以某种方式受到轰炸,因为我们是如此死板,肮脏,缓慢和官僚。这类事情只是一个总结。”(公务员)
强化证据的一种方法是,在规定的时间范围内给予市场批准作为补充证据的条件。然而,也有人说,即使在有条件的市场批准后,撤回一种药物在实践中也很困难——即使患者已经从中受益——尽管这种情况有时确实会发生。尽管如此,仍强调需要有更多高质量的临床研究,包括比较各种治疗方法的研究,改进选择将从非传染性药物治疗中获益最多的患者的方法,以及普遍需要加强启动后的证据生产,特别是在欧盟层面。
参与购买或报销非传染性药物的决策的公务员和医院员工往往面临两难境地:一方面,迅速引进非传染性药物可能为某些患者带来重要利益;另一方面,由于疗效和不良反应的证据有限,以及没有足够的手段来选择那些最有可能受益的患者,存在很大的不确定性。一些受访者质疑传统卫生技术评估过程对这种针对小患者群体的药物的适用性。
“这些创新药物只针对一小部分只有一种突变的患者。当癌症患者小组被分成这么小的小组,对于有效的药物你永远不会得到这种临床证据,直到它被引入。(癌症非政府组织代表)
引进新国家药物的国家结构和程序
引言系统是一个整体
在芬兰,在引进和资助门诊(OC)和医院使用的药物方面,在评估、商定价格和决定报销(OC)或购买(医院)方面有不同的程序和系统(图1)。1).受访者普遍认为,芬兰目前的药品引进制度碎片化,过程复杂,对提高合理用药效果不理想。
“目前,这是如此碎片化,没有人真正了解正在发生什么。”(科学家)
芬兰的药品引进和支付结构。一个芬兰药品的评估、价格谈判和引进决策。b芬兰可报销门诊和医院药品的筹资。在EMA的市场批准后,门诊治疗(OC)药物的评估和报销决定由药品定价委员会(PPB)在国家层面做出,并由芬兰社会保险机构(KELA)执行(一个(1)带有报销决定的OC药品由KELA的国家基金和患者自己共同出资(b).关于医院药品,芬兰药品局(Fimea)评估了医院药品的治疗和经济价值。卫生保健选择委员会就不同的公共卫生服务应当或不应当包括什么,包括医院药品,提出了国家服务建议(一个路线2 a)。或者,如果不存在Fimea评估,医院区自己进行评估,称为迷你卫生技术评估(mini-HTAs) (一个路线2 b)。芬兰卫生技术评估协调中心(FinCCHTA)协调各医院区进行的评估。21个医院区,又分为5所大学医院,由市政当局资助,负责医院药品的采购和支付。住院期间和在医院的综合诊所治疗期间,药费包括在病人费用中(b).从患者的角度来看,根据药物是由医院提供还是从药店购买,费用有明显的差别,而费用报销实际上是负担得起购买新型药物的必要前提。涉及的各个机构有不同的责任,包括社会事务和卫生部(PPB、Fimea、Cohere)、议会(KELA)和市政当局(医院区)。正在进行的社会和保健服务改革将使结构、筹资和问责方式发生显著变化,设立一个新的行政层——福利服务县,负责利用(至少最初)国家预算资金组织社会和保健服务
双通道系统被认为是一个主要问题。有专家指出,两种制度引入新国家医学标准不同。
由于一些现代癌症治疗结合了静脉和口服治疗,具有独特过程和标准的双通道决策结构被视为特别有问题的癌症治疗情况下,口服治疗不报销。根据访谈,这个问题似乎经常与口服ncm有关,这些药物可能在临床试验中使用,但缺乏报销决定,特别是最近口服ncm的适应症外使用。因此,一些医院在没有医院药房报销决定的情况下就为门诊患者发放口服ncm。至少在没有经过芬兰卫生技术评估协调中心(FinCCHTA)协调的评估的情况下,医院首席医疗官不鼓励这种做法[21],因为它不符合医院药房的既定职能,实际上是违法的。根据对在医院工作的专家的采访,一些但不是所有的医院已经停止了这种做法。
会上讨论了在各国进行市场批准和随后进行介绍性决定的标准是否应以癌症的位置或突变的类型为基础。一些人指出,特定突变的存在并不意味着某种药物将对具有该突变的所有类型肿瘤有效,并呼吁在选择患者时谨慎,以确保成本效益和成本控制。一些人还坚持认为门诊治疗中适应症外用药应该有更大的灵活性。在医院护理方面,精准医疗的理念也被提及,以证明更多地实验性地使用新药物是合理的。
“这是这些精确医学的想法之一,你不只是看有这种疾病适应症的分子,而是实际上非常随机,就像为另一种疾病构建的分子可能对个别患者有效。”(医院员工)
Fimea可批准未经销售许可的药品因特殊治疗原因在个别情况下发布使用,例如在没有其他治疗方法或可能没有预期效果的情况下。如果申请,PPB可以批准这种药物的报销。此外,患者可以通过注册参加临床试验,在没有EMA营销许可的情况下获得ncm,根据几名医院员工、癌症非政府组织和制药行业代表的说法,这是一个至关重要的选择。
人们一致认为有必要改革现有的制度,以确保快速的优质评估和决策。然而,对于新系统应该在国家或地方的程度上,以及如何将引入新国家网络的决定与融资联系起来,受访者之间存在分歧。有人指出,从医院预算中取消医院药品的国家资金可能会增加非传染性药物的使用,特别是在使用标准和患者选择方面,可能会倾斜医疗和其他形式治疗之间的平衡。要求制定关于治疗方案的国家指南。在这方面,两位专家提到,还需要增加措施,以确保合理使用目前由国家资助的新国家委员会。
“我认为,在国家层面,我们应该概述哪些治疗是有效的,哪些是值得引进的。但这个过程应该是快速的,而不是缓慢的。然后我想说,这些钱也应该通过一个单一的窗口,这样整个合作领域就有了一笔共同的钱,然后这个钱也被定义了,这样这些药物就会被引入这个领域。这样门诊医生,抱歉,现在是医生,就没有权利开任何他们想开的药方。”(医院员工)
在OC中引入ncm
在PPB和芬兰社会保险机构(KELA)决定OC药品报销的过程被认为是漫长而复杂的(图1)。1a). 2017年,对OC药品使用MEAs(也称为风险分担协议)成为可能,此后,大多数受访者不再将延迟视为主要问题。
“从我们如何将这些新药提供给患者的意义上来说,对延误的批评是相当合理的。所以花的时间太长了。”(公务员)
“这些门诊药物的情况正在改善。最明显的原因是风险分担协议的做法。(制药行业代表)。
PPB强调,从EMA市场批准到报销决定的时间框架涉及许多延迟,从向PPB提交申请到要求进一步信息和接受建议价格,以及关于多边环境协定同意价格。有人提到,芬兰并不是通常会最先提出偿还申请的国家之一。
大多数其他欧盟国家使用了多边环境药物,但芬兰直到2017年才使用,这一事实加剧了提供快速和具有成本效益的新型药物的挑战,因为芬兰当局在审议时处理了清单价格,而其他国家实际支付的价格可能更低。自2017年以来,大多数关于非传染性疾病的报销决定都是通过多边环境协定做出的。根据PPB网站,截至2022年5月,非处方药占口服药物的所有mea的58%(101/173)。所有这些都是经济的多边环境协定,这意味着它们包括与公开标价相比的简单的未披露的降价。据说,基于性能的多边环境评价存在许多实际困难,预计不会用于OC药物。首先支付带有MEA的NCM的标价,公司将差额退还给KELA。通过只公布具有多边环境协议的所有药品的这些退货付款的汇总总额,确保了实际支付价格的保密性。
尽管在2017年之前,PPB没有进行具体的价格谈判,但报销决策过程中的一个主要问题是权衡药物的临床价值和建议批发价格的合理性。多边环境协定的价格取决于谈判,由正式工作人员作为其日常职责的一部分进行谈判。谈判双方在定价方面的信息、权力和经验存在巨大的不对称。
“大卫和歌利亚的组合。他们知道他们如何从欧洲市场攫取了所有的大国——德国、法国、英国,可能还有瑞典,也就是我们现在的位置,但我们不知道他们在那里做了什么交易;我们不知道那里的价格水平。”(科学家)
在医院引入非传染性病毒感染者
芬兰药品管理局(Fimea)和芬兰保健选择委员会(Cohere)是为医院评估非传染性疾病的主要渠道(图1)。1a) Fimea没有资源来评估所有的新国家医疗机构,而Cohere用于发布建议的资源更加有限,致使医院自己进行一些评估。尽管Fimea的目标是预测EMA市场批准,并在市场批准后不久准备好评估,但一些专家表示,通过Fimea和Cohere的过程太慢,而其他人似乎更愿意等待Fimea的评估和Cohere的建议,医院会认真对待,即使它们不具有约束力。
在没有Fimea评估的情况下,医院可以在非常有限的专家资源下,以较小的规模(称为迷你htas)进行自己的评估。在进行访谈时,5个大学医院区中有4个聘用了负责评估的首席医疗官,但医院可能缺乏任何卫生经济学专业知识。卫生技术评估协调中心(卫生技术评估协调中心)协调各大学医院区的评估工作,并设法精简其结构和程序,根据访谈,这些结构和程序仍然各不相同,定义和执行可能不准确。
在一些医院区,在指定的评估小组作出采购决定之前讨论了小型htas,但在至少一个大学医院区,评估小组通常是在采购已经进行之后才提供信息。
“评估小组并不是一个真正会评估这些问题的活跃机构,它更多的是一个在节日结束后讨论这些问题的机构。”(公务员)
5个大学医院区的首席医疗官指出,每人每年花费3万欧元或以上的昂贵药品,应由国家药品监督委员会或国家药品监督管理局进行评估,所有医院均应遵循这些建议[21].根据访谈,在实践中可能并不总是如此,但至少在一些医院区,内部决策过程根据估计的费用而有所不同,医院领导层参与了最昂贵药品的采购决策。
“因此,我们(在我们的医院)有一种新的癌症药物治疗——如果每年的费用超过每名患者3万欧元,它的引入必须经过一个特定的程序,也就是说,它现在是否已经在Cohere或Fimea处理中,以及它是否已经在大学的其他医院中使用,所以必须认为,没有任何医生可以在批准使用一种昂贵的新药之前做出决定。也许在过去的5年里,它已经进化了。”(医院员工)
至少在一些医院区,评估非传染性医疗机构的必要性通常源于对个别病人的潜在采购需求。在这种情况下,可能无法完全遵循官方流程。
问:“我想知道你是否经常遇到这样的情况:有一个病人,一个癌症病人就是一个很好的例子,他有一个严重的危机,你先出去给病人买药,这就是合同是如何建立的。”
答:不幸的是,这可能是一种相当典型的情况。
问:“然后你不一定要等Fimea和Cohere的位置?”
答:“不一定。所以,在某种程度上,问题是,当系统是这种碎片化的或有碎片化的实践,那么情况就会形成,甚至可能是一个制药公司的代表,然后他就会接近你,说你有这种病人,他需要这个,医生也想使用它……”(公务员)
慈善性使用,即在EMA市场批准之前使用非传染性药物进行治疗,至少一些医院也在实行。这种形式的介绍可能是由临床医生提出的,但制药行业也可能发挥积极作用。
问:“如果我们再回顾一遍,我就会明白在你们的医院区,例如,这些新的抗癌药物或任何种类的药物是如何采购的。”
答:“到目前为止,在实践中一直是基于需求的,也就是说,对于第一个来找我们的患者,临床医生确定了其需求,该患者可能适合这种药物治疗。针对这种治疗,一种新产品已经在世界上某个地方出现,或者已经批准上市,但现在很多情况下,它只是刚刚收到FDA的推荐:EMA仍在对其进行评估。所以我们可能需要它作为一种富有同情心的使用公司知道如何很好地利用这种情况,那就是在市场投放之前,我们联系制药公司,让他们免费试用这种药物并在病人身上开始使用。”(医院员工)
有人强调,可能作为早期使用方案或特别优惠的一部分,为某一医院的个别病人或部分病人开始使用国家综合管理办法(另见[21]),具有更广泛的影响,因为其他医院会迫于压力,出于公平的理由为类似的病人采购和提供同样的治疗,即使它们认为这样做在其他方面并不合理。
“这是该体系的弱点,因为该行业肯定利用了这一点,把这些所谓的好交易从侧门推了出去。当然,这确实增加了不平等。”(科学家)
受访的几位受雇于医院的肿瘤专家抱怨说,早期介绍通常是在小医院进行的,但由于所有受访的人都在大学医院工作,我们没有听到小医院专家的观点。接受采访的专家希望,国家层面的评估和建议将为医院和临床医生个人进行艰难的审议提供支持,这些审议往往涉及患者个人。
“当我看我们的消费统计数据时,我知道有很多癌症药物是无效的,不应该使用,因此在某种程度上,它们占用了用于新的昂贵治疗方法的资源。所以所有其他大学医院区的数据都是零,但有三个中心医院有销售额,这不是巧合。在某种程度上,让人们接受无效的治疗也不符合那些病人的利益。我不认为这是一个好现象,我认为这是一个真正的问题。”(科学家)
对于通过特殊途径(如同情使用或作为临床试验的参与者)免费获得非传染性药物治疗的个别患者,一些受访者强调,只要他们需要,就应该保证他们的药物是免费的,而不期望药物将由公共部门支付。但情况并非总是如此。
“但这就是我们开始免费使用一种药物的地方,协议几乎没有例外,当它获得上市许可并设定了价格时,它就会被收费,所以我们不能停止这种药物,如果患者死亡,如果我们停止这种药物,这就产生了一个道德问题,因为它是有价格的。”(医院员工)
目前,医院的大部分药品是通过公共采购程序购买的,其中包括最需要的药品,并由大学医院区每隔几年进行一次采购,通常包括延长年份的选择。采购程序原则上包括医院使用的所有药品,甚至包括不受竞争影响的新医药公司。对于适应症和疗效相近的新型药物,可以根据价格进行选择。此外,医院区可能比其他药品更频繁地组织一些NCM类别的采购程序。
采购过程的人员和资源是稀缺的。虽然价格竞争是公共采购过程的核心思想,但在这一过程中没有单独的价格谈判。
“我们芬兰没有一个药品价格谈判的系统。我们有采购,这是基于卖家提供的东西,然后我们实际上接受它。而且我们完全无法控制。如果我们不能达成协议,那么协议就不会达成。原则上,没有人会协商医院的药品。”(科学家)
如前所述,许多非传染性药物最初是在公共采购程序之外采购的,通常是基于个别患者的需求。在这种情况下,医院药房负责与制药公司联系,商定价格并采购药品。
接受采访的专家认为,在医院环境中,环境影响评估仍然相对罕见(另见[22])。然而,自那以后,它们的使用迅速增加[23].据受访者称,据说只有极少数人知道带有多边环境协定的新型汽车的真实价格。虽然只涉及降低价格的经济多边环境协定很常见,但也可列入一些有关效力的方面(又见关于现行多边环境协定类型的(23))。一些专家预见了与发布从正常临床实践中收集的数据(也称为真实世界数据)相关的进一步降价的可能性(另见[25])。
许多接受采访的专家呼吁建立一个统一的国家评估、价格谈判和采购系统。2020年9月,政府宣布将在全国大学医院之间进行系统协调,以谈判和采购新的和昂贵的药物[24].
评估、价格谈判和采购方面的国际合作
芬兰(Fimea)、挪威和瑞典当局在保健技术评估方面进行了一定程度的合作,称为FINOSE。这取决于选择参与的制药公司,并且适用于所有三个国家。
欧洲委员会关于卫生技术评估(COM(2018) 51最终版本-现已批准,并作了一些修改,称为(EU) 2021/2282)和涉及在欧盟层面评估药物相对有效性的法规提案的总体目标得到了受访者的积极评价。欢迎在欧盟一级获得更广泛的专门知识,而不是只依靠国家专家。由于欧盟级别评估的数据基本上与提交给EMA的数据相同,因此人们对该过程的附加值、是否会与适当的替代处理进行比较、在该过程中包括新出现的数据的方法以及欧盟级别过程的长度表示担忧。主要关切的问题是最初建议的约束性。一些专家强调了卫生保健系统及其筹资和所涉国家能力方面的差异。专家们认为,有可能进行国家评估和国家决定是很重要的,而制药业的代表则赞成原提案更具约束力的性质。
“它的主要目标是对现有数据进行集中评估……然后我们将有专门针对特定适应症和药物的欧洲特别专家,这样我们就能获得最佳的专业知识来评估有效性的证据?”危害和不确定性是什么?我认为如果成功了,对大家都有好处。但是决策过程,我们如何权衡每个国家的所有证据必须独立于每个国家。”(公务员)
接受采访的专家对短期内涉及更多国家的共同采购并不乐观,至少对北欧国家以外的国家不乐观。他们提到了卫生保健组织和筹资方面的差异带来的挑战,包括国家富裕水平的差异。此外,据说制药行业以及拥有自己工业或对价格有更大影响力的欧盟大国反对这种努力。
透明度和利益冲突管理
作为一项规则,芬兰立法规定提供官方文件的资料,但有关贸易和商业秘密等例外情况除外,但可改进确保提供关于国家安全管理评估和费用的公开资料的做法。PPB的备忘录原则上是公开的,在省略了商业和商业秘密后,可以根据要求获得,但它们没有公布。Fimea和Cohere进行了公开报告,但医院之间也没有足够的渠道向Fimea和Cohere通报它们实际支付的药品价格,即使这些信息是公开的。
然而,围绕多边环境协定的保密是透明度方面最严重的问题,阻碍了信息共享的可能性,包括优先次序、成本效益分析和各种药物成本的统计,因为成本是未知的。随着多边环境措施的日益使用,这个问题变得更加明显。
当局的决定可能会受到社会压力的影响。例如,当局在媒体报道和制药业、患者非政府组织、临床医生和其他专家开展的运动方面感到压力,这些运动往往涉及患者个人的故事,在这些故事中,当局正在考虑的新药可以帮助患者。有关当局不参与对正在进行的进程的公开讨论。
“在某种程度上,社会压力会到来。我不是专门谈论抗癌药物,但这里可能也有抗癌药物,但你可以看到,例如,当你关注新闻或媒体上的某个地方,当你开始看到病人说世界上有一种新药问世,其中当然有一些令人震惊的人类故事,所以你可以猜测,好吧,很快可能就会有这样的药物问世。”(公务员)
如上文所述,在一家医院采用一种新型国家控制措施(通常是在一种特殊途径的情况下)之后,关于一种特殊国家控制措施的可用性的信息迅速传播,出于公平原因,其他医院也经历了采用这种特殊国家控制措施的压力,但不一定要披露采用这种特殊国家控制措施的背景,包括成本。同样,口服药物可作为临床试验或早期获得方案的一部分,但有一项谅解,即继续治疗将通过报销的非传染性疾病治疗。如果报销决定被延迟甚至拒绝,例如由于价格原因,情况就会变得很麻烦。
“我觉得这对该行业来说是一种非常不公平的行为,他们在这里开始了某种早期访问项目,无论是研究还是其他什么。然后在某种程度上,当病人开始接受药物治疗时,就会产生对药物的需求。然后他们向我们提交申请。他们可能会和医院达成协议他们会让这个早期准入项目生效直到药物得到偿还。然后,如果我们得到了拒绝的决定,那么他们会重新申请。然后我们开始接到制药公司的电话。”(公务员)
有几位专家提到,适当的利益冲突管理需要更多的注意,尽管各行动者之间意见不同。对于像芬兰这样的小国来说,能够熟练评估与非传染性药物有关的非常复杂问题的专家数量相对较少,而许多具有专业知识的专家是在为生产非传染性药物的制药公司工作时获得的特定非传染性药物的知识。许多专家还在参与国家战略管理引进决策的几个机构中发挥作用。多边环境协定定价的保密,加上要求迅速采用的压力,可能对确保公共卫生利益仍然是决策的核心构成进一步挑战。
“我们经常发现很难找到临床专家来进行这些癌症治疗评估,因为他们的从属关系……在社会上没有其他领域可以收钱,可以两手抓。”你不能一边担任公司医疗顾问的董事,一边做采购决定,如果你是这样做的,那就不太好了。”(公务员)
讨论
这项研究发现,芬兰专家和利益攸关方认为非传染性药物的临床价值很高,特别是针对某些类型癌症的非传染性药物,但许多人也认为不是所有的非传染性药物都能增加价值。在决定是否引入时,现有的科学证据往往仅限于区分增加价值的非传染性病毒感染和没有增加价值的非传染性病毒感染。这些价格通常被认为非常高,导致人们对卫生系统的可持续性和公平性感到担忧。
该研究还发现,在芬兰,关于推出新药物和谈判其价格的决策结构和过程是分散的,资源匮乏。加上透明度不足,这些体系为包括制药公司在内的不适当影响留下了空间。
芬兰需要进行的改革包括纠正将医管局和医院药品之间的程序分开、将任务分配给几个实体的双通道系统,并确保有足够的资源用于国家一级的快速评估、价格谈判和采购。这应该能够在全国范围内及时引进具有成本效益的新药物,而拒绝引进没有成本效益和附加值证据的新药物。应取消个别医院对小型hta的需要。
目前正在审查纠正双通道系统和确保在医院和门诊护理中通过适当的患者选择来最佳使用药物的备选方案[24,25].最近,各医院区开始了一项关于昂贵药品和价格谈判的全国药品采购进程,其依据是国际医疗卫生和环境保护组织的评估和综合建议。然而,执行重大变革的必要性仍然存在。
这项研究表明,当局可能会因提倡获得某些药物的运动而感到不适当的压力,因为当局认为他们无法参与讨论正在进行的评估中任何药物的价值和要求价格。这种压力可以有意影响当局的决定,但这种影响可能并不总是符合公共卫生利益。需要增加引进药品过程的透明度,以及严格管理这些过程中的利益冲突。
已建议在评估新药和购买昂贵药物方面进行国际合作,并已朝着这一方向采取了步骤[18,26,27].本研究发现,根据已批准的HTA法规(EU 2021/2282),对未来欧盟水平评估的总体态度是积极的。由于肿瘤学家与制药业之间的联系十分普遍[28],通过国际合作扩大独立专家的队伍受到重视,但也注意到由于证据有限,仍然存在一些问题。
迫切需要对非传染性药物进行更多的研究,特别是在市场批准之后,包括比较本研究专家提出的各种治疗方法的成本-效果,已在国际上进行了讨论[4,29,30.].临床试验中的患者通常不同于常规治疗中的普通患者。例如,已有研究发现,晚期实体癌患者和不良的表现状态可能无法从先进的免疫疗法中获益[31].需要改进的方法来确定那些最有可能从非传染性药物中受益的患者。
一些受访者认为,在常规的医院护理中,应该可以实验性地使用非传染性药物。然而,当用于常规临床环境而不是研究环境时,系统证据并没有增加。问题仍然是,公共卫生服务应该为实验性治疗支付多少费用,而不是在同情使用的情况下免费治疗,或由与研究相关的预算与系统证据生产提供资金。
非传染性药物的高价引起了人们对国际上整体卫生服务体系可持续性的担忧[14,16,17].尽管在21世纪初,新的、更昂贵的药物已经进入临床使用,药物成本也在不断上升,但2004年至2014年期间,由于门诊治疗的可能性增加,芬兰的每位癌症患者的总体治疗成本并没有上升[32],但抗癌药物的价格近年来大幅上涨[33,34,35].
在这项研究中,发现了患有各种疾病的患者之间、在不同医院地区就诊的癌症患者之间在获得各种非传染性疾病治疗方面的不平等,以及在住院或门诊治疗中接受非传染性疾病治疗的患者之间在费用方面的不平等。在国际上,各国在获得非传染性药物方面的差异往往被视为不平等问题[2,16].虽然制药业最初并没有在所有欧盟国家的市场上推出其非传染性药物,但在有限的保健资源和所要求的价格条件下评估非传染性药物的附加值也可能导致非传染性药物可得性的差异。
应对新型药物价格高企的措施包括专项资金和环境影响评估[19].在芬兰,在门诊和医院护理中,对非传染性疾病患者使用多边环境措施的情况正在迅速增加,至少在普通医院,这加快了获得非传染性疾病患者服务的速度。与国际上的情况一样[36],在芬兰订立的多边环境协定所涉及的是降价而非分担风险,国际上报告的通常降价幅度(20-40%)相当[37].然而,根据Gamba等人。38],多边环境协定导致了价目价格的上升,本研究采访的专家也提出了这种可能性,因此降低百分比与价目价格的相关性降低。
各实体在价格谈判中的杠杆作用各不相同[26,37].已呼吁建立更大的采购实体[27].虽然早期的介绍人可能获得特别好的交易,但这可能为制药行业与其他参与者的谈判提供筹码,本研究也显示了这一点。在芬兰,正在通过推动国家采购昂贵的医院药品来寻求部分解决办法[24].
一直有人呼吁提高价格制定和价格的透明度[14,15,16,27,39],而关于更多使用多边环境措施的透明度下降被视为对全世界卫生系统有害[37].多边环境影响措施的广泛使用妨碍了证据的积累,特别是关于成本效益的证据,妨碍了卫生保健治疗的优先次序努力,并使关于药品支出的高质量统计数据无法实现。多边环境协定的使用也对专家、行政和报告能力提出了新的要求[23].从公共利益的角度来看,国际上有范围和需要改善多边环境协定的质量[27,36,37].
现行新药研发激励机制的全面检讨[40以及确保提高透明度的手段是必要的。理想情况下,应当有关于新药价值的充分信息,以便能够根据证据作出决策,公共资金为药品支付的价格应当是公开的信息。
本研究的局限性
本定性研究旨在描绘芬兰引入新的癌症药物的主要问题的概貌。描述新国家模式的感知价值的一个主要目的是为评价介绍性系统的功能提供反思的基础,而不是描述新国家模式的任何特定价值。作为一种定性研究,它无法对所有类型的非传染性疾病进行公正的评价。它也没有量化介绍系统中遇到的机会和挑战。尽管如此,本研究提供了一个总体观点,在芬兰和欧盟层面的引入制度改革中需要探索的问题。
数据和材料的可用性
该同意书确保了受访者的匿名性,访谈内容将被保密。
缩写
- 癌症非政府组织:
-
非政府组织与癌症相关的
- 一致:
-
芬兰保健选择委员会
- 教育津贴:
-
欧洲药品局
- 欧盟:
-
欧盟
- Fimea:
-
芬兰药品管理局
- FinCCHTA:
-
芬兰卫生技术评估协调中心
- FINOSE:
-
Fimea(芬兰)、NoMA(挪威)和TLV(瑞典)之间的HTA合作网络
- 水平:
-
卫生技术评估
- 克拉:
-
芬兰社会保险机构
- 意味着:
-
市场准入协议
- 不合格品:
-
新癌症药物
- 度:
-
门诊医疗
- 磅:
-
药品定价委员会
- 提升:
-
质量调整生命年
参考文献
世卫组织关于癌症的报告:确定优先事项、明智投资和为所有人提供保健。日内瓦:世界卫生组织;2020.授权:CC BY-NC-SA 3.0 IGO。
欧洲委员会。委员会向欧洲议会、理事会、欧洲经济和社会委员会和各区域委员会的来文。欧洲制药战略{SWD(2020) 286 final}, COM(2020) 761 final,布鲁塞尔,2020年11月25日。
诺曼诉FDA和欧盟批准的药物和器械。科学通报,2016;1(5):399-412。
Davis C, Naci H, Gurpinar E, Poplavska E, Pinto A, Aggarwal A.获得欧洲药品管理局批准的癌症药物的总体生存期和生活质量益处的证据:2009 - 2013年批准的药物回顾性队列研究。BMJ。2017; 359: j4530。https://doi.org/10.1136/bmj.j4530.
欧洲孤儿药的获取:当前和未来的问题。2012; 12:23-9。https://doi.org/10.1586/erp.11.95.
Wolchok JD, Chiarion-Sileni V, Gonzalez R,等。nivolumab和ipilimumab联合治疗晚期黑色素瘤的总生存率。中华医学杂志2017;377(14):1345-56。
艾西托PA,麦克阿瑟GA, Dréno B,等。Cobimetinib联合vemurafenib治疗晚期BRAF v600突变型黑色素瘤(coBRIM):一项随机、双盲、三期试验的最新疗效结果。柳叶刀杂志。2016;17(9):1248 - 60。
王晓燕,王晓燕,王晓燕,等。达拉法尼和曲美替尼联合治疗可提高黑素瘤患者的总生存率。中华医学杂志2015;372(1):30-9。
莫泽克,吴永利,Kudaba I,等。Pembrolizumab与化疗治疗既往未治疗、表达pd - l1的局部晚期或转移性非小细胞肺癌(KEYNOTE-042):一项随机、开放标签、对照、三期试验。《柳叶刀》杂志。2019;393:1819-30。
Hellmann MD, Paz-Ares L, Bernabe Caro R,等。Nivolumab联合ipilimumab治疗晚期非小细胞肺癌。英国医学杂志2019;381:2020-31。
Socinski MA, Jotte RM, Cappuzzo F,等。Atezolizumab用于转移性非鳞状NSCLC一线治疗。中国医学杂志2018;378:2288-301。
Kashoki M, Hanaizi Z, Yordanova S, Vesely R, Bouygues C, Llinaries J, Kweder S. EMA和FDA 2014-2016年新药上市申请决策的比较:一致性,不一致性,以及原因。临床药理学杂志2020;107(1):195-202。https://doi.org/10.1002/cpt.1565.
Grössmann N, Del Paggio JC, Wolf S, Sullivan R, Booth CNM, Rosian K, Emprechtinger R, Wild C. ema批准的实体瘤系统性癌症治疗5年——有意义临床获益的两个阈值的比较。《欧洲癌症杂志》2017;82:66-71。
谁。技术报告:癌症药物的定价及其影响:针对世界卫生大会第70.12号决议的一份综合技术报告:执行部分第2.9段,关于定价方法及其对预防和治疗癌症药物的可得性和可负担性的影响。世界卫生组织,2018。可以从https://apps.who.int/iris/handle/10665/277190.License: CC BY-NC-SA 3.0 IGO。
经济合作与发展组织。《药物创新与药物获取》,经合组织卫生政策研究,经合组织出版社,巴黎,2018年;https://doi.org/10.1787/9789264307391-en.
经济合作与发展组织。应对获取肿瘤药物方面的挑战。分析报告。巴黎经合组织,2020年。
tayi - teo K, Ilbawi A, Hill SR.原药公司销售的经fda批准的抗癌药物的销售收入和研发成本的比较。2019;2(1): e186875。https://doi.org/10.1001/jamanetworkopen.2018.6875.
跨国家合作,以改善世卫组织欧洲区域的药品和疫苗的获得。2020年哥本哈根:谁。
Boom CM, Aggarwal A, Sullivan R.癌症药物的商业决定因素。Eurohealth。2022;28(2):21。
查普曼AL,哈德菲尔德M,查普曼CJ。医疗保健中的定性研究:专题分析扎根理论的介绍。英国医学杂志2015;45(3):2015。https://doi.org/10.4997/JRCPE.2015.305.
博诺P, Hiltunen K-M, Korpelainen J, Pietilä M, Vanninen E. Kalliiden lääkkeiden käyttöönotosta suositus。【关于引进昂贵药品的建议】Näkökulma。Suom Laakaril。2018;73(36):1936 - 7。
Honkanen H, Snicker K, Ahlamaa J. Lääkkeiden riskinjakosopimukset Suomen sairaaloissa-kyselytutkimus。芬兰Laakaril。2019; 72(49): 2872 - 6。
Ajosenpää M, Huupponen R, Turpeinen M, Rannanheimo P. Uusien sairaalalääkkeiden hallitun käyttöönoton sopimukset-maksajan näkökulma。[医院新药品的管理准入协议-支付方的观点]剂量37:278 - 300,2021。
Pennanen T. Sairaalalääkehankinnat tehdään jatkossa yhteistyössä。【医院药品未来将共同采购】Lääkärilehti, 2022年9月9日,从https://www.laakarilehti.fi/ajassa/ajankohtaista/sairaalalaakehankinnat-tehdaan-jatkossa-yhteistyossa/.2022年8月2日访问。
社会事务和卫生部,芬兰。Näkökulmia lääkehoitoon ja lääkkeiden jakeluun liittyvistä muutostarpeista。【关于发展药学服务和配送需求的观点】Virkamiesmuistio。Sosiaali- ja terveysministeriön raportteja ja muistioita 2019:5,可从https://julkaisut.valtioneuvosto.fi/handle/10024/161340.2022年8月2日访问。
联合药品采购的逻辑基础和好处:我们公共机构的务实角色。社会科学与医学,2012;75(9):152-8。
Perehudoff K, Mara K, t Hoen E.有什么证据表明采取法律措施提高药品、疫苗和其他卫生产品市场的透明度(世界卫生大会第WHA72.8号决议)?哥本哈根:世卫组织欧洲区域办事处;2021.可以从https://apps.who.int/iris/handle/10665/342474.2022年8月2日访问。
Pokorny AMJ, Fabbri A, Bero LA,等。与制药工业的相互作用和实践,医学肿瘤学家和临床血液学家的知识和信仰:一个系统的审查。癌症杂志,2022;126:144-61。https://doi.org/10.1038/s41416-021-01552-1.
Florio M, Pancotti C, Prochazka DA。公共基础设施能克服市场失灵吗?欧洲制药研发。科学技术的未来。欧洲议会研究处。服务预见股(STOA), PE 697.197, 2021年12月,从https://www.europarl.europa.eu/thinktank/en/document/EPRS_STU (2021) 697197.2022年8月2日访问。
Haslam A, Lythgoe MP, Greenstreet Akman E, Prasad V. 2015-2020年美国批准的肿瘤药物的成本-效果研究特征。JAMA Netw开放。2021; 4 (11): e2135123。https://doi.org/10.1001/jamanetworkopen.2021.35123.
Parikh R, Min E, Wileyto E,等。不符合试验条件的晚期实体癌患者接受免疫检查点抑制剂治疗后的吸收和生存结局JAMA杂志。2021;7:1843-50。https://doi.org/10.1001/jamaoncol.2021.4971.
Torkki P, Leskelä R-L, Linna M, Mäklin S, Mecklin JP, Bono P, Kataja V, Karjalainen S 2004-2014年芬兰人口癌症成本和预后。57学报杂志。2018;(2):297 - 303。https://doi.org/10.1080/0284186X.2017.1343495.
科斯基宁H, Juntunen L, Junttila T, Kurko T Korvausjärjestelmään hyväksytyt uuddet syöpälääkkeet。Kohtaavatko saatavuus ja hyödyt?[新的癌症药物获得报销。索门Lääkäril 2019;74(6): 327-30。
2019年芬兰药品统计。Fimea和KELA, 2020年赫尔辛基http://urn.fi/URN:NBN:fi-fe20201217101079.2022年8月2日访问。
Fimea,克拉。Aluekohtainen tilannekuva avo- ja sairaanhoidon lääkekustannuksista。[门诊和住院患者药物费用的特定地区快照]。新闻稿,2021年12月,可从https://laaketieto.kela.fi/docs/tilannekuva_avo-ja_laitoshoidon_laake.pdf.2022年8月2日访问。
在经合组织国家和欧盟成员国,基于绩效的新药准入管理协议:它们是如何工作的以及未来可能的改进。经合组织卫生工作文件第115号,2019年。可以从https://www.oecd.org/health/health-systems/pharma-managed-entry-agreements.htm.2022年8月2日访问。
摩根SG,沃格勒S,瓦格纳AK。支付者在保密药品价格折扣方面的经验:对北美、欧洲和澳大利亚公共和法定卫生系统的调查。卫生政策。121:354 - 62。2017;
张志强,张志强。管制准入协议对药品价格的影响。卫生经济学。2020;29 (S1): 47 - 62。
2019年世界卫生大会。提高药品、疫苗和其他卫生产品市场的透明度,WHA 72.8。2019年,可以从https://apps.who.int/gb/ebwha/pdf_files/WHA72-REC1/A72_2019_REC1-en.pdf#page=25.2022年8月2日访问。
Marselis D, Hordjik L.从大片到“利基破坏者”:有缺陷的立法如何帮助制药业创造新的盈利模式。BMJ。2020; 370: m2983。https://doi.org/10.1136/bmj.m2983.
确认
作者要感谢所有受访者的时间和专业知识,并感谢芬兰癌症协会为这项研究提供的资金。感谢马克·沃勒将这些引文从芬兰语翻译成英语并进行语言编辑。感谢两位匿名审稿人的评论,他们的评论大大改进了文章。
资金
这项研究由芬兰癌症协会资助。
作者信息
作者和联系
贡献
EO负责研究的设计,进行采访,分析,并撰写草稿。VK和LS从研究的开始到结束都为研究的内容做出了贡献,包括访谈主题的确定和受访者的确定。他们提供了肿瘤学专业知识以及药学入门系统的专业知识。他们审阅了论文的几份草稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
经伦理批准,同意参与并发表
本研究的研究是按照芬兰国家研究诚信委员会TENK的伦理指南进行的https://tenk.fi/en/ethical-review/ethical-review-human-sciences.芬兰生物伦理学研究所就此发表了一份声明。访谈开始时,受访者签署了一份书面知情同意书。特定被采访者的引文连同每条引文的前一段被发送给采访者。
相互竞争的利益
Eeva奥利拉受雇于芬兰癌症协会,该组织也是多个癌症患者组织的伞形非政府组织。这项研究由芬兰癌症协会资助。没有其他要申报的财务利益冲突。视频电子设备标准协会Kataja自2013年起担任药品定价委员会(PPB)科学咨询委员会成员,并继续担任国家卫生保健服务评估委员会(Cohere) 2014-16年成员,自2017年起担任国家卫生保健服务评估委员会(Cohere)药品评估部门成员。Kataja是2014-2020年芬兰中部卫生保健区首席医疗主任,同时根据职位,也是医院药物评估委员会主席。没有要申报的经济利益。Liisa Sailas自2018年以来是北卡雷利阿社会和卫生服务Siun sote-Joint市政管理局医学咨询委员会成员,自2022年以来是库奥皮奥大学医院区医学评估委员会成员。没有要申报的经济利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
额外的文件1。
面试的问题。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
奥利拉,E, Kataja, V. & Sailas, L.大卫和歌利亚的设置:一项关于确保芬兰引入具有成本效益的新型癌症药物的挑战的定性研究。医药政策与实践J1552(2022)。https://doi.org/10.1186/s40545-022-00449-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40545-022-00449-5
关键字
- 癌症药物
- 芬兰
- 医疗保健政策
- 药物的介绍
- 卫生技术评估
- 定价