摘要
背景
尽管呼吁在药物开发过程中使用额外的真实世界证据(RWE),但在监管阶段的纳入率仍然很低。药物采用模型表明,与仅提供随机对照试验证据(RCTE)相比,向监管机构提供额外的RWE将导致更广泛的指示人群。在这里,我们验证了这个假设。
方法
2019年9月至12月期间,审查了2009年至2019年在欧洲药品管理局孤儿药登记册上批准的88种孤儿药的所有合同。试验被分组为包含随机对照试验证据(RCTE)或包含真实世界证据(RWE)的RCTE。提取了可指征人群(项目要求的治疗指征)和指征人群(最终批准的治疗指征)的数据,以及每种研究类型中限制指征人群的标准的中位数(RCTE/RWE)。卡方检验评估了指示人群(作为指示人群的比例)与证据类型(有或没有RWE的RCTE)之间的相关性,Wilcoxon秩和检验评估了RCTE和RWE研究之间限制性标准的中位数之间的差异。预测模型将功率分析的结果外推到预期将产生显著性的水平以及这将需要的时间。
结果
审查确定了103项业务,其中3项被排除在外(其中一项仅包含莱茵集团;其中两项仅包含系统的文献综述),最终分析为87种孤儿药留下了100项约定。只有13%的业务涉及莱茵集团。尽管差异无统计学意义,但76.92%的包含RCTE和RWE的纳入研究导致了更广泛的指示人群,而仅包含RCTE的纳入研究只有56.32%。RCTE(37(28,43))和RWE(5(2,9))研究的限制性标准中位数差异显著(p= 0.005)。建模表明,按照目前的RWE采用率,该分析将在2033-37年获得足够的电力。
结论
RWE研究的疾病人群比例大于RCTE。测试额外的RWE和更广泛的RWE之间关系的分析表明,按照目前的RWE采用率,人口将在2032年至2037年之间获得足够的电力。
背景
2020年,欧洲药品管理局(EMA)发布了《EMA监管科学至2025年》,其中五大核心建议之一是促进在监管决策中使用高质量的真实数据[1].OPTIMAL框架是EMA为RWE的监管使用制定的一套标准,用于解决其操作、技术和方法上的挑战[2].尽管已经认识到有必要将RWE纳入监管文件,并已努力界定其适当使用的界限,但制定坚定的指导方针仍然是战略优先事项[1,2].因此,RWE尚未在监管机构提交的文件中与临床试验一起广泛提供,其包含通常仅限于批准后的研究和安全监测[3.,4].然而,最近提出药物采用模型的证据表明,在监管阶段纳入RWE可能会增加最大采用的深度,每100名试验患者增加31名,每100个试验月减少最大采用的时间22个月[5].这表明早期RWE在制药公司和患者的临床试验中产生的巨大益处。
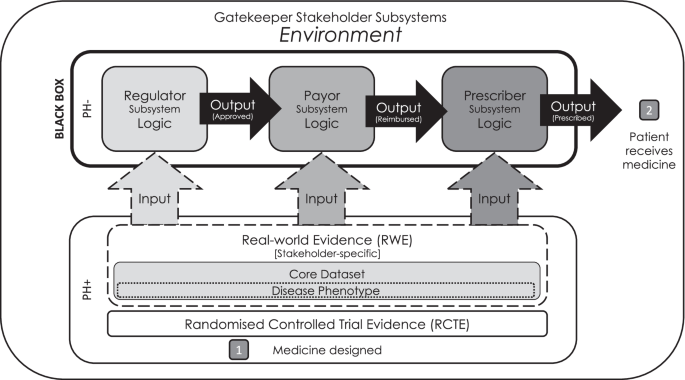
基于系统论[6],药物采用模型表明,药物的批准、报销、处方和接收发生在一个开放系统中,该系统包括三个连续的子系统,涉及监管机构、付款人和处方者[5].每个子系统都需要一组特定的证据来作为决策的基础。这通常以随机对照试验证据(RCTE)和特定利益相关者RWE的形式提供。该证据由各个子系统进行评估,如果其内部逻辑满足,且输出良好,则正在审批的药物将进入下一个系统。在最后一个子系统中,处方者批准用药物治疗患者的决定,此时患者接受药物治疗。因此,为了让药物通过这个系统到达患者手中,提供给看门人利益相关者的证据必须回答每个子系统提出的研究问题。
这三个子系统对RWE的态度是不同的,因此需要一个多个利益相关者的方法来生成RWE [7]以确保药物能及时地给适当的病人使用。简而言之,在任何采用阶段仅依赖RCTE都可能是次优的。此外,该研究表明,处方者控制药物最大采用的时间,最大采用深度的预期增加是由于RWE倾向于代表更大比例(广度)的疾病人群[7].因此,在提交监管申请时未能充分利用RWE的最大利益,可能会阻止可指示人群获得可能受益的药物。表明需要用一种新药治疗的疾病人群比例由监管子系统定义,传统上仅由RCTE提供,尽管其在适用于现实世界方面存在充分证明的局限性。RWE对该子系统的附加影响及其在疾病种群中所占比例的输出是本研究的主题。
方法
研究的目的是
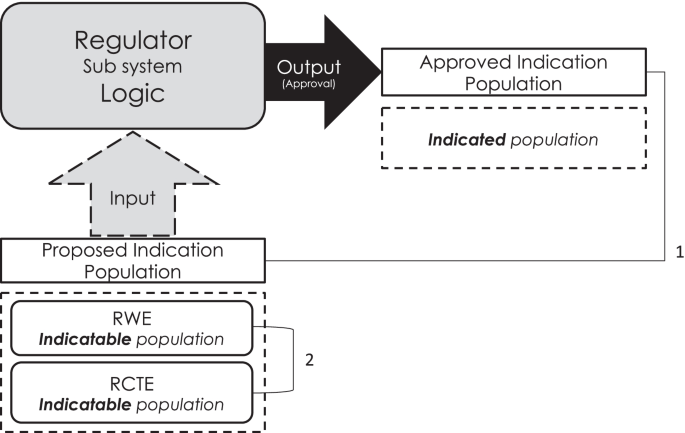
本研究的主要目的是确定在临床试验的监管约定中,与单独提交RCTE的监管约定相比,RWE加入RCTE是否增加了接受罕见药物治疗的人群的广度。我们期望在各自指示种群的大小之间有直接的比例效应。如果我们无法确定这一点,那么我们想知道,考虑到监管交战期间RWE加入RCTE的当前增长率,这种影响何时可能被检测到。次要目的是确定在监管会议期间提交的RWE中的可指示人群是否比RCTE中的更广泛,以确定任何可能影响的潜在机制(图2)。1).
设计、材料和工艺
这项研究分析了2009年至2019年在欧洲药品管理局(EMA)孤儿药登记册上批准的所有孤儿药的数据。在2019年9月至12月期间,对指定业务进行了审查。审计业务包括由上市许可申请人/持有人(MAA/H)向EMA提交支持药物的单独证据,以及EMA随后的回应。我们将构成证据分为RWE或RCTE。然后,我们通过测量限制可以接受药物的患者类型的标准的频率计数,确定每种证据的可指征人群(约定要求的治疗指征)和所指人群(最终批准的治疗指征)的大小。例如,Adcetris首次试验的适应症人群包括复发或难治性霍奇金淋巴瘤患者和复发或难治性系统性间变性大细胞淋巴瘤患者(标准计数= 4)。一般认为,限制性较强的标准代表的可指示/指示的人群较窄。可指示总体包括可用时从RCTE和RWE中提取的限制子(图2)。2).如果业务仅包含RWE,如果业务既不包含RCTE也不包含RWE,或者无法获得关于建议或指示人群的信息,则业务被排除在外。由于与单独的建议人群相关的支持性证据,对于有多个参与的药物,每个参与都被认为是有条件独立的。
统计分析
条形图直观地显示了契约的分布及其包含的证据类型。采用卡方检验评估所指人群与证据类型之间的相关性(RCTE伴或不伴RWE)。Wilcoxon秩和检验评估了RCTE和RWE研究中限制性标准频率计数的差异。在所有的分析中,p≤0.05为有统计学意义,采用R版本4.0.2。幂分析评估了RWE研究的小样本量对总体结果的影响。预测模型将这些结果外推到预期产生显著性的水平,以及所需的时间。该模型基于2010-2014年至2015-2019年研究增加的未来研究(或约定)的应计率,并假设随机对照研究的增加是线性的。该模型同时考虑了线性和指数设置下未来RWE的增加。结果显示,检测RCTE组和RCTE + RWE组之间在指示人群中观察到的差异所需的功率为常数。
结果
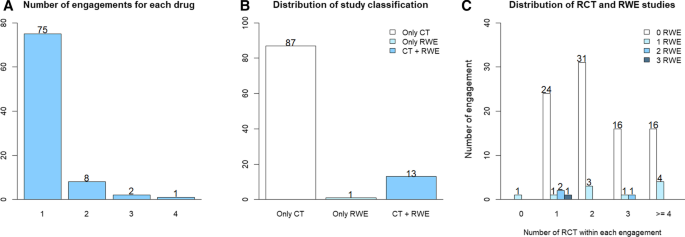
审查共确定了103项业务,其中3项被排除在外(其中一项仅包含莱茵集团;其中两项仅包含系统的文献综述),最终分析为87种不同的孤儿药留下了100项约定。在纳入的87种药物中,11种有一次以上的手术。在纳入的100项试验中,87项仅由RCTE组成,13项由RWE和RCTE组成,1项仅由RWE组成。数字3.提供每种药物的试验数量分布、试验中包含的研究类型以及研究类型的总体分布。表格1提供承保中包括的每种类型证据的指示总体差异(RWE或RWE的RCTE)。结果显示,单独提交RCTE的87项研究中有49项(56.32%)的指示人群更广泛,而RCTE与RWE一起提交的13项研究中有10项(76.92%)。然而,观察到的差异并无统计学意义(p= 0.269)。
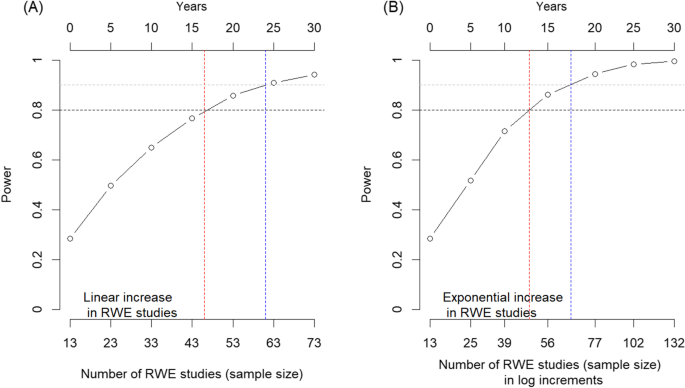
如表所示2, RCTE中提取的唯一限制子的中位数为37 (28,43),RWE中为5(2,9),差异有统计学意义(p= 0.005)。基于未来30年监管活动期间估计提交的研究数量的幂次分析显示,两组(有和没有RWE的RCTE)之间20%差异(2009-2019年期间观察到)的80%幂次将在大约17年(~ 2037年)实现线性增长,在大约13年(~ 2033年)实现指数增长(图2)。4).
讨论
主要研究问题旨在检验从以前的工作中提出的假设,其目的是确定在RCTE中添加RWE是否会增加一种新药的适应症人群。虽然涉及RWE的审计业务数量较少,限制了该分析的力量,但与仅提交RCTE的审计业务(56.32%)相比,包括RCTE和RWE在内的审计业务的指示人群(76.92%)有更广泛的趋势。然而,这种差异在统计上并不显著(p= 0.269)。预测模型显示,根据RWE纳入监管业务的指数增长还是线性增长,将在13至17年内实现足够的能力来检测这两组之间的显著差异。当RCTE和RWE都在监管会议期间提交时,RWE所表明的人群明显比其所伴随的RCTE所表明的人群更广泛。这支持了先前关于指示人口宽度的工作所产生的假设,即使最终的效应大小仍在出现。
包含RWE的业务在分析中包含的100项业务中占了相对较小的百分比(13%)。这并不奇怪,因为监管机构目前仍在鼓励制药公司生成RWE并将其纳入上市许可的提交文件中,并为此制定公司指南[1].目前,在药物开发过程中,RWE生成的设计和实施障碍阻碍了其与监管机构提交的同步。例如,临床开发团队往往有一个短期的观点,由于他们的传统重点放在监管子系统和确保监管批准,排除其他子系统和把关任务。下游目标可被视为营销后职能的责任,如商业、市场准入和医疗事务。为了使RWE和RCTE的交付同步并优化新药的采用,RWE必须与三期研究同时启动[8].
此前关于药物采用模型的研究表明,处方者控制最大采用深度,这可能解释了监管机构批准更广泛的适应症,并将RWE纳入业务约定的可能性。这是因为在监管会议期间将RWE加入RCTE将增加批准的可能性,并缩短处方者为患者开出已批准药物的时间。作为模型中的初始子系统,能够获得药物的人群的控制在于监管机构,因为报销决策主要局限于监管子系统批准的指定人群。一个可能的例外是处方者子系统,如果有适当的理由,它可以灵活地在指定的人群之外开药。这一论点与现有证据一致,表明仅来自RCTE的证据可能不足以确定新技术的成本效益[9].采用一种新药的一个基本前提是有证据表明在特定患者群体中具有有利的风险-收益概况。我们假设,额外的RWE将增加疾病人群的广度,显示出这种有利的风险-收益,这样做,满足调控子系统的内部逻辑,从而实现更广泛的指示人群。早期RWE交付运营仍面临挑战,超出了在第三阶段设计阶段参与下游职能的挑战[10].
了解用于生成RWE的车辆是当务之急[11].患者登记或前瞻性或回顾性的观察性队列临床研究可以说是进行初步研究的唯一选择[12,13].关于收集的真实世界数据的性质仍然存在问题,特别是所要求的数据缺失,以及所收集的数据如何准确地反映疾病表型[11,12].最近描述的关于结构测量的理论主张以中立的态度观察任何招募者进行临床研究,以确保所有影响都得到认可[13].在测量与健康相关的生活质量时未能应用中性理论的例子已被记录在案[13].为了应用这些原则,调查人员必须注意研究和开发一个核心数据集,该数据集包含所有相关指标,排除所有不相关指标。一个多学科专家小组一致同意的两个质量指标是核心数据集和在罕见病环境下与患者进行患者登记的需要[14].
这些核心指标也需要测试是否符合标准的诊断和监测实践,以避免该研究被某些监管机构视为临床试验[15].考虑到药物采用模型中各看门人利益相关者研究问题的异质性,他们参与任何核心数据集开发对于确保计划的研究能够回答他们的研究问题至关重要。从他们的角度来看,调查结果将构成“证据”[14].因此,在现实世界的研究中,一个中立的指标列表只能通过与每个看门人利益相关者进行详尽的有针对性的研究来实现。因此,最佳的现实世界研究设计将同时考虑药物的采用模型和RWE生成的多利益相关者方法。除了指标开发之外,进一步的工作将包括研究每个子系统中的逻辑,以为RWE的设计提供信息,确保它不仅在最早的机会交付,而且在促进新药物的采用方面是准确的和适合的。[16].
在罕见病医学的背景下,患者的登记是RWD的宝贵来源[17].为了加强RWE对监管报告的贡献,MAA/Hs必须采取一切合理步骤,将每一位接受RCT以外药物的患者纳入患者注册表。一种方法可能需要通过早期准入计划、慈悲使用计划招收这些患者接受治疗[18并列出病人的要求。尽管在监管阶段纳入RWE的组织方面研究较少,但与早期准入计划一起启动RWE的生成可以利用前置时间,而对监管参与的总体持续时间影响最小[19].在罕见病随机对照试验中,为了确保研究结果的内部有效性,排除了具有多种合并症的异质组,从这些组中产生的RWE可能是监管阶段的补充[19].然而,RWE中由小型、非代表性队列引起的选择偏倚和I型错误是在确定RWE是否适合监管使用时必须解决的风险,应考虑使用统计方法来解决患者群体差异[20.].最后,必须为任何研究提供适当的背景,以便充分了解研究结果的重要性。在这种情况下,适当的RWE规划和设计及其与RCTE同步交付以及时提交法规,不仅可以最大限度地增加更快接受新药的患者数量,而且更重要的是,否则将得不到治疗或接受次优治疗的患者现在有机会被纳入指定人群。因此,更多的患者会更快受益。每个患者都应该得到最佳治疗,这可以通过尽早向决策者提供优化的证据来实现。
限制
这项研究的范围仅限于欧洲的孤儿药。虽然可能没有确凿的证据表明,这必然限制了研究结果在北美或其他地区(如中国和日本)的普遍性,但应将其视为一种限制。稀有药物和非稀有药物的采用模式不太可能有所不同,但在没有明确确认的情况下,这需要被视为一个潜在的限制。
未来的发展方向
认识到这项研究的主要研究问题仍未得到解答,由于包含莱茵集团的有限交战,关键的下一步将是在未来的日期重复这项工作。在详细阐述在管理子系统中采用的逻辑方面,现在有一些信息。然而,还需要进一步研究,以生成一份由监管子系统、付款人和开出处方者使用的中立规则和原则清单。
结论
虽然RWE数量在增加,但作为监管申报的一部分,与RCTE一起交付的RWE数量目前不足以达到适当的统计能力,以了解它是否增加了指示或批准的人群的广度。按照目前的提交速度,答案将在13到17年后揭晓。RWE中观察到的人群占总疾病人群的比例明显大于RCTE中观察到的人群;因此,为调节子系统批准新药物用于的人群规模的新兴影响提供了一个机制基础。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 莱茵集团:
-
真实的证据
- RCTE:
-
随机对照试验证据
- 教育津贴:
-
欧洲药品管理局
- MAA / H:
-
上市许可申请人/持有人
参考文献
欧洲药品管理局。EMA监管科学到2025年。2020.2021年12月20日访问。https://www.ema.europa.eu/en/documents/regulatory-procedural-guideline/ema-regulatory-science-2025-strategic-reflection_en.pdf.
Cave A, Kurz X, Arlett P.监管决策的真实数据:欧洲面临的挑战和可能的解决方案。临床药物学杂志2019;106(1):36-9。https://doi.org/10.1002/cpt.1426.
Varnai P, Davé A, Farla K, Nooijen A, Petrosova L.证据揭示研究:探索欧洲制药行业使用真实世界证据和复杂临床试验设计。临床药物学。https://doi.org/10.1002/cpt.2103
鲍姆菲尔德,安德烈·E,雷诺兹R,考贝尔P,阿祖莱L,德雷尔NA。使用真实数据的试验设计:监管审批过程的变化景观。中国药物流行病学杂志2020;29(10):1201-12。https://doi.org/10.1002/pds.4932.
Jandhyala R.在产品发布时评估补充现实证据(RWE)预期效果的药物采用模型。中国医学杂志,2018;37(9):1645-55。https://doi.org/10.1080/03007995.2021.1947218.
卢曼N,贝克D,吉尔根P.系统理论导论。剑桥:政治出版社;2013.
真实世界证据(RWE)生成的多利益相关者方法:观察多学科专家对罕见病患者登记(rdr)质量指标的共识。Curr Med Res Opin, 2021。https://doi.org/10.1080/03007995.2021.1927689.
Jenkins D, Bujkiewicz S, Dequen P, Abrams K,代表GetReal W.在临床开发计划中纳入真实世界的证据。试验。2018;19(1):468。https://doi.org/10.1186/s13063-018-2769-2.
Sculpher M, Claxton K.在不确定的条件下建立新药的成本效益——什么时候有足够的证据?《价值健康》,2005;8(4):433-46。https://doi.org/10.1111/j.1524-4733.2005.00033.x.
Warner JJ, Crook HL, Whelan KM, Bleser WK, Roiland RA, Lopez MH,等。通过以患者为中心的研究和临床试验,改善心血管药物和设备的开发和证据。心血管质量结果。2020;13(7):e006606。https://doi.org/10.1161/CIRCOUTCOMES.120.006606.
Berger ML, Sox H, Willke RJ, Brixner DL, Eichler HG, Goettsch W,等。治疗和/或比较有效性的真实世界数据研究的良好实践:isor - ispe联合特别工作组关于医疗保健决策中的真实世界证据的建议价值健康。2017;20(8):1003-8。
马达尼,马达尼,马志强,杨晓明。基于非随机数据的治疗效果比较研究:ISPOR回顾性数据库分析工作组良好研究实践报告第一部分:价值健康。2009;12(8):1044-52。https://doi.org/10.1111/j.1524-4733.2009.00600.x.
Jandhyala R.中性理论:在特定工具可用的疾病或条件下,使用与健康相关的通用生活质量工具的适用性和中立性。中国生物医学工程学报。2021;21(1):86。https://doi.org/10.1186/s12874-021-01279-w.
Jandhyala R.评论:“患者登记处:药物评估中未充分利用的资源:在监管评估中增加患者登记处使用的操作建议。”中国医药杂志2019;42(12):1515-6。https://doi.org/10.1007/s40264-019-00862-x.
理事会指令2001/20/EC,关于在人用药品临床试验中实施良好临床规范的相关成员国法律、法规和行政规定的近似。官方J. L121。2001.意思是。
高志刚,李志刚,李志刚,等。真实世界证据(RWE)——颠覆性创新还是医学证据生成的悄然演变?F1000Research。2018; 7(111): 1 - 14。
吴娟,王超,Toh S, Pisa FE, Bauer L.在美国罕见病监管决策中使用真实世界证据的现状和未来方向。中国药物流行病学杂志2020;29(10):1213-8。https://doi.org/10.1002/pds.4962.
Balasubramanian G, Morampudi S, Chhabra P, Gowda A, Zomorodi B.欧盟成员国慈悲使用项目概述。顽固性罕见病,2016;5(4):244-54。
李敏,陈松,赖勇,等。在监管决策过程中整合现实证据:使用逻辑模型对美国、欧盟和中国的经验进行系统分析。前方医学,2021年。https://doi.org/10.3389/fmed.2021.669509.
Miksad RA, Samant MK, Sarkar S, Abernethy AP.小而强大:使用真实世界的证据来指导精准医疗。中国药物学杂志,2019;26(1):379 - 379。https://doi.org/10.1002/cpt.1466.
确认
作者要感谢Medialis有限公司的生物统计学家和医学作家在统计和写作/编辑方面的支持。
资金
作者在这项工作中没有得到任何资助。
作者信息
作者及隶属关系
贡献
RJ构思了这项研究,设计了这项研究,并且是本手稿的唯一作者。作者阅读并批准了最终稿。
相应的作者
道德声明
伦理批准并同意参与
伦理批准和参与同意不适用。
发表同意书
不适用。
相互竞争的利益
作者是Medialis Ltd的创始人和首席执行官,Medialis Ltd是一家医疗事务咨询和合同研究组织,参与设计和交付现实世界的证据,包括患者报告的结果和患者登记。
额外的信息
编辑责任:Zaheer Babar,哈德斯菲尔德大学,英国。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Jandhyala, R.在欧洲药品管理局提交的关于罕见病药物治疗的人口范围的监管报告中添加真实证据的影响。制药政策与实践J15, 36(2022)。https://doi.org/10.1186/s40545-022-00433-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40545-022-00433-z
关键字
- 真实的证据
- 药物采用模式
- 随机对照试验
- 孤儿药
- 多利益相关者方法