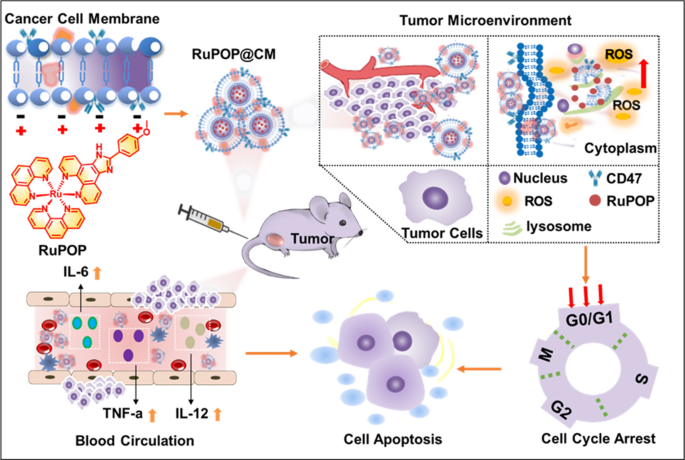
摘要
背景
金属配合物的癌细胞膜伪装纳米技术可以增强其生物相容性,延长其在体内的有效循环时间。钌多吡啶配合物(RuPOP)具有广泛的抗肿瘤活性,但仍存在生物相容性差、缺乏靶向性、易被机体代谢等缺点。癌细胞细胞膜上保留了大量的表面抗原和肿瘤粘附分子CD47,可用于伪装金属配合物,使其具有肿瘤归巢能力和较高的生物相容性。
结果
因此,本研究提供了一种静电吸附的方法,利用RuPOP与细胞膜之间正负电荷的静电相互作用,构建癌细胞膜伪装纳米平台(RuPOP@CM)。有趣的是,RuPOP@CM维持了表面抗原和肿瘤粘附分子的表达,可以抑制巨噬细胞的吞噬作用,降低RuPOP的清除率,增加有效循环时间,从而增强肿瘤部位的积累。此外,RuPOP@CM可增强细胞免疫反应活性,促进TNF-α、IL-12、IL-6等炎性细胞因子的产生,对肿瘤的治疗具有重要意义。另一方面,RuPOP@MCM可使细胞内ROS过量产生,从而加速肿瘤细胞的凋亡和细胞周期阻滞,在体内外均发挥优异的抗肿瘤作用。
结论
总之,对癌细胞膜-伪装金属配合物进行工程改造是提高其生物相容性、生物安全性和抗肿瘤作用的一种潜在策略。
简介
配合物独特的分子结构、配体交换、氧化还原和催化等特性使其有机会与生物分子发生反应,使其成为具有生物活性的治疗化合物,在肿瘤治疗中具有广阔的应用前景[1,2].多种化合物已被批准用于临床治疗和成像目的。到目前为止,它们在癌症治疗中有着广泛的应用,被认为是很有前途的药物,包括化疗、光动力治疗和成像引导治疗[3.].以顺铂为代表的金属配合物具有广谱抗肿瘤活性,目前仍是临床肿瘤治疗的一线药物。顺铂化疗药物的出现及其强大的抗癌作用引起了科学家对金属抗癌药物的极大兴趣。迄今为止,许多种类的含金属化合物在癌症治疗和诊断中的应用已经被研究,如钌配合物,[4,5铱配合物、铂配合物、金配合物等[6,7,8,9,10].例如,Liang等报道了一种针对钌基光敏剂量身定制的多功能抗癌系统,该系统可在近红外双光子光源的激发下重塑肿瘤微环境,增强联合癌症治疗效果[4].王等人发现铱(III)络合物(Ir1)可产生损伤相关分子模式(DAMPs),增加内质网应激和活性氧种类,最终导致肺癌细胞产生长效抗肿瘤免疫[9].尽管许多金属配合物在癌症治疗中已被证明具有良好的疗效并进入临床试验,但它们也存在着类似的缺点,如对正常细胞不可避免的毒性,生理条件下的生物相容性和溶解度较低,阻碍了其进一步的临床应用[11].因此,寻找有效的方法来取代金属配合物的这些缺点是十分重要的。
随着纳米技术的飞速发展,金属配合物的纳米工程在恶性肿瘤的诊断和治疗中克服了自身的不足,取得了很大的进展[12,13].科学家们在金属配合物的修饰方面做出了很大的努力,采用了多种方法,如具有酶模仿活性的金属氧化物纳米材料、聚合物、脂质体、胶束和无机纳米颗粒装饰,以及与其他抗癌药物的结合[14,15].尽管脂质体具有较高的生物相容性和简单的配方,聚合物基纳米载体在亲水性和疏水性药物方面表现出了多功能性,但它们也存在毒性和稳定性方面的问题[16].此外,金属基纳米药物很难识别并进入肿瘤区域,往往在免疫系统的攻击下失去有效的疗效[17,18,19].因此,构建金属配合物的仿生纳米平台,既能避免免疫系统的攻击,又能降低免疫系统的清除率是非常重要的。同时,细胞膜封装纳米技术因其维持细胞表面生化特性,如抗原和细胞粘附分子等逐渐引起人们的关注,可作为生物激发的纳米技术来防止纳米药物的清除,增强生物相容性和体内血液循环时间[20.,21,22,23].用红细胞来伪装纳米颗粒,这进一步证实了与聚乙二醇修饰的颗粒相比,包裹在小鼠红细胞膜中的纳米颗粒的半衰期更长,在循环中半衰期可达40小时[24].此外,在肿瘤细胞膜表面存在一种特殊抗原,可特异性识别同源肿瘤,延长其在肿瘤部位的滞留和归巢能力[25,26,27].一方面,与其他膜相比,包裹在肿瘤细胞膜上的纳米颗粒具有主动靶向性,可以依靠肿瘤微环境中毛细血管的浸润到达肿瘤部位,通过同样的识别机制进一步主动聚集到肿瘤病变部位[28].另一方面,肿瘤细胞膜伪装纳米粒子可以利用肿瘤细胞膜的特征蛋白激活免疫系统,提高对病原体的清除能力[29].例如,Shen等人构建了一种伪装癌细胞膜的铱配合物功能化的Ir-B-TiO黑钛纳米颗粒2@CCM,并发现与未包覆的纳米颗粒相比,癌细胞膜的同源靶向和免疫逃逸特性促进了Ir-B-TiO的选择性积累2@CCM对同源肿瘤细胞,同时避免巨噬细胞的免疫排斥,提高肿瘤聚集和治疗的安全性[30.].此外,癌细胞具有许多优良的特性,包括免疫逃逸和同源靶向能力等。在转移阶段,同型癌细胞聚集对远处器官继发性病变的形成非常重要。也有报道称,聚集过程是基于肿瘤细胞膜表面粘附分子。细胞毒性药物已被证实,一些药物通过表达肿瘤特异性抗原和癌细胞表面的MHC-I分子诱导免疫原性[31].综合而言,合理设计具有细胞膜伪装技术的金属配合物生物激发纳米材料是克服其缺点,增强癌症治疗的新策略[32,33,34].
在此,受细胞膜仿生纳米技术各种优点的启发,我们利用癌细胞膜(CM)伪装钌多吡啶基配合物(RuPOP),获得了一个仿生纳米平台RuPOP@CM。进一步的研究结果表明,RuPOP通过抑制巨噬细胞的吞噬作用,减少细胞膜伪装修饰后的溶血,提高血液相容性和生物安全性,延长循环时间。此外,RuPOP@CM可增强细胞免疫反应活性,在血液中产生IL-6、IL-12、TNF-α等炎性细胞因子,对肿瘤转移引起的循环肿瘤细胞或血液肿瘤的治疗具有重要意义。乳腺癌细胞MDA-MB-231和白血病细胞K562在血液中循环的肿瘤细胞较多,因此我们选择了这两种细胞作为我们的靶点。分别成功合成了负载RuPOP的MDA-MB-231细胞膜(RuPOP@MCM)和改性RuPOP的K562细胞膜(RuPOP@KCM)。CM的表面伪装修饰保留了纳米药物中粘附分子、表面抗原等肿瘤粘附分子,使RuPOP避免了血液中巨噬细胞的吞噬,具有强大的肿瘤到达能力。另一方面,RuPOP@MCM可使细胞内ROS过量产生,从而加速肿瘤细胞的凋亡和细胞阻滞,发挥良好的抗肿瘤作用(Scheme1).综上所述,本研究为利用金属配合物的癌细胞膜伪装纳米技术设计生物激发纳米材料提供了一种巧妙的设计,以克服其缺点,增强癌症治疗。
结果与讨论
RuPOP@CM的合成与表征
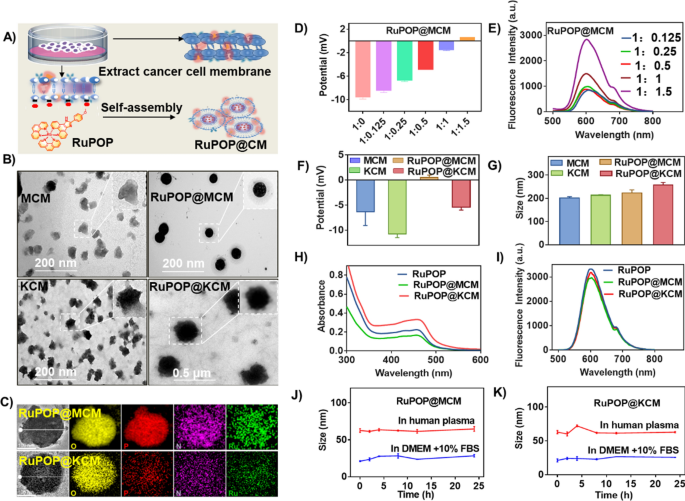
癌细胞膜伪装RuPOP复合物(RuPOP@CM)的制备过程如图所示。1A, RuPOP@CM是通过聚碳酸酯多孔膜反复挤压RuPOP和新鲜提取的MDA-MB-231和K562细胞膜。本研究成功合成了RuPOP@MCM和RuPOP@KCM,并通过显微和光谱分析对其进行了表征。在无花果。1B、TEM图像显示,提取的MDA-MB-M231和K562细胞膜为不规则片状,大小约为100 nm。与纯细胞膜相比,RuPOP@MCM和RuPOP@KCM为球形,大小相近,高度单分散,形状均匀。接下来,在最终的RuPOP@CM纳米颗粒中O、P和Ru信号的存在进一步证实了细胞膜的成功伪装(图1)。1C).令人鼓舞的是,我们对CM中RuPOP结合的最佳比例进行了有趣的探索。正如预期的那样,当RuPOP被细胞膜包裹的体积比为1:1.5时,RuPOP@MCM的电位达到最大(图1)。1D),荧光光谱也显示了相同的结果(图。1E),我们进一步选择这个比例进行后续的实验。相比之下,从zeta电位来看,MDA-MB-231和K562细胞被带负电的CM伪装后,RuPOP@MCM和RuPOP@KCM zeta电位分别增加到0.48 mV和−5.3 mV,而游离MCM和KCM的zeta电位分别为−6.3 mV和−10.8 mV,这可能与癌细胞细胞膜表面电荷降低有关(图5)。1F)。此外,MCM、KCM、RuPOP@MCM和RuPOP@KCM的水动力直径分别为200 nm、213 nm、223 nm和257 nm(图1)。1G). RuPOP和RuPOP@CM在479 nm处有明显的吸光度峰(图。1H)和600 nm处的荧光发射峰(图。1I)高度一致,说明RuPOP被CM伪装了。此外,为了评价它们的分散和稳定性,我们观察了MCM、KCM、RuPOP@CM和RuPOP@KCM在含10%胎牛血清和人血清的DMEM等不同生理环境下的大小变化。如图所示。1J,K,两种溶液中纳米颗粒的大小在24 h的观察时间内都是稳定的,说明RuPOP@CM在血液中具有良好的稳定性。综上所述,这些结果证实了RuPOP成功被癌细胞膜包裹。
RuPOP@MCM的合理设计与综合。一个RuPOP@MCM和RuPOP@KCM的制备示意图。BMCM、RuPOP@MCM、KCM和RuPOP@KCM的TEM图像。CRuPOP@MCM和RuPOP@KCM的元素映射。DZeta势和(E) RuPOP@MCM与MCM和RuPOP在不同混合比比例下的荧光光谱。FZeta势和(G) MCM的平均水动力直径RuPOP@MCM(比例为1:1.5)、KCM和RuPOP@KCM(比例为1:1.5)。H紫外可见光谱和(我) RuPOP、RuPOP@MCM(比例为1:1.5)和RuPOP@KCM(比例为1:1.5)的荧光光谱。稳定的(J) RuPOP@MCM和(K) RuPOP@KCM添加10%胎牛血清或人血清的DMEM 24 h内
在体外抗癌功效RuPOP@CM
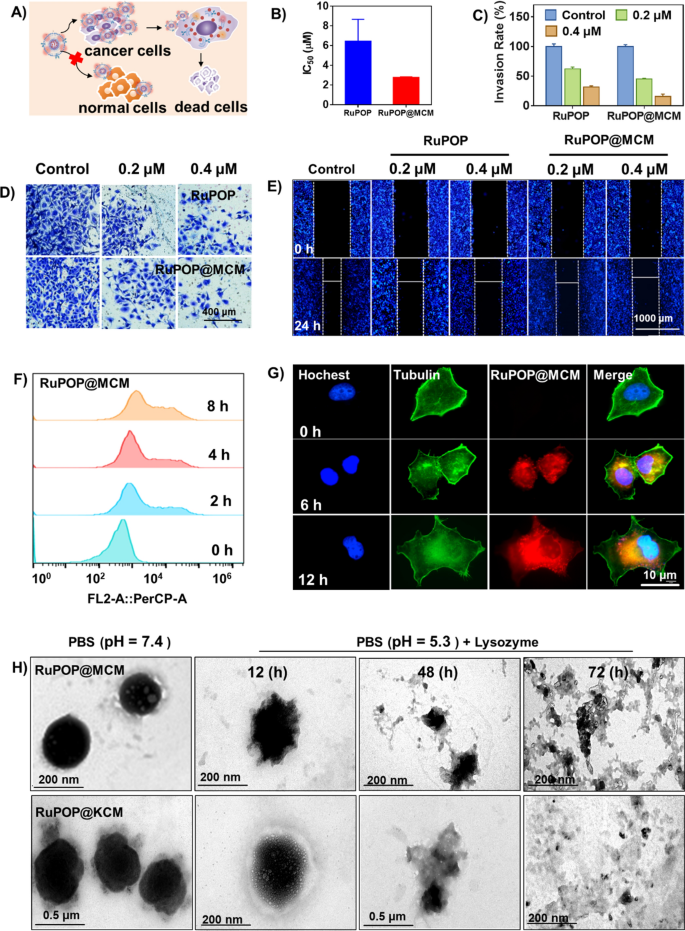
为了评估RuPOP@CM的体外抗癌效果和安全性,我们评估了RuPOP、RuPOP@MCM和RuPOP@KCM对肿瘤细胞和正常细胞的毒性,包括MDA-MB-231细胞、K562细胞、HK-2细胞、i -38细胞和Ect1/E6E7细胞(图1)。2A).与RuPOP单独相比,RuPOP@MCM对正常细胞如HK-2细胞、WI-38细胞和Ect1/E6E7细胞具有较低的细胞毒性,而对MDA-MB-231细胞具有较强的杀伤力(图1)。2B,额外的文件1:图S1)。这些结果表明,肿瘤细胞膜的伪装修饰可以降低RuPOP对正常细胞的毒性,提高其安全性。细胞侵袭和迁移是肿瘤发生和转移的必要标志。为了进一步评价RuPOP@CM纳米药物的抗癌活性,我们进行了transwell侵袭和划痕实验。如图所示。2C、D、RuPOP@MCM在低毒浓度下显著抑制肿瘤细胞的侵袭。同时,RuPOP@CM可显著抑制肿瘤细胞增殖,形成划痕隙(图1)。2E).结果清楚地表明,RuPOP@CM在体外仍具有有效的抗癌活性和对肿瘤侵袭迁移的良好抑制作用。
RuPOP@MCM具有良好的体外抗肿瘤能力。一个RuPOP@MCM治疗杀死MDA-MB-231肿瘤细胞方案。B集成电路50不同浓度的RuPOP和RuPOP@MCM处理mda - mb -231细胞72 h。C-DRuPOP或MCM@RuPOP对MDA-MB-231细胞的抗侵袭作用测定。ERuPOP或RuPOP@MCM在MDA-MB-231细胞上的创面愈合试验(标尺= 100 μm)。FRuPOP@MCM在MDA-MB-231细胞上不同时间的细胞摄取。GMDA-MB-231细胞中RuPOP@MCM的胞内定位。细胞骨架用Alexa Fluor 488 phalloidin标记(绿色荧光),细胞核用Hoechst 33,342标记(蓝色荧光)。H溶菌酶孵育12 h、48 h、72 h后RuPOP@MCM和RuPOP@KCM的形态变化
此外,细胞摄取被认为是药物抗肿瘤活性的一个关键因素。因此,我们首先通过流式细胞术检测了RuPOP、RuPOP@MCM和RuPOP@KCM的细胞摄取。在无花果。2F,细胞对RuPOP@CM的吸收随着时间的增加而增加,对RuPOP@MCM和RuPOP@KCM的吸收高于单独的RuPOP(附加文件1:图S2A-B),进一步说明细胞膜的伪装可以增加细胞对RuPOP的吸收。通过用Alexa Fluor 488 phalloidin对MDA-MB-231细胞骨架进行染色,我们证实RuPOP@MCM在细胞浆中积累12 h(图1)。2G)。此外,我们还用Hoechst 33,342(蓝色)和Lyso-Tracker(绿色)染色细胞核和溶酶体,探索RuPOP@MCM的细胞内易位。正如预期的那样,RuPOP@MCM的红色荧光以时间依赖性的方式增加,并与绿色荧光信号很好地融合1图S2C),符合RuPOP@MCM进入细胞是通过溶酶体内吞作用介导的。随后,我们模拟了人体体循环环境(PBS pH值为7.4)和细胞溶菌酶中的酸性环境(PBS pH值为5.3,溶菌酶浓度为1 mg mL)−1),并观察了不同条件下来自RuPOP@MCM和RuPOP@KCM的RuPOP版本。如图S3所示,随着时间的增加,RuPOP@MCM在人体体循环环境中逐渐释放(PBS pH值为7.4)。相比之下,细胞溶菌酶中酸性环境(pH为5.3的PBS与溶菌酶)的RuPOP@MCM在孵育12 h时释放的量要远远多于pH为7.4的PBS,这说明溶酶体是RuPOP@MCM胞内定位的重要细胞器,而RuPOP@MCM在溶菌酶环境中释放得更好。RuPOP@MCM和RuPOP@KCM在pH 7.4的PBS中均质且高度分散(图1)。2H).在溶菌酶溶液的孵育下,这两种纳米颗粒在12 H后出现收缩和空化现象,随着时间的增加,这些纳米颗粒逐渐失去了完整的球形外观,在溶酶体环境中继续膨胀破裂,在72 H时完全破碎。这一现象表明细胞溶菌酶中的生物酶与细胞膜之间存在生物相互作用,从而导致RuPOP@CM的崩解和RuPOP的释放。综上所述,这些结果说明溶酶体是RuPOP@MCM细胞内定位的重要细胞器,直接影响纳米药物的吸收和RuPOP的释放。
RuPOP@CM的血液相容性、药代动力学特性和体内免疫原性
金属配合物的血液相容性是评价药物生物安全性应考虑的重要因素。我们评价了RuPOP@CM在小鼠体内的生物安全性。来自照片的红细胞图。3.A-C,我们可以直接看到RuPOP处理过的红细胞表面出现小孔甚至损伤,而RuPOP@CM孵育后没有明显的形态变化。此外,RuPOP的溶血率高于RuPOP@MCM和RuPOP@KCM纳米颗粒(图1)。3.D). RuPOP@MCM和RuPOP@KCM纳米颗粒在不同时间的溶血率均保持在5%以下。这些结果表明,由于细胞膜的伪装修饰,RuPOP的血液相容性显著提高,促进了仿生医学在临床的应用。
RuPOP@CM的体外血液相容性和免疫活性。红细胞经(一个) RuPOP, (B) RuPOP@MCM和(C) RuPOP@KCM 6小时。DRuPOP、RuPOP@MCM、RuPOP@KCM的溶血检测。E静脉注射RuPOP和RuPOP@MCM后血浆中RuPOP含量随时间的变化。药代动力学指数(F)K10 (G)捷运(H) RuPOP的CL, RuPOP@MCM和RuPOP@KCM。细胞因子水平(我肿瘤坏死因子-α(J) IL-6,和(K) RuPOP、RuPOP@MCM和RuPOP@KCM分别作用24、48和72 h后小鼠血清中IL-12的含量(n=每组5只)。lRuPOP@MCM诱导激活免疫活性的方案说明
更重要的是,血液循环中的快速清除也是医学不可忽视的另一个严重缺陷。因此,为了验证细胞膜仿生伪装是否可以改善这些缺陷,我们对RuPOP和RuPOP@MCM进行了药代动力学分析。如图所示。3.E, RuPOP@MCM纳米颗粒的血液含量高于游离RuPOP,我们还发现,随着时间的增加,单独的RuPOP被清除得很快。根据拟合方程计算的药代动力学参数可知,细胞膜经过仿生伪装修饰后,RuPOP@MCM在血液中的去除率(K10)降低(图5)。3.F)。此外,RuPOP@MCM还显著提高了消除半衰期(消除期,T1冲击2 β)、最大血浆浓度(Cmax)、曲线下面积(AUC 0-80 h)、平均保留时间(MRT)和间隙(CL)值(图1)。3.G,H)与自由RuPOP比较。例如,RuPOP@MCM纳米颗粒的血液清除率(CL = 0.03 ng/(ng/mL)/h)低于RuPOP (CL = 0.10 μg/(ng/mL)/h)。有趣的是,RuPOP@MCM纳米粒子的半衰期(t1/2=2.4 h)高于RuPOP (t1/2=1.6 h),这一现象说明RuPOP@CM的血液循环时间延长了1:表S1、S2、S3)。这些指标均符合双室药代动力学。因此,这些结果进一步证明了细胞膜的仿生伪装装饰可以在一定程度上提高RuPOP的血液循环时间,改善其药代动力学。
此外,我们认为这可能是因为癌细胞细胞膜上保留了大量的表面抗原和肿瘤粘附分子,引发了巨噬细胞更强的炎症反应。进一步监测注射RuPOP@CM纳米颗粒后小鼠血清中细胞因子TNF-α(细胞免疫激活的重要标志物)、白细胞介素-6 (IL-6,体液免疫激活的重要标志物)和白细胞介素-12 (IL-12,先天免疫激活的重要标志物)的变化。如图所示。3.RuPOP@MCM和RuPOP@KCM纳米颗粒诱导的I、J、K、3种细胞因子释放均高于游离RuPOP组。此外,在72 h时,RuPOP@MCM和RuPOP@KCM纳米颗粒诱导的IL-6释放低于LPS组(附加文件1:图S4)。因此,我们认为可能是由于癌细胞细胞膜上保留了大量的表面抗原和肿瘤粘附分子,引发了巨噬细胞较强的炎症反应,在肿瘤的治疗中,特别是对肿瘤转移或血液肿瘤的循环肿瘤细胞有极好的优势(图1)。3.L)。
RuPOP@CM纳米颗粒的抗癌机理
基于RuPOP@CM在体外具有优异的抗肿瘤作用,我们对其潜在的抗肿瘤机制进行了简要的研究(图1)。4A).首先,更多的文献报道了肿瘤球状体生长到直径超过200 μm时,其微环境与体内肿瘤组织相似。在此基础上,我们成功地在体外建立了MDA-MB-231细胞的肿瘤球模型,并在第4天使其生长到直径约200 μm的直径,模拟肿瘤组织(图1)。4B).然后用不同浓度的RuPOP@MCM和RuPOP孵育肿瘤球体,连续测量肿瘤球体体积。实验结果表明,对照组的肿瘤球状体随着时间的增加迅速增加,而不同浓度的RuPOP@MCM纳米颗粒可以很好地抑制肿瘤球状体的生长,尤其是RuPOP@MCM,进一步说明RuPOP@MCM的抑制作用高于单独的RuPOP(图1)。4C).我们认为RuPOP@MCM和RuPOP对肿瘤球状体的不同抑制作用可能与肿瘤球状体对细胞膜的吸收有关。总之,细胞膜的仿生修饰提高了RuPOP在肿瘤球体内的通透性。
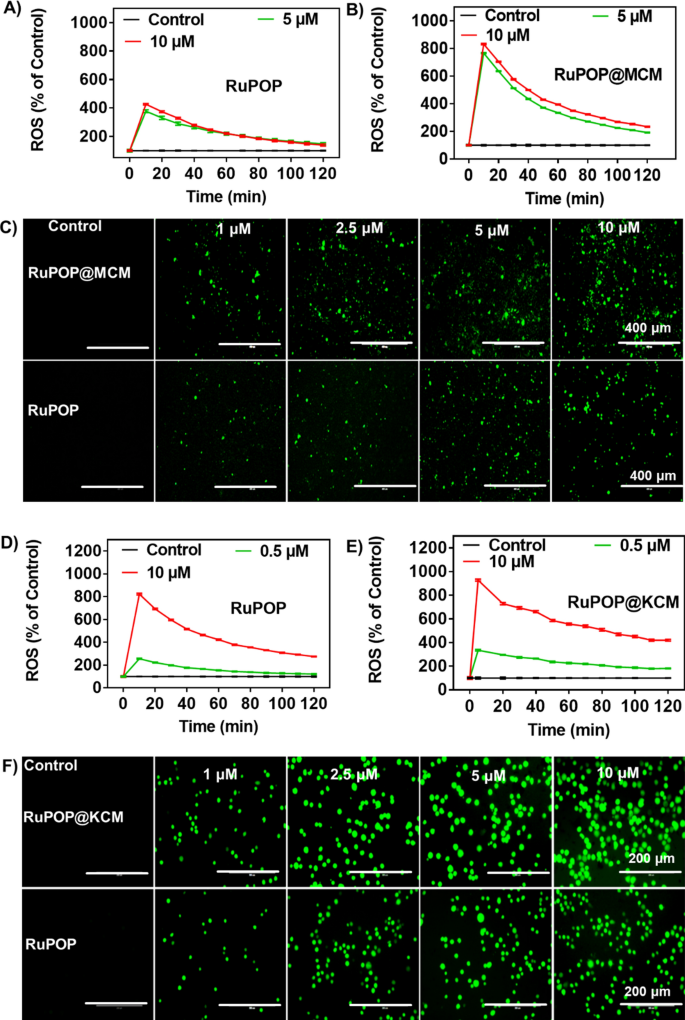
细胞凋亡和周期阻滞是体外抑制肿瘤增殖的重要途径。流式细胞术显示,RuPOP@MCM和RuPOP@KCM能有效诱导MDA-MB-231和K562细胞凋亡(图5)。4D)。例如,RuPOP@MCM (0-4 μ M)增加了MDA-MB-231细胞的凋亡,证实凋亡细胞的比例从0.33增加到50.76%。RuPOP@KCM (0-4 μ M)可使细胞凋亡比例由0.6增加到13.34%,同时使G0/G1细胞数量由38.99增加到70.19%。这些结果表明,RuPOP@MCM和RuPOP@KCM通过诱导G0/G1期阻滞抑制肿瘤细胞的发育。有研究表明,化疗药物破坏了细胞内ROS的稳定水平,导致生物大分子功能受损,进而诱导细胞凋亡。然后用荧光探针DCFH-DA检测MDA-MB-231细胞中ROS水平的变化(图1)。5A, B, C)分别用RuPOP@MCM和RuPOP、K562细胞处理(图。5D, E, F)用RuPOP@KCM和RuPOP处理。细胞内荧光强度随RuPOP、RuPOP@MCM和RuPOP@KCM纳米颗粒浓度的增加而增强。此外,我们还检测了RuPOP@MCM诱导的细胞凋亡和线粒体膜电位(MMP, Δψm)1:图S5),我们发现RuPOP@MCM显著增加了早期凋亡和晚期凋亡癌细胞。MMP呈剂量依赖性下降,反映了绿色荧光比的增加。综上所述,这些结果表明,RuPOP@MCM和RuPOP@KCM通过提高细胞内ROS水平、诱导DNA损伤加速细胞凋亡和细胞周期阻滞表现出明显的抗肿瘤活性。
在活的有机体内抗癌功效RuPOP@MCM
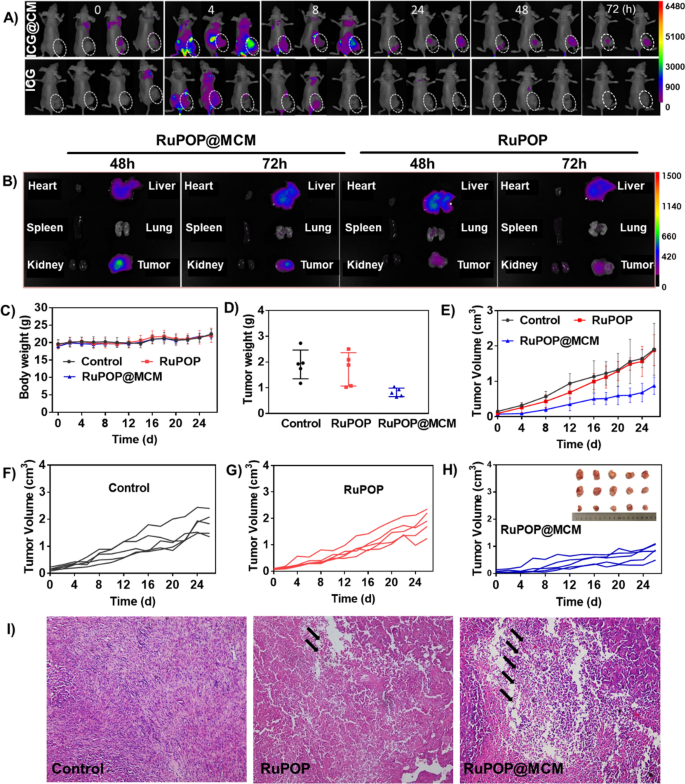
在满意的血液相容性和生物安全性的鼓舞下,我们随后通过活体成象仪研究了RuPOP@MCM在MDA-MB-231荷瘤裸鼠体内的肿瘤穿透和组织分布。为了提高组织成像的效率,我们选择吲哚菁绿(ICG)作为近红外荧光指示剂标记RuPOP@MCM纳米颗粒。如图所示。6A,注射RuPOP和RuPOP@MCM 4 h后,RuPOP@MCM组在肿瘤区域的荧光强度明显高于RuPOP组。特别是3天后,小鼠肿瘤区RuPOP@MCM的荧光强度仍强于RuPOP组,缓解了RuPOP在肿瘤区分布不足的问题。此外,为了准确确定药物在各组织中的分布,分别在48 h、72 h检测小鼠各器官组织的荧光强度(图1)。6B),这进一步证实了RuPOP@MCM在肿瘤组织中的积累高于单独RuPOP。以上结果说明细胞膜伪装修饰不仅能提高RuPOP在体内对肿瘤组织的靶向能力,还能增强其在肿瘤区域的积累,在体内具有较强的抗肿瘤作用。
接下来,我们进一步评估了RuPOP@MCM在MDA-MB-231荷瘤裸鼠体内的抗肿瘤能力。在无花果。6C,与对照组相比,RuPOP组与RuPOP@MCM组小鼠体重无明显差异,说明RuPOP@MCM对小鼠无明显毒副作用。此外,从肿瘤的重量和体积(图。6D-H),我们发现RuPOP@MCM能抑制MDA-MB-231肿瘤的生长,通过RuPOP@MCM治疗组肿瘤体积和肿瘤生长率的降低证实了这一点,进一步证实了RuPOP@MCM在体内具有优异有效的抗肿瘤能力。RuPOP对肿瘤的抑制作用低于RuPOP@MCM,验证了细胞膜介导的肿瘤归巢能力对有效癌症治疗的重要性。进一步进行H&E染色以证实其抗癌能力。对照组肿瘤切片细胞密度非常接近,表明携带mda - mb -231的裸鼠处于恶性肿瘤进展过程中。用RuPOP@MCM治疗的小鼠在肿瘤部位显示明显的核浓缩和细胞密度降低(图。6I),进一步说明了RuPOP@MCM在体内具有优异的抗肿瘤能力。我们还对RuPOP@MCM的主要器官进行了组织学分析,以进一步评价其生物安全性。主要器官切片未发现RuPOP@MCM引起的明显炎症或其他变化,进一步证明其安全性较高,毒性较低1:图S6)。因此,这些结果表明,细胞膜的仿生伪装修饰可以提高RuPOP在体内对肿瘤组织的靶向和渗透能力,从而增强RuPOP的抗肿瘤作用。
结论
合理修饰金属配合物,增强生物相容性,减少血液循环中化合物的清除,从而准确识别和根除肿瘤细胞,对金属配合物在癌症治疗中具有重要意义和应用潜力。癌细胞细胞膜表面保留了大量的表面抗原和肿瘤粘附分子,可用于修饰金属配合物,克服其缺陷。本研究采用细胞膜仿生纳米技术对RuPOP金属配合物进行伪装,得到工程细胞膜-伪装金属配合物RuPOP@CM。一方面,由于细胞膜的伪装,RuPOP的血液相容性和生物安全性显著提高,细胞膜的工程伪装修饰可以有效增强RuPOP的血液循环时间,防止巨噬细胞的吞噬。有趣的是,由于癌细胞细胞膜上保留了大量的表面抗原和肿瘤粘附分子,从而触发了巨噬细胞较强的炎症反应,进一步说明RuPOP@CM可能在体内诱导免疫反应。另一方面,RuPOP@MCM增加细胞内ROS水平,打破肿瘤细胞内氧化还原平衡,从而加速细胞凋亡和周期阻滞,具有优异的抗肿瘤效能。更重要的是,验证了RuPOP@MCM在体内优异的抗肿瘤能力,细胞膜工程伪装修饰使RuPOP与靶肿瘤组织具有相容性,并增加其在肿瘤部位的积累,从而增强了RuPOP的抗肿瘤作用。因此,本工作提供了一种利用细胞膜伪装纳米技术的金属配合物生物工程纳米平台的智能设计,以克服其缺点,增强癌症治疗。
实验部分
材料和方法
[俄文(苯酚的)2-p-MOPIP] (PF6)2h·22O (RuPOP)按先前报告所述合成[5].噻唑蓝溴化四唑(MTT), ICG, DMEM介质,Hoechst 33,342购自Sigma-Aldrich。莱素绿色追踪器购自生命科技公司。基质胶购自康宁。
细胞系和细胞培养
人乳腺癌细胞系MDA-MB-231、人骨髓性白血病细胞系K562和人正常乳腺细胞系Hs578bst在含10%胎牛血清和1%青霉素-链霉素溶液的DMEM中培养(Beyotime,代码No。C0222)。
厘米的准备
首先将肿瘤细胞(MDA-MB-231和K562细胞)离心,收集的细胞沉积物用PBS缓冲液洗涤3次。之后,将洗净的细胞沉积物悬浮在低渗裂解缓冲液中,并用均质机接地,再次以3000转/分离心,然后收集上清,以12000转/分离心。最后,收集上清液,转移到另一个试管中,以38,000 rpm的转速离心,收集细胞沉积物。然后用10mm Tris-HCl和1mm EDTA洗涤收集的细胞沉积物,并在38,000 rpm的转速下离心。最后的细胞沉积悬浮在PBS中,使用Avanti迷你挤出机(Avanti极性油脂)分别通过400nm和200nm的聚碳酸酯多孔膜进行连续挤出。
制备RuPOP@CM
RuPOP溶于浓度为5 mg/mL的DMSO中。将细胞膜(400µL PBS中28.8µg)和制备的RuPOP(600µL DMSO中3 mg,体积比为1:1.5)在37 kHz超声处理2 h后,挤压制备RuPOP@CM。挤压产生的机械力促进了RuPOP与细胞膜的融合,使RuPOP包裹在细胞膜中。进一步将RuPOP@CM的最终产物用于后续的实验。
表征RuPOP@CM
用Nano-ZS Instruments (Malvern Instruments Co., Ltd, UK)对RuPOP@MCM和RuPOP@KCM的尺寸和zeta电位进行表征,用透射电子显微镜(TEM, JEM-2100 F, JEOL, Japan)观察其形貌。紫外可见层近红外分光光度计在300 ~ 600 nm范围内检测其紫外可见近红外光谱,荧光分光光度计在500 ~ 800 nm波长范围内检测其荧光光谱。采用ICP-MS法测定细胞膜中RuPOP的浓度。
RuPOP@CM稳定性
分别将约0.5 mL PBS、0.5 mL DMEM(添加10%胎牛血清)和0.5 mL人血清与等体积的RuPOP@MCM或RuPOP@KCM混合。在不同孵育期,用Zetasizer Nano ZS颗粒分析仪测定RuPOP@MCM和RuPOP@KCM的粒径。
溶血率RuPOP@CM
测定RuPOP@CM的溶血率,评价其在血液中的生物相容性。红细胞分别用PBS、RuPOP、RuPOP@MCM、RuPOP@KCM处理2 h。PBS和Triton X-100处理的红细胞分别作为阴性对照和阳性对照。[35然后向下旋转红细胞,在540 nm处测量上清的吸光度。溶血率按下式计算。
溶血率(%)= (A样本——一个中文版本控制) / (积极的控制——一个消极的控制) * 100%。为了研究收集到的红细胞的细胞形态,我们将每个样本放在一块玻璃上,用相位对比显微镜(Life Technologies, EVOS FL AUTO)观察。
RuPOP@CM的药代动力学研究
将15只雌性SD小鼠(100 g/只)分为3组,每组分别以RuPOP、RuPOP@MCM、RuPOP@KCM等剂量静脉注射RuPOP (200 μ L /只)。在不同时间点(0 h、1 h、2 h、4 h、8 h、12 h、24 h、48 h、72 h)采集血样,对血清进行硝化处理,采用ICP-MS法测定Ru含量。采用Winonlin 3.3软件进行数据拟合和相关药代动力学参数的计算。
免疫原性的RuPOP@CM在活的有机体内
48只雌性Balb/c小鼠(18-22 g/只)随机分为4组,分别用生理盐水、RuPOP、RuPOP@MCM、RuPOP@KCM等剂量的RuPOP静脉注射(注射量200 μ L)。对照组小鼠注射生理盐水200 μ L /只。分别于24、48、72 h采血,用ELISA试剂盒检测血清中TNF-α、IL-6、IL-12的浓度。
在体外抗癌功效RuPOP@CM
将MDA-MB-231细胞、K562细胞、香港-2细胞、Ect1/E6E7细胞和WI-38细胞分别装于96孔板上(每孔2000个细胞),分别与不同浓度的RuPOP@CM(1.25µM、2.5µM、5µM、10µM、20µM、40µM)孵育72 h, MTT法检测细胞毒性[36,37,38,并计算了IC50RuPOP@CM的价值。
细胞迁移、侵袭检查
MDA-MB-231细胞接种于6孔板(5 × 104细胞/mL),然后取出培养液和饥饿细胞(含5%胎牛血清的培养液)孵育6 h。待细胞覆盖板底后,用无菌矛划痕(200 μ L), PBS冲洗3次。用不同浓度的RuPOP和RuPOP@MCM纳米颗粒(0.2 μ M和0.4 μ M)孵育细胞24 h。显微镜下记录缝隙的变化,用缝隙的宽度表示闭合程度。
流仪结果
细胞培养于6 cm (20 × 104细胞/mL)孵育24 h后,分别用不同浓度(2µM、4µM、8µM)的RuPOP@MCM、RuPOP@KCM处理,PBS洗涤细胞。最后,细胞在-20℃下固定过夜。[39固定细胞用500 μ L碘化丙啶(PI)在4℃下染色1 h。采用流式细胞仪(Epics-XL, Beckman Coulter)检测染色细胞,观察细胞周期分布,使用MultiCycle软件进行数据分析。
细胞内ROS生成的测定
用DCFH-DA荧光探针检测RuPOP@MCM和RuPOP@KCM处理MDA-MB-231细胞和K562细胞产生的ROS。首先,将MDA-MB-231细胞接种于96孔板(20 × 104细胞/mL, 100µL) [40,41].次日弃上清,用含DCFH-DA探针(10µM)的100µL PBS孵育细胞0.5 h,然后加入不同浓度的RuPOP、RuPOP@MCM和RuPOP@KCM,在荧光计(Ex = 488 nm, Em = 525 nm)下立即检测各处理组细胞的吸光度值,连续监测2 h。
细胞摄取和贩运RuPOP@MCM
根据RuPOP的荧光强度测定MDA-MB-231细胞对RuPOP和RuPOP@MCM纳米颗粒的吸收。细胞接种于6孔板(10 × 104细胞/毫升)。孵育后,在6孔板中加入RuPOP和RuPOP@MCM纳米颗粒,分别与细胞孵育2 h、4 h、6 h和8 h [42].除去上清液,用PBS溶液清洗。然后用胰蛋白酶消化细胞,收集在离心管中,分析细胞内RuPOP的荧光强度,分析RuPOP@MCM的细胞摄取情况。
观察MDA-MB-231细胞(8 × 104细胞/mL)接种于2cm的培养皿中。第二天,用Lyso Tracker绿色荧光探针标记细胞溶酶体或用Fluor 488 phalloidin染色细胞骨架(绿色)2 h,用Hochest 33,342染料(蓝色)标记细胞核1 h,然后加入RuPOP@MCM分别孵育0 h、2 h、4 h、6 h和8 h。清洗细胞以去除培养基中残留的药物。在荧光显微镜下实时监测细胞内药物的荧光信号。由于RuPOP的负载,纳米材料在细胞内发出红色荧光,通过监测药物红色荧光与溶酶体、细胞骨架和细胞核的重叠来分析纳米材料在细胞内的定位。同时,通过细胞内不同时间点的红色荧光强度来评价纳米药物在细胞内的吸收效率。
RuPOP@CM在溶菌酶中的形态变化
分别将RuPOP@MCM和RuPOP@KCM(浓度为4 μ M)与pH值为7.4的PBS溶液或pH值为5.3的PBS溶液与溶菌酶(1 mg/mL)混合,在37℃恒温孵育12 h、48 h和72 h。在实验时间点结束时,用透射电镜分析孵育的纳米颗粒RuPOP@MCM和RuPOP@KCM的微观形貌变化。
RuPOP@MCM对MDA-MB-231多细胞肿瘤球形体的抑制作用
MDA-MB-231多细胞肿瘤球体在6孔板中培养,用不同浓度的RuPOP或RuPOP@MCM(浓度分别为8µM、16µM)处理4天[43,44].每天用显微镜测量并记录MDA-MB-231多细胞肿瘤球体的长度和宽度,评价RuPOP@MCM的抑制作用。
体内抗肿瘤活性RuPOP@MCM
为建立MDA-MB-231 Balb/c裸鼠异种移植模型,MDA-MB-231细胞(1 × 106将DMEM中悬浮的细胞(每只小鼠)皮下注射到小鼠腋下。当肿瘤体积达到70 mm时3.将MDA-MB-231异种移植小鼠随机分为3组(每组5只),每隔一天静脉注射生理盐水、RuPOP (1 mg/kg)和RuPOP@MCM (1 mg/kg)。在26天内每天测量每只小鼠的体重和肿瘤大小,第26天处死。给肿瘤称重并拍照。收集肿瘤及主要器官,用4%多聚甲醛固定。
RuPOP@MCM分布在活的有机体内
采用吲哚菁绿(ICG)作为荧光指示剂对RuPOP@MCM纳米颗粒进行标记[45].实时体内成像以确定RuPOP@MCM在MDA-MB-231异种移植裸鼠体内的生物分布。通过活体成像系统采集小鼠体内ICG的近红外信号,进行动态荧光成像,观察时间分别为注射后4 h、8 h、24 h、48 h、72 h。48 h和72 h结束时,处死小鼠,对小鼠主要器官和肿瘤进行体外成像。
统计分析
本研究所有实验均采用三份重复试验。数据以均数±标准差(SD)表示。采用单因素方差分析(ANOVA)方法分析对照组与实验组的差异。差异显示为P < 0.05(*)或P < 0.01 (**)被认为具有统计学意义。
缩写
- RuPOP:
-
钌polypyridyl复杂
- RuPOP@CM:
-
癌细胞膜伪装RuPOP
- RuPOP@MCM:
-
MDA-MB-231癌细胞膜-伪装RuPOP
- RuPOP@KCM:
-
K562癌细胞膜伪装RuPOP
- ROS:
-
活性氧
- DMSO溶液:
-
二甲亚砜
- DMEM:
-
杜尔贝科改良鹰培养基
- 的边后卫:
-
胎牛血清
- 麻省理工:
-
噻唑基蓝
- 摘要:
-
电感耦合等离子体质谱法
- PI:
-
Propidium碘化
- ):
-
苏木精和伊红
参考文献
卡尔吉斯J,斯托克斯RW,科恩SM。用于治疗的金属配合物。化学趋势。2021;3(7):523 - 34。
费伟,张敏,范鑫,叶勇,赵敏,郑超,李勇,郑旭。生物活性金属硫化物纳米材料的癌症治疗工程。J Nanobiotechnol。2021;19(1):93。
刘锐,彭勇,吕丽,彭松,陈涛,詹明。近红外光触发纳米前药用于癌症气体治疗。J Nanobiotechnol。2021;19(1):443。
梁建华,郑勇,吴晓伟,谭培平,季琳,毛志伟。钌基光敏剂的多功能抗癌纳米递送系统:肿瘤微环境适应与重塑。难以科学。2020;7(1):1901992。
陈涛,刘勇,郑文杰,刘杰,王永春。钌多吡啶配合物诱导线粒体介导的癌细胞凋亡。Inorg化学。2010;49(14):6366 - 8。
魏峰,匡胜,李文涛,廖旭,刘杰,罗丹,王俊,张旭,季林,晁辉。石墨氮化碳配合物与氧自给光敏剂配合物的配合物在缺氧光动力治疗中产生多ROS。生物材料。2021;276:121064。
欧阳春,李勇,李文涛,廖旭,贾军,陈勇,张旭,纪林,晁辉。用于双光子生物成像的有机铂(II)配合物的比例双发射超分子组装。安琪化学国际教育学报2021;60(8):4150-7。
杨军,曹强,张宏,郝磊,周东,甘铮,李铮,童yx,季琳,毛志伟。通过治疗性铼(I)-DCA共轭物对癌细胞代谢的靶向逆转和磷光寿命成像。生物材料。2018;176:94 - 105。
王亮,关锐,谢琳,廖旭,熊凯,李文涛,陈艳,姬玲,晁宏。er靶向铱(III)复合物诱导非小细胞肺癌免疫原性细胞死亡。安琪化学国际教育学报2021;60(9):4657-65。
Brush J, Lipnick SL, Phillips T, Sitko J, McDonald JT, McBride WH。晚期正常组织损伤的分子机制。中国放射医学杂志2007;17(2):121-30。
曾亮,古普培,陈勇,王娥,季磊,晁辉,陈志生。抗癌钌配合物的发展:从单分子化合物到纳米材料。化学学报,2017;46(19):5771-804。
Karges J, Kuang S, Maschietto F, blqueso, Ciofini I, Chao H, Gasser G.合理设计用于1光子和2光子光动力治疗的钌配合物。Nat Commun。2020;11(1):3262。
林凯,赵卓,薄海波,郝旭军,王建强。钌配合物在肿瘤诊断和治疗中的应用。杂志。2018;9:1323。
金属和金属氧化物纳米材料的多酶活性:从生物技术到医学和环境工程的应用。J Nanobiotechnol。2021;19(1):26。
Bertrand N, Wu J, Xu X, Kamaly N, Farokhzad OC。癌症纳米技术:被动和主动靶向在现代癌症生物学时代的影响。Adv Drug delivery Rev. 2014; 66:2-25。
Michalak M, Lach MS, Antoszczak M, Huczynski A, Suchorska WM。salinomycin及其衍生物克服卵巢癌对铂类药物耐药性的体外研究。分子。2020;25(3):537。
布尔扎克K.新闻专题:癌症纳米药物,重新设计。美国国家科学研究院。113(45): 12600 2016; 3。
脂质体给药系统:从概念到临床应用。Adv Drug delivery Rev. 2013;65(1): 36-48。
俞敏明,Park J, Jon S.多功能纳米颗粒在癌症成像和治疗中的靶向策略。开展。2012;2(1):3-44。
韩燕,潘宏,李伟,陈铮,马阿,尹涛,梁锐,陈芳,马燕,金燕,等。T细胞膜模拟纳米颗粒生物正交靶向和免疫识别增强光热治疗。难以科学。2019;6(15):1900251。
胡春春,张磊,Aryal S,张磊,方荣荣,张磊。红细胞膜伪装聚合物纳米颗粒仿生给药平台。美国国家科学研究院。108(27): 10980 - 2011; 5。
何亮,聂涛,夏曦,刘涛,黄燕,王曦,陈婷。设计生物灵感的2D摩斯2纳米片用于有效的光热引发的癌症免疫治疗与重编程肿瘤相关的巨噬细胞。Adv Funct Mater. 2019;29(30):1901240。
李鑫,郭鑫,凌娟,唐铮,黄刚,何亮,陈涛。重编程肿瘤相关巨噬细胞构建纳米肿瘤免疫疗法。纳米级。2021;13(3): 4705 - 4727。
Luk BT, Fang RH, Hu CM, Copp JA, Thamphiwatana S, Dehaini D,高伟,张凯,李松,张磊。安全、免疫兼容的红细胞膜纳米载体用于治疗实体肿瘤。开展。2016;6(7):1004 - 11。
波色RJ, Paulmurugan R, Moon J, Lee SH, Park h。细胞包覆的纳米载体:用于癌症治疗的新兴靶向递送系统。《今日药物发现》2018;23(4):891-9。
朱建勇,郑德伟,张明明,余文英,邱文祥,胡建军,冯军,张旭泽。用同种癌细胞膜包裹纳米颗粒优先实现癌细胞的自我识别和肿瘤的自我靶向。纳米列托人。2016;16(9):5895 - 901。
Kamaly N, Xiao Z,巴伦西亚总理,Radovic-Moreno AF, Farokhzad OC。靶向聚合物治疗性纳米颗粒:设计、开发和临床转化。化学学报,2012;41(7):2971-3010。
太阳H,苏J,孟Q,阴问,陈L,顾W, P, Z, Yu H,王年代,et al。用于同种肿瘤靶向治疗的癌症仿生纳米颗粒。难以板牙。2016;28(43):9581 - 8。
方荣荣,胡春明,陆克bt,高伟,Copp JA, Tai Y, O 'Connor DE,张磊。用于抗癌疫苗接种和药物输送的癌细胞膜包被纳米颗粒。纳米列托人。2014;14(4):2181 - 8。
沈娟,Karges J,熊凯,陈艳,姬玲,晁宏。肿瘤细胞膜伪装铱配合物功能化黑钛纳米颗粒的分级靶向协同NIR-II光热声动力治疗。生物材料。2021;275:120979。
黄军,杨斌,彭宇,黄军,黄世东,卞亮,朱凯,帅鑫,韩松。纳米药物增强肿瘤免疫原性的增强免疫治疗。Adv Funct Mater. 2021;31(21):2011171。
吴海辉,周毅,塔巴塔亚,高建强。间充质干细胞为基础的药物传递策略:从细胞到仿生。J控制发布。2019;294:102-13。
方瑞敏,Kroll AV,高伟,张磊。细胞膜涂层纳米技术。难以板牙。2018;30 (23):e1706759。
韩玉红,夏海燕,王树顺,陈安智。介孔二氧化硅纳米粒子在生物医学创新应用中的纳米结构原型。J Nanobiotechnol。2022;20(1):126。
刘涛,石超,段磊,张铮,罗磊,Goel S,蔡伟,陈涛。高血液相容性红细胞膜包被的超微硒纳米体系用于癌症放射增敏和精确抗血管生成。化学学报。2018;6(29):4756-64。
何亮,赖红,陈涛。利用ros介导的信号通路实现肿瘤化疗/放疗协同的双功能纳米系统。生物材料。2015;51:30-42。
刘涛,赖林,宋铮,陈涛。序列触发纳米系统用于精确给药和同时抑制肿瘤生长、迁移和侵袭。2016;26(43): 7775-90。
黄刚,刘铮,何亮,陆克赫,张ST,黄克赫,陈涛。自噬是功能化硒纳米颗粒抗结直肠癌活性的重要作用模式。Biomater Sci。2018;6(9):2508 - 17所示。
莫杰,何亮,马斌,陈涛。介孔二氧化硅纳米系统的粒径定制拮抗胶质母细胞瘤和克服血脑屏障。ACS应用模块接口。2016;8(11):6811-25。
黄辉,何亮,周伟,曲刚,王杰,杨宁,高杰,陈涛,褚pk,余晓峰。用于协同放射治疗的稳定黑磷/Bi2O3异质结构。生物材料。2018;171:12-22。
引用本文郭涛,吴勇,林勇,徐旭,连辉,黄刚,刘建忠,吴旭,杨海红。具有肾脏清除特性的黑磷量子点用于有效的光动力治疗。小。2018;14(4):2815。
马斌,何亮,尤勇,莫杰,陈涛。用于精确癌症治疗的多功能介孔二氧化硅纳米系统的控制合成及尺寸效应。药物Deliv。2018;25(1):293 - 306。
黄健,黄伟,张铮,林鑫,林红,彭亮,陈涛。高均匀合成具有EGFR靶向和肿瘤微环境响应能力的纳米硒粒子,用于鼻咽癌的同时诊断和治疗。计算机应用技术,2019;11(12):11177-93。
冯超,欧阳君,唐铮,孔楠,刘颖,付亮,季曦,谢涛,Farokhzad OC,陶伟。德国基治疗材料用于手术辅助治疗:抑制肿瘤复发和伤口感染。事。2020;3(1):127 - 44。
黄伟,黄勇,尤勇,聂涛,陈涛。高产合成多功能碲纳米棒实现化疗-光热联合治疗癌症。Adv Funct Mater. 2017;27(33):1701388。
确认
基金资助:国家自然科学基金(21877049,32171296,81974282,82022037),国家卫生科研基金医药卫生科技重点项目,中国-浙江省卫健委委员会(No. 1);wkj - zj - 2036)。
作者信息
作者和联系
贡献
XL, LH和TC构思和设计了这个项目。XL、YY、LH分别进行实验并对数据进行分析。QC、JL、XZ、XL、TC参与讨论并监督项目。XL, YY, LH和TC写了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
所有的动物研究都得到了暨南大学动物使用和护理机构委员会的批准。
同意出版
所有作者都已看过稿件并批准了投稿。
相互竞争的利益
作者宣称不存在竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
补充信息
附加文件1:图S1。
RuPOP@CM在体外表现出优异的抗肿瘤能力。A)不同浓度RuPOP和RuPOP@KCM处理K562细胞72 h的IC50。B) RuPOP@MCM和RuPOP处理对MDA-MB-231细胞的细胞活力。C) RuPOP@KCM和RuPOP对K562细胞的细胞活力。RuPOP@MCM和RuPOP对D) HK-2细胞、E) Ect1/E6E7细胞和F) WI-38细胞的细胞活力。图S2。MDA-MB-231细胞在不同时间对RuPOP和KCM@RuPOP的吸收。A) MDA-MB-231细胞在不同时间对RuPOP和RuPOP@KCM的吸收。B)通过测定RuPOP的荧光强度,在MDA-MB-231细胞中对RuPOP@MCM、RuPOP和RuPOP@KCM的细胞吸收。C) RuPOP@MCM在MDA-MB-231细胞中的易位。图S3。溶菌酶与pH值为7.4的PBS和pH值为5.3的PBS孵育12小时后RuPOP的释放浓度。图S4。分别用RuPOP、RuPOP@MCM、RuPOP@KCM和LPS处理小鼠72 h(每组3只)后血清中IL-6含量的变化。图S5。RuPOP@CM的体外抗癌机制研究。A) RuPOP@MCM诱导细胞凋亡,B) RuPOP@MCM处理MDA-MB-231细胞的线粒体膜电位。图S6。各组主要脏器H&E染色图像。小鼠静脉注射生理盐水、RuPOP和RuPOP@MCM (1 mg/kg) 26 d。表S1。RuPOP的药代动力学参数。表S2。RuPOP@MCM的药代动力学参数。表S3。RuPOP@KCM的药代动力学参数。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
李,X,于,Y,陈,Q。et al。工程癌细胞膜-伪装金属配合物用于乳腺癌高效靶向治疗。J Nanobiotechnol20.401(2022)。https://doi.org/10.1186/s12951-022-01593-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12951-022-01593-5
关键字
- 金属络合物
- 癌细胞膜
- 伪装
- 高生物相容性
- 癌症靶向治疗