摘要
纳米医学和纳米递送系统是一门相对较新的但发展迅速的科学,其中纳米尺度范围内的材料被用于作为诊断工具的手段或以可控的方式将治疗剂递送到特定的目标部位。纳米技术在治疗人类慢性疾病方面提供了多种好处,包括针对特定部位的精准药物交付。近年来,纳米药物(化学治疗剂、生物制剂、免疫治疗剂等)在各种疾病的治疗中有许多突出的应用。目前的综述,通过全面审查纳米材料在提高新老药物(如天然产物)疗效和通过疾病标记分子选择性诊断方面的发现和应用,对纳米药物和纳米给药系统领域的最新进展进行了最新总结。本文还讨论了纳米药物从合成/天然来源到临床应用的机遇和挑战。此外,我们还包括了有关纳米医学领域的趋势和前景的信息。
背景
自古以来,人类就广泛使用植物性天然产品作为治疗各种疾病的药物。现代药物主要是在传统知识和实践的基础上从草药中提取出来的。目前,近25%的主要药物化合物及其衍生物是从自然资源中获得的[1,2].具有不同分子背景的天然化合物为新药的发现提供了基础。基于天然产物的药物发现最近的一个趋势是对设计合成易受影响的铅分子感兴趣,这种分子模仿其对应物的化学性质[3.].天然产物具有非凡的化学多样性、具有大分子特异性的化学和生物特性、毒性小等显著特征。这使他们成为发现新药的有利先导。4].此外,计算研究有助于设想药物的分子相互作用,并开发下一代药物发明,如基于靶点的药物发现和药物输送。
尽管有一些优势,制药公司仍不愿更多地投资于基于天然产物的药物发现和药物输送系统[5,而是探索可用的化合物库,以发现新的药物。然而,天然化合物现在正被筛选用于治疗几种主要疾病,包括癌症、糖尿病、心血管疾病、炎症和微生物疾病。这主要是因为天然药物具有毒副作用低、价格低廉、治疗潜力大等独特优势。然而,对天然化合物的生物相容性和毒性的担忧,使其作为药物使用面临更大的挑战。因此,由于这些问题,许多天然化合物没有通过临床试验阶段[6,7,8].大尺寸材料在药物输送中的使用带来了重大挑战,包括体内不稳定性、生物利用度低、溶解度低、体内吸收差、靶向给药问题、药物的滋补效果以及药物可能的不良反应。因此,使用新的药物输送系统将药物靶向到特定的身体部位可能是解决这些关键问题的一种选择[9,10].因此,纳米技术在先进药物/药物配方、靶向竞技场及其控制药物释放和传递方面发挥着重要作用,并取得了巨大成功。
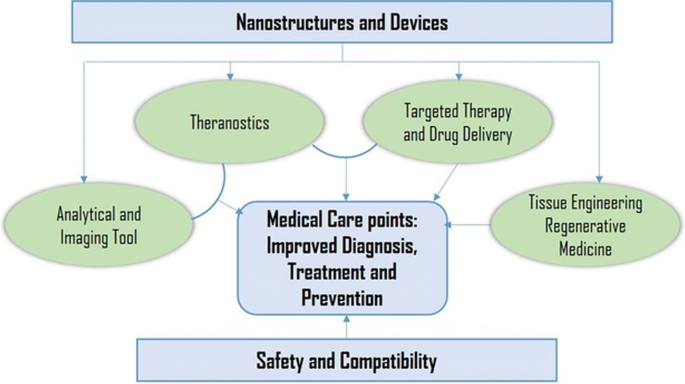
纳米技术被证明可以通过在不同的科学领域应用纳米结构和纳米相来跨越生物和物理科学之间的障碍[11];特别是在纳米医学和基于纳米的药物输送系统中,这些颗粒是主要的兴趣点[12,13].纳米材料可以定义为一种大小在1到100纳米之间的材料,它影响着纳米医学的前沿,从生物传感器、微流体、药物输送和微阵列测试到组织工程[14,15,16].纳米技术利用纳米级别的治疗剂来开发纳米药物。包括纳米生物技术、药物递送、生物传感器和组织工程在内的生物医学领域都是由纳米颗粒驱动的[17].由于纳米粒子是在原子或分子水平上设计的材料,它们通常是小尺寸的纳米球[18].因此,与较大的材料相比,它们可以在人体内更自由地移动。纳米级颗粒具有独特的结构、化学、机械、磁、电和生物特性。纳米药物近年来得到了广泛的重视,因为纳米结构可以作为药物递送剂,通过包裹药物或附着治疗药物,并以可控释放的方式更精确地将药物递送到靶组织[10,19].纳米医学是将纳米科学的知识和技术应用于医学生物学和疾病预防与治疗的新兴领域。它涉及纳米维材料的利用,包括纳米机器人,用于诊断,传递和感觉目的的纳米传感器,以及活细胞中的驱动材料(图。1).例如,已经开发出一种基于纳米颗粒的方法,它结合了癌症诊断的治疗和成像方式[20.].第一代基于纳米颗粒的治疗包括脂质体和胶束等脂质系统,现在已获得fda批准[21].这些脂质体和胶束可以含有无机纳米颗粒,如金或磁性纳米颗粒[22].这些特性使得无机纳米颗粒的使用增加,并强调药物输送、成像和治疗功能。此外,据报道,纳米结构有助于防止药物在胃肠道区域被玷污,并有助于将少量水溶性药物输送到目标位置。纳米药物表现出较高的口服生物利用度,因为它们表现出典型的吸收内吞机制。
纳米结构在血液循环系统中停留很长一段时间,并使合并药物按指定剂量释放。因此,它们引起的等离子体波动更少,不良影响也更少[23].由于纳米大小,这些结构渗透到组织系统中,便于细胞容易吸收药物,允许有效的药物传递,并确保在目标位置起作用。细胞对纳米结构的摄取远高于大小在1至10微米之间的大颗粒[17,24].因此,它们直接相互作用,以提高效率和减少或可忽略的副作用来治疗病变细胞。
在临床实践的所有阶段,已发现纳米颗粒在获取信息方面是有用的,因为它们被用于许多治疗和诊断疾病的新分析。这些纳米颗粒的主要好处与它们的表面特性有关;因为各种蛋白质可以附着在表面。例如,金纳米颗粒被用作各种生物分子检测程序分析的生物标志物和肿瘤标签。
关于纳米材料在给药中的应用,纳米颗粒的选择是基于药物的物理化学特性。纳米科学与生物活性天然化合物的结合使用非常有吸引力,近年来发展非常迅速。当涉及到治疗癌症和许多其他疾病的天然产品时,它具有几个优势。天然化合物由于具有多种特征性活性,如诱导肿瘤抑制自噬和作为抗菌药物等,在治疗疾病方面得到了广泛的研究。自噬已在姜黄素和咖啡因中观察到[25],而肉桂醛、香芹酚、姜黄素和丁香酚已显示出抗菌作用[26,27].通过纳米颗粒的掺入,对其生物利用度、靶向性和控释性等特性进行了富集。例如,百里醌,一种生物活性化合物黑种草将其包封在脂质纳米载体中。封装后,与游离百里醌相比,它的生物利用度增加了6倍,从而保护了胃肠道物质[28].它还增加了天然产物的药代动力学特征,从而获得更好的治疗效果。
金属、有机、无机和聚合物纳米结构,包括树状大分子、胶束和脂质体,在设计靶向给药系统时经常被考虑。特别是那些溶解度差、吸收能力较差的药物被这些纳米颗粒标记[17,29].然而,这些纳米结构作为药物传递载体的功效取决于大小、形状和其他固有的生物物理/化学特征。例如,直径在10至1000纳米之间的聚合物纳米材料具有高效运载工具的理想特性[7].由于其具有较高的生物相容性和生物降解性,各种合成聚合物如聚乙烯醇、聚l-乳酸,聚乙二醇和聚乳酸有限公司-乙醇酸)和天然聚合物,如海藻酸盐和壳聚糖,被广泛用于纳米粒子的纳米制造[8,30.,31,32].高分子纳米颗粒可分为纳米球和纳米胶囊,两者都是优良的药物传递系统。同样,致密的脂质纳米结构和磷脂(包括脂质体和胶束)在靶向药物输送中非常有用。
理想纳米药物输送系统的使用主要取决于所选治疗靶标药物的生物物理和生化特性[8].然而,在考虑使用纳米药物时,不能忽视纳米颗粒所表现出的毒性等问题。最近,纳米颗粒大多与天然产物结合使用,以降低毒性问题。设计含有药物的纳米颗粒的绿色化学路线受到广泛鼓励,因为它最大限度地减少了生物合成过程中的有害成分。因此,使用绿色纳米颗粒给药可以减少药物的副作用[19].此外,纳米结构的尺寸、形状、疏水性和表面变化的调整可以进一步增强这些纳米材料的生物活性。
因此,纳米技术在治疗人类慢性疾病方面提供了多种好处,可以针对特定的部位和靶向的药物输送。然而,对纳米结构毒性的认识不足是一个主要的担忧,毫无疑问,这需要进一步的研究,以提高疗效和更高的安全性,使这些药物能够更安全地实际应用。因此,谨慎地设计这些纳米颗粒可能有助于解决与它们的使用有关的问题。鉴于上述事实,本文旨在报告不同的纳米给药系统,天然化合物基纳米药物的重要应用,纳米药物的生物利用度,靶向位点,纳米药物的控制释放,以及与纳米材料在药物中的其他挑战。
纳米给药系统
最近,递送系统领域有了巨大的发展,将治疗剂或天然活性化合物提供到其目标位置,用于治疗各种食物[33,34].近年来,有许多药物递送系统被成功应用,但仍有一些挑战需要解决,需要开发一种先进的技术来成功地将药物递送到目标部位。因此,纳米给药系统的研究将为先进的给药系统提供便利。
纳米技术在药物设计中的基础知识
纳米医学是利用纳米技术来预防和治疗各种疾病的医学分支,使用纳米材料,如生物相容性纳米颗粒[35]和纳米机器人[36],用于多种用途,包括诊断[37]、交付[38],感官的[39],或生物体内的驱动目的[40].溶解度极低的药物存在各种生物药物传递问题,包括口服后的生物可及性有限,进入外膜的扩散能力较低,静脉注射需要更多的量,以及传统配方疫苗接种过程之前的不良后遗症。然而,所有这些限制都可以通过纳米技术在药物传递机制中的应用来克服。
纳米尺度的药物设计已经被广泛研究,并且是迄今为止纳米颗粒应用领域最先进的技术,因为它具有潜在的优势,如修改溶解性、药物释放谱、扩散性、生物利用度和免疫原性等特性的可能性。因此,可以改进和发展方便的给药途径,降低毒性,减少副作用,改善生物分布和延长药物生命周期[17].所设计的药物递送系统要么针对特定的位置,要么用于在特定的位置控制释放治疗药物。它们的形成涉及到自我组装,在明确的结构或模式中,它们自发地由积木形成[41].此外,它们需要克服单核吞噬细胞系统的调理/隔离等障碍[42].
纳米结构传递药物有两种方式:被动传递和自我传递。在前者中,药物主要通过疏水效应被纳入结构的内腔中。当纳米结构材料被靶向到特定的位置时,由于药物含量低,被包裹在疏水环境中,因此预期的药物量被释放[41].相反,在后者中,用于释放的药物直接偶联到载体纳米结构材料上,以便于传递。在这种方法中,释放的时机至关重要,因为药物不会到达目标位点,并且它很快就会与载体分离,相反,如果它在正确的时间从纳米载体系统中释放,它的生物活性和疗效将会降低[41].药物靶向是利用纳米材料或纳米配方作为药物传递系统的另一个重要方面,分为主动和被动两种。在主动靶向中,部分,如抗体和多肽与药物传递系统偶联,以将它们锚定在靶位点表达的受体结构上。在被动靶向中,所制备的药物载体复合物在血流中循环,并受pH值、温度、分子位点和形状等性质的影响,通过亲和力或结合驱动到目标位点。人体内的主要目标是细胞膜上的受体、细胞膜上的脂质成分和细胞表面的抗原或蛋白质[43].目前,纳米技术介导的药物递送系统主要针对癌症疾病及其治疗。
生物聚合物纳米颗粒在诊断、检测和成像中的应用
治疗和诊断的结合被定义为治疗性的,并被广泛用于癌症治疗[44,45].治疗性纳米颗粒可以帮助诊断疾病,报告位置,确定疾病的阶段,并提供有关治疗反应的信息。此外,此类纳米颗粒可携带肿瘤治疗剂,可通过分子和/或外部刺激提供所需浓度的治疗剂[44,45].壳聚糖是一种具有独特生物相容性和功能基团的生物聚合物[45,46,47].它被用于各种类型的纳米颗粒的包封或包覆,从而产生具有多种功能的不同颗粒,其潜在用途是检测和诊断不同类型的疾病[45,47].
Lee等人。[48]在油酸偶联壳聚糖(oleyl-壳聚糖)中包裹油酸包被FeO纳米颗粒,通过近红外和磁共振成像(MRI)机制检测这些纳米颗粒在体内状态下的穿透性和持存性(EPR)结果在肿瘤细胞中的吸积。通过体内评价,两种技术均表现出明显的信号强度,并通过静脉注射Cyanine -5附着的油基壳聚糖纳米颗粒(Cyanine -5)后的EPR结果在肿瘤组织中得到改善。
杨等。[49]制备了通过光介导机制揭示结直肠癌(CC)细胞的高效纳米颗粒;这些细胞是可见的,因为海藻酸与叶酸修饰的壳聚糖的物理共轭导致纳米颗粒的形成,增强了5-氨基乙酰丙酸(5-ALA)在细胞溶酶体中的释放。结果表明,该工程纳米颗粒可通过叶酸受体为基础的内吞过程被CC细胞主动内吞。随后,带电荷的5-ALA通过去质子化海藻酸盐分散到溶酶体中,这是由于5-ALA与壳聚糖之间的合宜强度较低,从而引起原卟啉IX (PpIX)的聚集,用于细胞内的光动力检测。根据这项研究,壳聚糖纳米颗粒与海藻酸盐和叶酸结合是将5-ALA明确递送到CC细胞的巨大载体,从而实现内镜下荧光检测。组织蛋白酶B (CB)与转移过程密切相关,在转移过程发生的细胞周围区域大量存在;因此,CB对转移的检测很重要。Ryu等人[50]设计了一种CB-CNP敏感的纳米探针(CB-CNP),该探针由一种自适应的CB-CNP组成,其表面附着一种含氟肽的肿瘤靶向乙二醇壳聚糖纳米颗粒(CNPs)。所设计的纳米探针为直径为280nm的球形,具有球形结构,在生物条件下荧光能力完全消失。对三种大鼠转移模型中cb敏感纳米探针的可用性进行评估,证明了这些非探针在通过非侵入性成像区分转移细胞与健康细胞方面的潜力。玻尿酸(HA)是另一种生物高分子材料。这是一种生物相容性的,带负电荷的糖胺聚糖,是细胞外基质的主要成分之一[51,52].HA可以通过受体-连接子相互作用与CD44受体结合,CD44受体在各种癌细胞中大多过度连接。因此,ha修饰的纳米颗粒在检测和治疗癌症方面的应用非常有趣[53,54,55].王等。[56],在氧化铁纳米颗粒(IONP)表面涂上多巴胺修饰的HA。这些纳米颗粒具有亲水的外观和疏水的内部,其中化学治疗用的同型喜树碱被包裹[56].在实验室和活细胞中研究了这一过程的生物潜力。当外部磁场作用时,MRI观察到肿瘤细胞对纳米颗粒的吸收增加[56].在静脉给药3mg /kg(相对于游离药物)的大鼠后,观察到一个较大的肿瘤消融,治疗后肿瘤几乎消失[56].
蔡等人。[53]还通过改变HA的疏水置换程度合成了不同直径的透明质酸纳米颗粒。在肿瘤小鼠体内系统注射纳米颗粒,并研究其疗效。该研究小组开发了一种使用聚乙二醇共轭透明质酸(P-HA-NPs)纳米颗粒的多功能恒温系统,用于结肠癌的早期检测和靶向治疗。为了评估纳米颗粒的有效性,它们首先通过化学偶联附着在近红外荧光染料(Cy 5.5)上,然后,伊立替康抗癌药物(IRT)被包裹在这些系统中。然后研究P-HA-NP在不同系统的小鼠结肠癌中的治疗潜力。通过静脉注射荧光染料附着的纳米颗粒(Cy 5.5-P-HA-NPs),微小和初期肿瘤以及肝包埋的结肠肿瘤可以使用NIRF成像方法有效地成像。由于其靶向肿瘤的非凡能力,含药纳米颗粒(IRT-P-HA-NP)显示出显著降低肿瘤发展和降低全身危害。此外,治疗效果可与Cy 5.5-P-HA-NPs同时检测[57].
可使用的另一种选择是海藻酸盐,这是一种从棕色海藻中提取的天然聚合物,由于其几个有利的特性,如制造成本低,性质和谐,危害小,易于在添加二价阳离子时凝胶化,在生物医学领域的潜在用途已被广泛研究[58,59].巴巴尼等人。60]制备了用海藻酸盐稳定的全氟己烷(PFH)纳米液滴来驱动阿霉素,然后评估了它们对超声和成像的敏感性以及它们的治疗性能。进一步发现,超声辅助的PFH纳米液滴负载阿霉素治疗在乳腺癌大鼠模型中表现出有希望的积极反应。疗效以肿瘤恶化为特征[60].在另一项研究中,Podgorna等人[61]制备了含有纳米凝胶的钆(gng),用于亲水药物负载并通过MRI进行筛选。海藻酸钆纳米凝胶的平均直径为110 nm,稳定时间为60 d。由于钆混合物具有顺磁性,通常在MRI图像中用作阳性造影剂(T1)。与对照组相比,钆纳米凝胶显著降低了弛豫时间(T1)。因此,海藻酸盐纳米凝胶具有增强对比度的作用,可作为一种合适的药理应用材料。
此外,聚合材料右旋糖酐是一种中性聚合物,被认为是用于医疗应用的微生物胞外多糖的第一个显著例子。使用右旋糖酐的一个显著优点是它耐受性好,无毒,在人体中可生物降解,在体内没有反应[62].光动力疗法是一种针对特定部位的癌症治疗,对非癌细胞的损害较小。丁等人。[63]制备了包封铁的纳米多功能复合材料体系3.O4右旋糖酐纳米颗粒中的纳米颗粒共轭氧化还原反应氯6 (C6)用于近红外(NIR)和磁共振(MR)成像。纳米颗粒对荧光信号的氧化还原细胞反应表现出“关/开”的行为,从而导致肿瘤的精确成像。此外,还观察到良好的体外和体内磁靶向能力,有助于增强光动力治疗的效果。洪等人。[64]制备了治疗性纳米颗粒或C6小鼠胶质瘤细胞。这些颗粒由氧化钆纳米颗粒组成,表面涂有叶酸共轭右旋糖酐(FA)或紫杉醇(PTX)。采用MTT法评价右旋糖酐包衣和PTX对C6胶质瘤细胞的生物保护作用。合成的纳米颗粒已被证明通过受体介导的内吞作用进入C6肿瘤细胞,并由于钆纳米颗粒的顺磁性,提供了增强的对比度(MR)浓度依赖性活性。多功能纳米颗粒比未涂覆的钆纳米颗粒更有效地降低细胞活力。因此,FA和PTX共轭纳米颗粒可作为具有顺磁和化疗特性的治疗药物。
药物设计和给药过程及机制
随着纳米医学的发展,以及药物发现/设计和给药系统的进步,人们提出了许多治疗方法,并对传统的临床诊断方法进行了研究,以提高药物的特异性和诊断的准确性。例如,正在探索新的给药途径,重点是确保它们在特定区域有针对性地发挥作用,从而降低它们的毒性,增加它们在生物体中的生物利用度[65].
在这种背景下,药物设计已经成为一个有前途的特征,其特征是基于生物靶点的知识发现新的先导药物。计算机科学的进步,以及蛋白质、多肽和生物靶标分类和纯化的实验程序的进展,对这一部门的增长和发展至关重要[66,67].此外,在这一领域还发现了一些研究和综述;他们专注于不同分子的合理设计,并表明了研究药物释放的不同机制的重要性[68].此外,天然产物可以为解决药物设计挑战提供可行和有趣的解决方案,并可以作为具有理想物理化学性质的药物发现的灵感[3.,69,70].
此外,药物输送系统在过去几年中变得越来越重要。这样的系统可以很容易地开发,并能够促进体内活性成分的改性释放。例如,Chen等。[70]描述了一篇使用纳米载体进行成像和感官应用的有趣综述,并讨论了这些系统的治疗效果。此外,Pelaz等人[71]提供了纳米载体在纳米医学中的几种应用的最新概述,并讨论了该部门面临的新机遇和挑战。
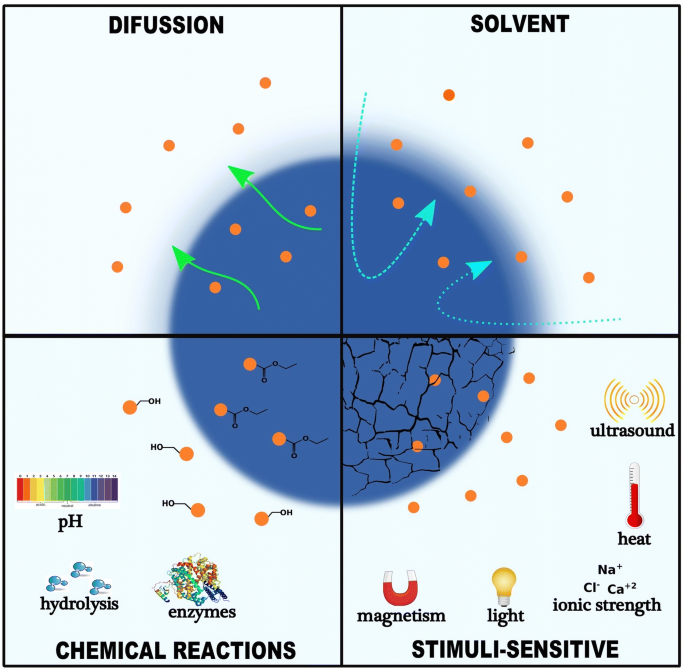
有趣的是,这些给药系统都有自己的化学、物理和形态特征,并可能通过化学相互作用(如共价键和氢键)或物理相互作用(如静电和范德华相互作用)对不同的药物极性具有亲和力。例如,Mattos等人[72]表明,嫁接印楝皮提取物的生物源性二氧化硅纳米颗粒的释放谱(化学相互作用)低于装载印楝皮提取物的生物源性二氧化硅纳米颗粒。因此,所有这些因素都会影响纳米载体与生物系统的相互作用[73],以及活性成分在生物体中的释放动力学[68].此外,Sethi等人[74]设计了以多西他赛和渥曼霉素为原型药物的交联脂壳(CLS),用于控制药物释放动力学;然后,他们研究了它的放电曲线,发现它在体内和体外条件下都受到影响。除此之外,其他参数,如纳米载体的组成(如有机、无机和杂化材料)以及药物与它们相关联的形式(如核-壳系统或基质系统)也是理解其药物传递特征的基础[75,76].总的来说,一些关于药物在纳米载体中的释放机制的研究已经进行。扩散、溶剂、化学反应和刺激控制释放是药物在纳米载体中释放的几个机制,如图所示。2[77,78].Kamaly等人。[79]对控释系统进行了广泛的综述,重点关注与控制聚合物纳米载体药物释放相关的研究。
虽然有几种纳米载体具有不同的药物释放谱,但目前正在制定策略以提高纳米结构对生物体目标区域的特异性[80],并通过其涂层或与聚合物等几种物质的化学功能化来降低免疫原性[81]、天然多糖[82,83],抗体[84],细胞膜[85],以及可调表面活性剂[86],多肽[87)等。在某些情况下,药物不表现出与特定靶点的结合和亲和力,或不跨越某些障碍(例如血脑屏障或血-脑脊液屏障)[88],这些配体修饰的纳米载体已被用于穿过细胞膜,并允许在特定环境下进行程序药物递送。例如,透明质酸(在细胞外基质中发现的一种多糖)已被用作几种纳米载体中的配体,显示出有希望的结果,以增强对黑色素瘤干细胞样细胞的抗肿瘤作用[89]、乳癌细胞[90]、肺腺癌细胞[91],以及为视网膜基因治疗的玻璃体内药物输送提供便利[83]及降低所形成蛋白冠的免疫原性[82].然而,配体附加给药系统的构建是劳动密集型的,并且必须在之前进行几个靶向设计,考虑到血流、疾病状态和组织结构等生理变量[92].此外,很少有研究评价纳米载体中附加的配体与细胞膜的相互作用,其摄取机制也不清楚。此外,已知细胞对纳米颗粒的摄取是通过吞噬或非吞噬途径发生的(例如网格蛋白介导的内吞作用、小泡介导的内吞作用等)[93,94],同时由于每种传递系统的某些特殊的物理化学特性,使得这些系统在细胞中的作用/相互作用机制难以标准化。例如Salatin和Khosroushahi [95],在一篇综述中强调了细胞摄取含有活性化合物的多糖纳米颗粒的主要内吞机制。
另一方面,刺激响应型纳米载体已显示出利用超声等外部因素控制药物释放的能力[96],热[97,98,99],磁力[One hundred.,101],光[102], pH [103],离子强度[104],可以提高靶向性,并允许更大的剂量控制(图。2).例如,超顺磁性氧化铁纳米颗粒与聚合物纳米载体相关联[105]或脂质[106通过外部磁场的应用初步刺激可控释放系统。此外,Ulbrich等人[107]修订了近年来以聚合物和磁性纳米颗粒为基础的药物递送系统的研究成果,并探讨了共价或非共价附着药物在癌症治疗中的作用[107].此外,非盟/ Fe3.O4@聚合物纳米颗粒也被合成用于nir触发的化学光热治疗[108].因此,混合纳米载体是目前最有前途的纳米医学工具之一,因为它们在单一系统中混合了不同系统的特性,从而确保材料在治疗和诊断应用(即治疗系统)中具有增强的性能。尽管如此,人们对药物传递系统的作用机制和毒性知之甚少,这为新的研究提供了机会。此外,通过实施植物提取物和微生物,基于环境安全的化学反应合成纳米载体的研究也有所增加[10].
用于药物输送系统的纳米颗粒
Biopolymeric纳米颗粒
有许多生物聚合物材料被用于药物输送系统。下面将讨论这些材料及其性能。
壳聚糖
壳聚糖具有黏液粘附特性,可用于紧密的上皮连接。因此,壳聚糖基纳米材料被广泛用于各种类型上皮细胞的持续药物释放系统,包括口腔粘膜[109],肠[110],鼻的[111],眼睛[112]和pulmonary [113].Silva等人。[114]制备并评估了含有壳聚糖/三聚磷酸钠/透明质酸纳米颗粒的0.75% w/w羟丙基甲基纤维素(HPMC)等渗溶液将抗生素头孢他啶输送到眼睛的功效。通过计算不同质量比例的纳米颗粒与粘蛋白接触时的黏度,计算其流变协同参数。壳聚糖纳米颗粒与粘蛋白接触时粘度最小。然而,纳米颗粒具有黏附性,与眼黏膜相互作用良好,延长了抗生素的释放时间,因此,纳米颗粒可以延长药物在眼睛中的寿命。纳米颗粒对测试的两种细胞系(ARPE-19和HEK 239T)没有显示细胞毒性。纳米颗粒还能够保持抗菌活性,从而使它们成为一种有前途的具有改善粘液粘附性能的眼部药物的管理配方。
皮斯托涅等人[115制备了壳聚糖、海藻酸盐和果胶的纳米颗粒,作为药物进入口腔的潜在候选药物。根据纳米颗粒在唾液环境中的溶解度估计了配方的生物相容性,并在口腔细胞系中估计了其细胞毒性潜力。海藻酸钠纳米颗粒在人工唾液中最稳定,至少2小时,而果胶,尤其是壳聚糖纳米颗粒则不稳定。然而,壳聚糖纳米颗粒的细胞竞争性最强,而海藻酸盐和果胶纳米颗粒在所有测试条件下(浓度和时间)均表现出细胞毒性。锌的存在2 +(交联剂)可能是观察到的细胞毒性的原因。每种配方都有其优点和局限性,因此需要进一步改进。
此外,Liu等。[116]制备了羧甲基壳聚糖纳米颗粒,用于鼻腔内卡马西平(CBZ)的释放,绕过血脑屏障膜,从而增加脑内药物量,提高治疗效果,从而减少全身药物暴露。纳米粒平均直径为218.76±2.41 nm,包封率为80%,载药量为35%。240min后脑内CBZ浓度仍高于血浆(P < 0.05)。
在另一个例子中,Jain和Jain [117]研究了5-氟尿嘧啶(5-FU)从透明质酸包被壳聚糖纳米颗粒通过口服进入肠道的放电情况。在模拟从胃到结肠的运输条件下进行的释放试验表明,5-FU的释放情况可以防止在胃和小肠中放电。同时,局部浓度高的药物可以增加暴露时间,从而增强抗肿瘤疗效的能力,降低结肠癌治疗的全身毒性。
藻酸盐
海藻酸盐是另一种用于给药的生物聚合物材料。该生物聚合物具有最终羧基,属于阴离子粘接聚合物,与阳离子和中性聚合物相比具有更强的粘接强度[59,118].帕蒂尔和德瓦拉扬[119]研制了以烟酰胺为渗透剂的含胰岛素海藻酸钠纳米颗粒,以降低糖尿病大鼠的血糖水平,提高血清胰岛素水平。在烟酰胺存在的情况下,舌下给药纳米颗粒(5iu /kg)具有高可用性药理学(> 100%)和生物利用度(> 80%)。与皮下注射1iu /kg相比,NPs具有20.2%的药理学高潜能和24.1%的生物利用度,这一事实已在链霉素诱导的糖尿病小鼠模型中得到证明,NPs是舌下途径胰岛素的有希望的载体[119].
此外,哈克等人。[120]制备的海藻酸钠纳米颗粒经鼻内释放文拉法辛(VLF)用于治疗抑郁症。与鼻内的VLF和静脉注射的VLF溶液相比,鼻内给药的VLF浓度与海藻酸钠纳米颗粒的血/脑比值更高,这表明纳米配方在直接将VLF输送到大脑方面具有优势。通过这种方式,这些纳米颗粒有望用于治疗抑郁症。在另一个例子中,Román等。[121]制备了表面结合表皮生长因子的海藻酸微胶囊,靶向非小细胞肺癌细胞。顺铂(致癌物药物)也被装载在纳米颗粒中。EGF的加入显著提高了载体系统的特异性,并比游离药物更快地呈现细胞死亡动力学(h460 -肺癌株)。
此外,Garrait et al. [122]制备了含苋菜红壳聚糖(AR)的纳米颗粒,并将其微胶囊化在海藻酸盐微粒中,研究了该新体系在模拟胃液和肠液中的释放动力学。颗粒平均直径为285 μm,分布均匀;观察到,在胃pH条件下,系统中所含AR的释放量不到5%,而在肠道pH条件下,系统中AR的释放量迅速而全面。因此,该载体显示出口服给药后保护肠道释放分子的希望。
科斯塔等人[123]制备壳聚糖包被海藻酸纳米颗粒,以增强达托霉素对眼上皮细胞的渗透,达到抗菌效果。体外通透性采用眼上皮细胞培养模型进行评估。纳米达托霉素胶囊对细菌性眼内炎病原菌的抑菌活性有潜在的抑制作用。此外,眼通透性研究表明,在壳聚糖/海藻酸纳米颗粒包裹的达托霉素处理4小时后,总数为9%至12%,这些都能够穿过HCE和ARPE-19细胞。这些结果表明,该系统增加了药物在眼上皮的滞留已经发生。
黄原胶
黄原胶(XG)是一种高分子量杂多糖黄定.它是一种聚阴离子多糖,具有良好的生物粘附性能。由于黄原胶无毒无刺激性,因此被广泛用作药物辅料[124].
拉弗勒尔和米查莱克[125]制备了黄原胶硫代载体l-半胱氨酸在口腔黏膜释放单宁来治疗唾液漏。与原生黄原胶相比,黄原胶的硫代作用导致颊黏膜粘连增加。此外,黄原胶硫酸盐对唾液的吸收更高,而单宁酸则能促进口腔黏膜的干燥。这样,该系统将是一种有效的减少唾液流患者的唾液流量的方法。血管新生是软组织再生的重要特征。
黄等人。[126]制备了含有强效血管生成因子(抗血管内皮生长因子,VEGF)的醛改性黄原胶和羧甲基改性壳聚糖组成的可注射水凝胶,以改善腹壁重建。水凝胶主要在消化道和开放性伤口等组织中表现出释放特性。含有VEGF的水凝胶能够加速血管生成过程,重建腹壁。门泽尔等人[127]研究了一种新的辅料,用于鼻腔释放系统。以黄原胶为主要聚合物,其中-(2-氨基-2-羧乙基)二硫酰烟酸(Cys-MNA)偶联。分析了所得到的共轭物的特性,如相关粘结剂的用量、粘接性能和抗降解稳定性。每克聚合物用252.52±20.54 μmol粘结剂结扎。接枝聚合物的黏附性能是硫代黄原胶的1.7倍,是天然黄原胶的2.5倍。此外,鼻上皮细胞的睫状体搏动频率受影响很小,只有在从黏膜中去除聚合物时才可逆。
纤维素
纤维素及其衍生物广泛应用于药物传递系统,主要用于改变药物的溶解度和凝胶化,从而控制药物的释放谱[128].Elseoud等人。[129]研究了纤维素纳米晶体和壳聚糖纳米颗粒在瑞格列奈(一种抗高血糖rpg)口服释放中的应用。壳聚糖纳米颗粒的平均粒径分布为197 nm,而壳聚糖与纤维素纳米晶体的杂化纳米颗粒含有RPG。壳聚糖杂化纳米颗粒和含RPG的氧化纤维素纳米晶体的平均直径为251 ~ 310 nm。纤维素纳米晶体与药物之间的氢键的存在导致了药物的持续释放,因此与天然纤维素纳米晶体相比,氧化纤维素纳米晶体制备的纳米颗粒具有更低的释放量。
Agarwal等人[130]已经开发了一种基于海藻酸钙珠与羧甲基纤维素(CMC)负载的5-氟酰(5-FU)偶联的药物靶向机制,并靶向结肠。低CMC比例的小球在模拟结肠环境中肿胀和黏附性更强。在结肠酶的作用下,5-FU的释放率达到90%。汉森等人。[131]研究了四种纤维素衍生物,包括甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和阳离子羟乙基纤维素在药物释放到鼻粘膜中的应用。还对这些纤维素衍生物与附加辅料的关系进行了评估。该过程采用的药物模型为阿昔洛韦。该聚合物作为鼻腔释放应用辅料的可行性也被仔细检查了其睫状体跳动频率(CBF)及其通过鼻腔组织系统的输注。当纤维素衍生物与聚合物接枝共聚物混合时,热诱导粘度增加。此外,当阿昔洛韦与阳离子羟乙基纤维素联合使用时,检测到阿昔洛韦进入鼻粘膜的渗透性增加。根据CBF的评估,没有一种纤维素衍生物对鼻黏膜的组织和细胞造成负面影响。
脂质体
1960年,亚历克·邦汉发现了它们。脂质体用于制药和化妆品行业的各种分子的运输,是研究最多的药物传递载体系统之一。脂质体是改善药物给药的一种根深蒂固的配方策略。它们是球状的小泡,由磷脂和类固醇组成,大小通常在50-450纳米之间[132].它们被认为是一种更好的药物传递载体,因为它们的膜结构类似于细胞膜,而且它们有助于药物在其中的结合[132].也已证明,它们使治疗性化合物稳定,改善其生物分布,可与亲水性和疏水性药物一起使用,同时具有生物相容性和可生物降解性。脂质体分为四种类型:(1)常规型脂质体:由脂质双分子层组成,该双分子层可以生成阴离子、阳离子或中性胆固醇和磷脂,环绕在水质核心材料周围。在这种情况下,脂质双分子层和水空间都可以分别被疏水或亲水材料填充。(2)聚乙二醇化型:将聚乙二醇(PEG)合并到脂质体表面以达到空间平衡,(3)配体靶向型:将配体如抗体、碳水化合物和多肽连接到脂质体表面或先前附着的PEG链的末端。(4)治疗性脂质体型:它是前三种脂质体的合并类型,通常由一个纳米颗粒以及靶向、成像和治疗元件组成[133].
脂质体的典型合成工艺为薄层水化、机械搅拌、溶剂蒸发、溶剂注射、表面活性剂增溶[134].关于脂质体需要指出的一个方面是,被困在脂质体中的药物在被释放之前是不可生物利用的。因此,它们在特定部位的积累对于在治疗窗口内以正确的速度和时间提高药物的生物利用度非常重要。脂质体内的药物装载可通过主动(脂质体形成后药物包被)和被动(脂质体形成时药物包被)途径实现[135].亲水药物如氨苄西林和5-氟脱氧尿苷通常局限在脂质体的水核中,因此,它们的包封不依赖于药物/脂质比的任何修饰。而两性霉素B、吲哚美辛等疏水分子则位于脂质体的酰基烃链上,因此它们的吞噬受到酰基链的特性的影响[136].在被动加载方法中,可以提到机械分散法和溶剂分散法以及洗涤剂去除法[135].
使用脂质体以RES(网状内皮系统)、调理和免疫原性的形式进行药物传递存在障碍,尽管可以利用增强渗透性和EPR(保留效应)等因素来提高脂质体的药物传递效率[133,135].一旦脂质体进入体内,它们就会在血液中自行循环时遇到调理蛋白和高密度脂蛋白(hdl)和低密度脂蛋白(ldl)。调理蛋白(例如免疫球蛋白和纤维连接蛋白)协助RES识别和消除脂质体。hdl和ldl与脂质体相互作用,降低脂质体的稳定性。脂质体倾向于在肝脏和脾脏等部位聚集更多,这是一个优势,因为高浓度的脂质体可以帮助治疗致病性疾病,尽管在癌症的情况下,这可能导致亲脂性抗癌药物的延迟去除。这就是为什么如开头所述,已经开发了不同类型的脂质体,在这种情况下,peg化的脂质体。Dimov等人。[137]报道了脂质体的合成、功能化和清洗的连续流动系统过程。这项研究由芯片实验室中300纳米以下的囊泡组成,这些囊泡是有用的,也是成本密集型药物或蛋白质封装开发的潜在候选对象[137].这是非常重要的,因为生产成本也决定了一种特定的药物是否可以商业化。基于脂质体的系统现在已被FDA批准[133,135,138,139,140].
聚合物胶束
聚合物胶束是由两亲性嵌段共聚物制成的纳米结构,在水溶液中自行聚集形成核壳结构。疏水核心可装载疏水药物(如喜树碱、多西紫杉醇、紫杉醇),同时亲水外壳使整个体系溶于水,稳定核心。聚合胶束的大小在100 nm以下,通常分布狭窄,以避免肾脏快速排泄,从而通过EPR效应在肿瘤组织中积累。此外,它们的聚合物外壳抑制了与生物成分的非特异性相互作用。这些纳米结构具有很强的疏水药物递送前景,因为它们的内部核心结构允许这些药物的同化,从而提高稳定性和生物利用度[141,142].
聚合胶束的合成有两种方法:(1)方便的溶剂型聚合物直接溶解,然后透析或(2)加入溶剂沉淀成块[142,143].两亲分子中疏水链的大小、两亲分子的浓度、溶剂体系和温度等因素影响胶束的形成[144].当两亲性分子达到称为临界胶束浓度(CMC)的最低浓度时,胶束组装就开始了[143].在较低浓度时,两亲性分子确实很小,并且独立发生[143].药物通过直接溶出法、溶剂蒸发法和透析法三种常用的方法装载在聚合物胶束中。在直接溶出过程中,共聚物与药物在水介质中自行结合,形成载药胶束。在溶剂蒸发过程中,使用挥发性有机溶剂将共聚物与预期药物溶解,最后在透析过程中,将溶液中的药物与有机溶剂中的共聚物在透析袋中结合,然后进行透析,形成胶束[145].
使用不同聚合胶束的药物的靶向性由不同的作用机制建立,包括增强穿透性和保持效应刺激;特定定向配体分子与胶束表面的络合;或通过胶束冠的单克隆抗体的组合[146].据报道,聚合物胶束既可用于抗癌药物输送,也可用于抗癌药物输送[143]以及眼内给药[147,如图所示。3.其中聚合物胶束用于到达眼后组织[147].在李等人的研究中[148],达沙替尼被包裹在PEG-b-PC胶束制备的纳米颗粒中,用于治疗增殖性玻璃体视网膜病变(PVR),其尺寸为55 nm,分布狭窄,对ARPE-19细胞无细胞毒性。与游离药物相比,这种胶束配方抑制了细胞增殖、附着和重新定位[148].在相关应用后,聚合胶束习惯性地通过经巩膜通路进入后眼组织(图。3.;[147])。
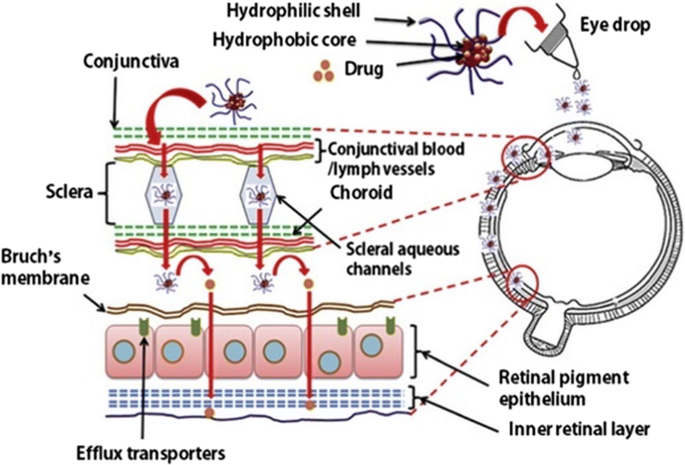
(此图转载自Mandal等人。[147]并须获得版权许可)
局部应用后通过经巩膜途径到达眼后组织的聚合胶束
树枝状分子
树状大分子是高度分叉,单分散,明确的三维结构。它们是球状的,表面易于控制功能化,这使得这些结构成为极佳的药物输送剂候选者[149,150,151].树突分子的合成有两种途径:第一种是不同的路径,树突分子从核心开始形成,然后向外延伸;第二种是收敛路径,从树突分子的外部开始[152].树状大分子根据其功能化部分分为几种:PAMAM、PPI、液晶、核壳、手性、肽、糖树状大分子和PAMAMOS,其中PAMAM是研究最多的口服给药药物,因为它是水溶性的,它可以通过上皮组织通过细胞旁途径促进其转移[153].由于胺基的存在,树状大分子的临床应用受到限制。这些基团带正电或阳离子,这使得它们有毒,因此树状大分子通常被修饰,以减少或消除这种毒性问题。树状大分子的载药机制如下:简单包封、静电相互作用和共价偶联[154].
树状大分子给药主要有两种不同的途径,一种是在体内利用合适的酶或有利的环境将药物树状大分子的共价键降解,另一种是由于pH值、温度等物理环境的变化而释放药物。[154].树状大分子已被开发用于透皮、口服、眼给药、肺给药和靶向给药[155].
Jain等人[156]描述了叶酸附着聚l阿霉素-赖氨酸树枝状大分子(盐酸阿霉素)作为一种具有pH依赖性药物放电、靶向特异性、抗血管生成和抗癌前景的癌症预防药物载体模型,表明阿霉素-叶酸共轭聚l与游离阿霉素相比,-赖氨酸树状大分子24 h后使阿霉素在肿瘤中的浓度增加了121.5倍。同样,(Kaur et al. [157]开发了叶酸偶联聚丙烯亚胺树状大分子(FA-PPI)作为甲氨蝶呤(MTX)纳米载体,用于ph敏感药物释放、选择性靶向癌细胞和抗癌治疗。体外研究显示其对MCF-7细胞系具有缓释、增加细胞摄取和低细胞毒性[157].此外,必须指出的是,与游离药物甲氨蝶呤(MTX)相比,所开发的配方,负载甲氨蝶呤(MTX)和叶酸偶联5.0G PPI (MTX- fa -PPI),被肿瘤细胞选择性地吸收。
无机纳米粒子
无机纳米颗粒包括银、金、氧化铁和二氧化硅纳米颗粒。对它们的研究并不像本节讨论的其他纳米颗粒类型那样多,尽管它们显示出一些潜在的应用。然而,只有少数纳米颗粒被接受用于临床,而大多数纳米颗粒仍处于临床试验阶段。金属纳米颗粒,银和金,具有特殊的性质,如SPR(表面等离子体共振),脂质体,树状大分子,胶束不具备。在表面功能化方面,它们表现出了良好的生物相容性和多功能性等优点。
对其给药相关活性的研究未能明确其颗粒或电离形式是否与毒性有关,即使提出了两种机制,即细胞旁转运和胞内转运,但关于其体内转运和摄取机制的信息并不充分[158].药物可以通过离子或共价键结合和物理吸收结合到金纳米颗粒(AuNPs)表面,并通过生物刺激或光激活来传递和控制其释放[159].银纳米颗粒具有抗菌活性,但在药物传递方面的研究很少,例如Prusty和Swain [160]合成了一种具有共价连接银纳米颗粒的多孔聚丙烯酰胺/葡聚糖纳米水凝胶杂化体系,用于奥硝唑的体外释放,其释放率为98.5% [160].类似地,在另一项研究中,使用激光热解法合成了氧化铁纳米颗粒,并将Violamycine B1和抗抗生素覆盖,并对MCF-7细胞进行了细胞毒性和抗增殖特性测试,并与市售氧化铁纳米颗粒进行了比较[161].
纳米晶体
纳米晶体是在1000nm范围内的纯固体药物颗粒。这些是100%的药物,没有任何载体分子附着在上面,通常通过使用聚合空间稳定剂或表面活性剂来稳定。在边缘液体介质中的纳米晶体悬浮液通常通过添加一种称为纳米悬浮液的表面活性剂来减轻。在这种情况下,分散介质主要是水或任何水或非水介质,包括液体聚乙二醇和油[162,163].纳米晶体具有特定的特性,使它们能够克服诸如增加饱和溶解度、增加溶解速度和增加表面/细胞膜的粘性等困难。纳米晶体的合成过程分为自上而下和自下而上两种方法。自顶向下的方法包括声结晶、沉淀、高重力控制沉淀技术、多入口涡流混合技术和有限冲击液体射流沉淀技术[162].然而,使用有机溶剂并在最后去除它使得这个过程相当昂贵。自底向上的方法包括研磨程序以及高压均质[162].在所有的方法中,铣削、高压均质和沉淀法是最常用的制备纳米晶体的方法。纳米晶体支持药物被系统吸收的机制包括增强溶解度、悬浮率和牢固固定肠壁的能力[162].Ni等。[164]在壳聚糖微颗粒中嵌入cinaciguat纳米晶,用于疏水药物的肺给药。纳米颗粒是为了利用聚合物的膨胀和黏液粘附潜力连续释放药物而设计的。他们发现,在疾病条件下,吸入的功效可能会降低,因此需要更多的研究来证明这个系统有更大的潜力[164].
金属纳米粒子
近年来,金属纳米颗粒在生物成像、生物传感器、靶向/持续给药、热疗和光消融治疗等不同医学应用领域的应用兴趣日益浓厚[35,165].此外,这些纳米颗粒的修饰和功能化具有特定的官能团,使它们能够与抗体、药物和其他配体结合,使这些系统在生物医学应用中更有前景[166].尽管研究最广泛的金属纳米颗粒是金、银、铁和铜,但人们对其他种类的金属纳米颗粒也有兴趣,如氧化锌、氧化钛、铂、硒、钆、钯、二氧化铈等[35,165,166].
量子点
量子点(QDs)是一种直径为2至10纳米的半导体纳米晶体,其光学性质,如吸光度和光致发光,均与尺寸有关[167].量子点在纳米医学领域得到了极大的关注,因为与传统的有机染料不同,量子点在近红外区域(< 650 nm)发射,这是生物医学图像领域非常理想的特性,这是由于组织吸收低,光散射减少[167,168].此外,具有不同大小和/或组成的量子点可以被相同的光源激发,从而在宽光谱范围内产生不同的发射颜色[169,170].从这个意义上说,量子点对多路成像非常有吸引力。在医学领域,量子点在靶向药物传递、传感器和生物成像方面得到了广泛的研究。目前文献中有大量关于量子点作为对比剂应用于体内成像的研究[168,171,172,173].韩等人。[172]开发了一种基于降冰片烯显示聚咪唑配体包被qds抗体偶联物的新型荧光团,用于活体细胞成像。这种荧光团被用来标记体内的骨髓细胞。作者发现荧光团能够在整个骨髓中扩散,并标记罕见的细胞群,如造血干细胞和祖细胞[172].Shi等。[171]开发了一种覆盖有发光磁性纳米平台的多功能生物相容性氧化石墨烯量子点,用于识别/诊断特定的肝癌肿瘤细胞(表达glypican-3的Hep G2)。根据作者的说法,将抗gpc3抗体附着在纳米平台上,可从受感染的血液样本中选择性分离Hep G2肝细胞癌细胞[171].量子点还可以在治疗分子的持续和/或控制释放方面带来好处。关于受控释放,这种行为可以通过光、热、射频或磁场等外部刺激来实现[170,174,175].Olerile等人[176]开发了一种基于量子点和抗癌药物共负载的纳米结构脂质载体治疗系统,作为肠外多功能系统。纳米颗粒呈球形,紫杉醇包封率为80.7±2.11%,肿瘤生长抑制率为77.85%。作者还发现该系统能够特异性靶向并检测H22肿瘤细胞[176].蔡等人。177]合成了以PEG和透明质酸修饰的ZnO量子点为基础的pH响应量子点,分别使其在生理条件下稳定,并以ha受体CD44靶向特定细胞。该纳米载体还对阿霉素(DOX)的缓释进行了评价。该纳米载体在生理pH值上稳定,并通过与Zn形成络合物将DOX负载在载体中2 +离子或与聚乙二醇缀合。由于ZnO量子点的破坏,DOX仅在肿瘤细胞酸性条件下释放。作者发现DOX和ZnO量子点的结合增强了其抗癌活性[177].
蛋白质和多糖纳米颗粒
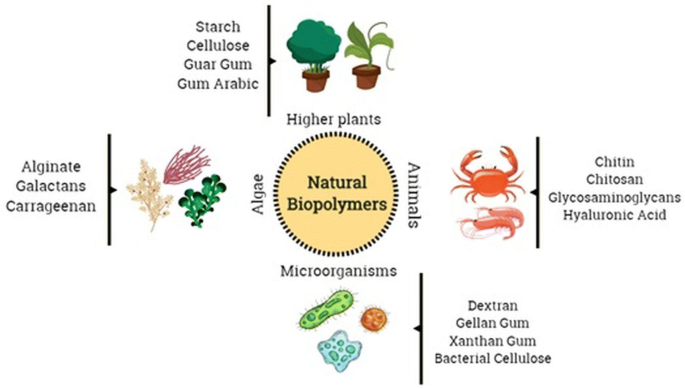
多糖和蛋白质统称为天然生物聚合物,从植物、动物、微生物和海洋来源等生物来源中提取[178,179].基于蛋白质的纳米颗粒通常可分解、代谢,并且易于功能化,因为它附着在特定药物和其他靶向配体上。它们通常由两种不同的系统生产,(a)由水溶性蛋白质如牛血清白蛋白和(b)由不溶性蛋白质如玉米蛋白和麦胶蛋白[180].常用的合成方法有凝聚/脱溶法、乳液/溶剂萃取法、复合凝聚法和电喷涂法。以蛋白质为基础的纳米颗粒被化学改变,以结合靶向配体,以识别精确的细胞和组织,以促进和增强其靶向机制[180].类似地,多糖是由糖单位(单糖)通过o -糖苷键连接。这些单体的组成及其生物来源能够赋予这些多糖一系列特定的物理化学性质[126,179,181].在纳米医学领域使用多糖的主要缺点之一是其在高温(高于熔点)下的降解(氧化)特性,这在工业过程中通常是必需的。此外,大部分多糖易溶于水,这限制了其在一些纳米医学领域的应用,如组织工程[182,183].然而,为了保证多糖链的稳定性,已经采用了聚合物链交联等技术,以保证它们在水环境中的稳定性[182,183].在无花果。4,总结了从不同来源获得的一些用于纳米医学的多糖的例子。这些生物聚合物在纳米医学和药物输送方面的成功是由于它们的多功能性和特定的特性,例如由于它们可以起源于软凝胶、柔性纤维和硬形状,因此它们可以是多孔的或无孔的;它们与细胞外基质成分有很大的相似性,可能可以避免免疫反应[179,184].
然而,与此类纳米颗粒相关的文献并不多,因为它们是由生物相容性化合物生成的,因此它们是进一步发展为药物输送系统的极好的候选者。Yu等人。[185合成牛血清白蛋白,并通过豚鼠耳蜗和中耳开口检测其附着和/或浸润特性。对被认为是药物转运体的纳米颗粒进行装载能力和释放行为的测试,可以提供更好的生物适应性、药物装载能力和有序的释放机制[185].
基于天然产物的纳米技术和药物输送
根据世界卫生组织(世卫组织)的报告,在发展中国家,约80%的人口的基本保健需求得到了传统医学的满足和/或补充[186].目前,科学界正专注于研究各种植物物种的生物活性化合物及其化学组成和药理潜力,以生产出比现有分子副作用相对较小的创新活性成分[5,187].长期以来,植物被证明是具有药用重要性的天然化合物的巨大来源,并且仍然为发现新的高效药物提供了充足的资源。然而,通过天然来源发现活性化合物与几个问题有关,因为它们起源于生物,其代谢物组成在压力存在时发生变化。从这个意义上说,制药工业已经选择将他们的努力集中在合成化合物的开发上。187,188,189].然而,实际上市的合成分子的数量正日益减少,因此,尽管存在障碍,但基于活性化合物的天然产物的研究再次成为人们关注的焦点[189,190].大多数已投入市场的具有经济重要性和药用潜力的天然化合物都是在高等植物中发现的[187,191].在其成分中也含有天然治疗剂的几种药物已经在市场上出售;它们的用途和名称如下:治疗疟疾(Artemotil®来自青蒿L.,一种中药植物),治疗阿尔茨海默病(瑞明®一种乙酰胆碱酯酶抑制剂雪花属woronowiiLosinsk),癌症治疗(紫杉醇)®它的类似物是从水松杂草植物;长春碱和长春新碱的提取Catharanthus roseus也叫;喜树碱及其类似物的衍生Camptotheca acuminata十二月),肝病治疗(水飞蓟素从Silybum marianum) [187].
许多天然化合物的组成和活性已经被研究和确定。生物碱、类黄酮、单宁、萜烯、皂苷、类固醇、酚类化合物等都是植物中的生物活性分子。然而,在大多数情况下,这些化合物由于分子尺寸大而缺乏穿过脂膜的能力,其吸收能力较低,从而导致生物利用度和疗效降低[192].这些分子也表现出较高的全身清除率,需要重复应用和/或高剂量,使药物治疗效果较差[189].纳米技术的科学发展可以彻底改变基于天然产物的配方的发展,带来能够解决上述限制这些化合物在纳米医学中大规模应用的问题的工具[7,189].近年来,人们广泛研究纳米技术在医疗领域的应用[193,194].因此,这些可以克服这些障碍,并允许在同一配方的制备中使用不同的化合物和混合物。此外,它们还可以改变生物系统内化合物的性质和行为[7,189].此外,释放系统对化合物的溶解性和稳定性带来了相对于化合物的溶解性和稳定性的好处,将化合物定向到特定的位置,提高生物利用度和延长化合物作用,并结合具有不同程度亲水/亲脂性的分子[7].此外,有证据表明,释放系统与天然化合物的关联可能有助于延缓耐药性的发展,因此在寻找治疗几种对现代医学常规治疗方法反应较低的疾病的新可能性方面发挥了重要作用[7,189].
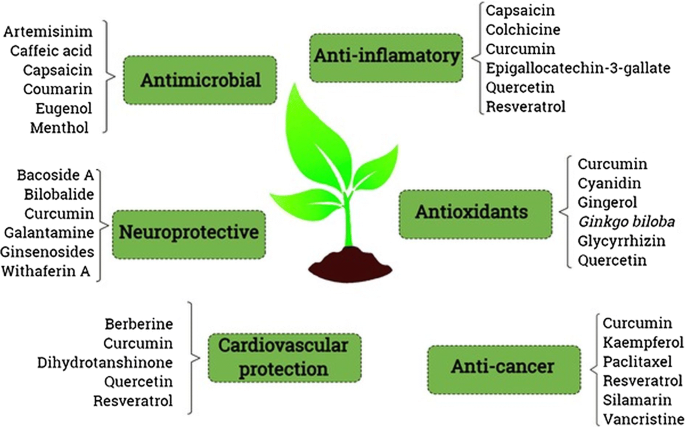
天然产物为基础的材料分为两类:(1)针对特定部位,在特定部位释放,治疗多种疾病[43,195]和(2)主要用于合成过程[196].大多数研究都是针对癌症的治疗,因为癌症是当今世界范围内最主要的死亡原因[197,198].在癌症疾病的情况下,身体的不同器官都受到影响,因此,需要开发一种替代药物来靶向癌细胞是现代研究人员的最优先事项,然而,纳米医学在其他疾病上的一些应用也正在研究中[199,200].这些输送系统根据其表面电荷、颗粒大小、大小分散、形状、稳定性、包封潜力和生物作用进行分类,并根据其要求进一步利用[33].图中描述了从高等植物中获得的生物化合物及其在纳米医学领域中的应用的一些例子。5.制药工业不断寻求开发和应用新技术,以改进和设计现代药物,并改进现有药物[71,201].从这个意义上说,纳米技术的加速发展通过不同的方法推动了新配方的设计,例如,将药物驱动到作用部位(纳米药物);图像和诊断(纳米诊断)、医用植入物(纳米生物材料)以及疾病的联合诊断和治疗(纳米医学)[71,202,203].
目前,许多正在开发的纳米药物是已用于治疗患者的活性成分(AI)的改性释放系统[203,204].对于这种类型的方法,评估这些AIs的持续释放是否改变药代动力学特征和生物分布。在这种情况下,可以确定纳米配方比现有配方具有优势,如果AI指向目标组织,显示细胞摄取/吸收增加,并且对生物体的毒性较低[205,206].本节重点介绍小檗碱、姜黄素、鞣花酸、白藜芦醇、姜黄素和槲皮素[8].其他一些提到的化合物是阿霉素,紫杉醇和万古霉素也来自天然产物。
纳米颗粒是用天然产物合成的。例如,据报道,金属、金属氧化物和硫化物纳米颗粒可以用各种微生物合成,包括细菌、真菌、藻类、酵母等[207]或植物提取物[208].对于第一种方法,在适当的生长介质中制备有助于合成程序的微生物,然后在溶液中与金属前体混合,并留下孵育以在细胞内或细胞外形成纳米颗粒[209,210,211].至于第二种方法,制备植物提取物,然后在溶液中与金属前驱体混合,在室温或沸温下进一步孵育一定时间,或作为外部刺激暴露于光下,以启动纳米颗粒的合成[212].
目前,这些天然产物为基础的材料被认为是制备和加工新型纳米配方的关键成分,因为它们具有有趣的特性,如可生物降解、生物相容性、可用性、可再生性和低毒[178,179,213].除了上述特性外,生物材料在大多数情况下能够进行化学修饰,这保证了它们在纳米医学领域的潜在用途的独特和理想的特性[45,214].利用多种细菌即合成了具有不同形态特征的金、银、硫化镉和二氧化钛大肠杆菌,铜绿假单胞菌,枯草芽孢杆菌而且肺炎克雷伯菌[211].这些纳米颗粒,特别是银纳米颗粒,由于其在所有金属纳米颗粒中具有更高的潜力,已在体外对其抗菌、抗真菌和细胞毒性潜力进行了大量研究[215,216].在微生物介导的纳米颗粒合成中,大部分研究集中在微生物减少金属前体并生成纳米颗粒的方式上。例如,Rahimi等人。217]合成的银纳米颗粒白色念珠菌并分别研究了其对两种致病菌的抗菌活性金黄色葡萄球菌而且大肠杆菌。类似地,Ali等人。218]合成银纳米颗粒艾苦艾水提取物及其抑菌活性进行了比较疫霉parasitica而且疫霉capsici[218].此外,Malapermal等。[219)使用罗勒属basilicum而且罗勒属圣所合成纳米颗粒,并研究其抗微生物活性大肠杆菌,沙门氏菌spp。金黄色葡萄球菌,铜绿假单胞菌还有抗糖尿病的潜力。同样,桑卡尔等人。220]还测试了银纳米颗粒对人类肺癌细胞株的抑菌和抗癌潜力。除了利用微生物外,我们的团队还利用各种食物垃圾,如提取物,合成了银,金和氧化铁纳米颗粒玉米叶子(221,222]、洋葱皮提取物[223],柔滑的毛发玉米[224的,水果的外皮Cucumis梅洛而且碧桃[225],…的外皮碧桃[226]和西瓜皮提取物[227]等,并测试了其对多种食源性致病菌的潜在抑菌作用,对多种致病菌的抑菌活性假丝酵母由于其潜在的抗氧化活性和蛋白酶体抑制作用。
在药物递送方面,最常研究的纳米载体是晶体纳米颗粒、脂质体、胶束、聚合物纳米颗粒、固体脂质纳米颗粒、超顺磁性氧化铁纳米颗粒和树状大分子[228,229,230].所有这些纳米载体都是为基于天然产物的药物输送而配制的。对于在癌症治疗中的应用,Gupta等人。231]合成了壳聚糖基纳米颗粒,负载紫杉醇(紫杉醇)衍生而来水松杂草,并利用它们来治疗不同种类的癌症。作者得出结论,与纯紫杉醇相比,纳米颗粒负载的药物表现出更好的缓释活性、高细胞摄取和降低溶血毒性[231].小檗碱是一种来自于小檗的生物碱。Chang等人。[232]产生了肝素/小檗碱缀合物来增加抑制作用幽门螺杆菌生长,同时减少受感染细胞的细胞毒性作用[232],如图所示。6.
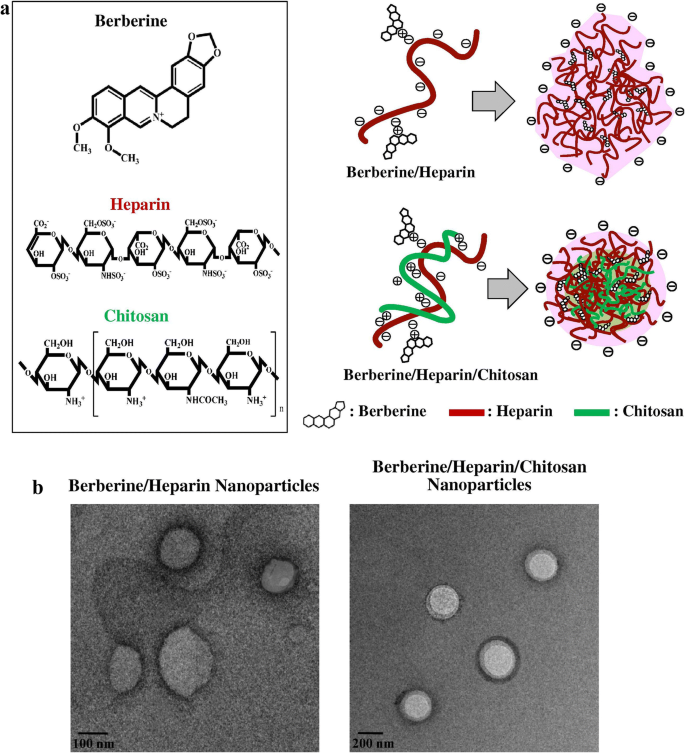
(此图转载自Chang等人。[232]并须获得版权许可)
一个小檗碱/肝素纳米颗粒和小檗碱/肝素/壳聚糖纳米颗粒的结构。b小檗碱/肝素纳米颗粒和小檗碱/肝素/壳聚糖纳米颗粒的TEM图像
Aldawsari和Hosny [233合成鞣花酸- slns包封万古霉素(一种糖肽抗生素,在培养Amycolatopsis胶).此外,在家兔身上进行了体内试验,结果表明鞣花酸可以阻止游离氧自由基及其清除自由基的形成,从而防止损伤并促进修复[233].槲皮素是一种多酚,属于类黄酮类,可以在柑橘类水果和蔬菜中找到,它具有抗氧化特性。在Dian等人的研究中[234],使用聚合胶束来递送槲皮素,结果表明,这种胶束在体外可以提供长达10天的连续释放,在体内条件下保持持续的血浆水平,并提高药物的完全可及性[234].
柔红霉素是一种天然产物,衍生自许多不同的野生型菌株链霉菌属,阿霉素(DOX)是阿霉素的水解版本,用于化疗[213].斯皮尔曼等人。[235]开发了一种多功能液晶纳米颗粒系统,用于细胞内荧光成像和阿霉素的递送,其中纳米颗粒与转铁蛋白功能化。HEK 293T/17细胞内吞囊泡内获得细胞摄取和持续释放。用苝作为发色团来跟踪粒子,并封装用于细胞内传递的药剂[235].Purama等人。[236]即从两种蔗糖基乳酸菌中提取葡聚糖变形链球菌而且明串珠菌属mesenteroides.Agarwal等人[237]配制了一种右旋糖酐为基础的树突分子制剂,并在体外条件下评价了其药物放电能力和溶血活性。他们的结论是,树突结构选择性地进入受影响细胞的高渗透性部分,而不干扰健康组织,从而更方便其在生物医学领域的应用[237].叶酸功能化超顺磁性氧化铁纳米颗粒以前用于肝癌治疗,也被用于输送多克西(一种阿霉素,是1995年fda批准的第一种纳米药物)[238].在兔子和大鼠体内的研究表明,与单独使用Doxil相比,叶酸辅助和增强了特异性靶向[239].脂质体是研究最多的纳米结构,它们已被用于几种配方,用于输送白藜芦醇等天然产物[240].姜黄素是一种从姜黄中提取的多酚类化合物,据报道可用于治疗乳腺癌、骨癌、宫颈癌、肝癌、肺癌和前列腺癌[241].脂质体姜黄素配方已被开发用于治疗癌症[242,243].程等人。[244]将姜黄素用不同的方法包封在脂质体中,并对结果进行了比较,结果表明,依赖pH的脂质体可获得稳定的产物,包封效率高,生物可及性好,在癌症治疗中具有潜在的应用价值[244].
总的来说,可以说,天然存在的治疗性化合物的缓释系统是提高这些化合物的生物活性的关键工具,并通过为治疗慢性和绝症提供新的替代方案来最大限度地减少其局限性[8,245].根据BBC Research的数据,全球植物衍生药物市场将从2017年的294亿美元增加到2022年的约396亿美元,这一时期的复合年增长率(CAGR)为6.15% (BCC-RESEARCH)。本节中涉及的一些基于纳米结构的材料已经得到了FDA的批准。波波等人。255提供了有关已获FDA批准的基于纳米技术的产品的信息(表1).
监管和现实:现在市场上的产品
在目前的医疗纳米技术场景中,基于这种技术的产品有51种[204,246,247,248],目前正应用于临床实践(表2).值得注意的是,此类纳米药物主要是针对低水溶解度和高毒性的药物而开发的,这些纳米配方通常能够降低毒性,同时提高所讨论药物的药代动力学特性。
根据Caster等人最近的一篇综述。[249,虽然很少有纳米药物受到FDA的监管,但就临床试验而言,目前有许多计划正在进行中,这表明许多基于纳米技术的新药很快就能进入市场。在这些处于研究阶段的纳米材料中,有18种用于化疗;15个用于抗菌剂;28个用于不同的医疗应用和心理疾病、自身免疫疾病和许多其他疾病,30个用于基于核酸的治疗[249].FDA批准的纳米药物清单,按制剂中使用的载体/材料类型分类,见表2.
近年来,纳米技术得到了蓬勃发展,所有国家,无论是否发达,都在增加在这一领域的研究和开发投资。然而,研究纳米药物实际应用的研究人员面临着高度的不确定性,例如构建这些产品的清晰定义;这些纳米材料在安全性和毒性方面的特性;以及缺乏有效的监管。虽然已批准的纳米药物清单相当广泛,但这些纳米材料的开发和表征的具体监管指南的不足最终阻碍了其临床潜力[250].各种纳米材料的结构/功能关系,以及它们的特性、组成和表面涂层与生物系统相互作用。此外,当这些纳米药物被引入生物系统时,评估聚集和团聚形成的可能性也很重要,因为它们不反映单个颗粒的性质;这可能会产生不同的结果和/或意想不到的毒性作用,取决于纳米配方[250].
在物理化学和生理/生物水平上缺乏表征纳米药物的标准方案,往往限制了许多研究人员在试验早期确定纳米药物毒性潜力的努力,并导致后期临床试验的失败。为简化和/或缩短纳米药物/药物、药物输送系统等的审批程序,监管机构之间应加强合作[204,251].
作为一种缺乏调控的纳米药物策略和纳米给药系统;这些药物的安全性评估、毒性和配伍性都是根据FDA对常规药物的规定进行的。在获得FDA的新研究药物(研究性新药,IND)地位后,纳米药物,纳米药物输送系统开始临床试验阶段,以调查其在人类中的安全性和有效性。这些临床试验分为三个阶段:第一阶段(主要评估安全性);阶段2(主要评估疗效)和阶段3(评估安全性、疗效和剂量)。在这三个阶段获得批准后,FDA可以提交IND申请,要求批准新的纳米药物或纳米药物输送系统。然而,这种调控纳米药物的方法受到了广泛的质疑[204,246,252].
由于纳米技术的快速发展及其在纳米医学上的潜在应用,迫切需要改革和更综合的监管方法。在这方面,各国政府必须共同制定新的方案,必须具体和足够严格,以解决任何安全问题,从而确保为患者释放安全和有益的纳米药物[204,252,253].
纳米医学与药物输送系统的未来
纳米医学是目前最吸引人的研究领域之一。在过去的二十年里,这一领域的大量研究已经导致了1500项专利的填写和几十项临床试验的完成[254].正如上面各部分所概述的,癌症似乎是疾病的诊断和治疗都受益于非医疗技术的最好例子。通过使用各种类型的纳米颗粒将精确数量的药物输送到受影响的细胞,如癌症/肿瘤细胞,而不干扰正常细胞的生理机能,纳米药物和纳米药物输送系统的应用肯定是未来几十年的研究和开发领域的趋势。
在这次通信中展示的纳米颗粒的例子在尺寸上是不均匀的,一些真正的测量单位是纳米,而另一些则是亚微米(超过100纳米)。对具有更一致的均匀性和载药和释药能力的材料进行更多的研究将是进一步的研究领域。在使用金属基纳米颗粒用于诊断目的方面也取得了相当大的进展。包括金和银在内的这些金属在诊断和治疗中的应用是一个研究领域,有可能导致未来纳米药物的更广泛应用。在这个方向上的一个主要热情包括金纳米颗粒,它似乎在柔软的肿瘤组织中被很好地吸收,并使肿瘤容易受到辐射(例如,在近红外区域)的热疗法的选择性消除。
尽管人们对纳米医学和纳米给药系统的未来前景有了压倒性的了解,但它在医疗保健系统,甚至在癌症治疗/诊断方面的真正影响仍然非常有限。这是因为该领域是一个新的科学领域,对该主题的真正研究只有20年,许多关键的基本属性仍然未知。病变组织的基本标记,包括允许绝对靶向而不改变正常细胞过程的关键生物标记,是未来的一个主要研究领域。最终,纳米医学的应用将随着我们在分子水平上对疾病的日益了解而发展,或者反映出纳米材料-亚细胞大小可比标记物的识别,从而为新的诊断/治疗开辟道路。因此,在未来了解疾病的分子特征将导致纳米医学应用的进步。除了我们在这篇综述中所概述的使用已知的纳米探针和纳米不可知产品之外,进一步的研究将是纳米医学更广泛应用的关键。
在被围困部位控制释放特定药物的概念、评估这些事件的技术、药物在组织/细胞水平上的作用以及预测的理论数学模型尚未完善。纳米医学领域的许多研究都集中在生物材料和配方研究上,这些研究似乎是生物医学应用的初始阶段。有价值的潜在应用数据,如药物治疗和诊断研究将来自动物研究和多学科研究,这需要大量的时间和研究资源。随着寻求更精确的药物和诊断的全球趋势日益增长,更加智能和多中心的纳米药物和纳米药物递送技术的前景看起来一片光明。
人们对纳米机器人(和纳米器件)的发展抱有极大的热情,这些机器人具有完整的外部控制机制,可用于组织诊断和修复机制。这还没有成为现实,仍然是一个未来的研究,也许在不久的将来人类可以实现。然而,与它们的好处一样,纳米药物对人类和整个环境的潜在风险也需要长期研究。因此,必须分析新型纳米材料对人类和环境可能产生的急性或慢性毒性效应。随着纳米药物越来越受欢迎,它们的可负担性将是另一个需要更多研究投入的研究领域。最后,如前一节所述,纳米药物的监管将随着纳米药物应用的进步而继续发展。
结论
本综述讨论了纳米药物的最新进展,包括新旧药物递送的技术进展以及新的诊断方法。概述了一系列纳米维材料,包括纳米机器人和纳米传感器,它们适用于诊断、精确地传递到目标、感知或激活活动系统中的材料。最初,纳米技术的使用主要是基于提高药物的溶解度、吸收、生物利用度和控制释放。尽管纳米药物的发现涉及高度的不确定性,而且与大约50年前相比,从天然来源中发现药理活性化合物在今天并不是一个受欢迎的选择;因此,通过纳米技术提高已知天然生物活性化合物的功效已成为一个共同的特点。很好的例子是纳米技术在小檗碱、姜黄素、鞣花酸、白藜芦醇、姜黄素和槲皮素方面的治疗应用。通过使用由金、银、硫化镉和二氧化钛聚合物纳米颗粒与固体脂质纳米颗粒、晶体纳米颗粒、脂质体、胶束、超顺磁性氧化铁纳米颗粒和树状大分子组成的纳米载体,这些天然产物的功效大大提高。
生物可降解、生物相容性、易得性、可再生和低毒的新型天然生物材料一直是人们的需求。除了鉴定这些多糖和蛋白质的天然生物聚合物外,通过交联等技术使其在工业加工环境和生物基质下更加稳定的研究是目前最先进的研究领域之一。通过溶剂蒸发法、乳液聚合法和无表面活性剂乳液聚合法合成的高分子纳米粒子(纳米胶囊和纳米球)也被广泛介绍。近年来,人们对纳米医学发展的极大兴趣之一与治疗和诊断(治疗)的整合有关,例如癌症作为一种疾病模型。很好的例子已经封装,如油酸涂层的氧化铁纳米颗粒通过近红外诊断应用;海藻酸盐和叶酸基壳聚糖纳米颗粒光动力检测结直肠癌利用组织蛋白酶B作为转移过程的荧光肽探针偶联乙二醇壳聚糖纳米颗粒;氧化铁包覆透明质酸在癌症治疗中的生物聚合材料研究还有葡聚糖。
自20世纪90年代以来,fda批准的基于纳米技术的产品和临床试验的清单已经惊人地增加,包括合成聚合物颗粒;脂质体配方;胶束纳米粒子;蛋白质纳米粒子;纳米晶体和许多其他物质经常与药物或生物制剂结合。尽管纳米药物的监管机制以及安全性/毒性评估将是未来进一步发展的主题,但纳米药物已经彻底改变了我们在生物系统中发现和管理药物的方式。由于纳米医学的进步,我们诊断疾病,甚至将诊断与治疗相结合的能力也已成为现实。
缩写
- 基于“增大化现实”技术:
-
苋菜红
- CBF:
-
睫状搏动频率
- 卡马西平:
-
卡马西平
- 答:
-
结肠直肠癌
- CMC:
-
羧甲基纤维素
- Cys-MNA:
-
(2-氨基-2-羧乙基)二硫酰烟酸(Cys-MNA)
- EPR:
-
穿透性和持稳性
- 费尔南多-阿隆索:
-
叶酸共轭葡聚糖
- 食品药品监督管理局:
-
食品和药物管理局
- FeO说:
-
氧化亚铁
- 哈:
-
透明质酸
- 高密度脂蛋白:
-
高密度脂蛋白
- HPMC:
-
hydroxypropylmethylcellulose
- 检测:
-
低密度脂蛋白
- 先生:
-
核磁共振
- 近红外光谱:
-
近红外
- NP:
-
纳米颗粒
- PFH:
-
perfluorohexane
- PTX:
-
紫杉醇
- 角色扮演:
-
repaglidine
- VEGF:
-
抗血管内皮生长因子
- 甚低频:
-
文拉法辛
- XG:
-
黄原胶
参考文献
Swamy MK, Sinniah UR。广藿香:植物学、农业技术和生物技术。农学通报,2016;87:161-76。
Mohanty SK, Swamy MK, Sinniah UR, Anuradha M.网状瘦叶虫(Retz.)怀特&阿恩公司。(Jivanti):植物学,农学,植物化学,药理学和生物技术方面。分子。1019;2017:22。
罗德里格斯,瑞克D,施耐德P,施耐德G.利用天然产物进行药物设计。化学。2016;8:531。
王志强,王志强,王志强。天然产物在药物发现过程中的作用。国际药物开发杂志,2014;6(2):172-204。
布鲁斯农协。天然产物是药物发现的基础。中国药物学杂志。2009;46(1):9-11。
黄酮生物利用度及提高生物利用度的尝试。营养。2013;5:3367 - 87。
Bonifácio BV, da Silva PB, dos Santos Ramos MA, Negri KMS, Bauab TM, Chorilli M.基于纳米技术的药物传递系统和草药:综述。国际纳米医学杂志2014;9:1。
Watkins R, Wu L, Zhang C, Davis RM,徐波。基于天然产物的纳米医学:最新进展与问题。中国生物医学工程学报。2015;
Martinho N, Damgé C, Reis CP.药物输送系统的最新进展。生物工程学报。2011;2:10。
Jahangirian H, Lemraski EG, Webster TJ, Rafiee-Moghaddam R, Abdollahi Y.基于纳米技术和绿色化学的给药系统综述:绿色纳米医学。中国生物医学工程学报。2017;12:2957。
刘震,戴华。碳纳米管在生物和医学中的应用:体内外检测、成像和药物输送。纳米决议2009;2:85-120。
Orive G, Gascon AR, Hernández RM, domom * nguez-Gil A, Pedraz JL。技术:生物制药交付的新方法。药理学杂志2004;25:382-7。
Razzacki SZ, Thwar PK, Yang M, Ugaz VM, Burns MA。控制药物输送的集成微系统。Adv Drug Deliv Rev. 2004; 56:185-98。
Arayne MS, Sultana N, Qureshi F.纳米颗粒在心血管药物输送中的应用。中国医药科学,2007;20:340-8。
白k - h。绿色纳米生物技术:影响合成和表征技术的因素。J Nanomater. 2014;2014:219。
Joseph RR, Venkatraman SS.药物输送到眼睛:纳米载体提供什么好处?纳米医学。2017;12:683 - 702。
Mirza AZ, Siddiqui FA。纳米医学和药物输送:一个小回顾。Int Nano Lett. 2014;4:94。
Rudramurthy GR, Swamy MK, Sinniah UR, Ghasemzadeh A.纳米颗粒:对抗耐药病原微生物的替代品。分子。2016;21:836。
林培林,黄伟勇,边忠,崔春华,甘巴里瑞。绿色纳米颗粒给药系统的研究进展:高效给药与安全性。纳米医学。2017;12:357 - 85。
Haba Y, Kojima C, Harada A, Ura T, Horinaka H, Kono K.包覆金纳米颗粒的聚乙二醇修饰聚胺胺树枝状大分子的制备及其产热性能。朗缪尔。2007;23:5243-6。
石旭,孙k, Baker JR JR .功能化树突分子稳定金纳米颗粒的自发形成。中华物理学报。2008;12(2):344 - 344。
朴世华,吴世国,文建勇,韩世善。金纳米颗粒在脂质体双分子层内的负载及其对膜流动性的影响。Coll Surf B. 2006; 48:112-8。
de Villiers MM, Aramwit P, Kwon GS。纳米技术在药物输送中的应用。纽约:施普林格;2008.
卡巴诺夫AV,莱米厄P,维诺格拉多夫S,阿拉霍夫v®嵌段共聚物:用于基因治疗的新型功能分子。Adv Drug Deliv Rev. 2002; 54:223-33。
王娜,冯云。阐述天然产物诱导自噬在癌症治疗中的作用:最新成就和成果。生物医学杂志,2015;2015:934207。
瓦塔拉B,西玛德RE,霍利RA。Piette GJ-P, Bégin A:选定的脂肪酸和精油对六种肉类腐败微生物的抗菌活性。食品微生物学杂志,1997;37:155-62。
姜黄素与多种植物化学物质的组合抑菌作用葡萄球菌epidermidis.J Asian Nat Prod res 2014; 16:535-41。
Abdelwahab SI, Sheikh BY, Taha MME, How CW, Abdullah R, Yagoub U, El-Sunousi R, Eid EE。负载百里醌的纳米结构脂质载体:制备、胃保护、体外毒性和血管外给药后的药代动力学特性。国际纳米医学杂志,2013;8:2163。
Krauel K, Pitaksuteepong T, Davies NM, Rades T.生物活性分子在聚(烷基氰基丙烯酸酯)纳米颗粒的诱捕。中华医学杂志2004;2:251-9。
谭强,刘伟,郭超,翟刚。槲皮素负载卵磷脂-壳聚糖纳米颗粒的制备与评价。国际纳米医学杂志,2011;6:1621。
Sanna V, Roggio AM, Siliani S, Piccinini M, Marceddu S, Mariani A, Sechi M.新型阳离子壳聚糖和阴离子藻酸盐包覆聚(d, l -白藜芦醇的控释和光保护。国际纳米医学杂志,2012;7:5501。
壳聚糖在治疗药物的鼻给药系统。中国机械工程学报,2014;
Obeid MA, Al Qaraghuli MM, Alsaadi M, Alzahrani AR, Niwasabutra K, Ferro VA.提供天然产品和生物疗法以提高药物疗效。Ther Deliv. 2017; 8:947-56。
Miele E, Spinelli GP, Miele E, Di Fabrizio E, Ferretti E, Tomao S, Gulino A.基于纳米颗粒的小干扰RNA递送:癌症治疗的挑战。国际纳米医学杂志,2012;7:3637。
麦克纳马拉K, Tofail SA。纳米系统:纳米合金、金属、双金属和磁性纳米颗粒在生物医学应用中的应用。物理化学化学物理。2015;17:27981-95。
Saadeh Y, Vyas D.纳米机器人在医学中的应用:目前的建议和设计。机械工程学报。2014;1:4-11。
Oliveira ON Jr, Iost RM, Siqueira Jr Jr, Crespilho FN, Caseli L.用于诊断的纳米材料:基于分子识别的智能设备中的挑战和应用。计算机科学技术。2014;6:14745-66。
De Jong WH, Borm PJ。药物递送和纳米颗粒:应用和危害。国际纳米医学杂志。2008;3:33。
李国强,李国强。纳米材料在生物传感中的应用研究进展。前沿化学,2014;2:63。
Golovin YI, Gribanovsky SL, Golovin DY, Klyachko NL, Majouga AG, Master AM, Sokolsky M, Kabanov AV.走向未来的纳米药物:通过交变磁场远程磁机械驱动纳米药物。中国农业大学学报(自然科学版),2015;
陆华,王娟,王涛,钟娟,鲍勇,郝慧。纳米结构在药物传递中的应用研究进展。J Nanomater. 2016;2016:20。
沈海燕,李志强,李志强,等。纳米颗粒设计在药物输送中的应用。生物工程学报。2015;33:941。
郭文杰,李志强,李志强,等。纳米技术是一种提高天然植物产品治疗价值的工具。医学趋势,2012;7:34-42。
陈峰,蔡伟。治疗用纳米颗粒。核医学杂志2014;55:19 - 22。
韩海红,李世峰,李世峰。基于多糖的纳米粒子在治疗性纳米医学中的应用。Adv Drug Deliv rev 2016; 99:70-84。
陈凯,陈霞。分子成像探针的设计与开发。中华医学杂志,2010;10:1227-36。
孙珊,李志刚,孙志刚,王志刚,王志刚。壳聚糖纳米颗粒的制备及应用。J Control Release, 2014; 193:202-13。
李春梅,张丹,金俊,郑世杰,金宜敏,郑敏华,金世华,金德伟,林圣,孙敏华,等。基于双探针的油基壳聚糖纳米颗粒用于体内光学/磁共振成像。生物偶联化学,2011;22:186-92。
杨淑娟,林富华,蔡慧敏,林长芳,陈慧珍,黄建民,谢明杰。海藻酸-叶酸修饰壳聚糖纳米颗粒光动力检测肠道肿瘤。生物材料。2011;32:2174 - 82。
柳俊华,罗俊华,高鸿华,尤德昌,朴寿,俊娥,廉海杰,徐德华,朴俊华,郑世永。用可激活的荧光纳米探针在各种转移模型中组织蛋白酶B的无创光学成像。生物材料。2014;35:2302-11。
Lapčík L, Lapcik L, De Smedt S, Demeester J, Chabrecek P.透明质酸:制备,结构,性能和应用。化学修订版1998;98:2663-84。
金浩,金毅,金毅,崔艳。ros反应激活光敏剂在活化巨噬细胞成像和光动力治疗中的应用。开展。2014;4:1。
崔健,郑浩,闵赫,尹海,金凯,朴志华,权智,郑世永。自组装透明质酸纳米粒子用于靶向肿瘤。生物材料。2010;31:106-14。
Kamat M, El-Boubbou K, Zhu DC, Lansdell T, Lu X, Li W,黄霞。透明质酸固定化磁性纳米颗粒在巨噬细胞活性靶向和成像中的应用。生物缀合化学。2010;21:2128-35。
Arpicco S, Lerda C, Dalla Pozza E, Costanzo C, Tsapis N, Stella B, Donadelli M, Dando I, Fattal E, Cattel L.透明质酸包被脂质体用于吉西他宾的活性靶向。中国生物医学杂志,2013;
王刚,高升,田瑞,Miller-Kleinhenz J,秦忠,刘涛,李玲,张峰,马强,朱磊。透明质酸-铁胶束纳米粒子在磁场增强的体内癌症化疗中的应用。ChemMedChem。2018; 13:78 - 86。
崔健,田艳杰,尹海艳,李波,罗俊华,闵赫,金雪雪,明世杰,李松,陈霞。基于聚乙二醇化透明质酸的治疗性纳米粒子在结肠癌诊断、治疗和监测中的应用。生物材料。2012;33:6186 - 93。
王志刚,王志刚。海藻酸盐基质中蛋白质的释放。Adv Drug Deliv rev 1998; 31:267-85。
Lee KY, Mooney DJ。海藻酸盐:性质及生物医学应用。自然科学进展,2012;
bagbani F, Moztarzadeh F, Mohandesi JA, Yazdian F, Mokhtari-Dizaji M.新型海藻酸盐稳定的阿霉素纳米液滴用于乳腺癌的超声治疗。中国生物医学杂志,2016;
Podgórna K, Szczepanowicz K, Piotrowski M, Gajdošová M, Štěpánek F, warszyzynski P.用于治疗的钆藻酸盐纳米凝胶。Coll Surf B. 2017; 153:183-9。
微生物胞外多糖的目前和未来医学应用。前沿微生物,1012;2015:6。
丁铮,刘鹏,胡东,盛志,易红,高刚,吴勇,张鹏,凌松,蔡林。氧化还原反应右旋糖聚糖基治疗性纳米粒子用于近红外/磁共振成像和磁靶向光动力治疗。生物科学学报,2017;5:762-71。
洪世平,姜硕,金德昌,姜斌。顺磁性纳米粒子靶向治疗c6大鼠胶质瘤细胞。J Nanomater, 2016;2016:7617894。https://doi.org/10.1155/2016/7617894.
Mignani S, El Kazzouli S, Bousmina M, Majoral JP。通过使用树突分子给药系统的新兴途径扩展经典给药方式:简要概述。Adv Drug Deliv Rev. 2013; 65:1316-30。
Lounnas V, Ritschel T, Kelder J, McGuire R, Bywater RP, Foloppe N.目前基于结构的合理药物设计的进展标志着药物发现的新思路。中国生物工程学报,2013;5:e201302011。
Mavromoustakos T, Durdagi S, Koukoulitsa C, Simcic M, Papadopoulos M, Hodoscek M, Golic Grdadolnik S.药物合理设计策略。高等医学化学,2011;18:2517-30。
王培平,崔雪峰。纳米药物释放机制的研究。化学修订版2015;115:3388-432。
Prachayasittikul V, worachartchewan A, Shoombuatong W, Songtawee N, Simeon S, Prachayasittikul V, Nantasenamat C.生物活性天然产物的计算机辅助药物设计。中国生物医学工程学报,2015;
陈刚,Roy I,杨超,Prasad PN。纳米化学和纳米医学用于基于纳米粒子的诊断和治疗。化学修订版2016;116:2826-85。
Pelaz B, Alexiou C, Alvarez-Puebla RA, Alves F, Andrews AM, Ashraf S, Balogh LP, Ballerini L, Bestetti A, Brendel C, Bosi S.纳米医学的不同应用。Acs Nano, 2017; 11:2313-81。
Mattos BD, Rojas OJ, Magalhaes WLE。生物二氧化硅纳米颗粒装载印楝树皮提取物作为绿色,缓释生物杀菌剂。J Clean Prod, 2017; 142:4206-13。
Kinnear C, Moore TL, Rodriguez-Lorenzo L, Rothen-Rutishauser B, Petri-Fink A.形式遵循功能:纳米颗粒形状及其对纳米医学的影响。化学修订版2017;117:11476-521。
Sethi M, Sukumar R, Karve S, Werner ME, Wang EC, Moore DT, Kowalczyk SR, Zhang L, Wang AZ.药物释放动力学对纳米颗粒疗效和毒性的影响。纳米级。2014;6:2321-7。
Mattos BD, Tardy BL, Magalhaes WLE, Rojas OJ。农作物和木材保护的可控释放:可持续和安全的纳米结构生物杀灭系统的最新进展。中国农业大学学报,2017;
谢晓明,李志强,李志强。一种新型的脂质植入物药物释放的数学模型。中国农业大学学报(自然科学版),2008;
丁长忠,李志斌。纳米载体系统药物释放机制研究进展。科学技术与工程学报,2017;
李俊华,杨旸。药物纳米载体控制药物释放。化学工程学报,2015;
卡马丽,杨晓明,吴杰。可降解控释聚合物和高分子纳米颗粒:药物释放控制机制。化学修订版2016;116:2602-63。
Torchilin副总裁。多功能的人们。Adv Drug Deliv rev 2012; 64:302-15。
Pelaz B, del Pino P, Maffre P, Hartmann R, Gallego M, Rivera-Fernandez S, de la Fuente JM, Nienhaus GU, Parak WJ。纳米颗粒与聚乙二醇的表面功能化:对蛋白质吸附和细胞摄取的影响。《生物工程学报》2015;9:6996-7008。
Almalik A, Benabdelkamel H, Masood A, Alanazi IO, Alradwan I, Majrashi MA, Alfadda AA, Alghamdi WM, Alrabiah H, Tirelli N, Alhasan AH。透明质酸包被壳聚糖纳米颗粒降低了形成的蛋白冠的免疫原性。科学通报2017;7:10542。
Martens TF, Remaut K, Deschout H, Engbersen JFJ, Hennink WE, van Steenbergen MJ, Demeester J, De Smedt SC, breeckmans K.透明质酸涂层纳米载体促进视网膜基因治疗的玻璃体内药物传递。J Control Release 2015; 202:83-92。
Kolhar P, Anselmo AC, Gupta V, Pant K, Prabhakarpandian B, Ruoslahti E, Mitragotri S.利用形状效应将抗体包裹的纳米颗粒靶向肺和脑内皮。美国国家科学研究院。2013; 110:10753-8。
高文文,张立峰。用细胞膜包裹纳米颗粒用于靶向药物递送。《药物靶标》2015;23:619-26。
Muller J, Bauer KN, Prozeller D, Simon J, Mailander V, Wurm FR, Winzen S, Landfester k。生物材料。2017;115:1-8。
高红,杨铮,张松,曹松,沈松,庞铮,姜旭。配体修饰纳米颗粒增加细胞摄取,改变细胞内吞作用,提高胶质瘤分布和内化。科学通报2013;3:2534。
Jain A, Jain SK。配体附加的bbb靶向纳米载体(LABTNs)。重症药物载体系统。2015;32:149-80。
沈海霞,石世杰,张志荣,龚涛,孙霞。透明质酸包覆固体脂质纳米颗粒增强对黑素瘤干细胞的抗肿瘤活性。开展。2015;5:755 - 71。
高鑫,张娟,徐强,黄忠,王亚友,沈强。透明质酸包被阳离子纳米脂质载体口服硫酸长春新碱。中国医药科学。2017;43:661-7。
王涛,侯建辉,苏超,赵玲,史玉军。透明质酸包被壳聚糖纳米颗粒诱导ros介导的肿瘤细胞凋亡,并通过CD44靶向给药增强抗肿瘤疗效。中国生物工程学报,2017;15:7。
配体靶向给药系统的设计和特性的挑战。中国农业大学学报(自然科学版),2012;
寇玲,孙杰,翟勇,何卓。纳米药物的胞内吞作用和胞内命运:对合理设计的启示。中国医药科学,2013;8:1-10。
李震,张颖,朱东,李松,余旭,赵颖,欧阳霞,谢震,李磊。非内吞摄取途径细胞内靶向传递载体的研究。药物输送。2017; 24:45-55。
王晓明,王晓明,王晓明,等。多糖纳米颗粒的细胞摄取机制研究进展。中国生物医学杂志,2017;21(2):366 - 366。
Anirudhan TS, Nair AS。介孔二氧化硅纳米颗粒控制化疗药物释放的温度和超声敏感把关者。J Mater chemistry, 2018; 6:428-39。
Al-Ahmady Z, Kostarelos K.用于癌症治疗的温度反应囊泡设计的化学成分。化学修订版2016;116:3883-918。
白勇,谢飞,田伟。热响应型两亲性h型聚合物的可控自组装及药物释放调节。高分子学报,2018;36:406-16。
张震,张东,魏林,王旭,徐益良,李宏伟,马明,陈波,肖丽华。温度响应荧光聚合物纳米颗粒(TRFNPs)用于细胞成像和控制药物向活细胞释放。Coll Surf B. 2017; 159:905-12。
郭艳,张颖,马娟,李强,李艳,周旭,赵东,宋辉,陈强,朱霞。多功能热敏磁脂质体释放光/磁热疗触发药物用于癌症精准协同治疗。中国农业科学,2017;
王晓明,王晓明。基于磁性纳米粒子的肿瘤热化疗药物的研究。纳米级。2014;6:11553 - 73。
Mathiyazhakan M, Wiraja C, Xu CJ:基于金纳米颗粒的光响应性脂质体的控制药物输送综述。纳米-微信2018年,10。
徐玲,邱丽珍,盛勇,孙玉玉,邓丽玲,李小强,Bradley M,张荣。可生物降解ph响应型双药控释水凝胶。J Mater chemistry . 2018; 6:10 - 7。
马桂兰,林文峰,袁泽峰,吴军,钱海峰,徐伯林,陈顺丰。研制了离子强度/pH/酶三重反应两性离子混合水凝胶l-谷氨酸和l-赖氨酸多肽,用于特定部位给药。J Mater Chem . 2017; 5:935-43。
Grillo R, Gallo J, Stroppa DG, carbon - argibay E, Lima R, fracto LF, banore - lopez M.亚微米磁性纳米复合材料:磁性纳米颗粒相互作用对SAR和MRI性能优化的影响。计算机科学与技术,2016;
阿隆索J, Khurshid H, Devkota J, Nemati Z, Khadka NK, Srikanth H, Pan JJ, Phan MH.超顺磁纳米颗粒包裹在脂囊泡中用于高级磁热疗和生物检测。应用物理学报。2016;119:083904。
Ulbrich K, Hola K, Subr V, Bakandritsos A, Tucek J, Zboril R.聚合物和磁性纳米颗粒靶向给药:共价和非共价方法,释放控制和临床研究。化学修订版2016;116:5338-431。
陈长武,徐文杰,黄翠青,李玉春,肖建科,黄建基,于海鹏,廖美美,赖培平。Au/Fe包封3.O4纳米颗粒进入聚合物纳米结构,结合近红外触发化学光热疗法,基于细胞内二级蛋白的理解。J Mater Chem . 2017; 5:5774-82。
Portero A, an- lopez C, Criado M, Alonso M.再乙酰化壳聚糖微球用于控制抗微生物药物到胃粘膜的递送。中国生物医学工程学报。2002;
Artursson P, Lindmark T, Davis SS, Illum L.壳聚糖对肠上皮细胞单层通透性的影响(Caco-2)。制药法令1994;11:1358-61。
Fernández-Urrusuno R,卡尔沃P, Remuñán-López C,维拉-贾托JL,阿隆索MJ。壳聚糖纳米颗粒促进胰岛素的鼻吸收。制药决议1999;16:1576-81。
德坎波斯AM, Sánchez A,阿隆索MJ。壳聚糖纳米颗粒:一种改善药物到眼表传递的新载体。环孢素的应用。2001;224:159-68。
Al-Qadi S, Grenha A, Carrión-Recio D, Seijo B, Remuñán-López C.肺蛋白递送微囊化壳聚糖纳米颗粒:胰岛素负载配方的体内评价。中国农业大学学报(自然科学版)。
Silva MM, Calado R, Marto J, Bettencourt A, Almeida AJ, Gonçalves L.壳聚糖纳米颗粒作为眼部给药的黏附给药系统。Mar pharmaceuticals . 2017;15:370。
Pistone S, Goycoolea FM, Young A, Smistad G, Hiorth M.局部给药的多糖纳米颗粒的配方。中国医药科学,2017;96:381-9。
刘硕,杨松,何国平。鼻内给药卡马西平羧甲基壳聚糖纳米颗粒药物输送到大脑。中国医药科学,2018;13:72-81。
陈建平,陈建平。壳聚糖纳米颗粒在结肠肿瘤治疗中的应用。纳米生物技术。2016;44:17 - 26。
海藻酸盐颗粒作为口服给药平台:最先进的技术。ISRN Pharm. 2014;2014:926157。
Patil NH, Devarajan PV。胰岛素负载藻酸纳米颗粒舌下传递。药物交付。2016;23:429-36。
Haque S, Md S, Sahni JK, Ali J, Baboota S.脑靶向鼻内海藻酸钠纳米颗粒治疗抑郁症的开发和评估。精神病学杂志2014;48:1-12。
Román JV, Galán MA, del Valle EMM。海藻酸交联微胶囊的制备和初步评价作为潜在的药物递送系统(DDS)治疗人类肺癌。生物医学物理工程学报2016;2:035015。
郭志强,李志强,李志强,等。壳聚糖纳米颗粒包埋海藻酸盐的研究进展。中国生物医学工程学报。2014;
陈志伟,陈志伟,陈志伟,等。壳聚糖包被海藻酸钠纳米颗粒在达托霉素眼部给药中的应用。中国临床微生物学杂志,2015;34(4):354 - 356。
天然胶及其药用应用。中国科学(d辑),2014;
改良的黄原胶用于口腔分娩——治疗唾液漏的一种有前途的方法。中国生物医学杂志,2017;
黄娟,邓勇,任军,陈刚,王刚,王峰,吴霞。黄原胶和壳聚糖液体再凝胶原位形成局部给药水凝胶。碳水化合物,2018;186:54-63。
孟泽尔C, Jelkmann M, Laffleur F, Bernkop-Schnürch a .鼻腔给药:一种新型黏黏剂和原位凝胶聚合物的设计。Int J Pharm. 2017; 517:196-202。
孙波,张敏,沈娟,何忠,法特希,倪艳。纤维素基材料在药物持续给药系统中的应用。高级医学化学,2017。https://doi.org/10.2174/0929867324666170705143308.
Elseoud WSA, Hassan ML, Sabaa MW, Basha M, Hassan EA, Fadel SM。壳聚糖纳米颗粒/纤维素纳米晶体纳米复合材料作为瑞格列奈控释的载体体系。中国生物医学杂志,2018;
Agarwal T, Narayana SGH, Pal K, Pramanik, Giri S, Banerjee I.海藻酸钙-羧甲基纤维素珠用于结肠靶向药物输送。中国生物医学杂志,2015;
Hansen K, Kim G, Desai KG, Patel H, Olsen KF, Curtis-Fisk J, Tocce E, Jordan S, Schwendeman SP.纤维素聚合物黏黏鼻给药应用的可行性研究。Mol Pharm. 2015; 12:2732-41。
鲍祖托,莫里纳利。脂质体作为纳米医疗设备。中国生物医学工程学报。2015;
Sercombe L, Veerati T, Moheimani F, Wu SY, Sood AK, Hua S.脂质体辅助药物递送的进展与挑战。Front Pharm. 2015;6:286。
Kotla NG, Chandrasekar B, Rooney P, Sivaraman G, Larrañaga A, Krishna KV, Pandit A, Rochev Y.仿生脂基纳米系统用于增强药物和生物活性制剂的真皮递送。中国生物工程学报,2017;
Akbarzadeh A, Rezaei-Sadabady R, Davaran S, Joo SW, Zarghami N, Hanifehpour Y, Samiei M, Kouhi M, Nejati-Koshki K.脂质体:分类,制备和应用。纳米尺度研究,2013;8:102。
Mohan A, Narayanan S, Sethuraman S, Krishnan UM。新型白藜芦醇和5-氟尿嘧啶聚乙二醇化纳米脂质体共包封提高联合化疗治疗头颈部鳞状细胞癌的疗效。生物医学研究。2014; 2014:424239。
Dimov N, Kastner E, Hussain M, Perrie Y, Szita N.基于模块的微连续流系统的药物输送定制脂质体的形成和纯化。科学代表2017;7:12045。
Zylberberg C, Matosevic S.药物脂质体给药:新的给药系统的回顾和监管格局的观察。药物交付。2016;23:3319-29。
Sapsford KE, Algar WR, Berti L, Gemmill KB, Casey BJ, Oh E, Stewart MH, Medintz IL.纳米技术与生物分子功能化:开发促进纳米技术的化学。化学Rev. 2013; 113:1904-2074。
张磊,顾峰,陈娟,王安,王志刚,王志刚,王志刚。纳米颗粒在医学中的应用。临床药物学杂志2008;83:761-9。
宫田,李志强,张志强,等。纳米级给药聚合物胶束的研究进展。高分子学报。2011;71:227-34。
徐伟,凌萍,张涛。聚合物胶束是提高低水溶性药物生物利用度的一种有前景的药物输送系统。《药物交付》2013;2013:340315。
Kulthe SS, Choudhari YM, Inamdar NN, Mourya V.聚合胶束:药物传递的权威方面。高分子学报。2012;15:465-521。
Devarajan PV, Jain S.靶向给药:概念和设计。柏林:施普林格;2016.
Mourya V, Inamdar N, Nawale R, Kulthe S.聚合胶束:一般考虑因素及其应用。Ind J Pharm Educ Res. 2011; 45:128-38。
Wakaskar RR。用于药物输送的聚合胶束。国际药物开发法令2017;9:1-2。
Mandal A, Bisht R, Rupenthal ID, Mitra AK。用于眼部药物输送的聚合胶束:从结构框架到最近的临床前研究。J Control Release, 2017; 248:96-116。
李强、黎健林、陈舜臣、梁少生、李海燕、方勇、杜家强、蔡志军、高启勇、李大伟。达沙替尼胶束给药抑制视网膜色素上皮的病理细胞过程。Coll Surf . 2016; 140:278-86。
透明质酸偶联聚酰胺胺树状大分子靶向传递3,4 -二氟苯姜黄素到过表达CD44的胰腺癌细胞。Coll Surf . 2015; 136:413-23。
朱军,石霞。基于树状聚合物的靶向给药纳米器件。清华大学学报(自然科学版);2013;
Madaan K, Kumar S, Poonia N, Lather V, Pandita D.树状分子在药物传递和靶向中的作用:药物-树状分子相互作用和毒性问题。中国生物医药科学。2014;6:139。
程勇,徐震,马敏,徐涛。树状大分子作为药物载体在不同给药途径中的应用。中国医药科学,2008;97:123-43。
Noriega-Luna B, Godínez LA, Rodríguez FJ, Rodríguez A, Larrea G, Sosa-Ferreyra C, Mercado-Curiel R, Manríquez J, Bustos E.树状大分子在药物递送剂、诊断、治疗和检测中的应用。J Nanomater. 2014;2014:39。
树突分子及其在新型药物传递载体中的应用。中国医药科学,2013;3:142-9。
Kesharwani P, Jain K, Jain NK。树突分子作为药物传递的纳米载体。自然科学进展,2014;29(3):329 - 329。
Jain K, Gupta U, Jain NK。用于治疗癌症的赖氨酸和叶酸的树突化纳米缀合物。中国生物医药杂志。2014;87:500-9。
Kaur A, Jain K, Mehra NK, Jain N.用于靶向给药的表面工程PPI树状大分子的开发和表征。中国生物医学工程学报。2017;
崔世杰,李俊杰,郑杰,蔡建辉。无机纳米颗粒的毒性评价:考虑因素和挑战。Mol Cell Toxicol. 2013; 9:205-10。
孔凤云,张建文,李荣峰,王志祥,王文杰,王伟。金纳米颗粒在药物传递、靶向和成像应用中的独特作用。分子。2017;22:1445。
Prusty K, Swain SK.纳米银修饰的聚丙烯酰胺/右旋糖酐纳米水凝胶杂化复合材料的药物输送应用。科学技术与工程学报,2018;
Marcu A, Pop S, Dumitrache F, Mocanu M, Niculite C, Gherghiceanu M, Lungu C, Fleaca C, Ianchis R, Barbut A.磁性氧化铁纳米颗粒在乳腺癌中的药物传递系统。应用物理学报,2013;
纳米晶体用于提高低水溶性药物的口服生物利用度。中国药学杂志2015;10:13-23。
杜娟,李霞,赵红,周勇,王玲,田松,王艳。自下而上技术制备低水溶性药物纳米悬浮液。国际医药杂志,2015;
倪锐,赵娟,刘强,梁忠,吴门斯特,毛山。壳聚糖可吸入可膨胀微粒子纳米晶体作为干粉用于持续肺部给药。中国医药科学,2017;99:137-46。
麦克纳马拉K, Tofail SA。纳米颗粒在生物医学中的应用。Adv Phys. 2017; 2:54-88。
库德J, Haddad Y, Richtera L, Heger Z, Cernak M, Adam V, Zitka O.磁性纳米颗粒:从设计和合成到现实世界的应用。纳米材料。2017;7:243。
普拉萨德PN。纳米光子学。纽约:威利;2004.
量子点在纳米医学:最近的趋势,进展和未解决的问题。生物化学与生物物理学报,2015;
刘杰,刘sk, Varma VA, Moffitt RA, Caldwell M,刘涛,Young AN, Petros JA, Osunkoya AO, Krogstad T.临床组织标本肿瘤异质性的量子点分子定位。计算机科学与技术。2010;4:457 - 457。
徐刚,曾森,张波,史伟涛,杨克泰,普拉萨德。用于生物光子学和纳米医学的新一代无镉量子点。化学修订版2016;116:12234-327。
Shi Y, Pramanik A, Tchounwou C, Pedraza F, Crouch RA, Chavva SR, Vangara A, Sinha SS, Jones S, Sardar D.用于高效捕获和双光子成像罕见肿瘤细胞的多功能生物相容性氧化石墨烯量子点装饰磁性纳米平台。计算机应用技术。2015;7:10935-43。
韩海山,Niemeyer E,黄毅,Kamoun WS, Martin JD, Bhaumik J,陈勇,Roberge S,崔j, Martin MR.量子点/抗体偶联在小鼠体内细胞成像中的应用。中国科学(自然科学版)2015;
徐超,苏明凯,罗宁AM, Gambhir SS,饶杰。自发光量子点共轭在体内成像中的应用。生物技术学报。2006;24:39。
郑芳芳,张鹏辉,奚艳,陈建军,李丽玲,朱建军。适配体/石墨烯量子点纳米复合材料覆盖荧光介孔二氧化硅纳米颗粒用于细胞内药物传递和实时监测药物释放。《肛肠化学》2015;87:11739-45。
黄春林,黄春春,麦凤东,晏春林,慈淑华,谢海涛,凌玉春,张继勇。顺磁石墨烯量子点作为同时双模生物成像和肿瘤靶向药物输送平台的应用。J Mater Chem . 2015; 3:651-64。
Olerile LD,刘颖,张斌,王涛,穆松,张娟,Selotlegeng L,张楠。近红外介导的量子点和紫杉醇共载纳米结构脂质载体的肿瘤不特异性研究。Coll Surf . 2017; 150:121-30。
蔡霞,罗勇,张伟,杜东,林燕。ph敏感ZnO量子点-阿霉素纳米粒子用于肺癌靶向给药。ACS应用板机接口。2016;8:22442-50。
王志刚,王志刚,王志刚,王志刚。天然和人工合成的生物相容性和生物降解聚合物。见:Shimpi NG (ed)生物降解和生物相容性聚合物复合材料:加工,性能和应用。复合材料科学与工程出版系列。达克斯福德:Woodhead Publishing;2017.3-32页。
Bassas-Galia M, Follonier S, Pusnik M, Zinn M.天然聚合物:灵感来源。适用于生物医学应用的生物可吸收聚合物。纽约:爱思唯尔;2017.31 - 64页。
王琳,陈玉春,王丽娟,王丽娟。蛋白质纳米颗粒在肿瘤治疗中的应用。BioMed Res Int 2014;2014:180549。
刘震,焦勇,王勇,周超,张震。多糖纳米颗粒给药体系的研究。Adv Drug Deliv Rev. 2008; 60:1650-62。
普尔-沃伦L,巴顿A.介绍生物医学聚合物和生物相容性。在:生物合成聚合物的医疗应用。纽约:爱思唯尔;2016.3-31页。
生物医学应用的生物可吸收聚合物介绍。在:生物合成聚合物的医疗应用。纽约:爱思唯尔;2016.3-29页。
卡多索MJ,科斯塔RR,马诺JF。海洋源多糖在给药系统中的应用。2016;14:34。
于震,于敏,张震,洪刚,熊强。牛血清白蛋白纳米颗粒作为内耳局部药物控释载体的研究。纳米尺度测量,2014;9:343。
罗宾逊M,张旭。世界医药形势。传统医药:全球形势、问题和挑战。日内瓦:世界卫生组织;2011.1 - 12页。
Atanasov AG, Waltenberger B, Pferschy-Wenzig E-M, Linder T, Wawrosch C, Uhrin P, Temml V, Wang L, Schwaiger S, Heiss EH。植物源性药理活性天然产物的发现与再供应综述。生物技术,2015;33:1582-614。
David B, Wolfender J-L, Dias DA。制药工业和天然产品:历史现状和新趋势。植物化学,2015;14:299-315。
Namdari M, Eatemadi A, Soleimaninejad M, Hammed AT。综述纳米颗粒包封中药在感染性心内膜炎治疗中的应用。Biomed Pharm, 2017; 87:321-31。
21世纪的民族药理学——巨大挑战。Front Pharm, 2010;1:8。
潘丽丽,蔡海峰,王志刚,王志刚。植物铅化合物的研究进展。中国科学院学报(自然科学版),2011;
袁浩,马强,叶玲,朴刚。从天然产物看传统药物与现代药物。分子。2016;21:559。
张志强,李志强,李志强。迈向绿色环境:绿色纳米颗粒的合成与应用。中国农业科学,2016;53:59-79。
Duncan R, Gaspar R.显微镜下的纳米医学。Mol Pharm, 2011; 8:2101-41。
刘志强,李志强,李志强,等。天然药物在人类疾病治疗中的应用。2014:573452。
郭伟。纳米颗粒在生物医学应用中的绿色技术。入:Rai M, Posten C,编辑。纳米颗粒的绿色生物合成:机理与应用。Wallington: CABI;2013.
Wicki A, Witzigmann D, Balasubramanian V, Huwyler J.纳米医学在癌症治疗中的挑战,机遇和临床应用。中国科学(d辑),2015;
纳米颗粒在癌症治疗和诊断中的应用。Adv Drug Deliv rev 2002; 54:631-51。
杨晓明,王晓明。纳米颗粒在纳米医学中的应用。中国生物医学工程学报。2014;
张志刚,张志刚,张志刚。纳米药物在冠状动脉疾病中的应用。《印度心脏》杂志2017;69:244-51。
Grazu V, Moros M, Sánchez-Espinel C.纳米载体作为纳米药物:设计概念和最新进展。正确的观点:纳米科学前沿。第4卷,纽约:爱思唯尔;2012.p . 337 - 440。
Rizzo LY, Theek B, Storm G, Kiessling F, Lammers T.纳米医学的最新进展:治疗,诊断和治疗应用。生物工程学报。2013;24:1159-66。
诊断和治疗纳米材料。在:治疗和诊断纳米材料。纽约:施普林格;2017.1-13页。
有传言CL。纳米医学进展:已批准和研究中的纳米药物。Pharm Ther. 2017;42:742。
Havel H, Finch G, Strode P, Wolfgang M, Zale S, Bobe I, Youssoufian H, Peterson M, Liu M.纳米药物:从长凳到床边和超越。Aaps j . 2016; 18:1373-8。
库马尔,陈F, Mozhi,张X, Y,雪X, Y郝,张X,王PC,梁X-J。基于纳米级给药配方独特特性的创新药物开发。纳米级。2013;5:8307-25。
Boroumand Moghaddam A, Namvar F, Moniri M, Md Tahir P, Azizi S, Mohamad R.真菌和酵母生物合成纳米颗粒:制备、性质和医学应用综述。分子。2015;20:16540 - 65。
Metz KM, Sanders SE, Pender JP, Dix MR, Hinds DT, Quinn SJ, Ward AD, Duffy P, Cullen RJ, Colavita PE。通过天然提取物绿色合成金属纳米颗粒:生物纳米颗粒日冕及其对反应活性的影响。中国机械工程学报,2015;3(2):344 - 344。
Paul D, Sinha SN。铜绿假单胞菌KUPSB12胞外合成纳米银及其抑菌活性。jjb。2014; 7:245-50。
郭晓燕,王晓燕,王晓燕,王晓燕,等大肠杆菌用于合成银纳米颗粒的细菌:粒子的表征和抗菌活性的研究。中国生物医学杂志,2015;5:65-70。
细菌在纳米粒子合成中的应用现状与展望。国际学校公告。2014;2014:359316。
米塔尔AK,克里斯蒂Y,班纳吉UC。利用植物提取物合成金属纳米颗粒。生物技术,2013;31:346-56。
Khan HA, Sakharkar MK, Nayak A, Kishore U, Khan A. 14-纳米颗粒用于生物医学应用:概述。入:纳拉扬R,编辑。随着纳米。剑桥:Woodhead Publishing;2018.p . 357 - 84。
阿拉瓦穆丹A,拉莫斯DM,纳达AA,昆巴尔SG。天然聚合物:生物医学应用的多糖及其衍生物。在:天然和合成的生物医学聚合物。纽约:爱思唯尔;2014.p . 67 - 89。
Franci G, Falanga, Galdiero S, Palomba L, Rai M, Morelli G, Galdiero M.银纳米颗粒作为潜在的抗菌药物。分子。2015;20:8856 - 74。
Pajardi G, Rapisarda V, Somalvico F, Scotti A, Russo GL, Ciancio F, Sgrò A, Nebuloni M, Allevi R, Torre ML.基于同种异体成纤维细胞或角质形成细胞的皮肤替代品用于对常规治疗无效的慢性伤口:一项回顾性观察研究。伤口J. 2016; 13:44-52。
李志强,李志强,李志强,等。真菌合成纳米银的研究进展白色念珠菌其抗菌活性大肠杆菌而且金黄色葡萄球菌.Trop J Pharm Res. 2016; 15:371-5。
阿里M,金B,贝尔菲尔德KD,诺曼D,布伦南M,阿里GS。对疫霉寄生的抑制作用p . capsici由纳米银用水萃取物合成而成艾苦艾.植物病理学。2015;105:1183 - 90。
Malapermal V, Botha I, Krishna SBN, Mbatha JN。增强抗糖尿病和抗菌性能罗勒属basilicum,罗勒属圣所(l)使用银纳米颗粒。中国生物医学杂志,2017;24:1294-305。
Sankar R, Karthik A, Prabu A, Karthik S, Shivashangari KS, Ravikumar V.牛至草介导的纳米银纳米颗粒的生物合成及其抗菌和抗癌活性。Coll Surf . 2013; 108:80-4。
彭志强,吴志强,白克辉。利用玉米水提取物合成的绿色生物合成磁性Fe3O4纳米颗粒的蛋白酶体抑制、抗氧化、协同抗菌和抗氧化活性(玉米l)耳叶。中国生物医学工程学报。2017;
白k - h。生物合成银纳米颗粒对食源性致病菌的抑菌活性、协同抑菌潜力及其抗氧化作用。前沿微生物,2017;8:167。
崔志刚,权毅,白k - h。洋葱皮提取物绿色生物合成纳米金:合成、表征及生物活性。Adv粉体技术。2016;27:2204-13。
白k - h。玉米丝毛水提液生物合成纳米银及其抗菌、抗氧化协同活性和抗氧化潜力的研究。生物工程学报。2016;10:326-33。
白k - h。水果废料生物合成金纳米颗粒蛋白酶体抑制、协同抗菌、协同抗氧化活性的比较研究国际纳米医学杂志。2016;11:46 6。
白k - h。绿色合成氯化银纳米粒子的应用碧桃L.果皮提取物及其抑菌、抗氧化作用的研究。绿色化学快报,2016;9:132-42。
张志强,李志强,李志强。用西瓜皮提取物植物介导生物合成纳米银(Citrullus lanatus),并对其抗菌、抗氧化和抗氧化性能进行了研究。中国生物工程学报(英文版);
Wilczewska AZ, Niemirowicz K, Markiewicz KH, Car H.纳米颗粒作为药物传递系统。Pharmacol rep 2012; 64:1020-37。
朱震,李勇,杨霞,潘伟,潘华。透明质酸修饰的高分子纳米颗粒逆转他莫西芬和多西他赛抗癌药物拮抗作用。Pharmacol res 2017; 126:84-96。
Dias DA, Urban S, Roessner U.天然产物在药物发现中的历史概述。代谢物。2012;2:303-36。
Gupta U, Sharma S, Khan I, Gothwal A, Sharma AK, Singh Y, Chourasia MK, Kumar V.基于壳聚糖的紫杉醇负载生物降解纳米颗粒增强凋亡和抗癌潜力。中国生物医学杂志,2017;
常春华,黄文英,赖春华,徐艳梅,姚艳华,陈天勇,吴建勇,彭世峰,林艳华。新型肝素壳小檗碱纳米粒治疗幽门螺杆菌的研制。生物材料学报。2011;7:593-603。
Aldawsari HM, Hosny KM。含有鞣花酸的万古霉素固体脂质纳米颗粒可作为克服肾毒性副作用的工具:制备、表征和肾毒性评估。中国生物医学工程学报,2018;
滇L, Yu E,陈X, X, Z,秦L,王问,李G,吴c .提高口服生物利用度的槲皮素使用小说soluplus聚合物胶束。纳米尺度测量,2014;9:684。
Spillmann CM, Naciri J, Algar WR, Medintz IL, Delehanty JB。用于细胞内荧光成像和药物传递的多功能液晶纳米颗粒。ACS Nano, 2014; 8:6986-97。
杨晓明,王志强,王志强,等。右旋糖酐的结构分析与性能研究明串珠菌属mesenteroidesNRRL b - 640。碳水化合物,2009;76:30-5。
Agarwal A, Gupta U, Asthana A, Jain NK。右旋糖酐共轭树突纳米结构物作为抗癌药物的潜在载体。生物材料。2009;30:3588 - 96。
Barenholz YC。Doxil®- fda批准的第一种纳米药物:经验教训。中国机械工程学报,2012;
孟俊华,李德华,郑赫,裴永华,朴一生,郑s,全永生,沈昌奎,金伟,金杰。多功能性阿霉素超顺磁氧化铁纳米颗粒在肝癌化疗和磁共振成像中的应用。生物材料。2010;31:4995 - 5006。
Bonechi C, Martini S, Ciani L, Lamponi S, Rebmann H, Rossi C, Ristori S.使用脂质体作为多酚类化合物的载体:以反式白藜芦醇为例。PLoS ONE。2012; 7: e41438。
姜黄素的临床研究进展。Curr Pharm Des 2013; 19:2032-46。
魏X, Senanayake TH, Bohling A, Vinogradov SV。提高姜黄素稳定性和细胞渗透性的靶向纳米凝胶共轭:合成、药代动力学和肿瘤生长抑制。Mol Pharm. 2014; 11:3112-22。
冯涛,魏勇,李仁杰,赵玲。姜黄素脂质体及其在癌症中的应用。中国生物医学工程学报。2017;12:6027。
程超,彭松,李志,邹玲,刘伟,刘晨。ph驱动、无有机溶剂、易于扩展的方法提高了姜黄素脂质体的生物利用度。RSC ad2017; 7:25978-86。
Bilia AR, Guccione C, Isacchi B, Righeschi C, Firenzuoli F, Bergonzi MC.纳米系统中负载的精油:一种成功治疗方法的开发策略。循证补体交替医学2014;2014:651593。
Sainz V, Conniot J, Matos AI, Peres C, Zupanǒiǒ E, Moura L, Silva LC, Florindo HF, Gaspar RS.纳米药物的监管方面。生物化学与生物物理学报,2015;
Hassan S, Prakash G, Ozturk AB, Saghazadeh S, Sohail MF, Seo J, Dokmeci MR, Zhang YS, Khademhosseini A.药物递送纳米材料的进化与临床转化。Nano Today, 2017; 15:91-106。
Agrahari V.促进纳米药物转化为临床产品:挑战和机遇今日药物发现。2018;23(5):974-91。
张涛,张涛,王安。2016年研究性纳米药物:目前正在进行临床试验的纳米疗法综述。威利跨学科Rev. 2016;2017:9。
Wacker MG, Proykova A, Santos GML。全球纳米安全——监管与创新。Int J Pharm. 2016; 509:95-106。
林鹏春,林松,王培平,斯里达尔瑞。纳米材料的物理化学表征技术。生物技术,2014;32:711-26。
格罗斯曼JH,克里斯特RM, Clogston JD。含纳米材料药品的早期开发挑战。中国医学杂志,2017;19:92-102。
Tinkle S, McNeil SE, Mühlebach S, Bawa R, Borchard G, Barenholz YC, Tamarkin L, Desai N.纳米药物:解决科学和监管差距。清华大学学报(自然科学版)2014;13:35 - 56。
Pandit A, Zeugolis DI。25年的纳米生物材料:我们已经彻底改变了医疗保健吗?中华医学杂志,2016;11(9):985-7。
Bobo D, Robinson KJ, Islam J, Thurecht KJ, Corrie SR.基于纳米颗粒的药物:迄今为止fda批准的材料和临床试验的回顾。Pharm Res. 2016; 33:2373-87。
陈志伟,陈志伟,陈志伟。肿瘤纳米药物的研究进展。临床翻译医学。2017;6:44。
纳米颗粒在临床中的应用。生物翻译医学2016;1:10-29。
Grumezescu。纳米尺度的制造,优化,放大和医药纳米技术的生物学方面。纽约:威廉·安德鲁;2017.
张涛,张涛,王安。2016年研究性纳米药物:目前正在进行临床试验的纳米疗法综述。Wiley interdisce Rev. 2017;9:e1416。
药品批准和数据库。https://www.fda.gov/Drugs/InformationOnDrugs/default.htm.2018年8月16日访问。
D 'Mello SR, Cruz CN,陈敏林,Kapoor M, Lee SL, Tyner KM。美国含纳米材料药品的发展前景。纳米技术。2017;12:523。
作者的贡献
JKP, GD, LFF, EVRC, MDPRT, LSAT, LADT, RG, MKS, SS和SH分别写了不同部分的手稿。JKP, LFF, MDPRT, RG, SS, SH和HSS对手稿进行了编辑。所有作者都阅读并批准了最终的手稿。
确认
Jayanta Kumar Patra和Gitishree Das感谢大韩民国东国大学的支持。Leonardo Fernandes fracto和Estefânia V.R. Campos感谢São Paulo State Research Foundation (FAPESP)和National Council for science and technology Development (CNPQ)提供的财政支持。Maria del Pilar Rodriguez-Torres特别感谢安哥拉国立南苏丹大学DGAPA提供博士后奖学金。Maria del Pilar Rodriguez-Torres、Laura Susana Acosta-Torres和Luis Armando Diaz-Torres感谢Red de Farmoquimicos-CONACYT和DGAPA-UNAM PAPIIT-IN225516项目的支持。Renato Grillo感谢São Paulo State Science Foundation (FAPESP, Grants #2015/26189-8)。Han-Seung Shin感谢韩国环境产业技术研究所(A117-00197-0703-0)和韩国农业、食品和农村事务部(MAFRA)(710 003-07-7- sb120,116075 -3)资助的农业生物技术发展计划,食品、农业、林业和渔业技术规划和评估研究所(IPET)。
相互竞争的利益
作者宣称他们之间没有利益冲突。
数据和材料的可用性
不适用。
发表同意书
我们包含了两张图(Figs。3.而且6)和一张桌子(桌子1)以前发表的文献,并获得版权持有人的版权许可。我们在原稿中有适当的引用。
伦理批准并同意参与
不适用。
资金
这项工作得到了韩国环境产业技术研究所(A117-00197-0703-0)和韩国食品、农业、林业和渔业技术规划与评估研究所(IPET)的支持,通过农业、食品和农村事务部(MAFRA)资助的农业生物技术发展计划(710 003-07-7- sb120,116075 -3)。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
作者信息
作者及隶属关系
相应的作者
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
帕特拉,j.k.,达斯,G.,弗莱塞托,L.F.et al。纳米给药系统的最新进展及展望。J Nanobiotechnol16, 71(2018)。https://doi.org/10.1186/s12951-018-0392-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12951-018-0392-8
关键字
- 纳米
- 纳米材料
- 药物输送
- 药物的靶向
- 天然产物