摘要
背景
肿瘤血管拟态是一个新兴的问题,影响患者的生存,而目前没有治疗。尽管有几个因素涉及血管拟态,但很少了解调节肿瘤微环境和形成恶性转化的基质因子。CD248是一种主要在基质细胞中表达的i型跨膜蛋白,介导细胞与细胞外基质蛋白之间的相互作用。CD248蛋白表达与转移性黑色素瘤表型相关,并促进基质细胞肿瘤进展。本研究旨在探索CD248在黑色素瘤血管模拟中的细胞自主作用,以帮助癌症治疗的发展。
方法
采用B16F10黑素瘤细胞功能丧失方法研究CD248对细胞粘附、迁移、增殖和血管拟态的细胞自主作用。采用固相结合法鉴定CD248与纤维连接蛋白之间的相互作用。通过水平和垂直细胞迁移实验来分析细胞迁移活性,并利用Matrigel上的细胞模式网络形成来评估血管模拟活性。生成重组CD248 (rCD248)蛋白,并在体外评估rCD248是否干扰黑色素瘤CD248功能。采用实验性小鼠肺转移模型研究rCD248在体内治疗的效果。
结果
以成纤维细胞为条件的培养基增加了黑素瘤细胞中CD248蛋白的表达。击倒的CD248表达显著降低了黑素瘤细胞对纤维连接蛋白的粘附、细胞迁移和血管拟态。CD248的凝集素结构域直接参与CD248与纤维连接蛋白的相互作用。此外,含有其凝集素结构域的rCD248蛋白抑制了细胞对纤维连接蛋白的粘附,减缓了细胞迁移和血管拟态。用rCD248蛋白治疗可以减轻肺肿瘤负担,同时减少黑色素瘤肺转移小鼠的血管拟态。
结论
CD248在黑素瘤细胞中的表达通过增加细胞粘附、迁移和血管拟态的活性来促进恶性转化,而rCD248蛋白则作为分子诱饵干扰CD248在黑素瘤细胞中的促瘤作用。
背景
肿瘤转移严重影响癌症患者的生存率,是癌症治疗的一大障碍。实体瘤中的血管生成是肿瘤进展的一个公认标志。然而,已有研究表明,针对血管内皮细胞的抗血管生成治疗不能有效抑制癌症进展,并可能导致侵袭性肿瘤表型,这表明肿瘤可能发展出抵抗抗血管生成治疗的机制[1].有人提出,肿瘤可能会采用三种可能的策略来抵抗抗血管生成治疗:上调替代途径(生长因子),内皮细胞独立的肿瘤灌注[血管拟制(VM)或表型切换],劫持预先存在的血管(血管征用或周细胞拟制)[1].值得注意的是,周细胞拟态和VM与患者生存率恶化有关,并可能是抗血管生成治疗耐药的原因[2].因此,了解恶性黑色素瘤转化的分子机制将有助于开发一种新的治疗策略。
侵袭性肿瘤细胞可能具有VM能力来构建独立于内皮细胞的血管样导管,以连接血液循环[3.].这种肿瘤diy通道首次在人葡萄膜黑色素瘤中发现,其组织病理学特征为周期性酸性希夫(PAS)染色阳性和CD31染色阴性的血管样结构,肿瘤组织中包裹有血细胞。4].VM在骨肉瘤、纤维肉瘤、胶质母细胞瘤、乳腺癌、结肠癌、肺癌、胰腺癌、卵巢癌、肝癌等多种肿瘤类型中均有发现,且与患者生存期呈负相关[4,5,6,7].此外,VM是在高侵袭性和转移性黑色素瘤细胞中观察到的一种突出行为,而在低侵袭性黑色素瘤细胞中则没有[8].尽管VM的形成机制尚不完全清楚,但一些重要因素,包括上皮-间充质转化、缺氧、胚胎细胞和干细胞以及血管信号通路,都与癌症中的VM有关[9,10,11,12].因此,VM中的VE-cadherin和基质金属蛋白酶(matrix metalloproteinases, MMPs)等分子标记已被鉴定[13].此外,肿瘤微环境创造了一个生态位,极大地影响肿瘤的可塑性和与癌症功能异质性相关的过渡状态[14].特别是,最近的一项研究表明,成纤维细胞可诱导肺癌的VM [15],提示基质因子在癌症的恶性转化中起着至关重要的作用。因此,癌细胞可以通过其他途径获得细胞可塑性,转化为内皮样或血管样细胞类型,以获得足够的营养供应,并延伸到另一层次的恶性肿瘤。
CD248是糖基化跨膜蛋白c型凝集素结构域组XIV家族的成员,包括6个功能域:n端凝集素结构域(D1)、一个Sushi结构域(D2)、3个串联重复表皮生长因子(EGF)样结构域(D3)、一个黏蛋白样结构域(D4)和一个跨膜结构域(D5),其后面是一个细胞质尾(D6)。CD248通过与各种细胞外基质(ECM)分子结合,被发现参与细胞粘附和细胞迁移[16].CD248是一种癌胎蛋白样分子,在许多病理情况下,包括组织纤维化和癌症,其水平上调[17],在胚胎发生过程中广泛表达。然而,其表达在小鼠出生后迅速下调,在成人组织中显著下调,除了肾脏[18].基质CD248促进肿瘤生长和转移,部分是通过增加肿瘤细胞外渗和肿瘤环境的构建[19,20.].在骨肉瘤和肾细胞癌等多种肿瘤中发现CD248表达水平升高[21,22].在85%的转移性黑色素瘤肿瘤微环境脉管中检测到CD248的表达;然而,在正常组织样本中未检测到CD248的表达,这表明CD248可能有助于黑色素瘤的进展[23].
在本研究中,我们探讨了基质因子是否有助于黑色素瘤的恶性转化。我们证明了CD248在与肿瘤转移行为相关的侵袭性表型黑素瘤细胞中表达的细胞自主效应的机制。使用还原方法评估CD248在黑色素瘤细胞粘附、增殖、迁移和VM中的作用。
材料与方法
细胞培养
B16F10细胞、HEK293细胞和NIH3T3细胞从ATCC购买,并在含有25 mM葡萄糖和10%胎牛血清(FBS)的Dulbecco 's Modified Eagle 's Medium (DMEM)中维持。用无血清DMEM培养NIH3T3细胞24 h,制备NIH3T3细胞条件培养基(CM)。CM离心后-80℃保存,用于后续实验,包括趋化迁移实验和VM实验。CD248 siRNA (siCd248)和siRNA对照(siCtrl)购自GE Dharmacon (siGENOME)。蛋白表达水平用蛋白印迹法分析,采用CD248 (18160-1-AP, Proteintech)、MMP9 (10375-2-AP, Proteintech)特异性抗体,GAPDH (sc-32,233, Santa Cruz)、肌动蛋白-β (HRP-60,008, Proteintech)或微管蛋白-α (HRP-66,031, Proteintech)作为内部对照。
重组CD248 (rCD248)蛋白的制备
利用人CD248 cDNA构建rCD248蛋白表达质粒。利用pSecTag 2-A表达系统在HEK293细胞中表达CD248的重组凝集素结构域(rCD248D1)和CD248的重组胞外区(rCD248D1- d4)。利用pPICZα-A表达系统表达CD248的重组EGF结构域(rCD248D3)毕赤酵母属pastoris.所有这些rCD248蛋白在其c端包含一个c- myc标签和一个his标签,用于检测和纯化。用Q-纯化可溶性rCD248蛋白琼脂糖和nickel-chelating琼脂糖色谱法。
细胞迁移试验
采用趋化(垂直)迁移试验和伤口恢复(水平)迁移试验检测细胞迁移活性。趋化迁移实验如前所述进行[24]使用博伊登腔通过膜与一个8微米孔和CM作为趋化剂。迁移细胞用刘氏染色法染色,迁移3 h后计数。伤口恢复迁移实验是使用培养插入物(ibidi)在含有%胎牛血清的培养基中融合生长细胞。伤口恢复率的测量方法如前所述[25].为了在CD248缺失的HEK293细胞中表达外源性CD248,将GFP或GFP标记的人CD248 (CD248-GFP)表达质粒转染HEK293细胞。在HEK293细胞的Boyden腔迁移实验中,膜被纤维连接蛋白包被,并使用含有5% FBS的培养基作为趋化剂。在rCD248D1-4存在或不存在的情况下,HEK293细胞迁移4小时。为了研究rCD248蛋白与纤维连接蛋白相互作用对趋化迁移的抑制作用,可溶性纤维连接蛋白与rCD248D1-4蛋白预孵育。
细胞增殖试验
MTT法检测细胞增殖情况。MTT处理后测量550nm处的吸光度(Sigma)。
细胞粘附试验
细胞粘附实验如前所述进行,并作了一些修改[26].简而言之,黑色素瘤细胞被允许粘附在纤维连接蛋白或bsa涂层的板上,并孵育30分钟。在适当的清洗程序后,用结晶紫对贴壁细胞进行染色,并在570 nm处测量吸光度。用western blot法分别检测tyr576磷酸化的FAK (sc- 16563, Santa Cruz)、FAK (sc-558, Santa Cruz)和GAPDH的特异性抗体,分析灶性粘附激酶(FAK)磷酸化水平。
固相结合试验
固相结合试验用于评估CD248和纤维连接蛋白之间的相互作用,如前所述,经过大量修饰[26].简单地说,将rCD248蛋白加入到纤维连接蛋白包被板或bsa包被板中,适当洗涤后使用抗c- myc抗体检测rCD248蛋白。测量了450 nm处的吸光度。
虚拟机分析图案化网络形成的矩阵
黑色素瘤细胞在含有Matrigel的µ-slide (ibidi)中播种。为了研究rCD248蛋白是否通过与纤维连接蛋白相互作用抑制VM,将可溶性纤维连接蛋白与rCD248D1-4蛋白预孵育。在指定的时间段后,对整个井进行了拍照,并测量了管子的总长度。
免疫组织化学
免疫组化的一般程序如前所述,经过大量修改[25].用特异性抗体检测肺组织切片CD248 (18160-1-AP, Proteintech)、MMP9 (10375-2-AP, Proteintech)、CD31 (ab28364, Abcam)的表达,苏木精反染。为了检测组织切片中的VM,用PAS染色试剂盒(PSH-010, Baso)进行PAS染色。
实验性肺转移小鼠模型
实验小鼠饲养在国立成功大学实验动物中心特定的无病原体动物设施中。动物研究遵循国立成功大学动物护理和使用委员会批准的实验规程(110085)进行,所有程序均符合NIH《实验动物护理和使用指南》。实验转移小鼠模型与之前一样进行,但进行了大量修改[27].简言之,8周龄雄性C57BL/6小鼠静脉注射rCD248D1-4(20µg)或PBS 1小时后静脉注射2 × 105B16F10细胞。另一天,小鼠腹腔注射rCD248D1-D4(20µg)或PBS,每天1次,连续2天。接种肿瘤14天后处死小鼠。测定肺表面肿瘤结节。
统计分析
数据表示为平均值加上平均值的标准误差。使用Graphpad Prism进行统计分析。分析数据的正态性和方差相等。使用Student 's进行统计分析t-检验(未配对和2尾)或单向方差分析,然后在比较两个以上组时进行Tukey的多重比较检验。P< 0.05为有统计学意义。
结果
黑色素瘤CD248促进细胞黏附到纤维连接蛋白上并迁移
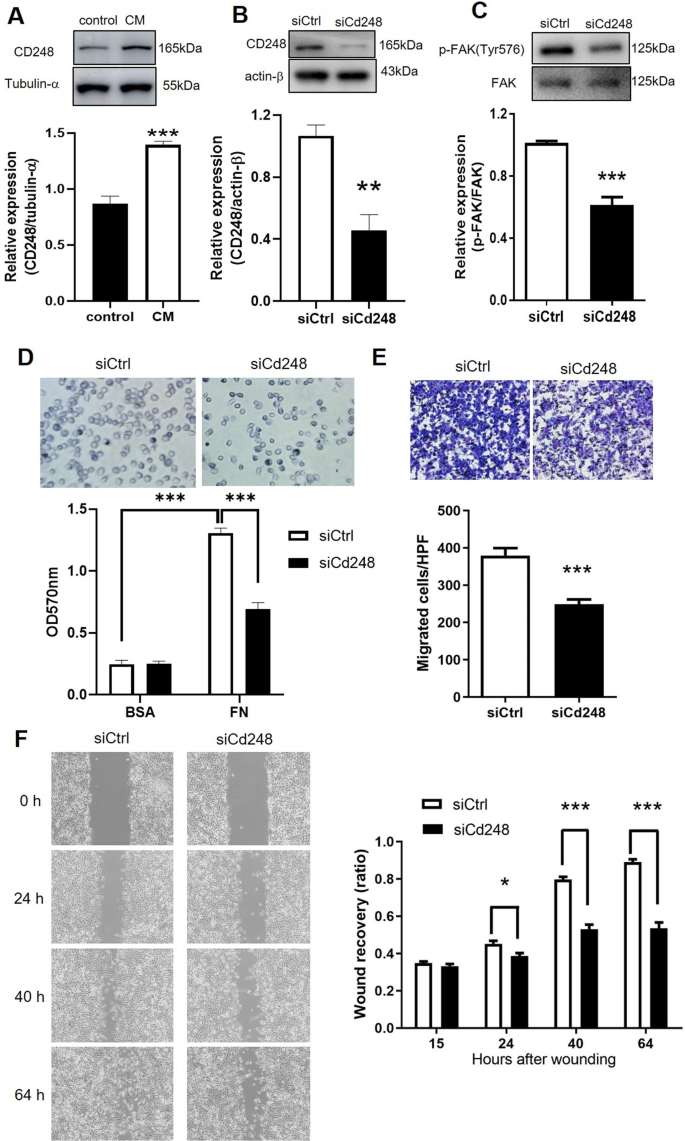
纤维连接蛋白促进黑色素瘤增殖和转移[28].CD248被认为在外源性细胞模型中介导细胞-纤维连接蛋白相互作用和迁移[16],但原生CD248在黑色素瘤细胞粘附和迁移中的作用仍有待进一步研究。我们发现CD248在B16F10细胞中表达,B16F10细胞在成纤维细胞产生的条件培养基中表达上调(图2)。1A).击倒CD248在黑素瘤细胞中使用特定siRNA显著降低CD248蛋白表达(图。1B).黑素瘤细胞在30分钟内粘附在纤维连接蛋白包裹的表面,但当siRNA抑制黑素瘤CD248的表达时,粘附和FAK的激活显著降低(图。1我们利用两种不同的迁移模型研究了CD248是否影响黑色素瘤细胞的迁移。趋化细胞迁移实验显示,3小时后观察到细胞向CM迁移。1E);然而,在sicd248转染的细胞中减弱(图2)。1E)。在水平迁移实验中,sicntl转染细胞的非细胞空间几乎完全被重新定位的细胞所覆盖,而cd248敲除细胞则没有(图2)。1F)。计算迁移前后的脱细胞面积显示,黑素瘤细胞中CD248表达的降低会延缓伤口的恢复(图。1F)。因此,CD248抑制黑色素瘤细胞的垂直趋化性(图;1E)或细胞水平迁移(图;1F).综上所述,这些结果表明黑素瘤CD248在细胞-纤维连接蛋白相互作用和迁移中起着至关重要的作用。
黑色素瘤CD248促进细胞粘附和迁移。小鼠黑素瘤细胞(B16F10细胞)转染siRNA对抗小鼠Cd248 (siCd248)或打乱对照siRNA (siCtrl)进行细胞粘附和迁移实验。一个Western blot检测经成纤维细胞条件培养基(CM)处理1 d B16F10细胞中CD248的表达并进行统计学分析。n = 5。***P< 0.001。BWestern blot检测siCtrl和siCd248转染B16F10细胞中CD248的表达。n = 5。***P< 0.001。细胞受到C,D细胞粘附试验,E趋化迁移实验和F伤口恢复试验。CWestern blot分析FAK活化(FAK Tyr576磷酸化,p-FAK(Tyr576)在细胞粘附实验后。n = 5。***P< 0.001。D纤维连接蛋白(FN)包被多孔板粘附30 min后细胞代表性图像及统计分析。用结晶紫染色后测定粘附细胞数量,然后用OD570nm测定细胞粘附水平。n = 5。***P< 0.001。E趋化迁移后3小时迁移细胞的典型图像,然后进行刘氏染色。CM诱导趋化。趋化性试验的统计分析。n = 5。* * *,P< 0.001。F创面恢复的代表性图像分析及统计分析。n = 8。*P< 0.05;***P< 0.001
黑色素瘤CD248促进VM,但不影响细胞生长
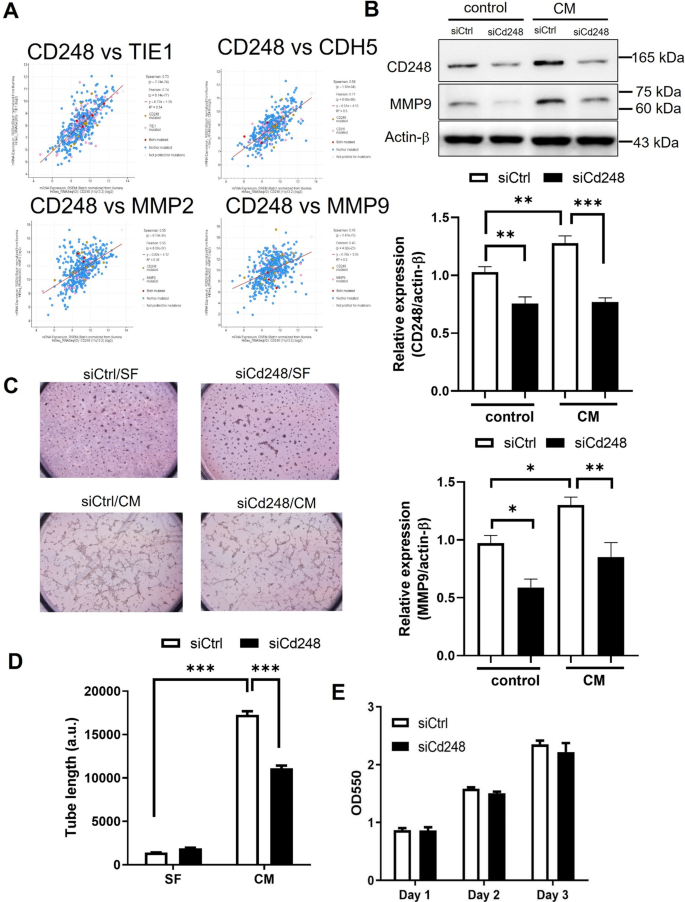
侵袭性黑素瘤表型有助于VM进展,并伴有VE-cadherin和MMP2/9等分子标记的表达[8,13].在70%血管样黑色素瘤标本中观察到CD248蛋白表达[23].因此,我们研究了CD248是否参与了黑色素瘤VM。利用cBioPortal数据库分析黑素瘤组织中CD248与VM分子标志物的表达相关性(https://www.cbioportal.org/),一些强相关性,如TIE−1 (Spearman相关ρ = 0.73, p = 2.24e−74;Pearson相关ρ = 0.74, p = 6.14e−77),CDH5 (Spearman相关ρ = 0.69, p = 1.92e−64;Pearson相关ρ = 0.71, p = 6.65e−68),MMP2 (Spearman相关ρ = 0.55, p = 9.13e−36;Pearson相关性ρ = 0.55, p = 8.07e−37)和MMP9 (Spearman相关性ρ = 0.45, p = 2.47e−23;Pearson相关ρ = 0.45, p = 4.92e−23)被确定(图。2A).因此,我们分析了B16F10细胞中MMP9的表达。结果表明,CM可提高MMP9蛋白水平,而siRNA抑制CD248表达可降低MMP9蛋白水平(图2)。2B)。此外,黑色素瘤细胞对CM的反应在Matrigel上形成了一个模式化的网络连接(图。2C),提示成纤维细胞CM可诱导黑色素瘤VM活性。CD248敲除显著减少了Matrigel中虚拟机的形成(图。2D). CD248与成纤维细胞增殖有关[25].因此,我们推测CD248的表达是否与黑色素瘤细胞的生长有关。用含有siCd248的黑素瘤细胞进行MTT试验,结果表明黑素瘤CD248表达水平可能不影响细胞增殖(图2)。2E).这些观察结果,连同其他研究[16],提示CD248可能与ECM蛋白相互作用,从而促进细胞迁移和VM。
黑色素瘤CD248促进血管拟态,但不影响细胞生长。一个利用cBioPortal数据库分析人类黑素瘤组织中CD248与VM分子标志物mRNA表达的相关性。用siCtrl或siCd248转染B16F10细胞BWestern blot检测,C,DVM分析(在Matrigel上形成网络)和E细胞增殖试验(MTT法)。BWestern blot检测成纤维细胞培养条件培养基(CM)与非细胞培养培养基(SF)处理1 d细胞CD248和MMP9的相对表达。n = 6。*P< 0.05;**P< 0.01;***P< 0.001。C以SF为对照的CM诱导的VM实验的代表图像。D在Matrigel上播种6小时后测量的网络总长度的统计分析。n = 5。***P< 0.001。EMTT试验。将含有siCd248或siCtrl的B16F10细胞培养1 - 3天,然后在指定时间点进行MTT检测。n = 4
CD248的凝集素结构域与纤维连接蛋白n端70 kDa片段结合
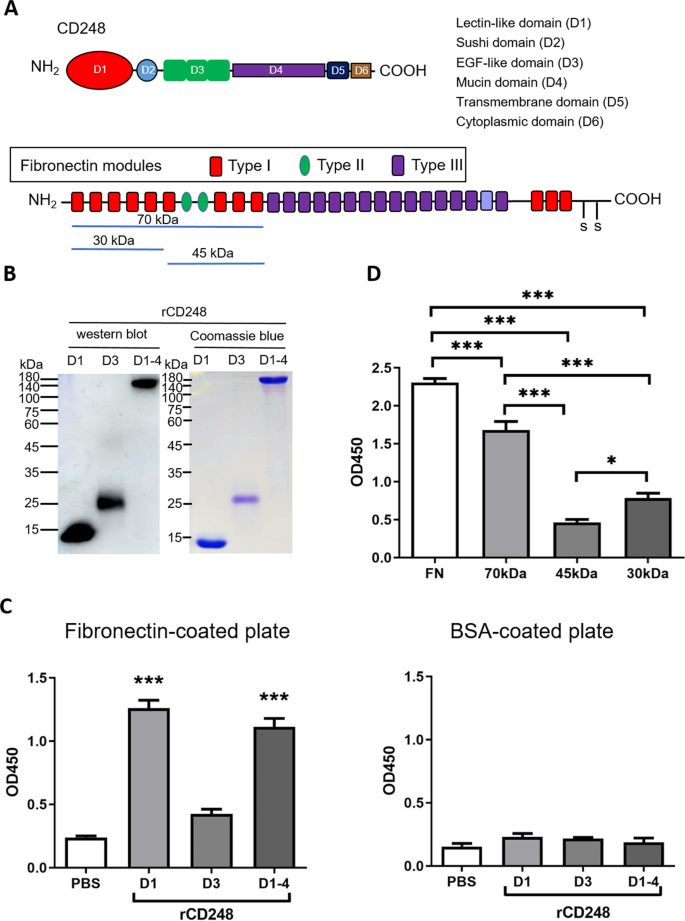
CD248已被证明与纤维连接蛋白相互作用。然而,CD248与纤维连接蛋白结合的机制尚不清楚。因此制备了rCD248蛋白(图;3.rCD248D1(凝集素结构域)和rCD248D1-4,而rCD248D3 (egf样结构域)可以与纤维连接蛋白结合(图2)。3.此外,n端70 kDa纤维连接蛋白足以与rCD248D1-4结合(图2)。3.D)。这些结果表明CD248的凝集素结构域与纤维连接蛋白n端70 kDa片段的结合可以介导黑素瘤细胞-纤维连接蛋白的相互作用。
CD248的凝集素结构域和纤维连接蛋白n端70-kDa片段介导CD248-纤维连接蛋白相互作用。一个本研究中使用的CD248蛋白结构和纤维连接蛋白片段示意图。B蛋白染色(考马斯蓝染色)和蛋白印迹分析rCD248蛋白,包括rCD248D1(蛋白染色6µg, Western blot 25 ng), rCD248D3(蛋白染色6µg, Western blot 140 ng), rCD248D1-4(蛋白染色4.8µg, Western blot 40 ng)。C,D固相结合试验。C将各种rCD248蛋白(0.1µM)应用于纤维连接蛋白(10µg/mL)或BSA(作为对照)包被的多孔板上进行相互作用。rCD248蛋白上的c-myc标记抗体检测相互作用水平。n = 3。***P< 0.001。D将各种纤维连接蛋白,包括完整的纤维连接蛋白(10µg/mL)和等摩尔量的各种重组片段(70 kDa、45 kDa和30 kDa)包覆在多孔板上。rCD248D1-4(0.1µM)应用于孔中,并用抗c-myc抗体检测相互作用。n = 4。*P< 0.05;***P< 0.001
rCD248蛋白干扰黑色素瘤细胞粘附、迁移和VM
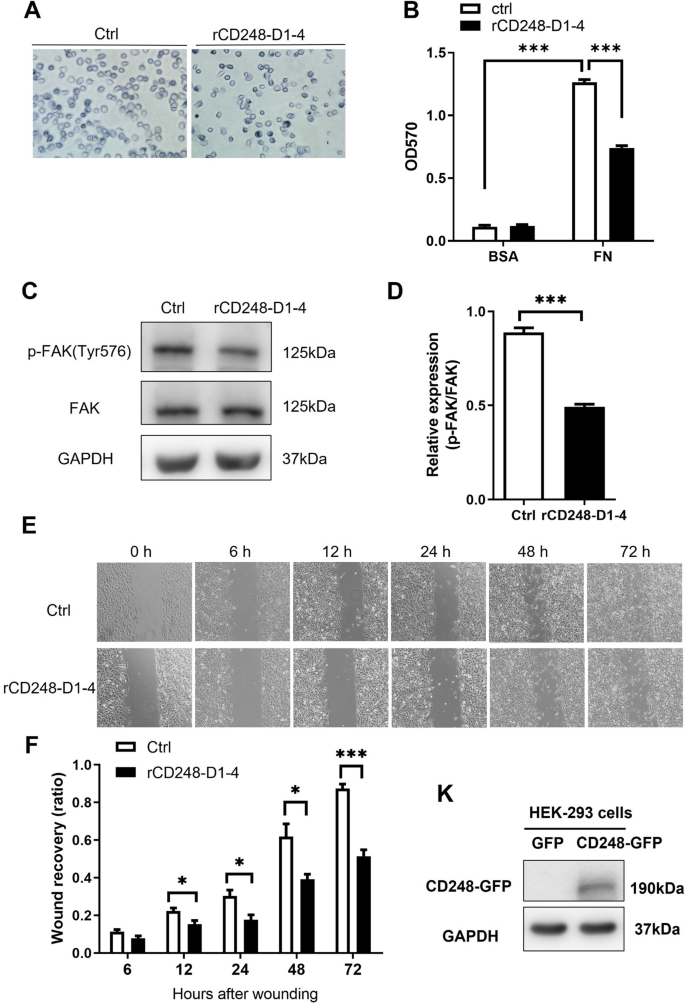
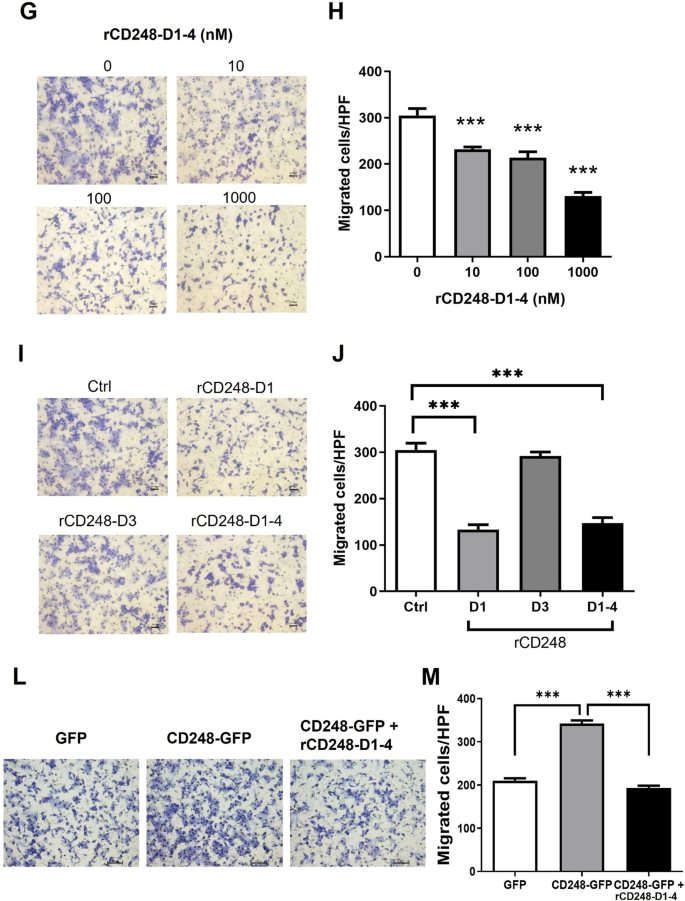
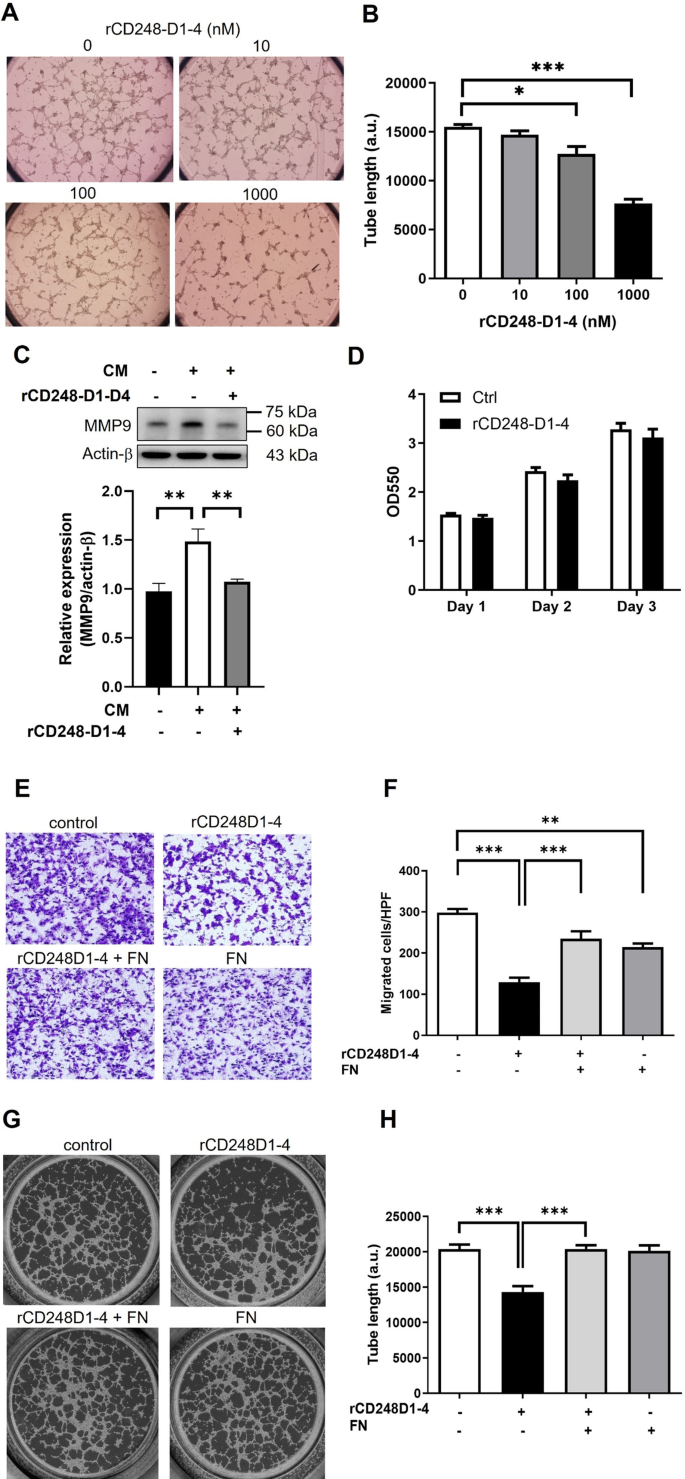
我们的研究结果表明,黑素瘤细胞中CD248的天然表达促进细胞粘附、迁移和VM。此外,CD248的凝集素结构域介导其与纤维连接蛋白的相互作用。因此,我们假设外源性rCD248蛋白可以作为分子诱饵干扰细胞功能。细胞粘附实验显示,纤维连接蛋白涂层促进细胞粘附,rCD248D1-4强烈抑制细胞粘附(图2)。4A, B),提示rCD248可能与黑素瘤CD248竞争纤维连接蛋白结合,阻碍细胞粘附。磷酸化FAK水平的降低支持了这一推测(图。4C, D)通过rCD248D1-4作用于细胞粘附。动态细胞粘附是细胞迁移的关键。因此,我们进一步研究了rCD248D1-4是否影响细胞迁移。两种水平细胞迁移(图;4E, F)和垂直趋化迁移(图。4G, H)被rCD248D1-4处理抑制。有趣的是,rCD248D1而不是rCD248D3表现出对趋化迁移的抑制作用。4I, J),表明CD248的凝集素结构域介导细胞迁移。我们利用外源性CD248在HEK293细胞中的表达进一步研究了rCD248是否作为分子诱饵。Western blot分析显示,gfp标记的CD248在CD248缺失的HEK293细胞中成功表达(图2)。4与表达gfp的细胞相比,外源性CD248表达促进HEK293细胞的细胞迁移(图2)。4L, M)。在rCD248D1-4蛋白的存在下,CD248表达增加的细胞迁移减少(图。4L, M),表明rCD248蛋白可以作为干扰细胞迁移的分子诱饵。此外,我们证明了VM的诱导(图。5A, B)和MMP9蛋白水平(图;5rCD248D1-4降低了C),但细胞增殖不受影响(图2)。5D)。我们进一步研究了rCD248D1-4蛋白的抑制作用是否由于其与纤维连接蛋白的相互作用,使用Boyden腔迁移实验和VM实验。结果表明,rCD248蛋白对趋化迁移的抑制作用(图;5E F)和虚拟机活动(图。5rCD248蛋白与可溶性纤维连接蛋白预孵育后,黑素瘤细胞的G H)明显逆转。这些结果表明,rCD248D1-4可能至少部分通过与纤维连接蛋白的相互作用发挥肿瘤抑制作用。
rCD248干扰黑色素瘤细胞粘附和迁移。一个,B细胞粘附试验。将B16F10细胞与含或不含rCD248(1µM rCD248D1-4)的BSA-或纤维连接蛋白(FN)涂层良好地粘附30分钟,然后进行结晶紫染色。一个细胞粘附到纤维连接蛋白的代表性图像。B统计分析。n = 4。***P< 0.001。C,DWestern blot分析FAK活化(FAK Tyr576磷酸化,p-FAK(Tyr576)在细胞粘附实验后。n = 4。***P< 0.001。对B16F10细胞进行(E和F)创面恢复迁移实验G- - - - - -J趋化迁移试验。E创面恢复试验代表性图像及统计分析(F).用rCD248D1-4(1µM)或载体对照(Ctrl)处理B16F10细胞,并在不同时间点拍照。n = 4。**P< 0.01;***P< 0.001。G,H用不同浓度的rCD248D1-4蛋白预处理B16F10细胞,然后将其应用于博伊登腔的上孔,并以成纤维细胞培养的条件培养基(CM)作为趋化剂,进行博伊登腔迁移实验。迁移细胞染色G和枚举H迁移后3小时。n = 5。***P与车辆对照组相比< 0.001。我,J用1µM各种rCD248蛋白(rCD248D1、rCD248D3和rCD248D1-4)预处理1小时的B16F10细胞进行博伊登室迁移实验,然后将其应用于博伊登室的上孔,并将CM置于下孔作为趋化剂。我博伊登腔迁移实验的代表图像。迁移细胞在迁移后3小时进行染色和计数。J不同rCD248蛋白处理B16F10细胞Boyden迁移实验的统计分析。n = 5。***P与对照组(Ctrl)相比< 0.001。转染GFP标记CD248或转染GFP作为对照的HEK293细胞KWestern blot分析蛋白表达和l,米博伊登室迁移试验。l有和没有rCD248D1-4(1µM)处理的HEK293细胞的Boyden腔迁移实验的代表图像。迁移后4 h对迁移细胞进行染色和计数。米HEK293细胞Boyden迁移实验的统计分析。n = 6。***P< 0.001
rCD248通过与纤维连接蛋白结合来干扰黑色素瘤血管拟态。用rCD248蛋白处理B16F10细胞一个,BVM法(在基质上形成网络),Cwestern blot分析MMP9的表达D细胞增殖试验(MTT法)。一个由成纤维细胞培养的条件培养基(CM)诱导的VM实验的代表图像。B在Matrigel上播种6 h后,对网络总长度进行统计分析。n = 3。*P< 0.05;***P与车辆对照组相比< 0.001。CWestern blot分析在rCD248D1-4(1µM)存在下CM处理过的细胞中MMP9表达1天。n = 6。**P <0.01。D将B16F10细胞与或不与rCD248D1-D4一起培养1- 3天,然后在指定时间点进行MTT检测。n = 3。可溶性纤维连接蛋白逆转了rCD248蛋白的抑制作用E,F细胞迁移G,HVM。可溶性纤维连接蛋白(0.5µM)在实验前与rCD248D1-4(0.5µM)蛋白预孵育30分钟。(E)使用CM作为趋化剂的Boyden腔迁移实验的代表性图像。F细胞向CM迁移3小时的统计分析。n = 4。**P <0.01;***P< 0.001。GVM实验的代表性图像。HCM诱导的VM试验的统计分析。n = 4。***P< 0.001
rCD248D1-4抑制小鼠实验性肺转移
为了进一步验证rCD248D1-4作为肿瘤抑制因子的假设,我们使用了实验性转移的体内小鼠模型。rCD248D1-4处理实验方案如图所示。6A.与对照组相比,接受rCD248D1-4治疗的小鼠肺表面肿瘤负担更轻(图2)。6B, C)。当分析小鼠肺部的微转移时,也得到了类似的结果(图。6D)。值得注意的是,rCD248D1-4治疗没有改变肿瘤CD248的表达(图。6D);然而,它降低了PAS的表达+/ CD31−血管状结构(如图的插入部分所示)。6E)(图6E, F)和MMP9在肿瘤结节中的表达(图。6这些结果表明rCD248D1-4具有抑制VM和肿瘤转移的作用。
rCD248抑制小鼠实验性肺转移。实验性肺转移试验。一个小鼠肺转移实验模型的实验方案。每只小鼠静脉接种B16F10细胞前1 h、后1、2 d分别给予rCD248D1-4蛋白20µg。B肿瘤接种后14天小鼠肺表面大体视图代表图片。C肿瘤结节肺表面占位的统计分析。对照组(Ctrl) N = 9, rCD248D1-4组N = 8。* * *,P< 0.001。DCD248在正常小鼠和小鼠肺转移实验后的代表性表达谱。E肺肿瘤结节中CD31(棕色)和PAS(品红)双染色的代表性图像。PAS+/ CD31−面积表示为血管拟态(VM)表型。F虚拟机通道(PAS)的统计分析+/ CD31−染色)在肺肿瘤结节。**P <0.01。Ctrl组N = 20结节,rCD248D1-4组N = 21结节。G肺肿瘤结节和MMP9染色的代表性图像H统计分析。***P <0.001。Ctrl组117个结节,rCD248D1-4组69个结节
讨论
肿瘤肿块内血管生成的发生是肿瘤直径超过几厘米的限制因素。肿瘤块中的部分肿瘤细胞可进化表达膜蛋白,承担内皮细胞的特征,参与新生血管过程,称为VM。一些与VM相关的膜蛋白已经被鉴定出来,包括CD31 [29]和VE-cadherin [12].基质富集因子虽然在调节肿瘤微环境中起着关键作用,但很少被研究。VM可加重侵袭性肿瘤进展,并与几种癌症类型的患者生存率呈负相关,如恶性黑色素瘤和肺癌。近年来的研究表明,成纤维细胞和周细胞间质CD248的表达在组织纤维化和肿瘤进展中起作用[17,20.,30.].已有研究表明,肿瘤VM表型与黑色素瘤患者的生存呈负相关,而在黑色素瘤患者中,CD248表达水平与生存相关性尚无报道。Hong等研究证明CD248表达水平与肺癌患者生存期呈负相关[30.].CD248在部分肿瘤细胞中也有表达[21,31].在本研究中,我们发现CD248自主表达的肿瘤细胞具有VM表达潜能,支持肿瘤的血供,促进肿瘤的生长和转移;因此,CD248的表达可能与肿瘤的恶性有关。
我们证实CD248在黑素瘤细胞中的表达与肿瘤细胞-纤维连接蛋白相互作用、FAK激活、MMP9表达、细胞迁移和VM相关。CD248的n端凝集素结构域可增强肿瘤细胞对纤维连接蛋白的粘附,而其c端细胞质结构域可锚定在F-actin上,从而形成F-actin与ECM蛋白之间的连接。这种连接可以促进细胞锚定到ECM和细胞迁移。本研究中加入rCD248蛋白等诱饵分子,中断CD248的连锁功能,缺失其细胞质结构域,或下调CD248蛋白表达,细胞迁移活性受到抑制[25,32].值得注意的是,VM与CD248的表达相关,这表明膜锚定蛋白对VM的形成至关重要。此外,外源添加rCD248蛋白可抑制黑素瘤细胞对ECM蛋白的粘附和细胞迁移活性;rCD248蛋白也抑制了实验性肺转移小鼠模型中基质细胞的VM和VM模式。此外,rCD248蛋白可抑制小鼠肿瘤转移。这些结果表明,CD248的表达与黑色素瘤的侵袭性表型切换有关,具有更好的转移活性和VM功能,部分原因是在肿瘤细胞与ECM蛋白纤维连接蛋白之间形成连接。
目前尚不清楚CD248的表达如何导致细胞承担VM功能,尽管CD248的凝集素结构域对其功能至关重要。在这项研究中,我们发现CD248的凝集素结构域,而不是egf样结构域,是其与纤维连接蛋白相互作用所必需的。cd248 -敲低或rCD248D1-4处理的细胞粘附纤维连接蛋白期间,细胞粘附和FAK活性降低。此外,我们证明rCD248对细胞迁移的抑制与其凝集素结构域有关,而与egf样结构域无关。这些结果表明CD248的凝集素结构域可能参与了黑素瘤细胞- ecm相互作用和细胞迁移。虽然目前的结果没有直接测试rCD248是否通过与纤维连接蛋白相互作用抑制肿瘤肺转移,但我们的结果,包括基于蛋白质和基于细胞的相互作用实验以及体外实验,都表明rCD248可以部分通过干扰细胞- ecm相互作用来干扰膜结合CD248在黑素瘤迁移和VM中的作用。
FAK信号通路和MMPs与肿瘤VM相关[13].根据这些观察结果,我们证明CD248的表达可以调节黑色素瘤细胞ecm粘附、FAK激活和MMP9的表达。此外,在CD248缺失的HEK293细胞中,外源性CD248的表达促进了细胞迁移,而rCD248蛋白的存在减少了细胞迁移。这些结果表明CD248是一种可以促进细胞迁移和VM等动态细胞活性的分子,从而转化恶性黑色素瘤。虽然我们已经证明CD248表达水平与几种细胞活动相关,但CD248介导的VM是否与肿瘤进展有关,目前的研究尚未直接验证。为了解决这一问题,可以利用FAK信号的本构激活来克服CD248或rCD248治疗黑色素瘤引起的FAK抑制。
CD248在肿瘤中的功能可能不仅仅局限于细胞-基质相互作用,其表达水平与不同细胞类型的细胞活性相关,包括细胞与基质的粘附活性、迁移、增殖、信号转导的调节等。例如,我们证明CD248的表达在激活的肌成纤维细胞增殖和迁移中起作用,并调节PDGF受体信号通路[25].因此,CD248在肌成纤维细胞中的表达与皮肤伤口愈合密切相关[25].CD248在周细胞中调控细胞增殖并调节周细胞-内皮细胞相互作用[33,34].相反,CD248在CD8中的表达+T细胞抑制细胞增殖[35].目前尚不清楚CD248是否对巨噬细胞有增殖作用。我们最近的研究表明,具有凝集素结构域缺失CD248的巨噬细胞表现出更少的由LPS诱导的促炎反应,具有这种遗传背景的小鼠对LPS诱导的感染性休克反应较低[36],提示CD248具有调控toll样受体信号的潜力,类似于血栓调节蛋白[37].在这里,我们证明了黑素瘤细胞中的CD248在细胞粘附、迁移和VM中也起着重要作用。然而,CD248的表达对黑色素瘤细胞增殖的影响较小。基于这些观察,我们可以得出结论,在大多数研究的细胞类型中,CD248在细胞-基质粘附和细胞迁移中起着关键作用。然而,CD248的表达对不同细胞类型的细胞增殖可能没有相似的影响。由于CD248可以作为一种辅助受体来调节膜受体的活性,这在调节PDGF信号通路中得到了证明[25,33,38,39], CD248对细胞增殖的细胞类型特异性作用可能归因于不同细胞类型中生长因子的膜受体性质不同。
CD248被认为是评价肾细胞癌、软组织肉瘤、胶质母细胞瘤、结直肠癌、膀胱癌和黑素瘤肿瘤进展的有价值的生物标志物[23,40,41,42,43].CD248通过肿瘤细胞自主和非细胞自主两种作用促进肿瘤进展。基质CD248可通过非自主效应促进肿瘤进展[32通过调节肿瘤微环境。例如,CD248在肿瘤相关周细胞中表达,以接触依赖的方式促进远端播散,从而增加循环肿瘤细胞数量[20.].此外,CD248调控周细胞Wnt信号通路促进肺癌血管生成和肿瘤生长[30.].癌症相关成纤维细胞中CD248的表达通过与巨噬细胞上CD68的相互作用促进肝细胞癌的进展,并导致肿瘤促进M2表型的极化[44].相反,CD248在某些癌细胞中的表达可能通过自主作用促进肿瘤进展。例如,CD248在骨肉瘤中的表达可能有助于肿瘤的侵袭和转移[21].我们的研究结果表明,黑素瘤CD248通过调控细胞- ecm粘附和MMP9表达参与细胞迁移和VM,从而促进肿瘤转移。这些研究表明CD248可能是一个很有前景的癌症治疗靶点。
由于CD248的癌胚基因样表达模式,靶向CD248已被建议用于治疗多种疾病,如组织纤维化和癌症[17,45].无论是通过药物偶联还是通过诱导内化和降解,针对CD248的抗体已被大量开发[46].最近的研究表明,人源化CD248单克隆抗体在抑制肿瘤进展方面具有显著的临床前作用,部分原因是通过降低膜CD248的表达[47]可能是因为细胞- ecm相互作用的抑制[16];然而,CD248抗体治疗对癌症患者的有益作用有限[48,49].CD248可能有多个ecm结合位点,因为它有各种相互作用的伙伴,这已在多项研究中得到证实[16,25,44,50,51].因此,单价单克隆抗体的优点和缺点是只能阻断一个位点,这限制了现有CD248抗体的使用。在这方面,分子模拟和受体诱饵是治疗各种疾病的有前途的替代品。因此,可以微调内源性蛋白质功能的分子诱饵已被提出作为对抗癌症和炎症疾病的新疗法[52].在体内和体外,用rCD248治疗可以显著减少肿瘤,这表明像rCD248D1-4这样的诱饵分子可能有干扰肿瘤进展的潜力。虽然我们已经确定CD248的凝集素结构域可能是CD248干扰黑色素瘤VM和转移的功能区,但在未来可能会明确定义凝集素结构域中更具体的序列/区域。因此,合成活性CD248分子诱骗肽有望用于治疗癌症和纤维化疾病。
结论
总之,我们的研究表明,黑素瘤CD248通过增强细胞-纤维连接蛋白相互作用、迁移和VM活性来促进肿瘤转移行为。CD248的凝集素结构域和纤维连接蛋白n端70 kDa片段介导分子间相互作用,可能与随后的VM和转移有关。利用rCD248,我们证明了细胞对纤维连接蛋白的粘附、迁移和体外VM以及小鼠黑素瘤的肺转移明显降低。因此,我们认为黑色素瘤CD248促进了黑色素瘤的恶性转化,可能是一种治疗肿瘤的靶点。
数据和材料的可用性
本研究中所包含的数据和使用的材料可根据合理要求从通讯作者处获得。
缩写
- 虚拟机:
-
血管拟态
- 表皮生长因子:
-
表皮生长因子
- CM:
-
条件培养基
- FAK:
-
局灶粘附激酶
- rCD248:
-
重组CD248
- 不是:
-
周期性acid-Schiff
- siCtrl:
-
打乱siRNA控制
- siCd248:
-
CD248核
- PDGFR:
-
血小板源性生长因子受体
- ECM:
-
细胞外基质
参考文献
Pinto MP,等。逃避抗血管生成治疗:癌细胞所采用的策略。国际分子化学杂志,2016;17(9):1489。
血管增选和血管生成拟态介导抗血管生成策略的抵抗。癌症代表(霍博肯)。2020.https://doi.org/10.1002/cnr2.1318.
费尔南德斯-科尔特斯M,德尔加多-贝利多D,傅立强j。血管发生拟态:成为内皮细胞“但不是那么多”。Front Oncol, 2019;9:803。
Maniotis AJ,等。人黑素瘤细胞在体内和体外的血管通道形成:血管发生模拟。中华病理学杂志。1999;39(3):339 - 344。
莱斯利·M.肿瘤自己制造的血管。科学。2016;352(6292):1381 - 3。
Ren HY,等。肿瘤血管生成拟态与人类消化系统癌患者不良预后的相关性:系统回顾和荟萃分析。病原生物学杂志2019;25(3):849-58。
曹喆,等。肿瘤血管生成拟态与人类癌症患者预后不良相关:系统回顾和荟萃分析。中华癌症杂志,2013;49(18):3914-23。
Hendrix MJ等人。肿瘤细胞血管拟态:黑色素瘤的新靶向机会。《药典杂志》2016;159:83-92。
刘q,等。血管发生拟态与上皮-间质转化的关系。细胞分子医学杂志,2016;20(9):1761-9。
孙H,等。癌干细胞样细胞在三阴性乳腺癌中直接参与血管生成模拟通道。中华癌症杂志2019;16(2):299-311。
李S,等。肿瘤治疗中血管生成拟态的缺氧相关信号通路。Biomed Pharmacother, 2016; 80:127-35。
Delgado-Bellido D等。血管发生模拟信号再谈:关注非血管ve -钙粘蛋白。中华肿瘤杂志,2017;16(1):65。
Hernández de la Cruz, ON,等。实体瘤中驱动血管生成拟态的调控网络。Front Oncol. 2019;9:1419。
丹顿AE,罗伯茨EW,费伦DT。肿瘤微环境中的基质细胞。中国生物医学杂志,2018;
蔡永明,等。肺癌中肿瘤与成纤维细胞在血管拟态和n2型中性粒细胞招募中的合作通过Notch2-Jagged1相互作用Front Oncol. 2021;11:696931。
Tomkowicz B,等。内皮素/TEM1与细胞外基质蛋白相互作用介导细胞粘附和迁移。中国科学院学报(自然科学版),2007;26(4):366 - 366。
Teicher英航。CD248:癌症和纤维化疾病的治疗靶点。Oncotarget。2019;10(9):993 - 1009。
黄惠鹏,等。小鼠Tem1/endosialin基因靶向及lacZ报告基因表达分析基因表达模式。2011;11(5-6):316-26。
Nanda A,等。肿瘤内皮标志物1 (Tem1)在腹部肿瘤生长进展中的作用中国科学(d辑),2006;26(3):349 - 349。
维斯基C等人。表达内皮素的周细胞促进转移扩散。癌症决议2016;76(18):5313-25。
近藤Y,等。Endosialin/CD248可能是预防骨肉瘤侵袭转移的潜在治疗靶点。生态学报,2022;23(2):42。
张凯,等。CD248在肾细胞癌中的诊断和免疫治疗价值。Front Oncol. 2021;11:644612。
清原E,等。内皮素在转移性黑素瘤微环境血管中的表达:潜在的治疗意义。癌症微环境。2015;8(2):111-8。
郭超,等。通过rock2依赖的血栓调节蛋白表达,vegf诱导的内皮细胞瘤体启动新生血管生成。中华心血管病杂志,2015;29(5):357 - 357。
洪玉坤,等。肿瘤内皮标志物1 (TEM1/Endosialin/CD248)通过与血小板源性生长因子受体相互作用促进创面愈合。中国皮肤病杂志。2019;139(10):2204-14.e7。
徐悠悠,等。血栓调节蛋白促进黏附激酶的激活,并通过与纤维连接蛋白结合促进血管生成。Oncotarget。2016;7(42):68122 - 39。
郭超,等。携带人纤溶酶原Kringle结构域的重组腺相关病毒血清型2/8的开发用于持续表达和癌症治疗胡吉恩·瑟。2015;26(9):603-13。
李B,等。纤维连接蛋白1通过抑制细胞凋亡和调节EMT促进黑色素瘤增殖转移。Onco Targets Ther. 2019; 12:3207-21。
邓利维JM,等。PECAM1 +黑素瘤细胞亚群形成的血管通道。Nat Commun. 2014;5:5200。
洪春玲,等。CD248调控周细胞wnt信号通路促进肺癌血管生成和肿瘤生长癌症杂志,2022;82(20):3737-50。
布雷迪J等。人内皮素(肿瘤内皮标志物1)在高度恶性和侵袭性脑肿瘤中大量表达。中华神经外科杂志,2004;29(4):344 - 344。
Maia M,等。CD248通过其细胞质结构域促进肿瘤生长。BMC癌症,2011;11:162。
Tomkowicz B,等。内皮素/TEM-1/CD248通过PDGF受体信号通路调控周细胞增殖。中国癌症杂志,2010;9(11):908-15。
Simonavicius N,等。周细胞促进选择性血管退化以调节血管模式。血。2012;120(7):1516 - 27所示。
Hardie DL,等。基质细胞抗原CD248(内皮素)在幼稚CD8 +人T细胞上表达并调节增殖。免疫学,2011;133(3):288 - 95。
程涛,等。肿瘤内皮标记物1 (Endosialin/CD248)凝集素样结构域在脂多糖诱导的小鼠巨噬细胞活化和脓毒症中的作用翻译Res. 2021; 232:150-62。
Ma CY,等。单核细胞血栓调节蛋白触发LPS和革兰氏阴性细菌诱导的炎症反应。中华免疫杂志,2012;29(4):529 - 529。
Wilhelm A,等人。CD248/endosialin在慢性肝损伤过程中通过pdgf调控机制调控肝星状细胞增殖。肠道。2016;65(7):1175 - 85。
Naylor AJ,等人。CD248(内皮素)在pdgf介导的骨骼肌血管生成中的差异作用。PLoS One. 2014;9(9):e107146。
李毅,等。血管表达PSMA和CD248在膀胱尿路上皮癌中的预后价值。Front Oncol. 2021;11:771036。
Simonavicius N,等。内皮素(CD248)是高级别胶质瘤中肿瘤相关周细胞的标志物。中华病理学杂志,2008;21(3):308-15。
徐成,等。CD248(+)癌相关成纤维细胞:肾细胞癌的一个新的预后和治疗靶点。Front Oncol. 2021;11:773063。
Thway K,等。内皮素在软组织肉瘤中的表达作为未分化间充质细胞的潜在标记物。中华肿瘤学杂志,2016;26(4):483 - 491。
杨峰,等。在肝细胞癌中,成纤维细胞与CD68的相互作用以及内皮素对GAS6表达的调控促进巨噬细胞的募集和极化。癌症杂志2020;80(18):3892-905。
Pai CH,等。靶向成纤维细胞CD248可以减弱表达ccl17的巨噬细胞和组织纤维化。科学通报2020;10(1):16772。
徐成,等。靶向CD248(+)肌成纤维细胞的抗体药物偶联物有效缓解小鼠肾纤维化。FASEB J. 2022;36(2):e22102。
Rybinski K,等。通过抗体介导的内化靶向内皮素/CD248导致周细胞成熟受损和肿瘤微血管功能障碍。Oncotarget。2015;6(28):25429 - 40。
D 'Angelo SP,等。ontuxiumab是一种靶向内皮素的单克隆抗体,用于转移性黑色素瘤的2期研究。投资新药。2018;36(1):103-13。
Jones RL等。吉西他滨、多西他赛联合ontuxiumab (MORAb-004)治疗转移性软组织肉瘤的安全性和有效性的1期和随机对照2期试验。癌症。2019;125(14):2445 - 54。
Becker R,等。肿瘤基质标记物内皮素(Tem1)是转移相关蛋白Mac-2 BP/90 K的结合伙伴。中国科学院学报,2008;22(8):3059-67。
Khan KA,等。多蛋白素-2是横跨内皮周细胞界面的14族c型凝集素CLEC14A、CD93和CD248的配体。致癌基因。2017;36(44):6097 - 108。
Gershoni JM。分子诱骗剂:解毒剂、疗法和免疫调节剂。生物技术学报。2008;19(6):644-51。
确认
作者感谢Ru-Han Sie女士协助进行western blot检测、免疫组化和实验结果分析,以及国立成功大学生物成像核心设施的工作人员。我们感谢国立成功大学实验动物中心的工作人员提供技术援助。我们非常感谢国立成功大学国际伤口修复与再生中心在行政和实验室方面的支持。
资金
这项工作得到台湾科技部的支持(MOST-108-2320-B-006-014, MOST-109-2320-B-006-023, MOST-110-2320-B-006-051 to HLW)。
作者信息
作者及隶属关系
贡献
概念化- chk、YFW和HLW;方法- chk, YFW和BIC;调查- chk, YFW和BIC;Resource-CHK, CKH, CHL, HLW;写作- chk和HLW;审查和编辑- chk, CKH, CHL和HLW。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准
动物研究遵循国立成功大学动物护理和使用委员会批准的实验方案(110085)进行,所有程序都符合NIH《实验动物护理和使用指南》。
参与同意书
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
郭志昌,吴永飞,吴永飞。, Chang, BI。et al。干扰黑素瘤CD248功能减少血管拟态和转移。生物科学29, 98(2022)。https://doi.org/10.1186/s12929-022-00882-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-022-00882-3
关键字
- CD248
- 血管拟态
- 纤连蛋白
- 转移
- 黑素瘤