- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
乙型肝炎病毒通过限制转录因子USF-1的可用性来抑制补体C9的合成,并抑制膜攻击复合物的形成:在疾病发病机制中的意义gydF4y2Ba
生物医学科学杂志gydF4y2Ba体积gydF4y2Ba29gydF4y2Ba,文章号:gydF4y2Ba97gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
补体系统主要作为宿主抵御入侵微生物(包括病毒)的第一线防御。然而,乙型肝炎病毒(HBV)在慢性HBV感染过程中与补体成分的相互作用在很大程度上仍然未知。我们研究了HBV抑制溶细胞补体膜攻击复合物(MAC)形成的机制,并研究了其对MAC介导的杀微生物活性和疾病发病机制的影响。gydF4y2Ba
方法gydF4y2Ba
采集慢性hbv感染者和对照组的血液/肝脏组织。HepG2gydF4y2BahNTCPgydF4y2Ba用HBV颗粒感染Huh7细胞,用含有不同HBV- orf的全长线性HBV单体或质粒转染Huh7细胞,并评估补体成分或其他宿主基因的表达。此外,还进行了ELISA、Real-time PCR、Western blot、生物信息学分析、基因过表达/敲除、诱变、染色质免疫沉淀、表观遗传学研究、免疫荧光、血清HBV-DNA、细菌- dna和内毒素定量检测。gydF4y2Ba
结果gydF4y2Ba
在MAC成分(C5b-C9)中,在hbv感染的HepG2中,MAC的主要成分C9的表达显著降低gydF4y2BahNTCPgydF4y2Ba在转染HBV和HBX的Huh7细胞中。慢性乙型肝炎(CHB)和免疫耐受(IT)患者血清/肝脏C9水平明显低于非活跃携带者和健康对照组。HBX在Huh7细胞中强烈抑制c9启动子活性,但在c9启动子中未检测到CpG-island。我们确定USF-1是驱动C9表达的关键转录因子,并证明hbx诱导的USF-1启动子的高甲基化是USF-1下调的主要原因,而USF-1下调又降低了C9的转录。在将这些细胞与C9缺陷的CHB血清孵育后,观察到hbv转染的Huh7和细菌细胞的MAC形成减少,裂解受损,但补充C9后逆转。hbv感染者C9浓度与HBV-DNA、细菌- dna、内毒素含量呈显著负相关。1年替诺福韦治疗后CHB患者C9水平改善,病毒/细菌/内毒素负荷下降。gydF4y2Ba
结论gydF4y2Ba
综上所述,HBX通过USF-1启动子的高甲基化来限制USF-1的可用性,从而抑制C9转录,从而阻碍MAC的形成和溶解功能。CHB和IT都需要早期治疗,以使异常补体谱正常化,遏制病毒和细菌感染,限制疾病进展。gydF4y2Ba
背景gydF4y2Ba
乙型肝炎病毒(HBV)是一种小的包膜DNA病毒,专门感染人类肝细胞,其持续感染可引起不同程度的肝脏炎症和损伤,最终可能导致肝硬化甚至肝细胞癌(HCC) [gydF4y2Ba1gydF4y2Ba].HBV基因组是一个约3.2 kb对的部分双链环状DNA,具有4个重叠的开放阅读框(orf),即(i)编码HBV聚合酶(P)的ORF-P;(ii)编码三种包膜蛋白,大/中/小(HBsAg)表面抗原的pre-S1/pre-S2/S ORF, (iii)编码乙型肝炎e抗原(HBeAg)和核心蛋白(HBc)的pre-C/ C-ORF,以及(iv)编码HBX蛋白的X-ORF,每种ORF在HBV生命周期和疾病发病机制中都有明确的作用。人们普遍认为,HBV感染的结局在很大程度上取决于免疫介导的宿主-病毒相互作用[gydF4y2Ba2gydF4y2Ba].宿主补体系统是先天免疫的重要组成部分,是抵御各种入侵微生物(包括包膜病毒)的第一线防御者。它包括一个由血浆和膜相关蛋白组成的复杂网络,这些蛋白主要由肝细胞产生,它们的激活导致了强大而有效的蛋白水解级联反应,从而导致病原体和受感染细胞的消除,产生炎症反应以及调节适应性免疫[gydF4y2Ba3.gydF4y2Ba].三种生化途径激活补体系统——经典途径、替代途径和凝集素途径,它们都共享一个共同的末端途径,最终形成一种称为膜攻击复合体(MAC)的多蛋白裂解复合体[gydF4y2Ba4gydF4y2Ba].MAC组装开始于C5转化酶的产生,C5转化酶是一种蛋白酶,它将补体成分C5切割成C5a和C5b两个片段。补体C6在C5b中捕获一个不稳定的结合位点,随后是C7结合,使C5b-7复合物亲脂性,然后它依次附着并插入到目标膜上。C5b-7与异三聚体C8αβγ结合形成C5b-8复合体,然后C5b-8复合体依次与12-18份C9 [gydF4y2Ba3.gydF4y2Ba].它们共同形成最终成熟的C5b-9 MAC复合体,这是一个亲水蛋白通道,破坏膜的完整性,导致渗透失衡,最终导致病原体和受感染细胞的裂解[gydF4y2Ba5gydF4y2Ba].当补体被激活时,许多锚定在宿主细胞表面的补体调节蛋白起保护宿主组织免受旁观者损伤的作用[gydF4y2Ba3.gydF4y2Ba].另一方面,入侵的微生物已经进化出逃避或失调补体系统的机制,以增强它们的传染性,甚至加剧疾病症状。其中包括通过编码蛋白酶裂解补体蛋白、抑制补体蛋白的合成、编码补体调节蛋白或将宿主补体调节因子掺入病毒粒子[gydF4y2Ba6gydF4y2Ba].就HIV-1而言,病毒包膜中存在补体调节因子CD59,可阻止补体介导的病毒裂解[gydF4y2Ba7gydF4y2Ba]而HCV核心已被证明在肝细胞中转录下调补体表达[gydF4y2Ba8gydF4y2Ba].然而,HBV与补体成分的相互作用在很大程度上仍未被探索。现有研究表明,慢性HBV感染(CHI)患者血清C3和C4水平明显降低[gydF4y2Ba9gydF4y2Ba].此外,在treatment-naïve慢性hbv感染患者中观察到较高的细菌感染发生率[gydF4y2Ba10gydF4y2Ba],提示CHI可能与功能补体缺陷有关。MAC是补体末端通路的主要先天免疫效应因子,本研究为HBV降低MAC的主要成分C9的表达从而抑制MAC的形成和微生物活性的机制提供了新的见解,从而导致在CHI的情况下病毒持久性和细菌感染增加。了解这些过程将有助于制定适当的治疗策略,以改善慢性hbv感染患者的补体功能和预防疾病进展。gydF4y2Ba
方法gydF4y2Ba
全长HBV和不同HBV- orf的克隆和测序gydF4y2Ba
从一名treatment-naïve CHB患者的档案血清样本中,使用QIAamp DNA Mini试剂盒(Qiagen, CA, USA)提取HBV-DNA。通过高保真Taq DNA聚合酶(Thermo Fisher Scientific, MA, USA)和引物HBVP1和HBVP2(附加文件)从提取的DNA中扩增HBV全长基因组(约3.2 kb)gydF4y2Ba1gydF4y2Ba:表S1),每一个都有唯一的SapI限制性内切酶位点[gydF4y2Ba11gydF4y2Ba].PCR产物经QIAquick凝胶提取试剂盒(Qiagen)纯化后,用CloneJET PCR克隆试剂盒(Thermo Fisher scientific fc)克隆到pJET1.2/blunt载体上。使用BigDye终止物v3.1周期测序试剂盒(应用生物系统公司)和不同的内部引物(附加文件)确定三个HBV克隆的完整核苷酸序列gydF4y2Ba1gydF4y2Ba:表S1)的自动DNA测序仪(3130,遗传分析仪,应用生物系统)。将这些序列与从GenBank中检索到的HBV D基因型的代表性序列进行比较,以再次确认其基因型相关性,并使用其中一个HBV/D克隆进行后续实验。该HBV/D克隆的序列可在GenBank中获得,登录号为MF618339。此外,用特异性引物对从HBV/D克隆中PCR扩增出完整的PreS1/PreS2/S-ORF和ORF-P(附加文件gydF4y2Ba1gydF4y2Ba表S1),分别克隆到pEGFP-N1和pcDNA3.1/myc-His(B)载体的indiii /PstI和KpnI/ indiii限制性内切酶位点(附加文件gydF4y2Ba1gydF4y2Ba表S1)生成pEGFPN1-HBs和pcDNA3.1/myc-His(B)-HBV-P克隆。克隆经测序验证。分别由HBX和核心基因组成的质粒pcDNA3.1/myc-His(B)-HBx和pCMV-HBc [gydF4y2Ba12gydF4y2Ba是由Soma Banerjee教授赠送的。gydF4y2Ba
细胞培养和转染gydF4y2Ba
人肝癌细胞Huh7培养于Dulbecco的改良Eagle 's培养基(DMEM) (Hi-Media Laboratories ppt . Ltd.),含有10%胎牛血清(FBS)(赛默飞世尔科学公司)。通过SapI酶(Thermo Scientific)在37℃下消化12小时,从pJET1.2/blunt载体中释放HBV全长线性单体,然后使用QIAquick凝胶提取试剂盒(Qiagen)进行凝胶纯化。将释放的HBV单体或含HBV- orf的质粒以2 × 10的浓度分别转染到12孔板上的Huh7细胞中gydF4y2Ba5gydF4y2Ba使用Lipofectamine 3000 (Invitrogen)。以未转染或空载体转染的Huh7细胞作为对照。转染6小时后,将培养基替换为含有10% FBS的新鲜DMEM培养基,72小时后,收集转染和未转染的Huh7细胞。所有实验一式三次,重复至少三次。Huh7细胞系经印度Pune国家细胞科学中心的STR谱分析方法鉴定。gydF4y2Ba
HBV的产生和感染gydF4y2Ba
HepG2.2.15和HepG2gydF4y2BahNTCPgydF4y2Ba细胞系是由马里兰大学人类病毒学研究所希亚姆·科蒂尔教授赠送的。HepG2.2.15细胞(稳定转染HBV完整基因组)在含10%胎牛血清的DMEM中培养4天。收集含有HBV颗粒的上清液,Real - Time PCR检测HBV原液滴度(每毫升基因组当量)。HepG2gydF4y2BahNTCPgydF4y2Ba表达人牛磺胆酸钠共转运多肽(NTCP)的细胞易感染HBV, HepG2.2.15细胞培养上清中提取的HBV作为HepG2感染的接种物gydF4y2BahNTCPgydF4y2Ba细胞。HepG2的gydF4y2BahNTCPgydF4y2Ba细胞在添加10%胎牛血清和1% l -谷氨酰胺的DMEM中接种,72小时后,用HBV颗粒(每个细胞100个病毒基因组当量)联合8%聚乙二醇(PEG) 8000和2.5%二甲基亚砜(DMSO)感染细胞[gydF4y2Ba13gydF4y2Ba].感染6小时后用PBS清洗细胞,在含有10%胎牛血清、1% l -谷氨酰胺和2.5% DMSO的DMEM中培养72小时,然后收集用于进一步实验。HBV未感染的HepG2gydF4y2BahNTCPgydF4y2Ba细胞作为对照。gydF4y2Ba
实时聚合酶链反应gydF4y2Ba
从收获的Huh7和HepG2提取总RNAgydF4y2BahNTCPgydF4y2Ba使用TRIzol (Invitrogen)和cDNA的细胞是用RevertAid逆转录酶(RT)酶(Thermo Scientific)进行逆转录生成的。使用cDNA、SYBR Green Master mix (Applied Biosystems)和每个基因特异性引物对,通过实时荧光定量PCR检测不同补体成分(C5-C9)以及其他宿主基因的mRNA表达gydF4y2Ba1gydF4y2Ba:表S2)。每个样本进行三次评估,以18S rRNA表达水平归一化。gydF4y2Ba
研究对象及样本gydF4y2Ba
Treatment-naïve慢性HBV感染患者(HBsAg阳性> 6个月)从印度加尔各答研究生医学教育与研究所(I.P.G.M.E & r .)消化与肝脏疾病学院(SDLD)的肝脏病学诊所招募,代表不同阶段的慢性HBV感染,并被分为不同的队列,即-gydF4y2Ba
免疫耐受(IT)gydF4y2Ba
hbeag阳性,HBV-DNA高的患者(> 10gydF4y2Ba6gydF4y2BaIU/ml),血清谷丙转氨酶(ALT)水平正常(≤40iu /L),轻度或无坏死性炎症。gydF4y2Ba
hbeag阳性慢性乙型肝炎(CHB)gydF4y2Ba
HBV-DNA >高gydF4y2Ba4gydF4y2Ba拷贝数/ml, hbeag阳性,ALT升高> 40 IU/L,有活动性肝坏死炎症的证据。gydF4y2Ba
非活跃载体(IC)gydF4y2Ba
HBeAg阴性,HBV-DNA低(< 10gydF4y2Ba4gydF4y2Ba拷贝数/ml), ALT正常(≤40iu /L),轻度或无坏死性炎症。gydF4y2Ba
hbeag阴性慢性乙型肝炎gydF4y2Ba
HBV-DNA >患者gydF4y2Ba4gydF4y2Ba拷贝数/ml, hbeag阴性,ALT > 40 IU/L和活动性肝坏死炎症的证据。gydF4y2Ba
排除HIV/HCV合并感染、糖尿病、慢性酒精中毒、静脉药物滥用或任何长期(> ~ 7天)药物治疗、任何癌症、明显感染或自身免疫性疾病的患者。作为对照/对照组,血清样本取自6个月内无病毒/细菌感染和慢性/急性疾病的健康志愿者(HC)。gydF4y2Ba
从每个研究对象中收集5毫升血液,并分离血清,并在−80°C下储存直到使用。在纳入研究之前,事先从参与者或未成年参与者的父母或法定监护人那里获得知情的书面同意。人体样本的获取和所有实验方案均按照I.P.G.M.E & r伦理审查委员会批准的指导方针进行。gydF4y2Ba
在超声内镜引导的常规活检中,从选定的CHB患者中收集肝活检组织样本,作为诊断检查的一部分。另外,取胆囊切除术患者的肝组织和肝组织正常、无肝转移的肝组织作为对照组。将组织收集在RNAlater溶液(Invitrogen)中,在4°C保存过夜,然后在- 80°C保存以备将来使用。gydF4y2Ba
测定患者血清C9水平gydF4y2Ba
通过市售的ELISA试剂盒(Elabscience),使用慢性HBV感染者和HC患者的血清来估计C9水平。gydF4y2Ba
C9在肝组织中的表达gydF4y2Ba
将保存在RNA中的肝组织均质,用TRIzol试剂提取RNA,生成cDNA, Real-time PCR检测C9 mRNA的表达。gydF4y2Ba
Western blot分析gydF4y2Ba
用pcDNA3.1/myc-His(B)-HBx或空载体转染的Huh7细胞在RIPA缓冲液[150 mM NaCl, 1% NP40, 0.5%脱氧胆酸钠,0.1% SDS, 50 mM Tris (pH 8.0)]中裂解,并辅以1X蛋白酶抑制剂鸡尾酒(Roche,瑞士)。用Bradford试剂(Sigma Aldrich, MO, USA)测定全细胞裂解液中的蛋白质浓度。等量总蛋白在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS PAGE)上分解,转移到硝化纤维膜上,用5% BSA在室温下阻断1 h,然后用小鼠抗人抗c9(1:500)或小鼠抗人抗usf -1(1:500)一抗在4℃下处理过夜(Santa Cruz Biotechnology)。膜用PBST [PBS + 0.1% Tween-20]清洗,并在室温下在辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(1:1000)中孵育1小时,然后用化学发光的HRP底物(赛默飞世尔科学公司)处理。最后,用ImageJ软件对x射线胶片进行曝光、显影、干燥、扫描和分析。细胞α-微管蛋白作为Western blot的负载对照gydF4y2Ba.gydF4y2Ba
5-Aza-2 ' -脱氧胞苷和Trichostatin A处理HBx转染的Huh7细胞gydF4y2Ba
为了确定DNA甲基化和组蛋白去乙酰化在C9下调中的作用,转染HBx的Huh7细胞分别用5 μM DNA甲基化抑制剂5- aza -2 ' -脱氧胞苷或0.1 μM组蛋白去乙酰化抑制剂曲古菌素A (TSA)处理,未处理的细胞作为对照。首先,将含有5 μM 5- aza -2 ' -脱氧胞苷或0.1 μM TSA的新鲜DMEM培养基分别添加到Huh7细胞中,同时将细胞播种到细胞培养板上。pcDNA3.1/myc-His(B)-HBx转染Huh7细胞,转染6 h后用PBS洗涤细胞,将培养基换成含有5 μM 5- za-2 ' -脱氧胞苷或0.1 μM TSA的培养基。培养基每24小时更换一次含有相同浓度5-Aza-2 ' -脱氧胞苷或TSA的新鲜培养基。转染72小时后,收集细胞,提取总RNA,制备cDNA。Real-time PCR检测5-Aza-2’-脱氧胞苷和TSA处理细胞C9和USF-1 mRNA的表达,并与未处理细胞进行比较。gydF4y2Ba
C9启动子序列突变gydF4y2Ba
C9启动子区(−786至+ 40 bp) [gydF4y2Ba8gydF4y2Ba首次从Huh7基因组DNA中扩增,引物为C9-prom_F和C9-prom_R(附加文件)gydF4y2Ba1gydF4y2Ba:表S2),插入到pGL3-Basic vector的KpnI/印地二位点(Promega, WI, USA),生成pGL3-C9-Prom构造。在pGL3-C9-Prom构建中,USF-1结合位点、E-box (CACGTG)被删除,用Agilent site Directed Mutagenesis Kit (Agilent, CA, USA)构建pGL3-C9-Prom-mt质粒,测序结果证实。用于产生突变启动子结构的寡核苷酸列在附加文件中gydF4y2Ba1gydF4y2Ba:表S2。gydF4y2Ba
双荧光素酶报告法gydF4y2Ba
为了研究HBX存在时C9启动子的活性,用pGL3-C9-Prom、pcDNA3.1/myc-His(B)-HBx和pRL-CMV共转染Huh7细胞gydF4y2BaRenilla荧光素酶gydF4y2Ba报告向量(Promega, WI,美国)。转染72小时后,细胞在被动裂解缓冲液(Promega)中收获gydF4y2Ba萤火虫gydF4y2Ba而且gydF4y2BaRenillagydF4y2Ba使用双荧光素酶报告试剂盒(Promega)在光度计(Promega)中依次测量荧光素酶活性。的活动gydF4y2BaRenillagydF4y2Ba荧光素酶被用来正常化gydF4y2Ba萤火虫gydF4y2Ba荧光素酶活性。gydF4y2Ba
CpG岛分布及转录因子(TF)结合C9启动子的分析gydF4y2Ba
使用在线工具Methprimer分析C9启动子区域的假定CpG岛[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
使用PROMO和TFBIND软件,以< 5%的差异阈值和长度为> 10的方法,生物信息地鉴定了C9启动子区域的转录因子(TF)结合。从Human Protein Atlas数据库中测定tf在肝脏中的表达水平。体外研究选择肝tf与C9启动子结合。gydF4y2Ba
USF1的过表达和敲除gydF4y2Ba
编码USF-1的pCMV-USF1质粒是Marie-Dominique Galibert教授的慷慨礼物。用pcDNA3.1/myc-His(B)-HBx、pGL3-C9-Prom和pRL-CMV Renilla荧光素酶报告载体以及不同浓度(0、400、800和1200 ng/ml)的pCMV-USF1质粒转染Huh7细胞,并从收获的细胞中评估C9启动子的荧光素酶活性。用pcDNA3.1/myc-His(B)-HBx和pCMV-USF1质粒(不同浓度)共转染Huh7细胞,检测C9 mRNA的表达。此外,USF-1反义寡核苷酸(USF-1_ASO)(附加文件gydF4y2Ba1gydF4y2Ba:表S2)针对USF-1外显子1的基因序列设计自UCSC基因组浏览器获得的USF-1基因序列。用pGL3-C9-Prom、pRL-CMV Renilla荧光素酶报告载体和USF-1_ASO (0-1200 ng/ml)转染Huh7细胞,测定c9启动子荧光素酶活性。此外,用USF-1_ASO (1000 ng/ml)或打乱寡核苷酸对照(ASO_Ctrl) (1000 ng/ml)转染Huh7细胞,评估C9 mRNA的表达gydF4y2Ba1gydF4y2Ba:表S2),在HBV或人类转录组中没有已知靶点。gydF4y2Ba
染色质免疫沉淀(ChIP)试验gydF4y2Ba
为了澄清USF-1与C9启动子区域之间的相互作用,根据制造商的说明,使用EpiQuik染色质免疫沉淀试剂盒(EpigenTek, NY, USA)进行ChIP检测。首先用小鼠抗人抗usf1抗体(Santa Cruz Biotechnology)和非免疫IgG(试剂盒提供)作为阴性对照制备检测试纸。2 × 10gydF4y2Ba6gydF4y2Ba用pcDNA3.1/myc-His(B)-HBx或空载体转染Huh7细胞,72 h后收集细胞,染色质与1%甲醛交联。加入1.25 M甘氨酸5分钟,终止交联过程。细胞在含有1X蛋白酶抑制剂鸡尾酒(Roche)的裂解缓冲液中孵育。超声处理将交联dna -蛋白质复合物剪切成约200-1000 bp的片段。从超声dna -蛋白质复合物中去除5%的输入参考。取各样品上清100 μl加入抗体包被检测条进行免疫沉淀。DNA交联被逆转,在所有样管(包括输入DNA小瓶)中,用蛋白酶K在65°C下处理2小时,去除蛋白质,并用DNA纯化自旋柱回收DNA。最后,使用附加文件中列出的C9启动子特异性引物,通过实时PCR对DNA进行定量gydF4y2Ba1gydF4y2Ba:表S2。然后将得到的数据归一化为阴性对照,并表示为相对于输入的回收率百分比。gydF4y2Ba
酸性亚硫酸盐测序gydF4y2Ba
从pcDNA3.1/myc-His(B)-HBx或空载体转染的Huh7细胞中采用DNA提取试剂盒(FAVORGEN Biotech Corp., Taiwan)分离基因组DNA。用EZ DNA甲基化试剂盒(Zymo Research, CA, USA)对2ug分离的基因组DNA进行亚硫酸氢盐处理和纯化。亚硫酸氢盐修饰的基因组DNA被USF-1启动子的亚硫酸氢盐特异性引物扩增(附加文件gydF4y2Ba1gydF4y2Ba:表S2)分别在95°C for 30 s、56°C for 30 s、72°C for 20 s的35个循环中扩增产物克隆到pJET1.2 blunt vector中。测序筛选各组pcDNA3.1/myc-His(B)-HBx /空载体转染细胞6个不同克隆,分析DNA甲基化状态。gydF4y2Ba
免疫荧光gydF4y2Ba
经HBV转染的Huh7细胞单层在多聚体上培养gydF4y2BalgydF4y2Ba-赖氨酸包被覆盖在6孔板上48 h,然后用50 μl HC或CHB患者血清或补充重组C9蛋白的CHB患者血清,最终浓度为15 ng/ml的培养基在37℃下处理60 min。将细胞用4%多聚甲醛固定10分钟,用冰冷的TBS洗涤后,用0.05%胰蛋白酶-氯化钙溶液[胰蛋白酶0.5%,氯化钙1% (pH 7.8)]在37℃下处理20分钟,回收被掩盖的抗原。用含0.025% TritonX-100的TBS洗涤后,用1% BSA在TBS中阻断2小时。细胞在4℃用1:500稀释的小鼠抗人抗c5b -9一抗(Santa Cruz Biotechnology)染色过夜,然后用1:100稀释的与Alexa fluor 488偶联的山羊抗小鼠IgG二抗(Thermo Fisher Scientific)在37℃孵育1小时。采用4 ',6-二氨基苯基吲哚(DAPI) Pro-Long Gold抗褪色试剂(Cell Signaling Technology)进行核反染色和安装。图像用雷雷成像仪(徕卡)以40倍放大倍率拍摄。gydF4y2Ba
补体介导的细胞溶解试验gydF4y2Ba
用HBV全长单体转染Huh7细胞,以1 × 10的密度分布于96孔板gydF4y2Ba4gydF4y2Ba细胞/。3天后,用HC或CHB患者的血清或补充重组C9蛋白的CHB血清处理细胞gydF4y2Ba(gydF4y2Ba终浓度15 ng/ml)在37°C下保温1小时。最后,用40 μg/孔MTT溶液(Sigma Aldrich)处理细胞,在37℃黑暗中孵育4 h。在测试波长为570 nm,参考波长为630 nm的ELISA平板阅读器上测量溶液的光密度。gydF4y2Ba
C9沉积在gydF4y2Ba大肠杆菌gydF4y2Ba
1 × 10gydF4y2Ba7gydF4y2Ba细胞的gydF4y2Ba大肠杆菌gydF4y2BaDH5α与CHB患者或HC患者血清在37℃孵育60 min。PBS洗涤后,将细菌镀于96孔酶免疫测定(EIA)板上,以~ 5 × 10吸附gydF4y2Ba6gydF4y2Ba每孔细胞。用200µl 0.5%牛血清白蛋白(BSA) -PBS阻断非特异性结合位点,并在37°C下孵育30分钟。洗净后,用100µl 1:100 (v/v)小鼠抗人抗c9抗体在室温下孵育60分钟,100µl 1:100 HRP偶联山羊抗小鼠二抗孵育30分钟,然后加入100µl底物溶液观察HRP活性。用50µl 10% H停止反应gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba,在ELISA阅读器490 nm处读取光密度检测显色反应。gydF4y2Ba
杀菌试验gydF4y2Ba
1 × 10gydF4y2Ba4gydF4y2Ba细胞的gydF4y2Ba大肠杆菌gydF4y2Ba菌株DH5α与CHB患者或HC的血清100µl(稀释1:500)或HC的热灭活血清(补体失活)在56℃孵育60分钟。洗涤后,在生理盐水中连续配制10倍稀释的菌悬液,100µl铺于LB板上。在37°C孵育16 h后,计数菌落形成单位(CFU)。实验一式三次,重复三次。gydF4y2Ba
细菌载量和内毒素滴度测定gydF4y2Ba
通过溶菌酶在56℃下孵育30分钟,分离不同阶段CHB患者和健康志愿者血清样本中的细菌DNA,然后使用QiaAmp血液DNA迷你试剂盒(Qiagen)进行DNA分离。用引物338F (5 ' actcctacgggaggcagcag -3 ')和806R (5 ' -GGACTACHVGGGTWTCTAAT-3 ')扩增细菌16S rRNA基因V3-V4高变区[gydF4y2Ba15gydF4y2Ba]使用Real-time PCR。用制备的标准曲线测定细菌载量gydF4y2Ba大肠杆菌gydF4y2Ba以已知细菌负荷的DNA为标准。采用显色内毒素定量试剂盒(Thermo Fisher Scientific) ELISA法检测慢性HBV感染者和健康个体血清中的内毒素水平。简单地说,将内毒素标准液与游离内毒素水重构后,分别取各50 μl标准液和HC、慢性HBV感染者血清样本,于37℃水浴下加入96孔板。每孔加入阿米巴细胞裂解液试剂,37℃孵育,加入显色底物,25%醋酸终止反应。在光学版阅读器中测量405nm处的光密度。gydF4y2Ba
接受替诺福韦治疗的慢性乙型肝炎患者血清C9水平和病毒学/细菌学参数的纵向评估gydF4y2Ba
10例接受替诺福韦(每日300 mg)治疗的CHB患者,分别在治疗开始前第0天(=基线)和治疗12个月结束时采集血液样本,如前所述评估血清C9、HBV DNA、ALT、细菌载量和内毒素滴度。gydF4y2Ba
统计分析gydF4y2Ba
数据以均数±标准差(SD)表示。成对的学生的gydF4y2BatgydF4y2Ba采用检验和重复测量方差分析来确定统计学意义。组间比较采用单因素方差分析(one - way ANOVA),随后采用Tukey多元比较检验(Multiple Comparison Test)。相关性分析采用线性回归。使用GraphPad Prism Software 5.0版本进行统计分析。对于所有的测试,gydF4y2BapgydF4y2Ba< 0.05为有统计学意义。gydF4y2Ba
结果gydF4y2Ba
hbv转染Huh7细胞和hbv感染HepG2细胞C9表达下调gydF4y2BahNTCPgydF4y2Ba细胞和慢性hbv感染患者gydF4y2Ba
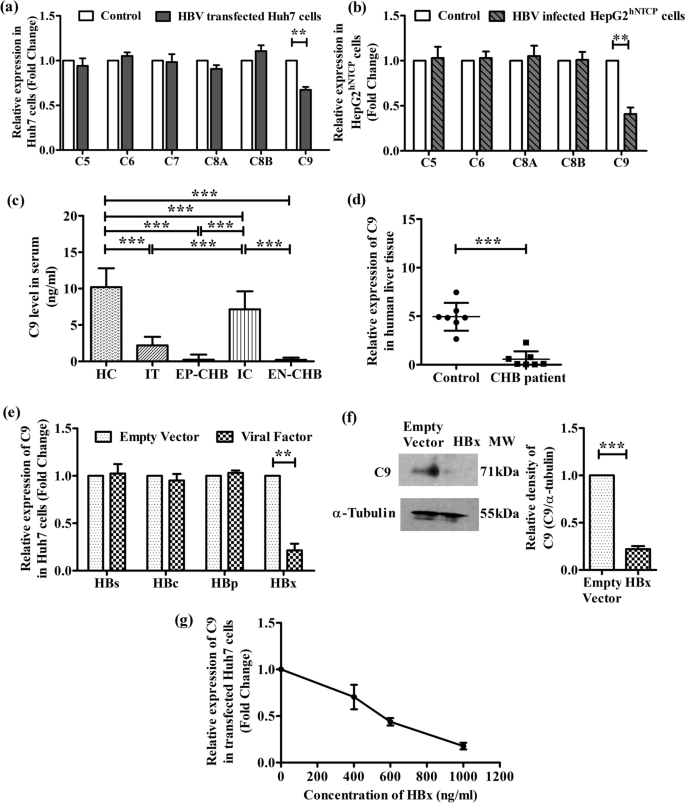
为了探究HBV是否会干扰MAC的形成,我们首先用Real-time PCR检测了转染全长HBV的Huh7细胞中不同MAC成分(C5/C6/C7/C8/C9)的表达。如图所示。gydF4y2Ba1gydF4y2Baa,与未转染的细胞相比,hbv转染的Huh7细胞C9表达显著降低(约1.5倍),而MAC其他成分的表达保持相当。此外,我们还研究了MAC成分在HepG2中的表达gydF4y2BahNTCPgydF4y2Ba由稳定的HBV复制细胞产生的细胞培养源HBV感染的细胞(HepG2.2.15)。结果显示了与Huh7细胞相似的趋势,hbv感染的HepG2中C9表达显著下调(约2.4倍)gydF4y2BahNTCPgydF4y2Ba细胞相对于未感染的对照细胞,而C5, C6和C8的表达没有观察到变化(图。gydF4y2Ba1gydF4y2Bab). HepG2中未检测到C7gydF4y2BahNTCPgydF4y2Ba细胞。gydF4y2Ba
HBV降低补体C9表达。不同膜攻击复合物组分相对mRNA的表达gydF4y2Ba一个gydF4y2Ba相对于未转染的细胞(对照组)和转染全长HBV线性单体的Huh7细胞gydF4y2BabgydF4y2BaHepG2gydF4y2BahNTCPgydF4y2Ba细胞培养源HBV颗粒感染的细胞与未感染的HepG2进行比较gydF4y2BahNTCPgydF4y2Ba细胞(对照),Real-time PCR检测。gydF4y2BacgydF4y2BaELISA法检测IT、EP-CHB、IC、EN-CHB、HC患者血清C9浓度。gydF4y2BadgydF4y2Ba慢性HBV感染肝活检组织与对照肝组织C9相对mRNA表达gydF4y2BaegydF4y2Ba分别转染三种HBV表面蛋白(HBs)、HBV核心蛋白(HBc)、HBV聚合酶(HBp)或HBV X (HBx)质粒的Huh7细胞C9 mRNA的相对表达。gydF4y2BafgydF4y2Ba抗C9一抗免疫印迹法检测转染HBx或空载体Huh7细胞中C9蛋白的表达细胞α-微管蛋白作为负载对照。gydF4y2BaggydF4y2BapcDNA3.1/myc-His(B)-HBx质粒转染不同浓度(0、400、600和1000 ng/ml)时C9相对mRNA的表达。mRNA表达与内源性18S核糖体RNA值归一化。如属gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba而且gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba,数值代表三个独立实验的数据,均值±标准差。为gydF4y2BacgydF4y2Ba采用单因素方差分析(one-way ANOVA)、Tukey多元比较检验(** .gydF4y2BapgydF4y2Ba< 0.005和***gydF4y2BapgydF4y2Ba< 0.0001)。配对gydF4y2BatgydF4y2Ba-测试对a、b和d-f中的配对组进行比较。**gydF4y2BapgydF4y2Ba< 0.005, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
接下来,我们用ELISA法测定了HC和慢性hbv感染患者在不同疾病期、IT期、EP-/EN-CHB期和IC期血清中的C9水平。研究对象的临床和人口学特征在附加文件中提供gydF4y2Ba1gydF4y2Ba:表S3。IT、EP-CHB和EN-CHB中C9明显低于IC和HC(图2)。gydF4y2Ba1gydF4y2Bac).此外,IC与HC相比,IC中C9浓度低于HC。此外,我们检测到CHB患者肝活检组织中C9转录水平明显低于对照组(图2)。gydF4y2Ba1gydF4y2Bad)。gydF4y2Ba
HBX抑制C9的表达gydF4y2Ba
为确定导致C9表达下调的病毒因子,分别转染Huh7细胞表达不同HBV蛋白的质粒,Real-time PCR检测C9的表达。与空载体转染的Huh7细胞相比,hbx转染的Huh7细胞C9 mRNA水平显著降低(约4.7倍)。gydF4y2Ba1gydF4y2Bae).相比之下,与对照组相比,表达其他HBV蛋白的细胞中C9 mRNA的数量没有明显变化。用抗C9抗体对细胞裂解液进行免疫印迹分析,在蛋白水平上进一步证实了HBX对C9表达的下调作用,与对照细胞相比,C9表达显著降低(图2)。gydF4y2Ba1gydF4y2Baf).为了评估HBX抑制C9表达的特异性,通过增加HBX表达质粒转染Huh7,观察到相应剂量依赖性的C9 mRNA水平下降(图。gydF4y2Ba1gydF4y2Bag).总的来说,结果表明HBX导致C9表达下降。gydF4y2Ba
HBV诱导的DNA高甲基化有助于C9下调gydF4y2Ba
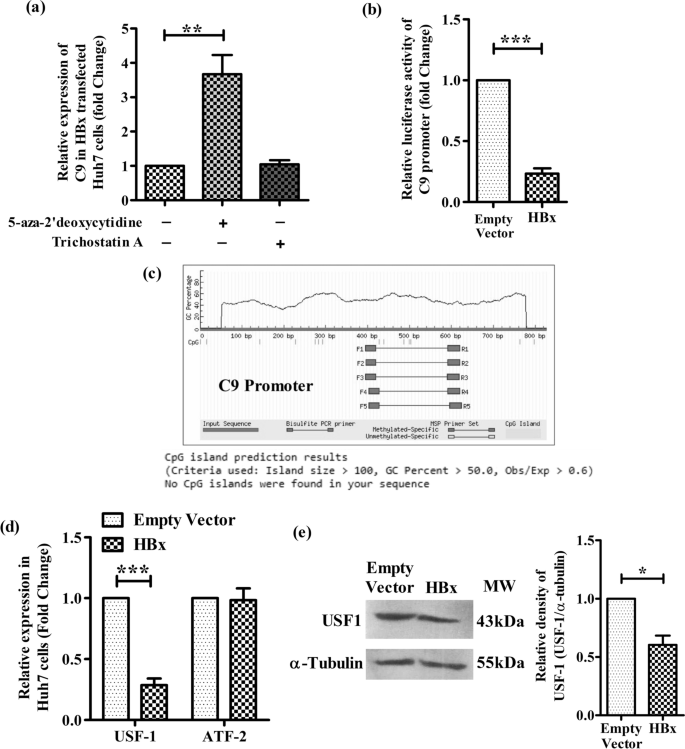
HBX诱导的表观遗传变化,包括DNA甲基化模式的畸变和组蛋白修饰,已被证明在调节多种宿主基因的表达中发挥重要作用[gydF4y2Ba16gydF4y2Ba].我们在Huh7细胞中通过干扰DNA甲基化或组蛋白去乙酰化来检测C9是否被HBX沉默。为此,用DNA甲基化抑制剂、5-Aza-2 ' -脱氧胞苷或组蛋白去乙酰化抑制剂、曲古菌素A (TSA)处理hbx转染的Huh7细胞,分析C9表达。与未处理的细胞相比,5-Aza-2 ' -脱氧胞苷存在时C9的表达显著增强,而TSA处理后没有观察到任何影响,这表明C9下调可能归因于HBV介导的DNA高甲基化(图)。gydF4y2Ba2gydF4y2Ba一个)。gydF4y2Ba
HBX下调C9启动子活性和USF-1表达。gydF4y2Ba一个gydF4y2BaDNA甲基化抑制剂5-aza-2 ' -脱氧胞苷(5 μM)或组蛋白去乙酰化抑制剂Trichostatin A (0.1 μM)转染HBx的Huh7细胞中C9的相对表达。gydF4y2BabgydF4y2Ba当与hbx表达质粒[pcDNA3.1/myc-His(B)-HBx]或空载体共转染时,C9启动子-荧光素酶报告结构(pGL3-C9-Prom)的相对荧光素酶活性。gydF4y2BacgydF4y2Ba利用Methprimer在线软件预测C9启动子的CpG岛。相对表达式gydF4y2BadgydF4y2Bausf1和ATF2 mRNA和gydF4y2BaegydF4y2Ba用实时荧光定量PCR和抗usf1抗体western blot分别检测HBx或空载体转染Huh7细胞中USF-1蛋白含量。均数±标准差是基于三个独立实验得出的。配对组间进行配对检验。。*gydF4y2BapgydF4y2Ba< 0.05, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
HBX抑制C9启动子活性gydF4y2Ba
为了进一步研究hbv介导的C9抑制机制,我们首先研究了HBX对C9启动子活性的影响。生成C9启动子-荧光素酶报告结构(pGL3-C9-Prom),并与pcDNA3.1/myc-His-HBx或空载体一起转染到Huh7细胞,并测量萤火虫荧光素酶活性。在这两种情况下,共转染质粒pRL-CMV,表达gydF4y2BaRenillagydF4y2Ba荧光素酶提供了内部控制,萤火虫荧光素酶的发光被归一化gydF4y2BaRenillagydF4y2Ba荧光素酶。报告分析显示,与载体控制相比,HBX的异位表达显著降低了C9启动子驱动的荧光素酶信号,降低了约4.3倍(图2)。gydF4y2Ba2gydF4y2Bab)。gydF4y2Ba
C9启动子中CpG岛缺失gydF4y2Ba
为了研究hbx诱导的高甲基化导致C9启动子失活的可能性,我们首先使用MethPrimer程序定位C9启动子中的CpG岛。然而,在硅片分析中发现,CpG岛在C9基因的启动子中不存在(图9。gydF4y2Ba2gydF4y2Bac)。gydF4y2Ba
HBX介导了TF与C9启动子结合表达的改变gydF4y2Ba
与启动子结合不足的tf可用性也被认为是启动子活性下调和基因表达减少的重要原因。使用在线工具PROMO和TFBIND,并设置一个< 5%的不相似指数和字符串长度> = 10的截止值,我们首先分析了与C9启动子结合的tf,并确定了四个重要的tf,即USF-1, ATF2, FOXO4, STAT1β。然而,从Human Protein Atlas数据推断,其中只有USF1和ATF2在肝细胞中表达。因此,我们通过Real-time PCR研究了ATF2和USF-1在hbx转染的Huh7细胞中的表达。我们注意到,与空载体转染的细胞相比,HBX导致USF-1 mRNA的表达显著降低(约3.5倍),而ATF2的表达没有变化(图2)。gydF4y2Ba2gydF4y2Bad). Western blot分析也观察到HBX在蛋白水平上对USF-1的抑制作用(图。gydF4y2Ba2gydF4y2Bae).这种低USF-1表达可能与其与C9启动子结合减少以及随后的转录活性衰减有关。gydF4y2Ba
USF-1过表达后hbx转染Huh7细胞C9启动子活性和C9表达增强gydF4y2Ba
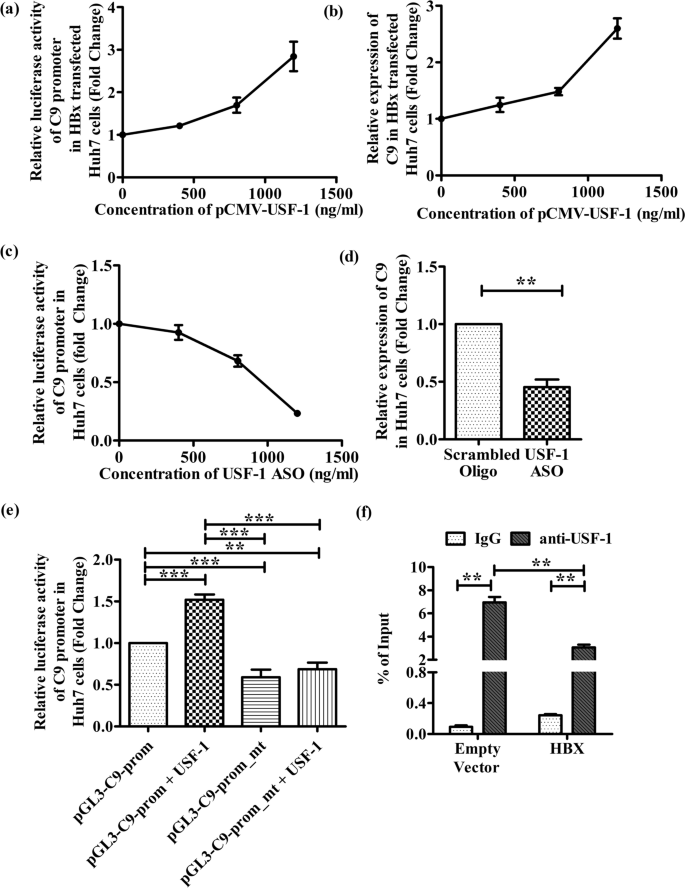
为了确定USF-1是否在C9的转录调控中发挥重要作用,我们在hbx转染的Huh7细胞中,在不同浓度表达usf1的pCMV-USF1质粒存在下,重新评估了C9启动子活性和C9表达。如图所示。gydF4y2Ba3.gydF4y2Ba在a和b中,USF-1表达的增加导致hbx转染细胞中C9启动子和C9 mRNA的剂量依赖性诱导。此外,我们用ASO敲除对照Huh7细胞中的USF-1,并观察到随着ASO浓度的增加,C9启动子荧光素酶活性和C9表达逐渐降低(图2)。gydF4y2Ba3.gydF4y2Bac, d).总之,这些数据表明USF-1是肝细胞C9基因表达的关键调节因子。gydF4y2Ba
USF-1是调控C9表达的重要转录因子,被HBX抑制。gydF4y2Ba一个gydF4y2BapcDNA3.1/myc-His(B)-HBx、pGL3-C9-Prom和pRL-CMV Renilla荧光素酶报告载体以及不同浓度(0、400、800和1200 ng/ml) pCMV-USF1质粒转染Huh7细胞C9启动子的相对荧光素酶活性。gydF4y2BabgydF4y2BapcDNA3.1/myc-His(B)-HBx和pCMV-USF1质粒以不同浓度(0、400、800和1200 ng/ml)转染Huh7细胞后C9 mRNA的相对表达。gydF4y2BacgydF4y2Ba用pGL3-C9-Prom、pRL-CMV Renilla luciferase Reporter载体和不同浓度的USF-1基因反义寡核苷酸(USF-1_ASO) (0-1200 ng/ml)转染Huh 7细胞,检测C9启动子荧光素酶的相对活性。gydF4y2BadgydF4y2BaUSF-1_ASO (1000 ng/ml)或ASO_Ctrl (1000 ng/ml)转染Huh7细胞后相对C9 mRNA的表达。gydF4y2BaegydF4y2Ba在存在或不存在USF-1表达质粒(pCMV-USF1)的情况下,评估野生型pGL3-C9-Prom及其突变衍生物pGL3-C9-Prom-mt转染Huh7细胞后C9荧光素酶的相对活性。gydF4y2BafgydF4y2BaUSF1在HBx和空载体转染Huh7细胞中与C9启动子结合的ChIP分析采用IgG(阴性对照)和抗usf -1抗体进行ChIP分析。C9启动子DNA的相对富集度归一化为每个实验的输入DNA(5%)。平均值±标准差是基于三个独立的实验。对组进行配对检验gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba.组间比较采用单因素方差分析gydF4y2BapgydF4y2Ba值通过Tukey的多重比较检验调整gydF4y2BaegydF4y2Ba.**gydF4y2BapgydF4y2Ba< 0.005, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
USF-1与c9启动子的E-box元件结合,在HBX存在时结合减少gydF4y2Ba
已知USF-1识别并结合到基因启动子内符合CANNTG核心六核苷酸共识序列的E-box motif [gydF4y2Ba17gydF4y2Ba].对C9启动子(nt - 786 - + 40)的序列分析显示,在nt. - 738/ - 732中存在一个假定的E-box位点(5 ' -CACGTG-3 ')。为了研究E-box motif在C9启动子基础转录活性中的功能作用,在pGL3-C9-Prom构建物中通过定点突变删除6 bp一致序列,生成pGL3-C9-Prom-mt。将野生型启动子和突变衍生物转染Huh7细胞,检测荧光素酶活性。结果见图。gydF4y2Ba3.gydF4y2Bae表明e -box缺失大大降低了C9启动子的基础活性。此外,我们还研究了过表达USF-1对这两种启动子结构的荧光素酶活性的影响。虽然pGL3-C9-Prom在响应细胞USF-1增加时表现出约1.5倍的强大启动子活性,但即使存在USF-1, pGL3-C9-Prom-mt的活性也没有变化(图1)。gydF4y2Ba3.gydF4y2Bae).这些结果表明USF-1对C9启动子具有e -box依赖性的刺激作用。为了直接评估USF-1与C9启动子结合的存在,我们在转染pcDNA3.1/myc-His-HBx或空载体的Huh7细胞中进行ChIP。当使用抗usf -1抗体免疫沉淀DNA时,检测到含有C9启动子DNA的E-box富集,而当使用IgG时则没有。gydF4y2Ba3.gydF4y2Baf)。然而,与载体控制相比,在HBX存在时,USF-1对C9启动子的占用率显著降低(约2.3倍)。gydF4y2Ba3.gydF4y2Baf).所有病例均采用Real-time PCR对免疫沉淀DNA进行定量,并将结果归一化至输入DNA。这些结果表明USF-1与C9启动子中同源E-box元件的结合有助于C9基因表达的激活,而HBX限制了USF-1与目标启动子结合的可用性。gydF4y2Ba
HBX高甲基化USF1启动子,减弱USF1和C9转录gydF4y2Ba
在HBX转染的Huh7细胞中,USF-1与C9启动子的结合减少可能归因于这些细胞中USF-1的丰度较低,我们试图确定HBX下调USF-1的分子机制。使用MethPrimer检测USF-1基因的启动子区域(nt-1000到+ 40),发现在nt -745和- 491之间存在CpG岛(图。gydF4y2Ba4gydF4y2Baa),我们推测hbx诱导的USF-1启动子的高甲基化可能是导致USF-1基因表达缺失的原因。为了证实这一假设,用5-Aza-2 ' -脱氧胞苷处理表达hbx的Huh7细胞,观察到相对于未处理的细胞,USF-1和C9转录本的强烈上调(图。gydF4y2Ba4gydF4y2Bab).正如预期的那样,在TSA处理的细胞中没有发现USF-1表达的变化(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。我们还在表达hbx的Huh7细胞中检测了DNMT3A的表达水平,DNMT3A催化了CpG二核苷酸胞嘧啶残基的甲基加成。我们的结果表明,与载体对照相比,在Huh7细胞中,HBX表达后DNMT3A表达显著增强(图2)。gydF4y2Ba4gydF4y2Bac).此外,我们通过亚硫酸氢盐测序评估了存在或不存在HBX时USF-1启动子的DNA甲基化模式。在表达hbx的Huh7细胞中,USF-1启动子甲基化的频率(~ 67%)明显高于对照细胞(~ 23%)(图2)。gydF4y2Ba4gydF4y2Bad).综上所述,这些数据表明HBX诱导USF-1启动子上的CpG甲基化,导致USF-1下调,并限制其与C9启动子的结合,从而抑制C9表达。gydF4y2Ba
HBX通过USF-1启动子的高甲基化来限制USF-1对C9转录的可用性。gydF4y2Ba一个gydF4y2Ba利用Methprimer在线软件预测USF-1启动子的CpG岛。gydF4y2BabgydF4y2BaDNA甲基化抑制剂5-aza-2 ' -脱氧胞苷(5 μM)转染HBx的Huh7细胞中USF1和C9的相对表达。gydF4y2BacgydF4y2Bahbx表达质粒和空载体转染Huh7细胞DNMT3A的相对表达。gydF4y2BadgydF4y2Ba在转染hbx表达质粒和空载体的Huh7细胞中USF-1启动子上CpG二核苷酸的示意图。横线表示单个克隆的测序结果,纵线表示各个CpG位点。开圈代表未甲基化胞嘧啶,闭圈代表甲基化胞嘧啶。计算并比较HBx和空载体转染Huh7细胞USF-1启动子中甲基化CpGs的百分比。数值以平均值±标准差表示。配对gydF4y2BatgydF4y2Ba进行配对组比较试验。**gydF4y2BapgydF4y2Ba< 0.005, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
CHB患者血清对hbv转染Huh7细胞MAC形成的抑制作用及细胞裂解受损gydF4y2Ba
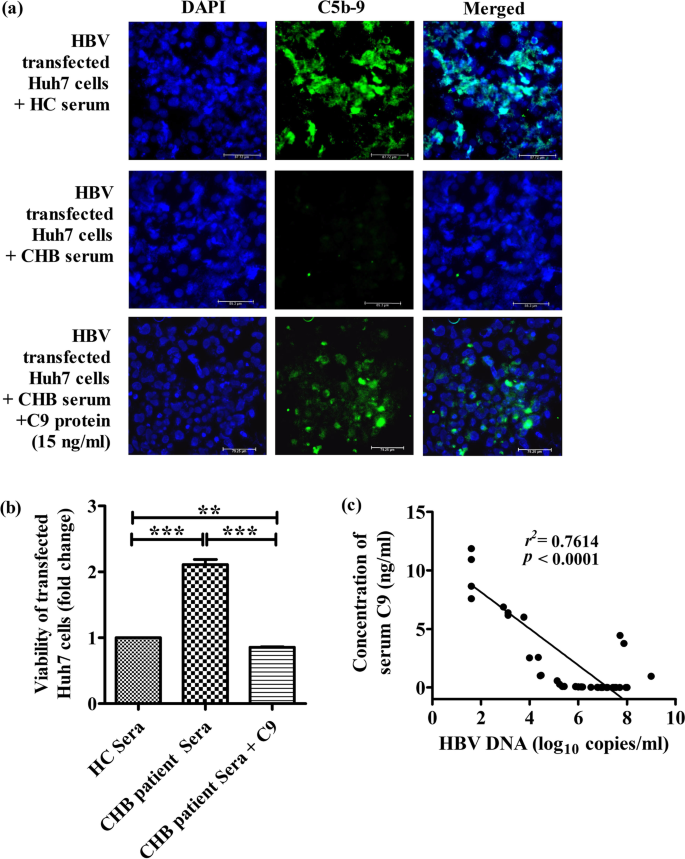
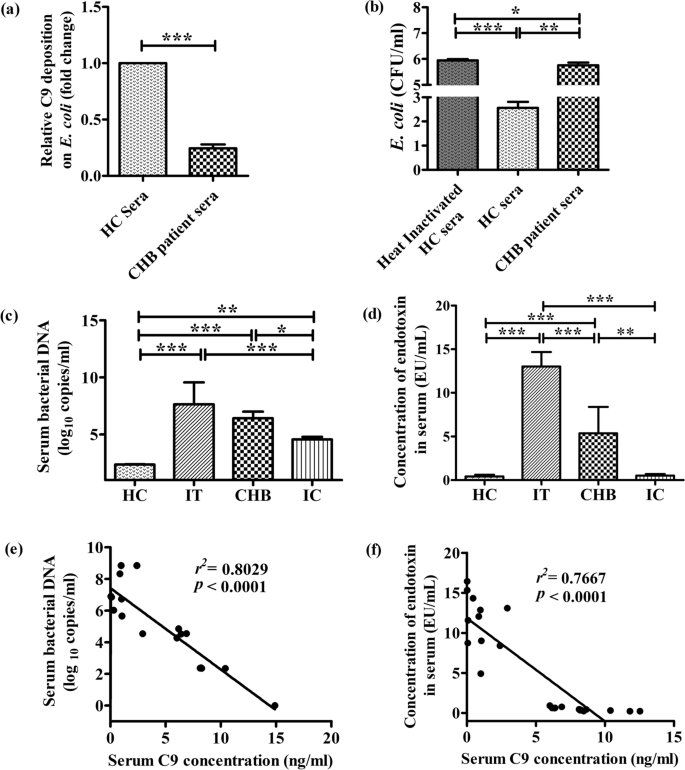
通过将hbv转染的Huh7细胞与CHB患者和HC的血清孵育,我们研究了C9缺乏对MAC复合物组装及其溶解功能的影响,这些血清作为补体成分的来源。使用抗c5b -9抗体荧光成像评估MAC在Huh7细胞上的定位。在HC血清处理的hbv转染Huh7细胞中,C5b-9沉积广泛存在,而在C9浓度降低的CHB患者血清培养的细胞中,C5b-9沉积稀疏或可忽略不计(图2)。gydF4y2Ba5gydF4y2Baa).与MAC形成的模式一致,来自CHB患者的血清引起细胞裂解的效果也要低得多,这从MTT试验中观察到的细胞活力的增加与HC血清相比,后者可以诱导明显的裂解,从而降低转染细胞的活力(图。gydF4y2Ba5gydF4y2Bab).此外,体外在CHB患者血清中补充低剂量的15 ng/ml C9蛋白可显著增强(~ 71%)这些细胞的MAC积累(图2)。gydF4y2Ba5gydF4y2Baa)以及细胞活力的显著下降(~ 2.5倍)(图。gydF4y2Ba5gydF4y2Bab),强化C9在MAC生成和活动中的关键作用。gydF4y2Ba
补充C9后,CHB血清减少的MAC形成和Huh7细胞裂解被逆转。gydF4y2Ba一个gydF4y2Ba具有代表性的×40放大免疫荧光图像显示HBV转染的Huh7细胞经HC和CHB患者血清以及补充C9蛋白的CHB血清处理后形成MAC (C5b-9,绿色)。细胞核用DAPI反染色(蓝色)。gydF4y2BabgydF4y2BaMTT法检测HBV转染Huh7细胞与HC血清、CHB血清和C9补充的CHB血清孵育后的活力。吸光度读数为三次实验的平均值。gydF4y2BacgydF4y2Ba慢性HBV感染者血清C9浓度与HBV- dna水平的相关性分析(b)采用单因素方差分析+ Tukey多元比较。**gydF4y2BapgydF4y2Ba< 0.005, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
hbv感染者血清C9浓度降低与HBV-DNA升高相关gydF4y2Ba
我们研究了慢性hbv感染者在IT期、EP-/EN-CHB期和IC期血清C9浓度与病毒载量的关系。血清C9与HBV-DNA水平呈显著负相关(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.7614,gydF4y2BapgydF4y2Ba< 0.0001)(图gydF4y2Ba5gydF4y2Bac),如IT/CHB中C9较低的患者HBV滴度较高,而IC中C9较高的患者HBV滴度明显降低。因此,我们有理由认为病毒表面或感染细胞上MAC的形成及其随后的裂解在降低HBV负荷中起重要作用。gydF4y2Ba
慢性乙型肝炎患者血清C9缺乏对细菌杀灭能力的损害gydF4y2Ba
已有文献表明,C9的聚合对MAC孔杀灭细菌很重要[gydF4y2Ba4gydF4y2Ba].在证明慢性hbv感染患者C9下调后,我们首先研究了C9在细胞表面的沉积水平gydF4y2Ba大肠杆菌gydF4y2Ba用CHB或HC患者血清培养细菌细胞,用抗c9抗体检测。观察到C9沉积在gydF4y2Ba大肠杆菌gydF4y2BaCHB血清比HC低约4倍(图;gydF4y2Ba6gydF4y2Baa).接下来,我们通过计数培养液处理后琼脂板上生长的菌落来检测mac介导的细菌杀灭状态gydF4y2Ba大肠杆菌gydF4y2Ba.治疗gydF4y2Ba大肠杆菌gydF4y2Ba以热灭活HC血清为阴性对照。CFU计数显示HC血清清除率达99%gydF4y2BaE .coligydF4y2Ba而c9缺陷CHB的细菌清除率显著降低,其中只有~ 35%的细菌清除率gydF4y2Ba大肠杆菌gydF4y2Ba被清除(图;gydF4y2Ba6gydF4y2Bab).因此,细菌存活率的提高可以归因于C9有效性的降低和其表面MAC形成的限制。gydF4y2Ba
慢性乙型肝炎患者血清中MAC介导的细菌杀灭的损害。gydF4y2Ba一个gydF4y2BaC9沉积在gydF4y2Ba大肠杆菌gydF4y2BaCHB患者血清与HC患者血清进行比较。gydF4y2BabgydF4y2BaCFU计数gydF4y2Ba大肠杆菌gydF4y2Ba用HC血清、C9缺陷CHB血清或热灭活HC血清处理后,在37°C下培养16 h。的决心gydF4y2BacgydF4y2BaReal-time PCR检测细菌dnagydF4y2BadgydF4y2BaELISA检测IT、CHB(包括EP-和EN-CHB)、IC和HC血清内毒素浓度。血清C9水平与gydF4y2BaegydF4y2Ba细菌DNA和gydF4y2BafgydF4y2Ba研究对象的内毒素滴度。配对gydF4y2BatgydF4y2Ba测试在gydF4y2Ba一个gydF4y2Ba.(b)-(d)采用单向方差分析和Tukey多重比较。*gydF4y2BapgydF4y2Ba< 0.05, **gydF4y2BapgydF4y2Ba< 0.005, ***gydF4y2BapgydF4y2Ba< 0.0001gydF4y2Ba
hbv感染者血清细菌载量和内毒素水平与C9浓度呈负相关gydF4y2Ba
为了评估C9缺陷CHB血清杀菌活性降低的体外观察在体内的相关性,我们采用实时荧光定量PCR,使用针对细菌16s rRNA基因的引物,对慢性hbv感染患者IT期、EP-/EN-CHB期和IC期血清中的细菌dna进行了定量。在所有研究对象中都检测到了血清细菌dna,尽管各组之间的浓度差异很大。IT和EP-/EN-CHB的细菌dna明显高于IC和HC(图2)。gydF4y2Ba6gydF4y2Bac).然而,IC比HC含有更多的细菌dna。此外,IT患者血清内毒素浓度较高,其次是CHB,而IC和HC患者血清内毒素滴度较低(图2)。gydF4y2Ba6gydF4y2Bad). C9浓度与血清细菌dna负荷呈明显的负相关(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.8029;gydF4y2BapgydF4y2Ba< 0.0001)以及内毒素水平(gydF4y2BargydF4y2Ba2gydF4y2Ba= 0.7667;gydF4y2BapgydF4y2Ba< 0.0001)。gydF4y2Ba6gydF4y2Bae, f).这些发现使我们推测C9水平的降低与循环细菌- dna和内毒素的高发密切相关,这可能有助于慢性hbv感染患者晚期肝病的发展。gydF4y2Ba
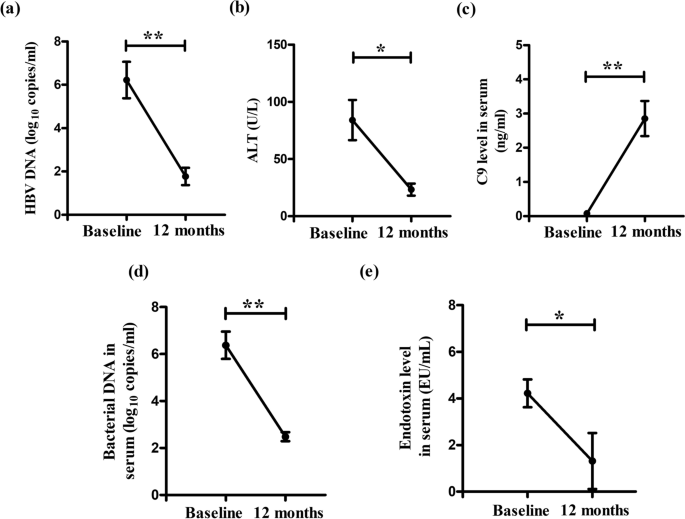
替诺福韦治疗CHB患者血清C9水平的改善和病毒/细菌/内毒素负荷的下降gydF4y2Ba
替诺福韦被推荐作为慢性乙型肝炎患者的一线单药治疗[gydF4y2Ba2gydF4y2Ba我们测定了10例CHB患者(包括6例EP-CHB和4例EN-CHB) 1年替诺福韦治疗对血清C9水平的影响。我们观察到,治疗后,所有患者HBV-DNA达到< 250拷贝/ml, ALT恢复正常(图2)。gydF4y2Ba7gydF4y2Baa, b),与治疗前相比,血清C9浓度显著升高,细菌dna和内毒素负荷显著降低(图。gydF4y2Ba7gydF4y2Ba一部)。gydF4y2Ba
讨论gydF4y2Ba
HBV特异性地感染作为补体合成主要位点的肝细胞。HBV感染的慢性性提出了一个重要的问题,即HBV如何在CHI过程中破坏补体介导的失活。此前有研究报道HBV通过上调肝癌细胞中的补体调节蛋白CD59来限制MAC功能组装和补体依赖的细胞毒性[gydF4y2Ba18gydF4y2Ba].然而,在本研究中,我们发现了HBV通过直接靶向MAC的成分来干扰MAC形成的一种新机制。我们证明HBX通过阻碍USF-1的可用性来减弱MAC的主要成分C9的表达,而USF-1对C9的转录至关重要。hbx诱导的DNMT活性上调可能与USF-1启动子区CpG岛的异常高甲基化有关,从而使USF-1转录沉默。USF-1表达的缺失和其转录活性的降低阻碍了C9的产生,进而损害了MAC的形成和抗菌功能,导致HBV持续存在和高病毒血症,以及慢性HBV感染患者的细菌感染和内毒素水平的高发,这可能会影响疾病的病理生理。这些发现将有助于全面了解HBV疾病生物学以及在CHI期间HBV进化和持续的机制,这将指导治疗方法和疫苗的设计,以恢复通常的补体活动,并促进有效的HBV控制和疾病管理。gydF4y2Ba
为了了解HBV对不同MAC成分(C5b/C6/C7/C8/C9)表达的影响,我们用全长HBV转染Huh7细胞和感染的HepG2细胞gydF4y2BahNTCPgydF4y2BaHepG2.2.15细胞HBV颗粒。在两种情况下,观察到C9表达显著减少,而其他MAC成分保持不变。此外,转染表达单个病毒蛋白的质粒表明HBX可以有效抑制C9的表达。C9的抑制程度也随着HBX表达量的增加而增加,这表明HBX以剂量依赖的方式降低了C9的转录活性。C9 mRNA水平的变化也与蛋白表达相对应。不同的研究表明,HBX能够通过与几种不同的tf直接相互作用对病毒和细胞基因进行转激活和转抑制,或者可能通过表观遗传修饰调节靶基因的转录活性[gydF4y2Ba16gydF4y2Ba].研究发现,用5-Aza-2 ' -脱氧胞苷处理hbx转染的细胞,而不是用TSA处理,可以恢复C9的表达,这表明C9的沉默是甲基化依赖的。我们进一步观察到HBX可以抑制c9启动子的激活,这促使我们在c9启动子中寻找CpG岛,假设HBX诱导的CpG位点的高甲基化事件可能导致启动子活性降低,从而无法转录下游基因。然而,c9启动子中CpG岛的缺失导致我们探索了另一种可能性,即与c9启动子结合的tf的可用性或活性的变化可能与hbx转染细胞中c9启动子活性的降低有关。我们通过硅晶分析确定了碱基-螺旋-环-螺旋亮氨酸拉链TF, USF-1作为C9基因表达的关键调节因子,并且在表达hbx的Huh7细胞中发现内源性USF-1的丰度显著降低。此外,过表达USF-1能够挽救HBX对C9启动子激活和表达的抑制作用。通过突变C9启动子上的E-box基序和ChIP实验,我们证实USF-1结合E-box在诱导C9转录中起着关键作用。我们进一步阐明了HBX改变USF-1表达的分子机制。研究指出,用5-Aza-2’-脱氧胞苷处理可以适度增强hbx转染细胞中USF-1的转录,同时伴有C9表达的增加,这意味着hbx诱导的DNA高甲基化与USF-1的转录抑制有关。Park等人gydF4y2Ba.gydF4y2Ba[gydF4y2Ba19gydF4y2Ba]已经证明HBX的表达可以通过诱导人肝细胞系DNMT1和DNMT3A来提高细胞内DNMT的整体活性,并产生异常的DNA甲基化模式。与这些发现一致,我们还观察到DNMT3A的高表达,DNMT3A在hbx转染的细胞中起新生甲基转移酶的作用。此外,在USF-1基因的内源性启动子区检测到局部的CpG重复序列,而亚硫酸氢盐测序显示,在hbx转染的Huh7细胞中,这些CpG位点广泛甲基化。这些和上面提到的结果强调了这样一个概念,即在CHI过程中C9的主要下降是由于hbx诱导的异常USF-1启动子甲基化导致转录因子USF-1的表达下调。这导致USF-1与C9启动子E-box元件的结合显著减少,从而降低C9表达。gydF4y2Ba
结合体外实验,我们还研究了慢性hbv感染患者在不同病程中的血清C9水平。与IC相比,以HBV-DNA高水平为特征的IT期和EP-/EN-CHB期患者血清C9缺乏最为明显,病毒载量较低,研究对象C9浓度与病毒载量呈强负相关。这表明慢性hbv感染患者依赖C9和MAC来降低病毒滴度。据报道,在寨卡病毒感染的情况下,病毒表面MAC的形成和补体介导的裂解对减少病毒RNA至关重要[gydF4y2Ba20.gydF4y2Ba].此外,C9耗尽的CHB血清也显示出较弱的抗菌作用,这从hbv转染的Huh7细胞的MAC形成减少和更大的细胞活力以及在这些细胞与CHB血清孵育后对细菌细胞的低效杀伤中得到证明。然而,用纯化的C9蛋白重建CHB血清可逆转这些作用。以前有文献记载hbv感染患者合并感染gydF4y2Ba大肠杆菌,金黄色葡萄球菌gydF4y2Ba,gydF4y2Ba铜绿假单胞菌gydF4y2Ba而且gydF4y2Bak .肺炎gydF4y2Ba与病毒载量低的患者相比,HBV-DNA高的患者伴有细菌感染的几率要高得多[gydF4y2Ba10gydF4y2Ba].根据这一观察,我们还注意到在高病毒载量的IT和CHB患者中细菌dna和内毒素的显著升高,这可能归因于这些患者中C9表达的严重缺失,而HBX表达的增强又加剧了这种缺失。细菌产物被肝细胞上的toll样和nod样受体识别,如库普弗细胞、肝星状细胞和固有层,启动和维持炎症级联,从而导致肝损伤[gydF4y2Ba21gydF4y2Ba].一项研究检测了来自HCC患者和各种病因肝硬化(包括HBV和HCV感染)患者的肝组织样本的mRNA表达谱,报道C9下调可被认为是癌前肝硬化组织中的癌症相关分子标记,并可作为HCC发病的早期诊断标志[gydF4y2Ba22gydF4y2Ba].因此,EP-/EN-CHB和伴有C9缺陷的IT都有发生HCC的风险,而这些患者的高细菌感染和内毒素浓度可能是肝损伤的潜在触发因素。然而,1年的替诺福韦治疗导致CHB患者HBV-DNA显著下降,C9水平改善,并增强了其控制细菌感染的能力。gydF4y2Ba
结论gydF4y2Ba
总之,我们定义了HBV在慢性HBV感染患者中抑制MAC形成及其溶解功能的新机制,特别是在IT期和EP-/EN-CHB期。不仅CHB, it期患者也应考虑早期治疗干预,以限制病毒复制和HBX的表达,并恢复通常的补体活动,以实现持续的病毒控制,降低细菌感染的脆弱性,并最大限度地减少疾病的发病机制。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本研究结论的原始数据将由作者毫无保留地提供给任何合格的研究人员。gydF4y2Ba
缩写gydF4y2Ba
- 乙肝病毒:gydF4y2Ba
-
乙型肝炎病毒gydF4y2Ba
- 气:gydF4y2Ba
-
慢性乙肝病毒感染gydF4y2Ba
- 麦克:gydF4y2Ba
-
膜攻击复杂gydF4y2Ba
- 制备过程:gydF4y2Ba
-
补充C9gydF4y2Ba
- C5:gydF4y2Ba
-
补充C5gydF4y2Ba
- C6:gydF4y2Ba
-
补充C6gydF4y2Ba
- C7:gydF4y2Ba
-
补充C7gydF4y2Ba
- C8A:gydF4y2Ba
-
补足C8 α链gydF4y2Ba
- C8B:gydF4y2Ba
-
补足C8链gydF4y2Ba
- 子:gydF4y2Ba
-
开式阅读架gydF4y2Ba
- HBX:gydF4y2Ba
-
乙型肝炎病毒X蛋白gydF4y2Ba
- 信使rna:gydF4y2Ba
-
信使核糖核酸gydF4y2Ba
- 慢性乙肝:gydF4y2Ba
-
慢性乙型肝炎gydF4y2Ba
- 它:gydF4y2Ba
-
Immune-tolerantgydF4y2Ba
- EP-CHB:gydF4y2Ba
-
HBeAg-positive慢性乙肝gydF4y2Ba
- 集成电路:gydF4y2Ba
-
不活跃的载体gydF4y2Ba
- EN-CHB:gydF4y2Ba
-
HBeAg-negative慢性乙肝gydF4y2Ba
- USF-1:gydF4y2Ba
-
上游转录因子-1gydF4y2Ba
- ATF2:gydF4y2Ba
-
激活转录因子2gydF4y2Ba
- FOXO4:gydF4y2Ba
-
O4、叉头箱gydF4y2Ba
- STAT1β:gydF4y2Ba
-
信号换能器和转录激活因子1- βgydF4y2Ba
- 麻生太郎:gydF4y2Ba
-
反义寡核苷酸gydF4y2Ba
- 肝细胞癌:gydF4y2Ba
-
肝细胞癌gydF4y2Ba
- 表面:gydF4y2Ba
-
乙型肝炎表面抗原gydF4y2Ba
- 国家:gydF4y2Ba
-
乙型肝炎核心蛋白gydF4y2Ba
- e抗原:gydF4y2Ba
-
乙型肝炎e抗原gydF4y2Ba
- HBV-P:gydF4y2Ba
-
乙型肝炎聚合酶gydF4y2Ba
- 艾滋病毒:gydF4y2Ba
-
人类免疫缺陷病毒gydF4y2Ba
- HC:gydF4y2Ba
-
健康的人gydF4y2Ba
- 芯片:gydF4y2Ba
-
染色质免疫沉淀反应gydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-Diamidino-2-phenylindolegydF4y2Ba
- 环境影响评价:gydF4y2Ba
-
酶免疫分析法gydF4y2Ba
- 合:gydF4y2Ba
-
辣根过氧化物酶gydF4y2Ba
- 核糖体rna:gydF4y2Ba
-
核糖体核糖核酸gydF4y2Ba
- 聚合酶链反应:gydF4y2Ba
-
聚合酶链反应gydF4y2Ba
- ELISA:gydF4y2Ba
-
酶联免疫测定gydF4y2Ba
- DNMT:gydF4y2Ba
-
DNA甲基转移酶gydF4y2Ba
- 菌落:gydF4y2Ba
-
菌落形成单位gydF4y2Ba
- ALT:gydF4y2Ba
-
丙氨酸转氨酶gydF4y2Ba
- TF:gydF4y2Ba
-
转录因子gydF4y2Ba
- E-box:gydF4y2Ba
-
剂盒gydF4y2Ba
- 合:gydF4y2Ba
-
辣根过氧化物酶gydF4y2Ba
- DAPI:gydF4y2Ba
-
4, 6-Diamidino-2-phenylindolegydF4y2Ba
- SD:gydF4y2Ba
-
标准偏差gydF4y2Ba
- 方差分析:gydF4y2Ba
-
方差分析gydF4y2Ba
参考文献gydF4y2Ba
Rizzetto M, Ciancio A.慢性hbv相关肝病。医学杂志2008;29:72-84。gydF4y2Ba
马宏斌,李志刚,李志刚。慢性乙型肝炎免疫应答失败的分子基础:治疗意义。中华肝病杂志,2010;52:616-9。gydF4y2Ba
邓克尔伯格,宋wc。补体及其在先天和适应性免疫反应中的作用。单元格号2010;20:34-50。gydF4y2Ba
杜杜因DJ, Heesterbeek DAC, Ruyken M, Haas C, Stapels D, Aerts P,等。C9的聚合增强了膜攻击复杂孔对细菌包膜的损伤和杀伤。公共科学学报。2021;17:e1010051。gydF4y2Ba
瑞克林D, Hajishengallis G,杨K, Lambris JD。补体:免疫监测和稳态的关键系统。中华免疫杂志2010;11:785-97。gydF4y2Ba
王晓明,李志强,王晓明,等。病毒互补逃避策略研究进展。前沿微生物,2017;8:1117。gydF4y2Ba
于强,于锐,秦霞。HIV-1感染中补体激活的正邪。细胞免疫杂志2010;7:334-40。gydF4y2Ba
Kim H, Meyer K, biseglie AMD, Ray R.丙型肝炎病毒抑制C9补体合成并损害膜攻击复合物功能。中国病毒学杂志,2013;87:5858-67。gydF4y2Ba
朱超,宋华,徐峰,易伟,刘峰,刘霞。乙型肝炎病毒在体内外抑制补体C3和C4的表达Oncol Lett, 2018; 15:7459-63。gydF4y2Ba
李伟,金锐,陈萍,赵刚,李娜,吴慧。HBV感染与并发细菌感染的临床相关性研究。科学通报2015;5:15413。gydF4y2Ba
Günther S, Li BC, Miska S, Krüger DH, Meisel H, Will H.一种高效扩增乙型肝炎病毒全基因组的新方法,允许快速功能分析并揭示免疫抑制患者的缺失突变。中国病毒学杂志,1995;69(9):5437-44。gydF4y2Ba
高希A,高希A, Datta S, Dasgupta D, Das S, Ray S,等。肝miR-126是检测乙型肝炎病毒感染的肝细胞癌的潜在血浆生物标志物。国际癌症杂志。2016;138:2732-44。gydF4y2Ba
毛荣,董敏,沈震,张华,刘勇,蔡东,等。RNA解旋酶DDX17通过阻断病毒前基因组RNA封装抑制乙型肝炎病毒复制。中国病毒学杂志,2021;95(19):e0044421。gydF4y2Ba
Li LC, Dahiya R. MethPrimer:甲基化pcr引物设计。生物信息学。2002;18:1427-31。gydF4y2Ba
左勇,谢伟,庞勇,李涛,李强,李勇。16S rRNA基因焦糖测序技术研究日本Lampetra肠道内容物中细菌群落组成。PLoS ONE。2017; 12 (12): e0188919。gydF4y2Ba
田勇,杨伟,宋军,吴勇,倪斌。乙型肝炎病毒X蛋白诱导的异常表观遗传修饰对人肝细胞癌发病机制的影响。分子生物学杂志,2013;33(15):2810-6。gydF4y2Ba
Calomme C, Nguyen TLA, Launoit Y, Kiermer V, Droogmans L, Burny A.牛白血病病毒长末端重复序列R区E box motif上游刺激因子刺激病毒基因表达。生物化学学报。2002;27:875 - 89。gydF4y2Ba
单春,张松,崔伟,游旭,孔刚,杜勇,等。乙型肝炎病毒X蛋白激活CD59参与DNA结合和let-7i保护肝癌和肝细胞免受补体攻击。致癌作用。2011;32:1190-7。gydF4y2Ba
朴永勇,孙伯辉,俞娥,徐东哲,郑永华,李俊华,等。乙型肝炎病毒X蛋白诱导肝癌发生的异常表观遗传修饰。胃肠病学。2007;132:1476 - 94。gydF4y2Ba
Schiela B, Bernklau S, Malekshahi Z, Deutschmann D, Koske I, Banki Z,等。活性人体补体通过形成膜攻击复合物减少寨卡病毒载量。前沿免疫。2018;9:2177。gydF4y2Ba
元SM,朴e,郑俊杰,Ganesan R, Gupta H, Gebru YA,等。慢性肝病中肠道菌群衍生的免疫反应国际分子生物学杂志,2021;gydF4y2Ba
金继伟,叶强,陈勇,陈勇,孙文杰,等。肝硬化患者组织样本中的癌症相关分子特征。肝脏病学。2004;39:518-27。gydF4y2Ba
确认gydF4y2Ba
我们感谢所有为这项研究捐献血液和肝脏组织的参与者。感谢Marie-Dominique Galibert教授为我们提供pCMV-USF1质粒,以及Pradip Sen博士在Galibert教授的允许下为我们提供质粒。这项工作的一部分在2021年国际HBV会议“乙型和丁型肝炎病毒生物学”上发表。我们感谢多学科研究单位,I.P.G.M.E & r。,Kolkata funded by Department of Health Research, Ministry of Health & Family Welfare, Government of India (No. V.25011/85/2014-HR(Pt.I) for providing the ELISA and imaging facility.
资金gydF4y2Ba
该研究得到了印度政府卫生研究部印度医学研究委员会(ICMR)的资助(项目编号:梵尔/ 10/2020 / ECD-1)。AB和SM由印度政府印度医学研究委员会研究奖学金资助(文件号分别为2019-6905/CMB/BMS和3/1/3/JRF-2020/HRD-LS/133146/16)。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
AB、AC和SD参与研究概念和设计。AB、MK、RKM、SG、SM分别进行了不同的测定和实验。BCC和AB进行免疫荧光图像采集和分析。AB和SD参与数据的分析和解释。SMA和AC负责检查患者的临床参数,并协助患者招募程序,而SB则提供物质支持。SD和AB起草了手稿,MK, RKM和SB帮助进行了批判性的修改。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
该研究得到了印度加尔各答研究生医学教育与研究研究所(I.P.G.M.E&R)伦理审查委员会的批准。在纳入研究之前,从每个参与者或未成年人的父母或法定监护人那里获得书面知情同意。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
没有利益冲突需要声明。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。gydF4y2Ba
表S1。gydF4y2Ba用于HBV扩增、测序和克隆的引物列表。gydF4y2Ba表S2。gydF4y2Ba针对宿主基因和启动子的引物和寡核苷酸列表。gydF4y2Ba表S3。gydF4y2Ba研究对象的临床、人口学、生化资料。gydF4y2Ba无花果S1。gydF4y2Ba经组蛋白去乙酰化抑制剂Trichostatin A (0.1μM)处理的HBx转染Huh7细胞中USF-1 mRNA的相对表达。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
拜迪亚,A.,卡顿,M.,蒙达尔,R.K.gydF4y2Baet al。gydF4y2Ba乙型肝炎病毒通过限制转录因子USF-1的可用性来抑制补体C9的合成,并抑制膜攻击复合物的形成:在疾病发病机制中的意义gydF4y2Ba生物科学gydF4y2Ba29gydF4y2Ba, 97(2022)。https://doi.org/10.1186/s12929-022-00876-1gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12929-022-00876-1gydF4y2Ba
关键字gydF4y2Ba
- 补充C9gydF4y2Ba
- HBXgydF4y2Ba
- USF-1gydF4y2Ba
- 启动子甲基化gydF4y2Ba
- 膜攻击复合体gydF4y2Ba