摘要
转移是癌症患者死亡的主要原因。癌细胞传播的两个主要途径是血液和淋巴系统。在过去的几十年里,血行转移的潜在机制已经被很好地描述。然而,我们对淋巴转移的分子基础的理解仍然处于不成熟的阶段。从概念上讲,癌细胞侵入毛细淋巴管,被动移动到聚集淋巴管,迁移到前哨淋巴结(SLN;,癌细胞从原发肿瘤扩散到的第一个淋巴结),并通过锁骨下静脉进入血液循环系统。在到达之前,癌细胞释放特定的可溶性因子来调节SLN中的微环境,以建立成功定植的滩头阵地。癌细胞定植后,通过诱导调节性T细胞和骨髓源性抑制细胞的募集,抑制树突状细胞和CD8的功能,从而抑制抗肿瘤免疫+T细胞,促进免疫抑制细胞因子的释放。逆转癌细胞引发的SLN重塑的新策略的发展可能会重新激活免疫以减少滩头积聚和远处转移。SLN除了是转移的微观解剖位置外,也是免疫调节的重要位点。基于纳米技术的靶向淋巴结抗体或药物偶联纳米颗粒在现场杀死癌细胞的方法是癌症治疗的一个新方向。相反,通过促进淋巴结抗原提呈来诱导更强的免疫,为增强免疫检查点疗法和癌症疫苗的疗效提供了另一种途径。本文综述了近年来在淋巴侵袭过程中SLN的重编程,并探讨了靶向SLN抑制肿瘤转移和诱导抗肿瘤免疫的可能性。
简介
癌细胞是在异质环境中生长的高度增殖细胞。当肿瘤生长到一定大小时,癌细胞面临氧气/营养供应和代谢废物积累的问题。从原发肿瘤中逃逸(称为转移)是癌细胞对抗有害微环境的一种选择压力或优势。转移是保证癌细胞持续生长的生物过程。它在很大程度上仍然无法治愈,是高达90%的癌症相关死亡的原因。肿瘤细胞的侵袭-转移级联过程主要由以下几个过程调控:(1)侵袭含丰富基质细胞和致密细胞外基质的周围组织;(2)通过静脉滴入循环系统,包括血液或淋巴系统;(3)在循环中存活并向远处器官移动;(4)血管外渗定植;(5)建立微转移,在殖民点建立滩头阵地; and (6) expansion in the new microenvironment to generate a secondary tumor.
转移通过血液和淋巴管传播
癌细胞主要通过血液和淋巴系统传播。淋巴系统不仅是将间质液收集到血液中的循环系统[1],还可以作为免疫防御屏障,以确保返回循环的淋巴液的清洁。终末淋巴管是没有周细胞覆盖的薄壁毛细血管,癌细胞更容易穿透。有人提出,大约95%被癌细胞侵袭的肿瘤周围血管是淋巴管[2,3.].淋巴血管系统包括淋巴内皮细胞(LECs),表达分子标记,包括淋巴管内皮受体1 (LYVE-1),普洛斯彼罗同源异体盒蛋白1 (PROX1), podoplanin (PDPN),血管内皮生长因子受体3 (VEGFR-3),神经蛋白酶2 (NRP-2)和C-C基序趋化因子配体21 (CCL21)。癌细胞释放的血管内皮生长因子- a (VEGF-A)、-C、-D刺激肿瘤周围淋巴管生长,促进癌细胞侵入附近淋巴结(称为前哨淋巴结,SLN),增强肿瘤转移[4,5,6,7].越来越多的证据表明,vegfr -3介导的LECs激活是诱导淋巴转移的关键步骤[8].然而,其他因素,如淋巴流速、肿瘤细胞上表达的表面受体和从LECs释放的趋化因子也会影响癌细胞进入淋巴管[9,10,11].这些因素可能共同作用促进淋巴转移。
淋巴结侵犯在肿瘤转移中的重要性——这个问题仍然存在争议
动物研究有力地支持了淋巴管生成和淋巴结侵袭在肿瘤转移中的作用。过表达vegf - c的乳腺癌细胞原位移植裸鼠瘤内淋巴管生成增加,并显著促进肿瘤向区域淋巴结和肺转移[12,13].同样,VEGF-A也被观察到触发SLN淋巴管生成和淋巴转移,以增强肿瘤扩散[14,15].其他淋巴管生成因子如VEGF-D、血小板衍生生长因子- bb和成纤维细胞生长因子-2的异位表达也诱导了不同癌症模型的转移[16,17,18].在临床环境中,SLN中的微转移是与皮肤黑色素瘤远处无转移生存期和总生存期降低相关的关键因素[19].Leiter等人还表明,原发性黑色素瘤中SLN的解剖减少了远处转移[20.].SLN的免疫和间质特征评分预测乳腺癌患者的远处转移[21].此外,淋巴结转移增加了甲状腺癌远处转移的发生率(危险比= 3.495)[22].通过研究特定DNA区域的体细胞变异来解决淋巴和远处转移的起源,Naxerova等人证明36%的远处转移发生于结直肠癌的淋巴结[23].同样,系统发育研究也显示25%的远处转移瘤来自淋巴结转移[24].最近的一项研究清楚地表明,癌细胞在淋巴结的定植引发了慢性干扰素信号,并引发了抗原特异性免疫耐受,以促进远处转移[25].然而,一些临床干预研究表明,预防性LN切除并不能提高黑色素瘤的总生存率[26]、甲状腺癌[27],以及乳癌[28].一项随机试验的长期随访表明,局限性淋巴结转移、远处转移与患者的生存并没有很强的相关性[29].此外,淋巴结阴性结直肠癌患者肺转移发生率较高[30.].相反,一项针对早期子宫内膜癌的前瞻性多中心研究表明,SLN活检为定制辅助治疗提供了重要信息[31].SLN活检仍然是涎腺肿瘤患者临床管理的关键程序[32].值得注意的是,在某些类型的人类癌症中,淋巴结阳性患者的临床结果往往比淋巴结阴性患者差。例如,在临床IIB期和IIC期黑色素瘤患者中,SLN状态是最重要的预后因素,SLN阳性受累率与远处无复发生存率和疾病特异性生存率的降低密切相关[33].在2086例黑色素瘤患者的回顾性队列研究中也发现了类似的结果[34].此外,一项纳入8562例患者的国家队列研究也得出结论,SLN状态是IIB/C期黑色素瘤患者的关键预后因素[35].在结肠癌中,淋巴结阳性患者的平均生存期短于淋巴结阴性患者(66个月vs. 89个月)[36].此外,阳性淋巴结的数量影响患者对化疗的反应。淋巴结1-、2-和3-阳性患者接受化疗的平均生存期分别为108、83和54个月。在胰腺癌中,淋巴结阴性患者的中位总生存期长于淋巴结阳性患者(25个月vs. 16个月)[37].在食管癌中,淋巴结阳性且肿瘤位于中下部的患者预后较淋巴结阴性患者差[38].新出现的证据表明,肿瘤转移可能发生在肿瘤发生的非常早期阶段。因此,如果癌细胞已经通过血液和淋巴系统在远处的器官上播下,切除原发肿瘤和SLN可能不会显著提高患者的生存率。如前所述原发肿瘤、淋巴结转移和远处转移的进化关系研究[23,24],大约30-40%的远处转移源于淋巴结转移。许多癌症可能同时通过血液和淋巴系统转移到远处器官,淋巴结转移对远处转移的贡献可能取决于癌症类型。此外,评价淋巴结数量、阳性淋巴结数量、淋巴结微环境特征、淋巴结受累深度等重要因素均影响病理评价结果和临床关联结论。例如,一项对61371名结肠癌患者的系统综述显示,评估手术清扫淋巴结的数量与II期和III期患者的生存期呈正相关[39].SLN中血管生成和淋巴管生成的增强被发现与黑色素瘤患者的远处转移和生存有关[40].此外,SLN中B细胞的数量,无论癌细胞入侵状态如何,也可以预测乳腺癌患者的无病生存[41].因此,淋巴结浸润在诱导远处转移中的重要性值得继续研究。
淋巴结结构
淋巴系统包括一个庞大的淋巴和淋巴毛细血管网络,收集淋巴管,淋巴结和淋巴器官。淋巴,从细胞和组织中流出的液体,包含小分子(矿物质和氨基酸),大分子(蛋白质和脂质)和细胞(受损细胞或免疫细胞)。它从淋巴管,淋巴网络的终端血管,流向一个大的汇集淋巴管,进一步连接到淋巴结,淋巴系统的肾状器官。淋巴结被归类为“次级”淋巴器官,而初级淋巴器官包括胸腺、扁桃体、脾脏和骨髓。全身约有数千个淋巴结由淋巴管相连[42]主要分布在胸部、颈部、骨盆、腋窝和腹股沟区域,并与肠道的血管有关[43].淋巴结的解剖结构分为几个区室。淋巴结的外部部分由皮层(包含b细胞滤泡)和旁皮层(包含t细胞区)组成。结的内部部分是髓质,包括血管、窦和髓索。产生抗体的浆细胞、巨噬细胞和B细胞是髓质的主要细胞类型。皮层旁的高内皮小静脉(HEVs)是淋巴细胞进入淋巴结的主要途径。
SLN被定义为原发肿瘤中第一个有直接淋巴流动的淋巴结,是淋巴转移早期阶段的滩头阵地。临床上,SLN中肿瘤细胞的存在是与癌症进展和患者预后不良相关的预后因素[44,45,46].SLN的生物学特征包括淋巴管生成增强,淋巴流量增加[47],混合动力汽车结构重塑[4,48],骨髓细胞招募增强,效应淋巴细胞减少[49],所有这些都有助于癌细胞进入和存活的转移前微环境的建立。
SLN中免疫细胞的重编程
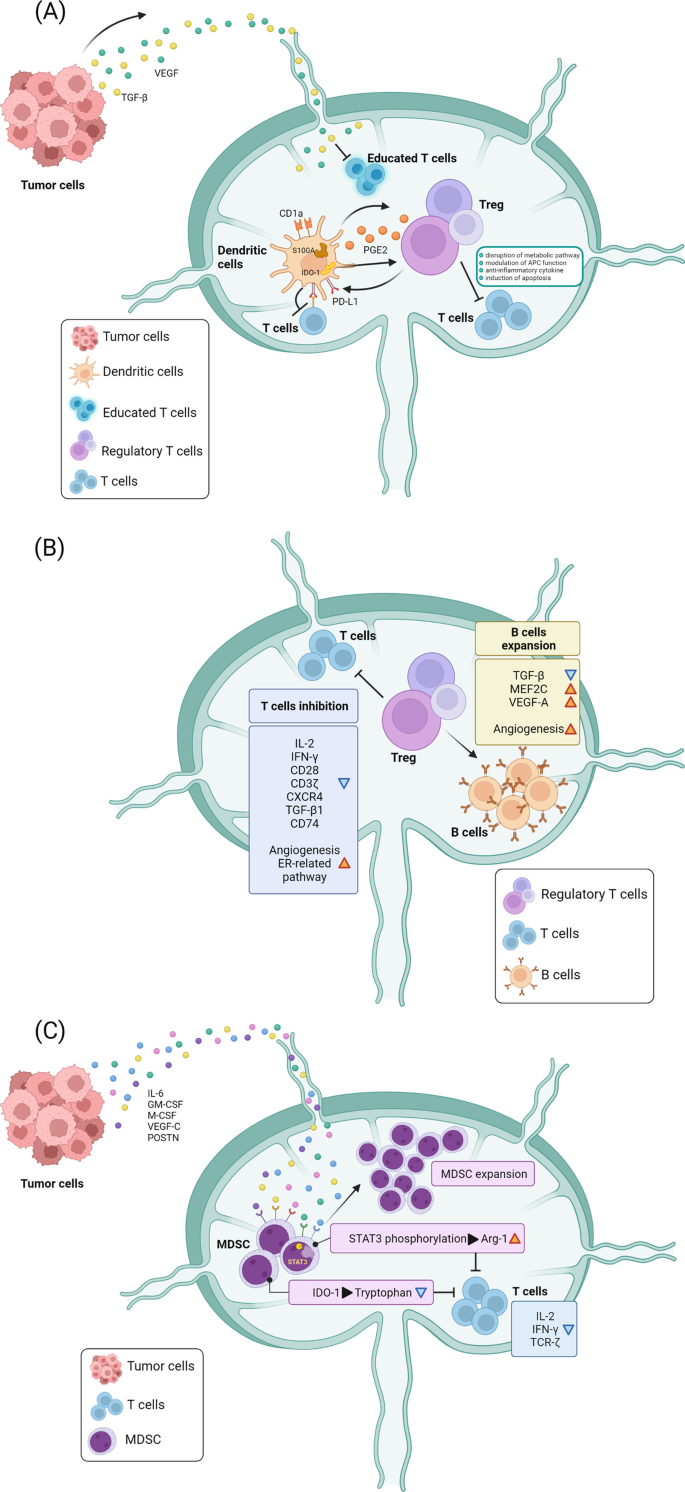
淋巴结中的免疫微环境是由免疫细胞协调的,包括巨噬细胞、树突状细胞(dc)、T细胞、B细胞和非免疫细胞,如成纤维细胞网状细胞(FRCs)、血液内皮细胞(BECs)和LECs。宿主免疫系统攻击癌细胞的关键调节因子之一是dc,高度特化的抗原呈递细胞,在细胞免疫的启动中起着至关重要的作用(图2)。1A).先前的研究表明,在没有DC的情况下,T细胞的抗癌活性会显著减弱[50,51,52,53].在SLN中,dc诱导的t细胞活化被癌细胞通过细胞与细胞的直接接触或癌细胞分泌的因子,如转化生长因子-β (TGF-β)和VEGF显著削弱。Munn和Sharma等人表明,SLN中少量表达吲哚胺2,3-双加氧酶1 (IDO1)的浆细胞样dc能够诱导调节性t细胞(Treg)生成和t细胞无能,这与t细胞对肿瘤抗原的反应降低有关[54,55].Sakakura等人也证明了S100的增加+和CD1a+口腔癌患者SLN中的dc抑制免疫应答[56].此外,有报道称dc可产生环氧化酶-2衍生的前列腺素E2,以促进SLN中treg的积累[46].
SLN在癌症进展中的免疫微环境调节。一个肿瘤细胞来源的可溶性因子包括TGF-β和VEGF损害T细胞和淋巴细胞被DCs激活。COX2和IDO-1在dc中的表达也有助于Treg细胞的扩增,从而直接降低T细胞的活性。Treg细胞刺激一个反馈回路以增强PD-L1在dc上的表达,导致通过PD-1受体对T细胞的免疫抑制。SLN中dc中S100和CD1a的升高也调节dc的抗原提呈。BTreg细胞扩增后,经HEV和淋巴管进入SLN。Treg细胞抑制T细胞活性,降低IL-2、IFN-γ、CD28、CD3-ζ链、CXCR4、TGF-β1、CD74等关键分子抑制T细胞增殖、激活和分化。Treg细胞还可诱导B细胞扩增,增强MEF2C表达,从而改变B细胞的增殖和存活。此外,Treg细胞促进T细胞中的雌激素受体相关通路,促进血管生成和淋巴管生成。(C)MDSCs被招募到SLN,并被远处肿瘤细胞释放的IL-6、GM-CSF、M-CSF、VEGF-C和POSTN等外部信号激活。MDSCs中的STAT3磷酸化刺激Arg-1的产生,与T细胞竞争必需氨基酸并抑制T细胞功能。此外,表达ido -1的MDSCs催化色氨酸向犬尿氨酸的代谢,犬尿氨酸是一种诱导T细胞凋亡的代谢物
淋巴细胞主要通过hev和淋巴管进入淋巴结。之前的一项研究表明,CD4细胞的数量显著下降+T辅助(Th)细胞在黑素瘤晚期临床中的应用[57].头颈部癌症的淋巴细胞浸润减少也有报道[56].此外,口腔癌SLN中的淋巴细胞被发现表达不同的免疫分子,提示这些细胞的表型改变[58].与此同时,另一个重要的亚群是具有免疫抑制作用的CD4+CD25嗨叉头盒P3 (FOXP3+treg(图。1B).在不同癌症患者的肿瘤细胞阳性淋巴结中,这些优势细胞显著升高[59,60].treg抑制CD8的增殖+T细胞和削弱淋巴细胞产生白细胞介素(IL)-2和干扰素(IFN)-γ的能力。原发肿瘤和SLN中T细胞的异质性非常显著。在SLN中只发现了非常少量的扩增T细胞[48,49].此外,CD4+乳腺癌SLN中的T细胞显著减少[61,62].口腔癌也有类似的发现[58].研究发现,SLN中B细胞的积累与淋巴管生成和淋巴流量增加有关,从而有效促进淋巴瘤和实体瘤的扩散[63].癌症患者中B细胞的增加提示了克隆扩增的激活,可能是由于对肿瘤抗原的识别而触发的,提示了B细胞诱导凋亡能力的增强[64,65].
最近,我们进行了单细胞RNA测序,以探索SLN中不同细胞群中基因表达的变化,并确定了SLN中T细胞中改变的分子途径[66].我们的结果显示,血管生成相关基因集在Cd4细胞中显著上调+, Cd8+t细胞和treg。与我们的发现一致,最近的一项研究表明,转移性淋巴结中T细胞、B细胞、dc和自然杀伤细胞(NK)的比例增加[67].有趣的是,N2型中性粒细胞(Cd54低)显著增强。此外,参与促进乳腺癌进展的雌激素反应基因信号在Cd4中升高+SLN中的T细胞。雌激素受体1 (Esr1)是一种直接结合维甲酸受体相关孤核受体γ基因启动子的转录因子,可能抑制Th17细胞的分化和功能[68].此外,Esr1可能抑制滤泡辅助t细胞活化以防止自身免疫[69].我们发现Esr1信号在Cd4细胞中被激活+T细胞表明SLN的免疫受到抑制。利用分子标记数据库进行的基因集富集分析显示,与foxp3介导的Treg转录调控相关的基因集在C7免疫标记中发生了改变,这表明在SLN中Treg的激活增强并产生了免疫抑制环境。Cd4中与增殖(Cxcr4)、极化(Cxcr4、Tgfb1和Cd4)、分化(Cd74和Cd4)相关基因的表达+SLN中的T细胞减少。分化标志物Cd74在Cd8中也被下调+SLN中的T细胞。我们的研究结果还证明了B细胞血管生成途径的增强,这与之前的研究结果一致,即肿瘤相关B细胞通过刺激血管生成促进肿瘤进展[70].在SLN中发现B细胞中肌细胞特异性增强因子2C (Mef2c)增加。Mef2c是促进b细胞增殖和存活的关键转录因子[71,72].此外,该分子在应激条件下通过调节B细胞特异性基因表达来保护B细胞的淋巴生成[73].最后,TGF-β,一种控制B细胞从pre-B细胞向分泌免疫球蛋白浆细胞发育的关键细胞因子[74],在SLN中下调,提示其功能分化受到抑制。
骨髓来源的抑制细胞(MDSCs)也通过在SLN中积累来抑制免疫反应,从而参与增强肿瘤的生长和转移(图。1C).癌细胞分泌IL-6、VEGF、巨噬细胞集束刺激因子(M-CSF)和粒细胞-M-CSF (GM-CSF)促进MDSC扩张并增强其向SLN募集[75,76].MDSCs通过(1)诱导treg的发育和扩大来影响免疫应答[77,78,79];(2)剥夺t细胞生长和分化所必需的氨基酸[80,81];(3)释放氧化分子,包括过氧化氢(H2O2)和过氧亚硝酸盐(ONOO- - - - - -)促进免疫细胞凋亡[82,83],(4)干扰t细胞迁移[84,85].MDSCs通过增加IDO1表达,降低T细胞的免疫反应,并通过产生犬尿氨酸引发T细胞凋亡[86,87].这些研究强调了MDSCs在免疫抑制中的作用,并提示了靶向MDSCs克服免疫逃逸的可能性。巨噬细胞是另一种被认为参与淋巴结转移的髓系细胞。广义上讲,巨噬细胞主要分为M1和M2两类。M1巨噬细胞释放炎性细胞因子,而M2巨噬细胞表现出抗炎活性。肿瘤相关巨噬细胞(TAM)获得M2表型,有助于肿瘤的生长和进展。已有研究表明TAM水平与病理阳性淋巴结显著相关,并与SLN中淋巴管生成增强有关[88].在各种类型的癌症中,一种独特类型的CD169的表达减少+SLN中的巨噬细胞与较差的临床结果相关[89,90,91].综上所述,现有数据表明,SLN中的免疫微环境在癌细胞到达之前就已经得到了调节,重新激活SLN中的抗癌免疫可能会阻止肿瘤转移。
SLN中BECs/ hev的重编程
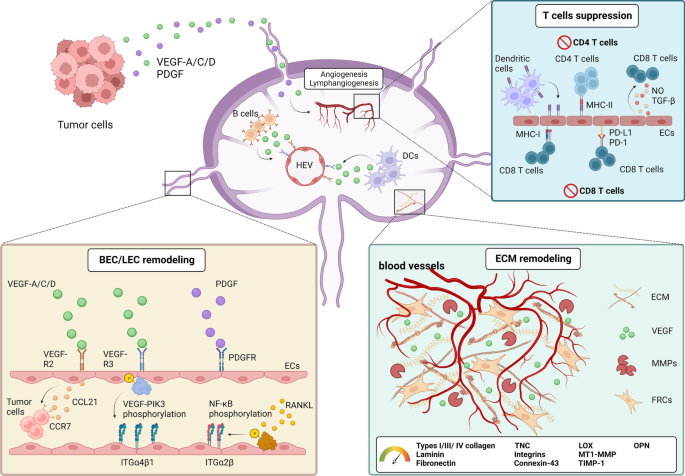
血管内皮在调节氧/代谢物交换和免疫细胞招募到淋巴组织中起着核心作用。哺乳动物淋巴结的血管系统由动脉、毛细血管、毛细血管后小静脉及静脉组成[92].最近,两项对不同小鼠器官的转录组分析揭示了淋巴结中BECs的分子标记,根据它们的位置[93,94].hev是一种特化的毛细血管,具有高表达的外周节点地址蛋白(peripheral node addressin, PNAd)、Ccl21和Cd105 [95,96].这些分子对于淋巴细胞选择性募集到淋巴结很重要。转移性淋巴结中PNAd的缺失已被证明会影响淋巴细胞的归巢[4].淋巴细胞募集到SLN主要通过hev发生,部分来自引流的传入淋巴管。hev的重塑(图;2)在SLN中减少淋巴细胞的募集,促进转移前小生境的建立[97].对人类样本的研究发现,SLN中hev的血管壁厚度减少,血管直径增加[4,98,99].
SLN中内皮细胞在癌症进展过程中的重编程。肿瘤细胞来源的VEGF和PDGF直接激活其在LECs上的特异性受体。信号通过VEGFR-3/PI3K轴诱导ITGα4β1的表达。VEGFR-3的激活也有助于LEC产生CCL21,进一步吸引表达ccr7的肿瘤细胞归巢到SLN。来自肿瘤细胞的PDGF刺激LEC增殖,为肿瘤细胞建立转移前小生境提供了更多的机会。RANKL激活SLN中的LEC可促进ECM重塑,从而触发LEC和BEC的萌发,从而促进肿瘤向次级淋巴器官的转移。B细胞和dc也分泌VEGF-A改造HEV中的BECs,导致血管壁缩小,HEV直径增大,促进肿瘤细胞转移,为SLN中维持肿瘤细胞生长提供营养。从DC获得的MHC II复合物存在于LEC细胞表面,诱导CD4细胞凋亡+T细胞。CD8+T细胞增殖也被表达在LEC上的PD-L1分子抑制。此外,LEC可产生可溶性因子如一氧化氮和TGF-β抑制CD8+T细胞活化
VEGF在刺激BEC增殖中起关键作用。这种血管生成因子不仅是内皮细胞的生存因子,还能刺激内皮细胞降解ECM进行萌发和迁移。因此,SLN BECs的结构和功能改变也会加速淋巴转移(图2)。3.).
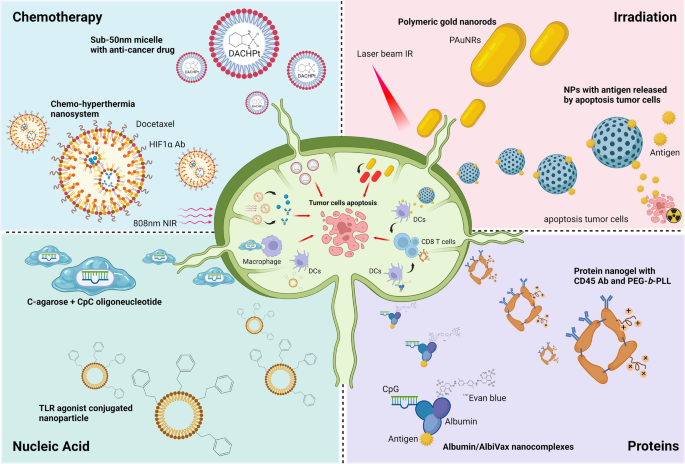
新型ln靶向治疗策略。纳米颗粒已被开发用于杀死肿瘤细胞或重新激活LN中的抗肿瘤活性。对于化疗,808 nm nir触发的纳米系统实现了协同化疗-热疗效应,以消除转移淋巴结中的肿瘤细胞。纳米载体可以将核酸带到淋巴结。经c -琼脂糖修饰的CpG寡脱氧核苷酸对淋巴结窦内的巨噬细胞具有较高的亲和力,并能有效地引发淋巴结内的抗肿瘤免疫反应。TLR激动剂偶联的纳米颗粒激活LN中的DCs并刺激T细胞活性。在放射治疗中,金纳米棒在短期近红外激光照射下可能通过热力学效应促进肿瘤细胞凋亡。IR处理后癌细胞释放的肿瘤抗原可作为货物,由纳米颗粒携带到LN,从而增强dc的抗原提呈,激活T细胞。携带带有CD45抗体包被的IL-15超级激动剂复合物的纳米凝胶可以与CD8结合+T细胞通过IL-15刺激特异性有效地刺激T细胞增殖。另一方面,通过将白蛋白结合疫苗与埃文斯蓝结合,该纳米复合物为疫苗递送和癌症免疫治疗提供了另一种途径
SLN的LECs重编程
LECs被定义为一种特殊的内皮细胞群,包括淋巴结中的淋巴管,由PDPN和LYVE-1忠实地表征,定位于被膜下、皮层和髓窦[One hundred.,101,102].在促淋巴管生成因子中,VEGF-C诱导淋巴管生成的活性最强,而LECs上的VEGFR3是参与肿瘤相关淋巴管生成和淋巴转移的主要受体[102,103].最近,单细胞转录组分析显示,在皮肤引流淋巴结中存在不同亚型的小鼠LECs,提示其功能的复杂性[104].
目前,VEGF-A和VEGF-C是与SLN转移前微环境建立相关的最完整的可溶性因子[5,105].通过VEGF-C-PI3K轴重塑LECs对于肿瘤相关淋巴管生成至关重要。该信号通路增强整合素α4β1在LECs上的表达,吸引表达vcam -1的肿瘤细胞[106].同时,VEGF-C还通过增强淋巴内皮细胞Ccl21的表达,促进Ccr7的进入+癌细胞进入SLN [107].相比之下,淋巴管生成已被发现可增加淋巴流动率,这也加速了淋巴结转移[49,108,109,110].SLN中的LECs也表达了更高水平的核因子受体激活因子kappa-Β (Rank),基质网状细胞通过Rank配体(Rankl)激活LECs,诱导LEC重塑[111].
LECs的功能重编程也影响其免疫调节活性。在生理条件下,LECs可在主要组织相容性复合体(MHC) I类分子上呈递多种外周组织抗原,诱导免疫耐受,调节Cd8+通过程序性死亡蛋白1 (Pd-1)/程序性死亡配体1 (Pd-l1)信号通路的T细胞增殖[112].在SLN中,通过呈递来自淋巴的可溶性肿瘤相关抗原,LECs可以触发Cd8功能障碍+通过调节Pd-1、Cd80和细胞毒性T淋巴细胞相关蛋白4 (Ctla4)的表达增加T细胞凋亡[112].此外,LECs在表面表达MHC I类,导致Cd8的功能改变+T细胞[53,113].此外,LECs可能从DC获得peptide/MHC II复合物,并出现在其细胞表面,引发Cd4细胞凋亡+T细胞[112].此外,LECs可呈递肿瘤抗原,并产生犬尿氨酸、一氧化氮、TGF-β等免疫抑制分子,在SLN中构建免疫抑制微环境[53,112,113,114,115,116,117,118].
SLN中基质细胞的重编程
淋巴结基质细胞包括不同的细胞类型:淋巴组织组织者(LTo)、滤泡dc (FDCs)、FRCs、边缘网状细胞(MRCs)、整合素α7周细胞(IAPs)、BECs和LECs。LTos招募造血细胞到淋巴结。在淋巴结B细胞区周围皮层发现的fdc对支持B细胞存活很重要。FRC产生多种ECM蛋白,包括纤原I型和III型胶原蛋白、IV型胶原蛋白、层粘连蛋白、纤维连接蛋白、腱蛋白- c和整合素,以形成网状的免疫细胞运动场所,并加强淋巴结结构[119,120].FRCs在维持HEV完整性和免疫细胞存活中起着至关重要的作用。MRC组成性地产生趋化因子CXCL13,以调节LTo细胞的特性和功能。IAP是一种新发现的位于淋巴结血管周围的间质细胞,其生物学功能尚不明确。
SLN中基质细胞的重编程已在先前的B16中报道过。F10黑色素瘤小鼠模型[121].本研究表明,与naïve淋巴结相比,肿瘤荷瘤小鼠SLN FRC中参与生长、代谢、线粒体功能、细胞运动和细胞-细胞连接等多种生物过程的基因上调。基因集富集分析和解释性现象学分析均发现,与naïve淋巴结相比,SLN中编码趋化因子、细胞因子及其下游介质的基因表达上调,而IL-19、IL-7、CCL4和CCL21等因子表达下调。转录分析还显示,激活标记PDPN、纤连蛋白1、Cd248、肌动蛋白α2、S100A4、波形蛋白、肌球蛋白轻链和胶原蛋白的表达增强,表明SLN中FRCs的激活。
根据我们的单细胞RNA测序数据,SLN中的FRC表达了氧化磷酸化(OXPHOS)通路特征的强烈升高[55].呼吸链复合体I的27个基因,复合体II的1个基因,复合体III的6个基因,复合体IV的9个基因,复合体V的4个基因差异表达,提示SLN中ATP消耗较大。这些数据表明,SLN的代谢开关促进淋巴转移。
SLN重编程的中介
生长因子和趋化因子
越来越多的证据表明,不同的趋化因子受体信号通路有助于癌细胞向淋巴结的运输(表1).与naïve淋巴结相比,黑色素瘤SLN中GM-CSF、IFN-γ、IL-2和IL-10的表达升高[122,123].在乳腺癌中,肿瘤浸润的SLN中CD83、IL-12p40、IFN-γ、IL-10和Foxp3的表达明显上调[124].在非小细胞肺癌中,肿瘤来源的TGF-β可减少SLN中dc的数量[53].Hirakawa等报道原发肿瘤在癌细胞到达前过度表达VEGF-A在SLN中诱导淋巴管生成[5].趋化因子受体如CXCR3和CXCR4已被证明在不同类型癌症的动物模型中上调,并与SLN转移密切相关[One hundred.].Das等发现CCL1蛋白在淋巴结和淋巴窦中被检测到,CCL1的同源受体CCR8在人黑色素瘤细胞表面显著上调,为CCL1如何促进癌细胞侵入SLN提供了分子基础[125].CXCL12-CXCR4、CCL19-CCR7、CCL21-CCR7等配对配体受体通路也能有效促进癌细胞的淋巴结侵袭[126,127,128].这些研究表明细胞因子/趋化因子环境在SLN转移前微环境的建立中起着至关重要的作用。
细胞外囊泡
细胞外囊泡(EVs)是由大多数类型的细胞自然释放的双层含脂囊泡。ev根据其大小和合成途径可分为外泌体、微囊泡和凋亡小体[129].这些囊泡在细胞与细胞之间的交流中起着重要作用;它们将不同的生物活性分子从分泌细胞传递到受体细胞,以调节受体细胞在各种生理和病理条件下的行为。最近的研究强调了外泌体介导的过程在为淋巴转移准备转移前壁龛的机制[130,131,132].肿瘤分泌的ev可以重建周围的基质,并重新编程淋巴结中的微环境,为癌细胞扩散建立滩头阵地(表2)。2) [133,134,135].例如,在淋巴结转移阳性的口腔癌患者的肿瘤组织外分泌体中,发现大型ECM蛋白复合物层粘连蛋白332增加。该蛋白的缺失可有效抑制ev介导的LEC迁移和SLN中的淋巴管生成[136].血浆ev中检测到的干扰素调节因子2被F4/80所吸收+巨噬细胞诱导VEGF-C的释放促进结直肠癌患者SLN的淋巴管生成和淋巴网络重塑[137].CD169+巨噬细胞捕获来自B16-F10黑素瘤细胞的微泡,在它们进入SLN后触发微环境重编程[138].乳腺癌释放EV诱导巨噬细胞IL-6表达增强,抑制免疫反应,促进异种移植小鼠肿瘤转移[139].此外,含有PDPN的EV促进培养的LECs管的形成[140].此外,来源于癌细胞的外泌体可以将EGFR传递给内皮细胞和LECs,以刺激血管生成和淋巴管生成[141].除了蛋白质外,ev中的核酸也被发现参与淋巴结转移。在宫颈鳞癌中,miR-221-3p表达与LYVE-1表达及淋巴结转移相关[142].癌细胞来源的含mir的ev增强MDSC的募集和TAM的激活以产生免疫抑制环境,导致癌细胞转移增加[132,143].黑色素瘤释放的外泌体将miR-9传递到内皮细胞,激活内皮细胞中的Janus激酶2信号换能器和转录激活因子3信号,从而触发血管生成[144].这些结果表明ev是癌细胞重塑SLN微环境的关键介质。
代谢物
淋巴结是一个富含脂质的器官,因为流入淋巴结的淋巴含有许多脂肪酸[44,145].Lee等人报道,癌细胞通过选择性激活转录辅激活物yes-associated protein (YAP),向脂肪酸氧化(FAO)的代谢转变,以促进淋巴结转移[145].粮农组织在控制淋巴管生成方面也发挥关键作用[146].此外,FAO影响SLN中的多种细胞类型。例如,最近的一项研究揭示了通过STAT3激活FAO上调抑制CD8的重要性+t细胞在促进肥胖相关乳腺肿瘤发生和转移中的作用[147].转录因子Foxp3增加了Tregs中乙酰辅酶a合成酶和肉碱棕榈酰转移酶1A的表达,说明Tregs更倾向于以脂肪酸为主要能量来源;这一过程可能有助于SLN的功能重编程[148].我们的研究还表明,胆汁酸代谢和脂肪酸代谢是SLN上调的标志通路。我们发现乳腺癌细胞诱导的FRCs中富马酰乙酰乙酸水解酶(FAH)的过表达显著增加了线粒体OXPHOS水平和ATP的产生。FAH催化4-富马乙酸酯水解为乙酰乙酸酯和富马酸酯,可在三羧酸循环中代谢或用于生物合成目的。从小鼠分离的免疫细胞与过表达fah的FRCs共培养,在体外抑制了免疫细胞的激活,这表明FRCs中的代谢重编程产生的代谢物在SLN中产生肿瘤诱导的免疫抑制小位。通过发现富马酸、琥珀酸和2-羟戊二酸等代谢物可以诱导表观遗传改变,增强细胞转化并为肿瘤进展产生有利的微环境,“肿瘤代谢物”的概念已经得到了很好的确立[149].
细胞外基质
ECM包含许多细胞外大分子,包括胶原蛋白、蛋白质和羟基磷灰石。它生成一个三维网络,作为支持组织完整性的结构和生化基础。在生理情况下,FRC是淋巴结中产生ECM的主要来源。它们产生不同类型的ECM,在淋巴结中形成特定的导管,以运输生物活性分子,并加速免疫细胞在淋巴结内的迁移[119,120,150].最近,Wei等人发现了一种特殊类型的骨膜蛋白+癌症相关成纤维细胞可能通过整合素-黏附激酶/Src-VE-cadherin信号通路破坏淋巴内皮细胞屏障促进口腔癌淋巴结转移[151].Li等阐明锌指蛋白139调控膜联蛋白A蛋白加速胃癌淋巴结转移[152].胃癌转移淋巴结中也有高表达的connexin-43和E-cadherin [153].此外,赖氨酸氧化酶、膜型基质金属蛋白酶和基质金属蛋白酶组织抑制剂1等酶的增加与口腔癌患者转移淋巴结中的ECM降解有关[154].相反,肿瘤间质中高水平的纤维连接蛋白、腱蛋白- c和骨桥蛋白已被证明与淋巴结转移有关[155,156].综上所述,这些研究表明ECM重塑在促进淋巴结转移中的重要性。
靶向SLN的治疗意义
由于SLN的参与似乎是肿瘤转移的初始和关键步骤,它可能是通过传递细胞毒性药物或激活免疫反应进行治疗干预的合适靶点。本文讨论了三种策略。第一,代谢改变的逆转。如前所述,SLN中各种细胞类型的代谢变化对转移前微环境的形成非常重要。因此,抑制或恢复代谢开关是一个相当重要的途径。例如,SLN中的基质细胞优先利用脂质作为主要能量来源,并通过FAO产生ATP。局部抑制SLN中的FAO反应可以使微环境逆转到正常的免疫活性状态,从而减少癌细胞的到达和侵袭。第二,抗癌药物可以直接输送到SLN或区域淋巴结,杀死癌细胞。这种方法的主要挑战是开发面向淋巴结的纳米颗粒。纳米颗粒的大小和特性是特异性淋巴结靶向的关键决定因素。 It has been shown that nanoparticles ranging 5 to 50 nm in size are favorable for uptake by lymphatic capillary and vessel, thus promoting SLN entry [157,158].磁性药物偶联纳米颗粒可使用外磁体集中于局部淋巴结[159,160].具有高SLN取向的给药粒子的设计是纳米医学的一个重要课题。第三,通过免疫调节剂和癌症疫苗增强SLN的抗癌免疫力。免疫疗法已经成为癌症治疗的主流之一。然而,只有一小部分癌症患者受益于免疫检查点抑制剂。最近的研究表明,SLN和肿瘤引流淋巴结是增强免疫反应的潜在靶点。Sasso等人通过注射过表达vegf -c和佐剂覆盖的死亡癌细胞,诱导T细胞在注射部位和引流淋巴结处激活,从而开发了免疫治疗的淋巴管生成增强[161].Francis等人还表明,在黑色素瘤动物模型中,淋巴结中免疫检查点抑制剂的局部递送引发了增强的癌症免疫治疗[162].结内注射肿瘤特异性抗原增加DC呈现和促进癌症疫苗的疗效。这些结果表明,靶向SLN或肿瘤引流淋巴结可能是抗癌药物开发的新方向。
结论
在登陆战中,滩头阵地的建立是赢得战争的最关键的一步。为了成功向远处器官扩散,癌细胞派遣了许多前哨部队,在SLN建立滩头阵地,进行进一步的转移。这些前哨部队可以是大分子,如ev,生长因子,ECM蛋白或小分子,如miRNA和代谢物。这些分泌因子改造SLN中的所有细胞类型,包括免疫细胞、LEC、BEC和成纤维细胞,将敌人变成朋友,为癌细胞入侵创造有利的微环境。在过去的二十年里,我们对SLN重编程的理解有了很大的提高。在不久的将来,我们可以期待淋巴结靶向药物和疫苗在癌症治疗中的应用。
数据和材料的可用性
不适用。
缩写
- BEC:
-
血液内皮细胞
- CAF:
-
癌症相关成纤维细胞
- CCL21:
-
趋化因子配体21
- CCR:
-
CC-chemokine受体
- 考克斯:
-
环氧合酶
- Cox7c:
-
细胞色素c氧化酶亚基7c
- CPT1A:
-
肉碱棕榈酰转移酶1A
- CTLA4:
-
细胞毒性t淋巴细胞相关蛋白4
- CXCR:
-
C-X-C基序趋化因子受体
- 2-HG:
-
2-hydroxyglutarate
- DC:
-
树突细胞
- 度:
-
差异表达基因
- ECM:
-
细胞外基质
- 呃:
-
雌激素受体
- 电动汽车:
-
细胞外囊泡
- 华氏温标:
-
Fumarylacetoacete羟化酶
- FAK:
-
局灶粘附激酶
- 粮农组织:
-
脂肪酸氧化
- FDC:
-
滤泡树突状细胞
- 具体:
-
叉头盒P3
- FRC:
-
成纤维网状细胞
- gm - csf:
-
粒细胞巨噬细胞集落刺激因子
- 戊肝病毒:
-
高内皮小静脉
- 我:
-
吲哚胺2,3-dioxygenase
- 干扰素:
-
干扰素
- IL:
-
白介素
- LEC:
-
淋巴内皮细胞
- 液态氧:
-
赖氨酰化氧
- 维度:
-
淋巴组织组织器
- LYVE-1:
-
淋巴管内皮透明质酸受体1
- csf:
-
巨噬细胞集落刺激因子
- MDSC:
-
骨髓来源的抑制细胞
- MEF2C:
-
肌细胞特异性增强因子2C
- MHC:
-
主要组织相容性复合体
- Ndufv2:
-
泛醌氧化还原酶核心亚基v2
- 光学字符识别:
-
耗氧率
- OXPHOS:
-
氧化磷酸化
- PDGF:
-
血小板衍生生长因子
- PDPN:
-
Podoplanin
- PGC-1α:
-
增殖细胞激活受体γ共激活因子1 α
- PGE2:
-
前列腺素E2
- PI3K:
-
Phosphatidylinositol-3-kinase
- PNAd:
-
外围节点地址
- Prdx5:
-
Peroxiredoxin-5
- Prox-1:
-
普洛斯彼罗同源异体蛋白1
- SDHD:
-
琥珀酸脱氢酶复合物亚基D
- SLN:
-
前哨淋巴结
- 统计:
-
信号转换器和转录激活剂
- TAM:
-
Tumor-associate巨噬细胞
- TFAM:
-
转录因子A,线粒体
- TGF -β:
-
转化生长因子β
- Treg:
-
调节性T细胞
- Uqcr11:
- VEGF:
-
血管内皮生长因子
- VEGFR-3:
-
血管内皮生长因子受体3
- 笨蛋:
-
Yes-associated蛋白质
参考文献
Oliver G, Kipnis J, Randolph GJ, Harvey NL。21世纪的淋巴管系统:在稳态和疾病中的新功能作用。细胞。2020;182(2):270 - 96。
代赭石NH。淋巴管和第三淋巴器官。中国临床医学杂志。2014;29(3):344 - 344。
Mohammed RAA, Martin SG, Gill MS, Green AR, Paish EC, Ellis IO。淋巴血管侵犯检测方法的改进表明,淋巴血管侵犯是乳腺癌血管侵犯的主要方法,具有重要的临床意义。中华外科杂志。2007;31(12):1825-33。
赵nq, Berghuis B, Tsarfaty G, Bruch BM, Kort EJ, Ditlev J,等。准备“土壤”:原发肿瘤在转移性癌细胞到来之前诱导前哨淋巴结的血管重组。癌症决议2006;66(21):10365-76。
肿瘤治疗中血管生成和淋巴管生成抑制之间的耐药性的平行。细胞。2020;9(3):762。
Ndiaye PD, Pagès G. VEGF-C和淋巴管:肿瘤发展和转移的双刃剑。医学(巴黎)。35(2): 132 - 2019; 7。
Künnapuu J, Bokharaie H, Jeltsch M. VEGF家族中的蛋白水解切割:在血管生成VEGF中产生多样性,对淋巴血管生成VEGF的激活至关重要。生物学(巴塞尔)。2021; 10(2): 167。
沙敏,郑松,陈晓霞,童勇,曹军,孙海燕,等。VEGFR-3在肝内胆管癌中的表达通过淋巴管生成与不良预后相关。国际生物学杂志,2018;14(10):1333-42。
王丽娟,吴国强,陈伟,等。近红外荧光成像技术在B16F10黑素瘤淋巴结转移中的应用。生物医学工程学报。2013;4(6):967-77。
莫林D, Erlichman N,本-巴uch A.超越细胞运动:在恶性肿瘤中扩大趋化因子及其受体的作用。前沿免疫。2020;11:952。
李文杰,李志强,李志强,等。趋化因子和趋化因子受体在肿瘤免疫治疗中的应用。前沿免疫。2019;10:379。
李志强,李志强,李志强,等。VEGF-C诱导肿瘤淋巴管生成促进乳腺癌转移。中华外科杂志2001;7(2):192-8。
张志刚,张志刚,张志刚,张志刚,等。血管内皮生长因子c介导的淋巴管生成促进肿瘤转移。环境科学学报,2001;20(4):672-82。
Hirakawa S, Kodama S, Kunstfeld R, Kajiya K, Brown LF, Detmar M. VEGF-A诱导肿瘤和前哨淋巴结淋巴管生成并促进淋巴转移。中华检验医学杂志,2005;21(7):1089-99。
Björndahl MA,曹睿,Burton JB, Brakenhielm E, Religa P, Galter D,等。血管内皮生长因子-a促进瘤周淋巴管生成和淋巴转移。癌症杂志2005;65(20):9261-8。
Thelen A, Scholz A, Benckert C, Marschall ZV, Schröder M, Wiedenmann B,等。VEGF-D促进肝细胞癌小鼠模型肿瘤生长和淋巴扩散。中华癌症杂志,2008;22(11):2471-81。
曹r, Björndahl MA, Religa P, Clasper S, Garvin S, Galter D,等。PDGF-BB诱导瘤内淋巴管生成并促进淋巴转移。中国癌症杂志,2004;6(4):333-45。
Nguyen-Ngoc KV,张KJ, Brenot A, Shamir ER, Gray RS, Hines WC,等。ECM微环境调节正常和恶性乳腺上皮的集体迁移和局部播散。美国国家科学研究院。2012; 109 (39): e2595 - 604。
Moehrle M, Schippert W, Rassner G, Garbe C, Breuninger H.皮肤黑色素瘤前哨淋巴结微转移是无病生存、无远处转移生存和总生存的重要预后因素。中华外科杂志2004;30(10):1319-28。
Leiter U, Buettner PG, Bohnenberger K, Eigentler T, Meier F, Moehrle M,等。原发性黑色素瘤前哨淋巴结清扫可减少随后的区域淋巴结转移和淋巴结累及后的远处转移。中华外科杂志,2010;17(1):129-37。
李志强,李志强,李志强,等。乳腺和腋窝淋巴结的免疫和基质特征的组织学评分是淋巴结阳性乳腺癌远处转移的预后。中华流行病学杂志,2018;4(1):39-54。
朱勇,林杰,闫燕,郑凯,张宏,吴凯,等。蝶状淋巴结转移是甲状腺乳头状癌肿瘤侵袭性和预后不良的新指标。中华外科杂志,2015;29(7):344 - 344。
Naxerova K, Reiter JG, Brachtel E, Lennerz JK, van de Wetering M, Rowan A,等。人类结直肠癌淋巴和远处转移的起源。科学。2017;357(6346):则高达55 -。
Venet D, ferereli D, Rothé F, Boeckx B, Maetens M, Majjaj S,等。乳腺癌的系统发育重建揭示了与不同临床结果相关的两种转移传播途径。EBioMedicine。2020; 56: 102793。
张伟,张志强,张志强,张志强,等。淋巴结定殖诱导肿瘤免疫耐受,促进远处转移。细胞。2022;185(11):1924 - 42。
Faries MB, Thompson JF, Cochran AJ, Andtbacka RH, Mozzillo N, Zager JS,等。黑色素瘤前哨淋巴结转移的完全性解剖或观察。中华医学杂志。2017;36:11 - 22。
Bozec A, Dassonville O, Chamorey E, Poissonnet G, Sudaka A, Peyrottes I,等。颈部淋巴结受累及中央颈部清扫术对甲状腺乳头状癌368例的临床影响中华耳鼻喉科杂志,2011;29(8):457 - 457。
Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR,等。腋窝清扫与不进行腋窝清扫对浸润性乳腺癌和前哨淋巴结转移患者10年总生存率的影响:ACOSOG Z0011(联盟)随机临床试验《美国医学协会杂志》上。2017年,318(10):918 - 26所示。
Fisher B, Jeong JH, Anderson S, Bryant J, Fisher ER, Wolmark N.一项比较根治性乳腺切除术、全乳腺切除术和全乳腺切除术后放疗的25年随访研究。中华实用医学杂志,2002;29(8):366 - 366。
郭奕涛,蔡文文,洪海海,谢世平,蒋顺丰,赖昌昌,等。转移性结直肠癌患者区域淋巴结受累的预后价值:姑息性与治愈性切除。中华外科杂志,2021;19(1):150。
Ballester M, Dubernard G, Lécuru F, Heitz D, Mathevet P, Marret H,等。早期子宫内膜癌前哨淋巴结活检的检出率和诊断准确性:一项前瞻性多中心研究(sentii - endo)。医学杂志,2011;12(5):469-76。
Joshi NP, Broughman JR.唾液腺肿瘤的术后处理。中国生物医学工程学报。2021;22(3):23。
冯seca IB, Lindote MVN, Monteiro MR, Filho ED, Pinto CAL, Jafelicci AS,等。前哨淋巴结状态是临床IIB期和IIC期黑色素瘤患者最重要的预后信息。中华外科杂志,2020;27(11):4133-40。
崔佩妮,李志刚,李志刚,等。前哨淋巴结肿瘤负荷在前哨淋巴结活检阳性黑色素瘤患者预后建模中的作用:一项意大利黑色素瘤组间研究(N = 2086)BMC癌症杂志,2022;22(1):610。
Straker RJ 3, Sharon CE, Chu EY, Miura JT, Ming ME, Karakousis GC。临床IIB/C期皮肤黑色素瘤患者前哨淋巴结活检:一项国家队列研究中华皮肤医学杂志,2002,23(4):344 - 344。
萨哈S,菲利蒙B,埃夫森M, Helina A, Elgamal M, Kiya G,等。前哨淋巴结作图在结肠癌中的作用:微转移的检测,对生存的影响,以及结肠切除范围的范式转变的驱动因素。临床经验转移。2022;39(1):109-15。
Honselmann KC, Pergolini I, Fernandez-Del Castillo C, Deshpande V, Ting D, Taylor MS,等。淋巴结阴性和淋巴结阳性切除胰腺癌的复发时间不同,但复发模式不同。中华外科杂志。2020;272(2):357-65。
王峰,葛霞,王铮,翁勇,殷瑞,尤倩。胸段食管癌锁骨上淋巴结转移的临床意义及预后。中华医学杂志,2020;8(4):90。
Chang GJ, Rodriguez-Bigas MA, Skibber JM, Moyer VA.结肠癌根治性切除术后淋巴结评价与生存:系统综述。中华肿瘤学杂志,2007;39(6):433 - 441。
帕斯图申科I,范登Eynden GG, Arregui SV,托雷斯LP, Alegret RA, Querol I,等。黑色素瘤患者转移前哨淋巴结的血管生成和淋巴管生成增加与非前哨淋巴结受累性和远处转移有关。中华皮肤科杂志。2016;38(5):338-46。
Blenman KRM, He TF, Frankel PH, Ruel NH, Schwartz EJ, Krag DN,等。前哨淋巴结B细胞可以预测乳腺癌患者的无病生存。中国乳腺癌杂志。2018;4:28。
辛格V.解剖学教科书:头、颈和脑。第二版,爱思唯尔有限公司;2017.
沃里克R,威廉姆斯PL.血管学(第六章)。格雷解剖学。, 35 edn, Longman, Ltd.;1973.
川田,武藤敏。淋巴结转移在肿瘤进展中的意义及机制。癌症研究,2011;71(4):1214-8。
Edge SB, Compton CC.美国癌症联合委员会:AJCC癌症分期手册第7版和TNM的未来。中华外科杂志,2010;17(6):1471-4。
李志强,李志强,李志强,等。前哨淋巴结转移在肿瘤中的临床意义。中国生物医学工程学报,2015;
Harrell MI, Iritani BM, Ruddell A.肿瘤诱导前哨淋巴结淋巴管生成和淋巴流量增加是黑色素瘤转移的前兆。中华病理学杂志。2007;17(2):774-86。
Chung MK, Do IG, Jung E, Son YI, Jeong HS, Baek CH.口腔鳞状细胞癌前哨淋巴结中淋巴管和高内皮小静脉在肿瘤细胞到达前增加。中华外科杂志,2012;19(5):1595-601。
程瑞,刘超,刘志强,刘志强,刘志强,等。牙周炎通过增加骨髓来源的抑制细胞招募远处转移性乳腺癌细胞。致癌基因。2020;39(7):1543 - 56。
吉伯特-拉莫斯A, López C,博世R, Fontoura L, Bueno G, García-Rojo M,等。乳腺癌原发肿瘤、前哨淋巴结和非前哨淋巴结与转移相关的免疫反应:免疫组化的观点中国生物医学工程学报。2019;32(3):379 - 379。
伊藤M,南宫Y,河合H,齐藤S,齐藤H,中川T,等。肿瘤源性tgf -1诱导前哨淋巴结树突状细胞凋亡。中华免疫杂志,2006;36(9):537 - 543。
Kaplan RN, Riba RD, Zacharoulis S, Bramley AH, Vincent L, Costa C,等。vegfr1阳性的造血骨髓祖细胞启动转移前生态位。大自然。2005;438(7069):820 - 7。
Lund AW, Duraes FV, Hirosue S, Raghavan VR, Nembrini C, Thomas SN,等。VEGF-C促进B16黑素瘤的免疫耐受和淋巴结淋巴交叉呈递肿瘤抗原。中国科学通报2012;1(3):191-9。
Munn DH, Sharma MD, Hou D, Baban B, Lee JR, Antonia SJ,等。吲哚胺2,3-双加氧酶在肿瘤引流淋巴结浆细胞样树突状细胞中的表达。中国科学(d辑),2004;
Sharma MD, Baban B, Chandler P, Hou DY, Singh N, Yagita H,等。来自小鼠肿瘤引流淋巴结的浆细胞样树突状细胞通过吲哚胺2,3-双加氧酶直接激活成熟的treg。中国科学(d辑),2007;
Sakakura K, Chikamatsu K, Sakurai T,高桥K,村田T, Oriuchi N,等。口腔癌中树突状细胞和NK细胞浸润前哨淋巴结。口腔医学杂志,2005;41(1):89-96。
法扎德Z,科克伦AJ,麦克布莱德WH,格雷JD,黄V,莫顿DL。淋巴细胞亚群在人类黑素瘤区域的淋巴结改变。癌症决议1990;50(12):3585-8。
Piersiala K, Silva PFN, Hjalmarsson E, Kolev A, Kågedal A, Starkhammar M,等。与口腔鳞状细胞癌肿瘤组织相比,前哨淋巴结中的CD4+和CD8+ T细胞表现出不同的PD-1、CD69和HLA-DR表达模式。中国生物医学工程学报(自然科学版);
张志强,张志强,张志强,等。高剂量白介素-2治疗转移性黑素瘤或肾细胞癌患者CD4+CD25+调节性T细胞的特征中华临床医学杂志,2006;24(7):1169-77。
Viguier M, Lemaitre F, Verola O, Cho MS, Gorochov G, Dubertret L,等。Foxp3表达CD4+CD25(高)调节性T细胞在人转移性黑色素瘤淋巴结中过度表达,并抑制浸润性T细胞的功能。中华免疫杂志,2004;17(2):444 - 453。
张志刚,张志刚,张志刚。乳腺癌引流淋巴结中CD4+淋巴细胞亚群的免疫特性研究。中华免疫杂志,2014;29(1):529 - 529。
Schule JM, Bergkvist L, Hakansson L, Gustafsson B, Hakansson A.乳腺癌患者前哨淋巴结活检中CD28表达与CD3-zeta链表达的比较中华医学杂志2004;2(1):45。
Ruddell A, Harrell MI, Furuya M, Kirschbaum SB, Iritani BM。B淋巴细胞促进淋巴瘤和黑色素瘤的淋巴转移。瘤。2011;13(8):748 - 57。
Zirakzadeh AA, Marits P, Sherif A, Winqvist O.恶性肿瘤患者血液、淋巴结和肿瘤中的多重B细胞特征。中华免疫杂志,2013;19(11):5847-55。
李强,老X,潘琦,宁宁,Yet J,徐勇,等。肿瘤反应性B细胞过继转移给予宿主t细胞免疫和肿瘤消退。临床癌症杂志,2011;17(15):4987-95。
李玉玲,陈超,陈建勇,赖玉生,王顺生,姜士生,等。单细胞分析揭示肿瘤引流淋巴结的免疫调节和代谢开关。Oncoimmunology。2020;9(1):1830513。
钱勇,翟娥,陈松,刘勇,马勇,陈杰,等。单细胞RNA-seq分析胃癌淋巴结转移过程中肿瘤细胞的异质性及肿瘤微环境的综合动态中华肿瘤学杂志,2002,22(8):457 - 457。
陈瑞瑞,范玉明,张强,刘松,李强,柯国荣,等。雌二醇通过将ERalpha/REA复合物招募到rorgamat启动子的雌激素反应元件上,从而抑制rorgamat转录,从而抑制Th17细胞分化。中华免疫杂志,2015;194(8):4019-28。
金德华,朴海杰,朴海山,李柱,高聪,桂春梅,等。T细胞中的雌激素受体抑制滤泡辅助T细胞反应并防止自身免疫。中华口腔医学杂志,2019;29(4):344 - 344。
杨超,李华,Pal S, Jove V,邓杰,张伟,等。B细胞通过STAT3调节的血管生成促进肿瘤进展。PLoS ONE。2013; 8 (5): e64159。
魏克PR, Kohyama M, Sandau MM, Albring JC, Nakagawa O, Schwarz JJ,等。转录因子Mef2c是抗原受体刺激后B细胞增殖和存活所必需的。中华免疫杂志2008;9(6):603-12。
赫格罗茨,L Unrau, hauschild F, Fischer M, Kriebitzsch N, Alawi M,等。Mef2转录因子对早期b细胞发育的基本控制。血。2016;127(5):572 - 81。
王伟,Org T, A, Pioli PD,段D, israel E,等。MEF2C在应激造血过程中保护骨髓b淋巴祖细胞。Nat Commun. 2016;7:12376。
谭晓明,李志强,李志强,等。tgf β精子家族成员在B细胞发育中的调控作用及其在自身免疫中的应用。国际分子化学杂志,2018;19(12):3928。
北村涛,钱伯泽,波拉德。免疫细胞促进转移。中华免疫杂志2015;15(2):73-86。
Schaller J, Agudo J.转移定植:逃避免疫监测。癌症(巴塞尔)。2020; 12(11): 3385。
潘碧,马刚,韦伯KJ,小涛蔡杰,王刚,尹波,等。免疫刺激受体CD40是肿瘤中由骨髓源性抑制细胞介导的T细胞抑制和T调节细胞激活所必需的。癌症杂志2010;70(1):99-108。
黄斌,潘碧,李强,佐藤爱,Levy DE, Bromberg J,等。Gr-1+CD115+未成熟的髓系抑制细胞介导荷瘤宿主中肿瘤诱导的T调节细胞和T细胞无能的发展。癌症杂志2006;66(2):1123-31。
骨髓来源的抑制细胞通过扩大调节性T细胞促进b细胞淋巴瘤的交叉耐受性。癌症决议2008;68(13):5439-49。
卞忠,Abdelaal AM,石林,梁红,熊林,Kidder K,等。精氨酸酶-1在骨髓源性抑制细胞介导的t细胞增殖抑制中既不是组成性表达,也不是必需的。中华免疫杂志,2018;48(6):1046-58。
葛日瓦TM, Sosnowska A, Matryba P, Rydzynska Z, Jasinski M, Nowis D,等。骨髓细胞源性精氨酸酶在癌症免疫应答中的作用。前沿免疫。2020;11:938。
Ohl K, Tenbrock K.活性氧作为mdsc介导的免疫抑制的调节因子。前沿免疫。2018;9:2499。
冯松,程旭,张磊,吕旭,Chaudhary S,滕锐,等。髓源性抑制细胞通过硝化LCK在小鼠癌症中抑制T细胞活化。美国国家科学研究院。2018; 115(40): 10094 - 9。
莫龙B, Ugel S, Del P, Soldani C, Zilio S, Avella D,等。趋化因子硝化阻止抗原特异性T细胞瘤内浸润。中华检验医学杂志,2011;29(4):529 - 529。
Ku AW, Muhitch JB, Powers CA, Diehl M, Kim M, Fisher DT,等。肿瘤诱导的MDSC通过远程控制抑制淋巴结中l选择素依赖的适应性免疫。电子生活。2016;5:e17375。
Cochran AJ,黄rr, Su A, Itakura E, Wen DR.前哨淋巴结转移易感性与淋巴结免疫调节有关吗?癌症杂志,2015;21(1):39-46。
于俊,杜伟,闫峰,王勇,李辉,曹松,等。髓源性抑制细胞通过IDO表达抑制抗肿瘤免疫反应,并与乳腺癌患者的淋巴结转移相关。中华免疫杂志,2013;19(7):3783-97。
Go Y,田中H,德本M,樱井K,丰川T,久保N,等。肿瘤相关巨噬细胞在人胃癌转移前淋巴结中沿淋巴流延伸。中华外科杂志,2016;23(增刊2):S230-5。
齐藤Y,大西K,宫下A,中原S,藤原Y, Horlad H,等。CD169+淋巴窦巨噬细胞在恶性黑色素瘤患者中的预后意义中国癌症杂志,2015;3(12):1356-63。
Shiota T, Miyasato Y, Ohnishi K, Yamamoto ibusuki M, Yamamoto Y, Iwase H,等。cd169阳性淋巴结巨噬细胞在乳腺癌患者中的临床意义PLoS ONE。2016; 11 (11): e0166680。
Stromvall K, Sundkvist K, Ljungberg B, Halin Bergstrom S, Bergh A.在动物模型中,转移前区域淋巴结中CD169(+)巨噬细胞数量的减少与随后的转移性疾病相关,并且前列腺癌患者预后较差。前列腺癌。2017;77(15):1468 - 77。
王志强,王志强,王志强。淋巴系统在心血管医学中的应用。Circ第2016;118:515-30号。
Brulois K, Rajaraman A, Szade A, Nordling S, Bogoslowski A, Dermadi D,等。小鼠淋巴结血管内皮的单细胞分辨率分子图。科学通报。2020;11(1):3798。
Lee M, Kiefel H, LaJevic MD, Macauley MS, Kawashima H, O 'Hara E,等。淋巴组织毛细血管和高内皮细胞的转录程序揭示了淋巴细胞归巢的控制机制。中华免疫杂志2014;15(10):982-95。
Mionnet C, Sanos SL, Mondor I, Jorquera A, Laugier JP, Germain RN,等。高内皮小静脉作为交通控制点,维持淋巴结内淋巴细胞群的稳态。血。2011;118(23):6115 - 22所示。
通过高内皮小静脉的淋巴细胞运输:教条和谜。免疫免疫学杂志2004;4(5):360-70。
帕德拉,梅杰,EF,孟。淋巴系统在疾病过程和癌症进展中的作用。生物医学工程,2016;18:125-58。
李雪雪,钱国强,黄国强,陈平,王敏,敏生,等。淋巴结特化血管的改变及其在癌症转移中的作用。中华医学杂志,2012;10:206。
炎症和癌症中的血管生成和血管重塑:血管生物学和结构。血管生成》2008。https://doi.org/10.1007/978-0-387-71518-6_2.
Stacker SA, Williams SP, Karnezis T, Shayan R, Fox SB, Achen MG。癌症中的淋巴管生成和淋巴管重塑。中华癌症杂志,2014;14(3):159-72。
郑伟,李志强,李志强,等。淋巴管生成因子、机制及应用。中国临床医学杂志。2014;29(3):344 - 344。
有本聪,长谷川T,武田D,斋藤I,天野R,明石M,等。口腔鳞状细胞癌的淋巴管生成与淋巴结转移。抗癌决议2018;38(11):6157-62。
boisio D, Ronca R, Salvi V, Presta M, Sozzani S.树突状细胞在炎性血管生成和淋巴管生成中的作用。《免疫杂志》2018;53:180-6。
藤本N, He Y, D 'Addio M, Tacconi C, Detmar M, Dieterich LC。单细胞作图揭示淋巴结中淋巴内皮细胞的新标记和功能。公共科学图书馆。2020;18(4):e3000704。
潘铮,陆旭,赵娟,高强,王娟。VEGF-C与直肠癌淋巴管生成及淋巴转移呈正相关。中华临床病理学杂志,2018;11(3):1777-83。
Garmy-Susini B, Avraamides CJ, Desgrosellier JS, Schmid MC, Foubert P, Ellies LG,等。PI3Kalpha激活整合素alpha4beta1在淋巴结中建立转移小生境。美国国家科学研究院。2013; 110(22): 9042 - 7。
张晓明,王晓明,张晓明,王晓明。CCL21/CCR7趋化因子轴在乳腺癌诱导淋巴管生成中的作用。摩尔癌症。2015;14:35。
Karnezis T, Shayan R, Fox S, Achen MG, Stacker SA。淋巴管生成信号和前列腺素生物学之间的联系:转移途径中缺失的一环。Oncotarget。2012;3(8):893 - 906。
魏特MH, Jones K, Wilting J, Dictor M, Selg M, McHale N,等。淋巴系统的结构功能关系及其对癌症生物学的意义。癌症转移,2006;25(2):159-84。
Avery M, Nathanson SD, Hetzel FW。亚致死热疗前后小鼠足底肿瘤的淋巴流动。辐射科学,1992;132(1):50-3。
柯德罗,李志强,李志强,等。整合素- IIb鉴定小鼠淋巴结淋巴内皮细胞对RANKL反应。PLoS ONE。2016; 11 (3): e0151848。
鲁哈尼SJ,埃克尔斯JD, Tewalt EF,恩格尔哈德VH。淋巴内皮细胞对t细胞耐受的调节。中华临床细胞免疫杂志2014;5:1000242。
淋巴结的淋巴内皮细胞。中华免疫杂志2020;20(9):566-78。
Card CM, Yu SS, Swartz MA。淋巴内皮在调节适应性免疫中的新作用。中国临床医学杂志。2014;29(3):344 - 344。
科恩,吉迪,EF Tewalt,乔,H,鲁哈尼SJ, Ruddell A,等。淋巴结内的淋巴内皮细胞通过不依赖air的直接抗原呈递介导外周耐受。中华检验医学杂志,2010;29(4):489 - 497。
Tewalt EF, Cohen JN, Rouhani SJ, Engelhard VH。淋巴内皮细胞-调节耐受和免疫的关键角色。《免疫前沿》2012;3:305。
Habenicht LM, Kirschbaum SB, Furuya M, Harrell MI, Ruddell A.肿瘤对小鼠和人淋巴结淋巴窦生长和淋巴流动的调节。中国生物医学杂志,2017;29(3):344 - 344。
刘国强,刘国强,李国强,李国强,等。淋巴内皮细胞通过PD-L1诱导耐受,缺乏共刺激导致CD8 T细胞高水平表达PD-1。血。2012;120(24):4772 - 82。
Morgado FN, Silva AVA, Porrozzi R.传染病和淋巴细胞外基质重塑:导管系统的焦点。细胞。2020;9(3):725。
马丁内斯VG, Pankova V, Krasny L, Singh T, Makris S, White IJ,等。成纤维网状细胞在淋巴结扩张过程中控制导管基质沉积。Cell Rep. 2019;29(9): 2810-22。
Riedel A, Shorthouse D, Haas L, Hall BA, Shields J.肿瘤诱导的间质重编程驱动淋巴结转化。中华免疫杂志,2016;17(9):1118-27。
Botella-Estrada R, Dasi F, Ramos D, Nagore E, Herrero MJ, Gimenez J,等。黑色素瘤前哨淋巴结细胞因子表达及树突状细胞密度。黑色素瘤杂志2005;15(2):99-106。
梁淑萍,彭敏,周永明,瓦奎拉杰,张建伟。前哨淋巴结引流原发性黑色素瘤的细胞因子谱。中华外科杂志,2002;9(1):82-7。
Matsuura K, Yamaguchi Y, Ueno H, Osaki A, Arihiro K, Toge T.乳腺癌前哨淋巴结树突状细胞成熟和t细胞反应的研究。癌症。2006;106(6):1227 - 36。
陈志强,陈志强,陈志强,等。在连接黏附分子a缺陷小鼠中DC运输到淋巴结和接触超敏反应增加。中国科学(d辑),2004;
Rusetska N, Kowalski K, Zalewski K, zieshiba S, bidzizynski M, Goryca K,等。CXCR4/ACKR3/CXCL12轴在外阴鳞癌淋巴转移中的作用。中华临床病毒学杂志,2021;35(5):324-32。
刘强,乔敏,罗希娜,毛松,潘勇,王勇,等。CCL19与小细胞肺癌患者淋巴结转移及预后不良相关。肺癌。2021;162:194-202。
早坂H,吉田J,黑田Y,西口A,松崎M,岸本K,等。CXCL12促进CCR7配体介导的乳腺癌细胞侵袭并向淋巴管迁移。中国生物医学工程学报(英文版);
Veziroglu EM, Mias GI。表征细胞外囊泡及其不同的RNA含量。前热内,2020;11:700。
贝克尔A, Thakur BK, Weiss JM, Kim HS, Peinado H, Lyden D.细胞外囊泡在癌症转移中的介导物。中国癌症杂志,2016;30(6):836-48。
马伟杰,马伟杰,马伟杰,马伟杰,等。与血浆相比,转移性黑色素瘤患者淋巴渗出液中肿瘤相关因子富集。中华检验医学杂志,2019;21(5):1091-107。
Hood JL, San RS, Wickline SA。黑色素瘤细胞释放的外泌体为前哨淋巴结的肿瘤转移做好准备。癌症研究,2011;71(11):3792-801。
尼科里尼A,法拉利P,比亚瓦PM。外泌体和细胞通讯:从肿瘤来源的外泌体及其在肿瘤进展中的作用到使用外泌体进行癌症治疗。癌症(巴塞尔)。2021; 13(4): 822。
Sleeman JP。淋巴结转移前小生境。J Mol医学(Berl)。2015, 93(11): 1173 - 84。
王灿,蔡世杰。肿瘤转移中细胞外囊泡对淋巴管生成的调控。Exp生物医学(梅伍德)。2021; 246(19): 2048 - 56。
王帅,刘广根,刘帅,张建军,肖小杰,甄玉春,等。口腔鳞状细胞癌细胞富含层粘连素γ - 2的细胞外囊泡通过淋巴内皮细胞依赖整合素α - 3的摄取增强体外淋巴管生成。中华癌症杂志,2019;44(11):2795-810。
孙波,周勇,方勇,李震,顾晓霞,向娟。结直肠癌外泌体诱导淋巴结淋巴网络重构。中华肿瘤学杂志,2019;29(6):344 - 344。
Pucci F, Garris C, Lai CP, Newton A, Pfirschke C, Engblom C,等。SCS巨噬细胞通过限制肿瘤来源的囊泡- b细胞相互作用抑制黑色素瘤。科学。2016;352(6282):242 - 6。
周安,周伟,刘玲,方美美,钱珀J,范豪特D,等。乳腺癌源性外泌体介导的巨噬细胞免疫调节需要toll样受体2介导的NF-kappaB激活。科学通报2014;4:5750。
Carrasco-Ramirez P, Greening DW, Andres G, Gopal SK, Martin-Villar E, Renart J,等。Podoplanin是细胞外囊泡的一种成分,可重编程细胞来源的外泌体蛋白并调节淋巴管的形成。Oncotarget。2016;7(13):16070 - 89。
Biagioni A, Laurenzana A, Menicacci B, Peppicelli S, Andreucci E, Bianchini F等。表达uPAR的黑素瘤外泌体通过VE-Cadherin、EGFR和uPAR过表达以及内皮细胞中ERK1,2信号通路的升高促进血管生成。中国生物医学工程学报,2017;29(6):357 - 357。
周锋,马军,黄玲,易海燕,张玉明,吴小刚,等。宫颈鳞癌分泌的外泌体miR-221-3p通过靶向VASH1促进淋巴管生成和淋巴转移。致癌基因。2019;38(8):1256 - 68。
李志强,李志强,李志强,等。转移前癌症外泌体通过在转移位点巡视单核细胞来诱导免疫监视。地理学报。2017;8(1):1319。
Gajos-Michniewicz A, Duechler M, Czyz M.黑色素瘤来源外泌体中的MiRNA。中华癌症杂志,2014;347(1):29-37。
李志强,郑旭,张超,裴华,金玉华,朴毅,等。肿瘤转移到淋巴结需要yap依赖的代谢适应。科学。2019;363(6427):644 - 9。
王宝文,王鑫,Zecchin A, Thienpont B, Cornelissen I, Kalucka J,等。脂肪酸氧化在淋巴管生成中的作用。大自然。2017;542(7639):49-54。
张晨,岳晨,Herrmann A,宋杰,Egelston C,王涛,等。STAT3激活诱导的CD8(+) T效应细胞中的脂肪酸氧化对肥胖促进的乳腺肿瘤生长至关重要。中国生物医学工程学报。2020;31(1):148-61。
张伟,张志刚,张志刚,张志刚,等。Foxp3驱动氧化磷酸化和脂毒性保护。中国机械工程学报。2017;2(3):e89160。
Mullen AR, DeBerardinis RJ。癌症中基因定义的代谢重编程。中国内分泌杂志2012;23(11):552-9。
Malhotra D, Fletcher AL, Astarita J, Lukacs-Kornek V, Tayalia P, Gonzalez SF,等。炎症和静息淋巴结间质的转录谱确定免疫特征。中华免疫杂志,2012;13(5):499-510。
魏文峰,陈晓军,梁立军,于林,吴小刚,周芳芳,等。在宫颈鳞癌中,骨膜蛋白(+)癌相关成纤维细胞通过破坏淋巴内皮屏障促进淋巴结转移。中国生物医学工程学报。2021;15(1):210-27。
李勇,王磊,康阿,范林,赵强,谭波,等。比较蛋白质组学方法筛选和鉴定胃癌转移相关蛋白。南方科技大学学报。2015;35(3):360-4。
唐波,彭志华,余普文,于刚,钱峰。Cx43和E-cadherin在胃癌及转移淋巴结中的表达及意义。中华医学杂志,2011;28(2):502-8。
Fujita S, Sumi M, Tatsukawa E, Nagano K, Katase N.细胞外基质重塑因子在口腔癌患者淋巴结中的表达。口腔科学2020;26(7):1424-31。
Allan AL, George R, Vantyghem SA, Lee MW, Hodgson NC, Engel CJ,等。整合素结合蛋白骨桥蛋白在乳腺癌淋巴转移中的作用。中华民国病理学杂志。2006;39(1):344 - 344。
silver CR, Messing EM,宫本H, Lee YF。肌浸润性膀胱癌淋巴结转移前小位中Tenascin-C的表达。中华肿瘤学杂志,2015;29(4):349 - 349。
舒德尔,范文杰,李文杰。淋巴结给药材料设计。科学通报。2019;4(6):415-28。
他藏J R,赵Y,李董H, Y的基于纳米技术的方法来促进癌症疫苗的淋巴结有针对性的交付。中国生物工程学报(自然科学版),2018;26(2):344 - 344。
李志强,李志强,李志强,等。磁药物靶向局部肿瘤治疗。癌症杂志2000;60(23):6641-8。
阿列克谢,施密特,克莱因R,胡林P, Bergeman C,阿诺德W.磁药物靶向:生物分布和磁场强度的依赖性。《中国科学》,2002;52:336 - 6。
王勇,王志强,王志强,王志强,等。淋巴管生成诱导疫苗引发强大和持久的T细胞免疫对抗黑素瘤。科学通报2021;7(13):eabe4362。
Francis DM, Manspeaker MP, Schudel A, Sestito LF, O 'Melia MJ, Kissick HT,等。通过局部递送阻断淋巴结中的免疫检查点增强癌症免疫治疗。科学翻译医学2020;12:eaay3575。
确认
感谢潘美仁博士和林淑义博士在稿件准备过程中提出的宝贵意见。
资金
本研究由台湾科技部110-2320-B-400-016及台湾卫生福利部CA-111-PP-17基金资助。
作者信息
作者及隶属关系
贡献
YLL和WCH撰写了手稿。两位作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
所有作者声明没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Li, YL., Hung, WC.肿瘤转移过程中前哨淋巴结微环境的重编程。生物科学29, 84(2022)。https://doi.org/10.1186/s12929-022-00868-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-022-00868-1
关键字
- 淋巴结
- 免疫
- 转移
- 微环境