摘要
病毒天生具有在细胞间转移遗传物质的能力。在早期的怀疑之后,工程病毒已被用于将遗传信息转移到数千名患者体内,基因疗法目前正吸引着大量投资。尽管存在挑战和严重的副作用,但优化的技术和改进的制造工艺正在推动基因疗法走向临床转化。由于1980年代艾滋病的爆发以及随之而来的对人体免疫缺陷病毒(艾滋病毒)的关注,源自艾滋病毒的慢病毒载体已发展成为最成功和最广泛使用的载体技术之一。到2022年,这种矢量技术已经存在了超过25年。在这里,我们通过描述向量系统及其有趣的性质来庆祝周年纪念。我们深入研究了该技术本身,并概述了慢病毒载体用于体外基因转移到造血干细胞和CAR - t细胞的生产。此外,我们描述了慢病毒载体在体内基因传递的适应性,并涵盖了慢病毒载体对基础分子研究的重要贡献,包括它们作为CRISPR基因组编辑技术载体的作用。最后,我们详述了慢病毒颗粒包装和转移外来蛋白质的新兴能力。
简介
获得性免疫缺陷综合征(艾滋病)于1981年首次被诊断出来。首批报告描述了来自洛杉矶地区的五名男子因严重的免疫抑制而遭受严重感染[1]之后很快又有更多的发现表明卡波西肉瘤和机会性感染在更大的男性群体中[2].这种迄今未被认识到的致命疾病当时被描述为一种导致感染和恶性肿瘤的细胞免疫能力下降的疾病。1983年,巴黎巴斯德研究所的研究人员培养了一名早期艾滋病症状患者的t细胞,并在培养基中发现逆转录酶(RT)活性,表明逆转录病毒感染正在进行中[3.].随后对逆转录病毒进行了定性研究,并记录了病毒感染与艾滋病发展之间的因果关系[4].不久之后,这种病毒在1986年被命名为人类免疫缺陷病毒1型(HIV-1) [5].
γ -逆转录病毒载体的过山车
发现HIV-1是艾滋病致病因子的快速通道是建立在对基因更简单的逆转录病毒的早期开创性研究的基础上的,这些逆转录病毒现在被分类为α -和γ -逆转录病毒。最重要的是,在50年前连续出版的出版物中,Howard Temin和David Baltimore重写了中心法则,他们记录了两种引起肿瘤的RNA病毒——劳斯肉瘤病毒(RSV)和劳舍鼠白血病病毒(R-MLV)——衍生出的病毒粒子携带一种病毒编码酶,能够将单链RNA转化为DNA [6,7].最终,这使得从RNA模板生成DNA的分子细节得以揭示。8],从而使人们认识到逆转录病毒复制的主要特征是双链DNA的逆转录和基因组整合。
简单逆转录病毒的分子特征,如小鼠白血病病毒(MLV),不仅支持迅速识别HIV-1作为艾滋病的病原体。它也为基因治疗的新概念铺平了道路,这些新概念在20世纪80年代初开始成型,并在接下来的40年里开始了一场惊险而崎岖的过山车,经历了风风雨雨。20世纪90年代末,基于HIV的载体技术出现了,但这一切都始于巴尔的摩和泰明实验室的工作,他们现在已经把逆转录病毒基因组从波尔基因编码到5 '端附近的区域,在那里他们偶然发现了指导病毒RNA合并到病毒粒子的RNA基序。
引导RNA封装进入病毒粒子的二级RNA结构被统称为包装信号Ψ。当Baltimore和同事去除Moloney小鼠白血病病毒(Mo-MLV)引物结合位点下游的351个核苷酸片段时,他们发现病毒复制被严重抑制[9].然而,重要的是,他们还发现缺陷病毒能够结合工程的异种RNA分子——只要351核苷酸片段存在于这些RNA中。通过这种相当简单的设置,他们不仅确定了Mo-MLV Ψ序列,而且确立了逆转录病毒载体技术的基本概念。Baltimore的团队继续生成MLV蛋白稳定表达的细胞系,这些细胞系作为包含Ψ-containing rna的病毒粒子的工厂,并显示基于病毒的此类rna转移到靶细胞,导致逆转录DNA的基因组整合。在平行的研究中,Watanabe和Temin发现了相似的结果独联体-在基因组中相似位置缺失的rsv中的作用缺陷[10],并同样证明了在不产生具有复制能力的辅助病毒的情况下,可以产生具有复制缺陷的逆转录病毒载体[11].
在提供逆转录病毒基因转移到造血干细胞的原理证明的同时研究中[12,13他的愿景是利用逆转录病毒转移外源基因的能力,作为造血干细胞移植疾病遗传治疗的新平台。尽管随后的报告成功地证明了在动物模型中使用逆转录病毒基因转移的造血干细胞治疗的概念,并支持了临床转译的途径[14],人类的突破受到了与干细胞培养和扩增、基因转移的功效以及逆转录病毒转导细胞植入的能力相关的技术问题的挑战。对于由腺苷脱氨酶缺乏症(ADA-SCID)引起的严重联合免疫缺陷的治疗,这些问题被逐一解决,导致患者免疫重建的证据[15,16].逆转录病毒转导CD34+ADA-SCID患者的造血干细胞最终发展成为一种基因治疗产品,用于缺乏匹配造血干细胞供体的患者的自体干细胞移植。这种药物被命名为Strimvelis,于2016年获得了欧洲药品管理局的上市许可,并于2018年由Orchard Therapeutics Ltd从葛兰素史克(GlaxoSmithKline)购买。
Strimvelis基于一种早期MLV载体,携带由长末端重复序列(LTR)启动子驱动的ADA cDNA表达盒。这种载体插入基因组的能力对其用于治疗干细胞至关重要,但这种载体的固有作用也是该技术的致命弱点。因此,基因组插入载体可能会干扰内源性基因调控和表观遗传标记,或直接影响必需基因的阅读框。我们现在知道mlv倾向于插入强增强子、活性启动子和转录起始位点附近[13,17,18,19],这增加了插入突变导致原癌基因激活的风险。这种整合是由逆转录病毒通过插入转录活性区域来确保前病毒DNA的活跃转录的机制所驱动的,因此可能在不同的细胞类型之间有所不同[20.].在MLV的情况下,溴域和外末端(BET)蛋白家族已被证明与病毒编码的整合酶相互作用[21,22].BET蛋白有助于预整合复合物与目标DNA的连接,被认为是MLV插入谱的关键决定因素[23,24,25].
尽管MLV载体有插入基因调控区域的趋势,但用于治疗ADA-SCID的MLV载体插入突变相关的严重毒性尚未在治疗患者中报道。然而,就在最近,也就是2020年10月,Orchard Therapeutics Ltd宣布,一名接受Strimvelis治疗的患者被诊断出患有淋巴t细胞白血病,目前正在接受白血病治疗。该诊断可能归因于与基因治疗相关的载体插入事件,但仍需要更多的信息。此前有报道表明,在γ-逆转录病毒基因疗法治疗的ADA-SCID患者中确实观察到近原癌基因的插入和微妙的突变性克隆变异[26].这一不幸的事件发生在其他疾病的相关基因治疗中观察到的病媒驱动恶性肿瘤的报道之后。在20例接受x -连锁SCID (SCID- x1)治疗的患者中,使用类似的基于mlv的ltr驱动转移方法IL2RG5例临床受益于该治疗的患者发展为淋巴t细胞白血病。在其中4例患者中,恶性肿瘤是由插入激活的LMO-2protooncogene [27,28].同样,用ltr驱动的MLV载体治疗的Wiskott-Aldrich综合征患者,由于该载体在肿瘤附近的整合而发生白血病LMO-2基因(29].
综上所述,多年的开创性工作和发展证明了逆转录病毒基因治疗的临床潜力,但也揭示了这种载体及其作用的严重副作用和缺点。幸运的是,新的载体结构正在酝酿之中,其中一种是基于从抗击艾滋病的斗争中获得的知识。
hiv -1衍生慢病毒载体的诞生和成熟
就像MLV和RSV一样,发现HIV-1基因组区5 '非翻译区的序列是将RNA包装成病毒粒子所必需的[30.,31,32].一系列早期报道表明,含有该区域存在的RNA基序的异源RNA转录本被主动包装成病毒颗粒[33,34,35,36]基本上提供了慢病毒衍生载体的第一个例子。早期生成的辅助病毒无载体转移是通过表达实现的gag pol而且env来自不同质粒的基因,允许基因转移到cd4阳性细胞,即HIV-1的原生靶细胞[37].
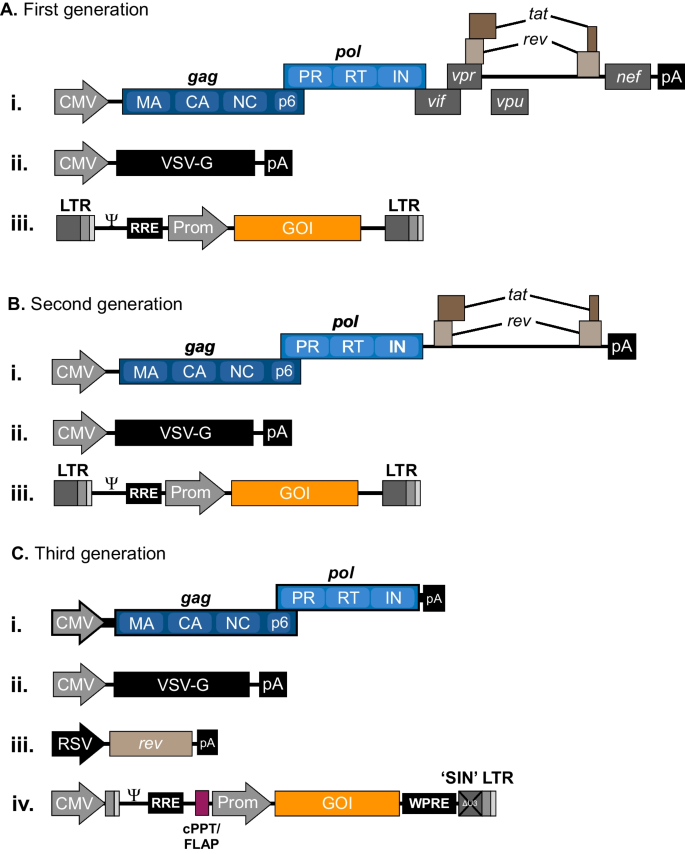
1996年,Naldini和同事报告了第一代矢量系统。1A)基于三个质粒的瞬时转染,(i)由异源CMV启动子驱动的表达Gag、GagPol和几个附属蛋白的包装结构,但具有阻塞的Env和Vpu阅读框,(ii)编码水泡性口炎病毒糖蛋白(VSV-G)的Env表达质粒,以及(iii)携带内部CMV驱动的转基因表达盒的慢病毒载体质粒,两侧是HIV-1 lts和所有所需的独联体元素(38].利用该载体系统,作者在大鼠体内证明了慢病毒基因转移到神经元和稳定的非分裂细胞转导。由于基于mlv的系统缺乏转导非分裂细胞的能力,这一发现揭示了将基因插入非增殖细胞基因组的诱人新能力。一种利用无辅助基因的包装结构的改进的第二代载体系统vif,冲程体积,vpu,nef(无花果。1B) (39]在被第三代慢病毒载体系统取代后不久(图。1C) (40],最终成为生产慢病毒载体的标准平台。为了降低在病毒载体生产过程中产生具有复制能力的HIV-1的风险,作者修改了包装结构答- - -牧师-编码外显子,只允许Gag和GagPol从这个质粒产生。然而,为了在trans中产生Rev,引入了一个额外的由异源启动子驱动的编码Rev蛋白的质粒。此外,在载体结构的5 ' -LTR中含有病毒启动子的u3区域被异源启动子取代,使得HIV-1的转录位点得以保留,并且载体RNA含有病毒启动子独联体-用于逆转录和整合的元素独立于Tat表达。Dull和同事的工作导致了两种载体配置,pRRL和pCCL,很快将被分发到世界各地的实验室,并成为标准的慢病毒载体。在pRRL中,引入233bp RSV增强子/启动子而不是病毒启动子,而在pCCL中,引入673 bp巨细胞病毒(CMV)增强子/启动子序列取代了原始启动子[40].
三代慢病毒载体的示意图。一个第一代载体系统包括所有HIV-1基因,除了env,在单个包装质粒。的env基因被VSV-G取代,并在单独的质粒中提供。载体质粒包含一个内部启动子驱动的转基因盒,其两侧为HIV-1 lts。B在第二代慢病毒载体系统中,编码辅助蛋白Vif、Vpr、Vpu和Nef的基因从包装质粒中去除。C在第三代慢病毒载体系统中牧师基因被放置在一个单独的质粒上,产生总共四个生产所需的独立质粒。用5 ' LTR中的异源启动子(通常是CMV或RSV)替换U3,可以使U3基因的表达降低答基因从包装质粒中去除,而从3 ' LTR中部分删除U3区域会导致所谓的“自灭活”(SIN)慢病毒载体。最先进的第三代慢病毒转移载体通常还含有额外的独联体-作用元件如cPPT/FLAP和WPRE分别提高转导效率和转基因表达。所有的载体都是图示的,而像基因和启动子这样的元素没有按比例显示
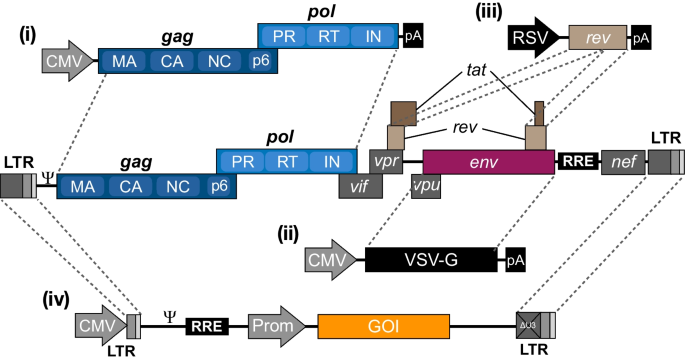
通过排除亲本HIV-1基因组中9个基因中的6个,并表达剩下的基因,呕吐,波尔,牧师加上一个异源env基因,从三个不同的质粒(图;2),在第三代载体生产过程中产生具有复制能力的HIV-1的风险被降到最低。而且,只包含载体RNA独联体- RNA包装、逆转录和整合所需的元素(图;2),降低逆转录过程中重组的风险。到今天为止,25年过去了,还没有关于复制能力病毒生成的报道。然而,值得注意的是,尽管这些载体被认为是安全的,但人们应该意识到一些情况,例如在包括HIV-1感染的原代细胞的研究中,涉及载体rna和可包装的HIV-1转录本的重组事件可能导致具有改变生物学特性的复制能力病毒的形成。与此相关,已经尝试减少原生HIV-1和慢病毒载体之间的序列同源性。这些尝试包括用异源RRE样RNA元件取代慢病毒载体的RRE [41,42],或将Gag/GagPol分离成单独的包装质粒[43],尽管这些方法尚未被广泛采用。目前第三代慢病毒载体生产和转导的一般设置概述在图中。3..
目前第三代慢病毒载体的推导。HIV-1基因组编码三个结构基因(呕吐,波尔而且env),以及规管(牧师而且答)及附件(vif,冲程体积,vpu而且nef)基因。Gag前体包含病毒核心蛋白,包括基质(MA)、衣壳(CA)、核衣壳(NC)和p6蛋白,而GagPol前体还包含蛋白酶(PR)、逆转录酶(RT)和整合酶(IN)蛋白。整个HIV-1基因组两侧是长端重复序列(lts),负责病毒转录、逆转录和整合。对于目前第三代慢病毒载体的生产,HIV-1基因组的基本部分已被分裂成四个单独的质粒;(i)编码GagPol多蛋白的包装质粒,(ii)编码病毒糖蛋白的包膜质粒(此处为VSV-G), (iii)编码rev的rev质粒,以及(iv)携带两侧有lts的转基因的转移载体
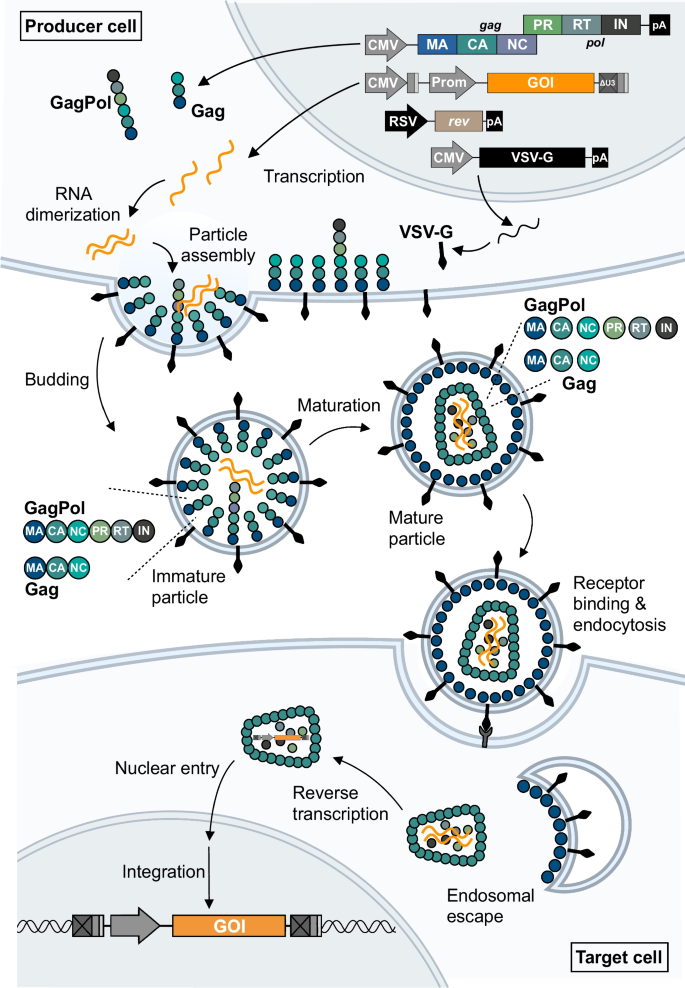
利用慢病毒载体进行基因转移。第三代慢病毒载体是通过四种包装质粒转染产生细胞而产生的,这些质粒将启动Gag和GagPol多蛋白前体、包膜糖蛋白(如VSV-G)、Rev和携带感兴趣(反式)基因(GOI)的转移载体的转录,并将其插入靶细胞。新生的慢病毒颗粒与编码基因的RNA二聚体包装在一起,基因的两侧是病毒ciRNA包装和逆转录所需的s元素。慢病毒颗粒的萌芽导致未成熟的颗粒,然后在Gag和GagPol多蛋白裂解以及病毒核心形成的过程中成熟。通过受体介导的内吞作用进入靶细胞,随后病毒核心被释放到细胞质中。然后发生转移载体单链RNA的逆转录,产生双链DNA,然后将其运输到细胞核并整合到目标细胞的基因组中
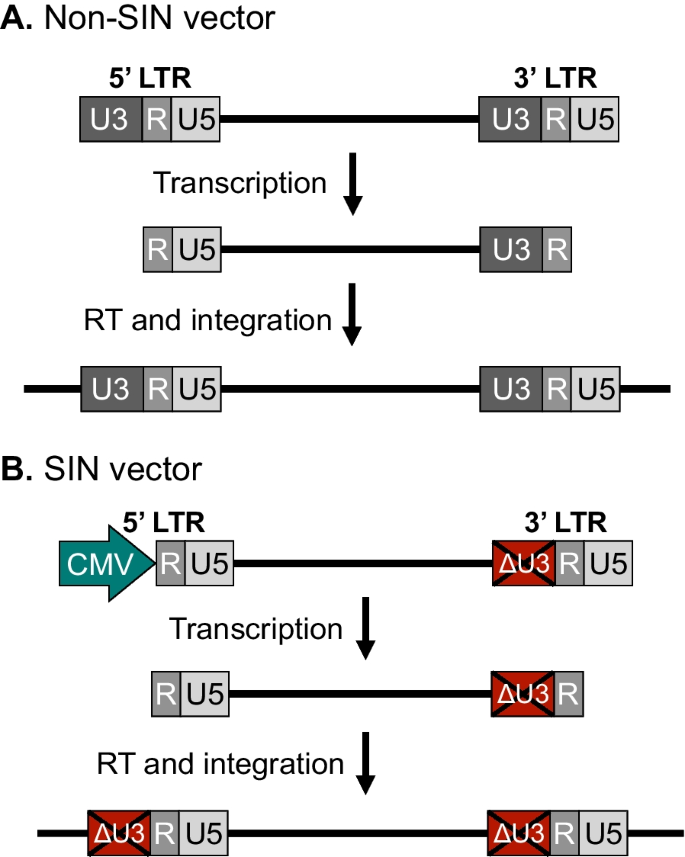
早期,对第三代载体设计进行了一些额外的修改,以增加慢病毒基因转移的安全性和有效性。首先,为了减少整合载体,特别是5 ' -LTR启动子对插入物侧边基因转录活性的影响,在用于产生载体RNA的质粒DNA中引入了位于3'LTR U3区域的病毒启动子的缺失[44].U3区域在逆转录过程中被复制,因此同时存在于前病毒DNA的5 ' -LTR和3 ' -LTR中(图2)。4然而,对于携带U3缺失的载体,称为“自我失活”(或SIN)载体,前病毒5’-LTR的转录活性显著降低,导致转导细胞中全长载体RNA的表达降低(图2)。4B) (45].由于在SIN载体中没有发现基因转移的基本特性或功效受到影响[44], SIN构型迅速成为慢病毒载体的标准特征。其次,Zufferey和他的同事指出了一些基于逆转录病毒的载体只支持相对低水平的转基因表达的趋势。他们将转基因mRNA的核输出不佳放大为基因表达降低的潜在原因,在转基因表达盒的3'UTR中引入土拨鼠肝炎病毒转录后调节元件(WPRE),发现转基因表达明显受到转基因、启动子和载体类型的独立刺激[46].第三,慢病毒载体进一步被发现,载体中由中央多嘌呤束和中央终止序列组成的短基序,分别参与反转录过程中DNA合成的起始和终止,是载体核输入的关键决定因素[[endnendn]]。47,48,49].尽管这个通常被称为cPPT/FLAP的元素的确切功能仍存在一定的争议[50,51,52,53,54,55]在标准的慢病毒载体中,由于对转导效果的有益影响,它得以维持。第四,在慢病毒载体中插入绝缘体和染色质开放元件,以保护转基因基因免受染色体位置效应和异染色质扩散导致的转录沉默。5 ' -HS4 β-珠蛋白(cHS4)绝缘体,既可保护转基因盒免受沉默,又可阻断转基因启动子与邻近启动子和增强子之间的相互作用[56],已发现支持整合慢病毒载体的转基因表达的增加和稳定水平[57].另一种异种元件,泛在染色质打开元件(UCOE),源自人类CpG岛,含有HNRPA2B1-CBX3位点的双向启动子,作为一种防止转录沉默的元件也引起了人们的关注[58].在一些情况下,UCOE已被观察到在由携带UCOE支持的转基因表达盒的慢病毒载体转导的细胞中支持稳定的转基因表达[59,60,61].
定制的慢病毒载体在造血干细胞基因治疗
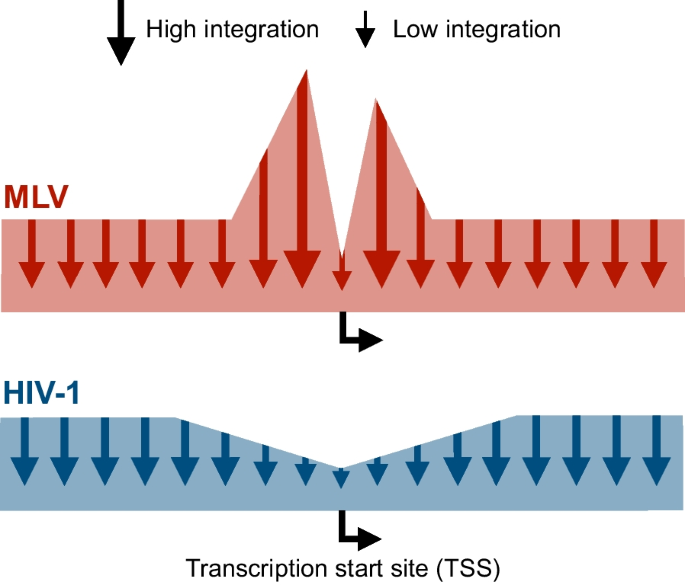
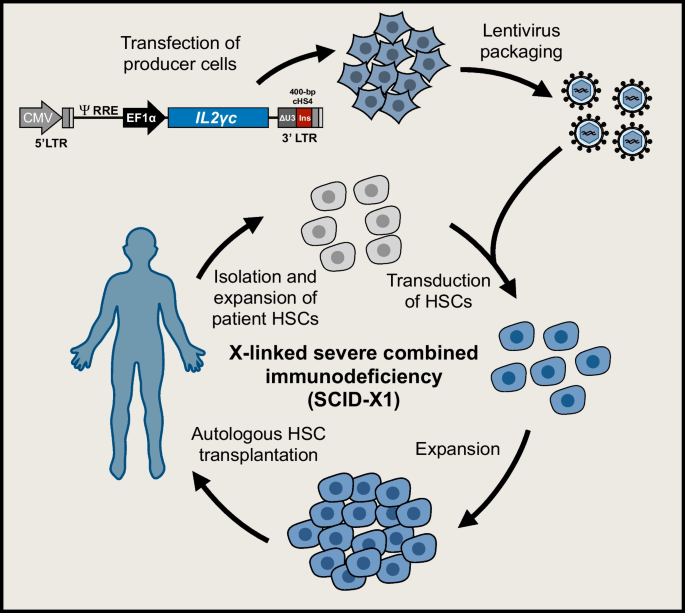
在关于慢病毒基因传递的早期报道后不久,很明显,早期一代vsv -g -伪型hiv -1衍生载体有助于有效地将基因转移到来自脐带血的CD34 +造血干细胞(hsc),并且转导的细胞能够移植到NOD/SCID小鼠[62].这立即引起了人们对使用慢病毒载体进行临床基因转移到CD34 +细胞的兴趣,但在使用γ转录病毒载体治疗的患者中出现的白血病病例加强了对载体整合和插入突变影响的担忧。这将注意力集中在慢病毒载体的整合上。布什曼小组的初步工作带来了令人担忧的消息,他们记录了HIV-1主要整合在积极转录基因中的趋势[63].基于外周血单个核细胞和肺成纤维细胞的慢病毒转导,高达80%的整合位点被发现映射到活性基因[64].然而,这些研究也揭示了MLV-和HIV-1衍生载体之间的一个关键区别,即HIV-1不像MLV那样整合到转录起始位点,而是倾向于沿着基因的整个长度找到其他位置进行整合[64].这种差异反映了MLV和HIV-1在到达整合位点的过程中与不同的细胞蛋白相互作用。因此,一系列论文描述了LEDGF/p75的关键作用,它与HIV-1整合酶相互作用,并帮助指导基因的整合过程和插入谱[65,66,67,68].事实上,一些研究已经通过改变LEDGF/p75的染色质结合域来调整基于hiv -1的慢病毒载体的插入配置,从而将载体整合重定向到其他位点[69,70,71,72,73].专注于未修饰载体的固有特性,一项关键研究在人类CD34 +造血祖细胞中定位了> 32,000个MLV载体整合位点和> 28,000个HIV-1载体整合位点,证实MLV插入位点聚集在基因调控区域,而HIV-1载体插入主要定位在基因内(75.7%)。然而,MLV整合位点聚集在转录起始位点周围,而HIV-1插入在同一区域显著减少,并均匀分布到靶基因的其他区域(图2)。5) [74].基因治疗界终于松了一口气。这些发现确实支持了慢病毒载体比具有有害副作用的MLV载体更安全的观点,这引发了一系列新的研究,旨在使用优化的载体配置和标准的临床方法在CD34 +造血干细胞中进行基因治疗的临床翻译(图4)。6).
MLV和HIV-1整合谱的示意图。来自小鼠白血病病毒(MLV)的逆转录病毒载体的整合谱显示出对转录起始位点(TSS)侧边区域的强烈偏好,而来自HIV-1的慢病毒载体则不表现出对转录起始位点附近区域的整合偏好,而是对活性转录区域的偏好。基于Cattoglio等人提供的数据的示意图表示。[74]
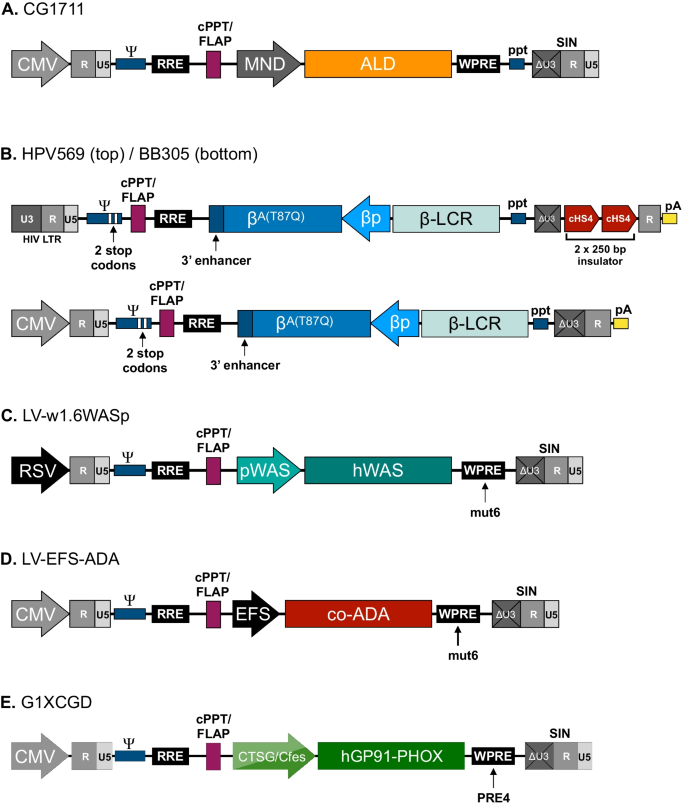
基于慢病毒的造血干细胞基因疗法已用于治疗x -连锁肾上腺脑白质营养不良(X-ALD) [75]、溶酶体储存病变质性白质营养不良(MLD) [76,77], β-血红蛋白病,如β-地中海贫血[78,79,80]和镰状细胞病[81],以及包括ADA-SCID在内的原发性免疫缺陷[82], scid-x1 [83]、维斯科特-奥尔德里奇综合症[84,85,86]和x -连锁慢性肉芽肿病(X-CGD) [87].这超出了这篇综述的范围,涵盖导致基因疗法临床翻译的细节,读者被提到了几篇优秀的综述,作者是或曾经是临床试验的关键人物[26,82,88,89,90,91].然而,在患者中实施慢病毒载体的常见情况是,多年来对定制的载体配置进行了深入分析,包括离体转基因表达研究、体外转化分析、整合分析和相关小鼠模型的临床前体内研究。值得注意的是,尽管两种疾病之间存在明显的临床差异,vsv -g伪型第三代SIN载体被用于转导相同的靶标:患者来源的CD34 +造血干细胞。在无花果。7,我们提供了进入临床的载体设计的例子。
X-ALD是由ABCD1编码ALD蛋白的基因,ALD蛋白是一种三磷酸腺苷结合盒式转运体。对于X-ALD的治疗,Cartier和同事使用了一种矢量设计,这与使用pCCL配置的原始SIN设计非常相似。7A).从野生型中产生ALD蛋白ABCD1由改良的骨髓增生性肉瘤病毒启动子(简称MND)驱动的cDNA,及其转移的表达ABCD1输血后2年>患者可检测到基因,导致主要神经症状改善。β-血红蛋白病通常是由β-血红蛋白产生缺陷引起的,因此使用慢病毒基因疗法治疗β-血红蛋白病的努力一直围绕着健康β-血红蛋白基因的转移。为了生产用于治疗β-地中海贫血的β-球蛋白,已经使用了所谓的LentiGlobin载体(图。7B).该设计的早期版本HPV569是一个SIN载体,包含两个cHS4绝缘体250 bp核心的副本,插入到3’ltr的U3区域,通过隔离附近的原癌基因免受激活来对抗潜在的插入突变[92].该载体在包装过程中的表达是由HIV-1自身的启动子驱动的,而转基因盒,放置在相对于载体本身的相反方向,编码了突变的成体β-珠蛋白变体(β(T87Q))由人β-珠蛋白启动子和人β-珠蛋白基因座控制区驱动。使用突变的成年β-珠蛋白变体可以将患者转移基因的表达与输入的野生型β-珠蛋白区分开来[93].为了进一步的安全性,这个向量在Ψ序列和一个异构聚a序列中具有两个停止密码子。在该载体的改进版本中,称为BB305,用于后续临床试验,去除两个绝缘体核心元件,并使用pccl风格的混合CMV-LTR启动子生产载体rna [80(图。7B). LentiGlobin BB305还用于治疗一名镰状细胞病患者,该患者在治疗1年后出现高水平的抗镰状β-珠蛋白,并纠正了该疾病的主要特征[81].
WAS是一种原发性免疫缺陷引起的突变是基因。在旨在治疗WAS的方案中,一种通常被称为LV-w1.6WASp的载体已在多个试验中使用(图2)。7C).该载体基于Dupre等人开发的格式,Dupre等人测试了由内源性启动子驱动的基因表达的不同变体控制的转基因表达是基因(94].进一步的研究证实,这个1.6 kb的片段位于转录起始位点上游是基因在造血细胞中导致高水平的转基因表达,与经典的异源启动子的水平相当,证明了利用天然调控序列获得细胞靶向表达的可能性是互补脱氧核糖核酸(95].该载体的最终版本包含WPRE信号的突变变体WPREmut6,它支持长期转基因表达,但携带干扰野生型WPRE序列中存在的开放阅读框(ORF)的突变[96].所讨论的ORF编码一种截断的土拨鼠肝炎病毒X蛋白(WHV-X),这是一种潜在的致癌物质[97因此,废除WHV-X蛋白的合成,增加了LV-w1.6WASp载体的安全性。用该载体治疗的患者已表现出稳定的遗传校正造血干细胞植入,导致持续的临床获益和改善的免疫功能,这从湿疹和感染的频率和严重程度的改善中得到了明显的改善[84,85].最近,一名使用这种载体治疗的患者能够停止免疫抑制,并使用免疫球蛋白进行支持[86].基于该载体的经验,通过将W1.6-WAS盒与密码子优化版本的W1.6-WAS盒交换,制备了用于ADA-SCID临床治疗的pccl型载体艾达在组成性作用伸长因子1α启动子(EFS)短形式的转录控制下的cDNA(图。7D) (98].该载体的有效性最近在ADA- scid的临床试验中得到证实,该试验显示,持续表达ADA和功能性免疫重建的总生存率较高[26,99].X-CGD结果来自于CYBB基因编码gp91phox,吞噬细胞nadph氧化酶的催化亚基。用于患者的治疗,一种含有密码子优化的CYBB的pccl型慢病毒载体互补脱氧核糖核酸版本由嵌合启动子表达,允许在髓细胞中高水平表达[87(图。7E).该启动子是编码组织蛋白酶G和c-Fes基因5 ' -侧翼区域的融合,在粒细胞中高度活跃,在该载体环境中被发现可有效恢复nnaph -氧化酶活性[One hundred.].
慢病毒载体整合位点分布:来自临床的经验
基于上述临床研究,代表了十年来利用慢病毒载体向造血干细胞传递治疗性转基因的经验,可以评估慢病毒基因整合到干细胞的安全性。由于新一代测序方法的技术改进,从第一次临床试验开始,在个体患者中确定的载体整合位点的数量稳步增加,目前已映射的载体整合位点的总数(每项研究仅计算该特定研究中唯一的位点)总共超过150万个整合位点。最近,Kohn和同事在9名X-CGD患者中鉴定出724,685个独特的慢病毒整合位点[87].分析载体整合位点分布可以监测多克隆造血的程度,整合位点可用于跟踪克隆行为和潜在的克隆扩增。值得注意的是,所有的研究都证实了慢病毒载体插入基因的趋势(通常70%到80%的插入在基因中被映射),并聚集在基因丰富的区域。然而,令人鼓舞的是,除了一项研究外,在所有的研究中,没有检测到优势克隆的多克隆整合谱都表明没有克隆生长,并降低了移植慢病毒转导干细胞的风险。在一次试验中,良性克隆携带载体整合在HMGA2该基因被创建,并被发现通过破坏转基因β-珠蛋白基因的调节导致产量增加来支持治疗效果[78].这种优势没有与任何严重的不良事件相关,并且发现在治疗后第12年逐渐被其他克隆所取代[80].总之,来自临床试验的报告证明造血的多克隆再生没有遗传毒性的迹象,并认为第三代慢病毒载体的整合概况确实比γ -逆转录病毒载体的概况更安全。这些发现支持了干细胞治疗慢病毒基因转移的持续发展。
研究慢病毒载体在体内的适用性
对于大多数疾病,在体外处理细胞并在培养瓶中转移治疗基因是不可取的。弗里德曼和罗布林在大约50年前首次提出基因疗法的概念时,明智地敦促人们在通过直接向患者注射基因来治疗人类疾病时要谨慎。101].事实上,多年来,基因治疗界经历了弗里德曼和罗布林预见的一些科学挑战,但许多突破,主要建立在基于腺相关病毒(AAV)的基因传递上,尤其是新型基因组编辑技术的发现,吸引了进一步的关注和大量投资,以开发体内基因治疗。早期,最终导致第三代慢病毒载体的一系列论文一致显示,将vsv -g -伪慢病毒载体注射到纹状体或海马体的大鼠的终分化神经元中,基因传递稳健[38,39,44,102,103].后来的研究表明,在成年小鼠大脑脑室下区的成体神经干细胞中有有效的慢病毒基因标记[104,105].此外,在视网膜下注射GFP编码的慢病毒载体的大鼠眼睛中,分别在使用CMV和视紫红质启动子的视网膜色素上皮细胞和感光细胞中有效转导和GFP表达明显[106].该策略最近被用于将基因组编辑工具包传递到小鼠视网膜色素上皮细胞,以实现对视网膜色素上皮细胞的敲除vegfa基因治疗老年性黄斑变性的可行性研究[107].
由于VSV-G具有广泛的组织特异性和高转导能力,在体内将转基因基因传递给细胞主要是使用VSV-G伪分型的慢病毒载体实现的,而体内慢病毒载体传递的一个有趣的方面是能够用替代的表面蛋白替代VSV-G,从而改变载体的取向。Girard-Gagnepain和同事证明,与vsv - g -伪慢病毒载体相比,狒狒内源性逆转录病毒糖蛋白在病毒粒子表面的结合,导致在人CD34 + hsc、b细胞和t细胞中的载体转导效果增加[108].作为另一个例子,Kobinger和同事展示了使用丝状病毒包膜蛋白假型的慢病毒载体在体内气道上皮细胞的有效转导[109].
对于肝脏导向的基因治疗,基于aav的载体已经显示出巨大的临床潜力,例如在aav治疗的B型血友病患者中持续表达高活性因子IX [110].然而,慢病毒载体可以潜在地提供某些优势,例如允许转基因整合在儿科患者的生长肝脏中。此外,尽管AAV导向的基因治疗可能会受到预先存在的中和抗AAV抗体和针对AAV的细胞免疫的挑战,但这种预先存在的针对伪型hiv衍生颗粒的免疫在患者中不太常见。早期在慢病毒转导的小鼠肝脏中实现稳定因子IX的尝试失败,导致Brown和同事开发了携带造血特异性microRNAs靶点的慢病毒载体[111].这种优雅的方法的基本原理是在转导的造血细胞(包括免疫系统的抗原提呈细胞)中限制转录后的载体表达,从而最大限度地降低引发针对转基因编码因子IX的免疫反应的风险[111].因此,给药含有4个miR-142-3p靶点阵列的慢病毒载体可导致血友病B小鼠的表型校正[112].值得注意的是,将这种慢病毒载体注射到通过插入突变易患肝癌的小鼠模型中并没有导致癌症形成,这表明载体的基因组整合是安全的,不会引起基因毒性[113].类似的方法也被用于治疗高胆红素血症的啮齿动物模型[114]和血友病A [115].使用mir -142-3p调控的载体配置,在3只血友病犬中实现了IX因子的稳定重建(高达正常的1%),从而减少了所有3只接受体内慢病毒基因治疗的动物的自发出血事件[113].然而,假设这一相对温和的结果反映了系统给药慢病毒颗粒的快速清除[116],这导致了有关慢病毒生产方法的研究,特别是围绕病毒颗粒的生产者细胞来源的质膜的工程。因此,Milani及其同事认为,CD47分子的密度对病毒颗粒逃避肝脏和脾脏巨噬细胞以及抗原提呈细胞吞噬摄取的能力具有重要意义。他们设计了CD47过表达的细胞系,并发现这些产生细胞中产生的装载CD47的慢病毒载体对吞噬的敏感性较低,从而导致非人类灵长类动物中转基因表达水平的升高[116].这些发现说明了在接近人体模型中的安全性和有效性,并指出选择生产者细胞,特别是质膜工程作为优化体内慢病毒载体性能的关键靶点[117].
利用慢病毒载体生产CAR-T细胞
慢病毒载体的临床潜力在嵌合抗原受体(CAR) t细胞的生成中特别明显,CAR - t细胞在治疗恶性血液病方面显示出令人印象深刻的潜力[118,119,120,121].CARs是一种合成受体,由细胞外免疫球蛋白结构域(用于传递抗原识别)、细胞内t细胞激活结构域(通常为CD3ζ)和其他共刺激信号结构域(如CD28或4-1BB)组成[122].利用基因转移技术,这些工程CARs可以被传递到免疫效应细胞,最显著的是自体t细胞,重定向细胞的特异性,这些细胞在输注和植入后能够表现出抗肿瘤作用[123].虽然现代CAR - t细胞已经使用γ -逆转录病毒和慢病毒载体以及非病毒载体生成,但由于良好的整合特性和高转导率,慢病毒载体已成为生成CAR - t细胞疗法的首选载体[124].我们在这里的目的不是详细概述慢病毒载体在CAR-T细胞治疗中的使用,而只是简单地说明这些载体对CAR-T细胞工程的重要性。靶向cd19的CAR-T细胞疗法Tisagenlecleucel (Kymriah™,原名CTL019)于2017年获得FDA批准,目前用于b细胞前体急性淋巴细胞白血病(ALL)和复发或难治性(r/r)大b细胞淋巴瘤的治疗,是使用慢病毒基因转移产生的CAR-T疗法的一个突出例子[119,125,126,127,128,129,130].这些抗cd19 CAR-T细胞的生成是使用第三代prrl型SIN慢病毒载体完成的,本质上是一种标准设置,旨在将抗cd19 CAR-T细胞输送到受刺激的CD4和CD8 T细胞[129].在开发抗cd19 CAR - T细胞时,Milone和同事进一步证明,通过用伸长因子-1α (EF-1α)启动子取代prrl型载体中的内部CMV启动子,抗cd19 CAR - T细胞的表达可以增加并最佳地维持在CD4和CD8 T细胞中,这对于CAR - T细胞在体内的长期抗肿瘤作用至关重要[129].
CAR- t细胞显示临床疗效的另一个领域是使用抗gd2 CAR- t细胞治疗成神经细胞瘤。然而,与b细胞恶性肿瘤的反应相比,CAR- t细胞疗法在实体肿瘤(如成神经细胞瘤)中的临床转译并不那么成功,反映了与实体肿瘤相关的各种挑战,包括缺乏高表达的肿瘤特异性抗原以及免疫抑制的肿瘤微环境,导致注入的CAR- t细胞衰竭和功能障碍[131,132,133].然而,为弥补CAR - t细胞治疗实体瘤的无效而开发的策略之一是为CAR - t细胞提供额外的诱导细胞因子反应,通常是通过活化t细胞的核因子(NFAT)转录因子介导的。这种所谓的TRUCKs(重定向通用细胞因子介导杀伤的T细胞)的发展可以通过传递两个单独的载体来产生;一个包含CAR,一个包含nfat诱导的细胞因子(如IL-12)。然而,最近Zimmermann和同事利用慢病毒载体的大容量载货能力,使用单一的第三代SIN慢病毒载体来转移组成型表达的抗gd2 CAR和nfat诱导的IL-12,从而生成抗gd2 TRUCKs [134].
鉴于自第三代慢病毒载体开发以来,最先进的慢病毒载体的设计并没有发生显著变化,几乎所有的努力,包括用于生产CAR -t细胞的慢病毒载体,都是基于第三代具有SIN配置的包装系统。然而,早期版本的第二代慢病毒载体确实被用于继续进行临床试验的研究[126].鉴于对CAR- t细胞疗法的巨大关注和基于CAR- t细胞的免疫疗法的快速发展,标准的第三代慢病毒载体将继续在癌症疗法的发展中发挥关键作用。
使用慢病毒载体进行CRISPR传递
基于快速发展的CRISPR技术家族的基因组编辑已经彻底改变了分子生物学,并正在迅速转变为有前途的位点定向基因修饰和基因治疗工具[135].基于标准CRISPR/Cas9系统的CRISPR基因编辑是基于Cas9内切酶和单个引导RNA的共同传递,后者通过sgRNA与目标位点两条DNA链之一的碱基配对将Cas9引导到基因组中的预定区域[136].此外,如果基因修饰涉及通过同源重组修复卵裂位点,则需要外源供体。随着CRISPR传递成为一个关键焦点,基因治疗界毫不意外地从满足传统基因治疗要求的载体技术中找到了灵感。然而,至少在治疗目的上,目标已经改变;使用CRISPR,目的是获得有效的基因转移,允许Cas9/sgRNA复合物在靶向细胞中快速建立,但表达应该只是短暂的,因为由于免疫反应或脱靶DNA切割水平的增加,Cas9/sgRNA的长时间产生可能是有毒的。
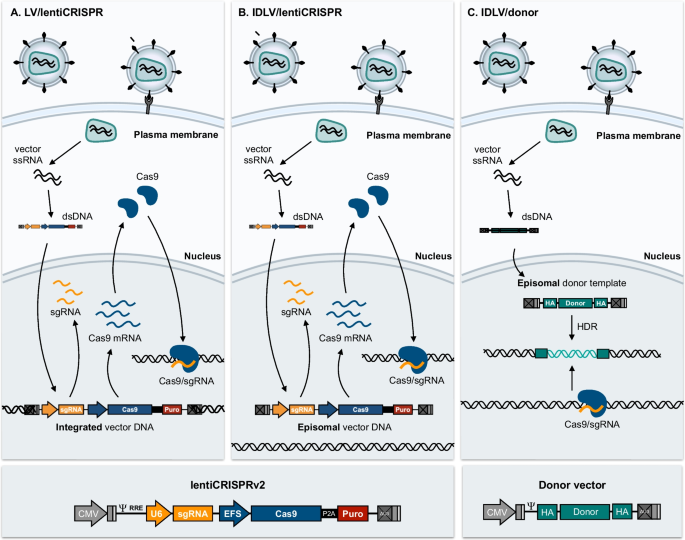
基于腺相关病毒(AAV)载体的基因转移是有效的、安全的,并且得到了充分的研究,这些载体正在被研究用于Cas9和sgRNA表达盒的共同递送[137,138,139],以及运送供体修复模板[140,141,142].在生长细胞中,基于aav的CRISPR递送可能会导致Cas9/sgRNA复合物的短暂生成,这是由于episomal DNA中间产物随着时间的推移而损失,而在非分裂细胞中,如果表达不受调控和限制,则表达可能是长期的和潜在的毒性。慢病毒载体已经成为CRISPR工具的重要载体,但Cas9和sgRNA表达基因的整合导致永久表达不太可能支持安全的治疗应用,除非表达受到严格调控。因此,基于Zhang实验室发表的lentiCRISPRv2向量[143],慢病毒传递主要演变为分子遗传学研究的关键工具。LentiCRISPRv2是一种经典的pccl型第三代慢病毒载体,携带两个表达盒,(i)由U6 snRNA启动子驱动的sgRNA盒,这是一种III型RNA聚合酶III启动子,通常用于驱动小RNA的表达;(ii)具有延伸因子-1α因子短启动子驱动的表达盒酿脓链球菌Cas9 (SpCas9)通过2A自裂肽与标记基因融合(图2)。8).该载体的早期v1版本导致相对较低的滴度[144],但一系列较小的调整,包括sgRNA盒的重新定位,导致了LentiCRISPRv2,其产生的载体具有更高的功能滴度[143].为了特定的研究目的,它可能有助于生产稳定表达SpCas9的细胞系,并利用慢病毒载体仅与选择标记基因一起传递sgRNA盒。该载体的转移效率高于携带SpCas9基因的载体,这可能对某些应用至关重要[143].基于标准慢病毒载体转导的基因组编辑是基于SpCas9和sgRNA之间的复合物形成,这些复合物是由该载体的集成副本产生的(图2)。8A).在整合载体存在的细胞群中,随着时间的推移,随着SpCas9/sgRNA复合物的建立并最终在所需位置切割DNA,目标indels将出现。根据细胞类型的不同,如果靶位点位于某个基因的编码区,24小时后可能开始出现indels,并在接下来的几天内积累,通常会导致完全敲除[145].
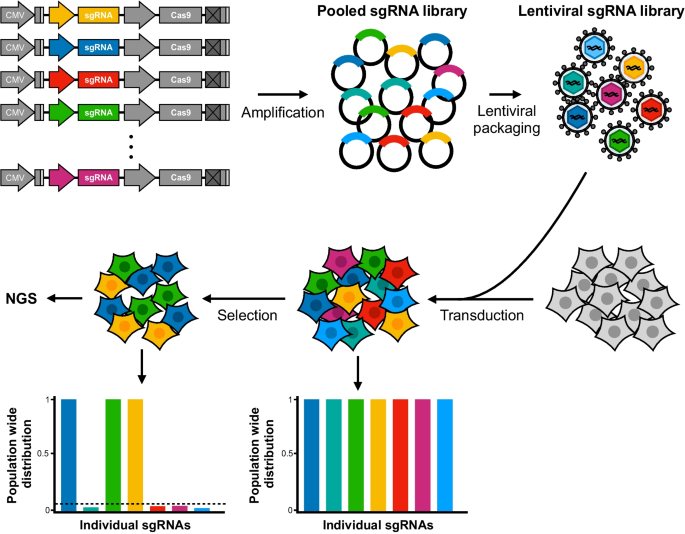
SpCas9-和sgrna -编码的慢病毒载体的基因组插入是基于crispr的新型慢病毒基因功能查询策略的基本特征。通过将慢病毒载体的特性与CRISPR定向基因敲除相结合,有可能创建由数千个不同的慢病毒载体组成的全基因组慢病毒CRISPR文库,每个载体编码一个针对单个基因的独特sgRNA [144].慢病毒将sgRNA文库转移到SpCas9稳定表达的细胞群中,导致由特定细胞中表达的sgRNA确定的每个细胞中出现不同的敲除突变(图2)。9).这就产生了一个由细胞组成的异质群体,每个细胞都携带一个独特的基因型以及一个慢病毒“足迹”或条形码,其中一个sgRNA序列揭示了目标基因的身份。根据应用于异质细胞群体的选择方式,例如对癌症药物的耐药性,现在可以通过对所选群体中存在的sgRNA盒库的测序来确定影响感兴趣表型的候选基因。这种全基因组筛选已经确定了各种癌症中驱动肿瘤生长和细胞增殖的基因[144,146].我们和其他人已经确定了影响弥漫性大b细胞淋巴瘤中癌变b细胞药物反应的基因[147,148,149]并提供了利用整合慢病毒载体进行全基因组筛查的方案[150,151,152,153].
出于特定目的,在不整合基因组中的SpCas9和sgRNA基因的情况下递送CRISPR组件可能是有吸引力的。8B).对一系列HIV-1整合酶突变体的早期研究表明,在被携带氨基酸取代的病毒(如D64V)感染的细胞中,整合减少,但在整合酶的催化区域内,episomal DNA中间产物的产生不受影响[154].因此,携带D64V整合酶变体的病毒的整合活性降低到野生型病毒的1/ 10000。用携带D64V变异的包装物生产的第三代整合酶缺陷慢病毒载体(idlv)最初被证明在体内有丝分裂后组织中促进有效的基因转移和稳定的表达[155]并已适用于基于重组酶瞬时表达的替代整合平台[156]和DNA转座酶[157,158,159].在CRISPR传递的情况下,lentiCRISPRv2可以在IDLV环境中传递,只允许短暂的SpCas9/sgRNA表达,至少在分裂细胞中(图2)。8B). Lombardo和同事调整了IDLV配置,将锌指核酸酶输送到造血干细胞[160], Ortinski等人将LentiCRISPRv2载体用于IDLV定向向大鼠腹侧纹状体传递SpCas9和sgRNA,证明了在非分裂脑细胞中IDLV传递后靶向基因敲除的长期效应[161].IDLV载体允许引入indels而无需将载体整合到基因组中,但在分裂细胞时,相对于精通整合的系统,可能会带来效率降低的风险。然而,值得注意的是,对于基于crispr的基因组编辑,IDLV平台可能特别适合于传递episomal供体修复模板,在转导细胞中的逆转录后,可以通过同源重组进行修复,从而允许在基因组中引入特定的编辑(图2)。8C) (160,162].
慢病毒蛋白转运:慢病毒转运的新途径
基因治疗的治疗重点一直是将遗传信息传递到细胞和组织。然而,随着基于基因组编辑工具包管理的基因组编辑技术的发现,最终目标可能不一定是转基因的长期表达,而是基因组中起作用的蛋白质的短期活性。正如上文所述,到目前为止,将CRISPR编辑方法转化为治疗方法的尝试从强大的基因传递技术中找到了灵感,这些技术在过去40年里得到了发展和优化。然而,为了减少脱靶切割事件和避免毒性作用,这些技术可能需要严格调控基因表达,允许Cas9和sgRNA的产生在成功的基因干预后被关闭,并且可能最终不是治疗性CRISPR管理的最佳药物。
然而,重组Cas9蛋白与化学修饰的sgrna复合物的核修饰已成为干细胞体外基因组编辑的首选策略[140],体内传递技术仍有改进的空间,这些技术可以靶向细胞类型,并提供有效但短期的靶向细胞暴露于CRISPR工具。病毒再次证明了蛋白质的传递是如何完成的,这为蛋白质传递工具的开发提供了灵感。逆转录病毒和慢病毒的特点是它们能够通过逆转录将RNA转化为DNA,并将双链DNA插入宿主细胞基因组。这些过程分别由逆转录酶和整合酶控制,这两种蛋白质是病毒自身携带遗传信息进入宿主细胞的。可以利用病毒的这些特性,使病毒颗粒与外源蛋白质(包括基因组修饰酶)结合并转移到暴露于蛋白质工程病毒颗粒的细胞核中。通过将Gag和GagPol蛋白n端相关的外源蛋白融合,我们已经证明了这些蛋白被纳入病毒颗粒,在病毒粒子成熟过程中以蛋白酶依赖的方式从病毒多肽中释放,并在涉及内体逃逸的过程中在细胞内释放(见图)。10图示)[163].在之前的工作中,我们证明了piggyBac DNA转座酶、锌指核酸酶和tal效应核酸酶在慢病毒衍生颗粒中被包装和运输到细胞的转移和功能[162,163,164,165].此外,Cas9蛋白的慢病毒传递在表达sgRNA的细胞中诱导目标indels的形成[166],表明慢病毒传递可以进一步优化,以促进由Cas9和sgRNA组成的核糖核蛋白复合物的转移。在早期的工作中,我们展示了用“all-in-one”慢病毒颗粒处理的细胞中的基因校正,这些慢病毒颗粒既携带靶向位点的内切酶,又携带含有逆转录时同源重组修复模板的载体RNA [162].由于这种递送基因组编辑工具包的方法仍处于起步阶段,仍缺乏在体内适用的证据,但使用不同的伪类型进行细胞靶向基因组编辑的潜力,以及提供更复杂的编辑技术,如rna引导的碱基和素编辑器[167,168],鼓励进一步研究这类方法。
慢病毒蛋白转导示意图。慢病毒载体可以被操纵包装感兴趣的蛋白质(POI)。这可以通过将POI融合到GagPol多肽的c端整合酶(IN)蛋白来实现,或者如图所示,通过将其融合到由Pleckstrin同源结构域(PH)分离的n端基质(MA)蛋白来帮助锚定质膜。整合酶含有D64V突变,导致病毒颗粒整合酶缺陷。通过在POI和MA蛋白之间包含一个蛋白酶识别位点,POI在成熟病毒颗粒中被释放,并通过目前未知的机制传递到靶细胞的细胞核。已经提出了两种可能的机制:在病毒核心内运输POI或通过细胞质扩散。一个可选的载体RNA基因组可以包含在病毒颗粒中,这对CRISPR-Cas9基因组编辑有兴趣,可以成为HDR的供体模板。在这种情况下,慢病毒颗粒将在一个慢病毒颗粒中携带基于crispr的HDR的所有必要成分
结论
在过去的某个时候,病毒进化到可以运输自己的遗传信息,并携带在宿主细胞中处理遗传信息所需的蛋白质。我们现在知道,病毒与细胞因子相互作用不仅是为了对抗细胞抗病毒反应,而且还能穿越细胞质,进入细胞核,并可能到达基因组中有吸引力的着陆点。病毒进化的这些早期步骤塑造了病毒,并提供了可能支持或阻碍其作为安全临床基因治疗的载体技术的特性。hiv衍生的慢病毒载体被赋予了一个理想的整合轮廓,促进转基因盒在转录活性区域的着陆,而不会严重影响内源性基因表达。来自临床试验的新证据见证了一种安全有效的载体技术,在基因和细胞治疗中具有明显的临床益处。与此同时,利用慢病毒传递进行全基因组筛查和基因组编辑的新方法正在萌芽。慢病毒载体正处于鼎盛时期,在25年后仍然是最先进的。
数据和材料的可用性
不适用。
缩写
- AAV:
-
腺相关病毒
- 艾达:
-
腺苷脱氨酶缺乏症
- 艾滋病:
-
获得性免疫缺陷综合症
- 注:
-
溴域和外端
- 汽车:
-
嵌合抗原受体
- Cas9:
-
crispr相关蛋白9
- 巨细胞病毒:
-
巨细胞病毒
- cPPT:
-
中央多尿道
- CRISPR:
-
有规律地聚集在一起的短回文重复
- EF-1α:
-
伸长率因子- 1α
- EFS:
-
短伸长因子1α启动子
- hiv - 1:
-
人类免疫缺陷病毒1型
- HSC:
-
造血干细胞
- IDLV:
-
整合缺陷慢病毒载体
- LTR:
-
长终端重复
- MLD:
-
异染性脑白质营养不良
- MLV:
-
小鼠白血病病毒
- Mo-MLV:
-
Moloney-MLV
- 子:
-
开式阅读架
- R-MLV:
-
Rauscher-MLV
- RSV:
-
劳斯肉瘤病毒
- RT:
-
逆转录酶
- SCID-X1:
-
x连锁SCID
- SCID:
-
严重联合免疫缺陷
- sgRNA:
-
单导RNA
- 罪:
-
Self-inactivating
- UCOE:
-
无处不在的染色质打开元件
- VSV-G:
-
水泡性口炎病毒糖蛋白
- 是:
-
Wiskott-Aldrich综合症
- WHV-X:
-
土拨鼠X型肝炎病毒
- WPRE:
-
土拨鼠肝炎病毒转录后调节元件
- X-ALD:
-
x连锁罹
- X-CGD:
-
x连锁慢性肉芽肿病
参考文献
洛杉矶,肺孢子虫肺炎中心。《世界末日》杂志,1981;30(21):250-2。
Hymes KB,张T, Greene JB, Prose NS, Marcus A, Ballard H,等。同性恋男性卡波西肉瘤——附8例报告。《柳叶刀》杂志。1981;2(8247):598 - 600。
Klatzmann D, Barre-Sinoussi F, Nugeyre MT, Danquet C, Vilmer E, Griscelli C,等。淋巴病相关病毒(LAV)对辅助诱导T淋巴细胞的选择性趋向性。科学。1984;225(4657):59 - 63。
Broder S, Gallo RC。一种与艾滋病有关的致病逆转录病毒(HTLV-III)。中华实用医学杂志,2004;26(4):344 - 344。
柯芬J, Haase A, Levy JA, Montagnier L, Oroszlan S, Teich N,等。艾滋病病毒叫什么?大自然。1986;321(6065):10。
RNA肿瘤病毒病毒粒子中依赖RNA的DNA聚合酶。大自然。1970;226(5252):1209 - 11所示。
崔敏,李秀华,李秀华,等。劳斯肉瘤病毒粒子中rna依赖性DNA聚合酶的研究。大自然。1970;226(5252):1211 - 3。
Gilboa E, Mitra SW, Goff S, Baltimore D.一个详细的逆转录模型和关键方面的测试。细胞。1979;18(1):93 - 100。
Mann R, Mulligan RC, Baltimore D.逆转录病毒包装突变体的构建及其用于生产无辅助缺陷逆转录病毒。细胞。1983;33(1):153 - 9。
渡边S,泰敏HM。脾脏坏死病毒是一种禽类逆转录病毒,其包封序列位于5 '长的末端重复序列和gag基因的起始位点之间。美国国家科学研究院。1982; 79(19): 5986 - 90。
渡边S,泰敏HM。禽网状内皮增生症病毒克隆载体辅助细胞系的构建。分子生物学杂志,1983;3(12):2241-9。
Joyner A, Keller G, Phillips RA, Bernstein A.细菌基因的逆转录病毒转移到小鼠造血祖细胞。大自然。1983;305(5934):556 - 8。
Williams DA, Lemischka IR, Nathan DG, Mulligan RC。将新的遗传物质引入小鼠多能造血干细胞。自然。1984;310(5977):476 - 80。
Bodine DM, Moritz T, Donahue RE, Luskey BD, Kessler SW, Martin DI,等。逆转录病毒介导的基因转移到CD34+骨髓细胞后,小鼠腺苷脱氨酶基因在多系恒河猴造血细胞中的长期体内表达。血。1993;82(7):1975 - 80。
Aiuti A, Slavin S, Aker M, Ficara F, Deola S, Mortellaro A,等。干细胞基因治疗联合非清髓性调节治疗ADA-SCID科学。2002;296(5577):2410 - 3。
Gaspar HB, Bjorkegren E, Parsley K, Gilmour KC, King D, Sinclair J,等。在停止PEG-ADA和使用温和预处理后,通过干细胞基因治疗成功重建ADA-SCID的免疫。Mol Ther, 2006;14(4): 505-13。
李志强,李志强,李志强,李志强,等。增强子是小鼠白血病病毒载体整合的主要靶点。中国病毒学杂志,2014;88(8):4504-13。
LaFave MC, Varshney GK, Gildea DE, Wolfsberg TG, Baxevanis AD, Burgess SM。MLV集成站点选择由强增强子和主动启动子驱动。中国生物医学工程学报,2014;42(7):4257-69。
吴霞,李勇,克里斯B, Burgess SM。人类基因组中的转录起始区是MLV整合的有利靶点。科学。2003;300(5626):1749 - 51。
Biasco L, Ambrosi A, Pellin D, Bartholomae C, Brigida I, Roncarolo MG,等。根据靶细胞的基因表达和染色质构象,逆转录病毒载体在基因治疗患者中的整合特征是细胞特异性的。中国生物医学杂志,2011;3(2):89-101。
艾耶,斯瓦普娜,马兰妮,阿拉米尼,施耐德,帕朗博,等。通过破坏整合酶和BET蛋白家族相互作用改变小鼠白血病病毒的整合。中国生物医学工程学报,2014;42(9):5917-28。
李志强,李志强,李志强,李志强,等。Brd4与小鼠白血病病毒整合酶和单个核小体的双峰高亲和关联。中国生物医学工程学报,2014;42(8):4868-81。
De Rijck J, De Kogel C, Demeulemeester J, Vets S, El Ashkar S, Malani N,等。BET家族蛋白靶向moloney小鼠白血病病毒整合转录起始位点附近。科学通报,2013;5(4):886-94。
Gupta SS, Maetzig T, Maertens GN, Sharif A, Rothe M, Weidner-Glunde M,等。溴域和外域染色质调控因子可作为小鼠白血病病毒整合的辅助因子。中国病毒学杂志,2013;87(23):12721-36。
沙玛A, Larue RC, Plumb MR, Malani N, Male F, Slaughter A,等。BET蛋白促进小鼠白血病病毒在转录起始位点的有效整合。美国国家科学研究院。2013; 110(29): 12036 - 41。
Thrasher AJ, Williams DA。原发性免疫缺陷的基因治疗进展。生物化学学报,2017;25(5):1132-41。
王广平,王志强,王志强,等。逆转录病毒介导的SCID-X1基因治疗4例患者的插入性肿瘤发生。中华临床医学杂志。2008;29(9):342 - 342。
王晓明,王志强,王志强,等。插入突变结合获得性体细胞突变导致SCID-X1患者在基因治疗后发生白血病。中华临床医学杂志。2008;29(9):344 - 344。
Braun CJ, Boztug K, Paruzynski A, Witzel M, Schwarzer A, Rothe M,等。Wiskott-Aldrich综合征的基因治疗——长期疗效和基因毒性。中国生物医学工程学报,2014;26(6):366 - 366。
Aldovini A, Young RA。参与人类免疫缺陷病毒1型包装的RNA和蛋白质序列突变导致非传染性病毒的产生。中国病毒学杂志,1990;64(5):1920-6。
克拉维尔F,奥伦斯坦JM。一种人类免疫缺陷病毒的突变体,RNA包装减少,颗粒形态异常。中国病毒学杂志,1990;64(10):5230-4。
杆,Gottlinger H, Haseltine W, Sodroski j .识别所需的一系列有效的人类免疫缺陷病毒1型RNA包装成病毒粒子。中国病毒学杂志,1989;63(9):4085-7。
Buchschacher GL Jr, Panganiban AT。诱导表达外源基因的人免疫缺陷病毒载体。中国病毒学杂志,1992;66(5):2731-9。
Hayashi T, Shioda T, Iwakura Y, Shibuta H.人类免疫缺陷病毒1型RNA包装信号。病毒学。1992;188(2):590 - 9。
波兹南斯基M,李维A,伯杰隆L,哈泽尔廷W,索德罗斯基J.缺陷人免疫缺陷病毒1型载体在人淋巴细胞中的基因转移。中国病毒学杂志,1991;65(1):532-6。
岛田T,藤井H,三谷H,年辉AW。通过重组人免疫缺陷病毒逆转录病毒载体靶向和高效地将基因转移到CD4+细胞。中国科学(d辑),2007;
Richardson JH, Kaye JF, Child LA, Lever AM。人类免疫缺陷病毒1型载体的辅助病毒无病毒转移。中华病毒学杂志,1995;36 (Pt 3): 691-6。
Naldini L, Blomer U, Gallay P, Ory D, Mulligan R, Gage FH,等。慢病毒载体在体内基因传递和非分裂细胞的稳定转导。科学。1996;272(5259):263 - 7。
朱菲里,李志强,李志强,李志强,等。一种新型慢病毒载体的研究进展。生物技术学报。1997;15(9):875 - 75。
杜毅,朱伟,陈志强,陈志强,等。带有条件包装系统的第三代慢病毒载体。中国病毒学杂志,1998;72(11):8463-71。
王志强,李志强,李志强,等。慢病毒载体制备中部分重组子的分析。Hum Gene Ther Methods. 2014;25(2): 126-35。
格鲁克年代,T, Uberla k降低动员Rev-responsive element-deficient慢病毒载体。中国病毒学杂志,2005;79(14):9359-62。
吴旭,韦克菲尔德,刘华,肖华,Kralovics R, Prchal JT,等。一种新型跨慢病毒载体的开发,提供可预测的安全性。Mol Ther, 2000;2(1): 47-55。
Zufferey R, Dull T, Mandel RJ, Bukovsky A, Quiroz D, Naldini L,等。自灭活慢病毒载体,安全高效的体内基因传递。中国病毒学杂志,1998;72(12):9873-80。
Logan AC, Haas DL, Kafri T, Kohn DB。整合的自灭活慢病毒载体产生能够封装和整合的全长基因组转录本。中国病毒学杂志,2004;78(16):8421-36。
祖弗瑞R,多内洛JE,特罗诺D,霍普TJ。土拨鼠肝炎病毒转录后调控元件增强逆转录病毒载体传递的转基因基因表达。中国病毒学杂志,1999;73(4):2886-92。
Follenzi A, Ailles LE, Bakovic S, Geuna M, Naldini L.慢病毒载体的基因转移受到核易位的限制,并被HIV-1 pol序列拯救。中国科学,2000;25(2):217-22。
谢文华,李志强,李志强,等。人类免疫缺陷病毒1型中心DNA瓣是慢病毒载体核导入和人类造血干细胞基因转导的关键决定因素。血。2000;96(13):4103 - 10。
Zennou V Serguera C, Sarkis C, Colin P, Perret E, Mallet J,等。HIV-1 DNA瓣刺激大脑中HIV载体介导的细胞转导。生物技术学报。2001;19(5):446-50。
王志强,王志强,王志强,王志强。整合酶和DNA瓣在人免疫缺陷病毒1型核导入中的作用。中国病毒学杂志,2002;76(23):12087-96。
Rivière L, Darlix JL, Cimarelli .核导入HIV-1 DNA所需病毒元素的分析。中国病毒学杂志,2010;84(2):729-39。
范梅莱,李志强,李志强,等。人免疫缺陷病毒1型载体转导动力学的研究进展。中国病毒学杂志,2003;77(8):4685-94。
Limón A, Nakajima N, Lu R, Ghory HZ, Engelman A.在没有中心DNA皮瓣的情况下,人免疫缺陷病毒1型核定位和复制的野生型水平。中国病毒学杂志,2002;76(23):12078-86。
李志刚,李志刚,李志刚,等。人类免疫缺陷病毒中央多尿束序列在反转录过程中的代偿作用。中国病毒学杂志,2008;82(15):7716-20。
Zennou V, Petit C, Guetard D, Nerhbass U, Montagnier L, Charneau P. HIV-1基因组核输入由中央DNA皮瓣介导。细胞。2000;101(2):173 - 85。
贾思敏,李志强。绝缘子的转录和表观遗传机制。中国科学院学报。2006;7(9):703-13。
杨晓明,王晓明,王晓明,杨晓明,等。鸡超敏位点-4 (cHS4)的自灭活慢病毒载体对人球蛋白表达的影响。生物化学学报,2007;15(10):1863-71。
李国强,李国强,李国强,等。包含来自人类TBP和HNRPA2B1位点的双启动子CpG岛的转基因对异染色质介导的沉默具有抗性。基因组学,2003;82(3):269 - 79。
戈皮纳斯C,乔迪塞S,高希A,尼尔森EJR。无处不在的染色质开放元件HNRPA2B1-CBX3在自灭活慢病毒载体中驱动人CD18基因表达的不同片段长度在基因治疗应用中的效率基因。2019;710:265 - 72。
张飞,Frost AR, Blundell MP, Bales O, Antoniou MN, Thrasher AJ。一种普遍存在的染色质开放元件(UCOE)可抵抗DNA甲基化介导的慢病毒载体沉默。Mol Ther, 2010;18(9): 1640-9。
张峰,史宗伟,张志强,张志强,等。慢病毒载体含有无增强子无处不在作用的染色质开放元件(UCOE),在造血细胞中提供高度可复制和稳定的转基因表达。血。2007;110:1448-57。
Miyoshi H, Smith KA, Mosier DE, Verma IM, Torbett BE。人CD34+细胞的转导介导HIV载体长期植入NOD/SCID小鼠。科学。1999;283(5402):682 - 6。
Schroder AR, Shinn P, Chen H, Berry C, Ecker JR, Bushman F. HIV-1在人类基因组中的整合倾向于活跃基因和局部热点。细胞。2002;110(4):521 - 9。
Mitchell RS, Beitzel BF, Schroder AR, Shinn P, Chen H, Berry CC,等。逆转录病毒DNA整合:ASLV、HIV和MLV显示出不同的靶点偏好。公共科学图书馆。2004;2(8):E234。
戴伯泽,李志强,李志强,等。逆转录病毒整合位点选择的研究进展。生物化学,2015;40(2):108-16。
enelman A, Cherepanov P.慢病毒整合酶结合蛋白LEDGF/p75与HIV-1复制。公共科学图书馆,2008;4(3):e1000046。
Vandekerckhove L, Christ F, Van Maele B, De Rijck J, Gijsbers R, Van den Haute C,等。整合酶辅因子LEDGF/p75的短暂稳定敲除揭示了其在人类免疫缺陷病毒复制周期中的作用。中国病毒学杂志,2006;80(4):1886-96。
Vanegas M, Llano M, Delgado S, Thompson D, Peretz M, Poeschla E. LEDGF/p75 HIV-1整合相互作用域和NLS的鉴定揭示了NLS独立的染色质系结。中国生物医学工程学报(英文版),2005;
Ferris AL, Wu X, Hughes CM, Stewart C, Smith SJ, Milne TA,等。晶状体上皮衍生生长因子融合蛋白重定向HIV-1 DNA整合。自然科学进展,2010;26(3):339 - 344。
Gijsbers R, Ronen K, Vets S, Malani N, De Rijck J, McNeely M,等。LEDGF杂化物有效地将慢病毒整合重定向到异染色质。Mol Ther, 2010;18(3): 552-60。
Meehan AM, Saenz DT, Morrison JH, Garcia-Rivera JA, Peretz M, Llano M,等。具有替代染色质系的LEDGF/p75蛋白是功能性HIV-1辅因子。公共科学图书馆,2009;5(7):e1000522。
肖华,李志强,李志强,等。通过一种新型合成蛋白的表达修饰hiv -1基载体的整合位点偏好。胡吉恩·瑟。2010;21(3):337-49。
Vets S, De Rijck J, Brendel C, Grez M, Bushman F, Debyser Z,等。在X-CGD模型中,LEDGF/p75嵌合体的瞬时表达重定向慢载体整合和功能挽救。生物化学学报。2013;2:e77。
Cattoglio C, Pellin D, Rizzi E, Maruggi G, Corti G, Miselli F,等。逆转录病毒整合位点的高清地图识别了人类多功能造血祖细胞中的活性调控元件。血。2010;116(25):5507 - 17所示。
Cartier N, Hacein-Bey-Abina S, Bartholomae CC, Veres G, Schmidt M, Kutschera I,等。用慢病毒载体的造血干细胞基因治疗x连锁肾上腺脑白质营养不良。科学。2009;326(5954):818 - 23所示。
张丽娟,张丽娟,张丽娟,等。慢病毒造血干细胞基因治疗有利于异染性脑白质营养不良。科学。2013;341(6148):1233158。
张晓东,李志强,李志强,等。慢病毒造血干细胞基因治疗早发性异染性脑白质营养不良:一项非随机、开放标签、1/2期试验的特别分析柳叶刀》。2016;388(10043):476 - 87。
王国强,王志强,王志强,等。人类乙型地中海贫血基因治疗后的输血独立性和HMGA2激活。大自然。2010;467(7313):318 - 22所示。
Marktel S, Scaramuzza S, Cicalese MP, Giglio F, Galimberti S, Lidonnici MR,等。输血依赖型地中海贫血成人和儿童患者的骨内造血干细胞基因治疗。中华医学杂志2019;25(2):234-41。
Thompson AA, Walters MC, Kwiatkowski J, Rasko JEJ, Ribeil JA, Hongeng S,等。输血依赖性乙型地中海贫血患者的基因治疗。中华实用医学杂志,2018;29(4):344 - 344。
李丽娟,李丽娟,马格纳尼,马格林,等。镰状细胞病患者的基因治疗中华实用医学杂志,2017;29(3):344 - 344。
张志勇,张峰,张志勇。基因治疗与基因组编辑在原发性免疫缺陷疾病中的应用。基因工程学报2020;7(1):38-51。
De Ravin SS, Wu X, Moir S, anya - o 'Brien S, Kwatemaa N, Littel P,等。慢病毒造血干细胞基因治疗x连锁严重联合免疫缺陷。中国生物医学工程学报,2016;26(3):337 - 341。
Aiuti A, Biasco L, Scaramuzza S, Ferrua F, Cicalese MP, Baricordi C,等。Wiskott-Aldrich综合征患者慢病毒造血干细胞基因治疗。科学。2013;341(6148):1233151。
Hacein-Bey Abina S, Gaspar HB, Blondeau J, Caccavelli L, Charrier S, Buckland K,等。重度Wiskott-Aldrich综合征患者基因治疗后的结果。《美国医学协会杂志》上。2015; 313(15): 1550 - 63。
Morris EC, Fox T, Chakraverty R, Tendeiro R, Snell K, Rivat C,等。一名重度成人维斯科特-奥尔德里奇综合征的基因治疗。血。2017;130(11):1327 - 35。
柯恩DB,布思C,姜em,白世勇,邵kl,桑蒂利G,等。x连锁慢性肉芽肿病的慢病毒基因治疗。中华医学杂志2020;26(2):200-6。
iawa Y, Miccio A, Magrin E, Kwiatkowski JL, Rivella S, Cavazzana M.血红蛋白病的基因治疗:进展和未来挑战。Hum Mol Genet. 2019;28(R1): R24-30。
Hacein-Bey-Abina S.严重联合免疫缺陷及以上的基因治疗。J Exp Med 2020;217(2)。
Booth C, Romano R, Roncarolo MG, Thrasher AJ。基因治疗原发性免疫缺陷。Hum Mol Genet 2019;28(R1): R15-23。
李志刚,李志刚,李志刚。体外造血干细胞基因治疗遗传性单基因疾病的研究进展。Mol Ther, 2020; 29:49 - 504。
Negre O, Bartholomae C, Beuzard Y, Cavazzana M, Christiansen L, Courne C,等。一种改良慢病毒载体治疗乙型地中海贫血和镰状细胞病的疗效和安全性的临床前评估中国生物医学工程学报。2015;15(1):64-81。
Bank A, Dorazio R, Leboulch P. β -珠蛋白基因治疗β -地中海贫血的I/II期临床试验。中国科学(d辑),2005;
Dupre L, Trifari S, Follenzi A, Marangoni F, LaindeLera T, Bernad A,等。威斯科特-奥尔德里奇综合征患者T细胞中慢病毒载体介导的基因转移导致功能矫正。Mol Ther, 2004;10(5): 903-15。
Charrier S, Dupre L, Scaramuzza S, Jeanson-Leh L, Blundell MP, Danos O,等。慢病毒载体靶向WASp表达到造血细胞,有效地转导和纠正WAS患者的细胞。基因科学。2007;14(5):415-28。
Zanta-Boussif MA, Charrier S, Brice-Ouzet A, Martin S, Opolon P, Thrasher AJ,等。验证突变的PRE序列允许高且持续的转基因表达,同时废除WHV-X蛋白合成:应用于WAS基因治疗。基因科学。2009;16(5):605-19。
王牌特工SM,米特罗法努斯K,奥尔森JC。土拨鼠肝炎转录后调控元件(WPRE)的潜在致癌基因活性。《中国科学》2005;12(1):3-4。
孟蒂尔- equihua CA, Zhang L, Knight S, Saadeh H, Scholz S, Carmo M,等。-珠蛋白基因座控制区与EF1alpha短启动子结合可增强慢病毒载体介导的红系基因表达,具有保守的多谱系活性。Mol Ther, 2012;20(7): 1400-9。
柯恩DB, Booth C, Shaw KL, Xu-Bayford J, Garabedian E, Trevisan V,等。自体体外慢病毒基因治疗腺苷脱氨酶缺乏症。中华实用医学杂志,2002,19(4):344 - 344。
杨晓东,王晓明,王晓明,王晓明,等。通过一种新型嵌合启动子调节髓系细胞中高水平转基因表达对X-CGD的生化校正。Mol Ther, 2011;19(1): 122-32。
弗里德曼T,罗布林R.人类遗传疾病的基因疗法?科学。1972;175(4025):949 - 55。
布卢默U,纳尔迪尼L,维玛IM,特罗诺D,盖奇FH。基因治疗在中枢神经系统中的应用。胡学文。1996;5(增刊1):1397-404。
Naldini L, bloom U, Gage FH, Trono D, Verma IM。在注射了慢病毒载体的成年大鼠大脑中转基因的有效转移,整合和持续的长期表达。美国国家科学研究院。1996; 93(21): 11382 - 8。
coniglio A, Gritti A, Dolcetta D, Follenzi A, Bordignon C, Gage FH,等。通过慢病毒载体稳健的体内基因转移到成年哺乳动物神经干细胞。美国国家科学研究院。2004; 101(41): 14835 - 40。
陈晓明,陈晓明,陈晓明,陈晓明。慢病毒载体在成体神经干细胞中介导高效稳定的基因转移。胡吉恩·瑟尔。2006;17(6):635-50。
Miyoshi H, Takahashi M, Gage FH, Verma IM。稳定有效的基因转移到视网膜使用基于hiv的慢病毒载体。美国国家科学研究院。1997; 94(19): 10319 - 23所示。
霍姆gaard A, Askou AL, Benckendorff JNE, Thomsen EA,蔡勇,Bek T,等。通过慢病毒传递CRISPR/Cas9在小鼠视网膜色素上皮细胞中敲除vegfa基因。Mol Ther Nucleic Acids, 2017; 9:89-99。
Girard-Gagnepain A, Amirache F, Costa C, Lévy C, Frecha C, Fusil F,等。狒狒包膜伪型LVs在基因转移到早期细胞因子刺激和静息造血干细胞方面优于VSV-G-LVs。血。2014;124(8):1221 - 31所示。
科宾格GP,韦纳DJ,余庆昌,威尔逊JM。丝状病毒-伪型慢病毒载体在体内能高效稳定地转导气道上皮细胞。生物技术。2001;19(3):225-30。
George LA, Sullivan SK, Giermasz A, Rasko JEJ, Samelson-Jones BJ, Ducore J,等。血友病B基因治疗的高特异性活性因子IX变体。中华实用医学杂志,2017;29(3):344 - 344。
Brown BD, Venneri MA, Zingale A, SergiSergi L, Naldini L.内源性microRNA调控抑制造血谱系中的转基因表达并实现稳定的基因转移。中华外科杂志,2006;12(5):585-91。
Brown BD, Cantore A, Annoni A, Sergi LS, Lombardo A, Della Valle P,等。microrna调控的慢病毒载体介导血友病B小鼠的稳定矫正。血。2007;110(13):4144 - 52。
Cantore A, Ranzani M, Bartholomae CC, Volpin M, Valle PD, Sanvito F,等。肝脏定向慢病毒基因治疗血友病犬模型的研究。中华医学杂志,2015;7(277):277ra28。
Schmitt F, Remy S, Dariel A, Flageul M, Pichard V, Boni S,等。在肝脏中表达UGT1A1并含有miR-142靶标序列的慢病毒载体使Gunn大鼠高胆红素血症正常化。胃肠病学。2010;139 (3):999 - 1007 - e1 - 2。
Matsui H, Hegadorn C, Ozelo M, Burnett E, Tuttle A, Labelle A,等。microrna调控的gp64伪型慢病毒载体介导血友病A.小鼠模型中FVIII的稳定表达。Mol Ther, 2011;19(4): 723-30。
马丽娟,刘涛,张志强,等。吞噬细胞屏蔽慢病毒载体改善非人类灵长类动物肝脏基因治疗。中国医学科学,2019;11(493)。
李志强,李志强,李志强,等。慢病毒载体介导的基因转移对免疫应答的影响。细胞免疫杂志,2019;342:103802。
Kochenderfer JN, Wilson WH, Janik JE, Dudley ME, steler - stevenson M, Feldman SA,等。用基因工程的识别CD19的自体T细胞治疗的患者中b系细胞的根除和淋巴瘤的消退。血。2010;116(20):4099 - 102。
波特DL, Levine BL, Kalos M, Bagg A, June CH.嵌合抗原受体修饰的T细胞在慢性淋巴细胞白血病中的作用。中华外科杂志,2011;
Brentjens RJ, Davila ML, Riviere I, Park J, Wang X, Cowell LG,等。cd19靶向T细胞在化疗难治性急性淋巴细胞白血病成人患者中迅速诱导分子缓解。中国生物医学工程学报,2013;26(3):344 - 344。
Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR,等。嵌合抗原受体修饰的T细胞治疗急性淋巴白血病。中华实用医学杂志,2013;29(4):529 - 529。
杨晓峰,杨晓峰,Rivière I;大自然。2017;545(7655):423 - 31所示。
嵌合抗原受体疗法。中华实用医学杂志,2018;29(1):344 - 344。
沃密塔格P,葛恩R,葛拉希S,维莱奇FS。CAR - T细胞疗法的制造指南。生物技术,2018;53:164-81。
Garfall AL, Maus MV, Hwang W-T, Lacey SF, Mahnke YD, Melenhorst JJ,等。CD19嵌合抗原受体T细胞治疗多发性骨髓瘤。中华实用医学杂志,2015;29(4):344 - 344。
Kalos M, Levine BL, Porter DL, Katz S, Grupp SA, Bagg A,等。带有嵌合抗原受体的T细胞具有强大的抗肿瘤作用,可以在晚期白血病患者中建立记忆。中国生物医学工程学报,2011;29(3):567 - 567。
Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ,等。嵌合抗原受体T细胞用于白血病的持续缓解。中华实用医学杂志,2014;29(4):529 - 529。
莫德,李志强,李志强,等。b细胞淋巴母细胞白血病儿童和青年患者的Tisagenlecleucel。中华实用医学杂志,2018;26(5):439-48。
Milone MC, Fish JD, Carpenito C, Carroll RG, Binder GK, Teachey D,等。含有CD137信号转导域的嵌合受体在体内介导增强T细胞的生存和增加抗白血病疗效。生物化学学报,2009;17(8):1453-64。
Schuster SJ, Svoboda J, Chong EA, Nasta SD, Mato AR, Anak Ö,等。嵌合抗原受体T细胞在难治性b细胞淋巴瘤中的应用。中华实用医学杂志,2017;29(4):344 - 344。
Louis CU, Savoldo B, Dotti G, Pule M, Yvon E, Myers GD,等。成神经细胞瘤患者嵌合抗原受体阳性T细胞的抗肿瘤活性和长期命运。血。2011;118(23):6050 - 6。
侯俊杰,陈立龙,陈友友。引导CAR-T细胞通过实体肿瘤微环境。中国医药科学。2021;20(7):531-50。
马松,李旭,王旭,程林,李震,张超,等。CAR-T细胞治疗实体瘤的研究进展中华生物医学杂志,2019;15(12):2548-60。
Zimmermann K, Kuehle J, Dragon AC, Galla M, Kloth C, Rudek LS,等。结合本构抗gd2 car表达和诱导细胞因子的“一体化”慢病毒载体系统的设计和表征。癌症。2020;12(2):375。
Skipper KA, Mikkelsen JG。利用CRISPR进行体内基因治疗。方法Mol生物学,2019;1961:293-306。
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E.一种可编程双rna引导的DNA内切酶在适应性细菌免疫。科学。2012;337(6096):816 - 21所示。
Nelson CE, Hakim CH, Ousterout DG, Thakore PI, Moreb EA, Castellanos Rivera RM,等。体内基因组编辑改善了杜氏肌营养不良小鼠模型的肌肉功能。科学。2016;351(6271):403 - 7。
冉发,丛l,严WX, Scott DA, Gootenberg JS, Kriz AJ,等。体内基因组编辑应用金黄色葡萄球菌Cas9。大自然。2015;520:186。
王东,张峰,高刚。基于crispr的治疗性基因组编辑:策略和AAV载体的体内传递。细胞。2020;181(1):136 - 50。
Dever DP, Bak RO, Reinisch A, Camarena J, Washington G, Nicolas CE,等。CRISPR/Cas9 β -珠蛋白基因靶向人类造血干细胞。大自然。2016;539(7629):384 - 9。
Martin RM,池田K,克罗默MK,内田N,西村T,罗马诺R,等。通过CRISPR-Cas9 RNP和AAV6供体介导的同源重组对人类多能干细胞进行高效无标记基因组编辑。细胞干细胞,2019;24(5):821-8e5。
王娟,Exline CM, DeClercq JJ, Llewellyn GN, Hayward SB,李培文,等。同源驱动的基因组编辑在造血干细胞和祖细胞使用ZFN mRNA和AAV6供体。中国生物工程学报。2015;33(12):1256-63。
张峰,张晓明,张晓明。CRISPR筛选载体和全基因组文库的研究进展。Nat Methods. 2014;11(8): 783-4。
Shalem O, Sanjana NE, Hartenian E, Shi X, Scott DA, Mikkelsen TS,等。人类细胞中CRISPR-Cas9基因敲除筛选。科学。2014;343(6166):84 - 7。
Ryo LB, Thomsen EA, Mikkelsen JG。用于CRISPR/Cas9传递的慢病毒载体的生产和验证。方法Mol生物学2019;1961:93-109。
陈松,陈佳娜,郑凯,李凯,石旭,等。肿瘤生长和转移小鼠模型中的全基因组CRISPR筛选。细胞。2015;160(6):1246 - 60。
Reddy A, Zhang J, Davis NS, Moffitt AB, Love CL, Waldrop A,等。弥漫性大B细胞淋巴瘤的遗传和功能驱动因素。细胞。2017;171 (2):481 - 94 - e15。
Phelan JD, Young RM, Webster DE, Roulland S, Wright GW, Kasbekar M,等。淋巴瘤中控制致癌信号的多蛋白超复合物。自然》2018。
Thomsen EA, Rovsing AB, Anderson MV, Due H,黄娟,罗勇,等。在gcb亚型弥漫性大b细胞淋巴瘤中,通过CRISPR筛选鉴定BLNK和BTK作为利妥昔单抗诱导的程序性细胞死亡的介质生物化学学报,2020;14(9):1978-97。
阿德尔曼,王涛,沙巴提尼,李国强。全基因组CRISPR/Cas9筛选鉴定细胞系中的癌症基因。方法Mol生物学2019;1907:125-36。
韦伯斯特DE,罗兰S,费兰JD。淋巴瘤细胞系中CRISPR-Cas9筛选方案。方法Mol生物学,2019;1956:337-50。
朱松,周勇,魏伟。用于人类细胞高通量功能基因组学的全基因组CRISPR/Cas9筛选。方法Mol biology, 2017; 1656:175-81。
Thomsen EA Mikkelsen JG基于crispr的慢病毒敲除文库用于功能基因组筛选和表型相关基因鉴定。方法Mol生物学,2019;1961:343-57。
莱维特AD,罗伯斯G,亚历山德罗N,瓦马斯HE。人类免疫缺陷病毒1型整合酶突变体保留了体外整合酶活性,但在感染期间不能有效地整合病毒DNA。中国病毒学杂志,1996;70(2):721-8。
Yanez-Munoz RJ, Balaggan KS, MacNeil A, Howe SJ, Schmidt M, Smith AJ,等。非整合慢病毒载体的有效基因治疗。中华外科杂志,2006;12(3):348-53。
Moldt B, Staunstrup NH, Jakobsen M, Yanez-Munoz RJ, Mikkelsen JG。酵母Flp重组酶引导的慢病毒DNA圈的基因组插入。生物技术。2008;8(1):60。
莫德B, Miskey C, Staunstrup NH, gogoli - doring A, Bak RO, Sharma N,等。从原代人类细胞中整合缺陷慢病毒载体高效动员睡美人转座子的基因组整合比较分析。生物化学学报,2011;19(8):1499-510。
史丹斯特鲁普,莫尔特B,马德斯L,维里森P,雅各布森M,伊维克斯Z,等。在人类细胞中随机整合的混合慢病毒转座子载体。Mol Ther, 2009;17(7): 1205-14。
Vink CA, Gaspar HB, Gabriel R, Schmidt M, McIvor RS, Thrasher AJ,等。睡美人转位非整合慢病毒Mol Ther, 2009;17(7): 1197-204。
李丽娟,李丽娟,李丽娟,等。使用锌指核酸酶和整合酶缺陷慢病毒载体传递的人类干细胞基因编辑。中国生物工程学报。2007;25(11):1298-306。
Ortinski PI, O 'Donovan B, Dong X, Kantor B.整合酶缺陷慢病毒载体作为高效CRISPR/ cas9介导的基因编辑的一体化平台。Mol Ther Methods临床开发2017;5:153-64。
蔡勇,巴克罗,Mikkelsen JG。锌指蛋白和tal效应核酸酶慢病毒蛋白转导的靶向基因组编辑。电子学报。2014;3:e01911。
蔡勇,Bak RO, Krogh LB, Staunstrup NH, Moldt B, Corydon TJ,等。通过慢病毒Gag前体piggyBac转座酶的蛋白质转导进行DNA转座。核酸工程学报,2014;42(4):e28。
蔡勇,Laustsen A,周勇,孙c, Anderson MV,李s,等。zfn负载的“all-in-one”慢病毒载体在干细胞中的靶向同源驱动基因插入。Elife。2016;5。
Skipper KA, Nielsen MG, Andersen S, Ryo LB, Bak RO, Mikkelsen JG。使用慢病毒衍生的纳米颗粒通过转座酶蛋白传递有时间限制的PiggyBac DNA转座。Mol Ther Nucleic Acids, 2018; 11:53 - 62。
崔建国,党勇,亚伯拉罕,马华,张军,郭华,等。慢病毒预先包装Cas9蛋白,更安全的基因编辑。Gene Ther. 2016;23(7): 627-33。
Anzalone AV, Randolph PB, Davis JR, Sousa AA, Koblan LW, Levy JM,等。没有双链断裂或供体DNA的搜索和替换基因组编辑。大自然。2019;576(7785):149 - 57。
高德利NM, Komor AC, Rees HA, Packer MS, Badran AH, Bryson DI,等。基因组DNA A*T到G*C的可编程碱基编辑,无需DNA切割。自然。2017;551(7681):464 - 71。
确认
不适用。
资金
通过丹麦独立研究委员会|医学科学(Grant DFF-9039-00173B)、伦德贝克基金会(Grant R324-2019-1832)、诺和诺德基金会(Grant NNF17OC0029042)和创新基金会(通过PASCAL-MID研究中心的资助)的支持,JGM实验室的基因转移和基因组工程技术研究成为可能。
作者信息
作者及隶属关系
贡献
JHW和JGM撰写了手稿。双方都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理认可和同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
不存在相互竞争的经济利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Wolff, j.h., Mikkelsen, J.G.用人类免疫缺陷病毒衍生载体传递基因:25年后仍然是最先进的。生物科学29, 79(2022)。https://doi.org/10.1186/s12929-022-00865-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-022-00865-4
关键字
- 艾滋病毒
- 慢病毒
- 慢病毒载体
- 整合缺陷慢病毒载体
- IDLV
- 基因治疗
- 基因编辑
- 基因组工程
- CRISPR