摘要
近年来,研究人员为开发控制COVID-19大流行的疫苗平台付出了前所未有的努力。尽管接种疫苗是预防SARS-CoV-2感染的一种实用策略,但用小分子/多肽和抗体等治疗方案补充抗covid - 19武器库是应对新出现的SARS-CoV-2变体的一种谨慎策略。值得注意的是,众多团队的共同努力已经产生了一个由化学和机械上不同的小分子组成的大量文库,作为抗covid - 19支架。这篇综述文章概述了药物化学运动和药物再利用计划,最终确定了大量基于小分子的抗covid - 19药物,通过抑制蛋白酶、S蛋白、RdRp、ACE2、TMPRSS2、组织蛋白酶和其他靶点介导其抗病毒作用。鉴于有证据确定小分子药物在接近所有冠状病毒复制所需的保守蛋白方面的潜力,预计FDA很快将加快批准用于治疗covid - 19的小分子药物。尽管最近在这一方向上进行的旨在丰富抗covid -19武器库(化学工具)的尝试值得赞扬,需要实施一些策略,以获得最近报道的小分子的最终益处,即(i)对生成的抗covid - 19支架进行详细的临床前研究(ii)对新出现的SARS-CoV-2变体的抑制剂进行体外分析(iii)开发能够快速筛选抗covid - 19支架文库的检测方法(iv)利用基于机器学习的预测模型的应用,加快抗covid - 19药物发现运动(v)抗体-药物偶联物的设计。
背景
目前,世界正处于大流行冠状病毒感染的阵痛中,称为冠状病毒病-2019 (COVID-2019)。COVID-2019是一种由严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)引起的令人困惑的呼吸道传染病[1,2,3.].病毒的基因测序确定它是一种新型乙型冠状病毒,一种包膜阳性单链RNA病毒,命名为2019新型冠状病毒(2019- ncov)。SARS- cov -2与SARS病毒密切相关,其表面具有典型的“冠状”尖刺,属于正冠状病毒亚科。据信,人传人可透过飞沫或接触[4,5,6,7,8,9,10,11].感染从病毒进入开始,通过识别受体,启动表面蛋白,然后是内吞作用和膜融合。具体来说,病毒刺突糖蛋白的受体结合结构域(RBD)与ACE2的相互作用导致病毒进入宿主细胞(病毒进入阶段)。接下来是RNA复制(病毒复制阶段)的开始,然后释放新的病毒粒子来感染宿主中的其他细胞[12,228].
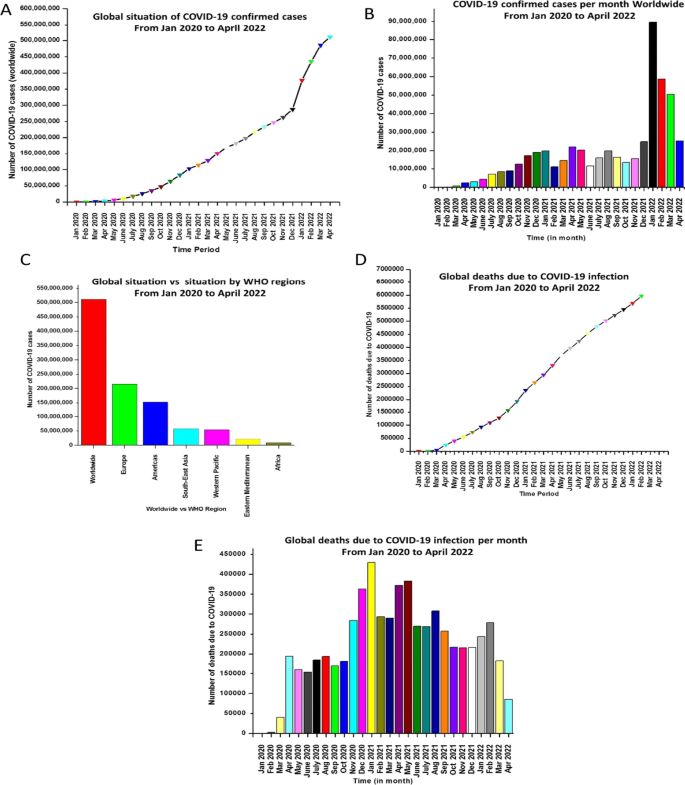
目前的全球形势受到大量感染者的破坏(图。1) [249]呼吁迫切需要开发负担得起的疫苗,为弱势群体提供主动获得性免疫。随后,许多实验室开始了制造covid - 19疫苗的重要追求。结果,投入的努力最终提供了不同的疫苗平台(基于mrna的疫苗、基于重组蛋白的疫苗、基于灭活病毒和蛋白质亚单位的疫苗以及基于病毒载体的疫苗)。令人欣慰的是,生物技术行业的及时行动导致了几种疫苗的批准。由于在疫苗效力方面有文件记载的进展(初步/中期报告和最后披露),疫苗接种似乎是结束大流行的最谨慎的方法。然而,由于SARS-CoV-2多种变体的出现,特别是omicron的出现,对疫苗诱导免疫的敏感性降低,已成为COVID-19疫苗临床应用的主要威胁[13].此外,最近发表在《柳叶刀》杂志上的一项系统综述和元回归研究显示,疫苗对感染和症状性疾病的疗效或有效性在6个月内下降了约20-30个百分点。免疫力下降被认为是药效下降的部分原因。因此,需要清楚地了解导致疫苗免疫力迅速下降的因素,以开发有效的疫苗[14,229,230].总的来说,诸如SARS-CoV-2变种、疫苗不平等以及需要加强剂量以恢复疫苗效力等因素清楚地表明,与这种臭名昭著的病毒的战斗远未结束[15].在这方面,需要努力开发能够产生持久保护并能够应对SARS CoV-2变体的新疫苗。此外,还设想,除了疫苗之外,用其他治疗方案补充抗covid - 19武器库可能是一种谨慎的战略。值得注意的是,抗covid - 19治疗方式正在朝着单克隆抗体、肽基药物和小分子抑制剂方向发展。对于基于抗体的抗covid - 19治疗开发,已经探索了来自SARS患者的抗体,这些抗体针对刺突表面蛋白上的rbd,并中和具有类似rbd的各种SARS- cov [16].研究还针对SARS-CoV-2表面亚基的外部部分(S1A/NTD)进行了探索,以制备针对sars - cov的广谱抗体[17,18].因此,目前针对COVID-19的单克隆抗体(mAbs)库中有少数几个选项,如sotrovimab (VIR-7831,抗体药物)、Lenzilumab(工程抗人粒细胞-巨噬细胞集束刺激因子单抗)、Bamlanivimab(重组人IgG1单抗抗体)、Casirivimab和Imdevimab (REGEN-COV,中和抗体)、Tixagevimab和cilgavimib (AZD7442,抗体鸡尾酒)、BRII-196/BRII-198 (SARS-CoV-2阴性单抗联合疗法)、CERC002(抗LIGHT或TNFSF14的完全人单抗)、SAB185(多克隆抗体)、Regdanvimab(重组人单抗)、Sarilumab (IL-6受体拮抗剂)和Tocilizumab(抗IL-6受体单抗)[19].令人欣慰的是,针对SARS-CoV-2单克隆抗体的研究结果令人乐观,并获得了美国FDA的几项批准(表2)1,2)用于紧急使用这种治疗方式治疗COVID-19。Casirivimab-Imdevimab、Bamlanivimab-Etesevimab、Sotrovimab、Tocilizumab、Tixagevimab-Cilgavimib和Bebtelovimab是fda批准用于COVID-19的单克隆抗体[20.].尽管这一领域已记录的进展令人鼓舞,但仍需要继续开展研究,以明确了解这些工具的治疗特征,以便在治疗或预防SARS-CoV-2的应用方面获得更多结论性的益处[19].
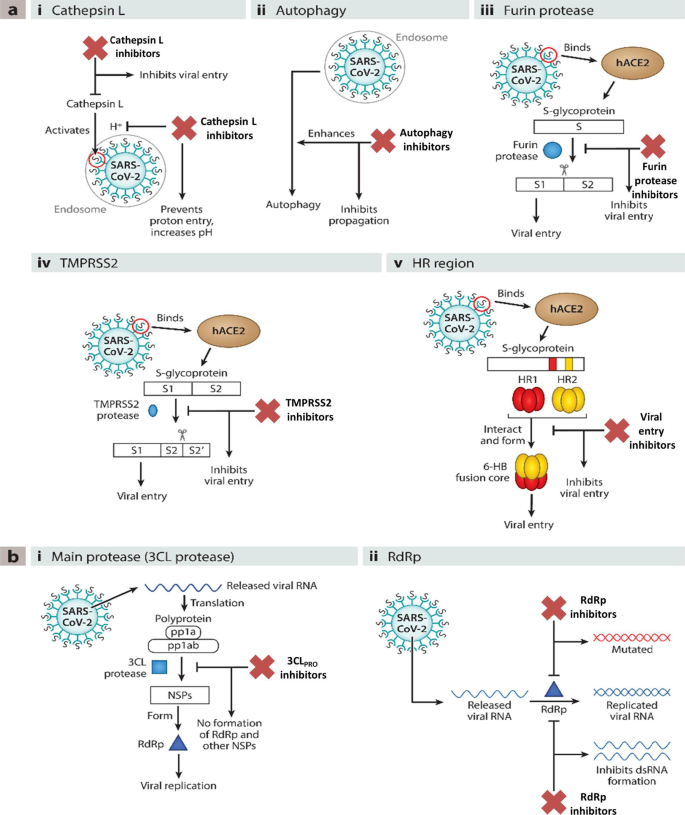
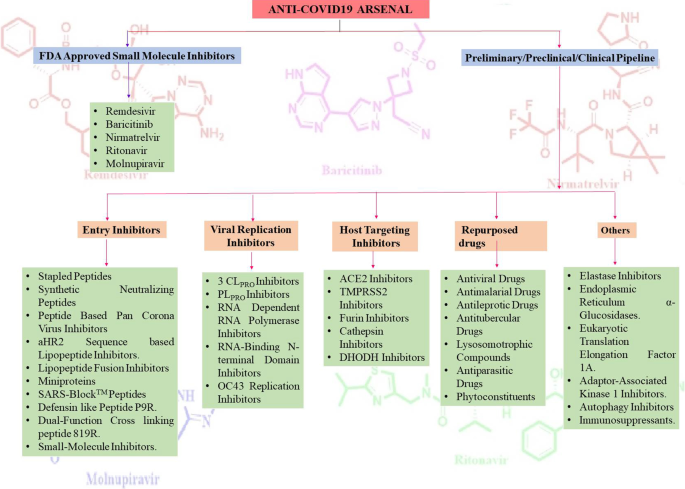
值得注意的是,最近见证了药物发现爱好者在利用现有治疗靶点列表构建实用设计的易处理抗covid - 19支架方面的最大熟练程度(附加文件)1和无花果。2).与小分子药物发现工作的通常趋势一致,开发有效的covid - 19治疗方法的任务需要明确了解病毒的性质、序列特征(SARS-CoV-2)、病毒受体相互作用的结构见解以及疾病的发病机制[11].令人高兴的是,我们进行了详尽的探索,以解开冠状病毒的结构[21,231,232,233,234],通过上述研究获得的见解促使药物化学家进行了大量的药物发现工作,以靶向病毒进入以及病毒复制阶段,以开发抗病毒药候选药物(图2)。2).因此,采用了几种策略来引导抗covid - 19药物研发运动的车轮。具体而言,SARS-CoV-2编码的3C-like蛋白酶(3CLpro)、木瓜蛋白酶(PLpro)和非结构蛋白(NSPs)在病毒复制中起着至关重要的作用,它们是构建抗covid - 19药物文库的谨慎靶点[22].令人高兴的是,在这一方向上投入的大量努力已经取得了回报,并通过大量对covid - 19具有显著抗病毒功效的3CLpro和PLpro抑制剂丰富了化学工具箱。值得注意的是,研究小组混合了经典的药物设计策略以及构建3CLpro和PLpro抑制剂的创新方法。在许多情况下,这位药物化学家利用了SARS CoV-1 3CL的晶体学信息箴和PLpro用于设计新的支架(抗sars CoV-2 3CLpro抑制剂)。值得注意的是,为了扩大结构库的大小,进行了实用设计的结构优化程序(3CLpro和PLpro抑制剂),以制造共价结合的可逆/不可逆抑制剂,拟肽/非拟肽型框架和肽-药物偶联物(PDCs)来传递药物有效载荷。重要的是,高通量药物筛选计划以及基于机器的学习,被证明是药物化学家在加速上述药物发现工作方面的福音。RNA依赖的RNA聚合酶(RdRp)和解旋酶作为covid - 19药物的靶点也是探索的主题[23,235,236].病毒尖刺糖蛋白S蛋白与宿主细胞血管紧张素转换酶2 (ACE2)结合已被证实[24,25]负责SARS-CoV-2进入宿主细胞。此外,S蛋白结合到细胞跨膜丝氨酸蛋白酶(TMPRSS2)促进病毒进入宿主细胞。根据这些披露,化学家也倾向于将ACE2和TMPRSS2作为抗covid - 19药物设计的重要靶点。令人鼓舞的是,人们还尝试将covid - 19药物研发活动与基于人工智能的方法结合起来。此外,研究人员还竭尽全力地采用了“聪明方法”,即不从零开始进行药物发现,而是转向快速通道模式(药物再利用),以确定抗covid - 19支架。在众多研究中,该团队有一个明确的计划,即利用现有药物作为可行的起点,开始抗covid - 19支架鉴定任务。因此,综合利用药物再利用策略来识别抗covid - 19支架。研究和开发成本以及药物开发时间表的预期降低,以及有关其药理学、剂量、可能的毒性和配方的信息的可用性,是启动许多基于药物重新利用的努力的主要原因。因此,通过几项高通量药物再利用分析,发现了大量SARS-CoV2入口以及复制抑制剂[23,26,237,238].值得一提的是,FDA批准了Lagevrio (molnupiravir, Small-分子核苷)和Paxlovid (nirmatrelvir和ritonavir,蛋白酶抑制剂)发挥了催化作用,促使研究人员开始开发更多的小分子抑制剂项目(新的药物设计策略和小分子抑制剂的重新利用)。总的来说,通过采用一种快速的药物发现方法,包括结构设计、合成和分析的迭代循环,以生成抗covid - 19支架,药物化学家在生成大量有前景的抗covid - 19支架方面取得了额外的进展。
抗covid - 19支架设计的主要目标。一个i.组织蛋白酶L自噬iii。Furin蛋白酶iv. TMPRSS2 v. HR区。bi. Main蛋白酶(2CL蛋白酶P[11(经Annu授权转载。启杂志。Toxicol。2021;61:465 - 93
这篇综述文章概述了通过药物化学运动产生的小分子抗covid -19药物。令人鼓舞的是,跨学科团队在这一研究方向上的巨大努力已经导致了针对S蛋白、PLpro、3CLpro和RdRp的几类抑制剂的概述,以及显示与宿主蛋白相互作用的潜力的支架,如ACE2和TMPRSS2(图2)。3.).此外,还提供了预防病毒进入的组织蛋白酶抑制剂和免疫调节药物。令人高兴的是,一些支架已经证明了未来有望成为治疗手段。该汇编还包括对用于支架制造以解决COVID-19潜在靶点的稳健药物设计策略的详细讨论。还提出了关于确定结构变异对病毒进入或复制的影响的已建立的结构-活性关系研究的关键概念。此外,部分药物再利用以及肽为基础的进入抑制剂也涵盖。鉴于上述药物发现活动的乐观结果,需要采用快速通道加速方法启动以开发用于治疗COVID-19的小分子和基于肽的疗法为中心的其他项目。不可否认的事实是,在这场战斗中(小分子与疫苗),小分子药物一直被认为是弱者,然而,小分子药物在接近所有冠状病毒复制所需的保守蛋白方面的潜力已得到证实,这表明它们可能能够解决SARS-CoV-2突变株[15].
蛋白酶抑制剂
COVID-19的致病病毒SARS CoV-2在被3CL切割的两个重叠的大多蛋白的背景下,与SARS CoV-1具有惊人的遗传相似性箴在特定的地点。对于冠状病毒复制,这种切割由3CL箴是一个必要的翻译后处理步骤。值得注意的是,蛋白质裂解的催化结构域(CoV-1和CoV-2-3CL箴序列)是相同的[44].事实上,Dai等人的一份报告揭示了SARS CoV-1 3CL的晶体学信息箴可以被药物化学家用来设计3CL蛋白酶抑制剂作为SARS-CoV-2的抗病毒药物[45].现有的半胱氨酸蛋白酶抑制剂可分为两类:共价结合的可逆抑制剂和共价结合的不可逆抑制剂。前一类抑制剂需要亲电碳的存在,与活性位点半胱氨酸的硫原子可逆相互作用。这种相互作用导致共价结合的四面体复合体的形成。第四,根据一些抑制剂的探索研究(x射线晶体学和核磁共振),由于活性位点存在氧阴离子空穴,这种带电蛋白质-配体过渡态得以稳定[46,239].一些官能团已被用于共价结合可逆抑制剂的构建,如醛、酮、腈、环酮、硫或氧甲基酮、1,2 -二羰基基序和酰胺甲基酮,[44].为了提供后一类(共价结合的不可逆抑制剂),使用了化学反应性标签,如氯甲基酮。尽管在有效的蛋白酶抑制方面相当有效,但出于安全考虑,它们的高化学反应性阻碍了其治疗效果的增长[47].为了加速不可逆类型抑制剂的支架发现计划,一些其他化学类别也被探索,如酰基氧甲基酮,被发现具有低化学反应性和对酶抑制的高效力[48,240].
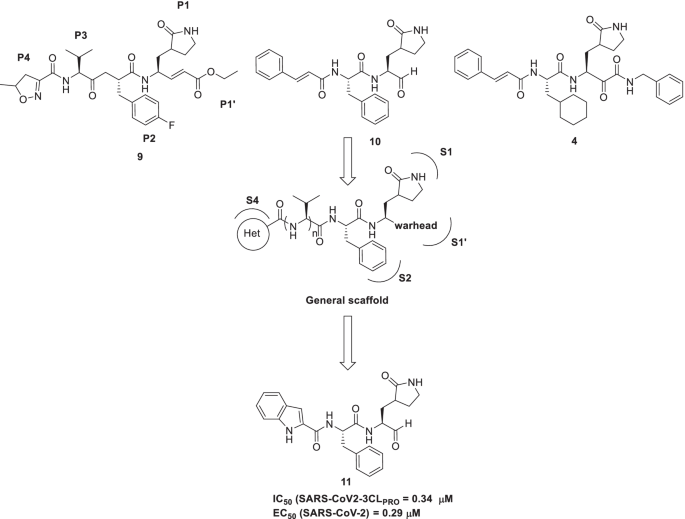
最近,Zhang等报道了拟肽α-酮酰胺作为主要蛋白酶和3C蛋白酶抑制剂的结构设计。脚手架建造运动(总体结构,1)开始于化学结构的合成2由肉桂基n -帽(P3位置)、苄基(P2位置)、谷氨酰胺内酰胺(P1位置)和苄基(P1’位置)组成。化合物晶体结构的观察2在SARS-CoV Mpro、HCoV-NL63 Mpro和CVB3 3Cpro的配合物中发现,α-酮碳与蛋白酶的活性位点Cys共价连接。结果观察到,与CVB3 3Cpro复合物中的S构型相反,硫半iketal在SARS-CoV和HCoV-NL63 Mpro中处于R构型。这种构型上的差异是由于氧原子的相互作用造成的。在SARS-CoV和HCoV-NL63酶中,氧原子(硫半iketal)从氧阴离子孔的主链酰胺中接受氢键,然而,它从CVB3蛋白酶中的催化His40中接受氢键。出来,加合物1在结构上进行了微调以实现更有效的酶抑制剂。值得注意的是,五元内酰胺环是所有化合物的一致结构特征,结构改变仅指向P1 '、P2和P3载体。该系列所有化合物都具有上述结构特征的原因是其具有良好的谷氨酰胺模拟能力。此外,先前的一些证据表明,使用这种刚性环可以放大酶抑制剂的潜力,大约比灵活的谷氨酰胺侧链高10倍。这些概念证明了在所设计的酮酰胺中使用刚性5元内酰胺环作为P1残基。因此,对于结构工程尝试,p2 -烷基取代基的尺寸以及p2 -环烷基甲基取代基的环尺寸和灵活性是不同的。所得到的支架对重组蛋白酶以及病毒复制子和病毒感染的细胞培养进行了评估。令人高兴的是,α-酮酰胺的P2取代基的结构优化尝试被证明是有益的3.而且4被确定为具有等效性(低µM EC50值)对抗肠道病毒,阿尔法冠状病毒,和贝塔冠状病毒在细胞培养。值得一提的是这种化合物4对MERS-CoV表现出出色的活性谱(3位数皮摩尔活性)。鉴于SARS-CoV的主要蛋白酶与新型BetaCoV/Wuhan/2019之间的惊人相似性,预计该化合物4也可能复制针对新型冠状病毒的大量活动趋势(图。4) [49].
Zhang等人沿着这一方向继续他们的药物发现计划,以寻求改善化合物在血浆中的半衰期。为了实现上述目标,研究小组开展了一项结构工程计划,将吡啶酮环接枝取代P3-P2酰胺键。据推测,这种结构改变将阻碍细胞蛋白酶接近该键,从而阻止其裂解。此外,疏水的肉桂基部分被疏水较少的基团所取代,以增加化合物在血浆中的溶解度并减少与血浆蛋白的结合。这些努力最终确定了化合物5与?相比,它显著改善了等离子体半衰期和等离子体溶解度4.另一项结构工程尝试是通过替换其P2环己基部分来提高对b支系β冠状病毒(SARS-CoV-2和SARS-CoV)的抗病毒活性5环丙基更小6.详尽的探索6发现它能抑制纯化的重组SARS-CoV-2 M箴与集成电路50= 0.67±0.18 μm。两种抑制剂的药代动力学研究均显示明显的肺向性。此外,两种抑制剂(5而且6)适合通过吸入途径给药(图;4) [50].
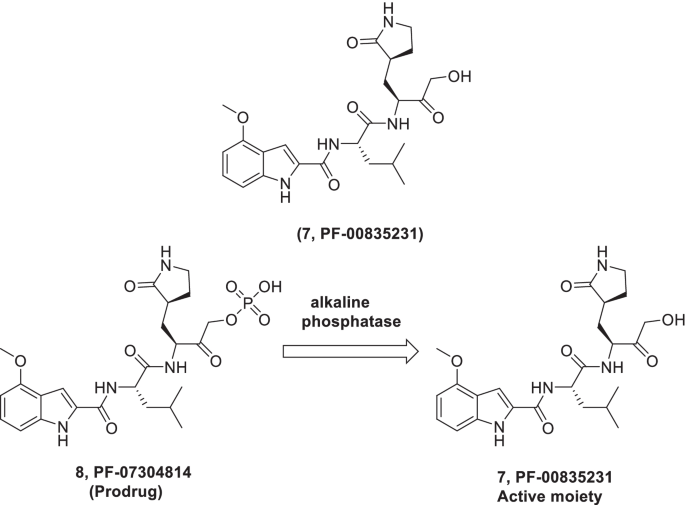
开展了一项研究,以发现SARS 3CLpro的抑制剂(可逆和不可逆,酮基)。结果,羟甲基酮(7, pf - 00835231)被确定为一种有效的化学工具,在3CLpro和抗病毒检测中表现出有效的SARS CoV-1抑制作用。高兴地,抑制剂7被发现对SARS CoV-2 3CLpro具有显著的抑制潜力,以及适当的药物特性,值得进一步研究,以开发为COVID-19的抗cov药物[44].最近,详细的临床前特征7 (pf - 00835231)是由Boras等人进行的。此外,课题组还合成了一种磷酸盐前药(pf - 07304814)7以达到持续的人体系统暴露。详细调查的结果表明7在体外参与SARS-CoV- 2 3CL的特异性结合,并对一组冠状病毒3CLpro表现出广谱抑制活性。同时,7在细胞培养中,利用细胞病变效应(CPE)试验(VeroE6肾细胞-VeroE6- enace2或VeroE6- EGFP)评估其对SARS-CoV-2的抗病毒效果。总的来说,大家认为7(PF-00835231)作为单一药物足以在体外表现出对SARS-CoV-2的抗病毒活性,并且与瑞德西韦联合使用也表现出协同作用。令人高兴的是,体内抗病毒活性也表现为7当时对SARS-CoV和SARS-CoV-2感染的小鼠模型进行了研究。此外,药代动力学研究表明,磷酸盐药物可迅速转化为3CLpro抑制剂(7, pf - 00835231).此外,磷酸前药(8)连续输注(500mg) 24小时可达到0.5µM的游离浓度7 (pf - 00835231).总的来说,前药(8)展示了一个伟大的临床前药代动力学剖面,有力地支持其推进到临床阶段的探索(图。5) [51,241].
另一探索进行了比较疗效分析7 (pf - 00835231)瑞德西韦和调查结果显示,7 (pf - 00835231)以及瑞德西韦,在人类极化气道上皮模型中被赋予了强大的SARS-Cov-2抑制能力。此外,根据在A549细胞或人上皮极化上皮培养中进行的实验,观察到在A549中,外排转运蛋白p -糖蛋白的疗效没有受到负面影响+ ACE2细胞或人极化气道上皮培养[52].
Dai等最近的研究报道了设计和合成肠病毒71 (EV71) 3C蛋白酶(3Cpro)抑制剂的拟肽醛。设计策略包括仔细考虑的结构特点9(AG7088, rupintrivir),是一种治疗鼻病毒感染的拟肽抗病毒药物。EV71 3Cpro的晶体结构分析9揭示了关键的相互作用/概念,如(i) α、β-不饱和酯与Cys147残基(EV71 3Cpro的S1亚位)的共价连接ii)内酰胺环与Thr142和His161 (S1亚位)的氢键相互作用iii) S2亚位被取代苯基占据(P2位置)iv)溶剂暴露的异丙基片段(P3部分)v)唑环(P4部分)与Gly164、Asn145和Ser128的氢键相互作用。的交互配置文件9 (AG7088),文献判例也表明9由于α, β-不饱和酯功能容易水解,半衰期短(在大鼠血浆中< 2分钟),显示较差的血浆稳定性。另一个令人失望的发现是9 (AG7088)对SARS-CoV 3CL蛋白酶(IC50> 100 μm)。有了这些信息,作者开始了一项药物发现活动,以提供肠病毒和SARS-CoV - 2的肽类抑制剂,以寻求克服药物的局限性9.为了进一步推进上述追求,作者进行了结构分析9以及之前报道过的10[53),4[49],由此推断三个支架(9,10,4)包含类似的关键碎片(弹头和(S)-γ-内酰胺环)。生成的抑制剂进行了生物学评价,从而确定了有效的酶抑制剂11显示对肠道病毒和鼻病毒的广谱抗病毒活性。ev713cpro配合物与化合物的晶体结构分析11揭示了化合物的醛基11参与了与催化Cys147的共价连接。令人高兴的是,抑制剂11显示出对3CLpro和SARS-CoV-2复制的抑制潜力(IC50= 0.034 μm, ec50= 0.29 μm)。总的来说,复合11表现出更好的抗sars - cov -2以及药代动力学特征9(AG7088)(图。6) [54].
最近,Dai等人提供了Mpro靶向化合物,显示出大量的抗sars - cov -2感染活性(IC50= 0.53和0.72 μ mol/L)。两种化合物均具有较低的体内毒性和适当的药代动力学性质。仔细观察SARS-CoV-2 Mpro与化合物配合物的x射线晶体结构,发现其醛基共价结合12而且13到半胱氨酸145(图;7) [45].
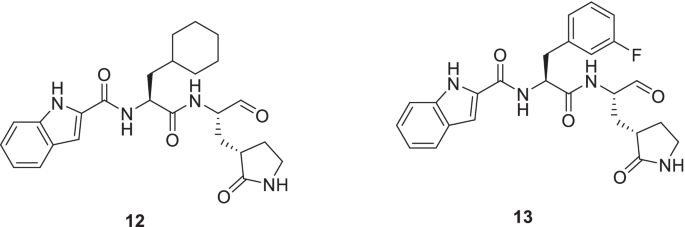
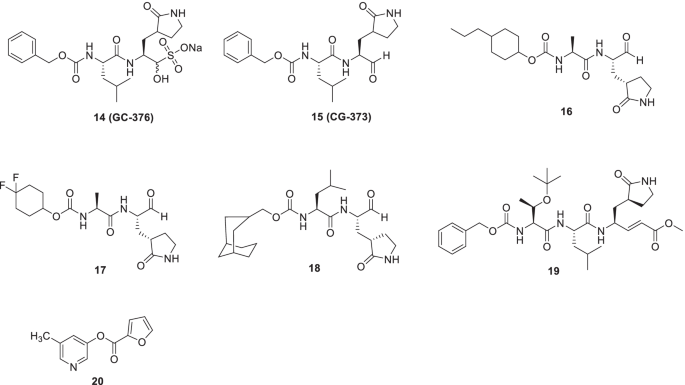
Rathnayake等人进行了结构指导下的优化努力,以提供冠状病毒3CLpro抑制剂[55].早些时候,该小组报告了多种人类和动物冠状病毒的二肽基和三肽基3CLpro抑制剂。根据上述化学类的药代动力学和药效学研究结果,推断二肽的药代动力学优于三肽[56,242].值得注意的是,二肽系列的原型支架,14(GC376),目前正在进行冠状病毒感染动物模型的临床研究。等,14是一种前药,已被证明具有治疗猫传染性腹膜炎的巨大潜力。在Vuong等人的一项研究中,14及其活性部分GC373 (15),被发现是Mpro (SARS-CoV和SARS-CoV-2)的有效抑制剂。令人高兴的是,前药以及母体化合物在纳摩尔浓度(IC)下发挥了抑制作用50值)。为了获得机理的见解,SARS-CoV-2 Mpro晶体结构加合物14而且15在2.0和1.9 Å进行了研究,并观察到亲核性Cys145与抑制剂的共价修饰。此外,半硫缩醛的可逆形成被发现是抑制作用的原因[57].有了这些信息,设计了新的二肽基系列,包括帽亚结构的结构变化。结果,这些努力导致了一种有前途的化合物的鉴定(16)被赋予对SARS-CoV-2的大量活性3CLpro (IC50= 0.17 μ M-FRET酶测定和EC50, 0.15 μ m细胞法)。另一个化合物,17对MERS-CoV表现出显著的抗病毒活性(EC50value = 0.04 μM)。在中东呼吸综合征冠状病毒感染的小鼠模型中进行的进一步探索表明,用化合物治疗17减少肺部病毒载量,增加感染小鼠的存活率。值得一提的是,只有当15以1 dpi剂量给小鼠(图;8) [57].
受到上述启示的刺激,Dampalla等人发起了一项以二肽基抑制剂为中心的药物发现努力。[58设计策略包括使用P1谷氨酰胺代物、P2亮氨酸残基和醛战斗部。该支架是在对蛋白酶可用的x射线晶体结构和先前报道的抑制剂进行深入研究后设计的[59,243,244].具体而言,构建了由构象约束环己基片段组成的过渡态SARS-CoV-2 3CLpro抑制剂(掩膜醛抑制剂以及非氘化和氘化二肽基醛)。第四,设计的加合物的成功提供,其作为SARS-CoV2 3CLpro抑制剂的分析是在生物化学和细胞基础上进行的。令人高兴的是,几种有效的MERS冠状病毒3CLpro抑制剂被确定,与化合物18在使用EC的vero细胞中显示出对SARS-CoV-2的抑制潜力50= 0.035µm。此外,化合物18显示适当的细胞渗透性以及缺乏细胞毒性(图。8) [58].
Iketani等人最近进行了一项研究,以确定SARS-CoV-2抑制剂。合成的化合物,14 (gc - 376),19而且20.(MAC-5576)被鉴定为具有IC的有效SARS-CoV-2-3CL抑制剂50值分别为151、160和81 nM。CPE还原实验结果显示病毒感染Vero-E6细胞可被阻断14(集成电路50= 2.883µM)和19(集成电路50= 2.189µM),20.没有证明这种能力。此外,化合物的结构14,19而且20.证实这三种都是共价抑制剂。虽然是共价键20.到Cys145,20.不能发挥时间依赖性的抑制作用,表明它可能是一种可逆共价抑制剂(图。8) [60]
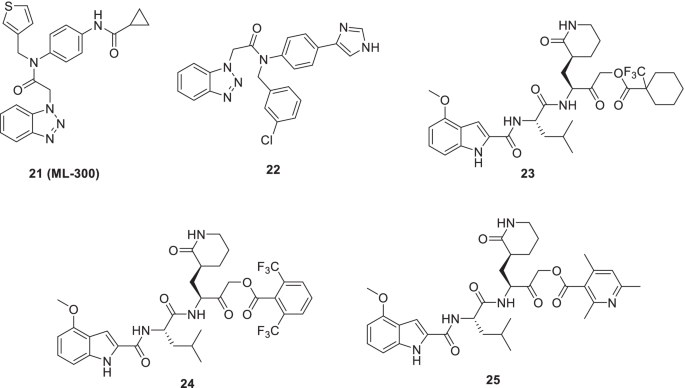
Han等人利用先前报道的非共价抑制剂的化学结构启动了一项药物化学优化计划21 (ML300)用于开发靶向SARS-CoV-2 3CLpro的支架[61].值得注意的是,21Turlingtone等人早些时候发现,这是他们致力于生成SARS-CoV 3CLpro抑制剂的一部分[61].为了指导本研究的进展,作者研究了SARS-CoV- 1和SARS-CoV-2 3CLpro酶的x射线结构21(ML300),ML300衍生抑制剂,表明S2- s4绑定的口袋。第四,设计的加合物成功完成,利用sars - cov -2感染Vero E6细胞活力测定和斑块形成测定对其进行了评估。结果,一种非共价小分子SARS-CoV-2抑制剂22发现了一种很有前景的活性谱[低纳摩尔生化抑制和细胞模型的有效性,EC50(SARS-Cov2 3CLpro) = 68 nM, EC50= 497 nM(抗病毒CPE抑制),EC50= 558 nM(斑块减少)]。值得注意的是复方的功效22与瑞德西韦相当。目前正在对化合物进行进一步的探索22以改善DMPK谱以及生化和细胞功效(图。9) [62].
Bai等人最近利用六元内酰胺谷氨酰胺模拟物作为结构基序设计α-酰基氧甲基酮战斗部拟肽支架。令人高兴的是,化合物第23 - 25被确定为SARS-CoV-2 3CLpro的有效抑制剂。具体来说,化合物第23 - 25IC抑制SARS-CoV2 3CLpro50分别为86 nM、1 nM和19 nM。此外,上述化合物对SARS-CoV-2 3CLpro的选择性优于CatB和CatS。进一步分析的结果揭示了几个关键的信息,如(i)化合物的优越活性谱第23 - 25(体外SARS-CoV-2抗病毒复制抑制)与先前报道的拟肽抑制剂相比(ii)共价加合物的形成(共结晶25与SARS-CoV- 233cl蛋白酶)(iii)化合物的潜力第23 - 25以抑制甲型冠状病毒和非sars乙型冠状病毒株。快乐的,化合物第23 - 25也显示出较低的细胞毒性,以及良好的血浆和谷胱甘肽稳定性(图。9) [63].
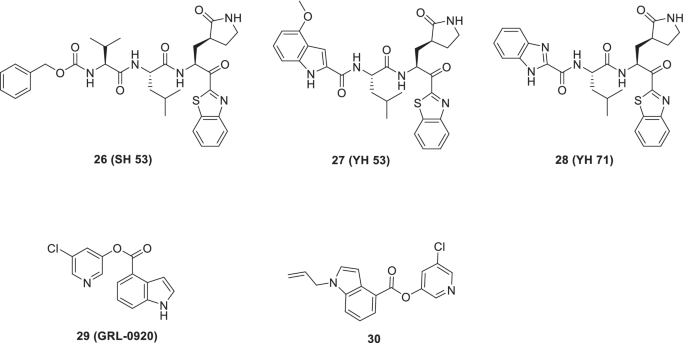
继续他们的药物发现项目,设计SARS-CoV-2 3CL箴抑制剂,Konno等人进行了另一个脚手架构建计划,以提供抗sars - cov -2药物[64].抑制剂26日(SH-5),27(YH-53),28(yh - 71)被鉴定为具有显著的SARS-CoV-1 3CLpro抑制活性,Ki值分别为4.1、6.3和22 nM [65,245].三种抑制剂的化学结构均含有苯并噻唑酮作为p1定向战斗部。进一步分析表明,SARS-CoV-1 3CLpro活性位点Cys145的亲电酮战斗部和亲核硫酯之间形成了可逆共价键。值得注意的是,这种相互作用通过半硫酮中间体的形成导致酶的短暂失活[65,245].本课题组根据已披露的SARS-CoV-1与SARS-CoV-2之间3CLpro结构相似性的研究结果,探索其此前报道的SARS-CoV-1抑制剂作为SARS-CoV-2抑制剂的潜力。让人满足的是,化合物代谢途径3CLpro对SARS-CoV-2有显著抑制作用,Ki值分别为14.5、34.7和32.1 nM。值得注意的是,在所有的三种化合物中,结构模板27(YH-53)由于其SARS-CoV2抑制活性,以及良好的体外ADME特征和体内药代动力学,被认为适合作为抗covid -19药物开发的先导化合物。进一步调查27表明与主链氨基酸形成了几个氢键。此外,在3CLpro的活性位点观察到一个共价键(图。10) [64].
Hattori等人最近评估了吲哚-氯吡啶酯对SARS-CoV-2的抑制活性。具体来说,作者使用VeroE6细胞和tmprss2过表达VeroE6细胞进行细胞基础分析。令人高兴的是,其中一种化合物29, GRL-0920对SARS-CoV-2表现出出色的活性(EC50= 2.8 μm)。复方可降低SARS-CoV-2的传染性、复制和CPE29.计算研究揭示了吲哚和氯吡啶基片段与Mpro, Cys145和His41的两个催化二元残基之间的关键相互作用,从而导致共价键(图2)。10) [66]
最近,Ghosh等人提供了一系列吲哚类5-氯吡啶酯,并评估了其作为抗sarscov -2 3CLpro抑制剂的疗效。生物评价结果表明,几种化合物可以在低纳摩尔浓度下发挥其3CLpro抑制潜力。机理研究表明,该抑制剂的酯羰基功能容易受到催化Cys145的攻击。此外,Cys145与活性酯的羰基之间形成了共价键。SAR研究表明,羧酸在吲哚环上的位置对活性至关重要。令人鼓舞的是,免疫细胞化学实验和Vero E6细胞实验的结果也证实了许多化合物的抗病毒活性。具体来说,复合29显示出显著的SARS-CoV-2 3CLpro抑制潜力[IC50= 250 nM, EC50= 2.8 μM (VeroE6细胞)]。值得注意的是,29在免疫细胞化学实验中显示出与瑞德西韦相当的抗病毒活性。另一个化合物30.使用IC显示了令人印象深刻的活动剖面50值73 nM (SARSCoV-2 3CLpro)10) [67].
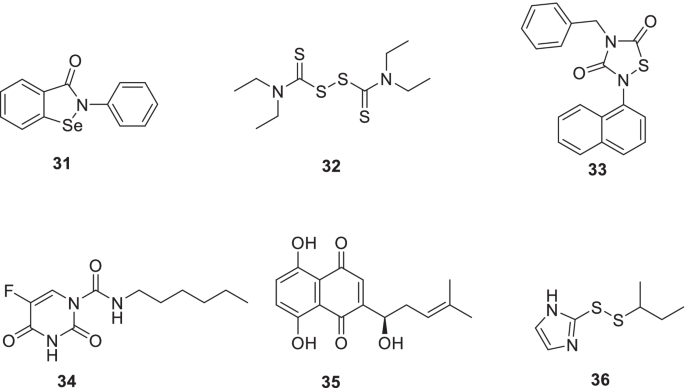
Ma等人探讨了先前报道的M箴抑制剂。具体地说,31(ebselen),32(戒酒硫),33(tideglusib),34(carmofur),35(紫草素),36(PX-12)采用原生质谱、分子动力学模拟、基于fret的酶分析、细胞抗病毒分析和热位移分析进行了机械研究。所有6种抑制剂均表现出非特异性Mpro抑制作用,1,4 -二硫苏糖醇的加入减弱了化合物的抑制活性。令人高兴的是,这些化合物对SARS-CoV-2 PLpro和2A也表现出抑制活性箴和3 c箴从肠道病毒A71 (EV-A71)和EV-D6(图。11) [68].
在SARS-CoV-2 Mpro抑制潜能的刺激下34(carmofur), Mpro的x射线晶体结构与34进行了研究。结果得到了一些关键的见解,如羰基反应基的共价结合34 (carmofur)到催化Cys145,疏水S2亚位点被脂肪酸尾巴占据(图。11) [69].
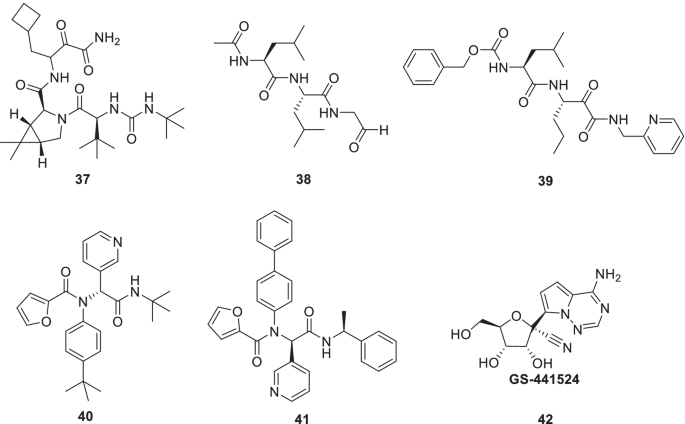
Ma等人采用基于fret的酶促实验并报道37(boceprevir),38(钙蛋白酶抑制剂II)和39(calpain inhibitor XII)作为针对SARS-CoV-2 Mpro的新型化学类型。值得注意的是,SARS-CoV-2病毒复制被显著抑制37-39(EC50= 0.49-3.37 μ m) [70].上述披露揭示了一个事实,即与大多数含有γ-内酰胺谷氨酰胺代物的Mpro抑制剂(P1位)不同,38而且39在P1位点包含疏水部分。值得注意的是,38而且39也表现出对抗宿主蛋白酶的活性,组织蛋白酶在病毒进入中起关键作用。基于上述,Mpro和组织蛋白酶L的双重抑制目前被认为是生成SARS-CoV-2抗病毒药物的一种谨慎的方法。[71].另一项研究报告了37(boceprevir)14(GC376)在vero细胞中抑制SARS-CoV-2。此外,研究结果还表明,与14(GC376)和remdesivir(图。12) [72].
受到钙蛋白酶抑制剂活性谱的启发,再加上钙蛋白酶类似结合模式的启示40(ML188)39(calpain inhibitor XII), Kitamura等人合理设计了非共价SARS-CoV - 2 M箴抑制剂(73].因此,40(ML188)是一种SARS-CoV Mpro抑制剂(IC50 =1.5±0.3 μm)。同时,40(ML188)抑制SARS-CoV病毒复制(EC50= 12.9 μM, Vero E6细胞)。在此背景下,使用基于结构的药物设计和一锅Ugi四组分反应生成了ML188类似物的概要。合成、复合41被鉴定为一种有效的非共价抑制剂,对SARS-CoV-2和SARS-CoV Mpro (EC50= 1.27 μM, Vero E6细胞),但对其他病毒和宿主蛋白酶没有作用。这是一个非常积极的发现14(GC376)没有表现出这种选择性趋势,也抑制宿主半胱氨酸蛋白酶,可能导致副作用。SARS-CoV-2 Mpro共晶结构的研究41在S2和S4位点之间发现了配体诱导的结合袋(图;12) [73].
化合物37(Boceprevir),38(钙蛋白酶抑制剂II)和39(钙蛋白酶抑制剂XII)以及14(GC376)也在其他研究中评估了其抑制SARS-CoV-2的潜力。一些必要的披露包括(i)广谱抗病毒活性37,38,39而且14对抗SARS-CoV、SARS-CoV-2、MERS-CoV及人类冠状病毒(229 E、OC43及NL63) [74(ii)体内SARS-CoV-2感染抑制效果14(iii)降低感染sars - cov -2的K18-hACE2小鼠的炎症反应和病毒载量14[75(iv)用鸡尾酒有效保护小鼠免受SARS-CoV-2感染14而且42(GS441524)(低剂量)12) [76].
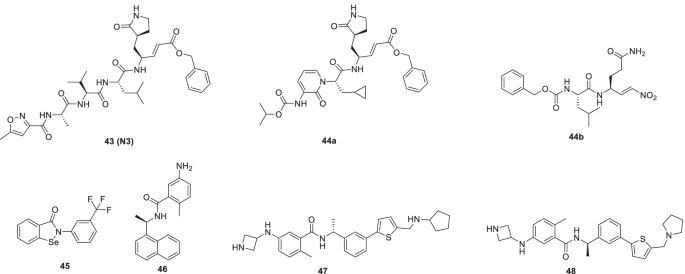
Jin等人采用基于结构的药物设计策略,结合HTS和虚拟药物筛选,开展了一项运动,以确定具有靶向SARS-CoV-2 Mpro能力的有前途的支架。合成,31(Ebselen,有机硒化合物)和43(N3,一种迈克尔受体抑制剂)表现出明显的抑制潜力SARS-CoV-2 (EC50= 4.67 μM和16.77 μM)。此外,这两种化合物都被赋予了细胞膜穿透能力,以接近他们的目标(图。13) [77].
阿拉法特等最近模拟了SARS-CoV-2 Mpro的抑制过程43(N3),并利用结果设计了两种假定的抑制剂44一个而且44个bSARS-CoV-2 Mpro。的识别部位43(N3)随着抑制剂设计的不同而不同44一个并对弹头进行了改性,以提供缓蚀剂44个b.基于QM/MM建模的机理研究揭示了该化合物44一个是不可逆的抑制剂吗44个b是可逆的抑制剂。基于这些发现,有必要评估这些抑制剂,以确定其作为抗covid药物的候选性(图2)。13) [78]
Huff等人研究了31日(ebselen)在Mpro的活性部位。利用提取的信息,设计并合成了一系列2-苯基-1,2-苯并硒唑-3-酮类似物。结构变化特别指向n -苯基部分以及电子多样性的取代,并探索了苯基部分的一些亲脂性替代品。在合成的化合物中,通过基于fret的重组SARS-CoV-2 Mpro筛选确定了6种化合物,这些化合物在纳摩尔浓度下表现出极大的抑制蛋白水解的潜力。通过孵育前稀释实验和分子对接实验,证实了共价和非共价机制对SARS-CoV-2 Mpro的抑制作用。最有效的化合物45显著抑制病毒复制(EC50值844 nM, sars - cov -2感染的Vero E6细胞)。还有化合物的潜力45损害SARS-CoV-2在人肺上皮细胞中的复制和人诱导多能干细胞来源的3D肺类器官被证明(图。13) [79].
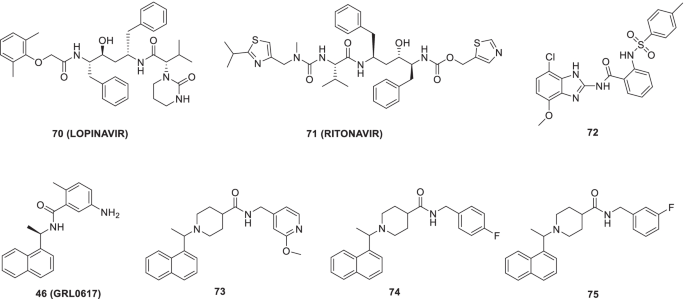
与SARS-CoV-2半胱氨酸蛋白酶一样,3CLpro, 2木瓜蛋白酶样蛋白酶(PLpro)也被认为是COVID-19的一个极好的治疗靶点,因为它参与了病毒复制的调节和逆转宿主介导的翻译后修饰以应对病毒感染。不幸的是,抑制活性位点半胱氨酸共价修饰的策略已被充分用于3CLpro抑制剂的生成,但由于P1和P2位点无特征(Gly-Gly识别),它不适用于PLpro抑制性加合物的构建。虽然46(GRL0617)是一种非共价SARS-CoV PLpro抑制剂(IC50= 1.61 μ M),它没有显示出令人印象深刻的活性谱,以进一步追求其作为抗病毒药物的发展。然而,的共晶46最近,由于sars冠状病毒的感染,PLpro已经启动了几项基于结构的设计工作。有了这些信息,的结构模板46(GRL0617)被Shen等人用作SARS-CoV - 2 PLpro抑制剂设计的起始支架。早前已经确定,苯甲酰胺46负责与BL2环残基建立氢键网络。然而,作者的策略是基于使用比使用的更多的绑定交互46在寻求提取放大抑制剂的效力。基于这种想法,我们提供了一组非共价PLpro抑制剂。随后的生物学评估导致了强有力的PLpro抑制剂的鉴定,如47 (集成电路50= 0.39 μ M)和48(集成电路50= 0.56µM),显示出阻断SARS-CoV-2 PLpro感染人类细胞的显著潜力。值得一提的是,该研究的结果进行了能力评估47而且48达到合适的血浆浓度表明C马克斯含量为6130 ng/mL476403 ng/mL48分别对应12 ~ 13 μM等离子体浓度。总的来说,上述披露的情况值得进一步调查47而且48(无花果。13) [80].
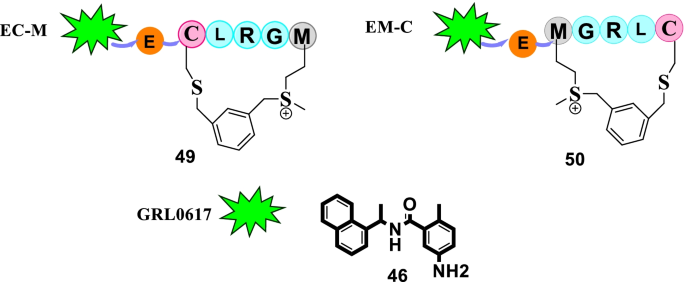
在肽-药物缀合物(PDCs)传递药物有效载荷的潜力的刺激下,Liu等人开始努力通过连接的结构模板来提供SARS-CoV-2靶向PDCs的PLpro46(GRL0617)转化为来自plpro特异性底物LRGG的磺系肽。该研究的结果是压倒性的积极,因为两个加合物(49而且50)显示了共价标记PLpro活性位点C111的能力,也能与SARS-CoV PLpro和MERS PLpro共价结合。令人高兴的是,加合49而且50被发现对SARS-CoV PLpro具有显著的抑制潜力与IC50分别为3.43±0.54和16.38±0.81 μ M。此外,抗isg15免疫印迹试验结果显示,SARS-CoV-2 PLpro抑制的细胞ISGylation水平可以被恢复49而且50以剂量依赖的方式。值得注意的是,PDC 50也表现出在细胞水平上恢复IFN-β启动子活性的潜力。总的来说,我们推断加合物50在重新激活宿主对抗病毒感染的先天免疫反应以及干扰SARS-CoV-2复制的背景下发挥双重作用(图2)。14) [81].
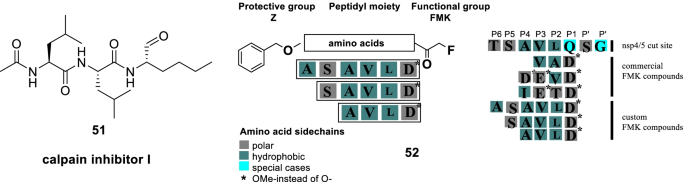
为了寻找SARS-CoV-2抑制剂,Milligan进行了一项高通量药物筛选计划,以确定NSP5(非结构蛋白)抑制剂。众所周知,Mpro切割多蛋白(由nsp5编码)释放nsp4-nsp16,切除的nsp在构成病毒复制转录复合体中起着至关重要的作用。在这种情况下,nsp5抑制目前被认为是抗病毒药物设计的一种合理策略。有了这些信息,作者开始了他们的努力,并开发了nsp5蛋白酶活性的测定方法。评估了5000种特征药物的概要。因此,一些有希望的nsp5抑制剂被鉴定出来(51,钙蛋白酶抑制剂I和52,肽基氟甲基酮)。第四,作者对拟肽FMK抑制剂采用了序列改变的方法,并提供了有效的nsp5抑制剂(IC50 =0.16 - -0.23µM)。总的来说,猴子来源的vero E6细胞的病毒感染的显著抑制作用51calpain I抑制剂,EC50= 0.28 μ m)。此外,所提供的肽基FMK抑制剂显示出明显的抗病毒活性(图。15) [82].
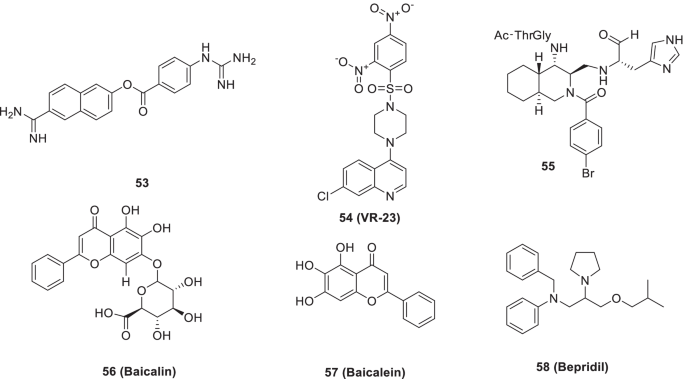
最近,Bhowmik等人对蛋白酶抑制剂库中的几种配体进行了分子对接,以确定其结合亲和力。基于对接得分,53(Nafamostat)和54(VR23,蛋白酶抑制剂)进一步研究,观察到这两种抑制剂都具有良好的药代动力学特性。总的来说,53而且54,被确定为治疗COVID-19的潜在3CLpro和PLpro SARS-CoV-2抑制剂[62].此外,动力学模拟研究强调了fda批准的蛋白酶抑制剂paritaprevir和simeprevir对SARS-CoV-2 3CLpro的抑制潜力。16) [83].
另一项最近的研究在结构上探索了十氢异喹啉支架,用于提供SARS 3CLpro的非肽抑制剂。设计策略包括在十氢异喹啉支架的第4位引入一个非素数取代基。加合物(55)由Pd (II)催化形成非对映选择性环。令人高兴的是,所采用的策略取得了成效55对R188I SARS 3Clpro (IC50= 26µM)16) [84].
Vandyck等报道了SARS-CoV-2 3CLpro的抑制潜力alg - 097111(结构未披露)(IC50= 7 nM),并能减少肺部的病毒RNA拷贝和传染性病毒滴度。值得注意的是,alg - 097111选择性抑制SARS-CoV-2 3CLpro,不调节人组织蛋白酶L的功能[85].
在研究来自中国传统药物的天然产物时,Su等人发现56(黄芩苷)而且57(黄芩甙元)作为SARS-CoV-2 3CLpro抑制剂(IC50= 10.27和1.69 μ mol/L,非共价,非拟肽型抑制剂)。随后的调查揭示了关于的绑定模式的关键见解57(黄芩甙元)使用SARS-CoV-2 3CLpro。复合57(黄芩甙元)与S1/S2子位点和氧阴离子环相互作用,阻止肽底物到达活性位点[86].另一项研究结果表明57(黄芩甙元)通过抑制线粒体OXPHOS作用于SARS-CoV-2复制,并以mptp依赖的方式发挥作用。除了强调潜力之外57(黄芩甙元)作为一种有前景的治疗COVID-19的药物,研究结果表明,靶向线粒体OXPHOS/mPTP是一种谨慎的抗病毒药物开发策略[87].Liu等还研究了其抗sars - cov -2活性美国baicalensis以及它的成分。的主要成分s . baicalensis57(黄芩甙元)被发现具有华丽的SARS-CoV-2 3CL箴抑制活性(IC)50= 0.39µm)。实验还表明,乙醇提取物美国baicalensis抑制病毒进入57(黄芩素)在病毒进入后阶段起作用。此外,一些类似的57(黄芩素)对SARS-CoV-2 3CL也有抑制作用箴活动(无花果。16) [88].
Vatansever等人通过计算对接分析评估了30种FDA/ ema批准的药物的Mpro酶(SARS-COV-2)抑制潜力。合成、复合58 (bepridil)被鉴定为SARS-COV-2在Vero E6和A549细胞内进入和复制的强抑制剂。此外,Vero E6和A549细胞抑制SARS-CoV-2感染诱导的CPE58 (bepridil)(集成电路50值= 0.86和0.46 μ mol/L)(图;16) [89].
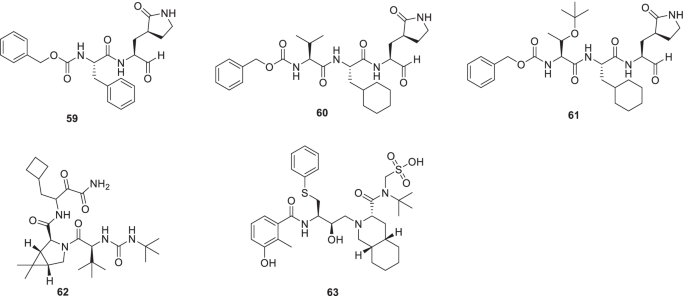
Yang等人开始了一项药物化学努力,以产生基于蛋白石的二肽基和三肽基的SARS-CoV-2 Mpro抑制剂。β-(s -2- oxopyrroliin -3-yl)-丙氨酸(Opal)被策略性地放置在设计加合物的结构模板中,与SARS-CoV-2 Mpro活性位点半胱氨酸C145形成可逆共价键。随后的评价导致了对59作为SARS-CoV-2的有效抑制剂Mpro (IC50= 8.5 nM)。其他几种抑制剂在Vero E6和A549/ACE2细胞中也表现出对SARS-CoV-2诱导的CPE的显著抑制潜力。值得注意的是,抑制剂完全阻止了Vero E6细胞中sars - cov -2诱导的CPE60而且61(无花果。17) [90].
在Jan等人的一项研究中,使用基于细胞的感染试验筛选了大量小分子和传统草药。上述努力导致鉴定出15种具有抗感染活性的小分子。两个小分子62 (boceprevir)而且甲磺酸奈非那韦)显示出很好的效果,因为它们可以抑制SARS-CoV-2的感染和IC的复制5050.1和3.3 μ mol/L。我们评估了活性化合物的3CL pro靶向潜力,并进一步在体内进行了测试。合成,62(boceprevir),63(奈非那韦)显示出抑制3CLpro的潜力。此外,在一项以仓鼠为疾病模型的挑战性研究中,两种化合物(62而且63)显示了疗效(图;17) [91].
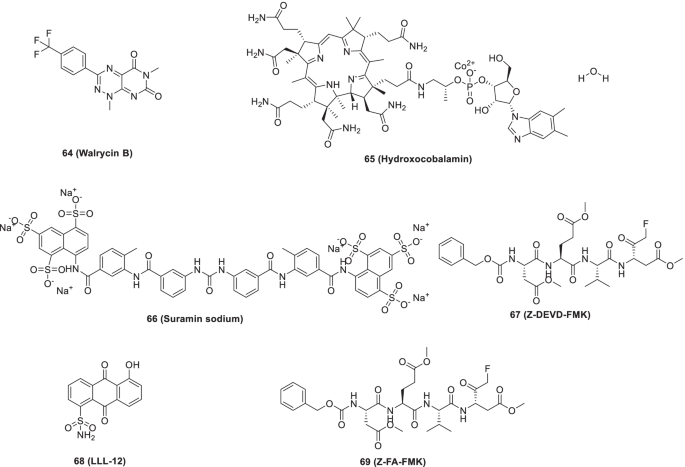
Zhu等鉴定出23种SARS-CoV-2小分子抑制剂3CLpro (IC50值= 0.26-28.85 μ M)通过批准和研究药物的定量HTS。研究结果是乐观的,因为几种化合物被发现具有极好的到中等的抑制潜力。具体地说,64(Walrycin B, IC50= 0.26 μm),65(羟钴胺素,集成电路50= 3.29 μm),66苏拉明钠,IC50= 6.5 μm),67(Z-DEVD-FMK,集成电路50= 6.81 μm),68(LLL-12,集成电路50= 9.84 μM)69(Z-FA-FMK,集成电路50= 11.39 μM)是最有希望的。总的来说,这些抑制剂可与其他抑制剂联合用于治疗COVID-19,也可用于结构工程,以增强效力(图2)。18) [92].
Choy等人最近报道了70 (lopinavir)(蛋白酶抑制剂)抗SARS-CoV-2病毒在Vero E6细胞(EC50= 26.63 μ m) [93].在一项针对COVID-19患者的2期试验中,三联抗病毒组合的有效性和安全性70(洛匹那韦),71(利托那韦)而且利巴韦林用干扰素β -1b进行评估。试验结果是压倒性的积极,因为三联疗法可以缩短COVID-19患者病毒脱落的时间。值得注意的是,三联抗病毒治疗被发现是安全的(图。19) [94].
鉴于USP2抑制剂显示出SARS-CoV PLpro抑制潜力的报道,Mirza等人开始了一项集成硅片研究,通过集成硅片工作来识别潜在的USP2抑制剂。结果,复合72 (Z93)被认为是一个很有前途的候选人,可以很好地适合蛋白酶的结合位点,并被发现参与π-π堆叠和h键相互作用。(无花果。19) [95].
Gao等人报道了46(grl - 0617)作为SARS-CoV-2 PLpro活性(IC50= 2.2 μ mol/L),并研究了SARS-CoV-2 PLpro复合物的结构GRL0617(46)致2.6 Å。观察到,除了占用衬底的结合袋,化合物46还通过密封衬底粘结裂缝的入口来防止衬底的粘结[96].SARS-CoV-2 PLpro的抑制潜能46(grl - 0617)也在另一项研究(IC50= 2.1 μ mol/L)。在基于细胞的检测中,该药对SARS-CoV-2显示出有效的抗病毒抑制作用。SARS-CoV-2 PLpro共晶结构的观察C111S通过46 (GRL0617)揭示了抑制剂的共价性质。此外,人们还发现46(GRL0617)位于PLpro的泛素特异性蛋白酶结构域。ISG15 c端与PLpro的结合被阻断46 (GRL0617)核磁共振研究表明。值得注意的是,该药物在浓度为100 μ mol/L时对Vero E6细胞几乎没有细胞毒性(图2)。19) [97].
Klemm等人最近报道了非共价抑制剂73针对SARS-CoV-2 PLpro (IC50= 0.81 μ m)。的抑制剂73此外,该抑制剂还显示出阻止nsp3-GFP自我加工的潜力,表明该抑制剂可以有效地靶向病毒复制。治疗后CPE明显降低73(11µmol / L)。还有另外两种非共价抑制剂,74而且75IC可抑制SARS2 PLpro50= 1.4 μ M和1.15 μ M(图;19) [98].
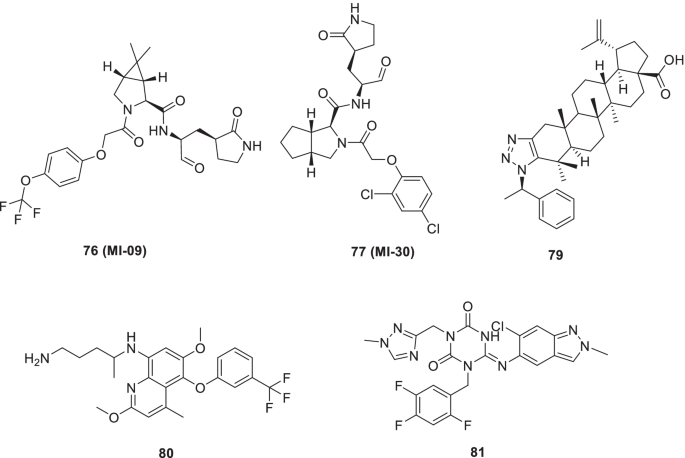
Qiao等人开始了一项药物发现努力,并提供了32种新的含双环脯氨酸的Mpro抑制剂。随后的评估鉴定出两种化合物(76, MI-09和77在SARS-CoV-2感染转基因小鼠模型中,MI-30被赋予了优异的抗病毒活性,并能降低肺部病毒载量和肺部病变。研究结果还显示,这两种化合物都能下调IFN-β和CXCL10的表达水平,这被认为是化合物能够改善肺损伤的原因。此外,两种化合物都表现出适当的药代动力学性质(图。20.) [99].
在为COVID-19小分子抑制剂设计寻找药物靶点的研究中发现,COVID-19的NSP15是一种尿苷酸特异性核糖核酸内切酶,与COVID-19具有高度的序列相似性NSP15可以作为提供抗covid -19药物的谨慎目标。尽管NSP15的功能还不完全清楚,但据报道,NSP15参与了RNA复制和亚基因组RNA的加工。为了利用这些发现,基于结构的药物设计运动已经启动,以确定针对COVID-19的抗病毒药物的NSP15 [One hundred.].Stevaert最近的一项研究很好地证明了这一努力,并报告了基于1,2,3-三唑熔融桦木酸的冠状病毒nsp15抑制剂。为建立结构-活性关系所投入的努力最终确定了HCoV-229E复制的有效抑制剂(EC50= 0.6 μm)。使用HCoV-229E进行了机理研究,观察到该抑制剂79在病毒RNA合成的早期阶段起作用,这由添加时间实验的结果证明。此外,还观察到核糖核酸内酶活性位点突变病毒对暴露的敏感性明显降低79.推测HCoV-229E nsp15基因n端突变是导致上述化合物耐药的原因79.对接研究披露的信息显示79与EndoU催化核相邻的单体间nsp15界面结合(图2)。20.) [101].
Chen等人最近利用基于fret的HTS平台筛选了fda批准的用于治疗COVID-19患者的药物。合成,80(他非喹)是一种抗疟疾药物,被发现有可能使SARS-CoV-2 Mpro发生构象变化,从而降低蛋白酶活性。此外,该药在细胞培养系统中显著抑制SARS-CoV-2感染50= 2.5 μ mol/L) [102].在另一项研究中,80在VERO E6细胞中,发现(他非喹)比羟氯喹更能抑制SARS-CoV-2(图2)。20.) [103].
UNOH等人发现了一种非共价非肽性SARS-CoV-2 3CLpro抑制剂81 (s - 217622)采用虚拟和生物筛查方案。令人高兴的是,抑制剂[IC]对SARS-CoV-2变体表现出抗病毒活性50(SARS-CoV-2 3CLpro) = 0.13µM和EC50(VeroE6/TMPRSS2) = 0.37µM]。此外,81 (s - 217662)也发现适合每日口服一次,并对小鼠SARS-CoV-2的肺内复制具有剂量依赖性抑制作用(图2)。20.) [104].
最近,Kneller等人试图在近生理温度(22°C)下,描述Mpro与蛋白酶抑制剂配合物的中子结构。具体来说,比较了抑制剂复合物和无配体Mpro的质子化状态。结果发现,抑制剂的结合导致级联的质子化/脱质子化和构象事件。上述事件导致SARS-CoV-2 Mpro活性位点腔的重塑。总的来说,该研究结果可用于设计具有特异性靶向SARS-CoV-2 Mpro酶潜力的蛋白酶抑制剂[105].
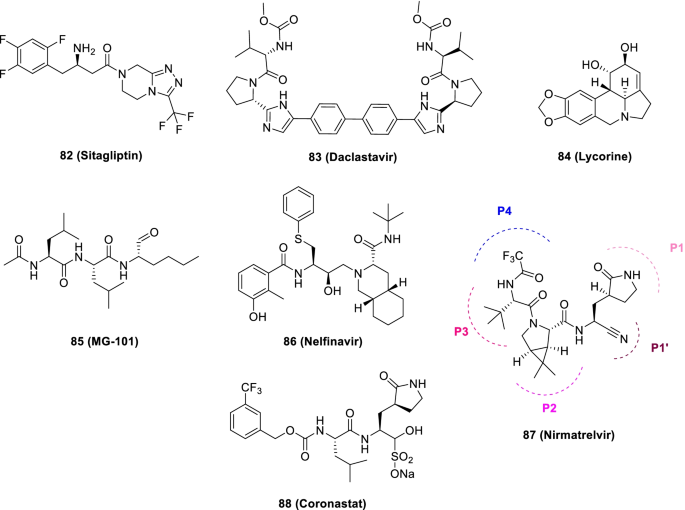
Narayanan等人为了快速鉴定具有低细胞毒性的蛋白酶抑制剂,采用了一种新的细胞内蛋白酶测定方法。在这项研究中,筛选了64种重新用途的药物库,从而确定了8种具有抗sars - cov -2活性的化合物。值得注意的是,82(Sitagliptin)被发现是一种有效的PLpro抑制剂,可以降低Huh-7.5细胞中的SARS-CoV250= 0.32 μM, 1 CC50直径22 μM。另一种PLpro抑制剂,83 (Daclastavir)还证明了降低Huh-7.5细胞中SARS-CoV-2复制的潜力。此外,复合84(盐酸石蒜碱)也引起了惊人的Mpro抑制活性与EC500.01 μ M。还观察到用鸡尾酒治疗85 (mg - 101Mpro抑制剂)和82 (SitagliptinPLpro抑制剂)对SARS-CoV-2 Delta变异生长有显著抑制作用。的组合84(盐酸石蒜碱)或86甲磺酸奈非那韦而且85 (mg - 101)显著降低了病毒滴度总体而言,该研究结果除了为开发SARS-CoV-2抗病毒药物提供了一种快速筛选方法外,还表明联合抑制Mpro和PLpro是抑制SARS-CoV-2及其delta变体的一种谨慎策略(图2)。21) [106].
Bung等人利用基于深度神经网络的生成和预测模型对小分子的设计(从头设计)进行了研究。具体而言,该模型用于3CL pro抑制剂的设计。这项研究的结果是,31个潜在的NCEs被精确定位,其中一些显示出与HIV蛋白酶抑制剂惊人的相似。总体而言,所鉴定的化合物有望抑制SARS-CoV-2的3CL蛋白酶[107]
Franko等人基于合成的自蛋白水解转录因子设计了模块化、可调的自蛋白水解基因开关(TAGS),显示出蛋白酶抑制依赖的转激活能力。利用设计的合成转录因子测定突变对蛋白酶的影响,并报告化合物的细胞内抑制活性。具体来说,候选药物对Mpro和PLpro活性的影响由TAGS报告,具有高信噪比响应和抑制病毒复制的灵敏度匹配浓度范围。人们高度期待TAGS可能成为加速未来细胞和基因疗法药物开发的有效工具[108].
传统HTS检测抗sars - cov -2支架的鉴定往往受到成本高、命中率低等因素的阻碍。为了克服这一障碍,Xu等人开发并使用机器学习模型来识别能够抑制SARS-CoV-2进入人类宿主细胞的化合物。令人鼓舞的是,表现最佳的模型使病毒进入抑制剂的检测命中率提高了2.1倍,3CLpro抑制剂的检测命中率提高了10.4倍。结果,在SARS-CoV-2活病毒测定中鉴定出几种具有强活性的化合物。这些发现证实了使用机器学习模型是加快抗sars - cov -2药物研发工作的有效方法[109].
最近,FDA于2021年12月22日向Paxlovid™发布了用于COVID-19(轻度至中度,年龄≥12岁的患者)的EUA。Paxlovid™是一种组合治疗,包括nirmatrelvir和ritonavir(低剂量)的鸡尾酒,以减缓肝脏代谢。值得注意的是,拟肽3c样蛋白酶抑制剂,87 (Nirmatrelvir),含有一个谷氨酰胺模拟吡咯烷酮部分(P1结构域)和一个氰基(亲电战斗部,P1’)。值得注意的是,87 (Nirmatrelvir)是一种可逆共价抑制剂,因为它与Mpro的催化半胱氨酸形成硫酰亚酯加合物,并具有抗SARS-CoV-2的体内外疗效[110].重要的是,Nirmatrelvir (87)适合口服[111].研究发现,联合用药可降低轻症COVID-19患者的住院风险和死亡率(图2)。21) [112,113].
Liu等人最近报道了基于gc376的小分子SARS-CoV-2 3CLpro抑制剂具有类药物性质。据报道,88(coronastat nk01 - 63)被发现是最有希望的化合物,对SARS-CoV-2具有强大的抑制作用50= 16 nM)。有人还指出88EC能阻止人类冠状病毒(alpha OC43和beta 229E)的病毒复制吗50在Huh-7人类细胞中值< 100 nM。此外,该药还阻断了MERS-CoV的复制(EC50值< 1 μM)和SARS-CoV (EC50值< 3 μM)。进一步的调查结果表明88 (nk01 - 63)经IP或口服给药均未表现出体内毒性。而且,大量的集中88 (coronostat)可以通过两种途径进入血浆和肺部。总的来说,88 (Coronastat)被推断为一种有效的小分子蛋白酶抑制剂,显示出治疗SARS-CoV-2感染的潜力(图2)。21) [114].
RdRp抑制剂
RdRp (nsp12)为抗病毒抑制剂的设计提供了一个谨慎和充分探索的靶点。因此,RdRp催化病毒基因组合成,这在冠状病毒复制中起着至关重要的作用。核苷类药物和非核苷类药物都被用作RdRp抑制剂,然而,由于耐药性问题,非核苷类药物的开发经常受到阻碍[115].
瑞德西韦
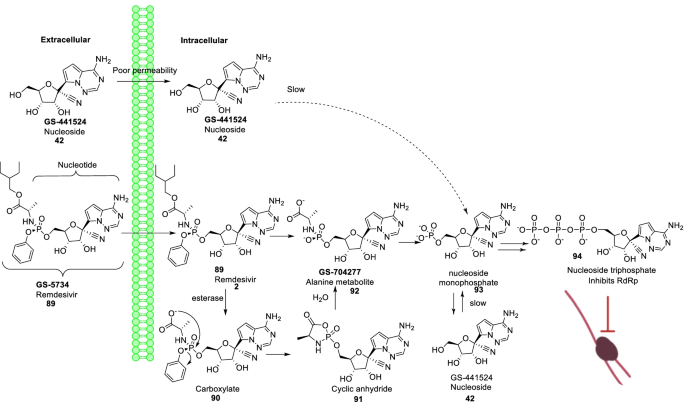
Remdesivir (89)是Gilead Sciences开发的一种广谱抗病毒药物。虽然最初是为治疗埃博拉而开发的,但它证明了有效阻断SARS-CoV-2感染的能力(EC50= 0.77 μm) [115,116,117,118,119,120,121,122,123].总的来说,89 (remdesivir)与SARS-CoV-2聚合酶- rna复合物形成复合物,表明延迟链终止机制[120,121].威廉姆森等人解释了89 (remdesivir)通过与丝氨酸的空间相互作用,阻碍RdRp合成中的易位,从而抑制SARS-CoV-2在动物模型中的作用[122,123].高兴地,89 (remdesivir)被发现具有低细胞毒性(CC50> 100 μm)。化学,89 (remdesivir)是一种芳氧基磷酸酰胺前药,可转化为单磷酸瑞德西韦(93)通过一系列复杂的反应。瑞德西韦单磷酸核苷(93)然后有效地转化为核苷三磷酸(94)靶向RNA病毒聚合酶并阻止病毒复制(图。22) [115,116].文献先例表明,1 ' -氰基取代腺嘌呤C核苷(42岁的gs - 441524)是低磷酸化的,它的芳氧基磷酸酰三孕期前药,89 (remdesivir),可以绕过所感知的缓慢的第一次磷酸化(图。22).尽管事实是94(三磷酸核苷)是一种极好的病毒RdRp抑制剂,具有抗病毒活性89 (remdesivir)在不同的细胞类型中变化很大。这种可变的活性剖面归因于转化所需酶的不一致表达模式89来93(无花果。22) [117,118,119].
Wit等人于2020年采用恒河猕猴模型进行MERS-CoV感染,并报告了MERS-CoV感染的可能性89 (remdesivir)(在动物感染中东呼吸综合征冠状病毒之前或之后给药)以减轻疾病严重程度、病毒复制和对肺部的损害[124].Remdesivir (89(双盲、随机、安慰剂对照试验,ACTT-1, NCT04280705)在缩短COVID-19住院成人的康复时间和减少下呼吸道感染方面显示出比安慰剂更好的结果[125].一项涉及30个国家405家医院的11,266名患者的临床试验(团结试验)结果显示,死亡率几乎没有差异(瑞德西韦组和对照组的危重患者)。基于上述结果,得出结论89 (remdesivir)对住院病人死亡率影响不大或影响不大或没有影响[126].尽管在死亡率出现有利趋势的情况下,团结试验失败,但试验结果并没有否定89 (remdesivir),由于ACTT-1评估的缩短恢复时间被认为是衡量治疗效果的更好标准89 (remdesivir)[125,126,127].美国FDA于2020年10月22日正式批准89 (remdesivir)作为首个也是唯一一个治疗COVID-19的药物。总的来说,可以确定89 (remdesivir)仅在提高康复百分比(COVID-19住院成年患者)方面有效,同时接受通气的比例略有降低,但在降低死亡率方面无效[127].
一些研究支持瑞德西韦母核苷的优越性42(gs - 441524)在COVID-19治疗的背景下。其优势在于结构简单,易于合成42(gs - 441524)比较瑞德西韦ii)鉴定42作为瑞德西韦在循环中的主要代谢物iii)证实的抗病毒活性概况42 (gs - 441524)对抗各种冠状病毒株。尽管有上述乐观的启示,候选人42 (gs - 441524)通常存在争议,因为感染SARS-CoV-2的原代HAE细胞对89 (remdesivir)[128,246].对此,Li等人进行了深入的研究,对其体外和体内抗sars - cov -2活性进行了研究42(gs - 441524)并报告说42(gs - 441524)3种细胞系(Vero E6、Calu-3和Caco-2)显著抑制SARSCoV-2。据观察,在致死性MHV-A59小鼠模型中,42(gs - 441524)可以减少肝脏中的病毒载量防止死亡此外,在感染SARS-CoV-2的AAV-hACE2小鼠中,42 (gs - 441524)导致病毒滴度大幅下降。快乐的,42(GS441524)还证明了抑制SARS-CoV-2在肺部的复制并缓解肺部炎症和损伤的潜力。总的来说,研究结果强调了42 (gs - 441524)用于治疗COVID-19 [129].
目前正在进行大量的研究,以寻求合适的替代品89 (remdesivir)用于COVID-19治疗,或通过设计新的制剂或通过结构改变提供的制剂89 (remdesivir)。的化学结构89 (remdesivir)包括适当定位的伯胺功能,可用于将瑞德西韦支架与其他有效抗病毒药物融合以提取协同效应。
最近的发现表明,伴侣蛋白HSP90在病毒性疾病中是一个广泛涉及的靶标。事实上,一项关于间苯二酚环含HSP90抑制剂ADX-1612的研究报告称,该药物在纳摩尔浓度下具有显著的效力,这从体外研究的结果中可见一斑。令人高兴的是,效果adx - 1612被观察到与的相似或更明显89 (remdesivir).机理研究表明adx - 1612对与病毒复制和感染相关的蛋白质施加抑制作用。作用的机制adx - 1612互补的作用机制是什么89 (remdesivir)在核酸抑制的背景下。这些见解强调了这样一个事实adx - 1612当联合使用时,可能会增加其他抗病毒药物治疗COVID-19的活性。重要的是,根据SARS-CoV-2感染人类细胞系的表达谱,HSP90也被确定为病毒抑制的关键药物靶点[130,131].总的来说,这些发现表明,启动临床评价研究的组合89 (remdesivir)使用HSP90抑制剂或开发混合支架(瑞德西韦-HSP90抑制剂)是当前的需要。
人们高度期待以RdRp抑制剂为中心的抗病毒设计将以更快的速度进行,因为核苷类似物的结合模式,89 (remdesivir)而且95 (favipiravir)已经在Rao等人的研究基础上得到了很好的确立。[132].值得注意的是,本研究解决了nsp7和nsp8配合物(2.9 a°)中全长RdRp的冷冻电镜结构[108].此外,苏拉明在通过靶向RdRp抑制SARS-CoV-2感染方面的初步成功可以激励研究人员转向非核苷类抑制剂。值得注意的是,苏拉明在抑制SARS-CoV-2感染方面表现出比瑞德西韦更明显的活性[133].
法匹拉韦
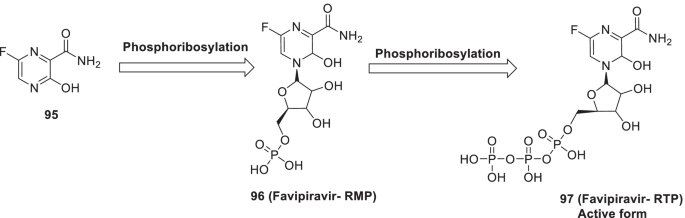
由富山化学公司开发,95 (favipiravir, Avignan)是一种吡嗪羧酰胺基衍生物。因此,95 (favipiravir)前体药物会转化成什么96 (favipiravir-ribofuranosyl-5一磷酸)通过磷酸核糖化进一步代谢成97(法吡拉韦-核呋喃基-5 ' -三磷酸,活性形式)发挥其RdRp抑制活性(图;23).人们发现95 (favipiravir)Vero细胞被赋予抗sars - cov -2活性[134,135,136].Favirapir (95)于2020年3月获中国国家药品监督管理局批准,成为中国首个抗COVID-19药物。临床研究结果进行评估的疗效95 (favipiravir)在COVID-19患者(35例)(ChiCTR2000029600)中,与对照组相比,favipiravir组的病毒清除时间更短[137].在一项多中心随机研究中,该药物还显示出改善COVID-19患者第7天康复的潜力。(ChiCTR200030254) [138].最近的一项研究表明95 (favipiravir)对轻中度COVID-19患者的死亡率没有任何显著的有益影响。此外,95(法匹拉韦)在临床试验中被发现对治疗SARS-CoV-2感染有效,因为它可以缩短可检测到的病毒RNA负转化的滞后时间[139].
Molnupiravir
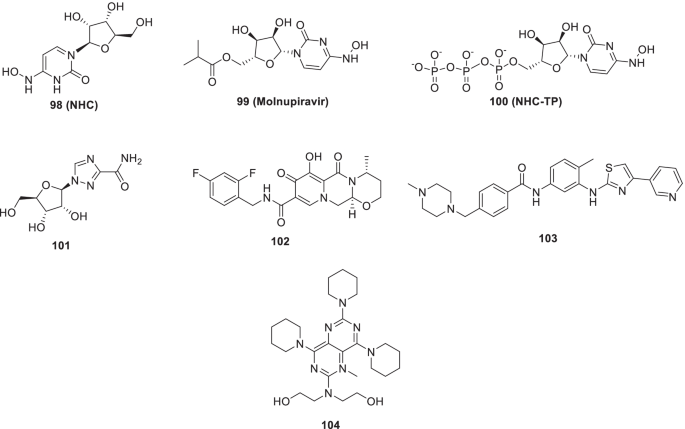
β-D-N4-hydroxycytidine (98年,eidd - 1931)是一种口服的核糖核苷类似物,在具有IC的Vero细胞中被发现具有对抗SARS-CoV-2的抗病毒活性500.3 mmol/L。Molnupiravir (99年,eidd - 2801)是一种口服生物可利用的前药98 (eidd - 1931)在治疗和预防双重作用下,在SARS-CoV感染小鼠中显示出改善肺功能、降低病毒滴度和体重减轻的潜力。作用的机制99(eidd - 2801的)对冠状病毒的抑制作用尚未完全阐明,但该药物通过抑制RdRp显示了对流感病毒的抗病毒功能。值得注意的是,99(eidd - 2801)对瑞德西韦耐药突变体有效,并显示出更高的耐药遗传屏障89 (remdesivir)[140].最近的研究阐明的机制99 (molnupiravir)揭示了活动的形式99(EIDD-2801), 100 (β d-N4-羟基胞苷三磷酸被RdRp用作底物,而不是三磷酸胞苷或三磷酸尿苷,导致RNA产物突变。对含有诱变产物的RdRp-RNA复合物的分析表明,该复合物可形成稳定的碱基对98 (NHC)在RdRp活性中心有G或A [141].由此得出结论,在复制冠状病毒时,增加G向A和C向U转变突变可导致显著的抗病毒作用99 (Molnupiravir)或98.另一项研究证实了100 (NHC-TP)对纯化的SARS-CoV-2 RdRp复合物的作用机制进行了证实99(EIDD-2801’s)基于模板链介导的RNA诱变。[142].值得一提的是,第三阶段的结果是一项双盲、安慰剂对照试验99(molnupiravir)都很乐观,99(molnupiravir口服对治疗COVID-19证明有效。具体而言,该药物降低了未接种疫苗的成年人的住院或死亡风险(图2)。24) [143]
总的来说,临床评价的结果99 (molnupiravir)虽然不是很显著,但患者康复的改善证明了其作为有效预防SARS-CoV-2感染的潜力。FDA发布了EUA的使用99 (molnupiravir)治疗COVID-19(轻至中度)。值得一提的是,一种口服药丸99 (molnupiravir)可以制定,这是一个显著的优势瑞德西韦需要静脉给药(图。24) [144].
其他复制抑制剂
利巴韦林(101),一种基于核苷的广谱抗病毒药物表现出温和的抗sars - cov -2活性(EC50值= 109.5 μM)和CC50数值> 400 μM (Vero E6 cell) [126].因此,101(利巴韦林)是一种前药,可转化为单磷酸利巴韦林(细胞内),并进一步转化为二磷酸利巴韦林和三磷酸利巴韦林。机制研究表明,三磷酸利巴韦林抑制RdRP导致抑制RNA复制(图。24) [133,145].
nsp16,或2 ' - o - mmtase,催化mRNA的5 ' -末端帽结构(m7GpppN)进行甲基化,从而阻止宿主免疫反应的识别和激活。在这种情况下,它被认为是负责SARS-CoV复制的关键蛋白质。最近,Dolutegravir (102),发现2ʹ- o - mmtase抑制剂对RdRp和Mpro具有抑制活性(图。24) [146].
RNA结合N端结构域(N蛋白)在病毒RNA转录和复制中起着关键作用。最近,发现了两种对sars - cov - 2n蛋白N端结构域具有结合亲和力的化合物(茶碱和嘧啶衍生物)[147].最近对sars - cov - 2n蛋白的x射线晶体结构(分辨率2.7 A°)进行了解析,揭示了药物与sars - cov - 2n蛋白的核糖核苷酸结合域结合所需的特定表面电荷分布[148].
Drayman等人进行了一项抑制OC43复制的临床安全药物筛选计划。因此,OC43是一种与SARS-CoV-2密切相关的人类β冠状病毒。确定了有效化合物,并进一步检测了其抑制SARS-CoV-2的活性。结果,一种酪氨酸激酶抑制剂,103 (masitinib),对SARS-CoV-2主要蛋白酶3CLpro (IC50= 3.2 μ mol/L)24) [149].
另一项研究的结果也强调了66(苏拉明)抑制SARS-CoV-2复制,保护Vero E6细胞(EC50∼20μM)。此外,病毒日志也减少了2至3日志的治疗66(苏拉明).进一步的调查(添加时间和斑块减少测定)证实了这一点66通过作用于复制周期的早期步骤,防止病毒结合或进入。抑制感染进展也证明了治疗66(苏拉明)在原代人气道上皮细胞培养模型中进行的实验[150].
Liu等人对美国fda批准的药物库进行了虚拟筛选,所投入的努力导致了关于SARS-CoV-2复制抑制能力的关键揭示104(dipyridamole, DIP抗凝剂)在Vero E6细胞中浓度为100 nmol/L。本研究共涉及31例COVID-19患者,经DIP辅助治疗2周后,经DIP治疗的重症患者中有8例病情明显好转,7例临床治愈(图2)。24) [151].
靶向宿主蛋白的抑制剂
宿主靶向治疗方法目前被认为是一种非常有潜力的方法,可降低sars - cov -2感染的侵袭性和死亡率[127].
ACE2抑制剂
通过结合SARS-CoV-2病毒刺突蛋白S-RBD和ACE2启动分子事件,导致病毒基因组在细胞内释放。在这种情况下,设想加合物具有拮抗上述相互作用的能力可以产生治疗益处[152,153].
最近,功效105(替米沙坦)在一项多中心优势试验中,研究了降低住院covid - 19患者c反应蛋白(CRP)血浆水平的作用。研究结果表明,这种药物在高剂量下能够发挥抗炎作用。此外,治疗用105(替米沙坦)还降低了covid -19住院患者的病态死亡率[154].在一项研究中,的影响106(坎地沙坦)对covid - 19患者的标准护理方案进行了评估。结果发现,新冠肺炎患者的住院时间显著缩短至106(坎地沙坦)(无花果。25) [155].
在另一项临床试验中(多中心盲法随机)107(洛沙坦)对COVID-19门诊患者进行评估。令人失望的是,观察到氯沙坦不能减少住院。此外,氯沙坦治疗并没有降低病毒载量(图。25) [156].
文献先例表明这一点108(大黄素)一种蒽醌化合物和结构相似的化合物109(丙嗪),可干扰S蛋白(SARS-CoV)与ACE2的相互作用,对复制产生抑制作用。因此,由于SARS-CoV-2和SARS-CoV的S蛋白序列相似,上述两种药物目前都被认为是治疗covid -19的谨慎选择[157].同时,110(烟草胺),是ACE2的有效抑制剂[158]与类黄酮一起[159]也正在进行探索,以确定它们作为细胞进入抑制剂的潜力,可以通过靶向S蛋白或ACE2起作用(图2)。25).
最近,Sadre Momtaz等人开始了一项支架构建计划,并进行了分子动力学模拟,以确定ACE2二级结构元件上的相互作用热点。第四,生成了不连续多肽的简编,并在基于生物发光的实验中进行了评估。因此,这些肽可以显著拮抗SARS-CoV-2 S-RBD: ACE2相互作用,从而证明了它们在治疗COVID-19方面的详细研究范围(图2)。25) [160].
Valeinte等人研究了类似的系,设计了d肽抑制剂,以阻断SARS-CoV-2刺突蛋白S-RBD与ACE2之间的关联。令人高兴的是,两种抑制剂被鉴定为SARS-CoV-2 RBD的高亲和力结合剂,显示出阻断SARS-CoV-2感染Vero细胞的巨大潜力(IC50值= 5.76 ~ 6.56 μM)。值得注意的是,这两种抑制剂在中和两种变异(体外试验B.1.1.7和B.1.351)感染的情况下都是等效的[161].
TMPRSS2抑制剂和furin抑制剂
已有充分证据表明,SARS-CoV-2通过与ACE2结合进入宿主细胞。值得注意的是,位于SARS-CoV-2表面的S蛋白介导了这种相互作用。因此,TMPRSS2切割病毒S糖蛋白,从而促进病毒激活。在这种情况下,TMPRSS2似乎是一个有前途的治疗靶点[162,247].为了确定SARS-CoV-2用于进入的细胞因子,Hoffman等人进行了探索,并得出结论,SARS-CoV-2利用SARS-CoV受体ACE2进行进入,TMPRSS2用于S蛋白启动。的电势对上述方法进行了验证111(甲磺酸卡莫司他)一种TMPRSS2抑制剂,可显著减少SARS-CoV-2假病毒进入Calu-3细胞(IC50= 1 μ mol/L)。此外,TMPRSS2抑制剂还被发现可以减少Calu-3细胞中的真实SARSCoV-2感染和原代人肺细胞中的SARS-CoV-2假病毒感染(图2)。26) [162,247].
另一种TMPRSS2抑制剂,53(甲磺酸萘莫司他)显示出抑制sars - cov - 2s介导的进入宿主细胞的能力。值得一提的是53(甲磺酸萘莫司他)被发现具有更明显的效果(高出15倍)111(甲磺酸卡莫司他)作为sars - cov - 2s介导的进入抑制剂。此外,53(甲磺酸萘莫司他)也被发现优于111(甲磺酸卡莫司他)在阻断SARS-CoV-2感染的背景下[163].另一项研究结果证明了53 (nafamostat)在细胞融合检测系统中抑制sars - cov - 2s蛋白介导的融合。此外,在细胞类型依赖的方式(Calu-3细胞),药物53 (nafamostat)体外抑制SARS-CoV-2感染(IC50= 10 nmol/L)26) [164].
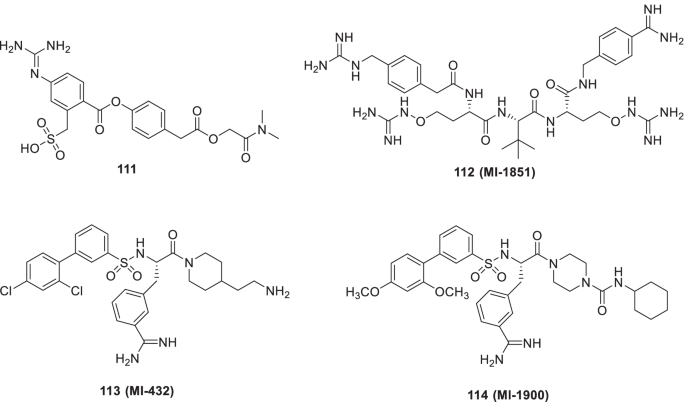
Bestle等(2022)研究表明,SARS-CoV-2表面糖蛋白突刺(S)上的两个不同位点必须被宿主细胞蛋白酶裂解才能进入细胞,并可作为治疗药物靶点。他们分别描述了原蛋白转化酶furin和TMPRSS2对S1/S2和S29位点S的裂解。此外,据报道,该病毒中的S蛋白被Calu-3 (HAE细胞)中的TMPRSS2通过反义机制介导的TMPRSS2表达下调而激活。合成呋喃抑制剂112(MI-1851)可抑制人气道细胞中的病毒复制。TMPRSS2抑制剂113(m1 - 432)114(MI-1900)(肽模拟药)激发了在CALU-3细胞中剂量依赖地防止SARS-CoV-2增殖和强CPE的潜力。值得注意的是,113(MI-432),在10 μ M时,只能对病毒复制产生轻微影响,然而,在50 μ M时,在24 h / i时,病毒滴度降低75倍,显示出放大效应。对SARS-CoV-2的强烈抑制和病毒滴度的显著降低(35-280倍)也被证明在处理细胞114(MI-1900)与对照细胞比较(图;26).令人高兴的是,结合112(呋喃抑制剂)TMPRSS2抑制剂对SARS-CoV-2表现出惊人的抗病毒活性[165]
Hu等人使用硅基数据库筛选(基于药效菌群的方法和对接研究)大约20万个分子作为TMPRSS2抑制剂,然后在SARS-CoV-2伪类型颗粒入口和TMPRSS2生化试验中测试了350个筛选的化合物。合成,115 (Otamixaban)(无花果。27)被确定为有效的TMPRSS2抑制剂(IC50= 0.62 μm)。同时,116(NCGC00386945)(一种选择性5-HT1D拮抗剂)也被发现对TMPRSS2 (IC50= 1.24 μm)。让人满足的是,116显示出作为病毒进入抑制剂的潜力,也显示出类似药物的特性。结构分析表明,苯甲胺头基是这些抑制剂抑制活性的重要结构特征。此外,NCGC00487181 (COX-2抑制剂)对TMPRSS2显示70%的疗效(IC50= 3.49 μM)。因此,这些分子可以作为设计TMPRSS2靶向药物用于治疗COVID-19的先导。27) [166].
Mahoney等人还证明,在SARS-CoV-2和其他冠状病毒中,刺突蛋白被TMPRSS2激活,导致病毒在肺部扩散。他们发现酮苯并噻唑作为底物特异性TMPRSS2抑制剂,使用基于结构的药物设计,具有优于TMPRSS2的活性和效力53(Nafamostat), 89 (remdesivir)和111 (camostat).在所有,117 (MM3122)阻断VSV- SARS-CoV-2嵌合病毒进入Calu-3人肺上皮细胞(IC50= 340 pM, EC50430 pM),同时抑制CPE (EC50= 74 nM)。复合117显示了适当的药代动力学剖面(t1/2= 7.5 h和8.6 h)。因此,由于其在小鼠体内令人印象深刻的药代动力学特征、代谢稳定性和安全性,目前被认为是治疗COVID-19的潜在分子。令人高兴的是,这种分子与53 (nafamostat)而且89 (remdesivir)(高浓度时有毒)在Calu-3细胞中。除了117环肽VD2173也作为TMPRSS2抑制剂,并表现出显著的抗病毒活性和药代动力学特征(t1/2= > 8 h小鼠)(图;27) [167].
众所周知,TMPRSS2参与了该病毒进入宿主细胞的途径,病毒Mpro/3CLpro有助于其繁殖。Wang等人(2020年)试图利用上述发现,开始了一项确定双TMPRSS2-Mpro/3CLpro抑制剂的运动。为了实现这一目标,研究小组评估了常见水果中存在的植物成分,以治疗SARS-CoV-2感染。所选植物成分为山奈酚、儿茶素、原花青素、槲皮素、单宁酸和白藜芦醇。采用fret法检测其对SARS- CoV-2 Mpro的抑制活性。在所有分子中,118(单宁酸)被确定为TMPRSS2和SARS-CoV-2 Mpro的有效抑制剂。复合118(单宁酸)与M箴分子分析结果为TMPRSS2 (KD分别为1.1 μM和1.77 μM;集成电路50= 13.4 μM和2.31 μM)箴和TMPRSS2)。27).通过抑制病毒进入118(单宁酸)通过使用SARS-CoV2-S伪病毒颗粒的功能测定得到证实。根据上述结果,118(单宁酸)这似乎是开发COVID-19新疗法的有力先导,作为SARS-CoV-2感染传播所需的两种独立酶的有效、安全、有效的双重抑制剂(图2)。27) [168].
Cheng等人描述了呋喃底物位点切割在CPE病毒刺突蛋白及其产生中的作用,因为该位点介导合胞体的形成。呋喃抑制剂119(萘荧光素)(0-20µM)而且癸醇- rvkr -氯甲基酮(CMK, 5µM)通过阻止合胞体的形成,阻止了SARS-CoV-2的进入及其复制111 (camostat, TMPRSS2抑制剂)通过这个机制没有效果。这两种药物都降低了CPE和病毒的产生CMK(CC50 =318.2 μ m, IC50= 0.057 μ M, SI = 5567)阻断病毒的进入,抑制合胞体和刺突的裂解。此外,119(naphthofluorescein) (CC50 =57.44 μ m, IC50= 9.025µM, SI = 6.36)抑制病毒RNA的转录。为111 (camostat),CC50CCK-8法测定> 2000 μ M, IC50= 0.025 μ M, SI > 81,004。因此,furin抑制剂可以被认为是这种感染的潜在抗病毒药物(图。27) [169].
组织蛋白酶B/L抑制剂
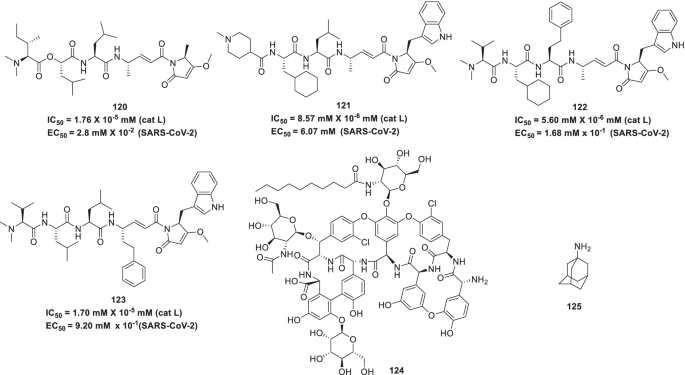
鉴于组织蛋白酶L作为COVID-19药物靶点的候选性,Ashhurst等人对海洋天然产物鸡酰胺a及其合成类似物进行了详尽的探索。因此,一些有效的组织蛋白酶L抑制剂(120 - 123)被鉴定为显著抑制SARS-CoV-2感染。值得注意的是,在TMPRSS2过表达细胞中观察到抗病毒活性降低。因此,本研究中产生的抑制剂鸡尾酒与TMPRSS2进行了评估,并获得了抗病毒活性的协同改善(图2)。28) [170].
Zhang等人评估了组织蛋白酶L在病毒进入宿主细胞中的功能。作为124 (teicoplanin)结合组织蛋白酶L,探索组织蛋白酶L在2019-nCOV S蛋白上的切割位点的存在,主张组织蛋白酶L参与了COVID-2019的进入和融合。作者评估的效力124 (teicoplanin,集成电路50= 1.66 μM)对新型冠状病毒感染的抑制作用,并观察到新型冠状病毒spike -伪病毒融合和进入细胞的潜在抑制作用。尽管体外和体内研究仍在进行中,但结果表明124 (teicoplanin)作为COVID-19感染的抗病毒药物(图;28) [171].
Sacco等人研究并阐明了Mpro配合物与三种类似物的晶体结构14 (GC-376), 38(钙蛋白酶抑制剂II),39 (calpain inhibitor XII)并观察到这些抑制剂的一些疏水相互作用(P1位点)。这些抑制剂被鉴定为对Mpro和人组织蛋白酶L的双重抑制,证实了S1口袋中存在疏水蛋氨酸侧链。同时,39 (calpain inhibitor XII)抑制组织蛋白酶L (IC50= 1.62±0.33 nM),并激活SARS-CoV-2刺突蛋白,阻断病毒的进入。因此,上述发现确定了为宿主组织蛋白酶L和SARS-CoV-2 M提供双重抑制剂的策略的潜力箴研制有效的抗病毒药物,防止病毒复制[172].
Smieszek等人(2020)描述了蛋白酶[组织蛋白酶L (CTSL)和组织蛋白酶B (CTSB)]在SARS-Cov-2通过病毒刺突(S)蛋白进入细胞中的作用。破坏CTSL/B被认为是一种谨慎的策略,其破坏机制包括降低CTSL表达、抑制CTSL和增加影响CTSL环境的溶酶体的pH。由于他们在这方面的努力,作者确定125(金刚烷胺)(10µM)作为组织蛋白酶表达的下调因子。此外,有人指出125高通量药物筛选基因表达分析结果证实溶酶体途径被破坏。同时,125由于其溶酶促体作用,被发现抑制病毒复制。总的来说,125似乎是一个有价值的候选人,能够降低SARS-CoV-2患者的病毒载量(图2)。28) [173].
DHODH抑制剂
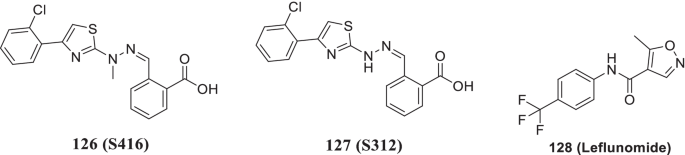
Xiong等人研究了DHODH酶的抑制作用,DHODH酶负责催化从头合成嘧啶的限速步骤,即二氢磷酸脱氢生成乳清酸,最终生成胞嘧啶和尿苷,供细胞内核苷酸供应,从而实现病毒复制。研究小组发现了两种有效的人类DHODH抑制剂,126 (S416)而且127 (S312),与布雷奎纳和特立氟米特相比,具有对SARS-CoV-2的疗效以及所需的药代动力学特征和药物相似性。这些抑制剂也被发现对埃博拉病毒、甲型流感病毒和寨卡病毒有效。值得注意的是,化合物126 (S416)被描述为最有效的抑制剂(EC50= 17 nmol/L, SI = 10,505.88)。此外,127 (S312)据报道,在感染动物体内具有高效低毒作用,可防止严重流感感染体内炎症细胞因子风暴。因此,这些抑制剂通过侵入嘧啶合成途径抑制了病毒的复制。总的来说,这些结果证实了DHODH是设计抗SARS-CoV-2感染的有效抗病毒分子的一个有吸引力的靶点(图2)。29) [174].
Hu等人评估了128 (Leflunomide)在10名COVID-19患者中,以控制免疫系统诱导的炎症,因为它是一种被批准的DHODH抑制剂,用于自身免疫性疾病的免疫调节。该研究中选择的患者有肺混浊,病情经实验室检查确认。Leflunomide (128)一半的患者接受了治疗,其余的患者没有给予任何药物(空白对照)。所有入选研究的COVID-19患者都接受了标准的支持性治疗。结果发现,在治疗后,病毒脱落时间缩短128 (Leflunomide)(中位数= 5天)与对照组(中位数= 11天,P = 0.046)相比。由于c反应蛋白水平大幅下降,治疗组免疫病理反应引起的炎症得到控制。治疗组比对照组早出院,无副作用报告。因此,使用这种药物被认为是一种潜在的对抗COVID-19的抗病毒药物(图。29) [175].
机制多样化的抑制剂和小分子的病毒进入抑制剂
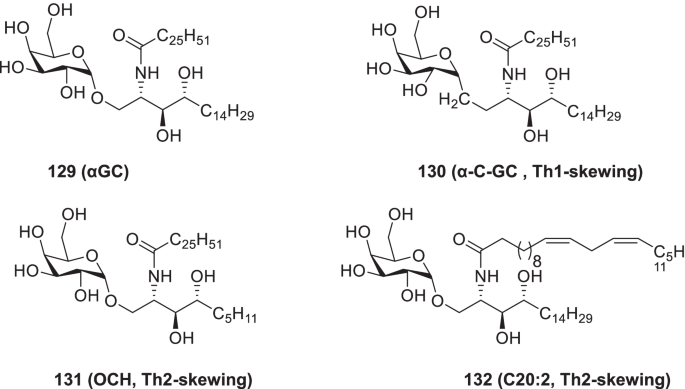
Th1和th2相关细胞因子的快速产生是由α-半乳糖神经酰胺(αGC,一种经典的iNKT细胞激动剂)引起的。目前,人们认为αGC的剂量节约效应和一次免疫后促进血清IgG快速上升的能力等特性在COVID-19中非常有用。根据这些启示,Wang等人提供了129而且130[Th1-biasing (α-C-GC)]131而且132[th2偏压(OCH和C20:2)]类似物,并通过不同剂量的RBD-Fc蛋白评估αGC在亚单位疫苗候选物中的佐剂活性进行了免疫学研究。令人高兴的是,观察到α gc佐剂RBD-Fc表现出显著的体液反应,并使抗原保留。此外,复合132 (th2偏压激动剂C20:2)中和抗体效价明显高于明矾。简而言之,基于α gc的糖脂类的使用可以在增强RBD-Fc蛋白的免疫原性以及减少抗原剂量方面带来决定性的好处(图2)。30.) [176].
文献表明,内质网(ER) α-葡萄糖苷酶(α- Glu) I和II是开发广谱抗病毒药物的有吸引力的靶点,因为包膜病毒对糖蛋白的正确折叠依赖于宿主细胞ER质量控制机制。为了利用上述发现,Karade等人完成了一系列拟糖缬氨酸衍生物作为ER α -葡萄糖苷酶I和II的有效抑制剂。生物学评价的结果是压倒性的积极,因为一些化合物被鉴定出对α-GluI和α-GluII表现出惊人的抑制潜力。还评估了加合物在人肺上皮细胞系(Calu-3)中减少SARS-CoV-2 England/2/2020复制的潜力。令人高兴的是,一些化合物被发现对SARS-CoV-2具有抑制活性。代表性结构(133 - 141年)如图所示。31[177].
Bojkova等人建立了SARS-CoV-2临床分离物感染的人细胞培养模型,并定期通过蛋白质组学和翻译酶3评估SARS-CoV-2感染情况。研究结果表明,小分子抑制剂靶向这些途径并抑制病毒复制,如142(吐根碱是40S核糖体蛋白S14的抑制剂),143(pladienolide B,SF3B1的剪接体抑制剂),101(利巴韦林,肌苷单磷酸脱氢酶抑制剂)144(2-脱氧葡萄糖己糖激酶抑制剂),145(环己酰亚胺,平移伸长抑制剂)(图;32).总的来说,我们研究了SARS-CoV-2感染宿主细胞的分子机制,以确定更好的治疗方案[178].
White等报道了临床前有效性146(Plitidepsin)通过真核翻译延伸因子1A对抗SARS-CoV-2(eEF1A)抑制IC90= 0.88 nM,其药效是普通的27.5倍89 (remdesivir),在细胞培养中毒性降低。他们观察到20 nM对核衣壳蛋白表达的抑制作用(146年,plitidepsin这些结果表明,该药物抑制了病毒的复制、N亚基因组RNA的表达(感染初期)和病毒的翻译。研究小组还确定了两种感染SARS-CoV-2的小鼠体内模型(IC)的药物效力90= 3.14 nM, SI = 40.4),并观察到病毒在肺部的复制下降。因此,这种药物可以成为COVID-19治疗的绝佳候选药物(图2)。33) [179].
Richardson等人提出在2019-nCoV中使用适配器相关激酶1 (AAK1)抑制剂,因为AAK1调节受体介导的病毒进入宿主细胞的内吞作用。肺AT2肺泡上皮细胞是受影响最严重的宿主细胞,这些细胞表面的受体是ACE 2。筛选378种AAK1抑制剂(在378种中,47种是批准的药物),观察到6种抑制AAK1具有高亲和力,如147(舒尼替)而且148(埃罗替尼).在这项研究中,149 (baricitinib)由于AAK1的破坏,病毒进入细胞及其颗粒在细胞内组装,可以减少肺部的病毒感染。复合149还表现出对细胞周期蛋白g相关激酶(胞吞调节因子)的结合亲和力,并被发现具有janus激酶抑制活性。由于AAK1抑制达到149 (baricitinib,剂量= 2/4 mg OD),建议在2019-nCoV急性呼吸道疾病患者中进行临床试验。值得注意的是,早期预警模型(MuLBSTA评分)被用于预测病毒性肺炎的死亡率(图。33) [180].
Cheng等人利用底物二硫化物和细胞表面的硫醇(外表面)之间交换硫醇-二硫化物的机制,开发出张力二硫化物作为巯醇介导摄取的抑制剂,用作抗病毒药物。荧光标记环低硫族化合物(COCs),150而且151被设计为细胞穿透报告剂,用于筛选硫醇介导的摄取抑制剂,因为COCs通过这种摄取进入细胞。筛选采用基于荧光显微镜图像的高含量HTS检测(全自动)。设计的抑制剂有苯并多磺酸(BPS)、附二硫代二酮哌嗪(ETP)、异芳烃砜、通过二硫化物、环二硫化物、硫代亚磺酸盐和硫代磺酸盐桥接的γ转化肽。生物学评估结果显示,用这些抑制剂治疗导致细胞中报告细胞摄取减少约15%。与Ellman试剂相比,确定的最佳抑制剂>(在纳摩尔浓度下)要好5000倍,这表明由于抑制剂的效率依赖于转运体类型,这一机制是一个具有多个靶点的复杂过程。终端设备thiosulfonate152表现出集成电路50= 50 μM,并在500 μM时对A549人肺泡基底上皮细胞系有毒性,初步研究使用的是伪慢载体,该载体编码荧光素酶报告基因,表达SARS-CoV-2刺突蛋白D614G突变体。化合物150而且151(COCs)因其共价交换的可逆性被认为是最佳的抑制剂。由此得出结论,巯基活性抗病毒药物可能通过巯基介导的摄取抑制作用早期胸腺祖细胞(mic = 20µm),31日(ebselen)而且152.根据这些乐观的发现,开发有效的通过巯基介导的摄取抑制作用的抗病毒药物似乎是一个合理的策略(图。34) [181].
Silvas等人(2020)研究了脂质代谢和膜动力学的小分子抑制剂,如PI3激酶(VPS34抑制剂),在胞吞、自噬和其他过程中发挥作用,可阻止SARS-CoV-2的复制和产生。研究中评估的药物为153(奥利司他)而且154(曲霉素C).本研究证实了VPS34抑制剂作为SARS-CoV-2/-CoV和MERS CoV的自噬和复制抑制剂的作用。评估结果显示,VPS34抑制剂153(奥利司他)而且154(曲霉素C)在病毒进入Vero E6和Calu-3细胞后抑制病毒的生长。VPS34抑制剂(153而且154)也破坏了这种病毒的复制中心和用于病毒细胞器形成的膜的可用性。因此,作者提出脂代谢是治疗这种感染的重要靶点,并提出了详细的研究,以阐明病毒复制机制,包括通过VPS34抑制,以确定SARS-CoV-2在calu-3细胞中生长时脂肪酸代谢的治疗靶点,以及这些抑制剂在不同细胞类型中的相对有效性(图3)。34) [182].
Halfon等为了研制有效的抗病毒药物,研究并重点研究了SARS-CoV-2抑制自噬的机制,从而抑制病毒复制。在这项研究中,155 (GNS561),研究发现了一种小的碱性亲脂性自噬晚期抑制剂,可诱导溶酶体失调。有人观察到155 (GNS561)对两株SARS-CoV-2菌株(IHU-MI3 -MI6, EC)感染均有较好的抗病毒效果50= 0.006, cc50= 2.0 μM和;USA-WA1/2020;电子商务50= 0.03 μm, cc50= 6.7 μM)89(瑞德西韦,电子商务50= 0.10 μM和1.2 μM, CC50= 73.2 μM和> 100 μM)。使用电子显微镜,电位155 (GN561)通过定位lamp2阳性溶酶体和扩大LC3-II斑点大小(轻链3-磷脂酰乙醇胺共轭),western blot法观察到SARS-CoV-2的自噬抑制作用。他们还研究了不同药物组合的增效作用,并发现组合155 (GNS561)而且89 (remdesivir)显示对该病毒的强协同作用(体外研究)).因此,自噬抑制被确定为治疗SARS-CoV-2感染的替代途径(图2)。35) [183].
根据多项研究发现,SARS-CoV-2 S蛋白参与受体识别、病毒附着和进入宿主细胞,已被确定为COVID-19药物设计的重要靶点[184].因此,在这个方向上开始了一些探索,并导致了一些有前途的抑制剂的鉴定。最近,156(丹酚酸)被发现是s -过表达hek293t和Vero-E6细胞膜融合的有效抑制剂。重要的是,156(丹酚酸)显示出对SARS-CoV-2的显著抑制作用50值为3.41 μM [185].抗流感药物157 (arbidol),可有效阻断或阻碍SARS-CoV-2刺突糖蛋白(IC50= 4.11 μ m)。157 (arbidol)也在临床水平上评估了作为单一药物和与洛匹那韦/利托那韦联合使用[186].临床试验结果表明,暴露后预防(PEP)的使用157 (arbidol)[187可以减少暴露于COVID-19确诊病例的个体的感染,然而,单药治疗157 (arbidol)无法为COVID-19患者(住院)带来重大利益[188,248].另一项研究设计了能够抑制SARS-CoV-2和SARS-CoV的hACE2-S蛋白相互作用的支架,结果令人乐观。通过研究确定了几种抑制剂,可以抑制上述与IC的相互作用50值在0.2 ~ 3.0 μM范围内。值得注意的是,其中一名代理人(158)表现出明显的SARS-CoV-2-S假病毒抑制活性505.6 mmol/L [189].为了扩大用于治疗COVID - 19的小分子抑制剂的武器库,Chen等人使用SARS-S和MERS-S伪粒子进入分析对已批准的药物进行了高温检测。因此,六种广谱尖刺介导的进入抑制剂(159 - cepharanthine,160 - abemaciclib,161 - osimertinib,162 -三甲丙咪嗪,163 - colforsin,164 - ingenol)被确定。与EC结合的抑制剂可显著降低Vero E6细胞受SARS-CoV-2感染后的CPE50分别为1.41,3.16,3.98,20.52,23.06和0.06 μ M。(无花果。35) [190].
Yuan等报道了165(氯法齐明),一种抗麻风药物和FDA批准的抗结核药物,用于治疗SARS-CoV-2引发的感染(EC50= 0.31 μM,剂量= 200 mg d−1)和中东呼吸综合征冠状病毒(EC50= 1.48±0.17 μM)。该药物在肺模型(离体)和人原代细胞的病毒载量降低实验中显示了拮抗作用。研究还发现,该药可以分别降低肺部和粪便中的病毒载量和脱落。该药物还通过阻碍基于病毒的刺突糖蛋白(S)伪型病毒粒子介导的细胞融合来阻止SARS-CoV-2进入。此外,病毒绕过细胞进入抑制介导165(氯法齐明),据报道,病毒中的RNA水平大约降低了1-1.5 log10在处理过的细胞中。此外,165(氯法齐明)利用双链DNA/RNA底物抑制SARS-CoV-2解旋酶(nsp13)的解旋活性。据推测,该药也可能通过引起相关基因的上调,恢复转录过程,刺激先天免疫通路。在体内预防研究中,发现氯法齐明(剂量= 200 mg和C马克斯= 0.41毫克升−1),说明其具有保护作用。同时,病毒攻毒后给予氯法齐明后,感染前体重的实现周期缩短,病毒空斑形成单位减少约1-2 log10在肺组织中。此外,在治疗组的仓鼠中观察到SARS-CoV-2的基因组抑制。而且,两者之间有协同作用165(低剂量氯法齐明)而且89 (remdesivir)结果表明,该方法可有效提高病毒控制,减少体重下降、肺部病毒滴度和鼻内病毒脱落。我们还观察到,Bliss独立模型预测,由于对病毒复制的影响,需要减少药物剂量,说明上述两种药物具有协同抗病毒关系。其他发现表明,1.25 μM of165(氯法齐明)在体外试验中使用瑞德西韦可使90%的病毒复制抑制和完全无细胞毒性所需的瑞德西韦浓度降低约20倍。因此,这些结果建议在当前大流行和未来出现的COVID-19疾病中使用这种药物(图2)。35) [191].
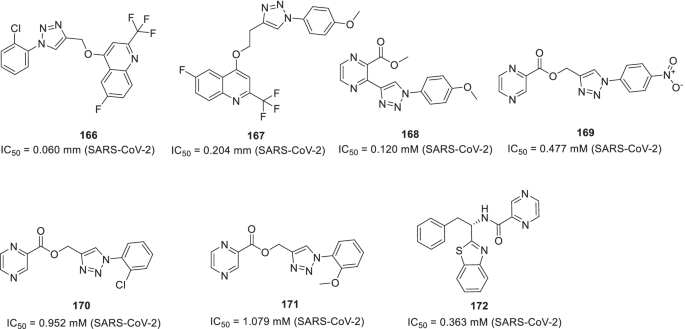
Seliem等人通过改进的微波辅助点击化学技术设计并合成了由喹诺酮环组成的1,2,3-三唑系结缀合物。生物学评估结果显示,两种缀合物(166而且167)是显著有效的SARS-CoV-2 [192].该研究小组继续努力利用click化学的应用,提供基于三唑的加合物作为抗SARS-CoV-2的有效抗病毒药物。受抗病毒特性的刺激95 (favipiravir),作者利用吡嗪片段设计杂化共轭物。令人高兴的是,这些努力导致一些吡嗪-三唑缀合物的鉴定(168 - 172)显示出对SARS-CoV-2的有效活性(图;36) [193].
Giovannoni等人探索了使用免疫抑制剂来减少伴有多发性硬化症(MS)的COVID-19患者的免疫反应,如fingolimod(一种S1P,多发性硬化症中的sphingosin -1-phosphate调节剂)来治疗COVID-19感染的ARDS。本研究中考虑的疾病修饰疗法(DMT)为干扰素-纳他珠单抗、特利氟米特、醋酸格拉替雷默、富马酸二甲酯或“淋巴衰竭”DMT。作者考虑了患有SARS-CoV-2感染的多发性硬化症患者的潜在发病风险和可能的死亡风险,并根据活动和疾病严重程度,建议暂时延迟(6和12个月)开始/重给药淋巴消耗性dmt,如利妥昔单抗、奥克雷珠单抗、克拉滨或阿仑妥珠单抗。此外,如果淋巴细胞计数(CD19 +和CD20 +)在下一次给药时大幅下降,建议将抗cd2o dmt的下一次给药时间推迟甚至超过6个月[194].
Chen等人调查了173(萨力多胺)关于COVID-19患者危及生命的器官功能障碍的免疫反应。该药联合小剂量短期糖皮质激素可抑制细胞因子激增,减少肺积液,缓解消化症状,调节免疫功能,恢复淋巴细胞计数,降低O2通过诱导镇静来治疗COVID-19患者。值得注意的是,即使使用高剂量,也未观察到不良反应。因此,沙利度胺的使用可能被认为是COVID-19危重患者的辅助治疗(图2)。37) [195].
药物再利用
Rodon等人研究了72种已批准的用于治疗sars - cov -2感染的药物在体外抑制CPE从而抑制病毒复制的能力。据观察,只有少数测试药物出现IC50< 25 μM的甲酯水合物63(奈非那韦),175(非诺贝特),147(普利替普素),干扰素-γ,干扰素2-α,氯喹衍生物,89(瑞德西韦)而且109 (camostat)。快乐的,147 (Plitidepsin)在纳摩尔浓度下,作为组织蛋白酶抑制剂,可以有效阻止病毒进入细胞。此外,胆固醇消耗剂,氯喹衍生物(IC50低于25 μM)阻断了假病毒进入表达ACE2HEK-293 T细胞)。还观察到组织蛋白酶抑制剂,174(MDL 28,170), npo-2142, npo-2143而且非营利组织- 2260被赋予阻断SARS-CoV-2中ACE2转染的HEK-293 T和Vero E6细胞内吞作用的潜力。研究小组还评估了药物组合,以确定在感染的不同步骤的协同作用或抗病毒作用,然而,没有观察到协同作用(图2)。37) [196].
Wang等人评估了176氯喹,177(penciclovir),101(利巴韦林),178(nitazoxanide),53 (nafamostat), 95 (favipiravir)而且89 (remdesivir),体外抗新型冠状病毒临床分离物(BetaCoV/Wuhan/WIV04/20192)。以DMSO为对照,通过CCK8试验评估这些药物对Vero E6细胞病毒产量、感染率和细胞毒性的影响。通过定量定量细胞上清液中的病毒拷贝数来确定疗效,并在感染后48小时用免疫荧光显微镜检测病毒核蛋白表达。7种药物中,有3种是高浓度的,包括95 (favipiravir)(EC50= 61.88 μm, cc50> 400 μm, si > 6.46),101(利巴韦林,电子商务50= 109.50 μm, cc50> 400 μM, SI > 3.65)177 (penciclovir)(EC50= 95.96 μm, cc50> 400 μM, SI > 4.17)可降低病毒感染。此外,53 (Nafamostat)而且178 (Nitazoxanide)被发现具有对病毒的抑制潜能50= 22.50 μm, cc50> 100 μM, SI > 4.44和EC50= 2.12 μm;CC50> 35.53 μm;在Vero E6细胞中,SI >分别为16.76。此外,氯喹(EC50= 1.13 μm;CC50> 100 μm, si > 88.50, ec90 =6.90 μM)在Vero E6细胞中对病毒有明显的抑制作用89(瑞德西韦,电子商务50= 0.77 μm;CC50> 100 μm;Si > 129.87, ec90 =1.76 μM)对Vero E6和Huh-7细胞均有抑制作用。因为这些药物被发现在体外治疗2019-nCoV感染方面是安全的和有潜力的,建议进一步评价(图;37) [197].
Gao等人基于中国的多中心临床试验,支持使用磷酸氯喹(抗疟药),因为它对COVID-19相关的肺炎有可接受的疗效。该药被推荐用于COVID-19患者肺炎的治疗、诊断和预防[198].Hoffmann等人报道,SARS-CoV-2感染的Vero细胞由于TMPRSS2的工程表达而变得对氯喹不敏感,并且该药物在表达TMPRSS2的人肺细胞系Calu-3中不能抑制这种感染。总的来说,我们推断氯喹靶向的病毒激活途径在肺细胞中不活跃(图2)。37) [199].
Maisonnasse等人研究了179(羟氯喹)在体外和感染sars - cov -2的猕猴体内。令人鼓舞的是,抗病毒的效力179在Vero E6(非洲绿猴肾细胞)中观察到,但在人气道上皮模型中发现该药物无效。评估开始剂量为90 mg kg−1,继续服用45 mg kg−1(每日维持剂量)在一组未感染的NHPs(非人灵长类动物)中产生临床血浆药物浓度。随后,他们还检查了低剂量方案(初始剂量= 30 mg kg−1,维持剂量= 15 mg kg−1).的影响179(羟氯喹)单独或联合阿奇霉素使用不同的方案与安慰剂比较,以检查其对病毒载量的影响。这两种药物都没有显示出任何显著的影响病毒载量分析组织,无论是单独或与高剂量方案179(羟氯喹)而且阿奇霉素(装载剂量= 36 mg kg−1,日剂量= 18 mg kg−1).179(羟氯喹)没有发现对SARS-CoV-2感染的预防和保护性治疗有用。因此,使用179(羟氯喹)不建议单药治疗或与AZTH联合治疗人类COVID-19感染(图2)。37) [200].
世界卫生组织的一组专家建议对4种抗病毒药物(重新用途)进行联合试验,即180(洛匹那韦)、89(瑞德西韦)、干扰素β -1a和179(羟氯喹)在COVID-19住院患者中。为了检查住院死亡率,所有治疗组的住院患者被随机分配,与对照组进行比较。在计算死亡率时,考虑了年龄和机械通气的状况。11,330名成年人在30个国家的405家医院接受随机分组;1411年到180(lopinavir)(不使用干扰素),2750人被分配接受治疗89 (remdesivir),954年到179(羟氯喹), 2063为干扰素,4088为无试验药物。上述药物均未发现能有效降低死亡率,也不能减少辅助通气或住院时间(图。37) [201].
最近,Riva等人开始了一项大规模化合物再利用计划(筛选12,000个小分子文库),并确定了许多可能抑制SARS-CoV-2病毒复制的化合物,其中21种药物表现出剂量-反应关系。研究人员还评估了这些化合物对支持SARS-CoV-2复制的人类细胞系(而不是vero细胞)的有效性。结果,观察到13个化合物表现出EC50在至少一个细胞系中< 500 nM,表明它们可以通过治疗性给药抑制病毒复制。具体地说,174 (mdl-28170), (181) z LVG chn2, 182 (vby-825), 183 (ono 5334)而且184, (apilimod,激酶抑制剂)在患者体内达到治疗浓度。研究小组评估了这些药物在不同研究时间对病毒进入的抑制作用,以及使用基于假型水泡性口炎病毒样颗粒、VSV G蛋白或MERS S蛋白对sars - cov -2刺突(S)蛋白的感染性的效率。这些分子通过阻断病毒的进入来阻止病毒的复制。所选蛋白酶抑制剂对该病毒3C-like蛋白酶和PLpro的抑制活性被剥夺,提示其抑制宿主蛋白酶是其抗病毒活性的机制。此外,病毒的融合活性依赖于病毒S蛋白通过核内体的蛋白水解过程,这需要人半胱氨酸组织蛋白酶,这些组织蛋白酶被用作抑制的靶点174 (MDL 28,170,组织蛋白酶B抑制剂),183 (ONO 5334,组织蛋白酶K抑制剂)而且182 (VBY-825,可逆组织蛋白酶抑制剂)。此外,病毒复制(原代人肺外植体模型)也被发现被抑制184 (apilimod), 183 (ONO 5334)而且174 (mdl - 28170),在诱导多能干细胞衍生的人类肺细胞样细胞中。研究结果非常乐观,这些药物的加速分析似乎是治疗COVID-19的合理选择,因为这些药物已经进入公共领域,其安全性也得到了很好的确立(图2)。38) [202].
Puhl等人测试了三种药物,185(吡咯啶,抗疟疾),186(替洛酮,抗sars - cov -2)而且187(阿那卡因,抗原虫)单核细胞Vero76、VeroE6、Calu-3、Caco-2、HUH-7和A549-ACE2与SARS-CoV-2、HCoV 229E和MHV体外感染。在A549-ACE2细胞中,病毒的复制被抑制185(吡咯啶,IC50值= 198 nM,分别)而且186(替洛酮,IC50值= 180 nM)。采用微量热泳仪和Kd值分别为647 nM和339 nM185 (pyronaridine)而且186 (tilorone),分别。研究小组还进行了实验,以阐明这些化合物的溶酶促生长机制。令人惊讶的是,187(奎纳克林)在Vero76、Calu-3和Vero E6中没有显示出体外活性,但在MHV (IC50= 2.3 μM), Caco-2 (EC90= 10.54 μM)和A549-ACE2 (IC50= 122 nM)(图;38) [203].
Gorshkov等人评估了7种溶酶促生长化合物,发现其中6种化合物即188(氯丙咪嗪)、189 (ROC-325)、177(氯喹)、179(羟氯喹)、190(甲氟喹)而且191 (hycanthone)抑制Vero E6细胞CPE (EC50= 2.0 ~ 13 μM, SI = 1.5 ~ >的十倍)89 (remdesivir)(EC50= 7.04 μM),无明显细胞毒性。在EpiAirway 3D组织模型中,用189年(民国- 325)导致病毒滴度降低,同时由于溶酶体pH值升高,病毒进入被阻断,自噬。此外,在新冠病毒感染的Vero E6细胞中,溶酶体的功能也被这些药物阻断,这表明溶酶体在新冠病毒生命周期中发挥了作用。此外,通过siRNA敲低ATP6V0D1可以阻断LLC-MK2细胞中HCoV-NL63的CPE。同样,被感染的细胞裂解液通过内质体对溶酶体的成熟阻断对病毒的复制表现出抑制作用,这是SARS-Cov-2内吞作用的重要步骤。总的来说,该研究结果证实溶酶体是SARS-CoV-2感染的重要靶点(图2)。39) [204].
Weston等人(2020)评估了几种FDA批准的药物对SARS-CoV和MERS-CoV的体外疗效,如192(三巴拉诺)、193(二水盐酸阿莫地喹)、194(盐酸氯丙嗪)、195(盐酸阿莫地喹)、196(甲磺酸苯托品)、197 (Anisomycin)、198(磷酸氯喹)、199(柠檬酸托雷米芬)、200(水合盐酸依美丁)、201(盐酸氯米帕明)、202(硫酸羟氯喹)、203(盐酸氟非那嗪)、204(氟吡啉)、205(盐酸异丙嗪)、206(盐酸吉西他滨)、207(甲磺酸伊马替尼),208(特康唑),190(盐酸甲氟喹),209(马来酸硫丙拉嗪)而且210(柠檬酸他莫昔芬)预防SARS-CoV-2感染.结果,据报道有17例抑制SARS-CoV-2 (IC50< 10µM), 17个中有7个抑制感染性sars - cov -2的产生。此外,194(氯丙嗪)而且177(氯喹)在体外实验中发现,抑制SARS-CoV与细胞膜的spike介导的融合,在不影响SARS-CoV (MA15)在小鼠肺中的复制的情况下保护疾病,但在体外实验中抑制了冠状病毒的复制。病毒进入宿主细胞的内吞过程需要网格蛋白,而网格蛋白也被发现被抑制194(氯丙嗪).使用TCID50试验,评估了所有这些药物在非细胞毒性水平上对病毒颗粒产生的抑制作用。研究发现,7种药物(氯喹、羟氯喹、伊马替尼、盐酸阿莫地喹脱水、氯丙嗪、甲氟喹或盐酸阿莫地喹)能够减少SARS-CoV-2在A549细胞中的复制,减少RNA、RdRp的产生,从而减少病毒的体外繁殖(图5)。40) [205].
Touret等人利用Vero E6和caco-2细胞系感染SARS-CoV-2菌株BavPat1,在基于细胞的试验中研究了PRESTWICK化学文库中1520种已批准的药物,并在感染后3天测量细胞活力。他们发现10 μM的157 (arbidol)抑制SARS-CoV-2感染,导致70-90%的细胞活力,使用EC50为10.7 μM,作为计算抑菌指数的板比基准。在10 μM浓度下,他们测定了细胞活力,并计算了1520种药物的抑制效力157 (arbidol).hits(90个分子)表现出与参考文献相同或更高的抑制作用,并根据结构相似性和/或抑制指数大于1的治疗类别被分为12组。以EC为筛选标准,从不同组中筛选出15个分子50和CC50基于Real-Time RT-PCR对病毒基因组进行定量分析,在10 μM范围内进行了定量分析。具体地说,211(奥美拉唑)、212(阿奇霉素)、213(盐酸克莱米唑)、214(螺旋霉素)、179(羟基氯喹)、215(盐酸Oxprenolol)、216(前列地尔)、217(磺胺多辛)、218(多鲁特格拉韦)、219(盐酸奎尼丁)、220(盐酸奥匹拉莫)、221(依西美坦)、222(沃诺普拉桑)、223(斯派龙)、89(瑞德西韦)、157(阿比多尔)而且224(盐酸替克罗宁)对SARS-CoV-2体外复制具有抑制活性。因此,本研究假设筛选药物的抗病毒效力有待进一步研究(图2)。41) [206].
Son等人评估了200种化合物对SARS-CoV病毒复制的抑制潜力(Vero E6细胞)。该研究采用了基于成像的方法,并确定178 (nitazoxanide,电子商务50= 4.90 μM))和225 (JIB-04,电子商务50= 0.69 μM),在SI为> 150的Vero E6细胞中可有效抑制病毒复制,在300 μM时无细胞毒性。这两种药物都降低了细胞内病毒的RNA水平,并在体外对一些RNA和DNA病毒(如猪传染性胃肠炎病毒)具有活性。值得注意的是,S病毒蛋白的产生受到抑制225 (JIB-04)通过抑制S mRNA转录同时,225(JIB-04, 0.1-3 μM)与178 (nitazoxanide)而且177(氯喹,1-10 μM)在MA104细胞中。快乐的,225(JIB-04)也减少了在体猪模型中的病毒感染(图。42) [207].
Caly等人演示了fda批准的抗寄生虫药物的使用,226(伊维菌素,5µM)在SARS-CoV-2感染的Vero-hSLAM细胞感染2小时后。有趣的是,该药物在体外48小时后被发现减少了约5000倍的病毒RNA (III期临床试验)。他们提出,通过IMPα/β1在细胞质中抑制病毒负载蛋白的核输入,并通过核孔复合体进入细胞核,复合体在核孔复合体中分解,宿主细胞的抗病毒反应被病毒负载降低,导致感染增强。值得注意的是,226(伊维菌素)使Impα/β1异源二聚体结合不稳定,阻止病毒蛋白附着,因此,进入细胞核导致抗病毒反应抑制降低和更显著的抗病毒效果(集成电路50= 2 μm).总的来说,226(伊维菌素)为治疗COVID-19提供了足够的希望(图。42) [208].
Zhou等人采用一种重新利用的方法,利用基于hcov宿主相互作用组和人类蛋白质-蛋白质相互作用网络中的药物靶点的药理学网络医学平台筛选抗病毒药物。系统发育分析显示,新型冠状病毒/SARS-CoV-2与SARS-CoV 15个HCoV全基因组核苷酸序列相似性为79.7%。2019-nCoV/SARS-CoV-2和SARS-CoV的包膜蛋白和核衣壳蛋白两个进化保守区序列相似性分别为96%和89.6%。他们通过对药物靶点和人类相互作用组中hcov -宿主相互作用的网络接近分析(如西罗莫司、褪黑素和巯基嘌呤)重新利用,发现了16种强效药物。通过HCoV诱导的药物基因标记富集分析和转录组学数据进一步验证了这些药物。因此,这项研究提出了有效的基于网络的方法来快速识别2019-nCoV的潜在药物(图2)。42) [209].
Huet等人于2020年3月18日进行了Ana-COVID研究。选择18岁及以上的新型冠状病毒肺炎患者,经实验室检查(肺部CT扫描)证实为严重双侧肺炎,典型肺浸润。复合227 (Anakinra),一种重组IL-1受体拮抗剂,在该机构进行标准治疗的同时,给予治疗组52例患者皮下注射(100mg BOD, 72小时,随后100mg OD, 7天)。在历史组中,患者只接受标准治疗和支持性护理。在治疗组中,25%的患者在ICU接受有创机械通气或死亡,与历史组的9%患者相比,该组有13%的患者被观察到肝转氨酶升高。总的来说,得出的结论是227 (Anakinra)由于对ICU有创机械通气的要求较低,降低了COVID-19危重患者的死亡率,可作为治疗COVID-19过度炎症的有效药物(图)。42) [210].
Brown et al.(2020)研究了212(阿奇霉素)而且179(羟氯喹)(off-label)在学术和非学术医院进行了一项针对犹他州300名COVID-19患者的积极比较、开放标签、实用的试验设计。对于中期监测,他们使用了混合贝叶斯-频率论设计来进行上下文评估和解释该试验的可能结果范围,他们在并行试验的背景下开发了一个推理网格。他们开始了一项务实的试验,在COVID-19的结构化环境中提供安全监测和知情同意的治疗方案(图2)。42) [211].
Kanjanasirirat等人使用基于荧光的工具检测Vero E6细胞中的核蛋白,同时使用斑块减少法筛选天然产物提取物及其植物成分作为SARS - CoV - 2的潜在抑制剂。作者选择了122种来自泰国的天然产品,发现其效力最大Boesenbergia圆形大厅提取和228 (panduratin A)对SARS - CoV - 2进行隔离。同时,Boesenbergia圆形大厅提取和228均能抑制病毒感染后的传染性(IC50= 3.62 μg/ mL, 0.81 μΜ;CC50= 28.06 μg/mL, CC50= 14.71 μM)。高兴地,228(Panduratin一)在病毒感染前后对Vero E6和人气道上皮细胞均有抑制作用。Panduratin A和b .圆形大厅萃取物显示IC50= 5.30 μM, 20.42 μg/mL;CC50分别为43.47 μM和> 100 μg/mL。同样的,229 (andrographolide)而且穿心莲香提取物也表现出抗病毒潜能(IC50= 6.58 μM, 68.06 μg/mL;CC50= 27.77 μM和> 100 μg/mL)。同样地,从生姜也有抗病毒作用(IC50= 29.19 μg/mL, > 100 μM, CC50= 52.75 μg/mL)。总的来说,228 (panduratin A)而且229 (Andrographolide)被发现是一种治疗COVID-19的有效植物成分(图。42) [212].
鉴于发现弹性蛋白酶是预防一种常见的COVID-19并发症(ARDS)的潜在靶点,Cui等人尝试了第一次全合成230 (Cyclotheonellazole A)是一种天然大环肽弹性蛋白酶抑制剂。为了进一步建立构效关系,作者提供了几个类似物230 (Cyclotheonellazole A).令人高兴的是,生物学评估的结果显示,治疗与230 (cyclotheonellazole A)减轻急性肺损伤,减少肺水肿和在体ALI小鼠模型的病理恶化。此外,230 (Cyclotheonellazole A)也证明了细胞安全性(图;42) [213].
Zhang等(2020)在Vero-E6细胞中开发了基于CPE的HTS试验,以开发针对病毒完整生命周期的SARS-CoV-2抑制剂。使用抗病毒药物(中和人抗体CB62、IFN-α、氯喹和瑞德西韦)作为阳性对照,在CPE降低后,使用CCK-8试验定量测定细胞活力。他们使用经过验证的测定方法,评估了1058种植物成分库,用于在细胞培养中鉴定有效的SARS-CoV-2抑制剂。经初步筛选,有30个位点对CPE具有> 50%的保护性。观察到所有植物成分(EC)对病毒的增殖有剂量依赖的抑制作用50= 0.011 ~ 11.03 μM)。并对化合物的CC进行了评价50值(细胞毒性)和16个化合物表现出选择性指标(SI = [CC .50] / [EC50) > 10,表明它们用于这种感染。所有这些结果都证明了基于cpe的HTS试验用于评估SARS-CoV-2抑制剂的可靠性和鲁棒性[214].
肽基进入抑制剂
钉肽
为了利用肽吻合器技术提高蛋白水解稳定性和膜渗透性,Verdine等人完成了一系列吻合器类似物,可以靶向SARS-CoV - 2刺突蛋白HR1,从而抑制病毒与其细胞受体的融合。随后的评估结果表明,多肽具有阻断SARS-CoV-2伪型病毒复制的能力。令人高兴的是,两种多肽导致真实病毒的减少,并剂量依赖地抑制刺突蛋白介导的细胞-细胞融合。正如预期的那样,与这些钉钉多肽相比,观察到更高的螺旋含量和增强的蛋白水解稳定性[215].
合成中和肽
最近,Wang等人通过石英晶体微量天平测量筛选多肽,以评估其抑制病毒进入宿主细胞的能力。为了实现这一目标,研究小组设计并提供了三个肽序列。令人高兴的是,这些肽对刺突蛋白S1亚基和SARSCoV- 2假病毒具有较高的亲和力。圆二色谱分析结果表明,多肽能使S1蛋白发生构象变化。总的来说,这些多肽对SARSCoV-2假病毒的感染表现出抑制作用,当三种多肽混合使用时,抑制作用被观察到更明显。值得注意的是,多肽对细胞毒性(A549细胞和293 T-ACE2 +细胞)没有产生作用,这主张在生物系统中安全使用多肽。[216]
EK1和EK-14C
EK1是一种肽基泛冠状病毒抑制剂,靶向hcov蛋白的HR1结构域。在抑制SARS-CoV感染的背景下,EK1已证明了有利的趋势。Xia等人进行了一项研究,以评估EK1的疗效,结果相当乐观,因为肽治疗(冠状病毒攻毒前和攻毒后)导致治疗小鼠免受HCoV-OC43或MERS-CoV感染。这些结果确定了EK01的预防作用和治疗潜力[217].此外,在Xia等人的另一项研究中,该肽对SARS-CoV-2 S蛋白介导的膜融合和PSV感染表现出剂量依赖疗效[218].鉴于这些压倒性的积极结果,同一组研究人员继续他们的调查,并提供了来自EK1的各种脂肽。结果发现EK14C对SARS-CoV-2 S蛋白介导的膜融合和假病毒感染具有显著的抑制潜力50= 1.3和15.8 nM)。值得注意的是,EK1C4对SARS-CoV-2 S蛋白介导的膜融合和假病毒感染的抑制能力比EK1高241倍和149倍。令人高兴的是,EK14C(鼻内应用)EK1C4出色地保护小鼠免受HCoV-OC43感染。上述发现表明EK-14C是一种有效的融合抑制剂,可与其他sars - cov一起用于预防和治疗SARS-COV2感染[219].
ipb02 -一种基于HR2序列的脂肽融合抑制剂
Zhu等报道了一种基于HR2序列的脂肽融合抑制剂IPB02,对SARS-CoV-2 S蛋白介导的细胞-细胞融合和假病毒转导具有显著的抑制作用。此外,IPB02对SARS-CoV伪病毒也有显著的抑制作用[220].
2019 - ncov hr2p
Xia等人利用2019-nCoV S介导的细胞-细胞融合实验报道了2019-nCoV- hr2p的融合抑制潜力。发现该肽与IC具有显著的融合抑制潜能500.18 μ M [218].
[SARSHRC-PEG4] 2-chol
Vries等人报道了一种脂肽融合抑制剂,可以阻断病毒突刺蛋白介导的病毒和宿主细胞膜之间的膜融合。令人高兴的是,通过对雪貂鼻内注射肽,观察到完全预防了SARS-CoV-2的直接接触传播[221]
SBP1
通过基于肽的药物破坏SARS-CoV-2-RBD与ACE2结合的策略目前被认为是抑制病毒进入人类细胞的潜在方法。在这些发现的激励下,Zhang等人合成了ACE2 PD α1螺旋(SBP1)的23 mer肽片段。结果表明,来自人ACE2的生物素化肽序列对中国生物科技有限公司昆虫源性SARS-CoV-2刺突蛋白RBD具有很强的选择性结合亲和力[222].
迷你蛋白质
为了利用上述防止病毒进入细胞的策略,这种策略是在SARS-CoV-2上的刺突(存在于SARS-CoV-2上)与宿主ACE2受体结合时启动的,Cao等人设计了小而稳定的蛋白质.可以紧密结合刺突,从而阻止其与ACE的结合。部分设计的小蛋白表现出较高的结合亲和力,可防止哺乳动物vero E6细胞被SARS-CoV-2感染(IC50= 24 pM至10 nM)。值得注意的是,迷你蛋白的体积小,稳定性高,可以直接输送到呼吸系统[223].
atn - 161
近日,Beddingfield等报道了整合素结合肽ATN-161治疗SARS-CoV-2感染的疗效。研究结果表明,ATN-161可以抑制SARS-CoV-2刺突蛋白与α5β1和α5β1/hACE2的结合,从而破坏SARS-CoV-2感染在体外.此外,在存在SARS-Cov-2的情况下,细胞活力增加,同时与病毒感染相关的CPE降低,这可以通过ATN-161的预防性治疗得到证明[224].
SARS-BLOCK™肽
Watson等人设计了COVID - 19的SARS-BLOCK™肽解毒剂,以提取疫苗和治疗的双重好处。具体地说,所设计的肽被提供作为SARS-CoV-2的解毒剂刺突蛋白介导的人ace2表达细胞感染。令人高兴的是,发现这些肽对ACE2和SARS-CoV-2 RBD具有大量的结合亲和力。总的来说,研究结果表明,SARS-BLOCK™肽可以显著减少感染,并可以成为预防病毒与ACE2和感染的有效治疗方式[225].
防御素样肽P9R
在Zhao等人进行的一项研究中,防御素样肽P9R显示出对pH依赖病毒(SARS-CoV-2, MERS-CoV和SARS-CoV)具有出色的抗病毒活性,从而抑制病毒-宿主内体酸化。此外,该肽对A (H1N1)pdm09病毒的致命挑战具有保护作用,并降低了引起耐药病毒的可能性。
对于P9R的体内评估,感染A (H1N1) pdm09病毒的小鼠在感染后6小时进行治疗,然后在第二天对感染小鼠进行两剂治疗。p9r治疗组的小鼠存活率明显高于pbs治疗组。此外,在感染后第2天和第6天,体重减轻的程度明显低于pbs治疗的小鼠。此外,还观察到P9R显著阻碍小鼠肺部病毒复制。此外,在一项抗病毒耐药性研究中,P9R阻止了耐药病毒的出现。
在斑块减少实验中,当P9R被引入SARS-CoV-2感染后的细胞时,它显著抑制了病毒的复制(IC50= 0.9µg/ml)。此外,P9R在针对MERS-CoV、A (H1N1) pdm09病毒、A (H7N9)病毒和鼻病毒进行测试时显示出有希望的结果。除了上述试验外,P9R还在多重生长试验中进行了分析,其中P9R对SARS-CoV、SARS-CoV-2和MERS-CoV等病毒的病毒复制抑制了100倍,而P9R对a (H1N1) pdm09病毒、a (H7N9)病毒和鼻病毒的>病毒复制抑制了20倍。从上述结果可以看出,P9R对新型冠状病毒SARS-CoV-2以及更多囊化和游离的呼吸道病毒有很强的抑制作用。
为检测耐药病毒的出现,将(H1N1) pdm09病毒连续转株40次到存在P9R的MDCK细胞,并以扎那米韦为对照。病毒传代10次后,扎那米韦不能抑制病毒复制,检测到病毒耐药性。值得注意的是,当病毒传代40次(10代P9R 5.0µg/ml,其余30代P9R 50µg/ml)时,P9R仍能有效抑制病毒复制。令人高兴的是,没有检测到P9R的病毒耐药性。
总的来说,这项研究的结果是压倒性的积极,特别是考虑到许多致病病毒都是内体ph依赖病毒。预计上述发现也可能促使其他研究人员开展类似的努力,以寻求生成可防止病毒-宿主内体酸化的抗病毒药物[226].
双功能交联肽8P9R
Zhao等近期发现的抗病毒肽8P9R在体内对SARS-CoV-2和SARS-CoV表现出显著的抑制活性,并抑制了仓鼠和小鼠SARS-CoV的复制。值得注意的是,该肽的抑制活性归因于其可能与病毒交联,从而通过tmprss2介导的途径阻断病毒进入细胞表面,抑制内体酸化。因此,8P9R是一种基于双功能交联肽的抑制剂(tmprss2介导的SARS-CoV-2表面和内吞途径)(附加文件)1).
值得注意的是,8支P9R即8P9R对IC表现出更强的抗病毒活性50比之前讨论的P9R (IC)低0.3µg/ml5020.2 μ g/ml)。通过TEM图像显示8P9R的交联能力,观察到交联的SARS-CoV-2形成一个大的病毒簇。这一结果在荧光标记的H1N1病毒中得到了进一步证实,此前研究的P9R和P9RS没有交联病毒以获得更大的病毒簇。共焦图像的观察也支持这一结果。此外,8P9R对病毒感染的内吞途径的抑制作用)被观察到类似于巴菲霉素A1。此外,8P9R显示出显著提高抗病毒活性的潜力157 (arbidol).
为了评估体内疗效,在感染SARS-CoV的10个月大的小鼠感染后8小时首次使用8P9R治疗。令人高兴的是,18天的体重跟踪和H&E染色显示,小鼠肺部没有观察到毒性。研究中使用的其他抗病毒药物是157 (arbidol,30毫克/公斤),177(氯喹, 40毫克/公斤)。生物学评价结果表明,上述药物及其合用均不能抑制SARS-CoV病毒的复制,而8P9R显著抑制了小鼠肺部SARS-CoV的复制。值得一提的是157 (arbidol)而且177(氯喹)在没有TMPRSS2的Vero-E6细胞中,这些药物能显著抑制SARS-CoV-2,而在Calu-3细胞中,这些药物不能抑制依赖TMPRSS2的SARS-CoV-2。相比之下,89PR对Ver-E6细胞和Calu-3细胞的SARS-COV-2均有显著抑制作用。简而言之,同时干扰冠状病毒的两条进入途径的方法似乎是一种可以产生决定性益处的谨慎策略[227].
结论与未来展望
新冠疫情在全球范围内引发了恐慌,这反过来刺激了制药行业和学术界并行开展疫苗、小分子、多肽和单克隆抗体的开发项目,以应对covid - 19。目前的情况非常清楚地表明,疫苗接种运动正在全速进行,所有国家的卫生机构正在不遗余力地为大多数民众接种疫苗。事实上,正在采取措施为已经接种疫苗的人群提供加强剂量。此外,还致力于开发改进的疫苗平台。因此,有许多疫苗属于不同的疫苗形式,如灭活病毒疫苗、蛋白质疫苗、重组腺病毒DNA疫苗和信使rna疫苗。由于在预防病毒传播方面已证明的安全性和有效性,信使RNA疫苗在疫苗平台优先考虑的背景下处于最前沿。除了疫苗接种策略外,使用口罩和保持社交距离是预防病毒传播的最有效策略。
不可否认,疫苗似乎是预防SARS-CoV-2感染的最佳方式,然而,用小分子补充抗covid - 19武器库,可以扩大治疗选择的范围,特别是对免疫功能障碍患者,目前被认为是最迫切的需求。令人惊讶的是,在疫苗开发和管理方面所投入的值得称赞的努力,以及试图提高人们对疫苗有益作用的认识,并没有阻碍小分子抑制剂的初步、临床前和临床药物发现工作的开始,这一事实在本综述所涵盖的文献中非常明显。令人鼓舞的是,最近批准用于治疗COVID-19的Molnupiravir和Paxlovid™给研究人员带来了持续的希望和承诺,他们将继续在这一研究方向上投入精力。这位药物化学家已经付出了额外的努力,生成了由化学和机制各异的抑制剂组成的大量抗covid -19支架文库。值得注意的是,在各种成熟的靶点中,这位药物化学家偏向地探索了3CLpro和PLpro作为靶点,并采用了许多强大的药物设计策略来提供3CLpro和PLpro抑制剂。值得一提的是,在小分子生成的背景下,这种快速的方法到目前为止是前所未有的。在大多数以蛋白酶抑制剂为中心的研究中,研究人员利用计算模拟方法提供合理设计的加合物。尽管在初步和临床前探索的背景下,化学家倾向于蛋白酶抑制剂,但也适当地关注了对S蛋白、RdRp、ACE2、TMPRSS2和组织蛋白酶具有抑制潜力的加合物的构建。除了新的药物设计策略外,药物再利用作为从现有药物中确定新的临床适应症的工具在COVID-19爆发期间被广泛使用。此外,基于肽的进入抑制剂得到了研究人员的合理关注,相当一部分属于肽类的药物在治疗COVID-19方面表现出了巨大的前景。 Peptide-based pan coronavirus inhibitor, Stapled peptides, Synthetic Neutralizing Peptides, HR2 sequence-based lipopeptide fusion inhibitor, an integrin-binding peptide, SARS-BLOCK™ peptides and defensin-like peptide excellently exemplifies some peptide-based viral entry inhibitors. As far as the therapeutic progress of monoclonal antibodies for the treatment of COVID-19 is concerned, they have outscored the small molecule inhibitors in the context of FDA approvals.
未来在治疗COVID-19的小分子药物发现领域的工作,将需要由化学家和生物学家组成的跨学科团队对本汇编中收录的大量支架进行详细调查。值得高度期待的是,本综述中涉及的一些有前景的抗covid - 19支架将在更高阶段的临床前和临床研究中复制其潜力。此外,本文所涵盖的研究结果,包括已建立的活性谱、药代动力学谱以及构效关系,可用于抗covid -19药物发现领域的许多重要研究。然而,为了让这艘船走得更远,需要朝着以下方向努力:(i)对新出现的SARS-CoV-2变体的抑制剂进行分析(ii)确定新小分子的治疗指数,以优化候选药物的安全性和有效性(iii)快速筛选抗covid - 19支架文库(iv)扩大治疗靶点列表,在新化学结构生成的背景下赋予药物化学家更广泛的范围(v)最大限度地使用机器学习预测模型来完成研究furnishment of anti-COVID19 adducts (vi) construction of antibody–drug conjugates utilizing the promising small molecules enlisted in this review as payloads. In a nutshell, it is highly anticipated that the comprehensive investigation of the armoury of small molecule anti-COVID19 scaffolds will culminate in a therapeutic in the near future.
数据和材料的可用性
不适用。
缩写
- RBD:
-
受体结合域
- 3 clpro:
-
3c样蛋白酶(3CLpro)
- PLpro:
-
Papain-like蛋白酶
- NSPs:
-
非结构性蛋白质
- RdRp:
-
RNA依赖的RNA聚合酶
- SARS-CoV-2:
-
严重急性呼吸综合征冠状病毒2
- DHODH:
-
Dihydroorotate脱氢酶
- 呃:
-
内质网
- eEF1A:
-
真核翻译延伸因子1A
- AAK1:
-
适配器相关激酶1
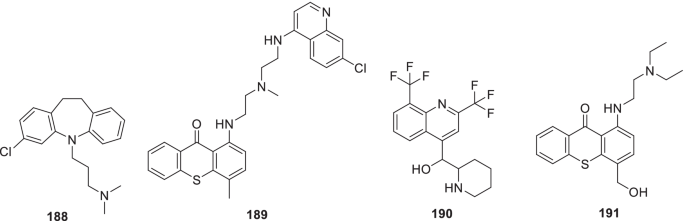
- DMT:
-
疾病缓解疗法
- ACE2:
-
血管紧张素转换酶2
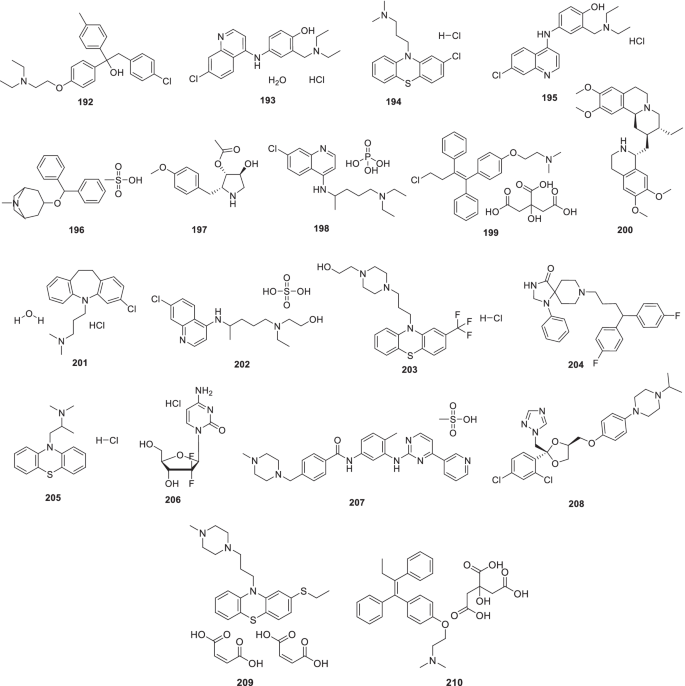
- TMPRSS2:
-
跨膜丝氨酸蛋白酶2
- 马伯:
-
单克隆抗体
- il - 6:
-
白细胞介素- 6
- 食品药品监督管理局:
-
食品药品监督管理局,中东呼吸综合征冠状病毒
- CPE:
-
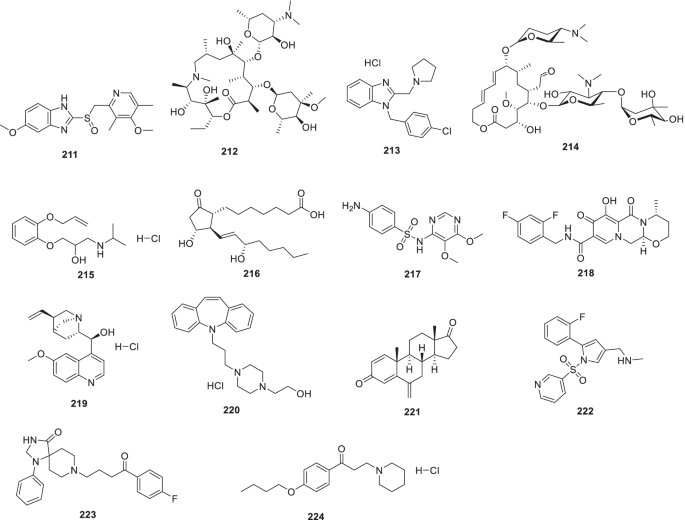
细胞病理效应
- 烦恼:
-
荧光共振能量转移,高温超导,高通量筛选
- x:
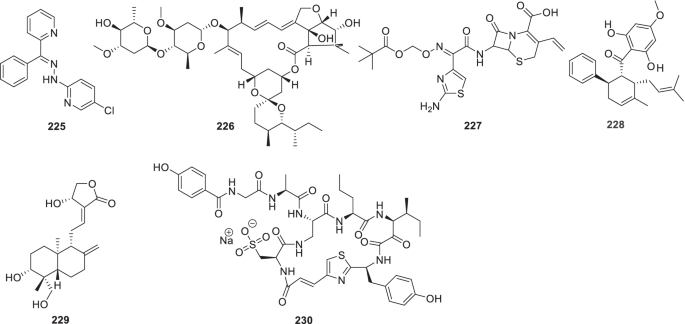
-
冠状病毒
- 有:
-
人气道上皮细胞
- ARDS:
-
急性肺损伤/急性呼吸窘迫综合征,EUA,紧急使用授权
- CTSL:
-
组织蛋白酶L
- CTSB:
-
组织蛋白酶B
- 聚合酶链反应:
-
聚合酶链反应
参考文献
黄超,王勇,李霞,任玲,赵娟,胡勇,等。武汉地区新型冠状病毒感染患者临床特征分析《中国柳叶刀》2020;395:497-506。
世界卫生组织。新型冠状病毒(2019-nCoV):情况报告,2020年11月。https://www.who.int/emergencies/diseases/novel-coronavirus-2019.2022年5月9日访问。
Mirtaleb MS, Mirtaleb AH, Nosrati H, Heshmatnia J, Falak R, Emameh RZ。COVID-19的潜在治疗药物:抗病毒治疗、免疫治疗和细胞治疗的最新综述Biomed Pharmacother. 2021;138: 111518。
陈建文,袁松,郭克华,杜家伟,朱华,杨杰,等。与2019年新型冠状病毒相关的家庭聚集性肺炎表明人传人:对家庭聚集性的研究。柳叶刀》。2019;2020(395):514 - 23所示。
Rothe C, Schunk M, Sothmann P, Bretzel G, Froeschl G, Wallrauch C,等。德国无症状接触者传播新型冠状病毒中华医学杂志。2020;382:970-1。
Phan LT, Nguyen TV, Luong QC, Nguyen TV, Nguyen HT, Le HQ,等。越南新型冠状病毒的输入和人际传播。英国医学杂志。2020;382:872-4。
陈楠,周敏,董霞,曲娟,龚峰,韩燕,等。武汉市99例2019年新型冠状病毒肺炎的流行病学和临床特征:描述性研究《柳叶刀》杂志。2020;395:507-13。
李强,关旭,吴鹏,王旭,周林,童勇,等。新型冠状病毒感染的肺炎在中国武汉的早期传播动态中华医学杂志,2020;
王伟,唐杰,魏峰。2019新型冠状病毒在中国武汉爆发的最新认识。中国医学病毒学杂志,2020;92(4):441-7。
又一个十年,又一种冠状病毒。大众医疗协会;2020; 382:760-2。
张晓东,张晓东,张晓东,张晓东。新型冠状病毒受体结合和小分子阻滞剂的研究进展。安revpharmacol Toxicol. 2021; 61:465-93。
兰娟,葛娟,于娟,单山,周华,樊松,等。SARS-CoV-2刺突受体结合域与ACE2受体结合的结构。大自然。2020;581:215-20。
Allen JG, Ibrahim AM。室内空气变化及其对SARS-CoV-2传播的潜在影响。《美国医学协会杂志》上。2021; 325:2112-3。
费金博士,希顿MM,阿布- raddad LJ, Andrews N, Araos R, Goldberg Y,等。针对SARS-CoV-2感染和COVID-19疾病的疫苗有效期:系统综述和元回归结果柳叶刀》。2022;399(10328):924 - 44。
Doherty P.治疗COVID-19的小分子药物在哪里?2021.http://www.doherty.edu.au/news-events.2022年5月9日访问。
Renn A,付勇,胡旭,Hall MD, Simeonov A.有效的中和抗体管道带来战胜SARS-Cov-2的希望。药物科学2020;41:815-29。
迟霞,闫睿,张娟,张刚,张勇,郝敏,等。一种中和人抗体与SARS-CoV-2的Spike蛋白的n端结构域结合。科学。2020;369:650-5。
Barnes CO, West AP Jr, Huey-Tubman KE, Hoffmann MA, Sharaf NG, Hoffman PR,等。结合SARS-CoV-2尖峰抗体的结构揭示了抗体的共同表位和复发特征。细胞。2020;182:828-42。
辛格DD,夏尔马A,李海杰,亚达夫DK。SARS-CoV-2:近期变异及抗体治疗的临床疗效。前端细胞感染微生物。2022;12:839170。
生物技术和医药工业研究所。Covid-19: FDA批准和批准的药物和非疫苗生物制品。2022.https://ibmi.taiwan-healthcare.org/en/bio_highlights_detail.php?REFDOCID=0ramw74aho8gigm4.2022年5月9日访问。
金丹,李建勇,杨建生,金继伟,张慧。SARS-CoV-2转录组结构的研究。细胞。2020;181:914-21。
孟晓明,张晓明,张晓明。新型SARS-CoV-2主要蛋白酶抑制剂的结构基础。前沿化学,2021;7:622898。
项荣,于震,王勇,王林,霍松,李勇,等。新型冠状病毒小分子抑制剂的研究进展。药物学学报(英文版);2007;
呋喃蛋白酶结合SARS-CoV-2刺突糖蛋白的结构及其对潜在靶点和毒性的影响。物理化学,2020;11:6655-63。
Torre-Fuentes L, Matías-Guiu J, Hernández-Lorenzo L, Montero-Escribano P, Pytel V, Porta-Etessam J,等。ACE2、TMPRSS2和Furin变体与西班牙马德里的SARS-CoV-2感染。中国医学病毒学杂志。2021;93:863-9。
Brimacombe KR,赵涛,Eastman RT,胡欣,王凯,Backus M,等。OpenData门户,实时共享COVID-19药物再利用数据。bioRxiv。2020.https://doi.org/10.1101/2020.06.04.135046.
王勇,张东,杜刚,杜瑞,赵杰,金勇,等。瑞德西韦治疗成年重症COVID-19:一项随机、双盲、安慰剂对照、多中心试验。《柳叶刀》杂志。2020;395:1569 - 78。
马可尼VC, Ramanan AV, de Bono S, Kartman CE, Krishnan V, Liao R,等。巴瑞替尼治疗住院成人COVID-19 (COV-BARRIER)的有效性和安全性:一项随机、双盲、平行组、安慰剂对照的3期试验《柳叶刀》呼吸医学2021;9:1407-18。
Kalil AC, Patterson TF, Mehta AK, Tomashek KM, Wolfe CR, Ghazaryan V,等。巴瑞替尼联合瑞德西韦用于住院成人Covid-19。中华医学杂志。2021;384:795-807。
辉瑞。在EPIC‐HR研究2/3期中期分析中,辉瑞新型COVID - 19口服抗病毒治疗候选药物将住院或死亡风险降低了89%。2021.https://www.pfizer.com/news/press-release/press-release-detail/pfizers-novel-covid-19-oral-antiviral-treatment-candidate.2022年5月9日访问。
麦克唐纳EG,李TC。Nirmatrelvir-ritonavir治疗COVID-19。Can Med Assoc J. 2022;194:218。
费晓东,王志强,王志强,等。Molnupiravir是一种口服抗病毒治疗COVID-19的药物。medRxiv。2021.https://doi.org/10.1101/2021.06.17.21258639.
Cox RM, Wolf JD, Plemper RK。治疗给药的核糖核苷类似物MK-4482/EIDD-2801可以阻断SARS-CoV-2在雪貂中的传播。Nat Microbiol. 2021; 6:11-8。
魏恩瑞,李志强,李志强,李志强,等。Covid-19门诊患者的REGEN-COV抗体组合及结果中华医学杂志。2021;35:8 8。
泰勒PC,亚当斯AC,赫福德MM,德拉托雷I,温斯洛普K,戈特利布RL。中和单克隆抗体治疗COVID-19。免疫杂志2021;21:382-93。
杜德根,陈平,陈平,等。bamlanivumab联合etesevimab治疗轻中度Covid-19。中华医学杂志,2005;
欧洲药品管理局。瑞德西韦的使用条件、分配条件、针对的患者和安全监测条件已向成员国提出,可用于医疗用途。2020.https://www.ema.europa.eu/en/documents/other/conditions-useconditions-distribution-patients-targeted-conditions-safety-monitoring-addressed_en-3.2022年5月9日访问。
古普塔A, Gonzalez-Rojas Y, Juarez E, Casal MC, Moya J, Falci DR,等。sotrovmaab对轻中度COVID-19高危患者住院或死亡的影响:一项随机临床试验《美国医学协会杂志》上。2022; 327:1236-46。
张志刚,刘志刚,刘志刚,张志刚,等。Tocilizumab用于Covid-19肺炎住院患者。英国医学杂志。2021;384:20-30。
Mushtaq MZ, Mahmood SB, Almas A, Wasti SA, Ali SA。Tocilizumab用于COVID-19危重患者。国际免疫药监学杂志。2022;102:108384。
阿斯利康。Evusheld (tixagevimab与cilgavimab联合包装)在英国被授权用于COVID-19暴露前预防(预防)。2022.https://www.astrazeneca.com/media-centre/press-releases/2022/evusheld-long-acting-antibody-combination-recommended-for-approval-in-the-eu-for-the-pre-exposure-prophylaxis-prevention-of-covid-19.html.2022年5月9日访问。
Chaqroun A, Hartard C, Schvoerer E.抗sars - cov -2疫苗和抗病毒变异的单克隆抗体。病毒。2021;13:1171。
高下E,木下N,山吉S,酒井田川Y,藤崎S,伊藤M,等。抗新冠病毒omicron变异抗体和抗病毒药物的疗效。英国医学杂志,2022;36:9 95 - 8。
Hoffman RL, Kania RS, Brothers MA, Davies JF, Ferre RA, Gajiwala KS,等。发现冠状病毒3CL蛋白酶的酮基共价抑制剂,可用于COVID-19的潜在治疗。中华医学化学杂志,2020;63:12725-47。
戴伟,张斌,蒋学明,苏辉,李娟,赵颖,等。针对SARS-CoV-2主要蛋白酶的抗病毒候选药物的结构设计。科学。2020;368:1331-5。
半胱氨酸蛋白酶及其抑制剂。化学修订版1997;97:133-72。
鲍尔斯JC,阿斯吉安JL,埃奇奇ÖD,詹姆斯KE。丝氨酸、半胱氨酸和苏氨酸蛋白酶的不可逆抑制剂。化学Rev. 2002; 102:4639-750。
Smith RA, Copp LJ, Coles PJ, Pauls HW, Robinson VJ, Spencer RW,等。半胱氨酸蛋白酶的新抑制剂。肽基酰基氧甲基酮和静止核逸剂策略。化学学报,1988;
张玲,林东,王娟,马强,年勇,等。α-酮酰胺类化合物作为冠状病毒和肠道病毒复制的广谱抑制剂:基于结构的设计、合成和活性评价。中华医学化学杂志2020;63:4562-78。
张磊,林丹,孙旭,Curth U, Drosten C, Sauerhering L,等。SARS-CoV-2主蛋白酶的晶体结构为改进α-酮酰胺抑制剂的设计提供了基础。科学。2020;368:409-12。
Boras B, Jones RM, Anson BJ, Arenson D, Aschenbrenner L, Bakowski MA,等。发现一种新型冠状病毒3CL蛋白酶抑制剂,可用于治疗COVID-19。bioRxiv。2021.https://doi.org/10.1101/2020.09.12.293498.
De Vries M, Mohamed AS, Prescott RA, Valero-Jimenez AM, Desvignes L, O 'Connor R,等。一项对SARS-CoV-2抗病毒药物的比较分析表明,3CLpro抑制剂PF-00835231是一种潜在的新治疗COVID-19的药物。中国病毒学杂志。2021;95:01819-20。
郭春杰,施建军,方建民,颜国荣,徐建安,刘海光,等。3C蛋白酶抑制剂作为抗肠病毒71剂的设计、合成和评价生物医学化学,2008;16:7388-98。
戴伟,Jochmans D,谢辉,杨辉,李娟,苏辉,等。作为肠道病毒和SARS-CoV-2广谱抑制剂的拟肽醛的设计、合成和生物学评价中华医学化学杂志,2021;65:2794-808。
郑洁,金勇,王晓燕,王晓燕,等。3d -like蛋白酶抑制剂在体外阻断冠状病毒复制并提高mers - cov感染小鼠的存活率。科学翻译医学2020;12:5332。
普赖尔,Kim Y, Weerasekara S, Moroze M, Alliston KR, Uy RAZ,等。病毒3C和3C样蛋白酶抑制剂的设计、合成和生物评价中国生物医学杂志,2013;23(23):6317-20。
王文文,王文杰,王文杰,等。猫冠状病毒药物抑制SARS-CoV-2主要蛋白酶,阻断病毒复制。Nat Commun. 2020; 11:1-8。
郑洁,陈志强,陈志强,陈志强,等。严重急性呼吸综合征冠状病毒-2 3CL蛋白酶构象约束环己烷抑制剂的结构引导设计。中华医学化学杂志,2021;64:10047-58。
V 'kovski P, Kratzel A, Steiner S, Stalder H, Thiel V.冠状病毒生物学和复制:对SARS-CoV-2的影响。微生物学报。2021;19:155-70。
池田,刘华,洪世杰,林凤云,Nair MS,等。开发SARS-CoV-2 3CL蛋白酶抑制剂的先导化合物。Nat Commun. 2021; 12:1-7。
韩硕,郭因斯,孙文杰,李志强,等。针对严重急性呼吸综合征冠状病毒3CL蛋白酶(SARS-CoV-2 3CLpro)的ml300衍生非共价抑制剂的结构优化中华医学化学杂志,2021;
杜灵顿M, Chun A, Tomar S, Eggler A, Grum-Tokars V, Jacobs J,等。发现N-(苯并[1,2,3]三唑-1-基)-N-(苄基)对乙酰氨基)苯基)羧基酰胺作为严重急性呼吸综合征冠状病毒(SARS-CoV) 3CLpro抑制剂:ML300和具有诱导配合结合的非共价纳米摩尔抑制剂的鉴定生物组织医学化学杂志2013;23:6172-7。
白B, Belovodskiy A, Hena M, Kandadai AS, Joyce MA, Saffran HA,等。含六元内酰胺P1谷氨酰胺的拟肽α-酰基羟甲基酮战斗部:SARS-CoV-2 3CL蛋白酶抑制、冠状病毒抗病毒活性和体外生物稳定性。中华医学化学杂志(英文版);
Konno S, Kobayashi K, Senda M, Funai Y, Seki Y, Tamai I,等。含有亲电芳基酮部分的3CL蛋白酶抑制剂作为抗sars - cov -2药物。中华医学化学杂志(英文版);
康野S, Thanigaimalai P, Yamamoto T, Nakada K, Kakiuchi R, Takayama K,等。含亲电芳基酮部分的新型三肽型SARS-CoV 3CL蛋白酶抑制剂的设计与合成。生物组织医学化学。2013;21:412-24。
Hattori S-I, Higshi-Kuwata N, Raghavaiah J, Das D, Bulut H, Davis DA,等。GRL-0920是一种吲哚型氯吡啶酯,可完全阻断SARS-CoV-2感染。M Bio. 2020; 11:01833-920。
高希,贾哈瓦雅,沙哈比,亚达夫,安森,等。吲哚氯吡啶酯衍生SARS-CoV-2 3CLpro抑制剂:酶抑制、抗病毒疗效、构效关系和x射线结构研究中华医学化学杂志,2021;64:14702-14。
Ma C, Hu Y, Townsend JA, Lagarias PI, Marty MT, Kolocouris A,等。Ebselen、disulfiram、carmofur、x -12、tideglusib和紫草素是非特异性的混杂性SARS-CoV-2主要蛋白酶抑制剂。美国药物学杂志2020;3:1265-77。
金Z,赵Y,太阳Y, B,王H,吴Y, et al。抗肿瘤药物卡莫弗抑制SARS-CoV-2主要蛋白酶的结构基础。分子生物学,2020;27:529-32。
马C, Sacco MD, Hurst B, Townsend JA, Hu Y, Szeto T,等。Boceprevir、GC-376和calpain抑制剂II、XII通过靶向病毒主蛋白酶抑制SARS-CoV-2病毒复制。Cell Res. 2020; 30:678-92。
孟ist HM, Mekonnen D, Mohammed A, Shi R, Jin T.针对SARS-CoV-2主要蛋白酶的潜在抑制剂的效力、安全性和药代动力学特征。《前线药典》2021;11:2495。
付林,叶峰,冯勇,于峰,王强,吴勇,等。Boceprevir和GC376均以SARS-CoV-2的主要蛋白酶为靶点,有效抑制病毒。Nat Commun. 2020; 11:1-8。
李志强,李志强,李志强,等。加快非共价SARS-CoV-2主要蛋白酶抑制剂的合理设计。中华医学化学杂志(英文版);
胡勇,马C, Szeto T, Hurst B, Tarbet B,王杰。Boceprevir, calpain抑制剂II和XII, GC-376具有广谱抗病毒活性。ACS感染疾病2021;7:586-97。
Cáceres CJ, Cardenas-Garcia S, Carnaccini S, Seibert B, Rajao DS, Wang J,等。GC-376在K18 hACE2转基因小鼠模型中抗SARS-CoV-2病毒感染的效果科学通报2021;11:1-13。
石勇,帅林,文泽,王超,闫勇,焦忠,等。临床前抑制剂GS441524联合GC376可有效抑制SARS-CoV-2在小鼠呼吸道的增殖。新兴微生物感染,2021;10:481-92。
邓徐金Z, Du X, Y, Y,刘M,赵Y, et al。SARS-CoV-2中Mpro的结构及其抑制剂的发现。大自然。2020;582:289 - 93。
阿拉法特K, Serrano-Aparicio N, Lodola A, Mulholland AJ, González FV, Świderek K,等。通过QM/MM模拟解释N3肽基迈克尔受体抑制SARS-CoV-2 M pro的机制,并设计了具有可调化学反应性的新衍生物。化学科学,2021;12:1433-44。
Huff S, Kummetha IR, Tiwari SK, Huante MB, Clark AE, Wang S,等。SARS-CoV-2主要蛋白酶抑制剂的发现及作用机制。中华医学化学杂志,2021;
沈震,李海华,李永强,等。利用结合协同作用设计用于COVID-19抗病毒治疗的SARS-CoV-2 PLpro抑制剂中华医学化学杂志(英文版);
刘楠,张勇,雷勇,王锐,詹敏,刘杰,等。一种新型共价靶向SARS-CoV-2木瓜蛋白酶的肽-药物缀合物的设计与评价。中华医学化学杂志,2022;
陈志伟,陈志伟,陈志伟,等。通过筛选nsp5主蛋白酶小分子抑制剂鉴定SARS-CoV-2抗病毒化合物。生物化学学报,2010;
Bhowmik D, Sharma RD, Prakash A, Kumar D.通过靶向3CLpro和PLpro鉴定nafamostat和VR23作为COVID-19候选药物。中国生物化学学报。2017,33:13004。
Ohnishi K, Hattori Y, Kobayashi K, Akaji K.非素数位点取代基和弹头与十氢异喹啉支架联合作为SARS 3CL蛋白酶抑制剂的评估。生物医学化学2019;27:425-35。
范岱克,王志强,王志强,等。ALG-097111是一种有效的选择性SARS-CoV-2 3-糜胰蛋白酶样半胱氨酸蛋白酶抑制剂,在叙利亚仓鼠模型中表现出体内疗效。生物化学生物物理学报,2021;555:134-9。
苏华,姚松,赵伟,李敏,刘杰,尚伟,等。发现黄芩苷和黄芩素作为新型天然产物体外抑制SARS-CoV-2 3CL蛋白酶。bioRxiv。2020.https://doi.org/10.1101/2020.04.13.038687.
黄松,叶磊,张勇,张荣,朱超,范林,等。黄芩素通过干扰线粒体氧化磷酸化以mPTP依赖的方式抑制SARS-CoV-2/VSV复制。信号传导目标Ther. 2020; 5:1-3。
刘华,叶峰,孙强,梁辉,李超,李松,等。黄芩提取物和黄芩素体外抑制SARS-CoV-2及其3C-like蛋白酶的复制。中国生物医学工程学报(英文版)。
Vatansever EC, Yang KS, Drelich AK, Kratch KC, Cho C-C, Kempaiah KR,等。贝地地体外抗SARS-CoV-2有效。《美国国家科学院学报》上。2021.https://doi.org/10.1073/pnas.2012201118.
杨坤,马晓荣,马勇,Alugubelli YR, Scott DA, Vatansever EC,等。一种快速获得多种高效SARS-CoV-2主要蛋白酶抑制剂的途径。ChemMedChem。2021; 16:942-8。
简建涛,程廷仁,庄彦平,马海华,吴彦涛,杨文波,等。鉴定现有药物和草药作为SARS-CoV-2感染抑制剂。《美国国家科学院学报》上。2021.https://doi.org/10.1073/pnas.2021579118.
朱伟,徐敏,陈长忠,郭辉,沈敏,胡霞,等。高通量定量筛选SARS-CoV-2 3CL蛋白酶抑制剂美国药物学杂志2020;3:10 8 - 16。
蔡建涛,王耀林,许建平,陈东,等。瑞德西韦、洛匹那韦、艾美汀和高杉酯碱可抑制新冠病毒的体外复制。抗病毒决议2020;178:0166-3542。
洪若宁,龙克春,左永凯,刘锐,钟道华,朱明英,等。干扰素-1b、洛匹那韦-利托那韦和利巴韦林三重联合治疗COVID-19入院患者:一项开放标签、随机、2期试验《柳叶刀》杂志。2020;395:1695 - 704。
Mirza MU, Ahmad S, Abdullah I, Froeyen M.新型人USP2抑制剂的鉴定及其通过抑制SARS-CoV-2木瓜蛋白酶(PLpro)治疗COVID-19的可能作用。中国生物工程学报。2020;49:107376。
高旭,秦波,陈鹏,朱凯,侯鹏,Wojdyla JA,等。SARS-CoV-2木瓜蛋白酶的晶体结构。中国药物学学报(英文版);2011;11:37 - 44。
付忠,黄斌,唐杰,刘松,刘明,叶勇,等。GRL0617和SARS-CoV-2 PLpro的复杂结构揭示了抗病毒药物的发现热点。Nat Commun. 2021; 12:1-12。
Klemm T, Ebert G, Calleja DJ, Allison CC, Richardson LW, Bernardini JP,等。SARS-CoV-2木瓜蛋白酶(PLpro)的机制及抑制作用中国科学院学报,2010;
乔健,李玉生,曾睿,刘凤林,罗荣华,黄超,等。在转基因小鼠模型中具有抗病毒活性的SARS-CoV-2 Mpro抑制剂。科学。2021;371:1374-8。
Krishnan DA, Sangeetha G, Vajravijayan S, Nandhagopal N, Gunasekaran K.基于结构的药物设计,通过靶向核糖核酸内切酶NSP15鉴定潜在的COVID-19抗病毒药物。通知Med解锁。2020;20:100392。
李文杰,李文杰,李文杰,等。桦木酸衍生物通过nsp15核糖核酸内切酶干扰人冠状病毒229E复制。中华医学化学杂志,2021;64:5632-44。
陈勇,杨文华,黄丽敏,王永春,杨春生,刘永林,等。他非喹体外抑制严重急性呼吸综合征冠状病毒2主蛋白酶的研究。bioRxiv。2020.https://doi.org/10.1101/2020.08.14.250258.
Dow GS, Luttick A, Fenner J, Wesche D, Yeo KR, Rayner C.他非喹在体外抑制SARS-Cov-2的复制。bioRxiv。2020.https://doi.org/10.1101/2020.07.12.199059.
乌贺,上原S,中原K, Nobori H, Yamatsu Y, Yamamoto S,等。发现用于治疗COVID-19的非共价口服SARS-CoV-2 3CL蛋白酶抑制剂S-217622。医学化学,2022年。https://doi.org/10.1021/acs.jmedchem.2c00117.
Kneller DW, Phillips G, Weiss KL,张强,Coates L, Kovalevsky A.用中子晶体学方法直接观察SARS-CoV-2主要蛋白酶质子态调制。中华医学化学杂志。2021;64:4991-5000。
Narayanan A, Narwal M, Majowicz SA, Varricchio C, Toner SA, Ballatore C,等。利用细胞蛋白酶法鉴定靶向Mpro和PLpro的SARS-CoV-2抑制剂公共生物学,2022;5:1-17。
Bung N, Krishnan SR, Bulusu G, Roy A.利用人工智能重新设计SARS-CoV-2的新化学实体。未来医学化学,2021;13:575-85。
王晓明,王晓明,王晓明,王晓明,等。抗冠状病毒药物的自蛋白水解基因开关的研究进展。Nat Commun. 2021; 12:1-12。
徐涛,徐敏,朱伟,陈长忠,张强,郑伟,等。利用基于化学结构和生物活性的建模高效识别抗sars - cov -2化合物。中华医学化学杂志,2022;65:4590-9。
Owen DR, Allerton CM, Anderson AS, Aschenbrenner L, Avery M, Berritt S,等。口服SARS-CoV-2 Mpro抑制剂用于治疗COVID-19的临床候选药物。科学。2021;374:1586 - 93。
文伟,陈超,唐杰,王超,周敏,程勇,等。三种新的口服抗病毒药物(molnupiravir、氟伏沙明和Paxlovid)治疗COVID-19的疗效和安全性:一项荟萃分析。安医学2022;54:516-23。
maase E. Covid-19:辉瑞公司报告称,paxlovid对有严重疾病风险的患者的有效率为89%。英国医学杂志(BMJ Br Med) 2021;
何伟,张锐,谭玉玲,柴丽玲。COVID-19和小分子疗法的前景:有什么值得借鉴的教训吗?药物学杂志,2022;179:106201。
刘华,池田一,Zask A, Khanizeman N, Bednarova E, Forouhar F,等。用于治疗COVID-19的SARS-CoV-2 3CL蛋白酶优化类药物小分子抑制剂的开发。Nat Commun. 2022; 13:1-16。
郭志刚,李志刚,李志刚,等。冠状病毒对抗病毒药物瑞德西韦(GS-5734)的敏感性是由病毒聚合酶和校对外核糖核酸酶介导的。MBio。2018; 9:00221 - 318。
席格尔,许慧,E Doerffler,莫克拉克,K春,张林,等。用于治疗埃博拉病毒和新出现病毒的吡咯[2,1 -f][三嗪-4-氨基]腺嘌呤c -核苷(GS-5734)的磷酸化前药的发现和合成。中华医学化学杂志,2017;
郭丽娟,王志强,王志强,等。早期瑞德西韦预防门诊患者进展为严重Covid-19。英国医学杂志,2022;386:305-15。
Schooley RT, Carlin AF, Beadle JR, Valiaeva N, Zhang X-Q, Clark AE,等。再思考瑞德西韦:口服脂质前药的合成、抗病毒活性和药代动力学。《Chemother》,2021;65:0115 - 221。
伊士曼,罗思,李志强,李志强,等。瑞德西韦:其发现和开发导致紧急使用授权用于治疗COVID-19的回顾美国科学院学报,2020;6:672-83。
张晓玲,刘志刚,张志刚,张志刚,张志刚。新型冠状病毒(SARS-CoV-2)聚合酶的研究进展。大自然。2020;584:154-6。
王强,吴娟,王宏,高原,刘强,穆安,等。SARS-CoV-2聚合酶复制RNA的结构基础。细胞。2020;182(417 - 28):13。
Williamson BN, Feldmann F, Schwarz B, Meade-White K, Porter DP, Schulz J,等。瑞德西韦对感染SARS-CoV-2的恒河猴的临床疗效大自然。2020;585:273-6。
穆兰古,杜德·勒,小戴维·RT, Tshiani Mbaya O, Proschan M, Mukadi D,等。埃博拉病毒疾病治疗的随机对照试验。中华医学杂志。2019;381:2293-303。
德威特,费尔德曼,克罗宁,乔丹,R, Okumura A,托马斯,等。预防性和治疗性瑞德西韦(GS-5734)在MERS-CoV感染恒河猕猴模型中的治疗。《美国国家科学院学报》上。2020; 117:6771-6。
张志刚,张志刚,张志刚,张志刚,张志刚,等。瑞德西韦用于治疗Covid-19。中华医学杂志。2020;383:1813-26。
瑞德西韦的情况非常非常糟糕。科学。2020;370:642-3
田东,刘勇,梁超,辛林,谢霞,张东,等。COVID-19新兴小分子治疗方案的最新综述。生物医药。2021;137:111313。
Yan VC, Muller FL. Captisol和GS-704277,而不是GS-441524,是瑞德西韦肾毒性的可靠介质。Chemother, 2020; 64:01920-2020。
李曹李Y, L, G, Cong F李Y,太阳J, et al。瑞德西韦代谢物GS-441524在小鼠模型中有效抑制SARS-CoV-2感染。中华医学化学杂志(英文版);
Aldeyra疗法。ADX-1612是一种新型HSP90抑制剂,具有抗SARS-CoV-2的潜在纳米摩尔效力,用于COVID-19的临床测试。2020.https://ir.aldeyra.com/news-releases/news-release-details/aldeyra-therapeutics-advance-adx-1612-investigational-new-hsp90.2022年5月9日访问。
Gil C, Ginex T, Maestro I, Nozal V, Barrado-Gil L, Cuesta-Geijo MÁ等。COVID-19:药物靶点和潜在治疗方法。中华医学化学杂志,2020;63:12359-86。
高原,闫磊,黄燕,刘峰,赵颖,曹林,等。COVID-19病毒RNA依赖RNA聚合酶的结构。科学。2020;368:779 - 82。
尹伟,栾霞,李震,周震,王强,高敏,等。苏拉明抑制SARS-CoV-2 RNA聚合酶的结构基础。分子生物学学报。2021;28:319-25。
巴拉诺维奇,王淑珊,阿姆斯特朗,马朱基,韦比,韦伯斯特,等。T-705 (favipiravir)体外诱导甲型H1N1流感病毒致死性突变。中国病毒学杂志,2013;87:3741-51。
阿格拉瓦尔U, Raju R, Udwadia ZF。Favipiravir:新出现的COVID-19抗病毒药物。印度医学杂志,2020;76:370-6。
张晓东,张晓东,张晓东,等。favipiravir在治疗COVID-19中的作用。国际传染病杂志;2021;32(2):531 - 531。
Coomes EA, Haghbayan H. Favipiravir,一种COVID-19抗病毒药物?《抗菌化学杂志》2020;75:2013-4。
杜燕霞,陈小鹏。Favipiravir: 2019-nCoV感染临床试验的药代动力学和担忧。临床药物学杂志2020;108:242-7。
Hassanipour S, Arab-Zozani M, Amani B, Heidarzad F, Fathalipour M, Martinez-de-Hoyo R. Favipiravir治疗COVID-19的有效性和安全性:临床试验的系统综述和荟萃分析。科学通报2021;11:1-11。
Sheahan TP, Sims AC, Zhou S, Graham RL, Pruijssers AJ, Agostini ML,等。一种口服生物可利用的广谱抗病毒药物可抑制人气道上皮细胞培养物中的SARS-CoV-2和小鼠体内的多种冠状病毒。科学翻译医学2020;12:5883。
卡宾格F, Stiller C, Schmitzová J, Dienemann C, Kokic G, Hillen HS,等。molnupirvir诱导SARS-CoV-2突变机制研究。中国生物医学工程学报。2021;28:740-6。
Gordon CJ, Tchesnokov EP, Schinazi RF, Götte M. Molnupiravir通过RNA模板促进SARS-CoV-2突变。生物化学杂志,2021。https://doi.org/10.1016/j.jbc.2021.100770.
Jayk Bernal A, Gomesda Silva MM, Musungaie DB, Kovalchuk E, Gonzalez A, Delos Reyes V,等。口服治疗非住院患者Covid-19的Molnupiravir。英国医学杂志,2022;386:509-20。
默克公司。默克公司和Ridgeback生物治疗公司提供了治疗轻中度COVID-19的实验性口服药物Molnupiravir临床开发项目的最新进展。2021.https://www.merck.com/news/merck-and-ridgeback-biotherapeutics-provide-update-on-progress-of-clinical-development-program-for-molnupiravir-an-investigational-oral-therapeutic-for-the-treatment-of-mild-to-moderate-covid-19.2022年5月9日访问。
胡娜尔,陈志伟,陈志伟,等。利巴韦林对SARS-CoV-2具有抗病毒活性,并在体外下调TMPRSS2活性和ACE2表达。《中国药物学杂志》2021;99:449-60。
Indu P, Rameshkumar MR, Arunagirinathan N, Al-Dhabi NA, Arasu MV, Ignacimuthu S. Raltegravir, Indinavir, Tipranavir, Dolutegravir和Etravirine对抗SARS-CoV-2的主要蛋白酶和RNA依赖的RNA聚合酶:分子对接和药物再利用方法。《感染公共卫生》2020;13:1856-61。
张志刚,张志刚,张志刚,张志刚,等。硅内同源性辅助鉴定RNA结合抑制物对抗2019-nCoV N蛋白(N末端结构域)。中国生物医学工程学报,2002,26(3):326 - 326。
康硕,杨敏,洪震,张磊,黄忠,陈旭,等。SARS-CoV-2核衣壳蛋白RNA结合域的晶体结构揭示了潜在的独特药物靶向位点。药物学学报(英文版);2020;10:1228-38。
德雷曼,琼斯,阿齐兹,马泽娃,等。药物再利用筛选发现,马西替尼是一种3CLpro抑制剂,可在体外阻断SARS-CoV-2的复制。bioRxiv。2020.https://doi.org/10.1101/2020.08.31.274639.
Salgado-Benvindo C, Thaler M, Tas A, Ogando NS, Bredenbeek PJ, Ninaber DK,等。苏拉明通过干扰复制周期的早期步骤来抑制细胞培养中的SARS-CoV-2感染。Chemother, 2020; 64:00900-20。
刘旭,李忠,刘松,孙杰,陈忠,姜敏,等。双嘧达莫对新型冠状病毒肺炎重症患者的潜在治疗作用中国药物学学报(英文版);2008;
Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S,等。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。细胞。2020;181:271 - 80。
周鹏,杨晓林,王晓刚,胡波,张磊,张伟,等。与一种可能来自蝙蝠的新型冠状病毒有关的肺炎爆发。大自然。2020;579:270-3。
Duarte M, Pelorosso F, Nicolosi LN, Salgado MV, Vetulli H, Aquieri A,等。替米沙坦治疗Covid-19患者:一项开放的多中心随机临床试验EClinicalMedicine。2021年,37:100962。
Lukito AA, Widysanto A, Lemuel TAY, Prasetya IB, Massie B, Yuniarti M,等。坎地沙坦作为COVID-19的试探性治疗:一项前瞻性非随机开放标签研究国际传染病杂志;2021;38:489 - 489。
Puskarich MA, Cummins NW, Ingraham NE, Wacker DA, Reilkoff RA, Driver BE,等。氯沙坦对COVID-19有症状门诊患者的多中心II期随机临床试验EClinicalMedicine。2021年,37:100957。
五、新型冠状病毒COVID-19及其诊断和治疗。Int J. 2020; 8:39-43。
高桥S, Yoshiya T, Yoshizawa-Kumagaye K, Sugiyama T.烟草胺是一种新型大豆血管紧张素转换酶2抑制剂。Biomed res 2015; 36:219-24。
Bhowmik D, Nandi R, Prakash A, Kumar D.通过分子对接和药理分析评价黄酮类化合物作为2019-nCoV细胞进入抑制剂。Heliyon。2021;7:06515。
Sadremomtaz A, al - dahmani ZM, Ruiz-Moreno AJ, Monti A, Wang C, Azad T,等。合成肽,拮抗血管紧张素转换酶-2 (ACE-2)与SARS-CoV-2受体结合刺突蛋白相互作用。中华医学化学杂志2021;65:2836-47。
李志强,李志强,李志强,等。新型冠状病毒强效d肽抑制剂的计算设计。中华医学化学杂志,2021;64:14955-67。
McKee DL, Sternberg A, Stange U, Laufer S, Naujokat C.针对SARS-CoV-2和COVID-19的候选药物。药典决议2020;157:104859。
Hoffmann M, Schroeder S, Kleine-Weber H, Müller MA, Drosten C, Pöhlmann S.甲磺酸萘莫司他阻断SARS-CoV-2的激活:COVID-19的新治疗方案。Chemother, 2020; 64:00754-820。
山本M,木佐M,酒井多川Y,岩津堀本K,今井M,武田M,等。抗凝剂nafamostat在细胞融合检测系统中有效抑制SARS-CoV-2 S蛋白介导的融合,并以细胞类型依赖的方式在体外抑制病毒感染。病毒。2020;12:629。
贝斯特尔D,亨德尔MR,林堡H, Pilgram O,莫尔顿H,斯坦因DA,等。TMPRSS2和furin都是人呼吸道细胞中SARS-CoV-2蛋白水解激活所必需的。生命科学。联盟。2020;3 (9):e202000786。
胡霞,虾俊辉,郭辉,徐明,陈长忠,朱伟,等。通过虚拟筛查发现tmprss2抑制剂可作为covid-19的潜在治疗方法。美国药物学杂志2021;4:1124-35。
Mahoney M, Damalanka VC, Tartell MA, Hee Chung D, Lourenço AL, Pwee D,等。一类新型TMPRSS2抑制剂可有效阻断SARS-CoV-2和MERS-CoV病毒进入并保护人类肺上皮细胞。《美国国家科学院学报》上。2021.https://doi.org/10.1073/pnas.2108728118.
王淑春,陈勇,王永春,王文杰,杨春生,蔡春林,等。单宁酸作为病毒主蛋白酶和细胞TMPRSS2蛋白酶的双重抑制剂抑制SARS-CoV-2。Am Cancer res 2020;10:4538。
程Y-W,曹国伟T-L,李有氯,赵M-F,花王·hc·王- h, et al。Furin抑制剂阻断SARS-CoV-2突刺蛋白裂解,抑制病毒产生和细胞病变效应。Cell rep 2020;33: 108254。
Ashhurst AS, Tang AH, Fajtová P, Yoon MC, Aggarwal A, Bedding MJ,等。天然产物鸡酰胺A及其类似物通过抑制Cathepsin L.具有强大的抗sars - cov -2活性J Med Chem 2021; 65:2956-70。
张娟,马旭,于峰,刘杰,邹峰,潘涛,等。Teicoplanin可有效阻断2019-nCoV的细胞进入。bioRxiv。2020.https://doi.org/10.1101/2020.02.05.935387.
张志强,张志强,张志强,等。SARS-CoV-2主蛋白酶的结构和抑制揭示了开发Mpro和cathepsin双抑制剂的策略。
Smieszek SP, Przychodzen BP, Polymeropoulos MH.金刚烷胺破坏溶酶体基因表达:covid - 19治疗的假设。国际抗菌药物杂志。2020;55:106004。
熊睿,张磊,李松,孙勇,丁敏,王勇,等。针对DHODH的新型有效抑制剂是针对RNA病毒的广谱抗病毒药物,包括新出现的冠状病毒SARS-CoV-2。蛋白质细胞,2020;11:723-39。
在一项开放标签空白对照临床试验中,小剂量来氟米特治疗COVID-19。《病毒学杂志》2020;35:725-33。
王晓峰,张明杰,何楠,王永春,闫超,陈学泽,等。基于rbd - fc的COVID-19候选疫苗由th2倾斜iNKT细胞激动剂佐剂诱导产生的强中和抗体。中华医学化学杂志2021;64:11554-69。
郭丽娟,王志强,王志强,等。n -取代缬胺衍生物是内质网α-葡萄糖苷酶I和II的有效抑制剂,具有抗病毒活性。中华医学化学杂志,2021;64:18010-24。
Bojkova D, Klann K, Koch B, Widera M, Krause D, Ciesek S,等。sars - cov -2感染宿主细胞的蛋白质组学揭示治疗靶点大自然。2020;583:469 - 72。
白志强,李志强,李志强,等。Plitidepsin通过靶向宿主蛋白eEF1A对SARS-CoV-2具有有效的临床前疗效。科学。2021;371:926-31。
Richardson P, Griffin I, Tucker C, Smith D, Oechsle O, Phelan A,等。巴瑞替尼作为新型冠状病毒急性呼吸道疾病的潜在治疗药物。《柳叶刀》杂志。2020;395:30。
郑勇,范亚东,加藤涛,林斌,莫罗D, López-Andarias J,等。巯基介导摄取的抑制剂。化学学报,2021;12:626-31。
Silvas JA, Jureka AS, Nicolini AM, Chvatal SA, Basler CF. VPS34和脂质代谢抑制剂抑制SARS-CoV-2复制。bioRxiv。2020.https://doi.org/10.1101/2020.07.18.210211.
刘国强,刘国强,刘国强,等。GNS561通过抑制自噬表现出对SARS-CoV-2有效的体外抗病毒活性。病毒。2022;14:132。
黄勇,杨超,徐晓峰,徐伟,刘世伟。SARS-CoV-2刺突蛋白的结构和功能特性:双嘧达莫在COVID-19重症患者中的潜在抗病毒药物开发中国药物学学报(英文版);2008;
杨超,潘旭,徐旭,程超,黄勇,李林,等。丹酚酸C通过阻断刺突蛋白六螺旋束核的形成,有效抑制SARS-CoV-2感染。信号传导目标Ther. 2020; 5:1-3。
王旭,曹睿,张辉,刘健,徐明,胡辉,等。抗流感病毒药物阿比多是一种有效的SARS-CoV-2体外抑制剂。Cell discover . 2020; 6:1-5。
张建南,王文杰,彭波,彭伟,张玉生,王玉林,等。阿比多暴露后预防COVID-19传播的潜力:一项回顾性队列研究的初步报告高等医学科学2020;40:480。
邓龙,李超,曾强,刘旭,李霞,张宏,等。阿比多尔联合LPV/r与单独LPV/r治疗2019年冠状病毒病:一项回顾性队列研究《传染病杂志》2020;81:1-5。
陈杰,陈建军,张世涛,张志强,等。冠状病毒的小分子抑制剂:ACE2蛋白-蛋白相互作用作为SARS-CoV-2病毒附着和进入的阻滞剂。ACS感染疾病2021;7:1519-34。
陈长忠,徐敏,Pradhan M, Gorshkov K, Petersen JD, Straus MR,等。通过药物重新利用SARS-S和MERS-S伪粒子筛选识别SARS-CoV-2进入抑制剂。美国药理学杂志2020;3:1165-75。
袁硕,尹旭,孟x,陈建峰,叶志伟,李华,等。氯法齐明广泛抑制包括SARS-CoV-2在内的冠状病毒。大自然。2021;593:418-23。
谢立明,张志强,张志强,张志强,等。新的喹啉-三唑缀合物:合成及其对SARS-CoV-2的抗病毒性能。生物化学。2021;114:105117。
李志刚,张志刚,张志刚,张志刚,等。新的吡嗪缀合物:合成、计算研究和对SARS-CoV-2的抗病毒性能。ChemMedChem。2021; 16:3418-22。
Giovannoni G, Hawkes C, Lechner-Scott J, Levy M, Waubant E, Gold J. COVID-19大流行和MS疾病修饰疗法的使用。多巩膜相关疾病,2020。https://doi.org/10.1016/j.msard.2020.102073.
陈超,齐峰,石凯,李勇,李娟,陈勇,等。沙利度胺联合低剂量短期糖皮质激素治疗2019年危重冠状病毒病临床翻译医学2020年。https://doi.org/10.1002/ctm2.35.
李志强,杨晓东,Muñoz-Basagoiti J,杨晓东,李志强,等。在药物再利用筛选后,plitdepsin作为sars - cov -2诱导的细胞病变效应的有效抑制剂的鉴定。Front Pharmacol. 2021;12:278。
王敏,曹睿,张玲,杨鑫,刘娟,徐敏,等。瑞德西韦和氯喹在体外能有效抑制新出现的新型冠状病毒(2019-nCoV)。Cell Res. 2020; 30:269-71。
高健,田志,杨旭。突破性进展:磷酸氯喹在治疗COVID-19相关性肺炎的临床研究中显示出明显疗效。生物科学进展。2020;14:72-3。
Hoffmann M, Mösbauer K, Hofmann-Winkler H, Kaul A, Kleine-Weber H, Krüger N,等。氯喹不能抑制SARS-CoV-2感染人类肺细胞。大自然。2020;585:588 - 90。
马松纳斯,郭俊杰,李志强,李志强,等。羟氯喹在非人类灵长类动物中用于对抗SARS-CoV-2感染。大自然。2020;585:584-7。
潘H, Peto R, Henao-Restrepo A, Preziosi M, Sathiyamoorthy V, Abdool Karim Q,等。联合WST(2021年)重新利用抗病毒药物治疗covid -19世卫组织团结试验中期结果。英国医学杂志。2021;384:497-511。
李丽华,袁世强,殷晓霞,陈志强,等。通过大规模化合物再利用发现SARS-CoV-2抗病毒药物。大自然。2020;586:113-9。
Puhl AC, Fritch EJ, Lane TR, Tse LV, Yount BL, Sacramento CQ,等。重新利用埃博拉和马尔堡病毒抑制剂噻洛酮、阿那平和吡咯啶:体外抗SARS-CoV-2活性及其潜在机制ACS Omega. 2021; 6:7454-68。
Gorshkov K,陈长忠,Bostwick R, Rasmussen L, Tran BN,程艳生,等。溶酶体碱化小分子阻断了SARS-CoV-2的细胞病变效应。ACS感染疾病2020;7:1389-408。
韦斯顿,柯尔曼,李杨,等。食品药品监督管理局批准的药物体外抗SARS-CoV-2和体内抗SARS-CoV的广泛抗冠状病毒活性中国病毒学杂志。2020;94:01218-20。
杜丽芳,王志强,王志强,Nougairède A,王志强,等。FDA批准的化学文库的体外筛选揭示了SARS-CoV-2复制的潜在抑制剂。科学通报2020;10:1-8。
孙俊,黄松,曾强,brick TL, Case JB,周俊,等。Nitazoxanide和JIB-04具有广谱抗病毒活性,并在猪模型中抑制SARS-CoV-2在细胞培养中的复制和冠状病毒发病机制。bioRxiv。2020.https://doi.org/10.1101/2020.09.24.312165.
Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM。fda批准的药物伊维菌素可在体外抑制SARS-CoV-2的复制。抗病毒决议2020;178:104787。
周艳,侯颖,沈娟,黄艳,Martin W,程飞。基于网络的新型冠状病毒2019-nCoV/SARS-CoV-2药物再利用。Cell discover . 2020; 6:1-18。
胡埃特,波西耶H,沃伊森O,朱维绍梅S, Dauriat G,拉扎雷斯I,等。阿纳金拉治疗严重形式的COVID-19:一项队列研究。《柳叶刀风湿病杂志》2020;2:393-400。https://doi.org/10.1016/s2665 - 9913 (20) 30164 - 8.
张志刚,张志刚,张志刚,张志刚,等。COVID-19住院患者的羟氯喹与阿奇霉素对比。随机、活跃比较试验结果。Ann Am Thorac Soc 2021; 18:590-7。
Kanjanasirirat P, Suksatu A, Manopwisedjaroen S, Munyoo B, Tuchinda P, Jearawuttanakul K,等。对泰国药用植物进行高含量筛选,发现圆檀提取物及其成分Panduratin A具有抗sars - cov -2的作用。科学通报2020;10:1-12。
崔勇,张敏,徐辉,张涛,张松,赵旭,等。弹性酶抑制剂环噻奈唑a:急性肺损伤的全合成及体内生物学评价。中华医学化学杂志,2022;
张志荣,张艳娜,李晓东,张海强,肖淑琴,邓峰,等。基于细胞的SARS-CoV-2抑制剂天然化合物的大规模筛选。信号传导目标Ther. 2020; 5:1-3。
郑敏,丛伟,彭辉,清娟,沈辉,唐勇,等。靶向SARS-CoV-2 Spike Protein HR1的钉钉肽抑制病毒与其细胞受体的融合。中华医学化学杂志,2021;64:17486-95。
王涛,方旭,文涛,刘杰,翟震,王震,等。合成的中和肽可以抑制刺突蛋白与宿主细胞的结合,阻断SARS-CoV-2感染。中华医学化学杂志,2021;64:14887-94。
夏山,闫磊,徐伟,阿格拉瓦尔,Algaissi A,曾昌tk,等。一种泛冠状病毒融合抑制剂,靶向人类冠状病毒峰值的HR1结构域。科学通报2019;5:4580。
夏松,朱勇,刘敏,兰青,徐伟,吴勇,等。新型冠状病毒与刺突蛋白HR1结构域融合抑制剂的融合机制细胞分子免疫,2020;17:765-7。
夏生,刘敏,王超,徐伟,兰青,冯松,等。通过一种高效的泛冠状病毒融合抑制剂抑制SARS-CoV-2(以前是2019-nCoV)感染,该抑制剂针对其具有高介导膜融合能力的刺突蛋白。Cell Res. 2020; 30:343-55。
朱勇,于东,闫红,冲红,何艳。新型冠状病毒SARS-CoV-2的高效膜融合抑制剂设计。中国病毒学杂志,2020;94:635-720。
李志强,李志强,李志强,等。鼻内融合抑制脂肽可防止雪貂直接接触SARS-CoV-2传播。科学。2021;371:1379 - 82。
张g, Pomplun S, Loftis A, Tan X, Loas A, Pentelute B. ACE2 n端片段与SARS-CoV-2 Spike RBD结合的研究。bioRxiv。2020.https://doi.org/10.1101/2020.03.19.999318.
曹l, Goreshnik I, Coventry B, Case JB, Miller L, Kozodoy L,等。新型冠状病毒微蛋白抑制剂的从头设计。科学。2020;370:426-31。
张志刚,张志刚,张志刚,等。整合素结合肽ATN-161作为一种治疗SARS-CoV-2感染的新疗法。科学通报2021;6:1-8。
Watson A, Ferreira L, Hwang P, Xu J, Stroud R. SARS-CoV-2 (COVID-19)肽解药。bioRxiv。2020.https://doi.org/10.1101/2020.08.06.238915.
赵华,杜家强,施国华,容天明,边敏,林华,等。一种针对SARS-CoV-2和其他呼吸道病毒的广谱病毒和宿主靶向抗病毒肽。Nat Commun. 2020;11:4252。
赵华,杜家强,林华,周旭,陈建文,彭智,等。交联肽和再利用药物均抑制新冠病毒的进入途径。Nat Commun. 2021;12:1517。
闫锐,张颖,李艳,夏玲,郭艳,周强。人ACE2全长识别SARS-CoV-2的结构基础。科学。2020;367:1444-8。
Chemaitelly H, Abu-Raddad L. COVID-19疫苗效力减弱。柳叶刀》。2022;399(10327):771 - 3。
孟妮,李丽娟,李丽娟,等。《柳叶刀》感染病2022;22:1002-10
陈建文,郭克华,朱震,朱华,杜家伟,袁晟,等。从武汉非典型肺炎患者身上分离的2019年新型人类致病性冠状病毒的基因组特征新兴微生物感染。2020;9:21 1 - 36。
Clausen TM, Sandoval DR, Spliid CB, Pihl J, Perrett HR, Painter CD,等。SARS-CoV-2感染依赖于细胞性硫酸肝素和ACE2。细胞。2020;183:1043-57。
欧旭,刘勇,雷霞,李鹏,米东,任林,等。SARS-CoV-2刺突糖蛋白在病毒进入时的特征及其与SARS-CoV的免疫交叉反应性Nat Commun. 2020; 11:1-12。
Fehr AR, Perlman S.冠状病毒:其复制和发病机制的概述。方法Mol生物学,2015;1282:1-23。
Elhusseiny KM, Abd-Elhay FAE, Kamel MG。COVID-19可能的治疗药物:一项全面综述专家Rev抗感染Ther 2020; 18:1005-20。
Nittari G, Pallotta G, Amenta F, Tayebati SK.当前SARS-COV-2的药物治疗:叙述性回顾。欧洲药物学杂志。2020;882:173328。
Neamati . COVID-19治疗进展特刊。J医学化学2022;65:2713-15。
Cannalire R, Cerchia C, Beccari AR, Di Leva FS, Summa V.针对SARS-CoV-2蛋白酶和聚合酶治疗COVID-19:最新进展和未来机会中华医学化学杂志,2020;
Gamcsik MP, Malthouse JPG, Primrose WU, Mackenzie NE, Boyd AS, Russell RA,等。直接核磁共振观察木瓜蛋白酶四面体抑制剂配合物的结构和立体化学。化学学报,1983;21(5):624 - 5。
杜乐RE,霍耶D,普拉萨德C,施密特SJ, Helaszek CT,米勒RE,等。P1天冬氨酸基肽α -((2,6 -二氯苯甲酰)氧)甲基酮作为有效的白介素-1 β -转化酶的时间依赖性抑制剂。中华医学化学杂志1994;37:534 - 4。
Boras B, Jones RM, Anson BJ, Arenson D, Aschenbrenner L, Bakowski MA,等。静脉注射冠状病毒3CL蛋白酶抑制剂用于治疗covid - 19的临床前研究Nat Commun. 2021; 12:1-17。
金毅,刘华,Galasiti Kankanamalage AC, Weerasekara S,华DH, Groutas WC,等。通过广谱冠状病毒蛋白酶抑制剂逆转猫致命冠状病毒感染的进展。PLoS Pathog. 2016;12:1005531。
卢林,苏松,杨华,姜松。高致病性病毒的共同靶点抗病毒药物。细胞。2021;184:1604-20。
Stephenson KE, Le Gars M, Sadoff J, De Groot AM, Heerwegh D, Truyers C,等。COVID-19 Ad26 COV2 S疫苗的免疫原性《美国医学协会杂志》上。2021; 325:1535-44。
檀igaimalai P, Konno S, Yamamoto T, Koiwai Y,田口A,高山K,等。具有新型P3支架的强效二肽型SARS-CoV 3CL蛋白酶抑制剂的开发:设计、合成、生物学评估和对接研究中华医学杂志,2013;
Pruijssers AJ, George AS, Schäfer A, Leist SR, Gralinksi LE, Dinnon KH III,等。瑞德西韦抑制人肺细胞中的SARS-CoV-2,并在小鼠中抑制表达SARS-CoV-2 RNA聚合酶的嵌合SARS-CoV。Cell rep 2020;32: 107940。
Stopsack KH, Mucci LA, Antonarakis ES, Nelson PS, Kantoff PW。TMPRSS2和COVID-19:意外还是干预的机会?癌症发现2020;10:779-82。
连娜,谢辉,林松,黄娟,赵娟,林强。一项回顾性研究显示,乌非韦治疗与2019年冠状病毒病患者预后改善无关。临床微生物感染,2020;26:917-21。
世界卫生组织。世卫组织冠状病毒(COVID-19)仪表盘。https://covid19.who.int/.2022年5月9日访问。
确认
作者非常感谢台湾科技部为他们提供资金支持,以进行研究工作,重点是设计和合成小分子抑制剂。[MOST -109-2113- m -038- 001, MOST- 110-2320-B-038-028-,和111-2320-B-038-047-]
资金
这项工作没有得到外部资助。
作者信息
作者及隶属关系
贡献
起草及文献分析:KN;文献综述:RS、SS;数字编制:AT;概念化、指导和监督:喷气推进实验室。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
Kunal Nepali和Jing Ping Liou是台北医科大学的员工。Ram Sharma, Sachin Sharma, Amandeep Thakur是台北医科大学的博士生。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
抗冠状病毒药物小分子活性谱。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
尼泊尔语,K,夏尔马,R,夏尔马,S。et al。疫苗之外:小分子和肽类抗covid - 19武器库一览生物科学2965岁(2022年)。https://doi.org/10.1186/s12929-022-00847-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-022-00847-6
关键字
- 冠状病毒
- 新型冠状病毒肺炎
- SARS-CoV-2
- ACE-2
- TMPRSS2药物再利用
- 药物化学
- 病毒复制
- 病毒进入
- RdRp抑制剂
- 3 clpro抑制剂
- PLpro抑制剂
- TMPRSS2抑制剂
- 肽
- 小分子抑制剂
- 疫苗
- 单克隆抗体