- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
CYP11A1的A '螺旋重组线粒体嵴gydF4y2Ba
生物医学科学杂志gydF4y2Ba体积gydF4y2Ba29gydF4y2Ba,文章号:gydF4y2Ba61gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
CYP11A1是一种位于线粒体内膜的蛋白质,催化类固醇合成的第一步。CYP11A1作为类固醇生成细胞的标记基因,其丰度表征了类固醇细胞分化的程度。此外,完全分化的类固醇细胞的线粒体特化为小管泡嵴。CYP11A1参与线粒体结构的改变和类固醇生成细胞的分化,但尚未被研究。gydF4y2Ba
方法gydF4y2Ba
我们设计了非甾体性猴肾COS1细胞,使其在强力霉素诱导下表达CYP11A1,并检测了这些细胞的线粒体结构。我们还绘制了赋予线粒体结构变化的CYP11A1结构域。我们寻找cyp11a1相互作用蛋白,并研究了这种相互作用蛋白在形成线粒体结构中的作用。最后,我们研究了CYP11A1过表达对线粒体接触位点数量和嵴组织系统的影响。gydF4y2Ba
结果gydF4y2Ba
我们发现CYP11A1过表达导致线粒体内小管泡嵴的形成。我们还发现位于57-68号氨基酸上的A ' -螺旋结构足以用于膜插入和嵴重塑。我们鉴定热休克蛋白60 (Hsp60)为CYP11A1相互作用蛋白,并表明Hsp60是CYP11A1积累和嵴重塑所必需的。最后,我们发现当CYP11A1过表达时,线粒体接触位点和嵴组织系统的MIC10小亚复合体减少。gydF4y2Ba
结论gydF4y2Ba
CYP11A1参与类固醇细胞线粒体小管泡嵴的形成。它的A ' -螺旋结构足以形成管状泡嵴和蛋白质整合到膜中。CYP11A1与Hsp60相互作用,这是CYP11A1积累所必需的。CYP11A1的积累导致MIC10复合物的减少,改变线粒体结构。gydF4y2Ba
背景gydF4y2Ba
类固醇产生的第一步发生在线粒体中,其中孕烯醇酮(P5)由细胞色素P450 11A1 (CYP11A1)酶从前体胆固醇产生[gydF4y2Ba1gydF4y2Ba].CYP11A1是细胞色素P450家族中的一种蛋白质。它催化胆固醇的侧链裂解,因此该酶又被称为胆固醇侧链裂解酶(简称P450scc或SCC)。该反应需要线粒体内膜中的电子载体,肾上腺素还蛋白还原酶和肾上腺素还蛋白[gydF4y2Ba2gydF4y2Ba].肾上腺素还原酶为肾上腺素提供电子。然后,肾上腺素还蛋白通过在铁氧还蛋白还原酶和细胞色素P450之间来回穿梭,将电子传送到CYP11A1 [gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].gydF4y2Ba
人的CYP11A1长度为521个氨基酸(AAs)。它携带39-AA信号肽,在CYP11A1进入线粒体后被裂解。成熟的CYP11A1由12个螺旋(螺旋A到L)、4个β片以及这些结构之间的环组成[gydF4y2Ba5gydF4y2Ba].CYP11A1部分插入线粒体内膜,而大部分蛋白面向基质[gydF4y2Ba5gydF4y2Ba].CYP11A1参与与膜相互作用的区域已被确定为疏水A ' -螺旋(AA # 57-68)和F-G环[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
在发育过程中,激素原性细胞随着激素原性酶的逐渐增加和线粒体形态的改变而分化[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].CYP11A1与囊泡聚集有关[gydF4y2Ba10gydF4y2Ba].此外,CYP11A1的增加与线粒体结构的变化相吻合,如嵴形状的改变[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].例如,球形线粒体存在于肾上腺皮质束状带和卵巢黄体细胞中[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba8gydF4y2Ba],而睾丸间质细胞中则存在细长的线粒体[gydF4y2Ba11gydF4y2Ba].颗粒细胞线粒体细长,嵴板层状,黄体细胞线粒体球形,嵴小管泡状[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].gydF4y2Ba
线粒体嵴是生物能量学的发生地[gydF4y2Ba13gydF4y2Ba].变形虫中的克丽丝塔重塑gydF4y2Ba混沌有害无益gydF4y2Ba保护膜免受氧化剂侵害及防止线粒体损伤[gydF4y2Ba14gydF4y2Ba].细胞凋亡过程中细胞色素c的完全释放也需要crissta重塑[gydF4y2Ba15gydF4y2Ba].嵴结构的完整性由线粒体接触位点和嵴组织系统(MICOS)维持[gydF4y2Ba16gydF4y2Ba].MICOS分为两个不同的亚复合物,MIC60/MIC19/MIC25和MIC10/MIC13/MIC26/MIC27 [gydF4y2Ba17gydF4y2Ba].MIC60亚复合物足以形成嵴结,而MIC10亚复合物则控制层状嵴的形成[gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].在缺少MICOS的情况下,电子配合物的定位受到干扰,因此嵴结构受损[gydF4y2Ba20.gydF4y2Ba].gydF4y2Ba
类固醇产生细胞的线粒体具有特殊的水泡嵴[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba],因此,探讨类固醇原性细胞分化过程中嵴重塑的机制很有意义。在类固醇源性合胞滋养细胞的线粒体中,二聚体呼吸复合体V的数量减少了一半[gydF4y2Ba21gydF4y2Ba],表明线粒体重塑过程中蛋白质组成的变化。但是在这些细胞中形成线粒体嵴的蛋白质在很大程度上仍然不清楚。CYP11A1可能是与线粒体嵴结构相关的候选蛋白,因为CYP11A1的缺失导致肾上腺皮质细胞中线粒体嵴的改变和小管泡嵴的丢失[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
在本研究中,我们使用COS1细胞,因为它缺乏CYP11A1,通常不能合成类固醇。然而COS1有能力转化为类固醇细胞[gydF4y2Ba24gydF4y2Ba],使其成为研究的理想细胞模型。我们在COS1细胞中过表达CYP11A1,研究CYP11A1在线粒体嵴重塑中的作用。我们发现CYP11A1可以将线粒体嵴从板层状结构改造为管状泡状结构,并且CYP11A1的A ' -螺旋在嵴重塑中起作用。此外,我们还发现Hsp60可调节CYP11A1的积累和线粒体嵴重塑。最后,我们发现CYP11A1通过减少MIC10复合物来重塑嵴。gydF4y2Ba
方法gydF4y2Ba
细胞培养,瞬时转染,生成稳定的细胞克隆gydF4y2Ba
COS1是一种来源于猴肾的成纤维细胞样细胞系。HEK 293 T细胞是含有SV40 T抗原的人胚胎肾细胞。这些细胞在添加10%胎牛血清和1%青霉素链霉素的DMEM中在5% CO中生长gydF4y2Ba2gydF4y2Ba37°C恒温箱。转染时,将15µg质粒和45µL转染试剂混合在1.5 mL无血清培养基中,然后以60%的融合度添加到10厘米培养皿中的细胞中。培养48 h后收获细胞。gydF4y2Ba
我们使用四环素诱导(Tet-On)慢病毒系统仅在四环素或类似物多西环素处理细胞时表达外源性CYP11A1。为了产生可诱导CYP11A1表达的细胞克隆,COS1细胞与两种慢病毒共转导gydF4y2BaCYP11A1-HF-IRES-EGFPgydF4y2Ba而且gydF4y2BartTA3gydF4y2Ba8 μg/mL聚brene存在下的cdna。用1 μg/mL嘌呤霉素处理感染细胞2周。分离细胞无性系gydF4y2BaCYP11A1-HF-IRES-EGFPgydF4y2Ba用1 μg/mL强力霉素处理耐嘌呤霉素(rtta3阳性)克隆细胞,在荧光显微镜下观察EGFP信号。分离egfp阳性克隆,多西环素诱导24 h后用抗flag抗体免疫印迹法检测CYP11A1的表达。选择C1和C4两个独立的细胞克隆用于后续实验。gydF4y2Ba
试剂、RNA、质粒和克隆gydF4y2Ba
这里使用的试剂,如抗体,寡核苷酸,质粒,酶,试剂盒和软件列在附加文件gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
为了分离RNA,将约50 mg 3个月大的斑马鱼睾丸组织样本均质于0.5 mL Trizol (Ambion)中。RNA用氯仿提取,异丙醇沉淀,溶解于50µL二乙基焦碳酸酯处理过的水中。gydF4y2Ba
克隆斑马鱼gydF4y2Bacyp11a1gydF4y2Ba而且gydF4y2Bacyp11a2gydF4y2Ba以斑马鱼睾丸RNA为模板,用Maxima逆转录酶和引物进行cDNA合成gydF4y2Bacyp11a1gydF4y2Ba而且gydF4y2Bacyp11a2gydF4y2Ba.人类gydF4y2BaCYP11A1gydF4y2Ba(AA # 1-521)在[gydF4y2Ba25gydF4y2Ba].gydF4y2BaCYP11A1gydF4y2Ba所有cDNA片段(aa# 1-39和aa# 1-85)均克隆到XhoI和EcoRI位点gydF4y2BapEGFP-N1gydF4y2Ba的AflII和BamHI位点gydF4y2BapcDNA3-EGFP-APEX2gydF4y2Ba向量。将人CYP11A1 (AA # 57-68)的A ' -螺旋亚克隆到人CYP11A1的EcoRI和BamHI位点gydF4y2BapCYP11A1 -EGFP (39)gydF4y2Ba向量,或gydF4y2BapcDNA3-CYP11A1 -EGFP-APEX2 (39)gydF4y2Ba向量。产生的结构gydF4y2Ba(pCYP11A1 (39) -EGFP pCYP11A1 (39gydF4y2Ba+gydF4y2BaA’)-EGFP, pCYP11A1(85)-EGFP, pCYP11A1(521)-EGFP, pcDNA3-CYP11A1(39)-EGFP- apex2, pcDNA3-CYP11A1(39)gydF4y2Ba+gydF4y2Ba“)-EGFP-APEX2 pcDNA3-CYP11A1 -EGFP-APEX2 (85),gydF4y2Ba而且gydF4y2BapcDNA3-CYP11A1 (521) -EGFP-APEX2)gydF4y2Ba通过DNA测序进一步验证。gydF4y2Ba
用于生成全长表达CYP11A1的慢病毒结构gydF4y2BaCYP11A1gydF4y2BacDNA被插入到Tet-On慢病毒载体的Eco RI和Bam HI位点gydF4y2BaPL-SIN-5TO-HF-IRES-EGFPgydF4y2Ba[gydF4y2Ba26gydF4y2Ba],包含一个c端HA-FLAG pPAX2 (HF)串联标签和一个由五个重复Tet操作子和一个mini-CMV启动子驱动的IRES-EGFP盒。由此产生的质粒,gydF4y2BaPL-SIN-5TO-CYP11A1-HF-IRES-EGFPgydF4y2Ba,经DNA测序验证。的gydF4y2BapTRIPZ-rtTA3gydF4y2Ba质粒含有反向四环素-转激活因子3 (rtTA3)的编码序列和由EF1a启动子控制的ires -嘌呤霉素盒[gydF4y2Ba26gydF4y2Ba].的gydF4y2BapPAX2gydF4y2Ba而且gydF4y2BapMD2。GgydF4y2Ba慢病毒包装用质粒购自Addgene。gydF4y2Ba
慢病毒表达gydF4y2BaPL-SIN-5TO-CYP11A1-HF-IRES-EGFPgydF4y2Ba或gydF4y2BapTRIPZ-rtTA3gydF4y2Ba根据Addgene的慢病毒包装协议制备。简而言之,1 μg慢病毒质粒,0.75 μggydF4y2BapPAX2gydF4y2Ba, 0.25 μggydF4y2BapMD2。GgydF4y2Ba用6µL TransIT-LT1转染试剂(Mirus Bio)共转染HEK 293 T细胞。转染后48小时收集含慢病毒的上清。gydF4y2Ba
Hsp60击倒gydF4y2Ba
Hsp60被gydF4y2Basi-HSP60gydF4y2BaRNA (Dharmacon)遵循制造商的说明。简单地说,用25 nM的gydF4y2Basi-HSP60gydF4y2BaRNA转染24 h后,加入1µg/mL强力霉素孵育24 h诱导外源性CYP11A1表达。再次转染细胞gydF4y2Basi-HSP60gydF4y2BaRNA,再孵育24小时,以确保在收获前充分消耗Hsp60。gydF4y2Ba
免疫荧光gydF4y2Ba
在12孔板内的覆盖物上生长的细胞用pH为7.4的磷酸盐缓冲盐水(PBS)清洗,并在室温下用4%的多聚甲醛固定20分钟。PBS洗涤三次后,细胞在0.2% Triton X-100 (PBS)中渗透10分钟。PBS洗涤三次后,在室温下用10%正常山羊血清在PBS中堵塞覆盖物1小时。去除阻塞液后,将一抗加入板中,4℃孵育过夜。PBS洗涤三次后,用二抗(Alexa Fluor 546 Thermo)和10µg/mL DAPI在室温下孵育1小时,用PBS洗涤三次,并安装在显微镜载玻片上。玻片在黑暗中一夜晾干。使用蔡司LSM710倒置共聚焦显微镜获取图像,并使用ZEN 2011(蓝色版)软件进行处理。gydF4y2Ba
蛋白提取,膜蛋白提取gydF4y2Ba
在2 mL裂解缓冲液(50 mM Tris HCl pH 7.4, 150 mM NaCl, 1 mM EDTA, 1%地黄皂苷,1 ×蛋白酶抑制剂)中均质后,使用带转柄的电动均质器从细胞中提取蛋白质。细胞裂解液在冰上孵育30分钟,然后离心17000 ×gydF4y2BaggydF4y2Ba在4°C下浸泡1分钟,以去除未破损的细胞和碎片。用Bradford法定量上清液中的蛋白质,并用于后续实验。gydF4y2Ba
对于膜蛋白提取,细胞在1 mL 0.1 M Na中均质gydF4y2Ba2gydF4y2Ba有限公司gydF4y2Ba3.gydF4y2BapH 11.5,使用带转杵的电动均质器,然后在冰上孵卵30分钟。均质液以435,400×离心gydF4y2BaggydF4y2Ba使用贝克曼转子TLA 120.1 1小时。颗粒组分在碱性缓冲液中重悬以达到均匀性。所有馏分保存在-80°C,直到进一步加工。gydF4y2Ba
cyp11a1相互作用蛋白的鉴定gydF4y2Ba
为了鉴定cyp11a1相互作用蛋白,将来自稳定克隆C1和C4的约4mg细胞裂解液置于500µL TBS (50 mM Tris pH 7.4, 150 mM NaCl)中,与100µL anti-FLAG M2或anti-HA亲和珠浆(Sigma Aldrich)孵育,在4°C下轻度摇晃过夜。离心8200×gydF4y2BaggydF4y2Ba用500µL TBS洗涤三次,时间为1 min。通过在200 ng/µL的3X FLAG (Sigma Aldrich)或1X HA肽(Sigma Aldrich)中孵育珠洗脱蛋白质,在4°C温和旋转1小时,然后以8200×离心gydF4y2BaggydF4y2BaSDS-PAGE分离样品进行Western blot分析。gydF4y2Ba
线粒体的分离gydF4y2Ba
使用哺乳动物细胞线粒体分离试剂盒(Thermo Scientific)从细胞中分离线粒体。简单来说,大约是4 × 10gydF4y2Ba7gydF4y2Ba700×离心裂解细胞,取细胞核gydF4y2BaggydF4y2Ba在4℃下放置10分钟。收集上清液,12000 ×离心gydF4y2BaggydF4y2Ba在4°C下放置15分钟。收集颗粒部分中的线粒体,清洗,再次以12000 ×离心gydF4y2BaggydF4y2Ba在4°C下加热5分钟。粒状线粒体溶解于样品缓冲液(50 mM Bis-Tris pH 7.2, 50 mM NaCl, 10% w/v甘油,0.001% Ponceau S)中。gydF4y2Ba
透射电子显微镜(TEM)gydF4y2Ba
在12孔细胞培养板中培养的细胞内衬Aclar膜(电子显微镜科学),用2.5%戊二醛固定20分钟,并用0.1 M碳酸钙缓冲液pH 7.2洗涤。细胞用1%锇固定30 min,蒸馏水清洗3次,再用1%乙酸铀酰固定30 min,再用蒸馏水清洗3次。然后依次在50%、70%、95%和100%乙醇中分别脱水5分钟,并用蒸馏水清洗3次。用Epon树脂将薄膜装入橡胶模具中,在65°C下孵育48小时。树脂块在超微切片机上用金刚石刀切成70 nm厚(Leica EM UC7)。将细胞切片置于网格上,然后用4%醋酸铀酰染色3分钟,柠檬酸铅染色10分钟。在120kv的Tecnai G2 Spirit TWIN (Thermo)透射电子显微镜上观察超薄切片。图像通过GATAN CCD SC1000 (4008 X 2672有源像素)相机采集,并用GATAN数字显微摄影软件进行处理。gydF4y2Ba
酶活性ELISA法测定gydF4y2Ba
为了检测CYP11A1的活性,稳定克隆C1, C4和对照用12.5µM 22-羟基胆固醇孵育过夜。P5采用ELISA试剂盒(LDN)检测。简单地说,将约50 μ L的细胞培养基移液到涂有兔抗p5抗体的微孔板中,然后加入100 μ L p5 -辣根过氧化物酶(HRP)偶联工作溶液。在孵育1小时后洗涤三次,向平板中加入150 μ L四甲基联苯胺和过氧化氢底物,再孵育15分钟。加入50 μ L 1m硫酸停止反应。P5含量用Emax Precision Microplate Reader (Molecular Devices)测量,用Softmax Pro 5.3分析。gydF4y2Ba
质谱分析gydF4y2Ba
采用基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱对亲和层析样品进行蛋白鉴定。采用凝胶消化和溶液消化两种方法。为了进行凝胶内消化,将考马斯染色凝胶中的条带切除,切成小块,用25 mM NH洗涤两次gydF4y2Ba4gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba样品在真空离心机中干燥前,用100%乙腈脱水。为了在溶液中消化,大约4µg蛋白质在真空离心机中冻干2-3小时。gydF4y2Ba
蛋白样品在30µL蒸馏水中重溶,在5 mM二硫苏糖醇、8 M尿素、pH为7.8的50 mM碳酸氢铵中37℃孵育1小时后还原。然后用15 mM碘乙酰胺在室温黑暗环境下烷基化30分钟,然后用12.5 ng/μL测序级改性胰蛋白酶在25 mM碳酸氢铵含10% v/v乙腈中37℃消化12-16小时。通过加入5%的甲酸来停止反应[gydF4y2Ba27gydF4y2Ba].用Millipore C18 Zip-tip除盐后,肽溶液用真空离心干燥,然后在30µL蒸馏水中溶解。gydF4y2Ba
质谱是用两台不同的仪器获得的。第一个光谱是在Bruker New UltrafleXtremeTM质谱仪上获得的,该质谱仪配备了以200 Hz速率工作的Nd-YAG激光器(255 nm)。将1µL蛋白质溶液与1µL基质(10 mg/mL α -氰基-4-羟基肉桂酸在50%乙腈/0.1%三氟乙酸中)直接混合在不锈钢MALDI板上并干燥。在20 kV加速电压的反射正离子模式下记录光谱。仪器用已知标准(卵白蛋白、血清白蛋白、肌红蛋白、细胞色素c、β-乳球蛋白和血管紧张素1)校准,准确度为5ppm。质谱通过平均2000次激光照射获得,数据使用Flex Analysis软件3.4 (Bruker, Daltonics)进行处理和分析。gydF4y2Ba
第二次MALDI-TOF质谱分析在正离子模式下延迟提取(反射模式),使用Bruker Autoflex III MALDI TOF/TOF质谱仪,配备200 Hz SmartBean激光器。取约0.5 μL上清液与0.5 μL基质溶液(5 mg/ml二氢苯甲酸0.1%TFA和30%乙腈)严格混合,各取0.3 μL等份沉积在384/600-μm MTP AnchorChip (Bruker Daltonics)上。使用FlexControl 3.4获取数据,并使用Flex-Analysis 3.4 (Bruker Daltonics)进行处理。数据通过Biotools 3.2 (Bruker)包进一步处理,访问在线Mascot服务器(gydF4y2Bawww.matrixscience.comgydF4y2Ba)根据Swiss-Prot或NCBI数据库识别相应的多肽。数据库搜索参数设置如下:半胱氨酸羧酰胺甲基化(固定修饰),蛋氨酸氧化(可变修饰),肽质量耐受60ppm,片段质量耐受0.7 Da, 2个缺失裂解。有代表性的质谱见附加文件gydF4y2Ba1gydF4y2Ba:图S1。gydF4y2Ba
聚丙烯酰胺凝胶电泳和Western blotgydF4y2Ba
将30µg蛋白质加载在12% SDS聚丙烯酰胺凝胶上,然后在90 V下电泳15分钟,然后在130 V下电泳2.5小时,直到蛋白质阶梯明显分离。对于蓝色天然凝胶电泳(BN-PAGE),在3-12% Bis-Tris gel (Novex)中加载约50µg线粒体蛋白。初始运行设定为150 V,持续45分钟,使用200 mL深考马斯蓝阴极缓冲液pH 6.8 (50 mM Bis-Tris, 50 mM Tricine, 10 mL 5% G-250考马斯蓝)和600 mL阳极缓冲液pH 6.8 (50 mM Bis-Tris, 50 mM Tricine)。初始运行后,将阴极缓冲液更换为200ml pH为6.8的轻度考马斯蓝缓冲液(50 mM Bis-Tris, 50 mM Tricine, 1 mL 5% G-250考马斯蓝),电压增加到250 V,持续1小时。gydF4y2Ba
蛋白质在1-L转移缓冲液(48 mM Tris, 39 mM甘氨酸,0.037% SDS, 20%甲醇)中的PVDF膜上转移,在80 V下转移2小时。对于蓝色天然凝胶,印迹上的蛋白质再用8%乙酸固定15分钟。gydF4y2Ba
印迹在5%的PBS- t pH值7.4的牛奶中被阻断(PBS中为0.1% Tween20),然后在4°C缓慢摇动下与一抗孵育过夜。PBS-T洗涤三次后,加入二抗,室温慢摇孵育1.5 h, PBS-T洗涤三次。免疫反应信号在生物成像系统(UVP Biospectrum 815)中使用增强的化学发光底物进行可视化。原始未裁剪的凝胶图片显示在附加文件gydF4y2Ba1gydF4y2Ba:无花果。S2-S9。gydF4y2Ba
耗氧量测量gydF4y2Ba
使用Seahorse XF Cell Mito压力测试试剂盒(Agilent)测量培养细胞的耗氧率。将约40000个细胞种在24孔XF24微孔板(Agilent)中,在加或不加多西环素的DMEM中培养6小时。在单层细胞培养达到约90%合流后,将细胞培养基替换为新添加1mm丙酮酸钠、2mm谷氨酰胺和10mm葡萄糖的Seahorse XF DMEM培养基,在37°C无CO条件下培养gydF4y2Ba2gydF4y2Ba在使用安捷伦海马分析仪测量耗氧量前1小时。细胞依次用0.5µM寡霉素、2µM羰基氰-4-三氟甲氧基苯腙和0.5µM鱼藤酮/抗霉素处理。使用Wave Software和Seahorse XF Cell Mito应力测试报告生成器对数据进行分析。gydF4y2Ba
量化和统计分析gydF4y2Ba
Western blot结果用Image J软件定量。对于嵴结构的定量,每个样本中计数超过50个细胞。数据以均值与标准差(SD)表示。未配对非参数gydF4y2BatgydF4y2Ba-test用于统计分析。N表示独立实验的个数。对于CYP11A1和MIC10复合物数量的相关性,通过绘制数据得到线性回归,并使用XY相关的非线性拟合进行分析。所有统计分析均使用GraphPad Prism8进行。gydF4y2Ba
结果gydF4y2Ba
CYP11A1将线粒体嵴改造成管状泡状gydF4y2Ba
我们在研究中使用COS1细胞,因为COS1细胞含有内源性肾上腺素还蛋白和肾上腺素还蛋白还原酶,这是类固醇合成电子传递链中的两种蛋白质[gydF4y2Ba24gydF4y2Ba].虽然COS1细胞不表达内源性CYP11A1,因此是非类固醇性的,但当COS1细胞表达CYP11A1时可以合成P5 [gydF4y2Ba24gydF4y2Ba].这一特性使COS1成为研究CYP11A1功能的理想细胞模型。gydF4y2Ba
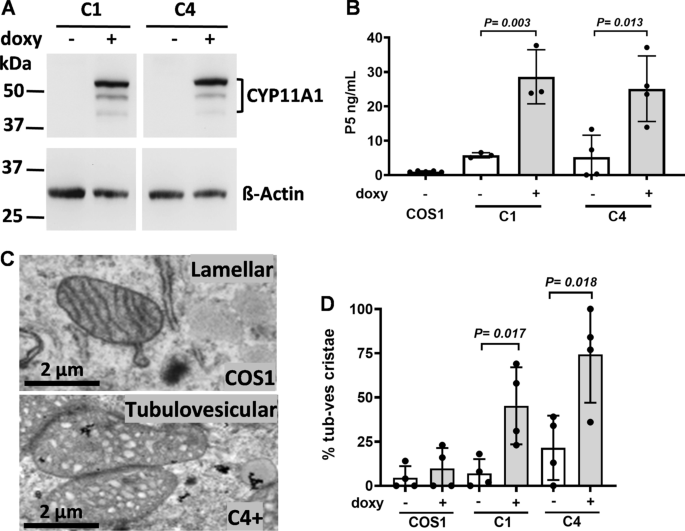
为了研究CYP11A1的功能,我们在COS1细胞中设计了一个四环素诱导的Tet-On系统,在四环素类似物多西环素存在的情况下诱导CYP11A1的表达。在这个系统中,细胞通常不表达外源蛋白。加强力霉素可诱导CYP11A1的表达。选择C1和C4两个独立的细胞克隆。免疫印迹试验证实,这些细胞仅在强力霉素存在时才表达CYP11A1(图。gydF4y2Ba1gydF4y2Ba一个)。gydF4y2Ba
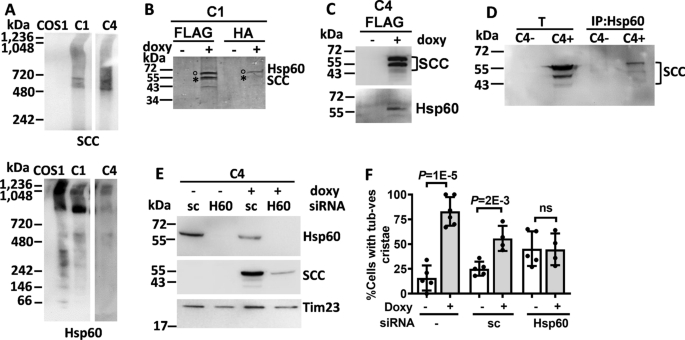
CYP11A1将线粒体嵴改造成管状泡状。gydF4y2Ba一个gydF4y2BaWestern blot显示,强力霉素(+ doxy)诱导C1和C4细胞中CYP11A1表达。gydF4y2BaBgydF4y2Ba在C1和C4细胞中,多西环素诱导CYP11A1后P5的产生量增加。gydF4y2BaCgydF4y2Ba多西环素诱导CYP11A1 (C4 +)后COS1细胞板层嵴和稳定克隆C4细胞小管泡嵴的TEM图像。gydF4y2BaDgydF4y2Ba透射电镜观察到,强力霉素诱导后,线粒体中含有管状泡嵴的细胞增多。未配对gydF4y2BatgydF4y2Ba-test,所示数据为均值与标准差gydF4y2Ba
为了测试过表达的CYP11A1是否具有功能,我们将细胞与底物22-羟基胆固醇孵育过夜,并检测用内源性电子供体产生的产物P5的数量。我们仅在C1和C4克隆中检测到多西环素诱导CYP11A1时P5的产生。这些实验表明,CYP11A1在这些细胞中的表达具有酶活性(图。gydF4y2Ba1gydF4y2BaB)。gydF4y2Ba
CYP11A1是线粒体蛋白。因此,我们在透射电镜下检测了正常和cyp11a1表达的COS1细胞的线粒体结构。COS1细胞中的线粒体含有平行状的板层嵴,而cyp11a1表达细胞克隆中的线粒体含有小管泡嵴,呈细长或球形囊泡(图)。gydF4y2Ba1gydF4y2BaC)。我们统计了含有板层状和小管泡嵴的细胞数量,在CYP11A1表达时发现含有线粒体的小管泡嵴细胞比例更高(图11a1)。gydF4y2Ba1gydF4y2BaD).这一结果表明,大量的CYP11A1使嵴从板层状向小管泡状转变。gydF4y2Ba
CYP11A1的crissta重塑在脊椎动物中是一种保守功能gydF4y2Ba
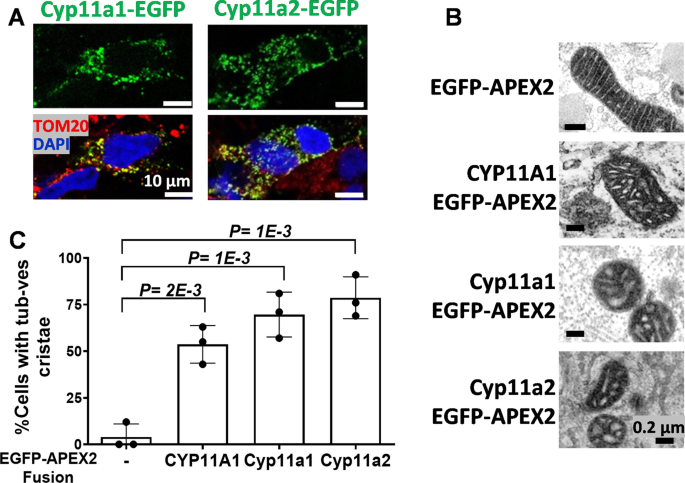
为了验证CYP11A1的嵴重塑功能在进化过程中是否保守,我们检测了人类CYP11A1的斑马鱼同源物。斑马鱼有两个这样的基因,gydF4y2Bacyp11a1gydF4y2Ba而且gydF4y2Bacyp11a2gydF4y2Ba[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].我们克隆了这两个cdna,并将它们放入与EGFP或EGFP- apex2融合的蛋白表达载体中。EGFP融合便于免疫荧光检测;APEX2具有抗坏血酸过氧化物酶活性,透射电镜下呈深色颗粒,有利于外源蛋白的检测[gydF4y2Ba30.gydF4y2Ba].将这些质粒瞬时转染到COS1细胞中,在荧光显微镜下观察过表达蛋白。斑马鱼Cyp11a1-EGFP和Cyp11a2-EGFP均以点状模式存在于线粒体中,并与线粒体蛋白TOM20共定位(图2)。gydF4y2Ba2gydF4y2BaA).过表达斑马鱼Cyp11a1-EGFP-APEX2和Cyp11a2-EGFP-APEX2在透射电镜下观察,也使线粒体嵴变为管状泡状(图11a2- egfp - apex2)。gydF4y2Ba2gydF4y2Ba此外,斑马鱼CYP11A1 - egfp - apex2或cyp11a2 - egfp - apex2表达细胞中含有较高比例的管状泡嵴,类似于人类CYP11A1(521)- egfp - apex2表达细胞(图。gydF4y2Ba2gydF4y2BaC).这一结果表明,从斑马鱼到人类,嵴重塑是CYP11A1的保守功能。gydF4y2Ba
CYP11A1的crissta重塑在脊椎动物中是一种保守的功能。gydF4y2Ba一个gydF4y2Ba在COS1细胞中转染斑马鱼Cyp11a1-EGFP和Cyp11a2-EGFP的免疫组化图像显示EGFP在线粒体中定位。TOM20(红色)是线粒体的标记物,DAPI(蓝色)是细胞核的标记物。gydF4y2BaBgydF4y2Ba经人CYP11A1和斑马鱼CYP11A1和Cyp11a2转染的COS1细胞线粒体的透射电镜图像融合到EGFP-APEX。gydF4y2BaCgydF4y2Ba透射电镜下小管泡结构的定量研究。每个样品的定量计数超过50个细胞。未配对gydF4y2BatgydF4y2Ba-test,所示数据为均值与标准差gydF4y2Ba
A '螺旋以CYP11A1为目标进入细胞膜并重塑线粒体嵴gydF4y2Ba
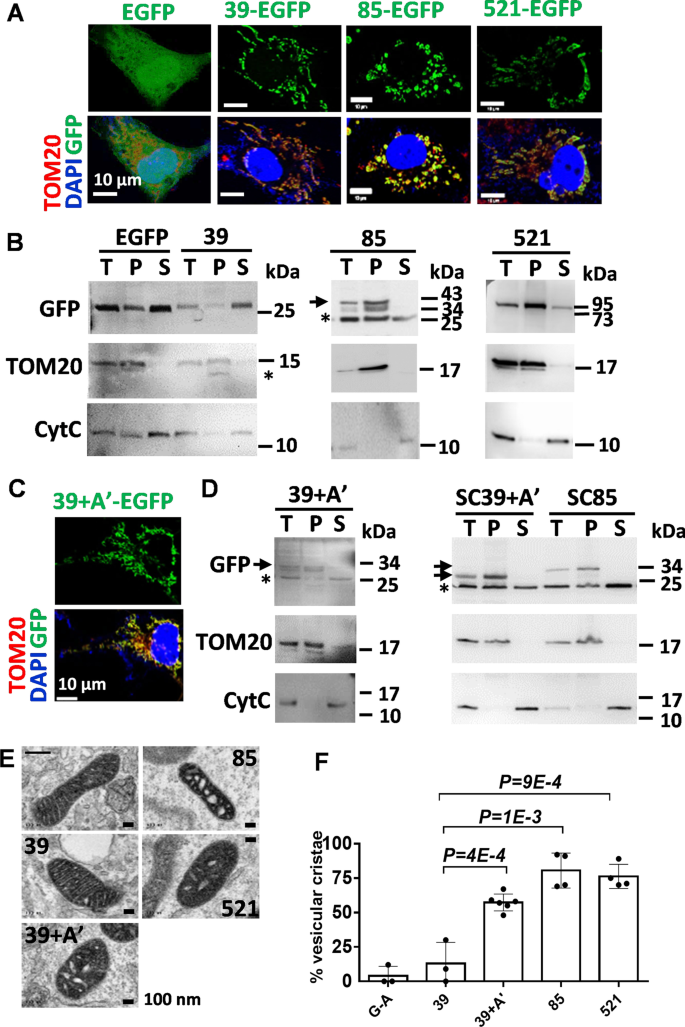
为了鉴定CYP11A1重构线粒体嵴的功能域,我们克隆了CYP11A1的不同片段gydF4y2BaCYP11A1gydF4y2BacDNA的框架与egfp编码序列。将这些质粒转染到COS1细胞中,使含有与EGFP融合的CYP11A1片段的蛋白过表达。单独的EGFP均匀地存在于细胞核和细胞质中(图。gydF4y2Ba3.gydF4y2BaA). EGFP融合n端片段(39-EGFP, AA # 1-39;85-egfp, aa # 1-85;然而,CYP11A1的521-EGFP, a# 1-521)定位于线粒体,如图所示,点状绿色荧光与线粒体标记蛋白TOM20共定位。gydF4y2Ba3.gydF4y2BaA).这些结果表明CYP11A1的n端具有线粒体靶向功能。gydF4y2Ba
A '螺旋以CYP11A1为目标进入细胞膜并重塑线粒体嵴。gydF4y2Ba一个gydF4y2Baegfp融合CYP11A1片段转染COS1细胞的免疫组化图像。gydF4y2BaBgydF4y2Ba碱性缓冲液提取和超离心分离后egfp融合CYP11A1片段免疫印迹。上清液中存在EGFP和39-EGFP(简称39)蛋白,颗粒中存在85-和521-EGFP蛋白。星号表示使用的抗体非特异性结合(T:总数;P:颗粒;S:上层清液)。TOM20是膜蛋白的对照,细胞色素c (Cyt c)是可溶性蛋白的对照。gydF4y2BaCgydF4y2Baegfp融合的CYP11A1信号肽(AA # 1-39)和锚定区A ' -螺旋(39 + A ' -EGFP)的免疫组化图像显示其在线粒体中的定位。TOM20(红色)是线粒体的标记物,DAPI(蓝色)是细胞核的标记物。gydF4y2BaDgydF4y2BaWestern blots检测瞬时转染(39 + A ')或稳定克隆(SC39 + A ')中egfp融合的CYP11A1片段与膜锚定区A ' -螺旋的分割。在稳定克隆体(SC85)中融合到a# 1-85的EGFP蛋白也进入颗粒。星号表示非特定波段(T:总;P:颗粒;S:上层清液)。gydF4y2BaEgydF4y2Ba转染人CYP11A1融合到EGFP-APEX2的各种片段的COS1细胞线粒体的透射电镜图像。仅转染EGFP-APEX2的COS1细胞用“-”符号表示。gydF4y2BaFgydF4y2Ba经透射电镜观察,A′型螺旋足以使嵴转变为小管泡状。所有蛋白片段都融合到EGFP-APEX (G-A)上。每个样品的定量计数超过50个细胞。未配对gydF4y2BatgydF4y2Ba-test,所示数据为均值与标准差gydF4y2Ba
CYP11A1是一种完整的膜蛋白。为了解决这些CYP11A1片段是否保留整合到线粒体膜的能力,我们检测了碱性提取后可溶性或膜部分中egfp融合的CYP11A1片段的存在。以线粒体膜蛋白TOM20作为膜部分的对照,以细胞色素c作为可溶性部分的对照。CYP11A1的前39个aa是线粒体靶向序列,蛋白质进入线粒体后被切割[gydF4y2Ba4gydF4y2Ba].虽然我们的Western blot在~ 25 kDa的位置总是有一个与游离EGFP蛋白带重叠的非特异性条带,但我们可以在表达39-EGFP蛋白的细胞的上清液中检测到EGFP信号强度增强(图2)。gydF4y2Ba3.gydF4y2BaB).这一结果与CYP11A1的前39个AAs作为线粒体靶向序列在线粒体输入时被切割的概念一致。85-和521-EGFP仅在颗粒部分中被检测到,表明它们与膜紧密相关(图。gydF4y2Ba3.gydF4y2BaB).这一发现表明CYP11A1的aa# 39-85可能具有有助于CYP11A1整合到线粒体膜的结构域。gydF4y2Ba
CYP11A1的晶体结构显示A ' -螺旋横跨AA # 57-68 [gydF4y2Ba5gydF4y2Ba],位于膜插入的候选区域(AA # 39-85)内。为了验证这一假设,我们将A ' -螺旋(AA # 57-68)与39-EGFP融合,形成39 + A ' -EGFP,并在COS1细胞中瞬时表达该蛋白。这种含有线粒体靶向序列的39 + A’-EGFP蛋白定位于线粒体,通过免疫荧光检测显示与TOM20共定位的点状外观(图2)。gydF4y2Ba3.gydF4y2BaC).在膜馏分中富集(图;gydF4y2Ba3.gydF4y2BaD)。为了进一步证实这一点,我们生成稳定过表达39 + A ' -EGFP (SC39 + A ')和85-EGFP (SC85)的COS1细胞。与上述观察相一致的是,这些含有A ' -螺旋的EGFP融合也在膜组分中被发现(图2)。gydF4y2Ba3.gydF4y2BaD).这些结果表明,A ' -螺旋和线粒体靶向序列AA # 1-39足以将乘客蛋白插入线粒体膜。gydF4y2Ba
为了检测这些CYP11A1片段对线粒体结构的影响,我们使用了与EGFP-APEX2标签融合的CYP11A1,以便于TEM下检测(图11)。gydF4y2Ba3.gydF4y2Ba虽然异位的EGFP-APEX2 (G-A)和39-EGFP-APEX2 (39-G-A)融合蛋白不影响线粒体板层嵴的结构,但在异位的39 + A ' -, 85-和521-G-A融合蛋白的细胞中发现了具有管状泡嵴的线粒体(图。gydF4y2Ba3.gydF4y2BaF).这些结果表明CYP11A1的A ' -螺旋可以介导膜关联和重构线粒体嵴。gydF4y2Ba
CYP11A1不改变线粒体呼吸活动gydF4y2Ba
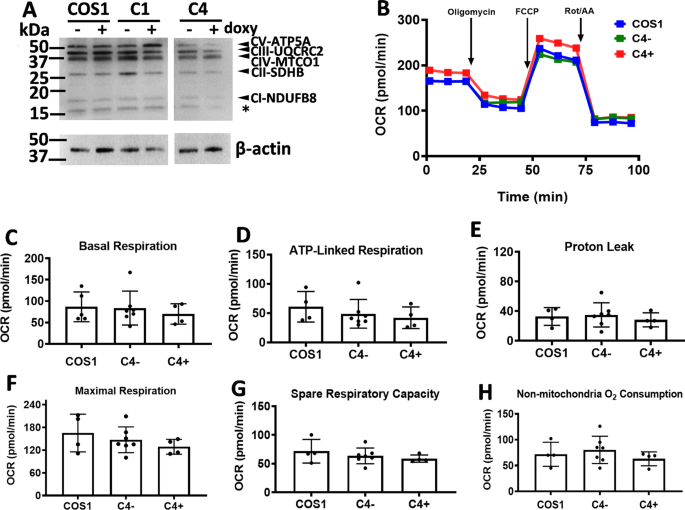
线粒体进行氧化磷酸化以产生能量。由于CYP11A1可将线粒体嵴从层状结构改造为管状-泡状结构,因此我们检查了CYP11A1过表达是否影响线粒体呼吸。首先,我们检测了cyp11a1表达稳定克隆C1和C4中呼吸复合物的表达,检测了每种复合物的蛋白亚基:NDUFB8(复合物1,CI)、SDHB(复合物II, CII)、UQCRC2(复合物III, CIII)、MTCO1(复合物IV, CIV)和ATP5A(复合物V, CV)。在CYP11A1过表达或未过表达的细胞中检测到相当数量的CI与CV复合物中的蛋白质(图11)。gydF4y2Ba4gydF4y2BaA).在海马分析仪中分析实时线粒体呼吸,我们发现使用或不使用强力霉素对C4细胞的总氧消耗没有显著变化(图。gydF4y2Ba4gydF4y2BaB).个体线粒体呼吸参数,包括基础呼吸(图;gydF4y2Ba4gydF4y2BaC), atp连锁呼吸作用(图;gydF4y2Ba4gydF4y2BaD),质子泄漏(图;gydF4y2Ba4gydF4y2BaE),最大呼吸(图;gydF4y2Ba4gydF4y2BaF),备用呼吸量(图;gydF4y2Ba4gydF4y2BaG)和非线粒体耗氧量(图;gydF4y2Ba4gydF4y2BaH)也没有显著改变CYP11A1过表达。此外,呼吸超复合体的形成(附加文件gydF4y2Ba1gydF4y2Ba:图S10)和线粒体膜电位(附加文件gydF4y2Ba1gydF4y2Ba:图S11)也没有变化。因此,CYP11A1过表达似乎不影响COS1细胞的线粒体呼吸。我们的数据与报告一致,显示类固醇源性合胞滋养层细胞及其前体细胞滋养层细胞具有类似的利用氧气生产ATP的能力[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
Hsp60与CYP11A1共同诱导线粒体嵴重塑gydF4y2Ba
CYP11A1常以复合物形式存在[gydF4y2Ba31gydF4y2Ba].我们通过蓝色天然聚丙烯酰胺凝胶电泳(BN-PAGE)检测了CYP11A1配合物的大小,发现它存在于480 ~ 720 kDa之间的少数超级配合物中(图11)。gydF4y2Ba5gydF4y2BaA).这表明CYP11A1可能与细胞内不同的蛋白质相互作用形成多个复合物。为了寻找CYP11A1相关蛋白,我们用抗flag或抗ha珠免疫沉淀C1和C4细胞裂解液中的CYP11A1及其相关蛋白。从FLAG或HA珠中洗脱的蛋白质在提交质谱分析之前用溶液或凝胶消化处理。进行了8次溶液消化进行质谱分析,在所有8次实验中我们都鉴定出了Hsp60,基因名gydF4y2Ba热休克蛋白家族成员DgydF4y2Ba(gydF4y2BaHSPD1gydF4y2Ba)作为主要的cyp11a1相关蛋白(表gydF4y2Ba1gydF4y2Ba).此外,抗flag和抗ha免疫沉淀的凝胶分析显示,考马斯蓝染色在表达cyp11a1的细胞中检测到两到三个主要条带(图11)。gydF4y2Ba5gydF4y2BaB).这些蛋白条带的质谱分析显示,一条明显的条带为CYP11A1,另一条为Hsp60。因此,我们使用了两种不同的免疫方法来确认Hsp60是cyp11a1相互作用的蛋白。抗flag免疫沉淀的免疫印迹分析证实了CYP11A1和Hsp60的存在(图2)。gydF4y2Ba5gydF4y2BaC)。反过来,用抗hsp60抗体免疫沉淀细胞裂解液,然后进行免疫印迹分析,在多西环素诱导细胞时,也检测到免疫沉淀中有CYP11A1(图。gydF4y2Ba5gydF4y2BaD).因此,我们确认了Hsp60和CYP11A1之间的相互作用。这一结果与之前的一份报告一致,该报告显示Hsp60和CYP11A1相互作用[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
Hsp60与CYP11A1共同诱导线粒体嵴重塑。gydF4y2Ba一个gydF4y2Ba采用天然蓝色凝胶,免疫印迹检测CYP11A1(简称SCC)和从CYP11A1稳定克隆线粒体中分离的Hsp60。SCC和Hsp60复合物分别在480 ~ 720 kDa和~ 900 kDa左右形成。gydF4y2BaBgydF4y2BaFLAG考马斯氏染色凝胶和稳定克隆C1的HA免疫沉淀。质谱分析显示,底带为CYP11A1 (SCC,星号标记),顶带为Hsp60(圈标记)。gydF4y2BaCgydF4y2BaWestern blot显示,用强力霉素(doxy)诱导C4细胞后,FLAG珠中洗脱的蛋白含有CYP11A1 (SCC)和Hsp60。gydF4y2BaDgydF4y2Ba多西环素(+ doxy)诱导C4裂解物,Hsp60抗体免疫沉淀后,SCC出现。T:总分数,IP: Hsp60免疫沉淀。gydF4y2BaEgydF4y2BaWestern blot显示C4细胞中Hsp60 siRNA (H60)的缺失。在Hsp60耗竭后,CYP11A1 (SCC)的数量减少。以siRNA (sc)和Tim23为阴性对照和加载对照。gydF4y2BaFgydF4y2Ba在稳定克隆C4中,透射电镜观察到siRNA对Hsp60的耗竭消除了强力霉素对线粒体管状嵴的诱导。未配对gydF4y2BatgydF4y2Ba-test,所示数据为均值与标准差gydF4y2Ba
我们通过BN-PAGE和免疫印迹进一步分析了Hsp60复合物,发现Hsp60存在于大小为> 900 kDa的复合物中(图2)。gydF4y2Ba5gydF4y2BaA).这一结果与Hsp60作为分子伴侣存在于大型蛋白复合物中的功能一致[gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
为了了解Hsp60- cyp11a1相互作用的作用,我们在C4细胞中进行了si- rna介导的Hsp60耗竭。用打乱siRNA (sc)作为阴性对照。当Hsp60被H60-siRNA耗尽时,也检测到CYP11A1数量的减少(图6)。gydF4y2Ba5gydF4y2BaE).这一结果表明线粒体CYP11A1的积累需要Hsp60。这一结果与早期发现的Hsp60促进孕激素合成一致[gydF4y2Ba32gydF4y2Ba].gydF4y2Ba
然后用透射电镜分析线粒体形态。与之前的数据一致,在存在或不存在对照sc时,在表达cyp11a1的细胞中发现了高比例的具有管状泡嵴的线粒体(图。gydF4y2Ba5gydF4y2BaF).然而,Hsp60的缺失完全削弱了CYP11A1过表达的效果(图。gydF4y2Ba5gydF4y2BaF).因此,在CYP11A1诱导的线粒体嵴重塑中,Hsp60是必需的。gydF4y2Ba
CYP11A1复合物过表达时,MICOS10复合物减少gydF4y2Ba
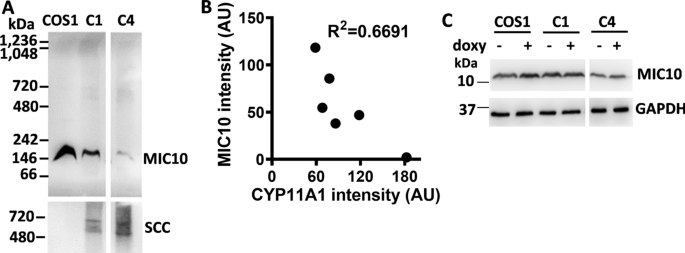
为了进一步了解cyp11a1调控的嵴重塑机制,我们检测了线粒体接触位点和嵴组织系统(MICOS)中的蛋白质,MICOS组织线粒体内膜以形成线粒体嵴[gydF4y2Ba18gydF4y2Ba].MICOS复合物分为MIC60和MIC10亚复合物[gydF4y2Ba17gydF4y2Ba].BN-PAGE在表达cyp11a1的C1和C4细胞中检测到~ 200-kDa MIC10复合物的数量减少(图11)。gydF4y2Ba6gydF4y2BaA),但MIC60复合物的量没有改变(数据未显示)。为了进一步证实这一点,我们使用Image J软件量化了CYP11A1表达C4细胞中CYP11A1-和mic10免疫反应复合物的强度,并将六个独立实验的结果绘制在图表上。每个点代表一个独立实验的结果。这些点拟合线性回归,含mic10的复合物数量与含cyp11a1的复合物数量呈负相关。(无花果。gydF4y2Ba6gydF4y2BaB).通过SDS-PAGE检测MIC10单体的表达没有变化(图。gydF4y2Ba6gydF4y2BaC).上述结果表明,CYP11A1过表达并没有改变MIC10单体的数量,而是减少了MIC10复合物的形成。gydF4y2Ba
CYP11A1复合物过表达时MIC10亚复合物减少。gydF4y2Ba一个gydF4y2Ba从过表达CYP11A1的稳定克隆的线粒体中分离蛋白复合物后,用免疫印迹法检测MIC10和CYP11A1复合物。单元格的名称写在每个车道的顶部。CYP11A1过表达与MIC10复合物降低相关。gydF4y2BaBgydF4y2Ba以任意单位(AU)定量表达CYP11A1的C4细胞中MIC10和CYP11A1复合物的带强度。图中显示CYP11A1与MIC10复合物呈反比关系。gydF4y2BaCgydF4y2Ba通过SDS-PAGE分离的蛋白质Western blot显示,在存在(+)或不存在(−)强力霉素诱导的稳定克隆中,MIC10单体数量不变gydF4y2Ba
讨论gydF4y2Ba
在这篇文章中,我们研究了CYP11A1在线粒体膜内的作用,以及它在类固醇合成中的已知功能。我们发现,CYP11A1的A '螺旋结构足以将CYP11A1带入细胞膜,并将线粒体嵴从板层状转变为小管泡状。我们还发现CYP11A1与Hsp60相互作用。CYP11A1可能通过减少线粒体嵴连接处MIC10复合物的数量来重塑嵴。因此,我们描述了Hsp60和MIC10在这一过程中的参与。gydF4y2Ba
当检查CYP11A1的新作用等基因功能时,应同时使用功能丧失和功能获得测试。CYP11A1是类固醇细胞的标记物。如我们之前的论文所示,缺乏CYP11A1的细胞不再是类固醇性的[gydF4y2Ba34gydF4y2Ba].我们以前也证明,类固醇细胞的线粒体在缺乏CYP11A1时缺乏可识别的嵴[gydF4y2Ba22gydF4y2Ba].这些论文为CYP11A1在类固醇生成和线粒体嵴形成中的作用提供了功能丧失的证据。现在,我们使用功能增益测试进一步研究CYP11A1这种新作用的机制。我们在COS1细胞中过表达CYP11A1,并表明这些细胞现在产生第一个类固醇产物P5,并且它们的线粒体嵴变成管状泡状,与类固醇生成细胞相同。因此,功能获得和功能丧失试验均证实CYP11A1在调节线粒体嵴结构中的作用。gydF4y2Ba
类固醇产生细胞中小管泡嵴的形成与它们类固醇产生能力的增加和CYP11A1表达的增加是平行的[gydF4y2Ba4gydF4y2Ba].这发生在肾上腺中类固醇原细胞从颗粒向束状分化的过程中[gydF4y2Ba8gydF4y2Ba],在卵巢中由颗粒细胞变为黄体细胞[gydF4y2Ba12gydF4y2Ba],在胎盘中从细胞滋养层细胞到合胞滋养层细胞[gydF4y2Ba9gydF4y2Ba].可见,囊泡膜的形成有利于膜在小空间内堆积,以便蛋白质有效对接,以及疏水胆固醇和类固醇在膜内扩散[gydF4y2Ba21gydF4y2Ba].在体内,大量的CYP11A1似乎是嵴重塑所必需的,尽管当少量的CYP11A1存在时,一些类固醇已经产生。gydF4y2Ba
类固醇样细胞的特征是CYP11A1丰富,囊泡嵴膜致密,类固醇合成充足;这三个特征是紧密相关的。CYP11A1可以通过其酶活性和重塑膜的能力触发类固醇的产生,导致类固醇生成细胞的最终分化和成熟。这一步也完成了细胞分化的最后一步,使类固醇细胞完全具备了在完全分化时产生大量类固醇的能力。gydF4y2Ba
由于嵴形状的改变依赖于膜的扰动,因此可能需要在膜中插入足够的CYP11A1以获得足够的膜。CYP11A1需要膜插入来重塑嵴。CYP11A1通过A ' -螺旋和F-G环两个假定的锚定区域锚定在线粒体内膜[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在这里,我们展示了一个锚定区域,A ' -螺旋,足以将CYP11A1插入线粒体内膜并重塑嵴。我们没有严格测试F-G环的作用,因为它在我们的缺失实验中似乎是可可可无的,因为在我们的初步测试中,含有F-G环的蛋白质片段的过表达会导致蛋白质聚集。而F-G环在A ' -螺旋结构失效的情况下,仍具有类似A ' -螺旋结构的膜锚定和嵴重塑功能。CYP11A1可能具有多个结构域,以确保适当的膜插入和重构。当一项功能对生存非常重要时,这种冗余策略经常被生物使用。然而,这种可能性还有待检验。gydF4y2Ba
Hsp60是一种调节线粒体蛋白折叠和组装的伴侣蛋白[gydF4y2Ba35gydF4y2Ba].此外,它通过与胆固醇结合并与StARD3和CYP11A1相互作用来促进孕激素的合成[gydF4y2Ba32gydF4y2Ba].我们的结果显示,Hsp60的缺失导致CYP11A1的减少,这与Hsp60作为伴侣的作用是一致的。此外,CYP11A1依赖于Hsp60将嵴从板层状结构改造为小管泡状结构。这可能是因为CYP11A1的丰富积累需要Hsp60,而CYP11A1的丰富对于嵴重塑是必要的。gydF4y2Ba
我们注意到,当细胞过表达CYP11A1时,Hsp60的数量会减少(图2)。gydF4y2Ba5gydF4y2BaA, E).似乎存在一种反馈机制,调节细胞中Hsp60和CYP11A1的数量以达到平衡。这种反馈抑制的控制机制目前尚不清楚,值得进一步研究。gydF4y2Ba
线粒体嵴受线粒体内膜的线粒体接触位点和嵴组织系统(MICOS)的调控。在这里我们发现,当CYP11A1过表达时,MIC10亚复合物的数量减少,尽管单体MIC10的表达没有变化。因此,CYP11A1锚定在线粒体内膜可能导致MIC10亚复合物的溶解或移位。CYP11A1可能不是唯一可以从膜上取代MICOS复合物的分子。当MICOS移位时,嵴会受到干扰。因此,任何占据嵴取代MICOS的蛋白质都可能改变嵴结构。任何大量插入线粒体内膜的蛋白质都可能形成膜的形态。例如线粒体呼吸复合体V,它位于胎盘合胞滋养层细胞的线粒体内膜,并将膜改变为囊泡状[gydF4y2Ba21gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
我们发现线粒体膜中MIC10亚复合物的减少解释了cyp11a1依赖性线粒体嵴重塑的机制。我们还发现A ' -螺旋结构足以用于膜插入和嵴重构,这为CYP11A1重组线粒体嵴的机制提供了进一步的信息。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用。gydF4y2Ba
缩写gydF4y2Ba
- CYP11A1:gydF4y2Ba
-
细胞色素P450 11A1gydF4y2Ba
- Hsp60:gydF4y2Ba
-
热休克蛋白60gydF4y2Ba
- 谱:gydF4y2Ba
-
基质辅助激光解吸/电离gydF4y2Ba
- TOF:gydF4y2Ba
-
飞行时间gydF4y2Ba
- mico:gydF4y2Ba
-
线粒体接触部位和嵴组织系统gydF4y2Ba
- 女士:gydF4y2Ba
-
质谱分析gydF4y2Ba
- P5:gydF4y2Ba
-
孕烯醇酮gydF4y2Ba
- 鳞状细胞癌:gydF4y2Ba
-
侧链裂解酶gydF4y2Ba
- sc:gydF4y2Ba
-
炒核gydF4y2Ba
- 透射电镜:gydF4y2Ba
-
透射电子显微镜gydF4y2Ba
- AA:gydF4y2Ba
-
氨基酸gydF4y2Ba
参考文献gydF4y2Ba
米勒,王伟,奥库斯。人体类固醇生成及其紊乱的分子生物学、生物化学和生理学。Endocr Rev. 2011; 32:81-151。gydF4y2Ba
米勒王。综述:电子转移调控甾体生成。内分泌学。2005;146:2544-50。gydF4y2Ba
王晓明,王晓明,王晓明。线粒体细胞色素P-450scc。肾上腺还肽电子传递机制研究。生物化学杂志,1980;255:3057-61。gydF4y2Ba
钱燕,葛丽珊,钟耀华。CYP11A1在线粒体中的功能。中国生物医学工程学报,2017;gydF4y2Ba
Strushkevich N, MacKenzie F, Cherkesova T, Grabovec I, Usanov S, Park HW。线粒体单加氧酶系统生物合成孕烯醇酮的结构基础。中国科学院学报(自然科学版),2011;gydF4y2Ba
海德兰MJ,威尔斯MC,塔基RC。细胞色素P450scc (CYP11A1)的F-G环区域与磷脂膜相互作用。生物化学学报,2003;1617:96-108。gydF4y2Ba
Pikuleva IA。假定的F-G环在P450scc (P450 11A1)中与膜有关。《细胞内分泌学报》2004;215:161-4。gydF4y2Ba
杨晓明,王晓明,王晓明,等。大鼠细胞色素P-450胆固醇侧链裂解抗血清的制备及其在蛋白a -金技术中免疫活性酶超微结构定位的应用。内分泌学。1986;118:1353 - 65。gydF4y2Ba
马丁内斯F,基里阿基杜M,施特劳斯JF 3。与滋养层分化相关的线粒体结构和功能变化:分离合胞滋养层线粒体富集制剂的方法。内分泌学。1997;138:2172 - 83。gydF4y2Ba
Dhariwal MS, Kowluru RA, Jefcoate CR.细胞色素P-450scc通过促肾上腺素结合位点的二次相互作用诱导囊泡聚集(与蛋白质交换竞争)。生物化学。1991;30:4940-9。gydF4y2Ba
克尔简森-巴顿。人类睾丸生精上皮和管间组织的超微结构。电子工程学报,2001;19(3):326 - 326。gydF4y2Ba
蒋艳芳,余福生,布迪一平,赵春春,付春春。山羊大黄体细胞系卵泡发生和黄体形成过程中线粒体三维结构的动态变化。科学通报2021;11:15564。gydF4y2Ba
Cogliati S, Enriquez JA, Scorrano L.线粒体嵴:美丽与功能相遇的地方。生物化学学报,2016;41:261-73。gydF4y2Ba
邓勇,陈志伟,陈志伟,等。短食诱导混沌卡罗莱纳变形虫抗氰化物呼吸和氧化应激:线粒体膜立方结构转变的意义。原生质。2002;219:160-7。gydF4y2Ba
Scorrano L, Ashiya M, Buttle K, Weiler S, Oakes SA, Mannella CA, Korsmeyer SJ。在细胞凋亡过程中,一个独特的途径重塑线粒体嵴和动员细胞色素c。开发细胞,2002;2:55-67。gydF4y2Ba
Kondadi AK, Anand R, Hansch S, Urbach J, Zobel T, Wolf DM, Segawa M, Liesa M, Shirihai OS, Weidtkamp-Peters S, Reichert AS。嵴以micos依赖的方式经历连续的膜重塑周期。EMBO代表2020;21:e49776。gydF4y2Ba
王志刚,王志刚,王志刚。线粒体接触位点和嵴组织系统在膜结构和动力学中的作用。生物物理学报,2017;1864:737-46。gydF4y2Ba
Stephan T, Bruser C, Deckers M, Steyer AM, Balzarotti F, Barbot M, Behr TS, Heim G, Hubner W, Ilgen P,等。MICOS组装控制线粒体内膜重塑和嵴连接重分布,从而介导嵴形成。EMBO J. 2020;39: e104105。gydF4y2Ba
Bohnert M, Zerbes RM, Davies KM, Muhleip AW, Rampelt H, Horvath SE, Boenke T, Kram A, Perschil I, Veenhuis M,等。Mic10在线粒体接触部位和嵴组织系统中的中心作用。Cell Metab. 2015; 21:747-55。gydF4y2Ba
Friedman JR, Mourier A, Yamada J, McCaffery JM, Nunnari J. MICOS与呼吸复合物和脂质协调建立线粒体内膜结构。Elife。2015;4:e0773。gydF4y2Ba
De los Rios Castillo D, Zarco-Zavala M, Olvera-Sanchez S, Pardo JP, Juarez O, Martinez F, Mendoza-Hernandez G, Garcia-Trejo JJ, Flores-Herrera O.人合胞滋养细胞线粒体的非典型嵴形态:复合物的作用。中国生物医学杂志,2011;gydF4y2Ba
黄昌昌,施振昌,许忠宁,钱勇,钟耀明。胎儿糖皮质激素的合成是胎儿肾上腺髓质发育和下丘脑反馈抑制所必需的。内分泌学。2012;153:4749-56。gydF4y2Ba
Ishii T, Hasegawa T, Pai CI, Yvgi-Ohana N, Timberg R, Zhao L, Majdic G, Chung BC, Orly J, Parker KL.循环高密度脂蛋白和营养激素在缺乏类固醇激素急性调节蛋白敲除小鼠表型中的作用。分子内分泌。2002;16:2297-309。gydF4y2Ba
Zuber MX, Mason JI, Simpson ER, Waterman MR.用线粒体和微粒体类固醇羟化酶同时转染COS-1细胞:将类固醇生成途径纳入非类固醇生成细胞。中国科学院学报(自然科学版),1998;gydF4y2Ba
Chung BC, Matteson KJ, Voutilainen R, Mohandas TK, Miller WL。人胆固醇侧链裂解酶,P450scc: cDNA克隆,基因分配到15号染色体,并在胎盘表达。中国科学院学报(自然科学版),1986;gydF4y2Ba
岛田M,陈文文,中代T, Onikubo T, Guermah M, Rhodes D, Roeder RG。基因特异性H1通过转录激活因子- >p300 - >NAP1 - >H1途径驱逐。Mol Cell, 2019; 74:268-83。gydF4y2Ba
舍甫琴科A, Tomas H, Havlis J, Olsen JV, Mann M.蛋白质和蛋白质组的质谱表征的凝胶消解。Nat Protoc 2006; 1:2856-60。gydF4y2Ba
Parajes S, Griffin A, Taylor AE, Rose IT, Miguel-Escalada I, Hadzhiev Y, Arlt W, Shackleton C, Muller F, Krone N.通过对关键酶cyp11a2的特征重新定义斑马鱼肾间激素发生的起始和维持。内分泌学。2013;154:2702-11。gydF4y2Ba
徐海杰,肖鹏,郭文伟,钟崇明。斑马鱼cyp11a1作为母体转录本和卵黄合胞层的表达。基因表达模式。2002;2:19 19 - 22。gydF4y2Ba
Lam SS, Martell JD, Kamer KJ, Deerinck TJ, Ellisman MH, Mootha VK, Ting AY。APEX2的定向进化用于电子显微镜和接近标记。Nat Methods. 2015; 12:51-4。gydF4y2Ba
Schwarz D, Chernogolov A, Kisselev P.通过EPR和ST-EPR旋转扩散实验证明,囊泡重建线粒体细胞色素P450系统(CYP11A1和CYP11B1)中复合物的形成。生物化学,1999;38:9456 - 64。gydF4y2Ba
Monreal-Flores J, Espinosa-Garcia MT, Garcia-Regalado A, Arechavaleta-Velasco F, Martinez F.热休克蛋白60促进JEG-3细胞线粒体孕酮合成。生殖生物学,2017;17:154-61。gydF4y2Ba
Okamoto T, Ishida R, Yamamoto H, Tanabe-Ishida M, Haga A, Takahashi H, Takahashi K, Goto D, Grave E, Itoh H.哺乳动物野生型HSP60的功能结构和生理功能。生物化学学报。2015;56:10 - 9。gydF4y2Ba
胡mc,徐忠宁,埃尔哈吉NB,派慈,朱hp,王ck,钟BC。靶向破坏Cyp11a1的小鼠类固醇缺乏综合征。分子内分泌。2002;16:43 - 50。gydF4y2Ba
Henderson B, Fares MA, Lund PA。伴侣蛋白60:一个矛盾的,进化上保守的蛋白质家族,具有多种兼职功能。生物学报,2013;88:955-87。gydF4y2Ba
确认gydF4y2Ba
我们要感谢Yu Chien, Chia-Ying Lee和Siang-Yun Lee对CYP11A1和线粒体嵴的初步描述,Wen-Chih Lee指导海马实验,Sue-Ping Lee和Wen-Li Pon在免疫荧光和透射电子显微镜方面的协助,Kathleen Joyce Carillo的化学研究所和中央研究院小分子质谱设备(AS-CFII-111-205),与中国科学院分子生物学研究所生物物理核心质谱分析装置进行质谱分析。我们感谢万陈超、台湾小鼠诊所、中央研究院及台湾动物协会对海马分析仪的技术支持,感谢中央研究院核心设备及创新仪器计划(AS-CFII-111-211)资助的生物医学研究所DNA测序核心设备用于DNA测序。gydF4y2Ba
资金gydF4y2Ba
这项工作得到了中央研究院(AS-107-TP-L08),台湾科技部(MOST 107-2321-B-001-034 - BcC和110-2320-B-A49A-533-MY3 - WYC)和国家卫生研究所(NHRI- EX107-10506SI)的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
KR设计、执行和分析实验,WYC生成可诱导的cyp11a1过表达克隆,BcC获得资金,设计实验,并监督项目的执行。KR、WYC和BcC撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们之间没有任何利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
本研究使用的主要资源。gydF4y2Ba图S1。gydF4y2Ba免疫沉淀(IP)后质谱分析含(C1 +)和不含CYP11A1 (C1-)的稳定克隆C1。(A)从质量分析的蛋白质洗脱峰对应的肽谱。(B) CYP11A1和Hsp60序列。MALDI-TOF鉴定的多肽以红色显示。gydF4y2Ba图S2。gydF4y2Ba图未裁剪的原始数据。gydF4y2Ba1gydF4y2BaA. Western blot显示,强力霉素(doxy)诱导CYP11A1过表达的稳定克隆C1和C4。方框表示由相应抗体识别的条带。β-肌动蛋白作为负荷对照。gydF4y2Ba图S3。gydF4y2Ba图未裁剪的原始数据。gydF4y2Ba2gydF4y2BaA.在COS1细胞中转染斑马鱼Cyp11a1-EGFP和Cyp11a2-EGFP的免疫组化图像显示EGFP在线粒体中的定位。TOM20(红色)是线粒体的标记物,DAPI(蓝色)是细胞核的标记物。方框标记图中所示的图像。gydF4y2Ba2gydF4y2Ba一个。gydF4y2Ba图S4。gydF4y2Ba图未裁剪的原始免疫荧光数据。gydF4y2Ba3.gydF4y2Ba.在COS1细胞中转染cyp11a1片段-EGFP的免疫组化图像显示EGFP在线粒体中的定位。TOM20(红色)是线粒体的标记物,DAPI(蓝色)是细胞核的标记物。方框标记图中所示的图像。gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba图S5。gydF4y2Ba图未裁剪的原始免疫印迹数据。gydF4y2Ba3.gydF4y2BaB.碱性缓冲液提取和超离心后,免疫印迹检测egfp融合的CYP11A1片段和锚定区(A’)的分配情况。上清液中存在EGFP和39-EGFP(简称39)蛋白,颗粒中存在85-和521-EGFP蛋白。星号表示使用的抗体非特异性结合(T:总数;P:颗粒;S:上层清液)。TOM20是膜蛋白的对照,细胞色素c (Cyt c)是可溶性蛋白的对照。方框标记图中所示的带。gydF4y2Ba3.gydF4y2BaB。gydF4y2Ba图S6。gydF4y2Ba图未裁剪的原始免疫印迹数据。gydF4y2Ba3.gydF4y2BaD. Western blots检测稳定克隆(SC)中egfp融合CYP11A1片段的分割。EGFP蛋白融合到a# 1-39 +锚定区(SC39 + A ')和a# 1-85 (SC85)也进入颗粒。星号表示非特定波段(T:总数;P:颗粒;S:上层清液)。方框标记图中所示的带。gydF4y2Ba3.gydF4y2BaD。gydF4y2Ba图S7。gydF4y2Ba图未裁剪的原始免疫印迹数据。gydF4y2Ba4gydF4y2BaA. Western blot显示,CYP11A1 (C1, C4)稳定克隆的电子传递复合物(CI-CV)的成分数量相似,无论是否诱导CYP11A1。β-肌动蛋白作为负荷对照。方框表示每个样本使用的抗体检测到的条带。星号表示非特定波段。gydF4y2Ba图S8。gydF4y2Ba图未裁剪的原始免疫印迹数据。gydF4y2Ba5gydF4y2Baa e。验证CYP11A1和Hsp60的相互作用以及Hsp60耗竭对CYP11A1的影响。方框标记图中所示的带。gydF4y2Ba5gydF4y2Ba.gydF4y2Ba图S9。gydF4y2Ba图未裁剪的原始免疫印迹数据。gydF4y2Ba6gydF4y2BaA和C. CYP11A1和Mic10复合物的反比关系。方框标记图中所示的带。gydF4y2Ba6gydF4y2Ba.图S9。CYP11A1和Mic10复合物的反比关系。(A)通过蓝源凝胶电泳,从过表达CYP11A1的稳定克隆的线粒体中分离出蛋白质复合物后,Western Blot显示MIC10和SCC复合物。Mic10复合物的减少表现为诱导的CYP11A1复合物的条带强度降低。(B) SDS-PAGE分离的蛋白质Western blot显示,在稳定克隆(C1, C2, C4)中存在(+)或不存在(−)强力霉素(doxy)诱导时,稳定克隆中MIC10数量不变。星号表示非特定波段。gydF4y2Ba图S10。gydF4y2Ba使用稳定克隆C4的电子超络合物的BN-PAGE。在COS1和C4中检测到含有(+)和不含(-)强力霉素(doxy)的电子超复合物。电子超复合物的可见光带用折线标记。gydF4y2Ba图S11。gydF4y2BaCYP11A1稳定克隆中线粒体膜电位的测定。A.强力霉素(doxy)诱导蛋白过表达后COS1、C1和C4细胞的荧光图像。GFP(绿色)为强力霉素诱导后CYP11A1的存在。TMRM染色(红色)显示线粒体膜电位。(B).对TMRM强度进行量化和比较。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
罗莎,k.g.,陈,WY。&钟,Bc。CYP11A1的A '螺旋重组线粒体嵴。gydF4y2Ba生物科学gydF4y2Ba29gydF4y2Ba, 61(2022)。https://doi.org/10.1186/s12929-022-00846-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12929-022-00846-7gydF4y2Ba
关键字gydF4y2Ba
- 类固醇生成gydF4y2Ba
- 孕烯醇酮gydF4y2Ba
- P450sccgydF4y2Ba
- Hsp60gydF4y2Ba
- 膜gydF4y2Ba
- MIC10gydF4y2Ba
- 线粒体结构gydF4y2Ba
- 嵴重构gydF4y2Ba