摘要
背景
严重皮肤药物不良反应(scar)是一组因对某些药物的免疫反应而引起的严重临床疾患。人类白细胞抗原HLA-B*13:01的等位基因变异与氨苯砜(DDS)诱导的超敏反应密切相关。T细胞受体介导的细胞毒性T淋巴细胞(ctl)活化也被认为在scar的发病机制中发挥重要作用。然而,HLA-B*13:01-DDS-TCR免疫突触在药物诱导超敏反应综合征(DIHS)相关T细胞激活中起作用仍未确定。
方法
为了研究HLA-B*13:01在氨苯砜诱导的药物超敏反应(DDS-DIHS)发病中的分子机制,我们通过结晶和扩展药物特异性CTLs分析DDS-DIHS的病理作用。
结果
结果表明,HLA-B*13:01- β -2-微球蛋白(β2M)复合物的晶体结构分辨率为1.5 Å,突变分析表明,HLA-B*13:01的I118或I119以及R121是介导DDS结合的关键残基。随后的单细胞TCR和RNA测序表明,由成对的TRAV12-3/TRBV28克隆型和共享CDR3区域组成的TCRs特异性识别HLA-B*13:01-DDS复合体,触发与DDS-DIHS相关的炎症细胞因子。
结论
我们的研究确定了新的p-i-HLA/TCR作为DDS- dihs中HLA-B*13:01、DDS与克隆型特异性TCR相互作用的模型。
图形抽象
背景
皮肤严重药物不良反应(Severe skin drug adverse reactions, SCARs),包括药物过敏性超敏综合征或伴有嗜酸性粒细胞增多和全身症状的药物反应(DRESS)、Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN),是一组具有潜在生命危险的药物不良反应,其临床表现和发病机制各不相同[1,2].scar是迟发性超敏反应(即,T细胞介导的药物诱导免疫反应,至少在暴露于致病药物3-4天后发生)。原始T细胞在最初的致病药物治疗中被启动,随后在持续暴露期间通过重新刺激逐渐形成记忆T细胞池。因此,当停用致病性药物治疗时,瘢痕消退,并在重新用药时迅速发展[3.,4].
有发展scar倾向的个体似乎拥有特定的人类白细胞抗原(HLA)等位基因,这些等位基因已被发现通过介导药物诱导的T细胞激活来触发这种情况[5,6,7,8,9].从具有HLA-B*58:01等位基因的别嘌呤醇诱导的SCAR患者的皮肤损伤和血液样本中分离出的寡克隆T细胞群中观察到药物特异性T细胞受体(TCRs) [10]和卡马西平诱导的HLA-B*15:02等位基因的SJS/TEN患者[11].几种理论,如半抗原(和前半抗原)、p-i(与免疫受体的药理相互作用)[12,13],肽库改变[14和改变的TCR库模型,已被提出来解释hla相关药物超敏反应[15,16].最近,一种独特的T细胞群,称为皮肤常驻记忆T细胞,已被确定为可能的SCAR介质[10,16].此外,据报道,由abacavir修饰的HLA-B*57:01显示的自肽的高分辨率晶体结构,在分子水平上为hla相关药物超敏反应提供了有价值的见解[11,17].此外,结构生物信息学方法近年来取得了显著的进展,是一种很有前途的方法来计算阐明hla -药物结合的结构基础、动力学和能量性质及其在scar中的病理作用。
HLA-B*13:01等位基因已被确定为包括氨苯砜(二氨基二苯砜,DDS)在内的许多药物诱导的scar的重要风险等位基因[18,19,20.,21,22,23,24].DDS诱导的超敏反应综合征(DDS- dihs)是具有HLA-B*13:01等位基因的麻风病患者死亡的主要原因之一(即约2%的麻风病患者接受DDS治疗,死亡率为12.5%)[25,26,27].DDS也被用于治疗各种皮肤和非皮肤疾病,包括卡式肺肺炎(28]、疱疹样皮炎[29]、免疫性血小板减少症[30.]及嗜酸性筋膜炎[31].既往研究发现DDS特异性细胞毒性T细胞与HLA-B*13:01-表达抗原提呈细胞(APCs)共培养时,DDS特异性细胞毒性T细胞显著活化[32,33].然而,在DDS-DIHS相关T细胞激活中起作用的HLA-B*13:01-DDS-TCR免疫突触仍未被表征,这使得预防和治疗工作更加困难。
在本研究中,我们利用结构生物学、生物信息学和突变实验证明了HLA-B*13:01和DDS的蛋白外结晶直接与HLA-B*13:01结合,并确定了介导结合的关键HLA-B*13:01残基。这些关键残基也解释了为什么DDS-DIHS与HLA-B*13:01特异性相关,而不是高度同源的HLA-B*13:02。此外,我们进行了rna测序和单细胞TCR测序,从DDS-DIHS和DDS-SJS患者的水泡细胞和外周血单个核细胞(pbmc)中鉴定dds特异性TCR克隆型。利用硅结构建模,我们发现DDS与HLA- b *13:01和DDS特异性TCR直接相互作用,这表明dihs相关的TCL激活是通过与HLA和TCR的p-i介导的药物相互作用介导的(p-i HLA/TCR模型)。本研究结果为DDS-DIHS的防治提供了新的思路,强调了p-i HLA/TCR模型可能是HLA相关药物超敏反应的发病机制之一。
材料与方法
研究设计和患者招募
从2012年到2020年,我们在中国医学科学院南京皮肤病研究所和台湾长庚纪念医院收集了12份诊断为dds诱导的超敏反应(DDS-DIHS)患者的临床信息,11份DRESS血细胞样本和1份SJS/TEN水泡细胞样本。DRESS根据RegiSCAR标准诊断[34,35],其特征是广泛的红斑斑丘疹伴眶周水肿和脱屑。使用RegiSCAR组的标准和评分系统对DRESS的诊断包括伴有典型皮肤疹的皮肤受累(如剥脱性皮炎、全身性黄斑丘疹疹)、发热(≧38.5°C),肿大的淋巴结(≧2网站,≧1 cm),不典型淋巴细胞和嗜酸性粒细胞增多,全身受累(如肝、肾和肺),消退时间,以及其他潜在病因的评估。分析氨苯砜的临床病程、剂量和持续时间、全身受累情况和死亡率。SJS和DIHS的药物因果关系由表皮坏死松解的药物因果关系算法(ALDEN)和遵循RegiSCAR小组发布的药物因果关系评估指南的Naranjo算法确定[35,36,37,38].只招募与DDS有可能或一定因果关系(ALDEN评分大于4或Naranjo算法大于5)的病例。所有DDS-DIHS患者和1例DDS-SJS患者均为HLA-B * 13:01两名皮肤科医生通过检查照片、病理组织切片和医疗记录对其进行了评估。我们还招募了10名DDS耐受对照组,他们接受DDS治疗至少3个月,无任何皮肤不良反应。其中,有三个是HLA-B * 13:01 -有七个是阳性的HLA-B * 13:01-阴性麻风病患者(见表1).此外,还纳入了12名健康对照者。获得了机构审查委员会的批准(IRB No. 100-4657A3, 201601761B0, 201902171A3和202001645B0),并获得了每位参与者的知情同意。
化学物质,载体和细胞系
DDS, DDS代谢物n -乙酰DDS (NAD),磺胺嘧啶和三氯乙烯购自Sigma-Aldrich(圣路易斯,密苏里州)。ebv转化的自体b细胞系(B-LCLs)和HLA i类缺陷淋巴母细胞b细胞系(Hmy2.C1R)作为抗原提呈细胞(APC),取自ATCC (Maryland, USA)。将编码HLA-B*13:01、HLA-B*13:02和β2M的全长开放阅读框克隆到VP64-GFP载体中进行突变分析。然后以编码野生型HLA-B*13:01和HLA-B*13:02的载体为模板,进行位点定向突变,生成单位点和双位点HLA-B*13:01和HLA-B*13:02突变变体(表2)2).将编码野生型或突变型HLA-B*13:01或HLA-B*13:02变体之一的VP64-GFP载体与VP64-GFP-β2M、pspax2和pMD2一起转染。G到Hmy2。C1R细胞(hla - b缺陷细胞),流式细胞术以GFP荧光蛋白为报告。采用流式细胞仪检测抗hla抗体蛋白表达,稳定表达C1R跨膜HLA-B*13:01 (C1R-HLA-B*13:01)克隆(w6/32, eBioscience)。
结晶学实验用重组蛋白的表达与纯化
HLA-B*13:01和β -2-微球蛋白(GenBank ID: AAA59627.1和AAA51811.1)基因序列由生工生物技术(中国)公司合成。将基因克隆到pET21a载体上,该载体的c端为6 × His大肠杆菌BL21 (DE3)细胞。细胞在37℃LB培养基中培养至OD600最终浓度为0.1 mM的IPTG(异丙基- b - d -1-硫半乳糖yranoside, isopropyl- b - d -1-硫半乳糖yranoside, IPTG)在16℃诱导表达20 h, 12000 × g离心20 min收获细胞,在含有6 M胍- hcl的裂解缓冲液中重悬,超声处理。重组蛋白(180 mg HLA-B*13:01和60 mg β2M)在4°C的透析缓冲液(0.1 M Tris pH = 8.0, 2 mM EDTA, 400 mM)中恢复l-精氨酸-盐酸,0.5 mM氧化谷胱甘肽),然后通过离心去除沉淀。将清除的上清液加载到5 mL镍-硝酸-三乙酸(Ni-NTA)树脂重力柱(Qiagen)上,与结合缓冲液(20 mM Tris-HCl pH = 8.0, 150 mM NaCl)预平衡。分别用含20 mM咪唑和100 mM咪唑的结合缓冲液50 mL洗涤色谱柱,用含500 mM咪唑的结合缓冲液洗脱靶蛋白。然后将目标蛋白浓缩并加载到Superdex G200尺寸排除色谱(SEC)柱上(120 mL, GE Healthcare生命科学,美国),预平衡SEC缓冲液(20 mM Tris-HCl pH 8.0, 150 mM NaCl和2 mM DTT)。由于最初的SEC结果表明大多数HLA-B*13:01不与β2M结合,我们使用NetMHC 4.0 Server预测的不同寡肽(http://www.cbs.dtu.dk/services/NetMHC/)稳定HLA-B*13:01-β2M复合物。纯化HLA-B*13:01和β2M后,分别加入预测肽。通过SEC结合SDS-PAGE验证了HLA-B*13:01-β2M配合物的形成,最终发现肽(RQDILDLWI)可以促进该配合物的形成。
结晶
HLA-B*13:01-β2M-peptide复合物(浓度为5-7µg/mL)的初始结晶筛选使用商用结晶筛选试剂盒,使用静滴蒸汽扩散法在16℃下进行。结晶液滴为0.5 μL蛋白质复合物溶液与0.5 μL储液混合。衍射质量晶体生长在0.1 M HEPES (pH 6.5-7.5), 20% (v/v) PEG 4000和0.2 M NaCl中。所有晶体在添加20-25% (v/v)甘油的储层溶液中冷冻保护,并在液氮中快速冷冻。
数据收集和结构确定
HLA-B*13:01-β 2m -肽配合物晶体的x射线衍射数据采集于上海同步辐射设备(SSRF)的BL-17U1束线。所有数据均使用HKL2000软件进行索引和缩放。用MOLREP取代PHENIX中的HLA-B*13:01-β2M-peptide复合物,确定其结构[39]采用HLA-B*44:03与eb病毒bzlf1衍生肽(PDB ID: 4JQX)复合物结构作为搜索模型。使用PHENIX中的AutoBuild自动构建结构模型。经过几轮定位和b因素优化使用Phenix。使用TLS参数在Coot中手动修改模型进行细化[40],采用PROCHECK程序验证模型质量(https://www.ebi.ac.uk/thornton-srv/software/PROCHECK).使用MolProbity验证最终模型的质量[41].使用Dali服务器上的PDBePISA (Protein Interfaces, Surfaces, and Assemblies)工具分析结构(http://ekhidna2.biocenter.helsinki.fi/dali).关于数据收集和细化统计的详细信息列在表中2.所有结构图均在PyMOL (http://www.pymol.org).
表面等离子体共振
使用Biacore T200表面等离子体共振(SPR)系统(GE Healthcare, Piscataway, NJ)分析HLA-B*13:01与不同药物之间的相互作用。重组HLA-B*13:01和β2-微球蛋白(Chemicon International, Temecula, california)一起在PBS缓冲液中孵育,然后通过胺偶联反应固定在芯片上。用于分析的药物溶解在添加了5%二甲基亚砜(DMSO)的PBS中,并流过固相。用DMSO效应的标准曲线减去相互作用的响应,并进行校正。数据分析采用BIA评估软件1.0版本。Kd值由三个独立实验确定。
HLA-B*13:01固定、脉冲和结合试验
我们研究了基于细胞毒性T淋巴细胞(ctl)活性的DDS/HLA-B*13:01相互作用。即使apc被0.25%多聚甲醛固定,特异性ctl也会发生反应,不包括加工或细胞内代谢。脉冲C1R-HLA-B*13:01与DDS孵育1小时,然后进行两步洗涤,未观察到DDS对药物特异性t细胞克隆的刺激。通过转染编码HLA-B*13:01的全长cDNA质粒,获得了C1R-HLA-B*13:01稳定克隆。用低温温和柠檬酸去除HLA-B*13:01中的内源肽。用培养基中和后,用β2M(4µg/mL)、GolgiStop(1µg/mL;BD Biosciences, california),并将合成肽在室温下放置3小时。
HLA-B*13:01蛋白提取,共免疫沉淀(Co-IP)和多肽的液相色谱质谱(LC-MS)鉴定
C1R和C1R- hla - b *13:01用DDS(50µg/mL)培养6 h,收集细胞球加入RIPA裂解缓冲液。上清液在10000 rcf离心10分钟,转移到3 kD超滤管中,在12000 rcf离心10分钟,4℃,然后收集小于3 kD的多肽。蛋白样品通过HLA-ABC抗体固定和Co-IP测定进行检测,并使用Easy-nLC1000和Q Exactive™混合四极- orbitrap™质谱仪(美国赛默飞世尔科学公司)进行分析。利用PEAKS Studio对原始的MS文件进行分析,并在蛋白质数据库中根据样品的种类进行检索。参数设置如下:蛋白质修饰为甲酰胺甲基化(C)(固定)、氧化(M)(可变)、乙酰基(蛋白n项)(可变);酶特异性设置为非特异性;最大缺失乳沟数设为2条;前体离子质量容差设置为20ppm, MS/MS容差设置为20ppm。仅选择高置信度鉴定的肽进行下游蛋白鉴定分析。
dds特异性T细胞的生长
采用Ficoll-Paque (GE, Life Sciences, USA)密度梯度离心法从全血样本中分离外周血单个核细胞(pmcs)。dds诱导SCAR患者和其他对照个体的pmcs (5 × 10e5 /孔)培养于96孔微板中,TexMACS培养基(德国miltenyi Biotec)中添加5%人AB血清[42] (Sigma-Aldrich, Darmastadt, Germany),青霉素-链霉素(Gibco Invitrogen, USA), 200U IL-2 (R&D systems, USA),和50µg/mL DDS (Sigma-Aldrich, St. Louis, MO),在5% CO中37°C浸泡1周2.通过用DDS(50µg/mL)培养患者的pmcs获得DDS特异性T细胞系(TCLs),然后用照射(50 Gy)的自体B-LCLs和DDS重新刺激扩增的T细胞约4至5个周期。通过连续稀释获得t细胞克隆。采用FACSAria (BD, Franklin Lakes, NJ)对10个CTL CTL进行了分类。另外,在培养基中加入二甲基亚砜(DMSO)作为溶剂对照,以浓度为10µg/mL的植物血凝素(phytohemhemagglutinin,即PHA)为阳性对照。T细胞增殖克隆型用于T细胞受体(TCR)研究。
通过高通量下一代测序和单细胞测序分析TCR库
采用(1)基于正常TCR测序的方法对dds诱导的SCAR患者的T细胞进行增殖克隆型,使用Qiagen RNeasy从每个克隆中纯化RNA,使用BD SmartRace试剂和方案进行5'RACE,使用通用5 '引物,以及用于TCR常数区的3 '基因特异性引物。(2)对于使用10 × Genomics平台的实验,根据制造商在单细胞V(D)J试剂盒用户指南中的说明使用人类T细胞(PN-1000005)。使用TC20™自动细胞计数器确认细胞数量和浓度。大约5000个细胞立即被置于10XGenomics铬控制器机器上进行乳状液凝胶珠(GEM)生成。在文库构建之前,通过TCR或Ig常数区域特异性引物PCR扩增T细胞转录物的第一链cDNA全长V(D)J片段。使用安捷伦生物分析仪2100评估文库质量和浓度。文库在Hiseq X或Novaseq上运行,用于Illumina PE150测序。Novogene使用10X Cell Ranger包(v2.2.0, 10X Genomics)进行后处理和质量控制。Reads对齐到mm10(或GRCh38等)参考集(v2.2.0, 10X Genomics)。
单链TCRα/TCRβ表达结构和细胞的生成
逆转录病毒编码携带人类TCR常数区域的TCR基因,其格式为TCRα- f2a -TCRβ,根据制造商的协议,通过使用lipofectamine 3000 (Thermo, Life, USA)短暂转染基于逆转录病毒的质粒及其包装载体(psPAX2和pMD2.G)在HEK-293T细胞中产生。转染48 h后,收集病毒,用0.45- m注射器过滤器过滤,用于感染。用添加10µg/mL Polybrene的病毒上清液在2500转/分、30°C下旋转感染T细胞90 min。感染后第3天,流式细胞术对表达TCR的细胞进行分类,建立衍生细胞系。
流式细胞术
流式细胞仪使用不同的荧光色素偶联单抗,识别人CD3, CD4和CD8 (BD Biosciences),人TCRα, TCRβ (bilegend)。这些单抗用Alexa Fluor 488、phycoerythrin (PE)、phycoerythrin- cyanine 5 (PC5)、phycoerythrin-cyanin 7 (PC7)或异藻菁标记。通过BD FACSVerse流式细胞仪(BD Biosciences)上的多色流式细胞仪检测细胞,并使用Flowjo™V10软件(BD Biosciences)分析数据。
T细胞活化和转导
为了转导原代人T细胞,PBMC (2 × 10e6细胞/mL)在24孔板上被1µg/mL CD3抗体(克隆OKT3, eBioscience)激活,同时存在1µg/mL可溶性CD28抗体(克隆CD28.2, eBioscience)和300U/mL白介素-2 (IL-2;在TexMACS培养基中添加5% (v/v)人AB血清和抗生素(青霉素-链霉素)。激活48 h后,用添加有10µg/mL Polybrene的病毒上清液自旋感染细胞90 min,转速2500 rpm,温度30°C。旋转感染后,用含有300 U/mL IL-2和1µg/mL anti-CD28的新鲜T细胞培养基替换逆转录病毒上清。将转导的原代T细胞培养48小时,然后用于细胞毒性测定。
ELISpot试验
从DDS- scar患者分离的pmcs与DDS孵育1周。加入50µg/mL DDS、30 nanogram/mL CD28、30 nanogram/mL OKT3(抗cd3抗体)和200 U/mL IL-2扩增DDS特异性T细胞2周。扩增后的T细胞复位3天,使用以抗人CD45、CD3和CD8抗体为标记的FACS分离ctl。根据人IFN-γ ELISpot试剂盒(BD生物科学,美国)的说明,用elisa法定量IFN-γ释放来检测dds特异性ctl。进行ELISpot分析×10e4个dds特异性ctl或TCR转染物与1×10e4 C1R, C1R- hla - b *13:01或EBV-B-LCL-13:01 APC, 37°C 24小时。使用CTL ELISpot Reader (CTL, USA)分析数据。
实时RT-PCR检测
使用Qiagen RNA提取试剂盒从患者pbmc中提取总RNA,并使用Superscript II逆转录酶(Life Technologies)进行逆转录。RT-PCR在ABI 7300(赛默飞世尔)上使用AgPath-ID一步RT-PCR试剂盒(赛默飞世尔)在20µL反应中进行,其中包含0.8µM正向和反向引物和5µL提取的RNA。热循环条件包括在50°C和95°C初始变性(每个10分钟),然后在95°C(15秒)和60°C(1分钟)进行40个循环。用于定量pcr扩增的TCR引物见附文件3.:表S1。为了验证引物的特异性,进行了熔化曲线分析和PCR产物测序。归一化至GAPDH后,采用2-ΔΔct方法计算Ct值。
TCR/peptide/HLA与DDS的建模
HLA-B*13:01的三维结构和一个TCR克隆型首次独立使用同源建模方法modeler构建[43].然后利用结构比对程序TMalign[参考已有的晶体结构(PDB代码:4EUP)进行了复杂结构的组装。44].该配合物通过蛋白质侧链重新包装方法CISRR进一步细化[45]以及基于CHARMM22力场的能量最小化[46].通过蛋白配体盲对接工具CB-Dock生成DDS与HLA-B*1301的结合模式[47]并叠加在HLA-B*13:01-TCR的复杂结构上。图像由PyMOL (PyMOL分子图形系统,版本1.2,薛定谔有限责任公司,纽约,纽约州)生成。
炎症细胞因子和细胞毒素产生水平的测定
为了定量IFN-γ、IL-3、IL-13、IL-5、IL-21、颗粒素和颗粒酶B的产生水平,将B- lcl (HLA-B*13:01)与CTL (5 × 10e5细胞/孔)共培养于24孔板(10e5细胞/孔),并在1ml完整的RPMI1640培养基中用DDS(50µg/mL)刺激过夜。然后用ELISA (R&D, USA)测定上述炎症细胞因子和细胞毒素的上清浓度。
统计分析
使用SPSS for Windows 21.0版(IBM, Armonk, NY)和GraphPad prism 8.0 (San Diego, CA)进行统计分析。热图使用stats包中内置的R热图功能创建,Circos图使用VDJtools软件(laboratory)生成。整个实验重复了三次。比率估计的p值采用双侧检验计算。ELISpot结果分析采用双尾Student 's t检验对两个变量进行统计学比较。p值小于0.05时,差异被认为具有统计学意义。
数据可用性
本研究中获得的所有测序数据已存入NCBI序列读取档案(SRA)数据库,并链接到BioProject登录ID“PRJNA867422”(稿件接受后将上传)。HLA-B*13:01-β2M-peptide复合物的原子坐标和结构因子存入蛋白质数据库,登录号为7ER5。所有其他数据均可根据合理要求从作者处获得。
结果
研究参与者
十二个HLA-B * 13:01-阳性DDS SCAR患者纳入本研究。DDS治疗引起的基础疾病大多被诊断为慢性炎性皮肤病,包括剥脱性皮炎、红皮病和嗜酸性粒细胞增多症(表2)1).DDS的平均日剂量为90.0±20.4 mg,皮肤症状的平均发病时间为暴露DDS后29.2±15.7天。此外,10个dds耐受性个体(3HLA-B * 13:01正数和7HLA-B * 13:01-阴性)的患者服用DDS至少3个月,无任何皮肤药物不良反应,同时还招募了12名健康对照组。所有研究参与者都是华裔。
DDS特异性细胞毒T淋巴细胞(ctl)以HLA-B*13:01依赖性的方式被DDS激活
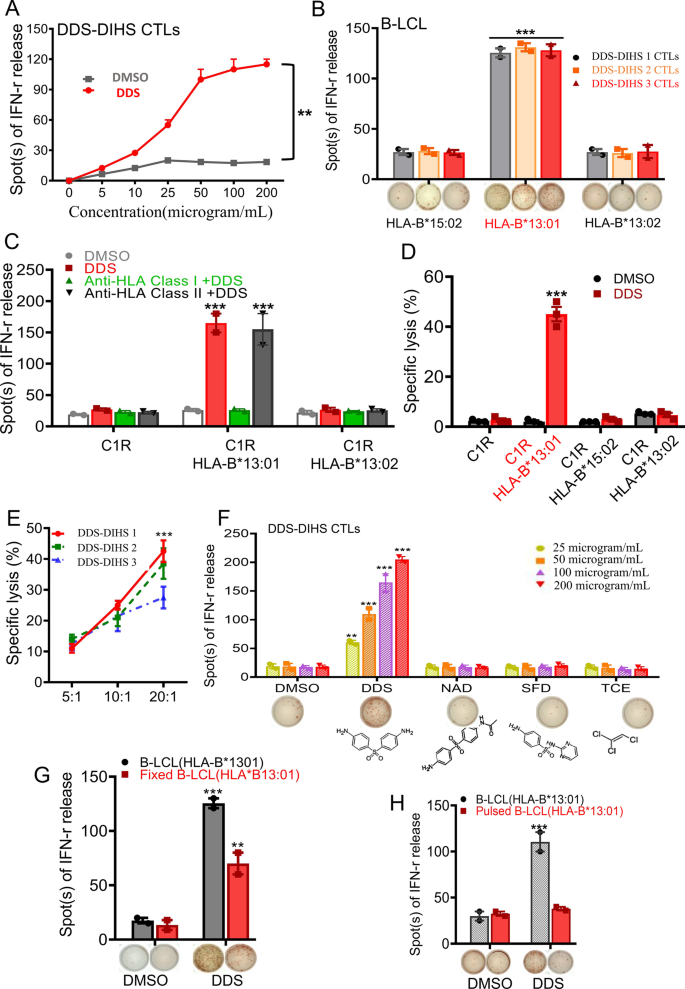
我们从所有DDS- dihs患者和耐受性个体中分离出pbmc,在50µg/mL DDS存在下进行体外T细胞扩增。经过大约三到四个周期的共培养,CD8+在来自DDS-DIHS患者的样本中,ctl构成了T细胞群的大多数,但在耐受个体的T细胞群中基本不存在(附加文件)2:图S1A-C)。因此,dds特异性CD8+可以从DDS-DIHS患者中获得CTL克隆,并在体外维持.然后,我们验证了DDS特异性CTL激活对不同HLA-B等位基因的存在以及DDS或其他药物刺激的依赖性。使用IFN-γ ELISPOT法检测激活,依赖于DDS浓度(图。1A、附加文件2:图S2A)。在DDS刺激条件下,DDS特异性ctl与表达自体HLA-B*13:01- b淋巴母细胞系(B-LCL)共培养时被激活,而与表达异体HLA-B*15:02-或HLA-B*13:02- B-LCL共培养时未被激活(图。1为了进一步确认HLA-B*13:01- CTLs在DDS-DIHS中的特异性激活,我们使用在第二个克隆扩增周期(14天)结束时获得的dds特异性t细胞进行HLA阻断试验。结果表明,ctl介导的IFN-γ释放可被抗hla I类抗体阻断,但抗hla II类抗体不能阻断(图2)。1C、附加文件2:图S2B)。此外,PI/annexin V流式细胞术检测的DDS特异性ctl的细胞毒性作用依赖于DDS和HLA-B*13:01(图。1D),且在20:1时随着效应子/靶细胞比例的增加而显著增强(图。1E)。此外,观察到DDS- dihs患者ctl中IFN-γ的释放以DDS浓度依赖的方式进行,但在磺胺嘧啶(SFD)、DDS代谢物n-乙酰DDS (NAD)、三氯乙烯(TCE)或溶剂对照(DMSO)中不存在IFN-γ释放(图2)。1F)。进一步研究氨苯砜与其他磺胺类药物在6例携带HLA-B*13:01的氨苯砜诱导SCAR患者中的交叉反应性,结果显示,携带HLA-B*13:01的氨苯砜诱导SCAR患者对柳氮磺胺、磺胺甲恶唑具有较高的交叉反应性(敏感性分别为66.7%和83.3%),而对丙苯乙酯、格列齐特、格列美脲无交叉反应性(补充文件)2:图S3A和B)。这一结果与临床和遗传学发现一致。然后,我们使用apc固定试验评估DDS-DIHS患者的抗原提呈。0.25%多聚甲醛固定APCs不能完全消除dds诱导的ctl激活(图2)。1G),但被脉冲程序取消(图。1H)。总之,这些结果表明DDS以HLA-B*13:01-依赖的方式激活来自DDS- dihs患者的扩展ctl。
HLA-B*13:01- dds诱导的DIHS患者中dds特异性ctl的依赖激活。一个采用IFN-γ ELISpot释放法对5例DDS诱导的DIHS患者PBMC扩增的ctl进行T淋巴细胞激活试验,分别用DDS或DMSO培养(溶剂对照)。ctls介导的IFN-γ释放以DDS浓度方式表现。B异基因HLA-B*15:02和HLA-B*13:02携带者,然后用来自三名DDS治疗后DDS诱导的DIHS患者的ctl体外培养。C进行HLA阻断实验,显示在HLA I类或II类抗体不存在或存在时,dds特异性ctl对不同细胞系(C1R、表达B-LCL的HLA- b *13:01或表达B-LCL的HLA- b *13:02) IFN-γ的释放情况。D通过流式细胞仪annexin-V标记检测,dds特异性CTL诱导表达B-LCL的HLA-B*13:01细胞死亡,但不诱导表达B-LCL的HLA-B*13:02或表达B-LCL的HLA-B*15:02细胞死亡。E随着DDS浓度的增加,DDS特异性ctl对表达B-LCL的HLA-B*13:01的细胞毒性。F针对表达B-LCL转染物和DDS结构的HLA-B*13:01 / HLA-B*13:01相关化学物质的DDS特异性ctl,包括n -乙酰DDS (NAD)、磺胺嘧啶(SFD)和三氯乙烯(TCE)。数值为平均值和平均值的标准误差。G用DDS或DMSO培养的PBMC固定试验进行IFN-γ释放的T淋巴细胞活化试验。H分别用DDS或DMSO培养的C1R (HLA-B*13:01)-洗涤法分析CTL细胞的活化。整个实验重复了三次。*P < 0.05, **P < 0.01,经双尾Student t检验。B-LCL, b淋巴母细胞系,CTL,细胞毒性T淋巴细胞;DIHS,氨苯砜诱导的超敏反应综合征;PBMC,外周血单个核细胞
HLA-B*13:01直接与DDS结合
为了确定HLA-B*13:01与DDS相互作用的机制,我们首先将重组HLA-B*13:01蛋白表达于大肠杆菌并将其纯化用于表面等离子体共振实验,然后与β2-微球蛋白形成复合物(附加文件)2:图S4A)。基于IP实验,β2-微球蛋白可与HLA-B*13:01蛋白结合2:图S4B)。结果表明,重组HLA-B*13:01直接与DDS结合,估计结合亲和力在微摩尔范围内(Kd = 68.54µM)(附加文件)2:图S4C)。为了进一步研究内源性肽是否参与HLA-B*13:01介导的DDS表达,通过稳定转染在C1R b细胞(HLA-B缺陷细胞)中表达HLA-B*13:01。然后从表达HLA-B*13:01的C1R细胞和野生型C1R细胞中收集裂解物,用液相色谱-质谱(LC-MS)鉴定HLA-B*13:01结合肽。考虑到HLA- b *13:01属于HLA I类受体,优先结合9-12-mer多肽,我们使用截止分子量为3 kDa的超滤管收集内源多肽。在表达HLA-B*13:01的C1R细胞中检测到7种多肽,明显高于野生型C1R细胞。在这些多肽中,VGFIGAGQLAF和VGFIGAGQLAY在DDS存在的表达HLA-B*13:01- C1R细胞中高度表达2:图S5A)。这两种丰富的内源性肽诱导了表达HLA-B*13:01的细胞在DDS存在时释放IFN-γ,而不是野生型C1R细胞(附加文件)2:图S5B)。然而,与单独使用DDS刺激相比,使用过量的这两种多肽中的任何一种处理都不能增强T细胞的激活(附加文件)2:图S5B)。这些结果表明,HLA-B*13:01直接结合DDS,内源性肽的出现可能是DDS与HLA-B*13:01结合的必要条件。
HLA-B dds结合槽的关键残基*13:01
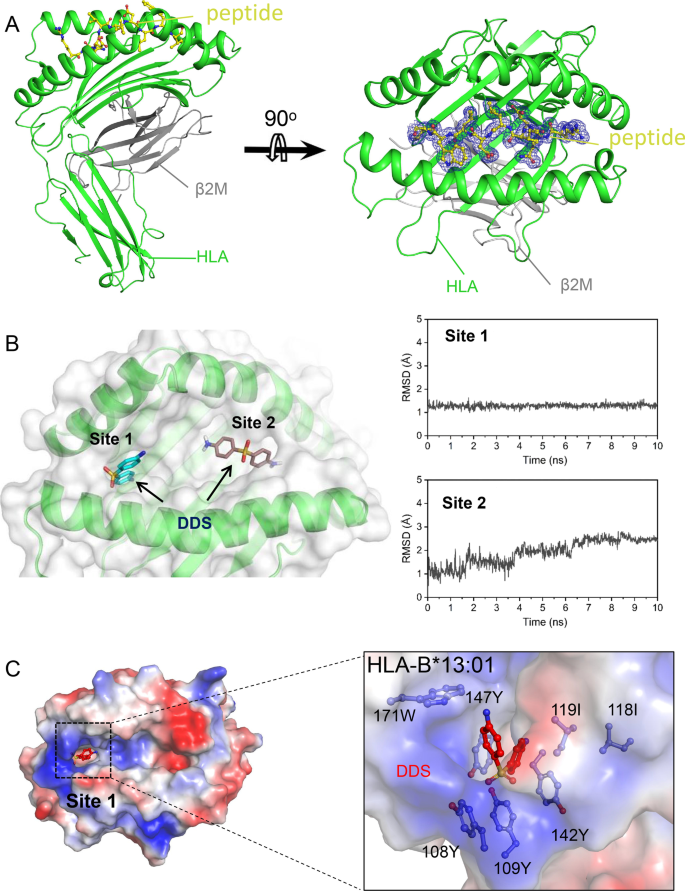
为了更深入地了解HLA-B*13:01与DDS结合的机制,我们曾尝试用多肽和DDS结晶HLA-B*13:01-β2M配合物,但加入DDS后大部分蛋白析出,没有得到配合物的结晶。但是我们以1.50 Å分辨率测定了HLA-B*13:01- β -2-微球蛋白(β2M)-肽复合物的晶体结构(附加文件)1: PDB id 7yg3)。NetMHC 4.0服务器预测的肽段用于稳定HLA-B*13:01-β2M结构,促进结晶,但不参与DDS相互作用。HLA分子是由α链和β链组成的异源二聚体,主要区别在于肽结合区组成。HLA I类的肽结合区由α链的α1和α2结构域组成,而HLA II类的肽结合区由α链的α1结构域和β链的β1结构域组成。HLA- b *13:01-β2M-peptide复合物是典型的HLA I类复合物(图1)。2我们进一步表明,DDS可能与结合槽的F口袋(称为site 1)结合,由于其均方根偏差(RMSDs)值恒定,因此看起来是稳定的(图1)。2B).为了深入分析DDS与位点1的结合,我们使用Accelrys Discovery Studio进行分子建模。结果显示DDS被埋在HLA-B*的108Y、109Y、118I、119I、142Y、147Y和171W形成的疏水口袋中(图13:01)。2C)。
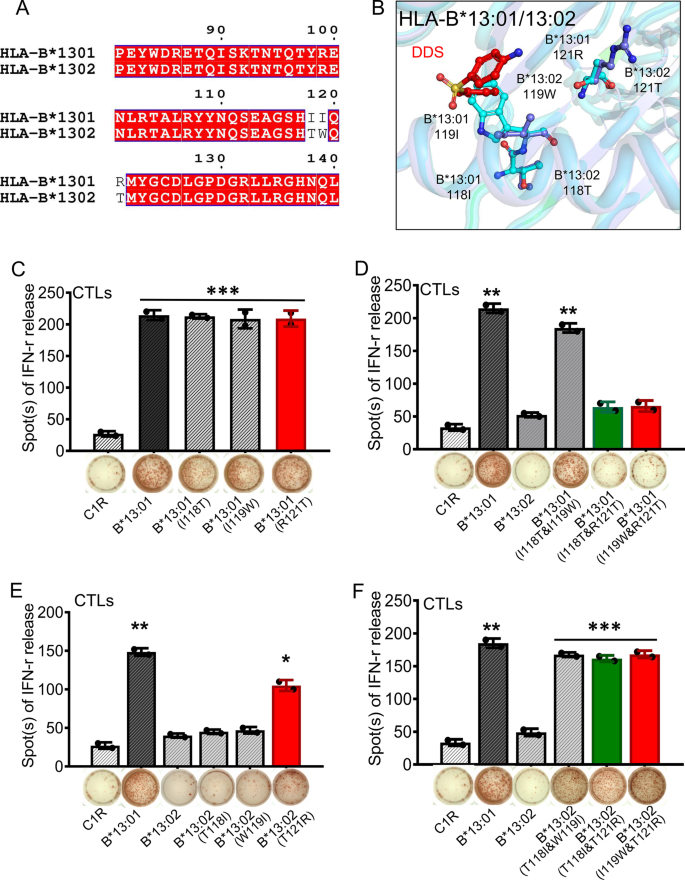
HLA-B*13:01与HLA-B*13:02有98%的同源性,只有3个氨基酸残基不同(118IB13:01/ 118吨B13:02119我B13:01/ 119 wB13:02121 rB13:01/ 121吨B13:02)(图。3.A).然而,DDS- dihs与HLA-B*13:01强相关,而与HLA-B*13:02不相关,这意味着这三个残基的身份在DDS结合中起着重要作用。确实,我们发现侧链119WB13:02DDS产生空间位阻(图。3.B).此外,范德华相互作用118TB13:02与邻近的氨基酸形成,包括119WB13:02,比118I形成的更强B13:01.因此,118吨B13:02和119 wB13:02通过改变绑定口袋的形状,共同阻碍DDS绑定(图2)。2C,3.B).而121R构象之间没有显著差异B13:01和121吨B13:02,这两种残基对dds结合袋的静电性能影响不同,表明121RB13:01也可能在DDS结合中发挥重要作用(图。3.B)。
HLA-B*13家族成员的关键残基参与了DDS的呈现和ctls介导的激活。一个HLA-B*13:01与HLA-B*13:02氨基酸序列的差异。BHLA-B*13:01与HLA-B*13:02在结构上的差异。HLA-B*13:01的121R和具有DDS配合物的HLA-B*13:02的121T分别以棒状和静电表面表示。CDDS诱导的DIHS患者的ctl对表达不同HLA-B*13:01野生型或单位点突变体的DDS和C1R B转染物的IFN-γ释放增加。DCTLs对表达不同HLA-B*13:01野生型、HLA-B*13:02野生型或HLA-B*13:01单位点突变体的DDS和C1R B的IFN-γ释放。ECTL对表达不同HLA-B*13:01野生型、HLA-B*13:02野生型或HLA-B*13:02单点突变体的DDS和C1R B的IFN-γ释放。FCTL对表达不同HLA-B*13:01野生型、HLA-B*13:02野生型或HLA-B*13:02单位点突变体的DDS和C1R B的IFN-γ释放。整个实验重复三次,数值均为平均值的标准误差。* p < 0.01;** p < 0.05;***P < 0.001,由双尾学生得出t测验
为了验证上述残基对DDS结合的重要性,我们生成了稳定表达单位点和双位点HLA-B*13:01突变体的C1R细胞系(HLA-B*13:01I118T, HLA-B * 13:01I119W, HLA-B * 13:01R121T, HLA-B * 13:01I118T&I119W, HLA-B * 13:01I118T&R121T,和HLA-B*13:01I119W&R121T)和HLA-B*13:02突变体(HLA-B*13:02T118I, HLA-B * 13:02W119I, HLA-B * 13:02T121R, HLA-B * 13:02T118I&W119I, HLA-B * 13:02T118I&T121R,和HLA-B*13:02I119W&T121R),并使用它们与扩展两周的dds特异性ctl进行体外共培养试验。通过ELISpot法检测每种突变变体ctl介导的IFN-γ释放(图2)。3.氟)。正如预期的那样,DDS特异性ctl与表达HLA-B*13:01的APCs共培养和DDS刺激后释放的IFN-γ水平显著升高(与野生型C1R细胞共培养相比,增加了9倍,P < 0.01,图。3.C).有趣的是,与HLA-B共培养时,CTL活化没有显著改变I118T, HLA-B * 13:01I119W,或HLA-B*13:01R121T(无花果。3.C),但与双位点突变体HLA-B*13:01共培养时显著降低I118T&R121T和HLA-B * 13:01I119W&R121T(无花果。3.D).相应的单位点突变体HLA-B*13:02T118I和HLA-B * 13:02W119I并没有明显改变CTL活化(图;3.E),而单位点突变HLA-B*13:02T121R位点突变HLA-B*13:02T118I&W119I, HLA-B * 13:02T118I&T121R,和HLA-B*13:02I119W&T121R显著增加CTL活化(图;3.E, F).总之,这些结果表明I118或I119和R121是HLA-B*13:01结合DDS的关键残基。
TCR测序证实dds特异性T细胞的多克隆性和单克隆性
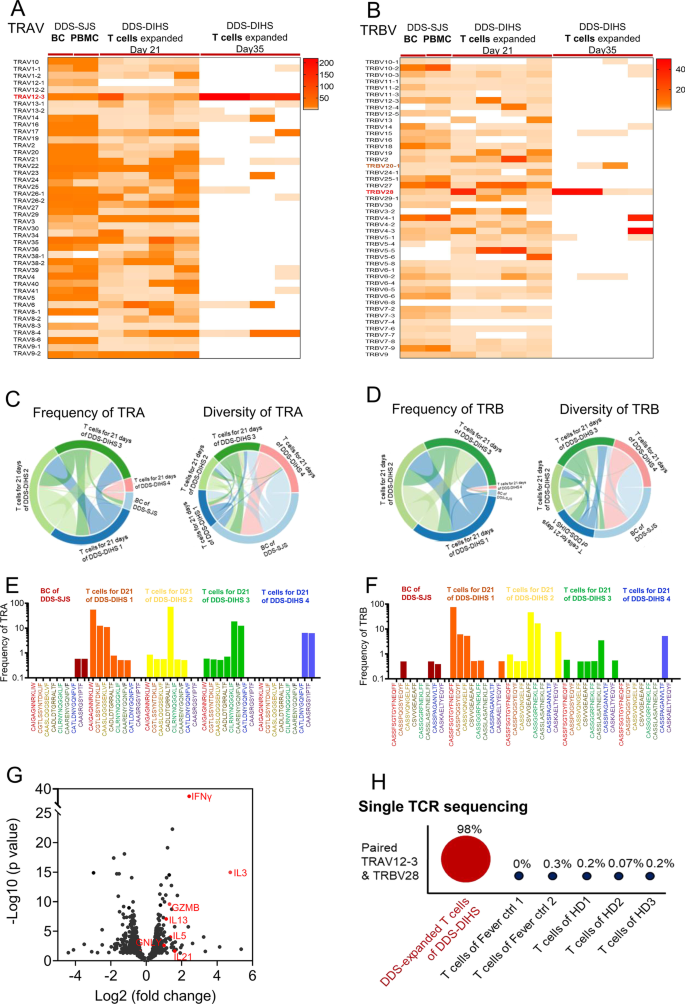
TCRs对于hla -药物复合物的识别和T细胞激活至关重要。为了同时分析基于5 ' race的TCR测序结果和umi校正的数据,我们首先研究了TCRα变量(TRAV)和TCRβ变量(TRBV)基因在dds诱导的SJS的水泡细胞和活性T细胞中的分布,以及来自DDS-DIHS患者的T细胞(图2)。4A, B)和CD8+随着时间的推移,T细胞群显著过表达21或35天(附加文件2:图S1A-C)。最丰富的转录本包括TRAV12-3、TRBV20-1和TRBV28,这些转录本都与DDS-SCAR患者的水泡细胞、活性pbmc以及dds -扩增T细胞的增加密切相关,但与12个健康对照的pbmc不相关(图)。4然后,我们绘制了TCR CDR3组装的circos图,发现DDS-DIHS患者的TRA/TRB CDR3区域具有高度的同源性和共享序列一致性(图2)。4C, D)。在DDS刺激21天后,共享的特异性TCR CDR3克隆型寡克隆扩增,但在12个健康对照组的pmcs中不存在或以极低的频率存在(< 0.001%)(图。4E, F)。虽然克隆型频率不同,但DDS-DIHS-1、DDS-DIHS-2和DDS-DIHS-3患者共享TRA CDR3克隆型‘CAIGAGNNRKLIW’、‘CGTLSSYNTDKLIF’、‘CAASLQGGSEKLVF’、‘CADLDTGRRALTF’、‘CILRNYNQGG KLIF’、‘CAARENYGQNFVF’(图5)。4E)和TRB CDR3克隆型' CASSFSGTGYFNEQFF '、' casspqgsyyeqyf '、' CASSVQNGELFF '、' cvsgeaeaff '、' CASSGGRFNEKLFF '(图5)。4此外,TRA CDR3克隆型' CATLDNYGQNFVF '和' CAASRGSYIPTF '(图5)。4E)和TRB CDR3克隆型' CASSPAGANVLTF '(图。4F)在DDS-DIHS-4患者中扩增,并在dds诱导的SJS水泡细胞中检测到。
dds诱导瘢痕患者dds特异性TCR的鉴定。A、B基于5 ' race的TCR序列结果对UMI校正数据进行并行分析。通过下一代测序分析了1例dds诱导的SJS患者的水泡细胞和活性PBMC中TCR库的表达谱,以及4例DDS-DIHS患者扩增21天或35天的T细胞。热图显示了每个样本的TRAV和TRBV基因的表达值,它们分别被归一化为12名健康捐赠者PBMC相应基因的平均值。TRBV和TRBJ的定义基于IMGT数据库。TRAV12-3、TRBV28和TRBV20-1是dds诱导瘢痕患者T细胞中最常见的TCR V基因。C, D两两重叠的Circos图分别显示了dds诱导的SCAR样本中TRA和TRB克隆型的重叠频率和多样性。E, F在dds诱导的SCAR样本中,TRA和TRB CDR3序列的频率。不同的颜色条代表TCR CDR3在不同dds诱导的SCAR患者中的频率。G与5个健康供者的未扩增T细胞相比,5个dds诱导的SCAR患者的dds扩增T细胞中DEGs上调或下调的火山图。使用CD3抗体通过FACS收集dds扩增T细胞或未扩增T细胞。红点和基因名称代表先前报道的与scar相关的基因。通过Wilcoxon秩和检验得到火山图的P值。H10XGenomics对样本进行了单细胞TCR测序,包括来自1名dds诱导的DIHS患者的dds扩增T细胞,来自2名发烧患者的非扩增T细胞和来自3名健康捐赠者的非扩增T细胞。显示了配对的TRAV12-3/TRBV28的频率。圆的大小越大,表示TCR的频率越高。Ctrl,控制;差异表达基因;DIHS,药物性超敏反应综合征;荧光激活细胞分选仪;HD,健康捐赠者;SJS, Stevens-Johnson综合征;严重的皮肤不良反应; TCR, T cell receptor
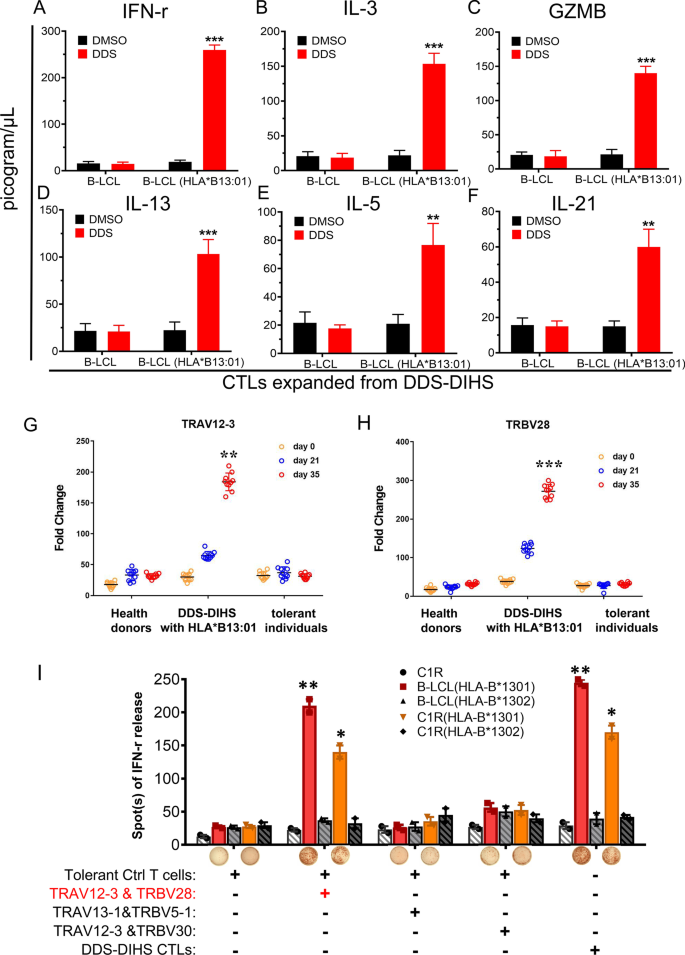
为了研究与上述TCR克隆型相关的基因表达谱,我们进行了RNA-Seq,并分析了来自5名DDS-DIHS患者的dds -扩增T细胞的差异表达基因(deg),并将其与5名健康对照组的未扩增T细胞进行比较(图2)。4G). IFN-γ、IL-3、IL-13、IL-5、IL-21、颗粒素和颗粒酶B的表达水平均与SJS和DDS-DIHS的发病有关[48,49,50,51,52],在表达上述TCR克隆型的dds扩增T细胞中升高。4G),进一步表明这些TCR克隆型参与了DDS-DIHS的发病机制。
接下来,我们进行了单细胞TCR测序,以确定从一个DDS-DIHS患者分离的T细胞中的tv - trbv配对(图2)。4H)。结果表明98%的dds扩增T细胞表达了与TRA CDR3“CAASRGSYIPTF”克隆型配对的TRAV12-3/TRBV28(图5)。4H)。相反,来自5个健康对照的T细胞中,只有高达0.3%的T细胞表达成对的TRAV12-3/TRBV28,没有一个表达TRA CDR3“CAASRGSYIPTF”克隆型。这一发现表明,表达由TRAV12-3/TRBV28与TRA CDR3 ' CAASRGSYIPTF '克隆型配对组成的TCR的T细胞负责DDS-DIHS中的T细胞激活和超敏反应。
dds特异性免疫显性TCR V克隆型的测定及其在DDS-DIHS发病中的作用
接下来,我们测定了DDS-和B-LCL (HLA-B*13:01)刺激ctl中的炎症细胞因子水平。结果显示,在DDS-和B- lcl (HLA-B*13:01)刺激的ctl中,IFN-γ、IL-3、IL-13、IL-5、IL-21和颗粒酶B水平明显高于模拟组(图。5f)。然后,我们用qPCR方法检测从DDS-DIHS患者分离的T细胞中TRAV和TRBV克隆型的表达水平。与10个健康对照组和10个DDS耐受对照组相比,10个DDS- dihs患者的T细胞中TRAV12-3和TRBV28的表达水平在DDS刺激下体外扩增的第21天和第35天分别高出约2倍和9倍(图2)。5此外,在HLA-B*13:01-阳性DDS-DIHS患者中发现了TRAV12-3和TRBV28克隆型,而在所有三名dds耐受HLA-B*13:01-阳性对照组中均无克隆型。因此,在DDS耐受对照组中缺乏TRAV12-3和TRBV28克隆型可能解释了为什么在所有服用DDS的HLA-B*13:01-阳性患者中并不总是发生DDS- dihs。
DDS特异性TCR转染物对DDS和HLA-B的免疫应答*13:01。fELISA法测定DDS和DMSO刺激的CTL中IFN-γ、IL-3、IL-13、IL-5、IL-21和颗粒酶B的含量。G H采用qPCR法分别检测TRAV12-3和TRBV28的表达水平。10例DDS DIHS患者,10例氨苯砜耐受性对照和10例健康供体。折叠变化由2计算−ΔΔct方法后归一化至GAPDH。我在PBMC与TCR转染物、C1R-B*13:01或EVB-HLA-B*13:01共培养时观察到IFN-γ ELISPOT反应。这些结果表明,特殊的αβTCR对DDS及其结构类似物有反应,HLA-B*13:01的出现促进了免疫识别。整个实验重复了三次。* * * P < 0.05, P < 0.01,由双尾学生* * * P < 0.001, t测试
为了进一步验证TRAV12-3和TRBV28克隆型在DDS-DIHS发病机制中的作用,我们在CD3 + T细胞中过表达成对的TRAV12-3/TRBV28, TRAV13-1/TRBV5-1和TRAV12-3/TRBV30,这些CD3 + T细胞是在从缺乏这些TCR克隆型的dds耐受对照中分离出来的pbmc扩增48小时后分选的2:图S6)。随后,我们进行了体外共培养实验,发现只有TRAV12-3/TRBV28 T细胞与C1R-HLA-B*13:01或B-LCL-HLA-B*13:01共培养,在DDS刺激下才产生IFN-γ(图。5这些结果进一步证实,具有配对TRAV12-3/TRBV28克隆型的TCR是与HLA-B*13:01-DDS复合物形成免疫突触和dds - dihs相关T细胞激活所必需的。
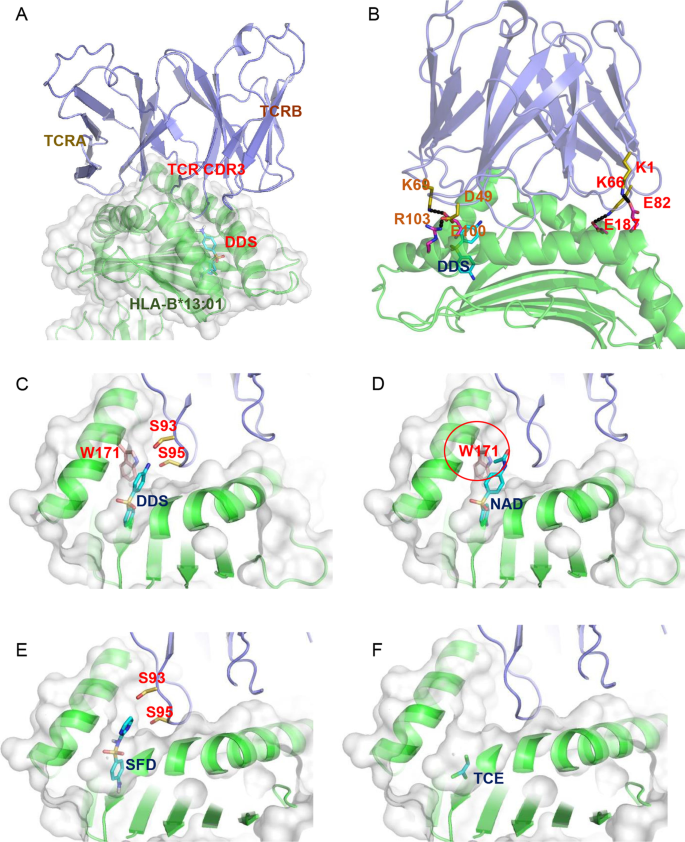
HLA-B*13:01-DDS-TCR免疫突触的建模
根据上述结果,DDS与HLA-B*13:01直接相互作用,是DDS- dihs相关TCR克隆型形成免疫突触所必需的。然而,在没有肽的情况下,DDS如何与HLA结合并介导与TCR形成免疫突触仍不清楚。为了回答第一个问题,我们对HLA-B*13:01和TCR进行了独立的硅晶结构建模,然后对DDS和HLA-B*13:01进行了盲对接,并基于现有晶体结构(PDB ID: 4EUP)进行了组装(图。6A).得到的HLA-B*13:01-DDS-TCR配合物表明DDS末端氨基与TCR H-CDR3区残基S95接触,可能形成分子间氢键。同时,TCR与HLA-B*13:01形成多个盐桥(图。6这意味着HLA-B*13:01和DDS都有助于与TCR的相互作用,尽管DDS明显小于9-mer肽,但由于与TCR和HLA-B*13:01的双重相互作用,DDS模仿了抗原性肽。然后分别用HLA-B*13:01对NAD、SFD和TCE进行盲对接。在三种分子中,SFD和TCE表现出类似于DDS的良好结合模式(图2)。6E, F),而NAD无法与HLA-B*13:01的F口袋结合(图。6D)。将NAD的三维结构叠加在F口袋的DDS上,发现HLA-B*13:01的Trp171与NAD的n -乙酰基部分发生冲突(图。6D),解释缺乏互动。相反,SFD表现出与DDS几乎相同的结合模式,但其疏水芳香端暴露在TCR的CDR3上(图2)。6E).这将使SFD和TCR之间的相互作用在能量上不利,因为相关的CDR3区域由多个亲水残基组成,如丝氨酸。此外,TCE也太小,无法与TCR形成相互作用(图2)。6F)。
讨论
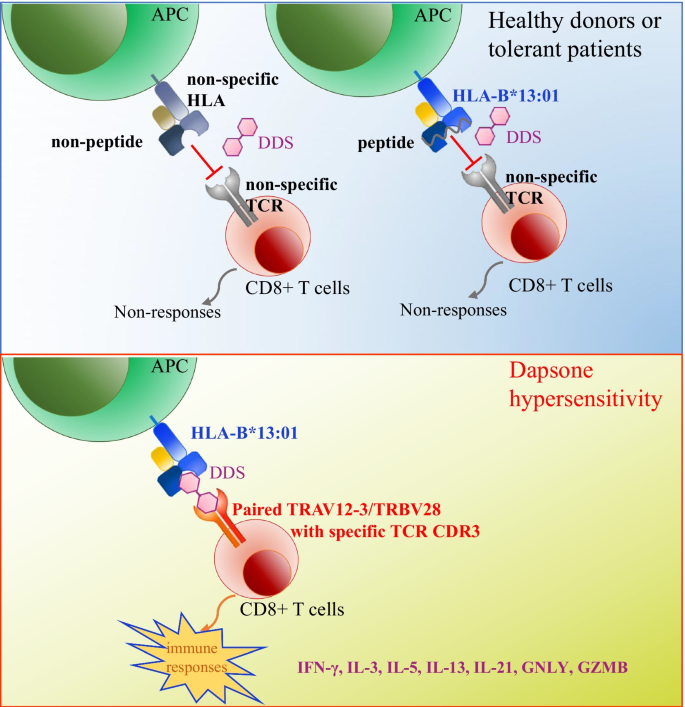
药物可能被识别为外来抗原,并引发细胞介导的适应性免疫反应,如scar [3.,12].虽然HLA被认为是参与药物呈现的重要免疫受体,但很少有研究调查HLA与scar相关药物相互作用的结构基础。最近报道了HLA - ii类限制性T细胞在DDS-DIHS患者中诱导的混杂免疫反应[21],但HLA-B*13:01/ dds限制性CTL反应的详细相互作用和机制仍不完全清楚。此外,之前的研究利用同源建模探讨了HLA-B*13:01与DDS之间的相互作用[53].我们的发现表明DDS直接与HLA-B*13:01和DDS特异性TCR结合,并验证了介导DDS结合的关键HLA-B*13:01残基。因此,我们的研究结果表明,HLA- b *13:01-DDS-TCR相互作用优于新型的p-i HLA/TCR模型,即药物直接与HLA和TCR相互作用,肽不直接参与HLA-药物相互作用,因为经典的p-i模型只关注HLA和药物在抗原加工通路中的相互作用[54,55].说明TCR也有重要作用,可以直接参与hla -药物相互作用,不需要任何肽参与。
根据本研究提供的数据,DDS几乎完全埋藏在HLA-B*13:01肽结合槽的疏水口袋中。这种结合方式不同于abacavir与HLA-B的结合方式*57:01 [56],但可与别嘌呤醇/氧嘌呤醇与HLA-B的相互作用相媲美*58:01 [8,57].此外,DDS的结构似乎对其与HLA-B*13:01和TCR的相互作用至关重要,因为高度相似的NAD和SFD所显示的结构差异足以阻碍与一种或两种蛋白的相互作用,从而无法触发CTL激活。HLA-B*13:01以前被认为是DDS-DIHS的遗传标记[32],我们的研究还表明dds特异性ctl以特异性TRAV/TRBV和CDR3克隆型的TCRs为特征。重要的是,我们发现这些克隆型可以在直接分离的未受刺激的pbmc中检测到HLA-B * 13:01-阳性DDS-DIHS患者。这与临床观察相一致,并可能解释为什么某些HLA-B*13:01携带者对DDS耐受。
此外,我们与TCR转染物的体外共培养实验进一步验证了免疫显性TCR克隆型(即TRAV12-3/TRBV28对和特定的CDR3区域)在DDS- dihs患者中的致病作用,并证明表达该TCR克隆型的ctl以依赖DDS-和HLA-B*13:01的方式产生高水平的炎症细胞因子和细胞毒素。类似地,最近的研究发现在水泡细胞中共享TCR克隆型[58]和体外扩增的T细胞[59卡马西平诱导的SJS/TEN患者的pbmc。除了敏感的HLA等位基因外,特异性TCR克隆型缺乏药物代谢/清除,这也与scar有关[15].因此,DDS诱导的超敏反应综合征的危险因素包括HLA-B*13:01等位基因、特异性TCR克隆型和DDS清除受损。
结论
在本研究中,我们提出HLA-B*13:01和具有特定TCR克隆型的T细胞的存在是触发dds诱导的超敏感综合征患者免疫反应所必需的。HLA- b *13:01-DDS-TCR免疫突触是根据新的p-i HLA/TCR模型形成的,DDS直接与HLA- b *13:01和特定克隆型的TCR相互作用。这些发现不仅揭示了hla限制性药物超敏反应的一般分子机制,而且为DDS-DIHS的预防和易感基因诊断(检测HLA-B*13:01和TCR克隆型)和T细胞免疫治疗(抗体治疗TCR克隆型)治疗其症状提供了框架。
数据和材料的可用性
支持本文结论的数据集包含在本文(及其附加文件)中。
缩写
- 奥尔登:
-
表皮坏死松解的药物因果关系算法
- APC:
-
抗原提呈细胞
- BLCLs:
-
b细胞行
- β2 m:
-
Beta-2-microglobulin
- 卡马西平:
-
卡马西平
- CDR3上:
-
第三互补决定区域
- ctl:
-
细胞毒性T淋巴细胞
- DDS:
-
氨苯砜
- 度:
-
差异表达基因
- DIHS:
-
药物过敏综合征
- DDS-DIHS:
-
氨苯砜致过敏综合征
- DMSO溶液:
-
二甲亚砜
- 衣服:
-
伴有嗜酸性粒细胞增多和全身症状的药物反应
- 对数:
-
迟发性超敏反应
- ELISA:
-
酶联免疫吸附测定
- ELISPOT:
-
酶联immunospot
- HLA:
-
人白细胞抗原
- LTG:
-
拉莫三嗪
- 迈普:
-
斑丘疹的疹
- NAD:
-
n -乙酰DDS
- PBMC:
-
外周血单个核细胞
- PHA:
-
植物凝集素
- 》:
-
与免疫受体的药理相互作用
- 疤痕:
-
严重的皮肤不良反应
- 悲伤:
-
单波长反常色散
- 陕西林业局:
-
磺胺嘧啶
- sj:
-
史蒂文斯—约翰逊综合征
- SSRF:
-
上海同步辐射设备
- SPR:
-
表面等离子体共振
- TCE:
-
三氯乙烯
- 识别:
-
T细胞受体
- 十:
-
中毒性表皮坏死松解
- TRAV基因:
-
T细胞受体α可变基因
- TRBV基因:
-
T细胞受体β可变基因
参考文献
杜文杰,李志强,李志强,等。严重的药物皮肤不良反应。柳叶刀》。2017;390(10106):1996 - 2011。
王志强,王志强,等。DRESS综合征:文献综述。中华医学杂志,2011;29(4):344 - 344。
王志强,王志强,等。药物性检查的发病机制。过敏。2002;57(10):884 - 93。
刘国强,刘国强,等。核苷逆转录酶抑制剂阿巴卡韦治疗期间的过敏反应。中华医学杂志2001;23(10):1603-14。
李志强,李志强,李志强,等。人白细胞抗原i类限制CD8+ T细胞的激活提供了系统性药物超敏反应的免疫遗传学基础。免疫力。2008;28(6):822 - 32。
钟文华,洪思,洪海生,等。医学遗传学:史蒂文斯-约翰逊综合征的标志。大自然。2004;428(6982):486。
洪思,钟文华,刘伯林,等。HLA-B*5801等位基因可作为别嘌呤醇致皮肤严重不良反应的遗传标记。中国科学院学报(自然科学版),2005;26(4):344 - 344。
林超,陈建科,柯天明,等。别嘌呤醇诱导的严重皮肤不良反应的免疫学基础:HLA-B*58:01-限制药物特异性T细胞的激活和分子相互作用。中华过敏临床免疫杂志,2015;35(4):1063 - 65。
魏春春,钟文华,黄宏伟,等。HLA-B与卡马西平的直接相互作用激活了Stevens-Johnson综合征患者的T细胞。中华过敏临床免疫杂志,2012;29(6):1562-9。
白文德,钟文华,洪思成,等。T细胞介导的药物过敏免疫发病机制的演化模型:宿主、病原体和药物反应的作用。中华过敏临床免疫杂志,2015;36(2):319 - 319。
周鹏,张松,王勇,等。HLA-B*1502/肽/卡马西平/t细胞受体复合物架构的结构建模:卡马西平诱导的Stevens-Johnson综合征/中毒性表皮坏死松解的分子机制的意义中国生物医学工程杂志,2016;34(8):1806-17。
奥斯特罗夫DA,格兰特BJ,庞培YA,等。由mhc呈现的自肽库改变引起的药物过敏。中国科学:自然科学(英文版),2012;
Pichler WJ。药物与抗原特异性免疫受体的药理相互作用:p-i概念。过敏临床免疫杂志,2002;2(4):301-5。
李志强,李志强,等。由药物修饰的hla肽库引发的免疫自我反应。大自然。2012;486(7404):554 - 8。
钟文华,王长武,道荣。严重的皮肤药物不良反应。皮肤杂志,2016;43(7):758-66。
潘瑞瑞,褚明敏,王长青,等。药物特异性公共TCR引发严重皮肤不良反应的鉴定。生态学报。2019;10(1):3569。
庞培雅,斯图尔特JD,马拉尔S,等。hla相关药物过敏综合征的结构基础。中国生物医学工程学报(自然科学版)2012;
王晓明,王晓明。HLA-B*1301与氨苯砜诱导的皮肤药物不良反应的关系:系统综述和meta分析。美国医学杂志,2018;154(4):441-6。
王华,闫磊,张刚,等。HLA-B*1301与氨苯砜诱导的麻风病患者超敏反应的相关性中华皮肤医学杂志,2013;29(4):344 - 344。
张芳芳,刘海华,Irwanto A,等。HLA-B*13:01和氨苯砜超敏反应综合征。中华实用医学杂志,2013;29(4):344 - 344。
赵Q, Alhilali K, Alzahrani A,等。表达风险等位基因HLA-B的高敏感患者的氨苯砜和亚硝基氨苯砜特异性T细胞激活过敏。2019;74(8):1533 - 48。
朴海杰,朴金伟,金帅,等。HLA-B*13:01与韩国和亚洲人群氨苯砜超敏反应综合征:基因型和荟萃分析。中国药理学杂志2020;19(10):1349-56。
王晓明,王志强,王志强,等。HLA-B*13:01是泰国患者氨苯砜诱导的严重皮肤不良反应的预测标志物。前沿免疫杂志2021;12:661135。
陈晓明,王晓明,王晓明,等。氨苯砜超敏反应综合征(DHS):氨苯砜的有害影响?病例报告。中国药理学杂志,2019;14(1):37-9。
潘迪,K, Lewis J,等。尼泊尔麻风病多药治疗合并氨苯砜超敏反应综合征导致的死亡率。热带科学,2007;37(3):162-3。
沈娟,刘敏,周敏,等。中国活动性麻风病患者的死亡原因中华皮肤医学杂志,2011;50(1):57-60。
刘华,王忠,鲍峰,等。前瞻性HLA-B*13:01筛查预防麻风病患者氨苯砜超敏反应综合征的评价美国医学杂志,2019;155(6):666-72。
吉拉尔PM,兰德曼R,高德波特C,等。氨苯砜-乙胺嘧啶与喷喷喷脒作为一级预防卡氏肺孢子虫肺炎和弓形虫病在HIV感染中的作用。PRIO研究小组。中华实用医学杂志,1999,26(4):329 - 329。
砜在热带医学和皮肤病学中的故事。中华皮肤医学杂志1989;28(1):17-21。
张志强,张志强,等。氨苯砜治疗儿童和成人慢性特发性血小板减少性紫癜——90例患者的报告。中国生物医学杂志,2005;29(4):344 - 344。
Servy A, Clerici T, Malines C,等。嗜酸性筋膜炎:一种罕见的皮肤硬化。病理学杂志,2010;2011:716935。
陈文涛,王长泉,陆长泉,等。HLA-B*13:01参与氨苯砜致严重皮肤不良反应的病理机制。中国皮肤科杂志,2018;38(7):344 - 344。
赵q, Almutairi M, Tailor A,等。HLA - ii类限制性CD8(+) T细胞参与氨苯砜高敏感患者的混杂免疫反应。J Invest Dermatol. 2021;141:2412。
王志强,王志强,等。中毒性表皮坏死松解症、Stevens-Johnson综合征和多形性红斑病例的临床分类。中华皮肤医学杂志。1993;29(1):92-6。
王志强,王志强,王志强,等。伴有嗜酸性粒细胞增多和全身症状的药物反应(DRESS):一种原始的多系统药物不良反应。来自前瞻性RegiSCAR研究结果。中华皮肤病学杂志,2013;26(5):369 - 369。
Naranjo CA, Busto U, Sellers EM,等。一种估计药物不良反应概率的方法。临床药物学杂志1981;30(2):239-45。
沙索拉斯B, Haddad C, Mockenhaupt M,等。一种评估Stevens-Johnson综合征和中毒性表皮坏死松解症药物因果关系的算法:与病例对照分析的比较。临床药物学杂志2010;88(1):60-8。
王长武,杨丽丽,陈长波,等。tnf - α拮抗剂在ctl介导的严重皮肤不良反应中的随机对照试验。中国临床医学杂志,2018;29(3):344 - 344。
李伯施纳D, Afonine PV, Baker ML,等。使用x射线、中子和电子测定大分子结构:Phenix的最新进展。晶体结构生物学报,2019;75(p10): 861-77。
Vagin AA, Steiner RA, Lebedev AA,等。REFMAC5字典:现有化学知识的组织和使用指南。生物晶体学报。2004;60(p12pt 1): 2184-95。
陈vb, Arendall WB 3rd, Headd JJ,等。MolProbity:大分子结晶学的全原子结构验证。岩石力学与工程学报,2010;26(1):1 - 6。
李G,白求恩太黄年代,等。通过trogocytosis发现T细胞抗原。光子学报。2019;16(2):183-90。
王晓燕,王晓燕,王晓燕,等。蛋白质结构的建模方法。中国生物工程学报(自然科学版)2016;
张勇,Skolnick J. TM-align:一种基于TM-score的蛋白质结构比对算法。核酸研究,2005;33(7):2302-9。
曹颖,宋林,苗智,等。通过耦合碰撞检测引导迭代搜索和旋转器松弛改进侧链建模。生物信息学。2011;27(6):785 - 90。
张志刚,张志刚,等。蛋白质分子建模和动力学研究的全原子经验势。化学与工程学报,1998;26(6):516 - 516。
刘勇,格林M,戴维特,等。CB-Dock:用于空腔检测引导蛋白配体盲对接的web服务器。药物学报2020;41(1):138-44。
钟文华,洪思,杨建勇,等。颗粒化素是Stevens-Johnson综合征和中毒性表皮坏死松解症中弥散性角化细胞死亡的关键媒介。中华外科杂志,2008;14(12):1343-50。
李文杰,李志强,李志强,等。白介素15与stevens-johnson综合征/中毒性表皮坏死松解症的严重程度和死亡率相关。中国皮肤病杂志,2017;37(5):366 - 366。
蔡永刚,刘俊华,洪思,等。嗜酸性粒细胞增多及全身症状综合征药物反应患者2型先天淋巴样细胞增多中国皮肤病杂志。2019;139(8):1722-31。
斯特恩RS, Divito SJ。Stevens-johnson综合征和中毒性表皮坏死松解症:关联、结果和病理生物学——三十年的进展,但仍有许多工作要做。中国临床医学杂志,2017;37(5):344 - 344。
Shiohara T, Mizukawa Y.药物性超敏反应综合征(DiHS)/药物反应伴嗜酸性粒细胞增多和全身症状(DRESS): 2019年更新。过敏杂志2019;68(3):301-8。
渡边H,渡边Y,田代Y,等。氨苯砜与HLA-B*13:01结合的对接模型解释了氨苯砜超敏反应综合征的风险。中华皮肤医学杂志,2017;32(3):344 - 344。
Pichler WJ。p-i概念:药物与免疫受体的药理相互作用。世界过敏器官杂志,2008;1(6):96-102。
杨晓东,王晓明,王晓明,等。别嘌呤醇过敏主要由剂量依赖的氧嘌呤醇特异性T细胞反应介导。临床经验。2013;43(11):1246-55。
刘涛,王晓明,王晓明。HLA-B*5701对阿巴卡韦超敏反应敏感性的筛选。抗菌化学杂志。2007;59(4):591-3。
Illing PT, Mifsud NA, Purcell AW。超敏反应中药物与HLA分子的异型特异性相互作用。《免疫杂志》2016;42:31-40。
高天明,钟文辉,魏春春,等。共享和限制t细胞受体的使用对于卡马西平诱导的Stevens-Johnson综合征至关重要。中华变态反应临床免疫杂志,2011;29(6):366 - 366。
褚明敏,王长武,常卫文,等。基于颗粒素的淋巴细胞活化试验用于评估抗癫痫药物诱导的严重皮肤不良反应的药物因果关系。中华医学杂志,2016;29(6):344 - 344。
确认
我们也感谢中国医学科学院和北京协和医学院苏州系统医学研究所秦晓峰和杨恒对药物特异性T细胞培养的支持,以及台湾长庚纪念医院人类疾病全基因组研究核心实验室和癌症疫苗与免疫细胞治疗核心实验室成员对基因TCR分析的支持。作者感谢上海同步辐射设备BL17U1光束线的工作人员对晶体数据的收集。
资金
这项工作由赠款支持中国国家重点研发项目的(2019 yfe0113300),中国国家自然科学基金(拨款81972950,82173431,82103748,31770948,82073595),凸轮主动创新医学(授予2016 - i2m - 1 - 005、2017 - i2m b&r - 14),科技部,台湾(大多数109 - 2326 b - 182 a - 001 - 108 - 2314 b - 182 a - 104 -MY3, 108 - 2320 b - 182 a - 024 -MY2, 107 - 2811 - b - 182 - 509), (CMRRPG3K0562,长庚纪念医院CMRPG3K2181, CMRPG3I0382, CIRPG3I0022),福建省科技厅(2020Y4007, 2021H0004, SO),福建师范大学高层次人才引进基金(Z0210509, SO)。
作者信息
作者及隶属关系
贡献
概念化:HSW, SYO, WHC;数据管理:HQJ, HSW;形式分析:HQJ、HSW、WHC、SYO、CWW;晶体结构数据:SYO, YC, ZXW;资金获取:HSW、SYO、WHC;主要产品:HQJ、HSW、SYO、WHC、YC、CWW、YFD、ZXW、YSL。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
获得了机构审查委员会的批准(IRB No. 100-4657A3, 201601761B0, 201902171A3和202001645B0),并获得了每位参与者的知情同意。
发表同意书
所有作者均同意发表。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
方法。
附加文件2:图S1。
DIHS患者dds特异性T细胞的流式细胞术分析A我们对dds诱导的DIHS患者和耐受供体PBMC的第0天、第21天和第35天进行了体外T细胞扩增,以测量CD8的比率+和CD4+流式细胞术检测T细胞。B C CD8的比率+和CD4+dds诱导的DIHS患者和耐受个体T细胞扩增后显示T细胞。整个实验重复了三次。* * * P < 0.05, P < 0.01,由双尾学生* * * P < 0.001, t测试。图S2。IFN-γ elisa检测结果。通过IFN-γ elisa法检测dds特异性ctl激活。B - T细胞被抗hla - I类抗体阻断,而不被抗hla - II类抗体阻断。图S3。HLA-B*13:01携带氨苯砜- scar患者DDS与其他磺胺类药物交叉反应性的测定。对6例携带HLA-B*13:01的氨苯砜诱导瘢痕患者和5例耐受对照组进行了基于颗粒剂的淋巴细胞激活试验(LAT)。阳性结果定义为颗粒素释放量比对照组增加1.3倍(蓝色虚线)。黑色实点,氨苯砜- sjs患者;蓝色实点,氨苯砜患者,灰色实点,氨苯砜耐受者。B显示LAT对携带HLA-B*13:01的氨苯砜诱导SCAR患者及其对氨苯砜的交叉反应的敏感性和特异性。图S4。β2M和HLA-B*13:01蛋白的SDS-PAGE分析。1。纯化HLA-B * 13:01;2.纯化β2米;3.标记;4.HLA-B * 13:01 -β2 m复杂。重组HLA-B*13:01蛋白以DDS浓度的方式与DDS结合,估计微摩尔范围低亲和力(Kd = 68.54 M)。图S5。脉冲分析和LC-MS分析参与DDS与HLA-B结合的肽*13:01。用Co-IP和LC-MS共培养的DDS在C1R (HLA-B*13:01)上分析A肽。通过释放IFN-γ对DDS或两种多肽培养的C1R (HLA-B*13:01)进行B淋巴细胞活化试验。图S6。dds特异性TCR转染物的流式细胞术分析。将TCRA12-3/ TRB28、TCRA13-1/TRB5-1和TCRA12-3/TRB30重组后过表达到DDS耐受的PBMC中,采用流式细胞仪检测TCRαβ和GFP的表达水平。
附加文件3:表S1。
RT-PCR分析中使用的TCR引物。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
蒋浩,王长波。,王,Z。et al。HLA-B*13:01介导的特异性T细胞在氨苯砜诱导的药物过敏反应中的功能和结构特征。生物科学29, 58(2022)。https://doi.org/10.1186/s12929-022-00845-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-022-00845-8
关键字
- 氨苯砜
- 氨苯砜致过敏综合征
- HLA-B * 13:01
- t细胞受体