摘要
背景
褪黑素是松果体的主要秘书产物,是一种强自由基清除剂和抗氧化分子。辐射防护功效及其机制是指其在体细胞中的抗氧化作用。因此,本研究的目的是研究褪黑素对生发细胞(睾丸)γ射线诱导损伤的预防作用。C57BL/6雄性小鼠在单次全身γ照射(5 Gy, 1 Gy/min)前30 min腹腔内给予褪黑素(100 mg/kg)60Co远程治疗单元。照射后2h、4h、8h处死动物,取睾丸和精子,测定总抗氧化能力(TAC)、脂质过氧化、彗星试验、western blotting和精子活力。在另一组实验中,同样处理的动物在1日被处死圣3理查德·道金斯7th, 15th和30th照射后评价精子异常及组织病理学分析。
结果
全身γ辐射暴露(5 Gy)在第三天大大减少了生精小管中生精细胞的数量,而这些细胞受到褪黑素的显著保护。此外,褪黑素显著降低了辐射诱导的精子异常、附睾尾的运动性和活力。褪黑素预处理显著抑制辐射诱导的DNA链断裂和脂质过氧化。此时,辐射诱导激活atm依赖的p53凋亡蛋白- atm, p53, p21, Bax,细胞色素C,活跃的caspase-3和caspase- 9表达,这些在褪黑素预处理小鼠中显著逆转。褪黑素预处理减少的凋亡蛋白与辐照小鼠抗凋亡bcl -x和DNA修复pcna蛋白的增加有关。此外,辐射诱导的TAC下降在褪黑素预处理小鼠中显著逆转。
结论
结果表明,褪黑素可作为预防剂保护雄性生殖系统免受辐射损伤。详细的研究将有助于了解褪黑素在调节辐射诱导的atm依赖p53介导的pro-vs中的作用。-抗凋亡蛋白在睾丸损伤中的作用。这些结果可以进一步利用褪黑素保护男性生殖系统的放射治疗应用涉及身体腹部暴露。
背景
全身辐射照射可对男性生殖系统造成可逆或永久性损害[1].睾丸是对辐射最敏感的生殖器官之一,由于其精原细胞高度增殖,对低至0.1 Gy的辐射剂量都很敏感[2,3.].据报道,在低至1-2 Gy的辐射剂量下,大鼠的精子数量显著减少,形态异常。睾丸拥有处于不同发育阶段的生殖细胞,这一过程被称为精子发生,而发育中的精子对电离辐射非常敏感,已知电离辐射会影响形态、功能并最终影响精子发生[4,5].辐射后精子发生受到影响,Leydig细胞和支持细胞在细胞分裂过程中死亡。杀死精母细胞所需的辐射剂量高于精原细胞,最终导致精子细胞、精原细胞和精母细胞的消失。在人类中,低至0.3戈瑞的辐射剂量可导致精子数量下降和暂时性无精子症[6,7].1戈瑞辐照后,Leydig和支持细胞的增殖受到抑制。恢复和再繁殖将取决于存活的精原细胞干细胞的增殖,最终是生殖细胞的生发上皮[6,7].意外照射的全身照射、辐射工作人员的过度照射和放射治疗中的腹部照射(例如霍奇金病),都可能受到对睾丸有害的辐射剂量。因此,希望有前途的放射性保护剂具有保护生殖系统的功效。
研制放射性防护剂的若干方法正在不同的实验室中进行研究。辐射暴露于低LET γ辐射,γ辐射通过辐射分解细胞中的水在细胞中产生自由基。这些自由基是活性氧,对细胞内的所有生物分子、DNA、蛋白质和脂类都有高度损害。其生物学表现为随着辐射剂量的增加而引起各器官的辐射损伤[8- - - - - -10].众所周知,抗氧化剂可以清除自由基,因此被认为是开发放射性防护剂的有力候选者[11].一些研究强调了植物提取物中纯化合物和复杂分子混合物的抗氧化性能。这些研究大多集中在寻找新分子,这些新分子通过增强生存能力得到验证,并得到抗氧化特性和相关机制的支持。对包括睾丸在内的辐射敏感器官的保护是合理的,以便为计划的全身或半体暴露开发放射性防护剂。最近的一些研究已经推荐褪黑素用于放射性防护的开发[12].Vijayalaxmi等人通过已,体外利用体细胞体外利用人体血液和已证明的褪黑素潜力开发放射性保护剂[12- - - - - -22].这些研究主要集中在褪黑素减少辐射诱导的DNA损伤的能力,使用染色体畸变、人外周血微核、小鼠骨髓的细胞遗传学分析,结果强有力地证明了褪黑素预给药对遗传损伤的保护能力。褪黑素在降低辐射引起的睾丸损伤和恢复方面的辐射防护功效尚未被详细研究。很少有研究报道褪黑素介导的保护生发细胞在全身辐照啮齿动物的睾丸。这些研究通过形态学和超结构研究在全身/部分辐射暴露后的单个时间点描述了褪黑素预处理的辐射防护作用[23- - - - - -25].此外,很少有研究报道了不同植物的草药提取物对啮齿动物睾丸的辐射防护作用[26- - - - - -28].
褪黑素是松果体的内源性首席秘书产物,具有很强的抗氧化和清除自由基的特性[29].褪黑素的抗氧化特性在分子和细胞水平上得到了充分的证明和理解[30.- - - - - -32].褪黑素上调多种抗氧化酶(过氧化氢酶、谷胱甘肽、SOD),下调促氧化酶(一氧化氮合酶),从而保护细胞生物分子免受辐射诱导的氧化损伤[12,33,34].此外,褪黑素通过其对不同修复酶的刺激作用促进辐射诱导的DNA损伤的修复过程[12,35].全身或局部暴露对生殖细胞群有潜在威胁,但关于褪黑素对生殖器官辐射保护的文献较少,因此其在生殖系统中的作用有待进一步研究。
由于意外场所和计划暴露场景中的吸收辐射剂量致死性较低,因此亚致死辐射剂量的相关研究需要更多的关注。因此,在本研究中,我们研究了褪黑素对C57BL/6雄性小鼠5 Gy亚致死剂量γ辐照诱导的生发细胞(睾丸)损伤的放射保护潜力。目的是研究C57Bl/6雄性小鼠生发细胞中褪黑素的详细组织学和形态学异常,以及褪黑素的辐射保护机制,重点是atm介导的途径,C57Bl/6雄性小鼠是开发辐射保护剂的推荐动物模型[36].我们评估了辐射诱导的定性和定量组织病理学改变、总抗氧化能力(TAC)、脂质过氧化、DNA链断裂和atm依赖的前对。-抗凋亡蛋白在睾丸中的表达。此外,还测定了辐射诱导的精子形态异常、活力和存活能力。本研究结果表明,在全身照射前30分钟,经腹腔内单次注射褪黑素可对小鼠睾丸提供辐射保护。褪黑素预处理增加了TAC,减少了脂质过氧化、DNA链断裂以及精子异常,导致辐照睾丸中生精细胞群的恢复。褪黑素的保护机制包括抑制辐射诱导的ATM、p53、p21、Bax、Bcl-x、细胞色素C、活性caspases-3和caspases-9的表达。该结果可用于在更高模型中进一步验证研究,以开发计划暴露的辐射保护器。
方法
抗氧化剂和化学物质
褪黑素(n -乙酰-5-甲氧基色胺)、大豆油、Bradford试剂、PMSF、牛血清白蛋白、碘化丙啶、蛋白酶抑制剂鸡尾酒、抗p53、抗bax、抗bcl -x、酶标结合物和福尔马林均购自美国密苏里州圣路易斯Sigma-Aldrich化学公司。EGTA、三盐酸、三氯乙酸、tween-20、tween-100、脱脂奶粉和磷酸盐缓冲盐水(PBS)购自印度孟买的HiMedia公司。EDTA、NaCl ABTS(2,2′-azinobis(3-乙基苯并噻唑-6-磺酸盐)和乙醇来自德国Merck公司。ECL化学发光试剂来自美国新泽西州皮斯卡塔韦的Amersham Pharmacia生物技术公司。二甲基亚砜(DMSO)和十二烷基硫酸钠来自Calbiochem, San Diego CA USA。DNase free RNase采购自Genei, Bangalore, India。
动物模型
雄性C57BL/6(8-9周龄)小鼠于驯化前1周从动物设施放生。将6只小鼠置于聚丙烯笼中,垫以无菌稻壳和经认证的无菌食物及酸化水随意在整个实验中。所有笼子放置在预先维护的房间(明暗循环12小时,温度23±2℃,相对湿度55±5%)。小鼠不接受任何治疗(药物或放射)作为假对照。实验组小鼠给予100 mg/kg体重的褪黑素作为褪黑素对照。放射治疗小鼠接受5 Gy (1 Gy/分钟)全身γ照射,而褪黑素预处理小鼠在5 Gy (1 Gy/分钟)全身γ照射前30分钟腹腔内接受100 mg/kg体重的γ照射。本实验使用的实验方案由机构动物伦理委员会批准(机构动物伦理委员会批准号为INM/IEAC/2012/06)。所有的实验步骤都是为了尽量减少颈椎脱位动物牺牲时的痛苦。
褪黑素的制备和给药
褪黑素是在大豆油中新鲜制备的。预防性单剂量褪黑素(100mg /kg体重),0.2 ml,在全身γ照射前30分钟,用26号无菌针腹腔内注射。
γ辐照
动物暴露于5 Gy的全身γ照射(剂量率1 Gy/分钟)60Co远程治疗单元(Bhabhatron-II, Panacea,印度)。根据印度原子能监管机构的规定,该研究所的辐射安全小组用物理剂量法校准了剂量率,这是常规校准要求的一部分。
睾丸组织学检查
测定全身γ的影响-照射睾丸,1日解剖各组小鼠右侧睾丸圣3理查德·道金斯7th, 15th和30th照射后几天,多余的组织在预冷的PBS中去除,并在室温下固定在10%的福尔马林中。包埋后切割5μM厚切片,用苏木二烯和伊红(H & E)染色并安装。以确定γ的影响-照射睾丸定量变化,每片评分5个切片,每个切片10个输精管,每只小鼠5 × 10个输精管。15只小鼠随机分为5组,每5个时间点考虑3只小鼠产生精原细胞、支持细胞、精母细胞和精母细胞的平均数量。所有的幻灯片由个人编码,不参与评分,完成后,所有的幻灯片代码被打开。
小鼠精子的形态学检查
动物在1圣3理查德·道金斯7th, 15th和30th天机理。切除两个尾端附睾,在预冷PBS中清洗,用细弯剪刀绞碎到2 ml TNE缓冲液(0.15 M NaCl, 0.01 M Tris-HCL, 0.001 M EDTA, pH 7.4)中,放在冰块上。Aliquot经100 μm尼龙滤网(BD Biosciences, San Diego, CA, USA)过滤去除组织碎片。滴一滴aliquot转移到血细胞计(Neubauer, Marienfeld, Germany),倒置显微镜下观察(4200,Meiji, Japan),以确保细胞的完整性和密度(1 × 106细胞/毫升)。
来评估γ-辐照引起的精子异常,1号做玻片圣3th7th、15th天机理。小体积细胞悬液(1 × 106细胞/ml)用巴斯德移液管转移到预先标记干净的载玻片上,用另一个载玻片的边缘进行薄涂片。涂片风干后,用乙醇(80% v/v)浸渍几秒钟固定。玻片再次风干,在室温下用1%伊红- y染色30分钟。染色后,用milliq水冲洗几秒钟,风干载玻片。每只小鼠至少1000个精子使用装有DIC的直立电动复合显微镜和数字成像系统(Axio Imager M2, Zeiss,德国)在400倍放大倍率下检查正常和异常形态(无钩、香蕉样、无定形、折叠、短尾、两尾两头)。每组3只小鼠,以百分数表达3 × 1000个精子。为了避免评分偏差,所有幻灯片都进行了编码。
精子活力测试
采用10-15 μL单细胞悬液(1 × 106细胞/ml)转入血细胞仪,倒置显微镜下观察。所有精子在原始放大倍数为400X的显微镜下单独观察,如果它们有任何运动,则认为它们是运动的。每个样本至少被计数三次。百分比精子活力指数结果由活动精子总数除以活动精子加非活动精子之和确定。
精子活力试验
测定全身γ的影响-照射后2h、4h、8h, 90 μl精子悬液(1 × 106细胞/ml)与1% Eosin-Y溶液10 μl混合,3 ~ 4 min后,在倒置显微镜下(400倍原始放大倍率)用血细胞计计数染色细胞和未染色细胞。每个样本至少检查三次未染色和染色的细胞,并按伊红阴性(未染色或存活)精子的比例(%)提交。
睾丸的总抗氧化能力
照射后2h、4h、8h颈椎脱位处死动物。在冰上预冷PBS中清洗睾丸,并使用天平称(CPA225D, Sartorius, Göttingen)。用组织匀浆机(OMNI, TH, USA)在预冷PBS (10% w/v)中制备睾丸匀浆,并在4°C下以12000 g离心15分钟。如果当天没有使用上清液,则立即在-80°C保存上清液以供进一步分析。
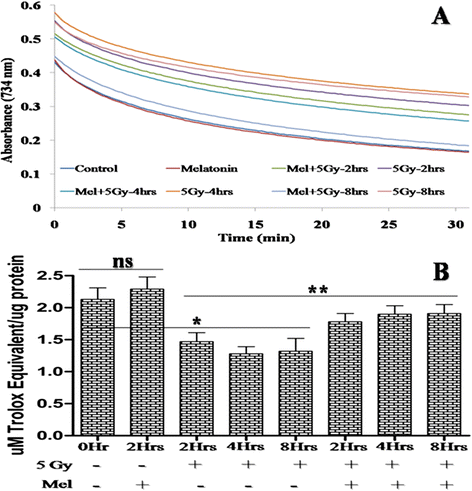
采用ABTS自由基清除法分光光度法测定睾丸总抗氧化能力[37].简而言之,本试验涉及蓝色/绿色ABTS的产生•+发色团(abt•+将ABTS (7mm)与过硫酸钾(2.45 mM)在水中混合,并在室温下在黑暗中保存12 - 16小时•+发色团在645 nm、734 nm和815 nm波长处有最大吸收[38].ABTS的工作方案•+是通过稀释ABTS来制备的•+PBS原液在734 nm处吸光度为0.70±0.02。对于abt•+20 μL生物样品与2 ml工作ABTS混合•+溶液用一次性塑料试管。ABTS的减少•+使用紫外可见分光光度计(Cary100Bio, Varian, Australia.)在734 nm动力学模式下监测自由基吸光度至30分钟。计算单个样品的抑制率,并与相似实验条件下(终浓度为1 ~ 32 μM)得到的Trolox标准曲线相等。
这些样品的蛋白质估计采用Lowry方法,使用BSA标准曲线,遵循制造商的说明(蛋白质估计试剂盒,GeNeiTM默克公司)。Trolox的等效ABTS•+睾丸的自由基清除能力以μM Trolox当量(TE) /μg蛋白表示。Trolox的含量(μmol)相当于1 μg蛋白质。
睾丸硫代巴比妥酸反应性物质测定
硫代巴比妥酸反应性物质(分别于照射后2 h、4h、8h测定睾丸生殖细胞TBARS的产量。用组织匀浆机(OMNI TH, USA)在预冷PBS (10% w/v)中均质睾丸。睾丸生殖细胞中的TBARS水平按照其他地方描述的标准方案进行测量[39].TBARS以每毫克蛋白质nmol表示。
睾丸碱性彗星试验
照射后2h、4h、8h,用细弯剪刀将睾丸放入预冷PBS中冰切。单细胞悬液通过100 μM尼龙网过滤器过滤得到(BD Biosciences, San Diego, CA, USA)。生殖细胞数量(1 × 106细胞/mL)由血细胞计(Neubauer, Marienfeld, Germany)使用倒置显微镜(4200,Meiji, Japan)维持。
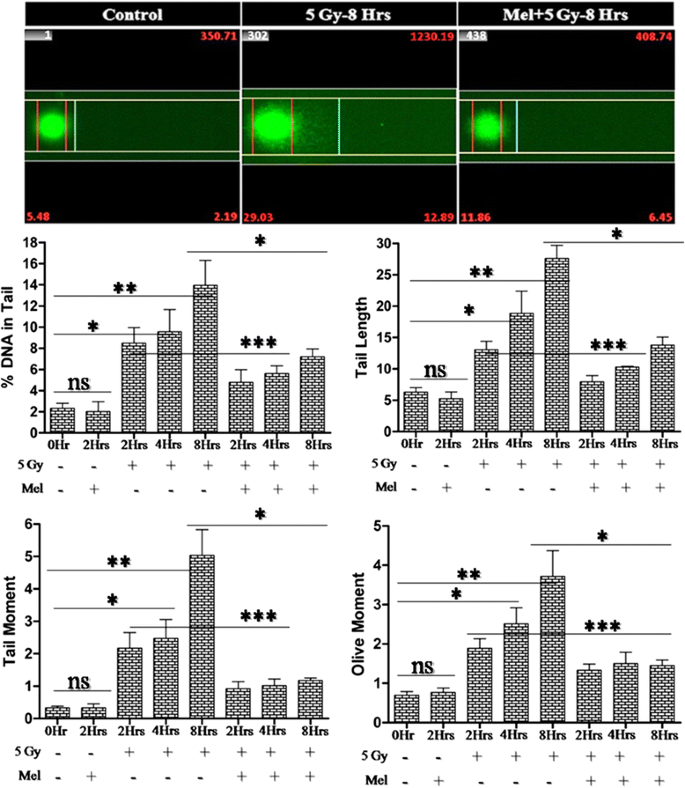
根据Tice及其同事制定的指导方针,进行碱性彗星试验以评估生殖细胞中的DNA链断裂[40].简单地说,将单细胞悬液与0.7% (w/v)低熔点琼脂糖混合,立即移液管移到含有1% (w/v)正常熔点琼脂糖的预涂彗星载玻片上。将载玻片转移到放置在冰袋上的载玻片托盘上,使琼脂糖层硬化(至少10分钟),然后浸入预冷却的溶解溶液(2.5 M NaCl, 100 mM Na2EDTA, 10 mM Tris, 1% SLS, pH 10),含有10% (v/v) DMSO和1% (v/v) Triton X 100过夜在4°C。完全裂解后,轻轻取出载玻片,置于预冷却的放卷溶液(200 mM NaOH, 100 mM Na2EDTA, pH 13.1)在4°C下放置30分钟。载玻片并排放置在电泳装置(comet 20系统,Scie-Plas,剑桥,英国)中,并连接冷冻水循环器(Julabo F12,德国)。玻片立即覆盖新制备的碱性电泳缓冲液(300 mM NaOH, 1 mM Na2EDTA, pH 13.1)和电泳(0.8 V/cm, 300 mA)使用电泳电源(Consort EV261,比利时)在4℃下电泳30分钟。电泳完成后,将载玻片浸泡在中和缓冲液(0.4 M Tris, pH 8)中两次,每次5分钟。最后,将载玻片在100%甲醇中脱水20分钟,然后在50°C的烘箱中风干30分钟。载玻片用2.5 μg/mL碘化丙胺染色,使用MetaCyte彗星扫描自动系统(Metafer4,蔡司,德国)分析至少500个彗星细胞。
睾丸蛋白提取及western blot分析
在辐照后2h、4h和8h分离睾丸,并在含有蛋白酶抑制剂鸡尾酒的预冷冻RIPA缓冲液(50 mMTris-Hcl、150 mMNaCl、0.5%脱氧乙酸钠、0.1% SDS、1% ten -100、5 mM EDTA、1 mM EGTA、1 mM PMSF)中均质。睾丸匀浆在4°C下以10,000 RPM离心15分钟。采用Bradford法测定蛋白质浓度[41]与BSA标准曲线。等量的蛋白质通过SDS-PAGE(12%或8%)分离并转移到PVDF膜上(Merck,德国)。用5%脱脂牛奶在TBST缓冲液(0.2 M Tris-base, 1.5 M NaCl, 0.1% ten -20)中阻断细胞膜,并与适当浓度的一抗(ATM, p53, p21, Bax, Bcl-x, PCNA,活性caspases-3, caspases-9和β-actin)在4℃孵育过夜。洗净印迹,在室温下用二抗偶联辣根过氧化物酶孵育1小时。二抗结合膜用TBST缓冲液冲洗两次。使用ECL化学发光试剂观察蛋白质条带,并将其暴露在x射线胶片上。使用Gel Doc XR (Bio-Rad, USA)分析每个蛋白带的强度。
统计分析
分析并报告数据的平均值和标准误差。两组间采用学生t检验和方差分析进行两两比较。组间差异有统计学意义P-value小于0.05。
结果
褪黑素对辐射诱导的组织病理改变的影响
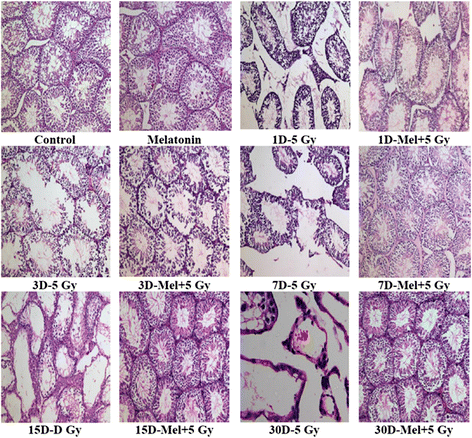
全身γ射线照射可引起睾丸的定性和定量变化。正常的生精细胞(精原细胞,支持细胞,精母细胞和精子细胞)在逐步发育阶段观察到对照和单独使用褪黑素的小鼠(图。1).辐射诱导(5 Gy)严重睾丸萎缩,发育阶段组织紊乱,生精细胞,特别是精原细胞、精母细胞和精小管中的精子细胞在第3天减少,但这些结构的变化在照射后第7天显著(图2)。1).此外,辐照小鼠小管间的Leydig细胞被发现较少(图2)。1).褪黑素预处理与辐照小鼠相比,在第三天显示出相对正常的睾丸结构,有规律的细胞关联,小管中生精细胞略有损失(图。1).
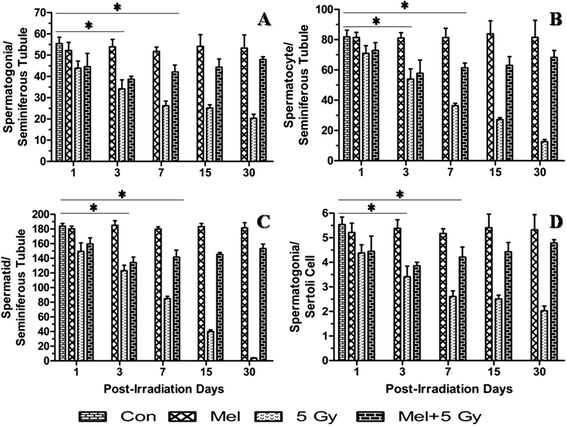
辐射导致睾丸组织结构的形态学改变主要是由于精原细胞的死亡[42],因此,精原细胞计数被认为是衡量辐射对睾丸影响的金标准。计数生精小管中的生精细胞,评估γ射线所致小鼠睾丸损伤。统计上显著的(p< 0.001)生精细胞(不包括支持细胞)减少理查德·道金斯辐照小鼠照射后第1天(图;2).褪黑素治疗前增加(p< 0.001)生精细胞7th与单纯放射治疗的小鼠相比(图;2).支持细胞似乎更耐辐射,因此没有表现出变化(p> 0.05)直到30岁th观察日(附加文件1:图S1)。因此,支持细胞被认为是参考标准细胞,只要它们在切片平面上有核仁。精原细胞总数除以支持细胞总数,以精原细胞/支持细胞之比表示。结果表明,褪黑素预处理小鼠的每个支持细胞中存在更多的精原细胞(p< 0.001)th照射后第二天(图;二维).另一方面,辐照导致辐照小鼠每个支持细胞的精原细胞数量显著减少(p< 0.001)理查德·道金斯天(图。二维).目前的结果表明,单一预防性剂量的褪黑素可以恢复辐照小鼠睾丸中的生精细胞,这与辐照后天数有关。直到30岁,褪黑素单独治疗对睾丸的组织学结构和生精种群没有任何改变th观察日(图;1而且2).
褪黑素可以保护辐射引起的精子异常、活力和活力
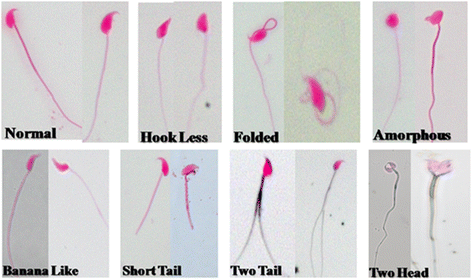
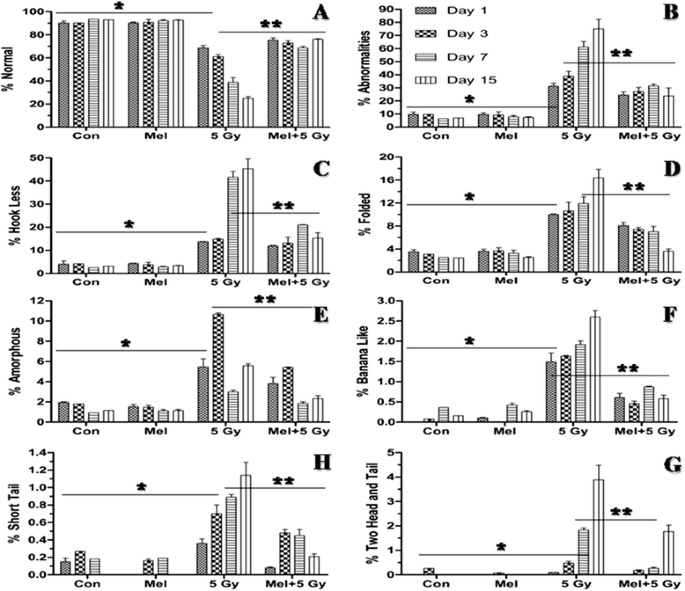
精子形态是直接评价精子质量的重要指标。因此,我们对辐照小鼠的精子进行了形态学评价,并分析了七种类型的精子异常(图2)。3.).在本研究中,一个显著的(p< 0.001)照射后第1天观察到总精子异常(以百分比表示)的日依赖性增加,即钩少、香蕉样、无定形、折叠、短尾、双尾和双头(图。4 b - h).然而,褪黑素治疗前显著降低(p< 0.001) %的精子异常(香蕉样,无定形,折叠,短尾,两个尾和两个头)在comprison照射小鼠的第3天(图。4 b - h).褪黑素单独治疗似乎没有引起任何精子异常(图。4 b - h).两个正面和两个反面的百分比非常低,因此两者都用一个参数表示。
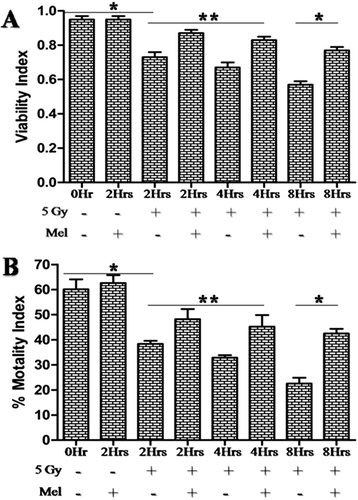
精子的活力和活力是影响精子正常功能的重要因素。全身照射后2h,精子活力和活力明显下降(p< 0.01), 4h (p< 0.01) 8h (p< 0.001)照射后与对照组比较(图;5 a - b).褪黑素预处理显著提高了精子的活力和活力(p< 0.05), 4h (p< 0.05) 8h (p< 0.001)照射后。单独服用褪黑素的小鼠与对照组小鼠相比,精子活力和活力没有明显变化(图2)。5 a - b).
褪黑素对辐射诱导的总抗氧化能力的影响
睾丸具有内源性抗氧化防御系统,维持生殖细胞、生精细胞和莱丁细胞的生类固醇功能[43].TAC对于对抗辐射引起的睾丸氧化损伤至关重要。5 Gy的全身辐射照射可使TAC显著降低(p照射后2h和8h,与对照组相比< 0.01),说明促氧化剂和抗氧化剂之间的不平衡导致活性氧产生过量。然而,辐照小鼠的褪黑素预处理显著增加(p< 0.05)照射后2 ~ 8小时的TAC。对照组小鼠睾丸TAC的计算值为2.13±0.18 μM TE/ μg蛋白(图13)。6).
褪黑素可以减少辐射引起的脂质过氧化
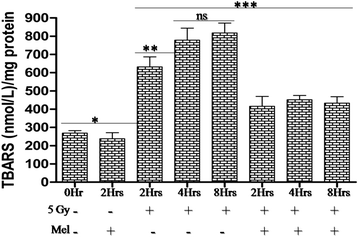
脂质过氧化是电离辐射诱导氧化损伤的关键事件之一。TBARS水平显著(p< 0.001)在5 Gy全身辐射照射后增加。在5gy辐射照射后2h、4h、8h进一步评价TBARS,差异有统计学意义(p< 0.01),差异无统计学意义(p> 0.05),说明TBARS随时间推移显著升高,直至4h达到最大。褪黑素预处理显著(p< 0.001)降低了辐照小鼠照射后2 ~ 8小时的TBARS水平。这表明,褪黑素预处理降低了正常小鼠睾丸中电离辐射诱导的TBARS(图2)。7).
褪黑素可以减少辐射引起的DNA链断裂
生殖细胞中DNA完整性的维持对生殖至关重要,因此防止自由基介导的γ辐射引起的DNA损伤是必要的。在本研究中,我们通过碱性彗星试验评估了γ辐射诱导的生殖细胞DNA损伤(图2)。8).5 Gy的全身γ照射在2h时,DNA链断裂参数(尾长、尾矩、橄榄矩和尾DNA百分比)显著增加(p< 0.01), 4h (p< 0.01), 8h (p照射后与对照组比较< 0.001)。8).褪黑素预处理在2小时内显著减少辐射诱导的氧化DNA链断裂(p< 0.05), 4h (p< 0.05), 8h (p< 0.01)。结果表明,褪黑素预处理对正常睾丸细胞(生精细胞)的DNA抗γ辐照诱导的氧化损伤提供了显著的保护(图。8).
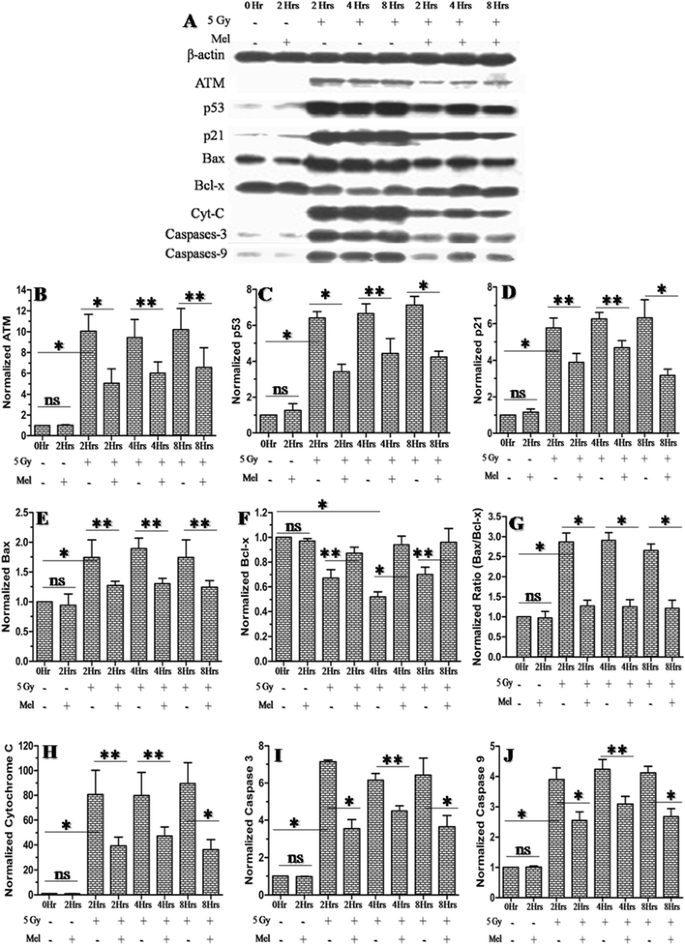
褪黑素对辐射诱导的atm依赖p53促凋亡蛋白和抗凋亡蛋白表达的调节作用
众所周知,ATM(共济失调毛细血管扩张突变)直接激活p53以响应电离辐射引起的DNA损伤。p53在激活几种促凋亡信号通路中起重要作用,包括p21、Bax、细胞色素C和活性caspases-3 [44].为了探讨褪黑素在调节ATM依赖性p53凋亡信号蛋白表达中的作用,我们在5 Gy全身γ照射后2h、4h和8h检测了ATM、p53、p21、Bax、Bcl-x、细胞色素C、活性caspases-3和caspases-9蛋白的表达规律。在5 Gy辐照后2h、4h和8h, ATM蛋白的细胞水平被发现上调,与对照组相比增加了约10倍(图2)。9 a - b).褪黑素预处理在辐照后2h、4h和8h抑制了辐射诱导的ATM蛋白的表达(约5倍)。9 a - b).5 Gy照射后2h、4h和8h, ATM依赖性p53凋亡信号通路p53、p21、Bax、细胞色素C、活性caspases-3和caspases-9也上调。蛋白表达增加约7倍,Bax和细胞色素C分别增加约2倍和80倍(图。9 c,d,e,h,我而且j).褪黑素预处理可抑制这些蛋白的表达约2 - 4倍,细胞色素C则减少约40倍(图4)。9 c,d,e,h,我而且j).结果表明,褪黑素的部分辐射防护作用可能是由于抑制atm依赖的p53相关凋亡信号蛋白的表达。我们还观察到抗凋亡Bcl-x蛋白在照射后2h、4h和8h (5 Gy)的显著抑制(图2)。9 f).Bcl-x蛋白表达的降低导致Bax/Bcl-x比值在所有时间点均相对升高。与正常对照组相比,辐照小鼠的Bax/Bcl-x比值高3 - 4倍(图2)。9克).褪黑素预处理使辐照小鼠的Bax/Bcl-x的上调比率降低了两到三倍(图2)。9克).有趣的是,褪黑素单独治疗并没有导致凋亡蛋白上游调控因子的表达模式发生任何变化(图。9克ydF4y2Ba).
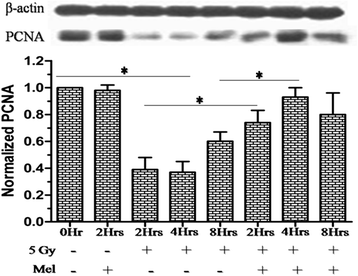
褪黑素对辐射诱导的生精细胞增殖蛋白PCNA的影响
生精细胞的进程对生精过程至关重要,因此,我们进一步评估了一种核蛋白和DNA聚合酶δ的辅助因子PCNA蛋白的表达模式,据报道,PCNA蛋白参与了rad6依赖的DNA修复途径,以响应DNA氧化损伤。在2h观察到PCNA蛋白显著下降(p< 0.001), 4h (p< 0.001)和8h (p< 0.01),表明PCNA的表达模式随着时间的推移而下降,直到照射后4h达到最大水平,随后升高(图1)。10).褪黑素预处理小鼠显示显著(P< 0.001)睾丸中PCNA的表达模式(图;10).这表明褪黑素预处理增加了PCNA蛋白表达,这对DNA修复和生精细胞增殖都很重要。
讨论
在计划的全身或局部辐射暴露场景中,保护生殖系统免受辐射诱导的氧化损伤是至关重要的。因此,开发用于放射医疗管理的预防制剂是必要的。在过去的几年里,一些化合物被研究用于同时使用这两种物质的放射性防护体外而且已模型系统[45- - - - - -47].人体应用的毒性和有效性仍然是主要问题。因此,寻找更少或无毒和更有效的辐射保护剂以供人类使用仍在继续[48,49].
睾丸具有内源性抗氧化防御系统,包括高度结构化的抗氧化酶、自由基清除剂和维持生精的低氧张力[43]和莱丁细胞的类固醇生成功能[43].然而,广泛的内源性和外源性因素,包括辐射,已知会扰乱这些防御系统,增加男性不育症[50,51].因此,辐射诱发的男性不育症在有计划的辐射照射下可以通过使用安全的辐射保护器来应对。
在早期的一项研究中,碳离子辐射暴露(高let)引起的细胞扰动包括:组织病理学的显著变化、脂质过氧化增加、DNA链断裂、染色体畸变、细胞凋亡和抗氧化状态失衡,以及小鼠睾丸中PARP-1(DNA修复酶)的失活[52].褪黑素治疗前后减少了碳离子辐射诱导的组织病理改变、DNA链断裂、脂质过氧化和细胞凋亡,与GSH和TAC的增加有关[53].此外,碳离子束还对产前和产后睾丸发育阶段产生有害影响。经观察,怀孕大鼠在妊娠第15天照射腹部,会影响雄性后代的繁殖活动[54].与高let照射相比,低let介导的损伤被认为主要是通过产生高活性自由基。据我们所知,没有文献报道褪黑素对低let介导的小鼠睾丸损伤的辐射保护作用。很少有组织病理学研究[23- - - - - -25表明褪黑素减少了低let介导的大鼠睾丸损伤。这些初步研究[23- - - - - -25]和Vijayalaxmi等人的辐射防护报告,[12- - - - - -22,促使我们对褪黑素在改善小鼠急性睾丸损伤中的辐射保护潜力进行了详细的研究。我们研究了褪黑素对小鼠急性睾丸辐射损伤的改善作用。我们的研究结果表明,褪黑素预处理通过恢复生精小管中的生精细胞群来减弱小鼠睾丸中γ射线诱导的急性睾丸损伤(图2)。1而且2)与精子活力和活力的增加有关(图。5)和减少精子异常(图。3.而且4).褪黑素的这些改善作用是由于它能够增加TAC水平(图。6),同时脂质过氧化降低(图;7)和DNA链断裂(ssb, dsb和不碱性病变)(图。8)。
阐明放射性防护药物的分子机制是新药审批过程中必不可少的。据我们所知,没有研究报道褪黑素在改善γ射线所致小鼠睾丸损伤中的分子机制。因此,本文研究了褪黑素对辐照小鼠睾丸细胞保护作用的分子机制。电离辐射诱导依赖于atm的p53激活响应DNA链断裂。p53基因在ATM、p53、p21、Bax、Bcl-x、细胞色素C、活性caspases-3、caspases-9等几种促/抗凋亡标志物的激活和动员中起着至关重要的作用[55- - - - - -60].其中,Bax通过p53将Bax动员到线粒体,诱导细胞凋亡。在线粒体膜中,Bax寡聚物的积累导致细胞色素C的释放,这导致半胱氨酸-天冬氨酸蛋白酶激活。细胞色素C的释放可阻止电子转移,导致线粒体膜电位的丧失和ATP的生成[59,61].抗凋亡标志物Bcl-2已被证明可以对抗Bax的作用,从而防止凋亡。促凋亡与抗凋亡蛋白的表达可能决定细胞对凋亡的敏感性。因此,平衡的Bax/Bcl-2蛋白比值(促凋亡蛋白与抗凋亡蛋白比值)对细胞存活具有重要意义[62,63].我们的western blot结果显示褪黑素预处理抑制了辐射诱导的ATM依赖性p53促凋亡标志物、ATM、p53、p21、Bax、细胞色素C、活性caspases-3和caspases-9的表达(图2)。9克ydF4y2Ba).促凋亡蛋白表达的降低与抗凋亡Bcl-x蛋白的增加有关,导致褪黑素预处理小鼠的Bax/Bcl-x比例平衡(图2)。9做减法).
细胞周期的进展对生精细胞的增殖至关重要。增殖细胞核抗原(PCNA)最初被认为是增殖细胞中的一种核抗原。随后,该蛋白被描述为DNA聚合酶δ的辅助因子,参与控制DNA复制和修复。PCNA蛋白水平仅在细胞周期的s期上升,并与p21抑制剂形成复合物。PCNA蛋白泛素化并参与rad6依赖的DNA修复途径,以响应DNA氧化损伤。在本研究中,褪黑素预处理增强了PCNA蛋白的表达,以应对辐射诱导的DNA损伤(图。10).
结论
褪黑素预处理减轻TAC和抑制γ射线诱导的脂质过氧化和DNA链断裂γ辐照小鼠的睾丸。褪黑素预处理可显著防止放射线诱导的精小管生精细胞耗竭以及附睾尾区精子异常、活力和活力。褪黑素预处理抑制了ATM依赖的p53凋亡信号蛋白ATM, p53, p21, Bax,细胞色素C,活性caspases-3和caspases-9。凋亡蛋白的抑制与抗凋亡bcl -x蛋白的增加有关。此外,褪黑素预处理还能保护RAD6 DNA修复- pcna蛋白。这些结果清楚地表明褪黑素在改善小鼠低let介导的睾丸损伤中的预防作用。这些结果将有助于了解褪黑素在男性生殖系统中的辐射保护潜力,并可用于接受全身和腹盆腔辐射照射的癌症放疗患者。
改变历史
11月2日
参考文献
化疗和放疗对精子发生的影响。欧洲,1993;23:136-41。
崔艳,高峰,李波,赵玲,钱玲,曹峰,王玲,孙霞,崔娟,蔡娟。富氢盐水通过还原羟基自由基来减弱辐射诱导小鼠雄性生殖细胞损失。生物化学学报(英文版);2012;
Oakberg EF。在小鼠成熟的不同阶段辐照生精细胞的敏感性和退化时间。辐射决议1955;2:369-91。
Sapp WJ, Philpott DE, Williams CS, Williams JW, Kato K, Miquel JM, Serova L. x射线照射、高LET (HZE)照射或航天飞行后精原细胞存活率的比较研究。Adv Space res 1992; 12:179-89。
申聪,姜延民,陈耀文,金海生。高剂量率和低剂量率γ辐照ICR小鼠附睾尾部精子的相对形态异常。辐射学报。2009;50:261-6。
奥美stuart AL, Shalet SM。辐射对人类生殖系统的影响。《环境卫生展望》,1993;101:109-16。
罗利MJ,利奇DR,华纳GA,海勒CG。不同剂量的电离辐射对人类睾丸的影响。辐射Res. 1974; 59:665-78。
放射诱导凋亡的新概念:“有丝分裂前凋亡”和“有丝分裂后凋亡”。中华细胞医学杂志2001;5:349 - 349。
尼克洛夫JA,胡克斯特拉MF。DNA损伤与修复:从噬菌体到人类的进展。胡玛纳出版社;2001.
放射生物学的化学基础。泰勒&弗朗西斯;1987.
卢建民,林福平,姚强,陈晨。抗氧化剂的化学和分子机制:实验方法和模型系统。中华医学杂志(英文版),2010;
Vijayalaxmi, Reiter RJ, Tan DX, Herman TS, Thomas Jr CR.褪黑素作为辐射保护剂:综述。放射与肿瘤生物物理杂志2004;59:639-53。
Vijayalaxmi, Selva M, Reiter RJ, Meltz ML, Prihoda TJ, Barnes J, Leal BZ, Dahiya RS, Herman TS.放疗对脑癌患者尿中6-磺化褪黑素水平的影响。神经内分泌杂志2000;21:203-7。
Vijayalaxmi, Meltz ML, Reiter RJ, Herman TS, Kumar KS。褪黑素和全身辐射的保护作用:小鼠的生存研究。Mutat Res. 1999; 425:21-7。
Vijayalaxmi, Meltz ML, Reiter RJ, Herman TS.褪黑素与血液和骨髓遗传损伤的保护:小鼠全身照射研究。松果体学报1999;27:21 - 5。
Vijayalaxmi, Reiter RJ, Herman TS, Meltz ML.褪黑素和辐射保护对遗传损伤的影响:人体志愿者体内/体外研究。Mutat Res. 1996; 371:221-8。
黄志强,李志强,李志强,等。褪黑素对辐射诱导的染色体损伤的保护作用。穆塔特决议1995;346:23-31。
Vijayalaxmi, Reiter RJ, Sewerynek E, Poeggeler B, Leal BZ, Meltz ML.褪黑素预处理对人血淋巴细胞辐射诱导微核的显著降低。辐射Res. 1995; 143:102-6。
Vijayalaxmi, Reiter RJ, Leal BZ, Meltz ML.褪黑素对人血淋巴细胞有丝分裂和增殖指数及姐妹染色单体交换的影响。Mutat Res. 1996; 351:187-92。
褪黑素降低γ辐射诱导的人血淋巴细胞DNA损伤。穆塔特决议1998;397:203-8。
Vijayalaxmi, Reiter RJ, Meltz ML, Herman TS.褪黑素:其“辐射防护”作用的可能机制。穆塔特决议1998;404:187-9。
Vijayalaxmi, Thomas Jr CR, Reiter RJ, Herman TS.褪黑素:从基础研究到癌症治疗临床。中华临床医学杂志,2002;20(4):366 - 366。
胡晓明,李志强,李志强,李志强,等。褪黑素对白化大鼠x射线致早期和急性睾丸损伤的保护作用。中华病理学杂志。2006;87:237-50。
莫尔杰科维奇Z, Alicelebic S, Bilalovic N. Susko I[褪黑素治疗大鼠全照射后Leydig细胞的形态特征]。医学Arh 1998; 52:183-4。
取G, Erdogan D, Helvacioglu F, Goktas G, Ozbey G, Uluoglu C, Yucel B, Guney Y, Hicsonmez A, Ozkan s。褪黑素和给药时间对辐照致大鼠睾丸损伤的影响。巴西医学生物学杂志2009;42:621-8。
陈晓明,李志强,李志强,等。人参对瑞士白化病小鼠睾丸磷酸酶和脂质过氧化水平的放射保护作用。生物医药,2003;26:308-12。
薄荷草对瑞士白化小鼠辐射诱导睾丸损伤的保护作用(Linn.)。基本临床药物。2009;104:329-34。
沙玛P,帕玛J,沙玛P, Verma P, Goyal PK.辐射致睾丸损伤及其药用植物Tinospora cordifolia提取物的改善。循证补体交替医学2011;2011:643847。
褪黑素:一种证据充分的具有条件促氧化作用的抗氧化剂。中国植物学报,2014;
莫内贝,日野M,苏美M,乌泽A,平山R,安藤K,小岛s。褪黑素对伽玛射线所致肠道损伤的保护作用。中华放射生物学杂志2005;81:855-60。
陈晓明,陈晓明,陈晓明,等。褪黑素对褪黑素的抑制作用。中国生物医学工程学报,1999,26(2):379 - 379。
马绍凯,李志刚,李志刚,李志刚。褪黑素体外抗氧化活性的研究。自由基生物医学1996;21:307-15。
褪黑素的抗氧化保护:从彻底解毒到彻底避免的多重机制。内分泌。2005;27:119-30。
Rodriguez C, Mayo JC, Sainz RM, Antolin I, Herrera F, Martin V, Reiter RJ。抗氧化酶的调节:褪黑素的重要作用。松果体学报2004;36:1-9。
Reiter RJ, Tan DX。褪黑素:可食用植物中的抗氧化剂。南京大学学报(自然科学版)2002;
Williams JP, Brown SL, Georges GE, Hauer-Jensen M, Hill RP, Huser AK, Kirsch DG, Macvittie TJ, Mason KA, Medhora MM等。辐射暴露医疗对策动物模型。辐射Res. 2010; 173:557-78。
Katalinic V, Modun D, Music I, Boban M. 2,2 ' -azinobis(3-乙基苯并噻唑啉6-磺酸盐)测定大鼠组织抗氧化能力的性别差异;ABTS)和铁还原抗氧化能力(FRAP)测定。中国生物化学杂志,2005;
赖斯-埃文斯C,新泽西州米勒。血浆和体液中的总抗氧化状态。方法酶制剂,1994;234:279-93。
大川,大石,八木。硫代巴比妥酸反应测定动物组织中脂质过氧化物。生物化学。1979;95:351-8。
Tice RR, Agurell E, Anderson D, Burlinson B, Hartmann A, Kobayashi H, Miyamae Y, Rojas E, Ryu JC, Sasaki YF。单细胞凝胶/彗星试验:体外和体内遗传毒理学测试指南。环境分子诱变剂。2000;35:206-21。
一种利用蛋白质-染料结合原理快速而灵敏地定量微量蛋白质的方法。《肛门生物化学》1976;72:248-54。
柯德利E,弗雷塞尼亚AM,莱特G, Eleuteri P,斯帕诺M,维拉尼P.睾丸X射线照射对小鼠精子发生不同阶段DNA损伤的评价。辐射决议2003;160:443-51。
陈华,刘杰,罗林,牟柏格,金建民,齐金布。维生素E,衰老和Leydig细胞类固醇生成。Exp Gerontol. 2005; 40:728-36。
菲P, El-Deiry WS。P53和辐射反应。致癌基因。2003;22:5774 - 83。
Singh VK, Ducey EJ, Brown DS, Whitnall MH.武装部队放射生物学研究所正在进行的辐射对策工作综述。国际放射生物学杂志,2012;
维斯摩根富林明。预防辐射致死性和其他损害的药理学方法。《环境卫生展望》,1997;105:1473-8。
库马尔KS, Srinivasan V, Toles R, Jobe L, Seed TM。放射性防护的营养方法:维生素e。Mil Med. 2002; 167:57-9。
Pellmar TC, Rockwell S,辐射/核威胁对策工作G.辐射核威胁对策的优先研究领域列表。辐射Res. 2005; 163:115-23。
种子TM。辐射防护剂:现状与未来展望。卫生物理,2005;89:531-45。
Aitken RJ, De Iuliis GN。男性生殖细胞DNA损伤的起源和后果。《生物医学杂志》2007;14:727-33。
Jedlinska-Krakowska M, Bomba G, Jakubowski K, Rotkiewicz T, Jana B, Penkowski A.氧化应激和补充维生素E和C对大鼠睾丸形态的影响。中华医学杂志,2006;52:203-9。
张慧,赵伟,王艳,李娜,吴忠,刘勇,陈娟,蔡艳。低剂量C(6+)离子预暴露对小鼠睾丸精原细胞和精母细胞细胞遗传适应性的诱导。穆塔特决议2008;653:109-12。
刘颖,张宏,张玲,张霞,谢艳,赵伟。褪黑素对碳离子致小鼠急性睾丸损伤的调节作用。Pharmazie。2009;64:685-9。
王波,村上M,江口嘉井K,野岛K,尚Y,田中K,藤田K, Coffigny H,早田I.产前加速重离子束照射对大鼠出生后发育的影响:I.神经生理改变。辐射Res. 2005; 164:561-6。
杨晓明,陈晓明,陈晓明,等。BcI2、Bax与p53的关系:细胞周期进展与细胞死亡的关系。《中国科学》1998;4:1099-109。
儿童ES,曼恩DJ。p21磷酸化的复杂性:蛋白/蛋白相互作用,亚细胞定位和稳定性。细胞周期。2006;5:13 - 9。
Hemann MT, Lowe SW。p53-Bcl-2连接。《细胞死亡差异》,2006;13:1256-9。
Kaelin Jr . WG。p53基因家族。致癌基因。1999;18:7701-5。
里德JC。促凋亡多域Bcl-2/ bax家族蛋白:机制、生理作用和治疗机会细胞死亡差异。2006;13:1378-86。
杨东,张志刚,张志刚。BCL2家族在DNA损伤和细胞周期调控中的作用。《细胞死亡差异》,2006;13:1351-9。
蔡j, Wallace DC, Zhivotovsky B, Jones DP。在缺乏线粒体DNA的细胞中,从硫醇-二硫化氧化还原变化中分离细胞色素c依赖的半胱天冬酶激活。自由基生物学杂志2000;29:34 - 42。
Rupnow BA, Knox SJ。放射诱导的细胞凋亡作为肿瘤对放射治疗反应的决定因素。细胞凋亡。1999;4:115-43。
张志刚,张志刚。辐射诱导细胞凋亡。细胞组织决议2000;301:133-42。
确认
Shahanshah Khan非常感谢德里核医学和联合科学研究所所长提供的工作设施。作者非常感谢Anjali Sharma夫人的手术60Co γ辐射源和B G Roy博士的动物设施。这项工作得到了印度国防部国防研究与发展组织“安全化学辐射保护器的开发”(NBC 1.29)项目的支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
构思并设计实验:SK JSA MAR NKC。执行实验:SK JSA。分析数据:SK JSA NKC。贡献的试剂/材料/分析工具:SK JSA MAR NKC。写论文:SK NKC。审稿:MAR.数据解释:SK NKC。数据采集:SK JSA NKC。全面监督和批评意见:JSA MAR NKC。所有作者都阅读并批准了最终的手稿。
额外的文件
附加文件1:图S1。
褪黑素预处理对全身暴露小鼠支持细胞的影响60γ-射线。颈椎脱位处死动物,1号取睾丸圣3理查德·道金斯7th, 15th和30th天机理。固定处理后,用H和E染色睾丸横切面(5 um),分析并表示支持细胞。ns =无意义。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。
本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。
如欲查看本牌照的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献弃权书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Khan, S., Adhikari, j.s., Rizvi, ma .et al。褪黑素的辐射防护潜力60Co γ射线致雄性C57BL/6小鼠睾丸损伤。生物科学22, 61(2015)。https://doi.org/10.1186/s12929-015-0156-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12929-015-0156-9
关键字
- 褪黑激素
- γ-射线
- DNA链断裂
- 自动取款机
- TAC
- 精子发生的细胞
- 精子异常