摘要
3D打印有望根据患者特定的解剖数据,根据计算机设计生产复杂的生物医学设备。自最初用于术前可视化模型和工具模具以来,3D打印已经慢慢演变为创建独一无二的设备、植入物、组织工程支架、诊断平台和药物输送系统。由于最近公众兴趣的爆炸式增长和廉价打印机的普及,人们重新对将干细胞与定制3D支架结合起来用于个性化再生医学产生了兴趣。在3D打印可以常规用于复杂组织(例如骨骼,软骨,肌肉,血管,颅颌面复合体中的神经)的再生,以及具有复杂3D微结构的复杂器官(例如肝脏,淋巴器官)的再生之前,必须解决几个技术限制。在这篇综述中,主要的材料和技术进步在过去五年内,每一种常见的3D打印技术(三维打印,熔融沉积建模,选择性激光烧结,立体光刻,和3D绘图/直写/生物打印)进行了描述。例子突出说明在组织工程中的每项技术的进展,并确定了关键的局限性,以激励未来的研究和推进先进制造的这一迷人的领域。
简介
设计和制造复杂的3D生物医学设备的能力在组织工程中至关重要。三维生物医学设备的应用包括三维解剖缺陷的修复,具有复杂三维微结构的复杂器官的重建(如肝脏,淋巴器官),以及干细胞分化的支架。需要的一个例子是由癌症、创伤和先天性缺陷引起的颅颌面复合体的解剖缺陷。这些缺陷的适当恢复需要功能神经,血管,肌肉,韧带,软骨,骨骼,淋巴结和腺体。
近年来,基于组织工程原理的各种方法已被探索用于再生与颌面部组织再生相关的其他功能组织。在组织工程中,支架在为细胞浸润和增殖提供结构、为细胞外基质生成和重塑提供空间、指导细胞行为的生化线索以及为损伤组织提供物理连接方面至关重要。在制作支架时,宏观、微观和纳米层面的架构设计对于结构、养分运输和细胞-基质相互作用条件很重要[1-3.].宏观结构是设备的整体形状,可以是复杂的(例如患者和器官的特异性,解剖特征)。微结构反映了组织结构(如孔隙大小、形状、孔隙度、空间分布和孔隙互连)。纳米结构是表面修饰(例如用于细胞粘附、增殖和分化的生物分子附着)。
尽管理想的支架可以考虑所有这些因素,但在生物材料选择和3D形状特异性方面仍然存在挑战。常用的生物材料有聚合物(合成的和天然的)、陶瓷和金属。每种生物材料都有特定的材料和机械性能、加工方法、化学特性、细胞-材料相互作用和FDA批准。产生孔隙率和孔隙大小范围的常见制造方法有气体发泡、颗粒浸出溶剂铸造、冷冻干燥和电纺丝。虽然这些方法中的微观结构可以很好地控制和理解,但使用这些方法控制宏观结构的能力仅限于由模具和手工加工确定的3D形状和几何形状。在使用这些方法时,合并内部架构或弯曲通道的能力也受到限制。
固体自由形式制造(SFF)允许设计和制造复杂的3D结构,这可以是特定的患者。计算机辅助设计、先进成像技术(即磁共振成像和计算机断层扫描)和快速原型技术的集成,使宏观和微观结构控制的物体都得到了先进的制造。此外,患者特定的成像可用于为个人定制构建[4,5].作为一种快速原型,SFF提供了一种方法来控制微观和宏观架构,以创建复杂的生物医学设备。大多数表面修饰可以在后处理中完成。传统的材料处理技术在支架工程中非常有效,SFF技术为高度复杂的颌面组织工程提供了令人兴奋的机会。然而,每种技术都有其局限性。制造技术的选择取决于感兴趣的材料,机器的限制,以及最终支架的具体要求。
术语“3D打印”应该澄清,以防止混淆在这篇评论文章。目前在文献和主流媒体中,术语“3D打印”被用来指所有SFF技术(例如,熔融沉积建模,选择性激光烧结等)。在这篇综述中,该术语将以两种方式使用:一般指所有SFF技术,以及指下面详细描述的基于液体粘合剂的喷墨技术。该术语的用法将在不同部分中明确。
最先进的3D打印技术,特别是用于可植入生物医学设备的生产,受到可打印材料的严重限制。因此,在大多数情况下,需要替代材料加工方法来处理不易印刷的材料。在材料可以打印的情况下,3D打印对于独一无二的定制复杂设备特别有优势,这些设备在传统的制造方法(如注塑)中不具有成本效益。
虽然工业3D打印机在过去几年中已经达到了极高的分辨率,但机器性能的进步并没有转化为生物材料的使用。工业3D打印机现在可以达到非常小的构建层,例如SLA的16 μm层厚度(Polyjet, Stratasys), FDM的178 μm层厚度(Fortus 900mc, Stratasys), SLS的80 μm层厚度(sPro 230HS, 3D Systems)和SLA的75 μm分辨率(3D Systems)。不幸的是,这些系统并没有针对感兴趣的生物材料进行优化在体外而且在活的有机体内研究和进展仍在改进生物材料的SFF方法。
这些技术的成本目前很难比较,因为许多进步是基于自制的设置或创意工程师对商业机器的修改。实际成本将更容易比较,当材料成为大规模适应工业3D打印机。这一阶段还将决定打印和后期处理的易用性。即使使用目前的建模材料,大多数打印机也需要某种类型的牺牲支撑材料,需要小心去除
SFF方法,尤其是FDM,最近流行起来并迅速传播开来。机器是专门为家庭、学校和小型企业开发的,与工业级机器相比,价格更低,复杂性更低。此外,低成本的消费者3D扫描仪和免费的CAD软件允许那些对SFF感兴趣的人在家里自己设计和制造零件。虽然这些技术以前主要局限于学术界和工业界,但SFF已经成为主流使用,现在有更多的人了解了这些技术的功能。
本文重点介绍了先进的3D打印技术,这些技术被用于制造组织工程支架,重点介绍了这些制造技术沿着复杂的3D梯度对细胞和多种材料进行建模的能力。这些技术中的许多已经用于为术前规划、手术模板和假体制造制造患者特定模型。一些植入式装置已经获得了FDA的许可。特别强调过去五年所做的工作,以显示该领域的进展。
组织工程支架的3D打印
大多数SFF方法在一层一层的过程中构建3D生物医学设备。一般的SFF过程包括1)创建3D计算机模型(可以从CT扫描或x光等医学成像数据生成)2)用软件将3D计算机模型切片成2D图像的构建文件,3)通过计算机控制的逐层过程制作构建,4)完成任何后期处理,如纳米结构的表面修改。复杂的三维特征,如内部空隙、悬臂、底洞和狭窄曲折的路径,简单地简化为一堆常见的二维特征,如圆、线和点。由于不受加工路径限制,这些增材技术提供了更高的形状复杂性。虽然这些SFF技术主要是为工业应用开发的,但它们在创建复杂三维形状方面的灵活性使SFF技术成为生物医学工程的有吸引力的候选技术。引入了各种SFF技术来构建具有可控宏观结构的对象以及具有生物医学和组织工程应用的微观结构。形式的自由,结合适当的材料沉积技术,通过在制造过程中同时指导细胞、信号和支架基质的空间分布,提供了对组织工程三位一体的控制。此外,这些技术允许在数字化医学成像数据与计算机辅助设计模型之间进行集成[5,6].SFF技术与患者特定的医学成像数据的集成使得组织工程移植物的无菌制造能够精确匹配患者的轮廓。这些技术使得多功能支架的制造能够满足基于优化模型的结构、机械和营养要求[7].
对于这篇综述,简要概述了五种流行的SFF技术,并提供了组织工程应用的例子。对于每种技术,将回顾机器能力和可打印生物材料的最新进展。
三维打印
技术描述及应用
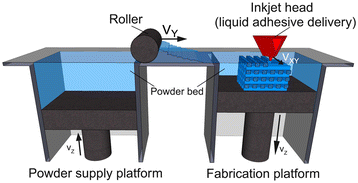
三维打印技术由麻省理工学院发明,通过喷墨将液体粘结剂溶液打印到粉末床上,制造三维结构[8-10].由于大多数生物材料以固体或液体状态存在,因此广泛的材料已用于印刷。这个过程首先在活塞上均匀地涂上一层细粉末材料。X-Y定位系统和打印头同步,通过在粉末层上选择性沉积粘结剂液滴来打印所需的2D图案(图1) [11].活塞、粉末床和零件放低,再撒下一层粉末。drop-spread-print循环重复,直到整个部分完成。去除未结合的粉末,就可以看到被制造的部分。通过指定适当的打印头来沉积适当的粘合剂的预定体积,可以操纵局部组成。通过在制造过程中改变打印参数,可以控制局部微观结构[12].微通道的加入有效地分布了整个装置内部的额外播种表面,提高了有效播种密度和均匀性。图案表面化学可能提供空间控制多种细胞类型的细胞分布。这种技术受到打印头可靠性和特征分辨率之间竞争需求的限制,因为小喷嘴可以制造更精细的特征,但更容易堵塞。目前的分辨率限制为一维特征(如最薄的可打印线的宽度)为100 μm,三维特征(如最薄的可打印垂直壁的厚度)为300 μm。
3D打印原理图。3D打印是一种将液体粘合剂逐层沉积在薄层粉末上以创建3D物体的过程。转载须经[11].
由于物体是由周围的无界粉末支撑的,因此使用这种技术可以很容易地制造复杂的支架,如内部通道或悬挂特征。Kim等人结合3DP颗粒浸出技术制作了高多孔支架,并证明细胞向支架内长入[13].此外,室温处理条件允许将温度敏感材料,如药物和生物制剂掺入支架[10].Lam等人通过打印蒸馏水制备淀粉基支架,证明了在制备过程中使用生物制剂和活细胞的可行性[14].该技术用于组织工程的另一个有利特点是多“色”打印,其中每种颜色的墨水可以定位在精确的位置上。这一特性提供了令人兴奋的潜力,可以同时排列多种类型的细胞,沉积多种额外的细胞基质材料,并对生物活性制剂进行点对点控制,用于生物组织制造。在这方面,3DP在可打印材料的选择上可能比其他SFF技术更灵活。广泛的生物制剂,如多肽、蛋白质(如纤维蛋白原、胶原蛋白)、多糖(如透明质酸、海藻酸盐)、DNA质粒和活细胞已被3DP打印。这些生物材料的沉积需要对工业3DP机器进行改造。特别是细胞必须保存在适当的环境中,有适当的温度、氧和营养供应。
以前用于直接3DP的其他材料包括由合成聚合物(即聚(ε-己内酯)、聚乳酸-乙酸或聚(l -乳酸))与有机溶剂作为粘结剂组成的粉末[10,13,15]及以水为粘合剂的天然聚合物粉(即淀粉、葡聚糖及明胶)[14,16].间接3DP打印一个模具,然后用最终的聚合物和致孔材料铸造。以前用于间接3DP打印模具的材料包括市售石膏粉(即半水硫酸钙石膏粉)和水性粘合剂。然后用可降解聚合物的浆液浇铸模具,该浆液溶解在与孔隙剂混合的溶剂中(即氯仿聚乳酸-聚乙二醇与氯化钠混合)[17,18].由此形成的多孔支架如图所示2有绒毛状的柱子[17].组织工程师已使用3DP技术直接从羟基磷灰石(HA)粉末中制备具有完全连通通道的多孔陶瓷支架,用于骨置换[16].根据患者的医疗信息,可以制造定制的解剖形状的HA结构。该技术还允许构建双相支架来再生混合组织系统,如颞下颌关节(TMJ)。Sherwood等人开发了骨软骨复合结构,其中上部区域由D,L-PLGA/L-PLA组成,孔隙率为90%,用于软骨再生,下部区域由L-PLGA/TCP复合材料组成,以最大限度地提高骨长入[19].采用3DP技术与颗粒浸出技术相结合,形成了一种高多孔支架。
由间接3D打印创建的带有绒毛状支柱的PLGA支架。支架是通过间接3DP将多孔剂和溶解在溶剂中的聚合物包装在3D打印模具中创建的。所得到的支架具有所需的绒毛状支柱(一)高孔隙度和互联性(b).转载须经[17].
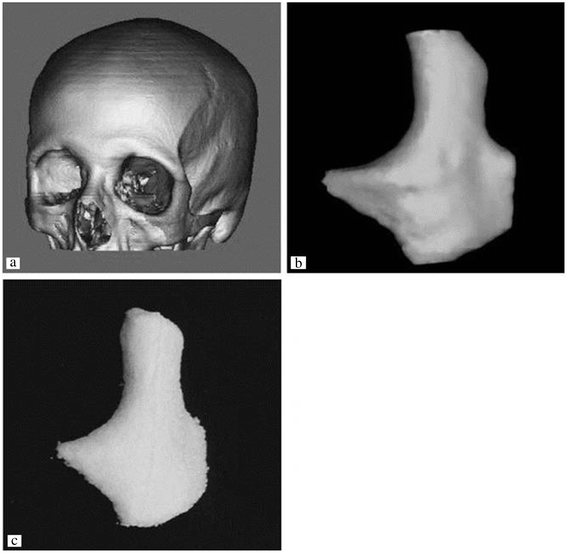
这个问题是通过一个实用的,间接的3DP协议来解决的,其中模具被打印出来,最终的材料被铸造到模具型腔[17,18].在间接技术中,使用市售石膏粉打印模具,并将可生物降解的聚合物浇铸到打印模具中。许多不同的材料可以在相似的打印工艺参数下铸造,而在传统的直接3DP方法中,需要优化各个工艺参数以最大限度地提高构建分辨率。该技术可应用于颧骨骨折的治疗。Lee等人从CT数据中证明了间接3DP方法直接构建颧骨支架的能力,如图所示3.[17].
3D打印支架可以针对不同的患者。由CT 2D图像生成颧骨瘤(a, b)间接3DP制备颧型支架(c).转载须经[17].
直接3DP的一个优势是直接控制微观结构(即孔径大小)和宏观结构(即整体形状)。使用致孔剂作为粉末的印刷品在浸出后具有高的孔隙连通性,均匀的孔隙度和确定的孔径。该方法已被证明可制备支持肝细胞长入的支架[13].与间接3DP不同,它对宏观架构没有限制,也不需要拆除。直接3DP的一个限制是有机溶剂可以溶解大多数打印头中使用的聚合物。为了克服这一限制,研究人员使用模板将聚合物溶液分布在孔隙颗粒(NaCl)上,以制造支架[13].然而,使用模板防止制造高度复杂的形状或小的特征。有机溶剂兼容,高精度打印头可用,但它们是针对狭窄范围的聚合物溶液进行优化的。直接3DP的另一个限制是层厚度必须大于孔隙颗粒尺寸,并且小于150 μm的最大阈值,以在打印过程中保持层间连通性和零件强度[12].为了克服孔隙尺寸的限制,必须打印更大的孔隙。3DP的一个缺点是,当在制造之前将致孔剂掺入粉末中时,最终结构中的可用孔径有限[15].当粉末材料为可降解聚合物时,支架的形状复杂性也受到限制。此外,这种可降解聚合物的3DP方法要求使用有机溶剂作为液体粘合剂。由于有机溶剂可以溶解大多数商业上可获得的按需滴式打印头组件,报告的研究需要使用定制机器,通过模板的高分辨率射流[15].然而,这种方法对于复杂结构是不切实际的。间接3DP克服了直接3DP的许多局限性。在间接技术中,使用商业上可用的建模材料(如石膏)打印模具,并将可生物降解的聚合物浇铸到打印的模具中。许多不同的材料可以在相似的打印工艺参数下铸造,而在传统的直接3DP方法中,需要优化各个工艺参数以最大限度地提高构建分辨率。该技术可应用于颧骨骨折的治疗。水性粘合剂的使用允许使用消费级喷墨打印头,并消除了对模板的需求[17].由于在印刷后引入模腔,孔隙尺寸不受限制,不影响印刷分辨率或层间互联性。由于不受粉末材料性质的影响,聚合物-孔隙剂组合具有很高的材料灵活性。该方法可用于创建小的、高纵横比的特征(即小肠绒毛)或大规模的、高多孔的支架(即孔径为300-500 μm的解剖学形状的颧骨支架)[18].间接3DP的局限性是:1)在复杂特征(即复杂的内部底孔或交叉通道)中均匀、高密度地填充孔隙的挑战;2)由于难以拆除,形状或特征设计受到限制。不完整的包装将导致均匀的微观结构和期望的宏观结构的损失。
3DP的主要优势是由于室温加工和粉末形式的材料,可以使用广泛的材料,能够打印悬垂和内部结构,以及微结构控制。3D打印的缺点是由于商业打印头的溶解而限制使用有机溶剂作为粘合剂,并且难以从小或弯曲的通道中去除未绑定的粉末。
最近的材料和技术进步
3DP材料包括聚磷酸钙和聚乙烯醇[20.], HA和TCP [21-25, TCP [26-29], TCP与SrO和MgO掺杂[30.,31]、透明质酸和磷灰石硅灰石玻璃陶瓷配水基粘结剂[32]、与胶原蛋白结合的磷酸钙[33], plga [34)和Farringtonite粉(Mg3.(PO4)2) [35].间接3DP明胶预制体中使用的材料被PCL和壳聚糖取代[36].牛软骨细胞用于关节软骨组织工程的体外研究[20.]、骨组织工程[21,22,25,26,37],来自RAW 264.7细胞系的单核细胞[22]、人类成骨细胞[23,29,32,34], C2C12前成肌细胞系[24],以及骨髓基质细胞[36].已用兔颅骨进行体内研究[26]、兔胫骨及猪上颌骨[24],大鼠股骨缺损[28,30.],小鼠股骨缺损[33]、兔股骨[31].
熔融沉积建模
技术描述及应用
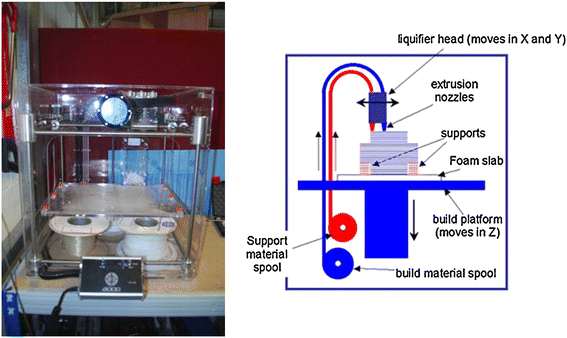
熔融沉积建模(FDM)是指熔融的热塑性材料通过两个加热挤压头以特定的铺设模式沉积,挤压头上有一个小孔[38].一个喷嘴沉积热塑性材料,第二个喷嘴沉积临时材料以支撑悬臂。在FDM中,传统的方法之一是将热塑性聚合物熔解成半液态,然后头部将材料挤压到构建平台上(图2)4) [39].该部件以一层一层的方式构建,其中各层被融合在一起。由于FDM可以使用多个挤压喷嘴,每个喷嘴都使用不同的材料,因此FDM在所有三个维度上的成分梯度都没有理论上的限制。然而,这并没有被简化为实践。
熔融沉积建模示意图。在熔融沉积建模中,热塑性纤维被加热成液体,并通过喷嘴以特定的铺设模式挤出,以创建支架。转载须获[39].
FDM材料最重要的选材标准是传热特性和流变性(液体流动行为)。热塑性塑料由于熔融温度低而被广泛使用。PVC、尼龙、ABS、熔模铸造蜡均已成功应用。在生物应用中,PCL因其熔融温度低(~60°C),玻璃化转变温度低(-60°C),热稳定性高[38,40].PLGA之前已与FDM一起用于制作支架,然而,PLGA的高玻璃化转变温度(40-60°C)使得加工PLGA具有挑战性,需要更高的挤出温度[41,42].该材料被加热到~110-140°C,以创建正确的材料流动特性,以便从喷嘴挤出和层的融合[38,40-42].可以使用流变改性剂,但必须具有生物相容性。
可控变量为光栅厚度、光栅间隙宽度(光栅之间的空间)、光栅角度和层厚度(取决于挤压尖端直径)。这使得支架具有可控的孔径、形态和互联性。挤出的熔融液体必须足够热,以迅速诱导与先前挤出的材料融合,并迅速凝固,以最大限度地减少流量和特征尺寸。此外,材料的粘度是至关重要的,既要足够高,以允许挤压通过精细喷嘴,又要足够低
通过控制挤压头的x-y运动,生物相容性材料制成了具有不同孔隙形态和通道大小的支架[38].材料也可以在该技术中组合,如聚对苯二甲酸乙二醇酯/聚对苯二甲酸丁二烯或聚丙烯/TCP [43,44].其他复合材料如PCL/HA或PCL/TCP用于FDM,因为其具有良好的骨再生机械和生化性能[45].
FDM的主要优点是由于铺放方式而产生的高孔隙率和良好的机械强度。FDM面临的一个挑战是对具有良好熔体粘度特性的热塑性材料的限制,这种材料具有足够高的粘度来构建,但具有足够低的粘度来挤压。此外,这些特性对于生物脚手架材料来说具有有限的形状复杂性,通常会导致相对规则的结构[40].应该注意的是,对于使用具有最佳热学和流变性能但缺乏生物相容性的工业材料的FDM,几何复杂性不受限制。FDM的另一个缺点是由于加工温度高,无法在挤压过程中加入活细胞或对温度敏感的生物制剂。
最近的材料和技术进步
FDM常用低熔点的生物相容性聚合物。FDM用于制作支架的材料为PCL和生物活性玻璃复合材料[46], l -乳酸酯/e-己内酯[46],胶原浸润PLGA [47, PCL-TCP与庆大霉素[48, pcl-tcp [49, PLGA-TCP和HA涂层[42, pcl-plga-tcp [50], plga-pcl [51],涂有明胶的PCL [52], PCL [53,54], pmma [55],及PLA [46].猪软骨细胞已进行体外研究[47],小鼠前成骨细胞[52],以及骨髓来源间充质干细胞[53].用小鼠动物模型进行伤口愈合的体内研究[48]、人类颅面缺损病人[49],及兔骨缺损[42,50].应用包括软骨组织工程、抗生素输送系统[48]、人类的骨性颅面缺损[49,55],以及骨组织工程[13].
虽然FDM灯丝的数量每个月都在增加,但与传统注射成型可以形成的热塑性塑料的总数相比,材料的选择显得苍白。最近的一项进展可能会极大地增加3D打印可用材料的范围,并将其从原型设计方法转变为可行的制造方法,即将精密注塑成型纳入3D打印龙门架。这种组合具有巨大的潜力,因为它可以加工大多数作为传统注塑球团存在的热塑性塑料,而无需预处理成细粉末或传统的FDM细丝。它本质上是最终结构的无模具注射成型,使制造一种,一次一个病人的医疗设备成为可能[56].
有限元
技术描述及应用
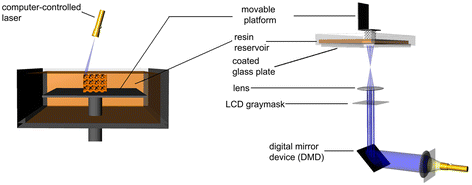
立体光刻(SLA)被认为是第一个快速成型工艺,于20世纪80年代末开发[57].原始SLA光栅hecd激光束,以2D模式控制光固化树脂的聚合[58].在每一层固化后,附着固化结构的平台以自下而上的方式降低,另一层未固化的液体树脂覆盖在顶部。最上面的图层现在已经准备好了。对于自顶向下的方法,光被投射到一个透明板上,最初定位于靠近容器底部的液体树脂(图5) [59].将一层模压穿过透明板后,固化结构与透明板分离。所述固化结构凸起,以允许未固化的液态树脂填充在所述结构与透明板之间的空间。下一层现在已经准备好绘制图案了。由于光栅激光束可能会很慢,特别是对于较大的部件,因此掩模灯技术被开发出来一次固化整个光敏聚合物层。结构建成后,通过排水将未聚合的液态树脂除去。在UV烘箱中固化后可转换任何未反应的基团,并增强部分[60].
有限元示意图。立体平版印刷是光固化树脂聚合的自下而上系统与扫描激光(左)或自上而下设置与数字光投影(右)。转载须获许可[59].
聚合过程中发生的固化反应动力学是至关重要的。这影响固化时间和聚合层的厚度。动力学可以通过光源的功率、扫描速度、单体和光引发剂的化学性质和用量来控制。此外,可在树脂中加入UV吸收剂,以控制聚合深度[61].
材料必须具有光固化部分才能进行光交联。STL中使用的典型材料包括丙烯酸和环氧树脂。在组织工程应用中,很少有生物可降解和生物相容性的生物材料在光聚合过程中尺寸稳定。光交联聚富马酸丙烯(PPF) [62]通常用于SLA,并已用于制造复杂的具有可控微结构的三维支架,用于重建兔颅骨缺损[58].PPF需要一种活性稀释剂,如富马酸二乙酯或n -乙烯基-2-吡咯烷酮,以降低树脂的粘度,以达到适当的加工条件[63].这些稀释剂引入了大量的不可降解成分。用SLA处理了含和不含生物陶瓷分散体的树脂。
SLA的医学应用包括为术前规划制作解剖模型,以及通过使用SLA模式制作模具间接制造医疗设备(例如填充SLA结构以用作负模)[64,65]。基于SLA模型,采用电火花加工钛合金种植体构件。
SLA的优点是能够创建具有内部结构的复杂形状,易于去除未聚合树脂,以及极高的特征分辨率(~1.2 um) [66].SLA的主要缺点是缺乏具有适当SLA加工性能的生物相容性树脂。额外的挑战是使用可能具有细胞毒性的光引发剂和自由基(处理时间长),未反应单体和剩余光引发剂的夹持,以及无法沿水平平面创建成分梯度。光聚合树脂也有较差的机械性能,这是硬组织工程所需要的。最后,临时支撑结构必须纳入CAD模型,以制造无支撑的特征(如悬挑,悬臂)。完全拆除支撑结构可能很困难。
最近的材料和技术进步
SLA的最新改进包括增加光交联聚合物库和一次构建使用多种树脂。在过去的几年里,更多的聚合物被合成含有脂肪族聚酯,允许生物降解。由此产生的宏观聚合物是丙烯酸,允许光交联能力。在支架的不同区域使用荧光标记的右旋糖酐、荧光标记的生物活性聚乙二醇或生物活性聚乙二醇对PEG- dma和PEG- da进行图形化显示,在一个构建中使用多种树脂[67].当更换材料时,将支架从树脂池中取出,用蒸馏水冲洗,然后将新的树脂添加到桶中。使用一个夹具来保持支架的X-Y对齐,以确保层的对齐。动态掩码投影SLA已经能够实现横向分辨率的∼2 μm,垂直分辨率∼PPF树脂为1 μm [68].尽管在创建水平通道和防止结构收缩方面仍存在挑战,但该技术能够生产的微结构非常详细。
SLA最近增加了具有可生物降解部分的树脂库,并在加工过程中封装细胞。新合成的高分子化合物包括PCL(三臂端羟基)片段[69]或poly(d,l丙交酯)[63,70,71].光固化聚(D, l -乳酸)(PLLA)树脂不使用活性稀释剂已开发和应用于SLA [70].端基被修饰为丙烯酸酯或甲基丙烯酸酯,以允许光交联能力。最近用于制造SLA支架的另一种树脂是PPF-DEF [72,73]和PPF-DEF与BMP-2负载PLGA微球[74].PPF-DEF或PPF-DEF与HA用于μSL (<5 μm分辨率),尽管聚合物的收缩会导致部分翘曲[68,75].聚(碳酸三亚甲基)高分子聚合物已用于柔性弹性应用,其刚度为22-156千帕[76]例如软骨组织工程[77].用小鼠前成骨细胞在体外研究了更坚硬的结构[70],人脐静脉内皮细胞[78]、大鼠骨髓细胞[73], MC3T3-E1前成骨细胞[63,72,74],以及人类间充质干细胞[71].SLA的一大应用是骨组织工程[79],体内研究显示,在大鼠颅骨缺损中促进骨形成[74].对于更柔软、更灵活的应用,如软骨组织工程,已经用牛软骨细胞进行了体外研究[77].研究发现,与用盐浸和聚(d,l-乳酸)低聚物及PFF-DEF [73,80].NIH/3T3细胞的PEG-DA显示SLA期间细胞包封[81]和PEG-DMA与人类软骨细胞,尽管使用喷墨打印机[82].
选择性激光烧结/熔化
技术描述及应用
选择性激光烧结(SLS)是1989年由美国德克萨斯大学发展起来的。SLS类似于3DP,将粉末颗粒粘结在薄层上,除了CO2使用激光束(图6) [83].激光以特定的2D模式扫描粉状聚合物颗粒的表面,通过将它们加热到玻璃化转变温度以上进行烧结。在烧结过程中,分子沿颗粒最外表面扩散,导致相邻颗粒之间形成颈部。在创建一层后,将包含该部件的活塞降低,并在顶部表面滚过一层新的粉末材料。随后的层形成并与前一层绑定。松散的粉末在零件完成后被去除,并经过热处理以达到全密度。与SLA不同,不需要临时支撑结构,因为未绑定的固体颗粒支持任何悬臂结构。由于烧结不会导致粉末颗粒完全熔化,因此可以保留原始颗粒之间的孔隙率,可以加工各种纯材料和混合材料。
选择性激光烧结原理图。选择性激光烧结使用激光将粉末颗粒融合在一起,以创建3D支架。在每层熔融层之间都铺上薄薄的粉末层。转载须获[83].
而在0.5-1 T之间的大多数材料都可以实现固态烧结融化、选择性激光熔炼(SLM)和电子束熔炼(EBM)利用强大的能量加热T以上的粉末融化使粒子完全融合成一个完全致密的、固结的结构。在实践中,如果所有的粉末都具有单一熔点,则更容易熔化,因此由于液态金属流动行为、表面张力和激光-材料相互作用的变化,纯金属比合金更容易熔化。因此,SLM的材料范围比SLS更有限。
特征的分辨率由粉末粒径、聚焦激光束直径和粉末床内的传热决定。由于扩散不良和烧结过快导致边缘不准确,粒径限制为10 um。常用材料为聚氯联苯及聚醚醚酮和羟基磷灰石的组合[84-87].使用生物材料,通常制作薄的固体圆盘,但特征是在~400-500 μm尺度上制作。
以前涂层陶瓷粉末和热塑性塑料已用于SLS。由于陶瓷粉的玻璃化转变温度和熔点过高,需要中间粘结材料。中间粘结材料在陶瓷粉末之前熔化,使陶瓷颗粒融合在一起。Tan等用聚合物包覆磷酸钙粉末烧结制备磷酸钙骨植入物[88].在零件建成和多余的粉末去除后,后处理(例如在烤箱中额外烧结)会增加零件的强度,但会导致零件的收缩。聚乙烯醇(PVA)和羟基磷灰石(HA)的生物复合混合物也用于SLS [89].通过喷雾干燥或物理共混,将HA颗粒涂上水溶性PVA。这些部件用于颅面和关节缺损的应用。Williams等人制备了具有多孔结构和足够力学性能的PCL支架,用于骨组织工程应用[90].
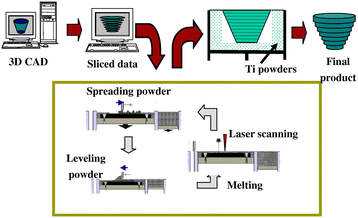
该技术也适用于医学数据,以创建解剖特定结构。使用来自猪髁突的CT数据证明了该技术中的下颌髁支架[90].计算设计和SLS技术的集成使得能够制造具有解剖形状的外部结构和多孔内部结构的支架。FDA最近批准使用SLS加工医用级聚醚醚酮(PEEK),以制作定制的颅面植入物。最近,SLM被用于创建第一个患者特异性的、准备植入的钛下颌骨,它接受牙科植入物以支持下颌假牙[91].
SLS/SLM/EBM的主要优势是能够直接制造金属植入物,促进骨生长和再生,用于需要高断裂韧性和机械强度的承重应用。即使是非承载应用,聚合物也可以在不使用有机溶剂的情况下进行加工。SLS的成分梯度比SLA的成分梯度要容易一些,但在水平面上的成分梯度非常有限。主要缺点是有限的材料在激光束(高温)下熔合但不分解,以及需要清除被困粉末的后处理。另一个限制是激光热的传导和扩散会导致相邻粉末颗粒不必要的融合,限制了最终特征的分辨率。最后,较小的孔隙尺寸是有限的,因为所产生的孔隙取决于所使用的粉末的粒径。太小的粉末颗粒不能使用,因为粉末结块导致扩散不良。
最近的材料和技术进步
SLS的最新进展是能够产生更低刚度的支架和更高分辨率的特征。PCL支架已在300-400 kPa的较低刚度下生产[87]高于之前报告的14.9-113.4 MPa [85,86,90,92].这种较低的硬度允许软组织工程的应用,如心脏组织。
通过使用多面体库来控制孔隙率,简化了制作功能梯度支架(FGS,改变零件内的刚度)的CAD/CAM过程。然后处理的孔隙度与支架的刚度有关,并在SLS中用PCL演示[93].关于微建筑设计发展的全面回顾,请参阅[94].此外,FEA已被用于帮助设计微结构和预测SLS的力学性能[92,95].
对于SLS,常用的材料是PCL和HA [92,96,97], PCL和β-TCP与胶原蛋白涂层[98], Ca-P/PHBV和CHAp/PLLA [99,One hundred.],及PVA [101].为了证明生物分子的包封性,牛血清白蛋白被包封在Ca-P/PHBV微粒中,并处理[102].体外研究已使用C2C12成肌细胞进行心脏组织工程[87, SaOS-2细胞[99]、人骨髓基质细胞[103],以及人类骨祖细胞[52]、猪脂肪干细胞[98,104],及MG-63 [101]用于骨组织工程。在裸鼠身上进行的体内研究表明,更好的编织骨和血管组织形成[98].应用于骨组织工程和脊柱融合术的椎间笼[97].
3D绘图/直写生物打印
技术描述及应用
2000年,弗莱堡材料研究中心开发了3D绘图技术,用于制作软组织支架。三维绘图是基于将粘性液体材料(通常是溶液、膏体或分散体)从加压注射器挤压到具有匹配密度的液体介质中。通过喷嘴或注射器将材料沉积成一长串或单个点,以创建所需的陶瓷、聚合物或水凝胶的3D形状[105].该工艺可以在室温或高温下进行,但不像FDM那样涉及热塑性塑料。
这种SFF方法特别适用于天然生物材料制备水凝胶。Landers等人在溶液中使用了热可逆的天然聚合物,如琼脂和明胶。将该溶液加热并在~80°C下挤压到较冷的明胶或硅油液体介质(~20°C)中,以快速凝固加热溶液。[106,107].另一种方法是将聚合物挤压到含有反应物的液体介质中进行交联。一个例子是将明胶挤压成钙2 +微血管系统贮存器[108].对于其他材料,如TCP,用水制成溶液,从注射器挤出,然后冻干以除去液体[109].每根支撑杆的直径为~400 μm。
主要优点是材料的灵活性和室温处理(如果适用)。此外,由于加工条件的原因,许多其他SFF技术不能使用天然聚合物。一个关键的缺点是难以制造复杂的形状与悬垂,因为临时的,牺牲的材料是需要的。此外,这种方法生成的水凝胶具有较低的刚度,可能导致结构的倒塌或形状复杂性的限制。
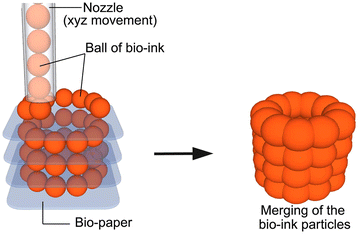
类似地,生物打印是直接与细胞结合的水凝胶结构的制造(图7).在细胞打印策略的处理过程中添加细胞,例如从注射器挤出海藻酸盐细胞(牛软骨细胞)溶液[110],在培养基中静电驱动喷墨打印牛血管内皮细胞[111]、激光引导直接写入胚胎鸡脊髓细胞[112],以及海藻酸盐中悬浮细胞的激光诱导正向转移[113].该技术提供了细胞或生长因子以及支架结构的可控空间分布。然而,这种制备技术一般仅限于海藻酸盐和纤维蛋白等水凝胶材料,对于需要较强力学性能的生物环境的植入来说可能并不理想。示例应用是大鼠平滑肌细胞负载的胶原蛋白液滴(直径650 μm)在3D中创建特定的细胞空间模式[114].这种SFF方法特别适用于低粘度材料,由于挤压材料与液体介质的密度匹配而产生的浮力防止了形状的坍塌。绞线厚度可根据材料粘度、沉积速度、挤压尖端直径和施加压力而变化。
生物打印示意图。在生物打印中,由细胞和水凝胶材料(如海藻酸盐或脱细胞细胞外基质)组成的生物墨水小球被打印成所需的形状。转载须经[11].
生物打印的主要优点是室温处理(如果适用),细胞的直接掺入和细胞的均匀分布。主要缺点是机械刚度有限,凝胶时间的关键时机,材料和液体介质密度的特定匹配以保持形状,以及低分辨率。进一步开发最适合生物因子打印的材料,以及可以在同一平台上分别沉积多种生物因子和材料的下一代打印头,将为创造满足组织工程支架复杂生物学要求的结构提供潜力。
最近的材料和技术进步
生物标绘材料包括PLGA、TCP、胶原蛋白和壳聚糖[109],壳聚糖[115],胶原蛋白-海藻酸盐-二氧化硅复合材料包覆HA [116]、大豆蛋白[117,118],以及琼脂糖加明胶[107].已对小鼠前成骨细胞进行了体外研究[116]和人类间充质干细胞[117].已对绵羊骑士缺陷进行了体内研究[109].应用范围包括骨组织工程[109,116]、组织再生[118].
生物打印材料为含人脐静脉平滑肌细胞(HUVSMCs)和人皮肤成纤维细胞(棒)的琼脂糖[119],明胶- ha - tetrappeg - da与NIH 3T3s(棒)[120],大鼠原代膀胱平滑肌细胞中的胶原滴[114],人微血管内皮细胞纤维蛋白(喷墨打印机)[121],以及海藻酸液滴[108].主要应用于血管组织工程[108,119-121].
最近的研究表明,生物打印单细胞和细胞负载水凝胶- pcl支架的能力。“Block-Cell-Printing”已显示出单细胞阵列的高通量打印[122].钩形陷阱的微流控阵列用于捕获单个细胞。捕获细胞可配对分离5 μm,用于研究细胞通讯。在本研究中,捕获的原代大鼠皮层神经元被培养,细胞表现出神经元形态。Ahn等人通过将4°C的细胞-海藻酸盐溶液挤压到-10°C的阶段来生物打印高密度细胞负载水凝胶[123].海藻酸盐被交联,通过在氯化钙中培养结构来提供强度2解决方案。人间充质干细胞和人成骨样细胞经处理后具有良好的细胞活力。最后,一层一层的工艺交替沉积软骨细胞负载的水凝胶液滴(海藻酸盐或脱细胞的细胞外基质生物墨水)和PCL在一层一层的过程中创建一个3D结构[124-126)(图7).
生物因子打印技术的最新进展允许在制造过程中同时打印制药和生物制剂。Xu等人证明了喷墨打印技术可以精确地将细胞和蛋白质放置在3D海藻酸盐结构中[127].
未来的方向
在不牺牲支架的形状、强度和可操纵性的情况下,3D打印技术需要进一步提高分辨率。解剖特征和组织结构可能具有数百微米尺度的细节(例如直径约500 um的小肠绒毛)。扩散消耗模型表明,氧气输送到细胞的支架的极限为200 μm,导致细胞存活的最大直径特征为400 μm [128].对于SLS和3DP来说,在不增加尺寸的情况下创建更坚固的结构都是一个挑战。为了制造出能在制造过程中存活下来的小特征,粉末颗粒必须紧密地结合在一起。通过增加SLS的激光强度或3DP的粘结剂数量,额外的粉末颗粒将结合,从而增加尺寸。为了将SLS和3DP的分辨率提高到400-500 μm以下,还需要做更多的工作。此外,未结合的困粉很难从小通道中去除。未来的工作需要创造出可以用传统的高压空气方法轻松去除的粉末。一种策略是制造球形粉末颗粒,这将有助于在狭窄的空间中去除。
虽然SLA可以达到极高的分辨率,但生物降解、生物相容性树脂的数量有限。在合成具有可生物降解部分的新高分子方面已经取得了进展,然而,这些材料尚未获得FDA批准。FDM、SLS和3DP能够使用PLGA、PLLA和PCL等聚合物,而无需化学修饰,这将有助于加快FDA对生物医学设备的未来批准。
尽管宏观和微观架构在过去五年中取得了巨大的进步,但更多的工作应该集中在纳米架构(例如生化分子)上。由于SFF方法的苛刻的加工条件(如热,有机溶剂),生化分子通常不会直接加入到支架中。虽然生物化学分子可以在后处理中被涂层到结构上,但随着时间的推移,需要持续释放生长因子。因此,将生化分子直接纳入支架以延长释放的策略将是必要的。
虽然这篇综述文章的重点是3D支架的制造技术和生物材料,但由于厚支架内的质量传输限制,材料的降解动力学和副产物实际上是3D支架中一个非常重要的问题。这是一个移动的边界扩散反应问题,即使没有可生物降解的生物材料,也会导致支架内缺氧和酸中毒。预计酸性降解产物的释放将加剧酸中毒,从而可能损害种子细胞和/或周围细胞”。
参考文献
Karande TS, Ong JL, Agrawal CM。肌肉骨骼组织工程支架的扩散:与孔隙度、渗透性、结构和营养混合有关的设计问题。中国生物医学工程学报。2004;32:1728-43。
霍利斯特SJ。组织工程多孔支架设计。清华大学学报,2005;4:518-24。
史蒂文斯MM,乔治JH。探索和设计细胞表面界面。科学。2005;310:1135-8。
温德,毕布。医学快速原型技术:在口腔颌面外科应用的现状和目前的限制。中华口腔颌面外科杂志,2005;33(3):344 - 344。
Colin A, Boire J-Y。一种用于pc上简单3D医学图像处理应用程序的快速原型和开发的新工具。计算方法程序,生物科学,1997;53:87-92。
Winder J.医疗快速原型和三维CT在制造定制的颅骨钛板。中华医学工程杂志1999;23:26-8。
李志强,李志强,李志强,等。模拟组织特性和满足生物学约束的支架的优化设计和制造。生物材料。2002;23:4095 - 103。
Cima MJ, Sachs E, Cima LG, Yoo J, Khanuja S, Borland SW,等。3D打印的计算机衍生微结构:生物和结构材料。Solid Freeform Fabr Symp Proc: DTIC文件;1994.p . 181 - 90
格里菲斯LG,吴B,西玛MJ,鲍尔斯MJ, Chaignaud B, Vacanti JP。肝组织的体外器官生成。南京大学学报(自然科学版),2001;
Wu BM, Borland SW, Giordano RA, Cima LG, Sachs EM, Cima MJ。固体自由形式的给药装置制造。《控制释放》1996;40:77-87。
陈建平,陈建平,陈建平,陈建平。水凝胶快速成型技术在组织工程中的应用。生物材料。2012;33:6020-41。
吴BM, Cima MJ。三维打印过程中溶剂-颗粒相互作用动力学对微观结构形成的影响。高分子材料学报,1999;39(3):344 - 344。
金世山,宇都宫,孙杰,吴文敏,西马MJ,等。肝细胞在具有固有通道网络的新型三维合成生物可降解聚合物支架上的生存和功能。安外科1998;228:8。
林CXF,莫XM,赵淑贞,何志伟DW。使用淀粉基聚合物3D打印支架开发。科学与工程学报。2002;20:49-56。
泽尔廷格J,谢伍德JK,格雷厄姆达,Müeller R,格里菲斯LG。孔隙大小和孔隙率对细胞粘附、增殖和基质沉积的影响。组织工程,2001;7:557-72。
Seitz H, Rieder W, Irsen S, Leukers B, Tille C.用于骨组织工程的多孔陶瓷支架的三维打印。中国生物医学工程学报,2005;26(2):344 - 344。
李敏,邓建勇,吴国明。间接三维打印支架制造。生物材料。2005;26:4281-9。
李敏,吴国明,邓建勇。支架结构和孔隙大小对平滑肌细胞生长的影响。中国生物医学工程学报(英文版);2008;
Sherwood JK, Riley SL, Palazzolo R, Brown SC, Monkhouse DC, Coates M,等。用于关节软骨修复的三维骨软骨复合支架。生物材料。2002;23:4739-51。
Shanjani Y, Croos D, Amritha J, Pilliar RM, Kandel RA, Toyserkani E.用于组织工程目的的多孔聚磷酸钙结构的固体自由形态制备和表征。中国生物医学工程学报。2010;29(3):344 - 344。
张晓明,张晓明,张晓明。不同磷酸钙颗粒对骨组织工程支架三维打印的影响。工程学报。2009;11:B41-B6。
Detsch R, Schaefer S, Deisinger U, Ziegler G, Seitz H, Leukers B. 3D打印磷酸钙支架表面的体外破骨细胞活性研究。生物工程学报,2010。
沃恩克PH, Seitz H, Warnke F, Becker ST, Sivananthan S, Sherry E,等。由计算机辅助3D打印和烧结生产的陶瓷支架:表征和生物相容性研究。中国生物医学工程学报。2010;29(3):344 - 344。
阿巴拉特吉A,莫雷诺-维森特C, Martínez-Vázquez FJ,西文托斯A,拉莫斯V,桑兹-卡萨多JV,等。含BMP-2的固体自由形态陶瓷支架的生物学特性:体内外评价。科学通报。2012;7:e34117。
张志刚,张志刚,张志刚,等。内植:3D打印定制多孔支架用于异位骨诱导。口腔医学杂志2009;45:e181-e8。
塔米米F, Torres J, Gbureck U, Lopez-Cabarcos E, Bassett DC, Alkhraisat MH,等。兔颅面垂直骨增强:3D打印单片金钱石块与自体嵌体移植的比较。生物材料。2009;30:6318-26。
Butscher A, Bohner M, Roth C, Ernstberger A, Heuberger R, Doebelin N,等。用于组织工程支架三维打印的磷酸钙粉体的印刷适性。生物学报2012;8:373-85。
Tarafder S, Balla VK, Davies NM, Bandyopadhyay A, Bose S.微波烧结3D打印磷酸三钙骨组织工程支架。中华医学杂志,2013;7:631-41。
桑托斯CF,席尔瓦AP,洛佩斯L,皮雷I,科雷亚IJ。烧结β-磷酸三钙三维骨组织再生支架的设计与制作。科学技术与工程学报。2012;
Tarafder S, Davies NM, Bandyopadhyay A, Bose S. 3D打印磷酸三钙骨组织工程支架:SrO和MgO掺杂对大鼠股骨远端缺损模型体内成骨的影响。生物科学学报,2013;1:1250-9。
Tarafder S, Dernell WS, Bandyopadhyay A, Bose S. SrO‐和MgO‐掺杂微波烧结3D打印磷酸三钙支架:兔模型的力学性能和体内成骨。生物医学研究B辑:应用生物医学。2014
王志强,王志强,王志强,等。三维打印法制备磷灰石-硅灰石玻璃陶瓷增强羟基磷灰石复合材料的力学性能。中华医学科学杂志(英文版);2009;20(4):489 - 489。
Inzana JA, Olvera D, Fuller SM, Kelly JP, Graeve OA, Schwarz EM,等。3D打印用于骨再生的复合磷酸钙和胶原蛋白支架。生物材料。2014;35:4026-34。
葛志,王林,恒广,田学锋,卢凯,范文武,等。人成骨细胞在3D打印聚乳酸-羟基乙酸支架内的增殖和分化。生物工程学报,2009;23:533-47。
Klammert U, Vorndran E, Reuther T, Müller FA, Zorn K, Gbureck U. 3D粉末打印低温制备磷酸镁水泥支架。中华医学科学杂志(英文版),2010;21:2947-53。
李建勇,崔波,吴波,李敏。间接三维打印技术用于组织工程的定制仿生支架。生物制造。2013;5:045003。
Bose S, Vahabzadeh S, Bandyopadhyay . 3D打印骨组织工程。今日板牙。2013;16:496-504。
蔡志刚,陈志刚,陈志刚。组织工程中新型支架结构的熔融沉积建模。生物材料。2002;23:1169 - 85。
牙科设备的未来是数字化的。邓特·脱线。2012;28:3-12。
胡德伟,陈志强,陈志强,陈志强,陈志强。聚己内酯支架的力学性能及细胞培养反应。生物医学杂志2001;55:23 3 - 16。
朴硕,朴世德,申继伟,姜益国,金宏科,尹志林,等。通过快速成型技术,由两种不同材料制备的骨组织工程支架:PCL vs PLGA。中华医学科学杂志2012;23:2671-8。
Kim J, McBride S, Tellis B, Alvarez-Urena P, Song Y-H, Dean DD,等。快速原型PLGA/β-TCP/羟基磷灰石纳米复合支架兔股骨缺损模型。生物制造。2012;4:025003。
陈志伟,陈志伟,陈志伟,等。基于三维纤维沉积技术的软骨组织工程多孔支架的研究。生物材料。2004;25:4149 - 61。
王志强,王志强,王志强,等。聚合物-陶瓷复合材料支架的研究进展。科学与工程学报。2003;23:611-20。
曹涛,陈峰,李志强,李志强,等。rhBMP-2对植入三维生物活性聚己内酯支架的犬成骨细胞的影响。生物材料。2004;25:5499 - 506。
刘志强,刘志强,刘志强,Närhi T, Seppälä J.熔融沉积法制备生物降解支架结构。中国生物医学工程杂志,2013;
甄海杰,曾志生,邵海华,蔡志良。用填充II型胶原的熔融沉积制造(FDM)制成的高多孔支架中软骨细胞生长的评估。生物医学微设备。2009;11:615-24。
张怡,王世勇,孔冲MS,张震,陆杰,Moochhala S,等。聚己内酯为基础的融合沉积模型网格用于向感染伤口输送抗菌剂。生物材料。2011;32:279 - 87。
Probst F, hutacher D, Müller D, Machens H, Schantz J.定制生物活性种植体的颅骨重建。中国科学。2010;42:369-73。
沈建辉,文天生,尹明杰,全永昌,郑长明,赵德伟,等。采用固体自由形态制备技术,PCL/PLGA与TCP混合支架刺激兔颅骨缺损愈合。中华医学科学杂志2012;23:2993-3002。
金志勇,赵德伟。采用多头沉积系统制备混合PCL/PLGA支架。电子工程学报,2009;
范巴埃尔,戴梅特,柴玉c,皮卡G,杜bruel P, Kruth J-P,等。选择性激光烧结和等离子体表面功能化聚己内酯骨再生支架的体外细胞生物学性能和结构表征。清华大学学报(自然科学版),2013;
姜世伟,裴建华,朴世安,金卫东,朴明生,高永杰,等。BMP-2和骨髓间充质干细胞联合治疗可增强3D作图系统制备的PCL支架在大节段缺损模型中的骨愈合效果。生物技术,2012;34:1375-84。
沈建华,李建生,金志勇,赵德伟。使用多头组织/器官构建系统的骨软骨组织工程的机械增强三维双细胞负载结构的生物打印。微机械学报,2012;22:085014。
Espalin D, Arcaute K, Rodriguez D, Medina F, Posner M, Wicker R.患者特异性聚甲基丙烯酸甲酯植入物的熔融沉积建模。快速成型技术,2010;
Arburg. 3D打印与自由形式从Arburg。
自动建模缩短了设计时间和成本。塑料工程,1989;45:43-5。
Fisher JP, Dean D, Mikos AG。富马酸二乙酯/聚富马酸丙烯生物材料的光交联特性及力学性能。生物材料。2002;23:4333-43。
李文杰,李志强,李志强。立体光刻技术及其在生物医学工程中的应用综述。生物材料。2010;31:6121-30。
王伟林,谢明明,傅建华,陆磊。工艺参数对立体光刻零件收缩的影响。板料设计。1996;17:205-13。
Heller C, Schwentenwein M, Russmueller G, Varga F, Stampfl J, Liska R.乙烯基酯:低细胞毒性单体,用于基于光刻的增材制造生物相容性3D支架。高分子学报。2009;29(3):349 - 349。
李k - w, Wang S, Fox BC, Ritman EL, Yaszemski MJ, Lu L.用立体光版技术制备聚富马酸丙烯骨组织工程支架:树脂配方和激光参数的影响。《生物高分子。2007;8:1077 - 84。
杨森,梅彻斯FP, Grijpma DW, Feijen J.富马酸单乙基酯功能化聚(d, l-乳酸)/ n -乙烯基-2-吡咯烷酮树脂用于组织工程支架的立体成像制备。《生物高分子。2008;10:214-20。
姜华伟,赵德伟。间接立体光刻技术的发展,支架制造具有广泛的生物材料选择性。组织工程C部分方法。2012;18:719-29。
朴志辉,郑继伟,姜华伟,赵德伟。基于热成型工艺的合成聚合物支架间接三维打印。生物制造。2014;6:025003。
张旭,蒋旭,孙成。聚合物和陶瓷微结构的显微立体光刻。传感器执行器A:物理,1999;77:149-56。
Arcaute K, Mann B, Wicker R.空间控制多材料生物活性聚乙二醇支架的立体光刻。生物学报,2010;6:1047-54。
崔建伟,李世华,崔克华,何春生,郑毅。三维生物相容性/可生物降解微支架的动态掩膜投影显微立体刻蚀技术。中国机械工程学报。2009;26(3):349 - 349。
Elomaa L,特谢拉S,哈卡拉R, Korhonen H, Grijpma DW, Seppälä JV。立体光刻法制备聚ε-己内酯基组织工程支架。生物学报。2011;7:3850-6。
李文杰,李志强,李志强。用立体光刻技术制备组织工程支架的聚(D, l -乳酸)树脂。生物材料。2009;30:3801-9。
谢晓峰,李志强,李志强。采用聚(乙二醇)/聚(d, l-乳酸)基树脂,采用立体光刻法制备生物可降解水凝胶结构。J控制释放,2010;148:34-41。
申建辉,李继伟,郑继辉,赵德伟,林国强。功能肽处理聚富马酸丙烯三维支架细胞增殖和分化的评价。中国科学(英文版),2011;
Kim K, Dean D, Wallace J, Breithaupt R, Mikos AG, Fisher JP。立体光刻支架结构和组成对大鼠骨髓基质细胞成骨信号表达的影响。生物材料。2011;32:3750 - 63。
李继伟,姜坤,李硕,金志勇,李伯凯,赵德伟。骨再生使用微立体平刻法生产的定制聚(富马酸丙烯)/富马酸二乙酯光聚合物3D支架,结合BMP-2负载PLGA微球。生物材料。2011;32:744-52。
李继伟,安贵,金世德,赵德伟。利用PPF/DEF-HA和微立体光刻技术开发纳米和微尺度复合三维支架。电子工程学报,2009;
Schüller‐Ravoo S, Feijen J, Grijpma DW。用立体光刻法制备柔性和弹性聚(碳酸三亚甲)结构。生物科学进展。2011;11:1662-71。
Schüller‐Ravoo S,特谢拉SM, Feijen J, Grijpma DW, Poot AA。基于聚(三亚甲基碳酸酯)树脂的立体光刻制备软骨组织工程柔性和弹性支架。生物科学进展。2013;13:1711-9。
高文R,陈永春,李继伟,Soman P, Zorlutuna P, Nichol JW,等。利用三维投影立体光刻技术制备复杂多孔组织工程支架。生物材料。2012;33:3824-34。
金K,叶芝A,迪安D,费雪JP。立体光刻骨支架设计参数:成骨分化和信号表达。组织工程Part B Rev. 2010; 16:523-39。
Melchels FP, Barradas A, Van Blitterswijk CA, De Boer J, Feijen J, Grijpma DW。组织工程支架结构对细胞播种和培养的影响。生物学报。2010;6:4208-17。
陈伟,郑俊华,孔海华,巴希,等。水凝胶三维光模式的立体光刻技术。实验室芯片。2010;10:2062-70。
崔x, Breitenkamp K, Finn M, Lotz M, D'Lima DD.基于三维生物打印技术的人体软骨直接修复。组织工程Part A. 2012; 18:1304-12。
帕塔纳亚克DK,福田A,松下T,竹本M,藤林S,佐佐木K,等。生物活性钛金属类似于人类松质骨:选择性激光熔化和化学处理制备。生物学报。2011;7:1398-406。
Lohfeld S, Tyndyk M, Cahill S, Flaherty N, Barron V, McHugh P.一种通过选择性激光烧结制备组织工程支架小特征的方法。中国生物医学工程学报,2010;3:138-47。
梁桂芳,刘玉玉,刘玉玉。聚- < i > ε -己内酯/羟基磷灰石选择性激光烧结制备组织工程支架材料。生物学报。2007;3:1-12。
陈坤,蔡超,梁坤,谢超,张鹏,Abu Bakar M,等。采用选择性激光烧结聚醚醚酮-羟基磷灰石生物复合材料共混物的支架开发。生物材料。2003;24:3115-23。
韦英,Sudarmadji N, Yu H, Chua C, Leong K, Venkatraman S,等。选择性激光烧结制备心脏组织工程用多孔聚己内酯支架。生物学报。2010;6:2028-34。
谭克勤,蔡志强,梁克富,谢志明,桂伟,谭伟,等。生物相容性聚合物在组织工程中的选择性激光烧结。中国生物医学工程学报(英文版);2005;
蔡超,梁凯,谭凯,陈志伟,谢志强。聚乙烯醇/羟基磷灰石生物复合材料选择性激光烧结用于颅面和关节缺损的组织支架的研制。中华医学科学杂志(英文版)2004;
Williams JM, Adewunmi A, Schek RM, Flanagan CL, Krebsbach PH, Feinberg SE,等。选择性激光烧结制备聚己内酯支架的骨组织工程研究。生物材料。2005;26:4817-27。
尼克尔斯L.世界上第一个患者专用颌骨植入物。金属粉末报告,2012;67:12-4。
选择性激光烧结制备具有一维、二维和三维正交取向多孔结构的聚己内酯支架的力学和微观结构性能。生物学报。2010;6:2467-76。
陈建民,陈建民,陈建民,陈建民。激光烧结多面体功能梯度支架材料力学性能与孔隙率关系的研究。生物学报,2011;7:530-7。
贾尼泰利,阿科多,李志强,李志强。计算机辅助组织工程支架设计的研究进展。生物学报。2014;10:580-94。
选择性激光烧结制备骨组织工程用聚己内酯-羟基磷灰石复合支架的压缩力学性能的微观力学有限元模拟和实验表征。生物学报。2012;8:3138-43。
Eosoly S, Brabazon D, Lohfeld S, Looney L.羟基磷灰石/聚ε-己内酯支架的选择性激光烧结。生物学报,2010;6:2511-7。
康宏,Hollister SJ, La Marca F, Park P,林承勇。基于激光烧结整体局部拓扑优化的多孔可生物降解腰椎椎间融合器设计与制造。中国生物工程学报,2013;
廖海涛,李美美,蔡文伟,王兴华,陆卫武。通过选择性激光烧结和i型胶原表面涂层制备的聚己内酯-β‐磷酸三钙支架上脂肪来源干细胞的成骨。
段乙,王敏,周文文,张王力,李志智,陆伟伟。选择性激光烧结制备三维纳米复合材料骨组织工程支架。生物学报。2010;6:4495-505。
段斌,王敏。骨组织工程专用Ca-P /PHBV纳米复合支架:设计、制造、表面改性和生长因子缓释。J R Soc Interface. 2010;7: S615-S29。
帅超,毛震,卢红,聂勇,胡红,彭松。选择性激光烧结制备骨组织工程多孔聚乙烯醇支架。生物制造。2013;5:015014。
段斌,王敏。选择性激光烧结制备Ca-P /PHBV纳米复合微球及三维支架生物分子的包封与释放。《大学学报》2010;95:1655-64。
夏勇,周鹏,程霞,谢勇,梁超,李超,等。选择性激光烧结制备纳米羟基磷灰石/聚ε-己内酯骨组织工程支架。国际纳米医学杂志,2013;8:4197。
张建生,张志明,张志强,张志强,等。聚乙烯醇/硅酸钙选择性激光烧结制备复合多孔支架。生物活性和相容性聚合物:生物医学应用。2014;29:110-20。
lander R, Mülhaupt R.通过计算机辅助设计结合聚合物和活性低聚物的计算机引导3D绘图,实现复杂物体、原型和生物医学支架的桌面制造。生物化学学报,2000;42(2):344 - 344。
lander R, Hübner U, Schmelzeisen R, Mülhaupt R.来自热可逆水凝胶的支架的快速成型,并为组织工程中的应用量身定制。生物材料。2002;23:4437-47。
马赫·P, Keatch R, Donnelly K, Paxton J.通过快速成型技术形成三维生物支架。国际医学和生物工程联合会第四次欧洲会议:施普林格;2009.2200 - 4页。
Pataky K, Braschler T, Negro A, Renaud P, Lutolf MP, Brugger J.水凝胶生物墨水的微滴打印成3D组织样几何。Adv Mater. 2012; 24:391-6。
Haberstroh K, Ritter K, Kuschnierz J, Bormann KH, Kaps C, Carvalho C,等。由胶原处理的磷酸三钙或磷酸三钙壳聚糖胶原水凝胶或PLGA制成的细胞种子3D生物标线复合支架对绵羊临界大小颅骨缺损进行骨修复。中国生物医学工程学报。2010;29(3):344 - 344。
柯恒,马龙龙,李普生,李文杰。以任意几何形状直接自由制造种子水凝胶。组织工程,2006;12:1325-35。
中村M,小林A,高木F,渡边A,平间Y,大口K,等。用于设计单个活细胞播种的生物相容性喷墨打印技术。组织工程,2005;11:1658-66。
Odde DJ, Renn MJ。激光引导的活细胞直接写入。生物技术,2000;67:312-8。
郭文杰,郭文杰,郭文杰,等。皮肤细胞和人类干细胞的激光打印。组织工程C部分方法。2009;16:847-54。
文文山,宋玉生,徐峰,何凯乐,曼祖尔,等。一层一层的三维组织外延由载细胞的水凝胶液滴。组织工程C部分方法。2009;16:157-66。
林涛,钱克士,梁克福。具有可控微观和宏观结构的壳聚糖支架的低温成型及其对体内新血管化和细胞浸润的影响。中国生物医学工程学报,2010;
李华,金毅,金松,金吉。用低温生物标图工艺制备的矿化仿生胶原蛋白/海藻酸盐/二氧化硅复合支架用于硬组织再生:制备、表征和体外细胞活性。B. 2014。
钱建斌,马丽达,沙荣。用于组织再生的大豆蛋白支架的三维打印。组织工程C部分方法。2012;19:17 - 26。
钱凯比,阿瓜多BA, Bryce PJ, Shah RN。三维多孔大豆蛋白支架的体内急性和体液反应。生物学报,2013;9:883 - 90。
罗丽娟,王志强,王志强。基于生物打印技术的无支架血管组织工程研究。生物材料。2009;30:5910-7。
张军,张志刚,张志刚。使用透明质酸水凝胶交联四面体聚乙二醇四酸酯的生物打印容器状结构。生物材料。2010;31:6173 - 81。
崔晓霞,王晓明。利用热喷墨打印技术制备人体微血管。生物材料。2009;30:6221-7。
张凯,周昌奎,夏霞,洪明春,秦林。一种用于活单细胞打印的块细胞打印技术。美国国家科学院学报,2014:201313661
安山,李华,李艳杰,金国强。一种直接细胞打印辅助低温处理方法制备高多孔三维细胞负载支架。J Mater Chem . 2014; 2:2773-82。
昆都J,沈建辉,张俊,金文文,赵德伟。基于添加剂制造的pcl -海藻酸盐-软骨细胞生物打印支架用于软骨组织工程。《组织工程与再生医学》2013。
李建生,洪建民,郑建伟,沈建辉,吴建辉,赵德伟。3D打印复杂形状复合组织在耳再生中的应用。生物制造。2014;6:024103。
张俊,何德华,李建伟,陈建华,等。用脱细胞细胞外基质生物墨水打印三维组织类似物。4 . Nat Commun. 2014
徐涛,金军,郭志刚,刘志刚,刘志刚。哺乳动物细胞喷墨打印技术研究进展。生物材料。2005;26:93-9。
Dunn JCY, Chan WY, cristina V, Kim JS, Lowengrub J, Singh S,等。三维支架细胞生长分析。组织工程,2006;12:705-16。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
HNC和BMW构思、撰写并编辑了手稿。两位作者都已阅读并批准了最终稿。
权利和权限
这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
贾宏宁,吴伯明。生物材料3D打印技术的最新进展。J生物工程9, 4(2015)。https://doi.org/10.1186/s13036-015-0001-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13036-015-0001-4
关键字
- 3 d打印技术
- 熔融沉积建模
- 选择性激光烧结
- 有限元
- 计算机辅助组织工程
- 三维绘图
- 生物打印