摘要
MicroRNAs (miRNAs)是调控非编码rna,对细胞分化和增殖等细胞过程的许多方面都很重要。在T细胞中,许多mirna的功能已经被确定,miR-181a在胸腺T细胞发育和外周T细胞激活期间调节T细胞激活阈值。有趣的是,miR-181a与老年人的抗病毒和疫苗反应缺陷有关,因为它在naïve T细胞中的表达随着年龄的增长而下降。在这里,我们回顾了由miR-181a调控的通路,并解释了miR-181a在T细胞发育、T细胞激活和抗病毒T细胞反应中的独特作用。这些研究为理解T细胞中miR-181a表达下降如何导致适应性免疫中与年龄相关的缺陷提供了框架。我们进一步回顾了导致miR-181a年龄相关表达下降的机制,并讨论了恢复miR-181a表达或靶向miR-181a调控通路以改善老年人受损T细胞反应的潜力。
背景
microRNAs (miRNAs)是一种小的非编码rna,通过翻译抑制或mRNA降解在转录后调节基因表达。通过靶向许多参与共同调控途径的基因,它们在包括细胞发育和分化在内的基本生物过程中起着关键的调节作用[1]。早期对T细胞特异性mirna缺陷小鼠的研究发现T细胞分化、细胞因子产生、增殖和存活的改变[2,3.]。单个miRNA在T细胞反应中的重要性和功能也已被确定[4]。例如,miR-146a负向调控T细胞受体(TCR)激活诱导的核因子-κB (NF-κB)信号通路[5]。miR-17 ~ 92簇对效应CD8 T细胞和T滤泡辅助细胞的分化很重要[6,7]。miR-155是CD8 T细胞对病毒感染和癌症的最佳反应所必需的[8]。
对感染产生保护性免疫反应的能力随着年龄的增长而下降,导致感染和癌症的死亡率和发病率增加,流感病毒和SARS-CoV-2感染就是一个例子[9,10]。虽然接种疫苗有助于预防儿童和青年人的传染病,但对老年人的效果一般[11]。老年人对感染的易感性增加以及疫苗效力差,表明包括T细胞和B细胞反应在内的适应性免疫缺陷[12,13]。鉴于mirna在T细胞免疫中的重要作用[4,14],年龄相关的miRNA网络变化可以解释老年人中出现的一些功能缺陷。事实上,多种mirna的表达随着年龄的增长而变化,例如在幼稚CD8 T细胞室中miR-146a和miR-155的上调[15]以及终分化效应CD8 T细胞中多种mirna的下调[16]。此外,T细胞活化后诱导的miR-21在老年人naïve CD4 T细胞中表达量高于年轻人[17]。异常的miR-21过表达通过抑制负调控因子导致TCR下游几个信号通路的持续激活,这反过来使老年人的T细胞向炎症效应细胞分化,而不是T滤泡辅助细胞和记忆前体细胞[17,18,19]。
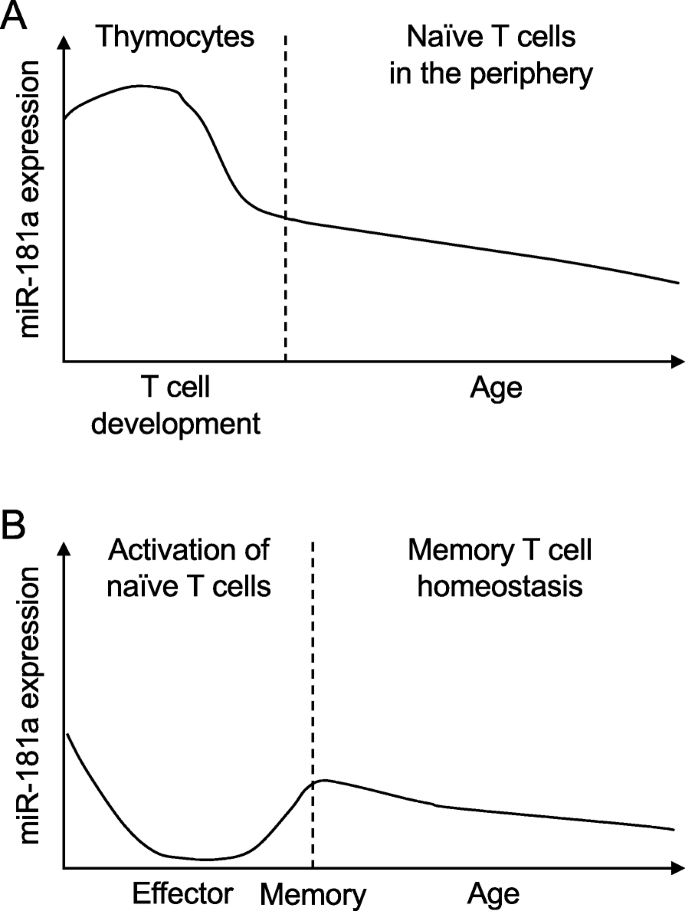
miR-181家族在所有脊椎动物中都是进化保守的。它由四个几乎相同的成熟mirna (miR-181a, miR-181b, miR-181c和miR-181d)组成,来自独立染色体上的三个簇;miR-181ab1, miR-181ab2和miR-181cd。miR-181家族的成熟成员具有相同的5 '种子序列,该序列决定了它们与mRNA靶标的3 '非翻译区(UTR)的结合,这表明它们在靶向相似的一组基因时具有功能冗余。miR-181家族是淋巴组织中最丰富的mirna之一[20.]。miR-181a表达在骨髓B细胞发育过程中的重要性已被描述[21,22]以及巨噬细胞和树突状细胞等先天免疫细胞功能的调节[23,24]。然而,miR-181a的功能在T细胞中研究得最好。miR-181ab1的缺失完全消除了胸腺中成熟miR-181a的表达,而miR-181ab2或miR-181cd的缺失没有影响,这表明miR-181a在T细胞中主要由miR-181ab1位点表达[22,25]。miR-181a的表达在T细胞的生命周期中受到动态调控,从它们在胸腺中的发育到分化并最终在外围老化。在这里,我们将回顾miR-181a在这些T细胞分化途径中的不同功能,并讨论miR-181a缺陷在老年人T细胞对感染和疫苗接种的反应中的意义。
miR-181a与T细胞发育
在胸腺的T细胞发育过程中,选择对自身抗原具有低到中等亲和力的T细胞,并消除具有高亲和力的T细胞是能够在外围维持中心耐受性的功能性T细胞库的关键。因此,设置TCR对同源肽抗原的敏感性在筛选过程中起着重要作用。miR-181a最初被描述为胸腺细胞和T细胞中TCR信号阈值的内在调节因子[26]。miR-181a在CD4和CD8双阴性(DN)和双阳性(DP)胸腺细胞中高度表达。随着分化,其在CD4或CD8单阳性(SP)胸腺细胞和周围成熟T细胞中的表达下调(图。1),这与TCR对同源抗原的敏感性逐渐降低有关[26]。在功能上,miR-181a靶向多种磷酸酶,如SHP2, PTPN22, DUSP5和DUPS6。PTPN22通过去磷酸化使LCK和ZAP70失活[27]。DUSP5和DUSP6也是细胞质(DUSP6)和细胞核(DUSP5)中TCR信号去磷酸化细胞外信号调节激酶(ERK)的负调节因子[28]。通过抑制TCR信号下游的这些多个负反馈回路,miR-181a降低了激活阈值,增加了TCR对同源抗原的敏感性[26]。因此,成熟T细胞中miR-181a的异位表达增强了TCR刺激时TCR信号传导的敏感性,如LCK和ERK磷酸化的增加以及钙通量和IL-2产生的增加所示[22,26]。此外,miR-181a在胸腺细胞中的过表达促进DN向DP细胞的分化[22,29]。相反,拮抗miR-181a或其基因缺失可降低TCR敏感性,并损害发育中的DP和SP胸腺细胞的阳性和阴性选择[22,26,30.]。因此,miR-181a缺陷可能无法在胸腺的负选择过程中删除对自身抗原具有潜在自反应性的T细胞[31]。事实上,与野生型相比,miR-181ab1种系敲除小鼠中发育的成熟T细胞在自我抗原免疫应答中表现出更高的反应性[30.]。然而,种系敲除miR-181ab1并没有引起自发的自身免疫,这表明改变T细胞库选择并不足以诱发疾病[30.]。
鉴于每个miRNA可以靶向多个不同的mRNA, miR-181a也通过靶向其他分子来控制T细胞的发育。miR-181a通过抑制多种负调控因子激活致癌NOTCH通路参与T细胞急性淋巴细胞白血病(T- all)的发展[22]。在正常的T细胞发育过程中,NOTCH信号通路可以通过转录诱导转录因子Tcf7,对T细胞的发育也很重要[32]。因此,miR-181a通过控制独立于校准TCR激活阈值的两个主要途径来调节T细胞的发育。在miR-181ab1敲除小鼠的独立菌株中也观察到胸腺T细胞发育的中断[33]。有趣的是,在这个mir -181ab1缺陷的小鼠模型中,没有观察到磷酸酶上调和tcr诱导的ERK磷酸化缺陷。相反,mir -181a缺陷胸腺细胞增加了其靶标PTEN的表达,PTEN抑制PI3K-AKT-mTORC1信号通路,这是支持细胞生长和增殖的合成代谢的重要轴[34]。因此,mir -181ab1缺陷小鼠胸腺T细胞发育受损,细胞代谢改变,细胞增殖减少,细胞死亡增加[33]。两种敲除菌株生物学差异的原因尚不清楚,可能代表脱靶效应。
通过miR-181a控制TCR信号通路对调节性T细胞和几种先天样T细胞群的发育也很重要,包括不变自然杀伤T (iNKT)细胞和粘膜相关不变T (MAIT)细胞,这些细胞也由双阳性胸腺细胞产生[35,36]。相比之下,miR-181a似乎不能控制从DN胸腺细胞发育而来的γδ T细胞的生成[37]。miR-181ab1缺失影响胸腺调节性T细胞从头生成[38],符合其发展相对较强TCR信号的要求[39]。在mir -181ab1缺陷小鼠中,通过异位表达Nur77家族成员Nr4a2增加TCR信号强度,挽救受损的调节性T细胞发育,进一步支持一种机制链接[38]。iNKT细胞通过其半不变的TCRs识别糖脂,在其发育过程中需要强TCR信号进行选择[40]。值得注意的是,在mir -181ab1缺陷小鼠中iNKT细胞的生成严重受损[25,33]。在mir -181ab1缺陷小鼠中,给药配体可挽救iNKT细胞生成缺陷[25],这与miR-181a缺乏增加激活阈值的观点一致。除了控制TCR信号,mir -181a调节的细胞代谢也有助于早期iNKT细胞发育,因为基因缺失Ptenmir -181ab1缺陷小鼠iNKT细胞生成恢复[33]。除了iNKT细胞外,miR-181ab1缺失还会损害MAIT细胞的生成,这些MAIT细胞通过其不变TCRα链的异位表达而恢复[41],提示TCR信号强度可能也参与了MAIT细胞的发育过程。
miR-181a与T细胞活化的年龄相关缺陷
与胸腺细胞相比,外周naïve T细胞中miR-181a的表达较低,并随着TCR刺激的分化和激活而进一步降低[26]。值得注意的是,老年人naïve CD4 T细胞中的miR-181a水平下降[42]。记忆CD4 T细胞的miR-181a表达低于naïve CD4 T细胞,而且也倾向于与年龄相关的下降(图。1) [42]。在老年人和小鼠naïve CD8 T细胞中也发现了类似的miR-181a表达减少[15,43]。相比之下,新生儿脐带血naïve CD4 T细胞miR-181a的表达水平相对高于成人外周血naïve CD4 T细胞[44]表明与年龄相关的miR-181a水平下降可能反映了老化naïve T细胞的部分分化状态,可能是由于稳态增殖。
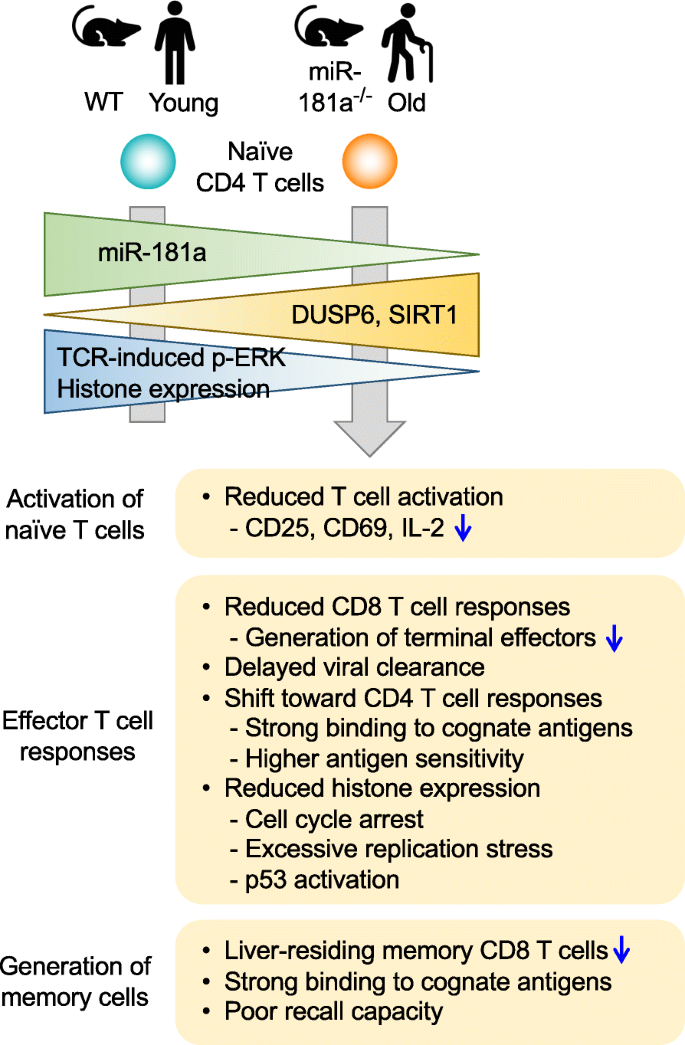
这种表达变化对于外周naïve T细胞的激活具有重要的功能(图。2)。与miR-181a在控制TCR信号通路中的作用一致,老化的naïve CD4 T细胞在TCR刺激时ERK磷酸化存在缺陷,这主要是由年龄相关的DUSP6表达增加引起的。相反,新生儿CD4 T细胞由于较高的miR-181a表达而增加tcr诱导的ERK活性[44]。由于TCR敏感性降低,衰老的naïve CD4 T细胞因此需要更高的抗原刺激来诱导活化标记CD69和CD25,并产生与激活的年轻naïve细胞相当水平的IL-2 [42]。的确,增加疫苗剂量可以提高老年人的疫苗效力[45,46,47]。miR-181a的过表达、DUSP6的沉默或DUSP6活性的药理抑制在TCR刺激下恢复了缺陷的ERK信号、IL-2的产生和增殖能力,改善了旧naïve CD4 T细胞的T细胞反应[42]。在丙型肝炎病毒感染患者的CD4 T细胞中观察到几乎相同的结果,miR-181a下降,DUSP6表达增加,这表明慢性病毒感染可能会诱导免疫过早衰老[48]。
miR-181a与抗病毒T细胞应答的年龄相关缺陷
鉴于老年个体中miR-181a表达降低的T细胞活化缺陷,在外周T细胞中miR-181ab1敲除的小鼠模型中,研究了miR-181a缺失对抗病毒免疫应答的影响(图。2) [43]。在远端Lck启动子控制下,通过表达Cre重组酶对胸腺进行阳性选择后,有条件地删除miR-181ab1,胸腺内的T细胞发育不受干扰,naïve CD4和CD8 T细胞在外围呈正态分布。与DUSP6过表达抑制T细胞活化一致,miR-181a缺乏在小鼠急性淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染后损害抗原特异性CD8 T细胞的扩增[43]。这一缺陷导致病毒清除延迟,重现了老年人对西尼罗河病毒(WNV)病毒感染的免疫反应,以及老年人接种减毒黄热病病毒(YFV)的情况[49,50,51,52,53,54]。有趣的是,与野生型小鼠相比,缺乏mir -181a的lcmv特异性CD4 T细胞反应增加。这种增加可能是一种代偿效应,因为在LCMV感染后,过继转移的LCMV特异性TCR转基因野生型CD4 T细胞在mir -181a缺陷小鼠中比野生型小鼠增殖得更多。此外,当野生型和mir -181a缺陷TCR转基因CD4 T细胞一起转移到同一只小鼠时,缺陷T细胞在LCMV感染后表现出减少的扩张,这表明mir -181a缺陷小鼠中显示的CD4 T细胞免疫的增加是由于延迟的病毒清除[43]。事实上,在病毒控制较差的老年人中观察到更多的西尼罗河病毒特异性CD4 T细胞[55]。YFV减毒活疫苗还在老年人中诱导CD4 T细胞延长增殖,同时延迟病毒清除[54]。因此,具有mir -181a缺陷外周T细胞的小鼠模型为随着年龄增长的急性感染中抗病毒CD4和CD8 T细胞免疫与病毒控制之间的关系提供了见解。了解miR-181a缺陷如何形成T细胞对老年人经常发生的慢性病毒感染或肿瘤的反应将是人们感兴趣的,而且仍有待解决。
与升高的T细胞激活阈值一致,miR-181a缺陷使抗病毒CD4 T细胞的反应偏向于选择具有更高亲和力的识别抗原肽的T细胞,如它们与同源肽/MHC II四聚体的强结合所示[43]。在人类中,来自老年感染个体的西尼罗河病毒特异性记忆T细胞与肽/MHC四聚体的结合比来自年轻感染个体的记忆T细胞与肽/MHC四聚体的结合更强[43],提供曲目选择的证据。同样,与野生型细胞相比,小鼠miR-181a缺陷的CD4 T细胞对LCMV的反应需要更少的抗原肽来诱导半最大的细胞因子产生,这进一步支持了miR-181a缺陷驱动保留库选择到更高功能的观点[43]。有趣的是,这种曲目选择与克隆水平上曲目多样性的收缩无关。相反,在缺乏mir -181a的小鼠中,CD4 T细胞反应随着扩增的增加而表现出增加的克隆多样性,这可能是由于延迟的病毒清除和在反应中招募更多克隆[43]。在回忆反应中,mir -181a依赖的库选择也很明显;缺乏mir -181a的记忆性CD4 T细胞与四聚体结合更强,产生效应细胞因子的抗原肽数量减少,继发感染后TCR库更收缩[43]。与之形成鲜明对比的是,CD8 T细胞的反应没有显示出任何证据表明,miR-181a缺乏时,细胞库选择朝向更高的亲和力或更高的功能。此外,对LCMV有反应的CD8 T细胞的寡克隆性程度及其库的多样性也没有差异[43],表明单个CD8 T克隆的扩增同样减少[56]。总之,年龄相关的miR-181a表达下降导致CD8 T细胞反应缺陷导致病毒清除延迟。随之而来的抗病毒CD4 T细胞反应改变的特征是扩大TCR剧目,具有更高的亲和性和同源抗原的功能性,试图克服CD8 T细胞反应缺陷。
TCR信号强度与指导T细胞分化有关,短寿命末端效应CD8 T细胞的发育需要强激活信号,而相对较弱的TCR信号有利于记忆前体效应细胞和中央记忆T细胞的产生[57,58,59]。因此,mir -181a调控的TCR激活阈值控制可以决定病毒感染期间T细胞的命运。事实上,在mir -181a缺陷小鼠中,CD8 T细胞的扩增减少主要是由于短期效应CD8 T细胞的分化缺陷,而记忆前体发育正常[43]。此外,在mir -181a缺陷小鼠中产生的记忆CD8 T细胞迅速获得CD62L和CD27高表达的中央记忆表型,并在体外重新刺激后能够产生多种细胞因子,如IFNγ、TNFα和IL-2。然而,它们在随后的再感染中再次未能扩张,也没有提供更多的保护。重要的是,miR-181a缺失尤其会损害肝脏组织记忆CD8 T细胞的生成[43]。组织驻留记忆T细胞在保护宿主免受局部部位再感染方面发挥着重要作用[60]。此外,在CD4 T细胞分化过程中,miR-181a缺失选择性地损害了Th1细胞的生成,而不改变LCMV感染后Tfh细胞的分化[43]。同样,DUSP6沉默也增强了Th1极化条件下产生ifn γ的Th1细胞的分化[42]。与信号强度在CD8 T细胞中效应与记忆分化中的作用类似,强TCR信号是产生分化程度更高的Th1 CD4 T细胞所必需的,而弱信号有利于Tfh细胞分化[61,62]。因此,老年人naïve T细胞中miR-181a水平的降低不仅会影响抗原特异性T细胞克隆的招募,还会影响它们的分化、组织迁移、效应功能的获得和回忆能力。
miR-181a缺乏导致老年人T细胞反应中的复制应激
在mir -181a缺陷小鼠和老年个体的T细胞反应中观察到的一个特征是T细胞激活后核心组蛋白的表达降低[63]。总的来说,组蛋白丢失是几个模型系统衰老的标志之一[64,65],相反,组蛋白的异位表达延长了酵母的寿命[66]。组蛋白水平在未受刺激的naïve T细胞中无差异,提示激活诱导缺陷。为了将新合成的DNA打包到染色质中,组蛋白转录在细胞增殖周期的早期s期被强烈诱导[67]。组蛋白表达上调失败导致DNA复制应激反应和细胞周期进程停滞[68,69]。与这一观点一致,增殖T细胞在mir -181a缺陷小鼠和老年人的早期s期积累。p53和ATR信号通路,指示复制应激[70]的异常激活,表现为PRA32和CHK1磷酸化增加,DNA损伤标志物磷酸化H2aX (γH2aX)的积累和细胞周期抑制剂p21的诱导[63]。这种增加的复制压力和p53通路的激活可能解释了最近发现的老年人有缺陷的疫苗反应[11]。在接种水痘带状疱疹病毒(VZV)活疫苗株后,老年人的抗原特异性CD4 T细胞的扩增与年轻人没有什么不同。然而,峰值反应后的细胞损失加速,留下较少的vzv特异性记忆CD4 T细胞。这种收缩与细胞周期调控和DNA修复途径的基因信号的富集相关,表明细胞周期调控失败[71]。
在小鼠和人类中,组蛋白上调的缺陷是由miR-181a靶SIRT1(一种NAD)的过表达引起的+依赖组蛋白脱乙酰酶[72,73]。SIRT1被招募到组蛋白基因启动子上,在那里它局部降低了H3K9/14和H4K16的乙酰化,从而抑制了组蛋白基因的转录[74,75,76]。重要的是,通过抑制SIRT1恢复组蛋白表达可以挽救细胞周期进程,减轻复制压力,改善T细胞扩张和病毒控制[63]。与活化T细胞中的这些发现相反,SIRT1的表达通常被认为在包括终末分化效应记忆CD8 T细胞在内的几种组织中随着年龄的增长而下降[77,78],提示SIRT1在组织和细胞类型上的特异性作用。增加SIRT1表达或活性可延长寿命[79]。因此,全面抑制SIRT1可能是有害的,然而,在接种疫苗后立即或在感染的情况下进行短暂的SIRT1抑制似乎是安全的。在这方面,药物SIRT1抑制剂Ex-527 (Selisistat)通过了治疗亨廷顿舞蹈病的II期临床试验[80],可以用于治疗改善疫苗诱导的老年人T细胞反应。
miR-181a与T细胞稳态年龄相关缺陷
miR-181a是naïve CD8 T细胞中表达随年龄变化的几种mirna之一[15]。对这些miRNAs控制的下游靶点(包括miR-181a、miR-146a、miR-155、let-7f、miR-7和miR-142)的通路分析发现,随着年龄的增长,FOXO1活性的丧失显著富集。FOXO1靶标之一的IL-7R在老化的naïve CD8 T细胞中表达明显降低[15],这可能解释了T细胞稳态的改变和naïve CD8 T细胞数量随年龄的减少[81,82]。在小鼠中,miR-181a单独似乎通过靶向PTEN控制naïve T细胞的稳态增殖[33]。当将野生型和mir -181a缺陷的naïve T细胞过过性共转移到rag1缺陷的淋巴细胞减少小鼠中时,mir -181a缺陷的naïve T细胞的相对比例和数量严重减少,可能是由于PI3K信号受损[33]。
miR-181a转录控制中的年龄相关缺陷
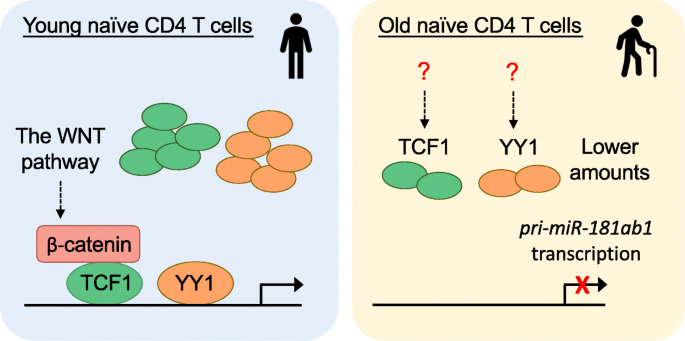
除了miR-181a活性的下游途径外,靶向与年龄相关的miR-181a损失的上游机制有可能改善老年人的缺陷T细胞反应。像所有miRNA基因一样,miR-181a被转录为初级miRNA (pri-miRNA),包括miR181a和b,随后在细胞核中加工成前体miRNA (pre-miRNA),在细胞质中加工成成熟miRNA。与年龄相关的miR-181a水平下降源于pri-miR-181ab1转录的降低[73]。对miR-181ab1位点的假定增强子区域的分析确定YY1和TCF1是诱导pri-miR-181ab1转录的主要转录因子。YY1和TCF1表达的降低导致pri-miR-181a转录年龄相关的下降(图。3.) [73,83]。因此,恢复YY1或TCF1表达上调了miR-181a,从而改善了老年人的T细胞反应。
YY1参与了许多生物过程,如细胞生长和发育,在这些过程中,它作为转录激活剂或抑制剂发挥作用,这取决于与其他辅助因子的相互作用[84,85]。随着年龄相关的YY1表达下降,naïve来自老年人的CD8 T细胞显示染色质对基因启动子YY1结合位点的可达性降低[86,87]。除了miR-181a表达外,YY1沉默对未受刺激的naïve CD4 T细胞转录组的影响很小[73]。由于YY1参与控制小鼠Th1、Th2和调节性T细胞的分化和功能[88,89],表达的降低可能解释了活化T细胞分化和效应功能的年龄相关差异。
与年龄相关的TCF1表达下降尤其有趣。TCF1是WNT/β-catenin通路下游的转录因子和效应分子[90]。抑制GSK3β稳定β-catenin和随后的β-catenin/TCF1复合物诱导TCF1依赖的基因表达,包括TCF7本身。药物抑制GSK3β可诱导TCF1和pr - mir -181ab1转录,从而改善老年人T细胞活化[83]。虽然对T细胞发育很重要[32], TCF1也维持低分化的外周T细胞干细胞样细胞状态,以应对急性和慢性病毒感染和癌症[91,92,93]。有趣的是,TCF1在老年人中的表达降低在T细胞反应中持续存在,有助于最终分化的促炎效应细胞而不是记忆前体细胞的发展[17,94]。TCF1在效应细胞中激活后下降,但在记忆细胞中重新表达,尽管与naïve细胞相比水平较低。TCF1是否驱动记忆T细胞中pri-miR-181ab1的表达及其功能后果仍有待解决。
结论
miR-181a的表达在胸腺的T细胞发育过程中以及在外围的T细胞分化过程中受到动态调控。它在胸腺中大量表达,miR-181a通过抑制多种磷酸酶降低TCR激活阈值,促进常规T细胞、调节性T细胞、iNKT细胞和MAIT细胞的胸腺发育。尽管miR-181a在外周的水平较低,但它同样会增加TCR对抗原的敏感性,并促进外周T细胞的激活。由于miR-181a表达的缺失,来自老年人的naïve T细胞不能对T细胞刺激做出适当的反应,例如,特别是对抗原亲和力较低的T细胞或对抗原信号较弱的刺激产生次优反应。
新出现的数据还表明,miR-181a参与了对T细胞反应重要的其他途径。通过抑制PTEN来控制细胞代谢对T细胞和iNKT细胞的发育至关重要[33]。鉴于PTEN被包括miR-21在内的多种miRNAs靶向,miR-21的表达随着年龄的增长而增加[17], miR-181a对衰老T细胞中PTEN表达的贡献似乎有限。NOTCH通路被T细胞中miR-181a的表达激活,从而促进T- all的发育[22]。NOTCH通路在老年成人的T细胞中是否减弱尚不确定。有趣的是,一个T细胞中缺乏miR-181ab1的小鼠模型发现,miR-181a控制抗病毒T细胞反应的许多方面,包括T细胞扩增、保留库选择、效应和记忆T细胞发育和回忆反应,从而总结了人类T细胞反应中许多与年龄相关的差异[43]。一些表型明显与miR-181a在初始T细胞激活信号中的作用以及随后对T细胞分化途径的影响有关。其他不能用TCR激活阈值解释,如T细胞增殖缺陷和miR-181a缺陷导致的组织驻留记忆T细胞生成失败。在这方面,SIRT1是miR-181a在衰老背景下的另一个重要靶标。SIRT1表达在mir -181a缺陷小鼠的naïve T细胞以及老年人中增加。通过抑制增殖过程中的组蛋白上调,导致细胞周期阻滞和过度复制应激,从而抑制T细胞增殖[63]。
这些见解为治疗干预提供了潜在的靶点,以恢复老年人受损的抗病毒和疫苗反应[95]。靶向miR-181a或miR-181a调控的通路可以改善T细胞的活化和功能。通过沉默DUSP6增强T细胞激活不足以挽救LCMV感染后mir -181a缺陷T细胞的增殖缺陷[43],提示多种磷酸酶的协同作用。在老T细胞中抑制SIRT1活性是有希望的,因为它通过恢复组蛋白上调和减少过度复制应激来改善T细胞增殖。YY1和TCF1年龄相关的下降以及pri-miR-181ab1转录的降低导致miR-181a水平低的发现是有趣的[73,83]。的确,YY1或TCF1的异位过表达,或增加WNT信号通路,通过诱导pri-miR-181ab1改善T细胞活化。
数据和材料的可用性
不适用。
缩写
- 3’UTR:
-
3’未翻译区域
- DN胸腺细胞:
-
CD4和CD8双阴性胸腺细胞
- DP胸腺细胞:
-
CD4和CD8双阳性胸腺细胞
- 兵:
-
细胞外信号调节激酶
- iNKT细胞:
-
不变的自然杀手T细胞
- 淋巴细胞脉络丛脑膜炎病毒:
-
淋巴细胞性脉络丛脑膜炎病毒
- MAIT细胞:
-
粘膜相关的不变T细胞
- MHC:
-
主要组织相容性复合体
- microrna的:
-
微
- NF -κB:
-
核因子-κB
- pre-miRNA:
-
microrna的前兆
- pri-miRNA:
-
主要microrna的
- SP胸腺细胞:
-
CD4或CD8单阳性胸腺细胞
- t:
-
T细胞急性淋巴细胞白血病
- 识别:
-
T细胞受体
- 西尼罗河病毒:
-
西尼罗河病毒
- YFV:
-
黄热病病毒
参考文献
Bartel DP。MicroRNAs:基因组学,生物发生,机制和功能。细胞。2004;116(2):281 - 97。
刘志刚,刘志刚,刘志刚,刘志刚,刘志刚,李志刚,李志刚,李志刚,等。缺失dicer对T细胞分化的影响。中华检验医学杂志,2005;23(2):326 - 326。
张宁,Bevan MJ。Dicer控制CD8+ t细胞的活化、迁移和存活。中国科学(d辑:自然科学),2010;
鲍姆约翰D,安塞尔KM。microrna介导的T辅助细胞分化和可塑性的调控。中华免疫杂志,2013;13(9):666-78。
杨玲,刘晨晨,刘春霞,刘春霞,刘春霞,等。miR-146a控制小鼠T细胞应答的分辨率。中华检验医学杂志,2012;29(4):344 - 344。
吴涛,魏eland A, Araki K, Davis CW, Ye L, Hale JS,等。microRNA簇miR-17-92的短暂表达调节效应和记忆CD8+ t细胞分化。中国科学:自然科学(英文版),2012;
鲍姆约翰D, Kageyama R, Clingan JM, Morar MM, Patel S, de Kouchkovsky D,等。microRNA簇miR-17约92促进TFH细胞分化并抑制亚群不适当的基因表达。中华免疫杂志,2013;14(8):840-8。
杜达JC, Salaun B, Ji Y, Palmer DC, Monnot GC, Merck E,等。MicroRNA-155是效应CD8+ T细胞对病毒感染和癌症反应所必需的。免疫力。2013;38(4):742 - 53。
免疫的黄昏:免疫系统老化的新概念。中华免疫杂志,2018;19(1):10-9。
Goronzy JJ, Weyand CM。成功的和不适应的T细胞老化。免疫力。2017;46(3):364 - 78。
Gustafson CE, Kim C, Weyand CM, Goronzy JJ。免疫老化对疫苗反应的影响。中华过敏临床免疫杂志,2020;44(5):1309-21。
Goronzy JJ, Weyand CM。T细胞老化的机制中华免疫杂志2019;19(9):573-83。
Frasca D, Diaz A, Romero M, Garcia D, Blomberg BB。B细胞免疫衰老。细胞发育生物学,2020;36:551-74。
O'Connell RM, Rao DS, Baltimore D. microRNA调控炎症反应。中华免疫杂志2012;30:295-312。
Gustafson CE, Cavanagh MM, Jin J, Weyand CM, Goronzy JJ。microRNA网络调控CD8 t细胞衰老的功能通路。中国生物医学工程学报。2019;18(1):e12879。
Hackl M, Brunner S, Fortschegger K, Schreiner C, Micutkova L, Muck C,等。miR-17, miR-19b, miR-20a和miR-106a在人类衰老过程中下调。衰老细胞。2010;9(2):291-6。
金晨,胡斌,Jadhav RR,金杰,张华,Cavanagh MM,等。mir -21调控通路在免疫衰老中的激活选择了记忆T细胞的特征特征。Cell rep 2018;25(8): 2148-62 e5。
方飞,于敏,Cavanagh MM, Hutter Saunders J,齐强,叶铮,等。CD39在活化T细胞上的表达削弱了老年人的生存能力。Cell Rep. 2016;14(5): 1218-31。
曹伟,方峰,Gould T,李X, Kim C, Gustafson C,等。Ecto-NTPDase CD39是一个抑制卵泡辅助细胞生成的阴性检查点。中华临床医学杂志。2020;30(7):344 - 344。
尼尔森JR,郑GX,伯格CB,夏普PA。细胞发育有序阶段中miRNA表达的动态调控。基因开发,2007;21(5):578-89。
陈长忠,李林,Lodish HF, Bartel DP。MicroRNAs调节造血谱系分化。科学。2004;303(5654):83 - 6。
毛涛,王山,王晓霞,龚晓霞,岳山,等。通过mir-181a-1/b-1调节NOTCH致癌信号的强度和阈值。公共科学图书馆,2012;8(8):e1002855。
谢伟,李敏,徐楠,吕强,黄楠,何俊,等。MiR-181a调节单核细胞和巨噬细胞的炎症反应。公共科学学报,2013;8(3):e58639。
Lim CX, Lee B, Geiger O, Passegger C, Beitzinger M, Romberger J,等。miR-181a对ERK-MAPK信号的调控维持DC-SIGN表达并限制单核细胞来源的树突状细胞的激活。Cell rep 2020;30(11): 3793-805 e5。
Zietara N, Lyszkiewicz M, Witzlau K, Naumann R, Hurwitz R, Langemeier J,等。miR-181a/b-1在不变自然杀伤T细胞激动剂选择中的关键作用。中国科学(d辑:自然科学),2013;
李庆杰,周杰,Ebert PJ, Sylvester G, Min H, Liu G,等。miR-181a是T细胞敏感性和选择的内在调节剂。细胞。2007;129(1):147 - 61。
吴娟,Katrekar A, Honigberg LA, Smith AM, Conn MT, Tang J,等。人蛋白酪氨酸磷酸酶PTPN22底物的鉴定。中国生物医学工程学报。2006;26(6):528 - 528。
Stefanova I, Hemmer B, Vergelli M, Martin R, Biddison WE, Germain RN。TCR配体辨别是由竞争的ERK阳性和SHP-1负反馈途径强制执行的。中华免疫杂志2003;4(3):248-54。
刘刚,闵华,岳山,陈长忠。Pre-miRNA环核苷酸控制mir-181a-1和mir-181c在早期T细胞发育中的不同活性。公共科学图书馆,2008;3(10):e3592。
谢福龙,王淑娟,王志强,等。Mir-181a-1/b-1通过在选择和外周T细胞功能中的相反活动调节耐受性。中华免疫杂志,2015;195(4):1470-9。
Ebert PJ, Jiang S, Xie J, Li QJ, Davis MM.在缺乏microRNA miR-181a的情况下,内源性正选择肽增强成熟T细胞反应并成为自身抗原。中华免疫杂志2009;10(11):1162-9。
韦文彬,王志刚,张志刚,杨志刚,等。TCF-1在t谱系规范和分化中的关键作用。大自然。2011;476(7358):63 - 8。
陈志强,陈志强,陈志强,等。microRNA miR-181是NKT细胞个体发生和淋巴细胞发育和稳态所必需的关键细胞代谢变阻器。免疫力。2013;38(5):984 - 97。
魏铮,崔琳,梅泽,刘敏,张东。miR-181a通过PTEN/AKT通路介导结肠癌细胞代谢转移中国生物医学工程学报,2014;29(3):344 - 344。
钱德华,李志强,李志强,等。iNKT和MAIT细胞的激活和功能。Adv immunl 2015; 127:145-201。
在胸腺选择和外周t细胞功能中TCR信号的MicroRNA miR-181-A变阻器。中华分子生物学杂志,2020;21(17):6200。
沙岩I, Zietara N, Lyszkiewicz M, Oberdorfer L, Witzlau K, Krueger A,等。MicroRNA-181a/b-1在先天γ伽玛德尔塔NKT效应细胞发育中不是必需的。科学通报。2015;10(12):e0145010。
Lyszkiewicz M, Winter SJ, Witzlau K, Fohse L, Brownlie R, Puchalka J,等。miR-181a/b-1控制Treg细胞的胸腺选择并调节其抑制能力。《公共科学图书馆·生物学》2019;17(3):e2006716。
莫兰,李志强,杨兴华,陈志强,等。Treg和iNKT细胞发育中的T细胞受体信号强度由一种新型荧光报告小鼠证明。中华检验医学杂志,2011;29(6):339 - 339。
Seiler MP, Mathew R, Liszewski MK, Spooner CJ, Barr K,孟F,等。转录因子Egr1和Egr2的升高和持续表达控制着NKT谱系的分化,以响应TCR信号。中华免疫杂志,2012;13(3):264-71。
Winter SJ, Kunze-Schumacher H, Imelmann E, Grewers Z, Osthues T, Krueger A. MicroRNA miR-181a/b-1控制MAIT细胞发育。中国生物医学工程学报,2019;29(2):339 - 339。
李G,余米,李WW,曾荫权M, Krishnan E,韦安德一道厘米,et al。miR-181a表达随年龄的下降通过增加DUSP6活性损害T细胞受体的敏感性。中华医学杂志,2012;18(10):1518-24。
Kim C, Jadhav RR, Gustafson CE, Smithey MJ, Hirsch AJ, Uhrlaub JL,等。衰老相关miR-181a缺陷引起的抗病毒T细胞反应缺陷。Cell rep 2019;29(8): 2202-16 e5。
佩林AC,拉马钱德兰V,阿查里亚S,刘易斯DB。人新生儿初代CD4+ T细胞具有增强的激活依赖信号,由microRNA miR-181a调控。中华免疫杂志,2013;19(6):2682-91。
DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A,等。大剂量与标准剂量流感疫苗在老年人中的疗效比较中华实用医学杂志,2014;29(7):339 - 344。
Falsey AR, Treanor JJ, Tornieporth N, Capellan J, Gorse GJ。一项随机、双盲对照三期试验,比较了65岁及以上成年人大剂量和标准剂量流感疫苗的免疫原性。中华流行病学杂志,2009;20(2):319 - 319。
Dolin R.四价流感疫苗接种方法。中华流行病学杂志,2013;28(4):539-40。
李元元,周勇,应瑞生,史林,程永青,任建平,等。丙型肝炎病毒诱导miR-181a的减少通过DUSP6的过表达损害CD4(+) t细胞的反应。肝脏病学。2015;61(4):1163 - 73。
本德BS,约翰逊议员,斯莫尔PA。衰老小鼠的流感:细胞毒性t淋巴细胞活性受损与感染时间延长相关。免疫学。1991;72(4):514 - 9。
Brien JD, Uhrlaub JL, Hirsch A, Wiley CA, Nikolich-Zugich J. T细胞缺陷在年龄相关性西尼罗河病毒易感中的关键作用。中华检验医学杂志,2009;26(3):357 - 357。
陈志伟,陈志伟,陈志伟,等。老龄小鼠记忆T细胞生成缺陷的研究进展。中华免疫杂志2002;32(6):1567-73。
Smithey MJ, Renkema KR, Rudd BD, Nikolich-Zugich J.在老年小鼠中,CD8+ T细胞凋亡增加,扩张受限和不完全分化共同降低单核增生乳杆菌的清除。中华免疫杂志,2011;41(5):1352-64。
Roukens AH, Soonawala D, Joosten SA, de Visser AW, Jiang X, Dirksen K,等。老年受试者在接种黄热病疫苗后抗体反应延迟和病毒血症延长:一项前瞻性对照队列研究公共科学学报。2011;6(12):e27753。
舒尔茨AR,马尔泽JN,多明戈C,朱肖特K,格鲁茨考A,巴别尔N,等。低胸腺活性和树突状细胞数量与老年人对原发性病毒感染的免疫反应有关。中华免疫杂志,2015;19(10):499 - 711。
James EA, Gates TJ, LaFond RE, Yamamoto S, Ni C, Mai D,等。神经侵入性西尼罗病毒感染引起升高的非典型极化T细胞反应,促进致病结果。公共科学图书馆,2016;12(1):e1005375。
Kim C, Williams MA。先天和后天:t细胞受体依赖和t细胞受体独立的分化提示选择记忆t细胞池。免疫学。2010;131(3):310 - 7。
崔伟,李志强,李志强,李志强,等。炎症通过T-bet转录因子的分级表达来指导记忆前体和短寿命效应CD8(+) T细胞的命运。免疫力。2007;27(2):281 - 95。
Sarkar S, Kalia V, Haining WN, Konieczny BT, Subramaniam S, Ahmed R.效应CD8 T细胞亚群与不同记忆命运的功能和基因组分析。中华检验医学杂志,2008;29(3):344 - 344。
马志刚,李志刚,李志刚。T细胞记忆中TCR信号通路的研究。前沿免疫杂志2015;6:617。
库马尔BV,康纳斯TJ,法伯DL。人类T细胞的发育,定位和功能贯穿一生。免疫力。2018;48(2):202 - 13所示。
陈杰,陈建民,陈建民,等。IRF4基因调控模块作为一个读写积分器动态协调T辅助细胞的命运。免疫。2017;47(3):481-97 e7。
Snook JP, Kim C, Williams MA。TCR信号强度控制CD4(+)效应T细胞和记忆T细胞的分化。免疫科学,2018;3(25):eaas9103。
金晨,金杰,叶震,Jadhav RR, Gustafson CE,胡斌,等。组蛋白缺乏与T细胞老化中的加速复制应激。中华临床医学杂志,2011;29(11):369 - 369。
Pal S, Tyler JK。表观遗传学和衰老。科学通报2016;2(7):e1600584。
Goronzy JJ, Hu B, Kim C, Jadhav RR, Weyand CM。T细胞衰老的表观遗传学。中国生物医学工程杂志,2018;43(4):369 - 369。
费泽,张东,达斯C,卡森J,基夫特J, Harkness T,等。组蛋白表达升高促进寿命延长。生物化学学报。2010;39(5):724-35。
马兹拉夫WF,瓦格纳EJ,杜罗尼奥RJ。典型组蛋白mrna的代谢和调控:没有poly(a)尾巴的生命。植物学报。2008;9(11):843-54。
梅杰瓦,冯勇,赵旭,等。新的组蛋白供应调节复制叉速和PCNA卸载。中国生物医学工程学报,2014;29(1):329 - 329。
Barcaroli D, Bongiorno-Borbone L, Terrinoni A, Hofmann TG, Rossi M, Knight RA,等。FLASH是组蛋白转录和s期进展所必需的。中国科学(d辑),2006;26(4):349 - 349。
Zeman MK, Cimprich KA。复制压力的原因和后果。细胞生物学杂志,2014;16(1):2-9。
齐奇,Cavanagh MM, Le Saux S, Wagar Le, Mackey S,胡娟,等。老年人水痘带状疱疹疫苗接种后T记忆细胞分化缺陷。公共科学图书馆,2016;12(10):e1005892。
周斌,李超,齐伟,张勇,张峰,吴建新,等。miR-181a下调可上调sirtuin-1 (SIRT1)并改善肝脏胰岛素敏感性。Diabetologia。2012;55(7):2032 - 43。
miR-181a表达在T细胞衰老中的调控地理学报。2018;9(1):3060。
Vaquero A, Scher M, Lee D, Erdjument-Bromage H, Tempst P, Reinberg D.人SirT1与组蛋白H1相互作用并促进兼性异染色质的形成。生物化学学报,2004;16(1):93-105。
何红,余FX,孙晨,罗艳。CBP/p300和SIRT1参与s期特异性组蛋白基因的转录调控。科学通报。2011;6(7):e22088。
马锐,吴勇,翟勇,胡波,马伟,杨伟,等。外源性丙酮酸通过NAMPT-NAD+-SIRT1途径抑制组蛋白基因表达,抑制癌细胞增殖。中国生物医学工程学报,2019;47(21):11132-50。
龚红,庞杰,韩艳,戴艳,戴东,蔡杰,等。衰老加速小鼠中Sirt1的年龄依赖性组织表达模式。Mol Med . 2014;10(6): 3296-302。
郑敏敏,帕赫尔,马飞,权浩,曹成林,H Kasler,等。人类CD8(+)记忆T细胞通过SIRT1缺失的代谢重编程。中华检验医学杂志,2018;21(1):531 - 531。
增加sir-2基因的剂量可以延长秀丽隐杆线虫的寿命。大自然。2001;410(6825):227 - 30。
苏斯穆斯SD, Haider S, Landwehrmeyer GB, Farmer R, Frost C, Tripepi G,等。一项关于SirT1抑制剂selisistat在亨廷顿舞蹈病患者中的探索性双盲随机临床试验。中国临床药物学杂志,2015;79(3):465-76。
Czesnikiewicz-Guzik M, Lee WW,崔东,Hiruma Y, Lamar DL,杨泽泽,等。T细胞亚群特异性衰老易感性。临床免疫杂志,2008;27(1):107-18。
韦廷,西伯特,纽曼,杜华伟,Alizadeh AA, Goronzy J,等。正常人类衰老的大规模和全面的免疫分析和功能分析。公共科学学报。2015;10(7):e0133627。
叶铮,Gould TM,张华,金俊,Weyand CM, Goronzy JJ。gsk3beta - β -catenin- tcf1通路通过上调miR-181a来改善老年人中naive T细胞的活化。中国机械工程学报。2021;7(1):4。
施Y,李JS,加尔文公里。你想知道的关于阴阳的一切。生物化学学报。1997;1332(2):F49-66。
张强,张志刚,张志刚,隋国强。阴阳的促癌作用中国科学。2011;16(3-4):163-97。
Moskowitz DM, Zhang DW, Hu B, Le Saux S, Yanes RE, Ye Z,等。人CD8 T细胞分化和衰老的表观基因组学研究。免疫科学,2017;2(8):eaag0192。
胡波,Jadhav RR, Gustafson CE, Le Saux S,叶泽,李旭,等。CD4和CD8 T细胞中明显的年龄相关表观遗传特征。前沿免疫。2020;11:585168。
黄世寿,张文文,金MK,金丽龙,金BS,金HS,等。YY1通过阻断Foxp3的表达和活性抑制调节性T细胞的分化和功能。Nat Commun. 2016;7:10789。
黄世升,金宇,李山,张文文,金明,高洪波,等。转录因子YY1是调节Th2细胞因子位点和Th2细胞分化所必需的。中国科学(d辑),2013;26(1):1 - 6。
Staal FJ, Luis TC, Tiemessen MM.免疫系统中的WNT信号:WNT正在展开翅膀。中华免疫杂志2008;8(8):581-93。
Kim C, Jin J, Weyand CM, Goronzy JJ。转录因子TCF1在T细胞分化和衰老中的作用。中华分子生物学杂志,2020;21(18):6497。
Escobar G, Mangani D, Anderson AC. T细胞因子1:疾病中T细胞反应的主要调节因子。免疫科学2020;5(53):eabb9726。
拉古D,薛洪辉,米尔克LA。TCF-1对淋巴细胞命运、感染和肿瘤免疫的控制免疫杂志2019;40(12):1149-62。
李胡B, G, Z, Gustafson CE、田L,韦安德一道厘米,et al。转录因子网络在老化幼稚CD4 T细胞偏向谱系分化。衰老细胞。2019;18(4):e12957。
张华,Weyand CM, Goronzy JJ。老化t细胞系统的特征。2021年2月。https://doi.org/10.1111/febs.15770.在线先于印刷。
确认
一个也没有。
资金
这项工作得到了美国国立卫生研究院R01 AR042527, R01 HL117913, R01 AI108906, R01 HL142068和P01 HL129941对C.M.W的支持,R01 AI108891, R01 AG045779, U19 AI057266和R01 AI129191对J.J.G的支持,高丽大学拨款(K2110581)给C.K.,以及帕洛阿尔托退伍军人管理局医疗保健系统的资源和设施的使用。内容仅为作者的责任,并不一定代表美国国立卫生研究院的官方观点。
作者信息
作者及隶属关系
贡献
所有作者都撰写并编辑了手稿。作者阅读并批准最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
批准。
相互竞争的利益
作者声明没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Kim, C., Ye, Z., Weyand, C.M.et al。mir -181a在t细胞分化和衰老中的调控途径Immun老化18, 28(2021)。https://doi.org/10.1186/s12979-021-00240-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12979-021-00240-1
关键字
- 微
- mir - 181 a
- T细胞老化
- T细胞分化
- T细胞活化
- 记忆T细胞
- 疫苗
- 传染性疾病
- 复制的压力