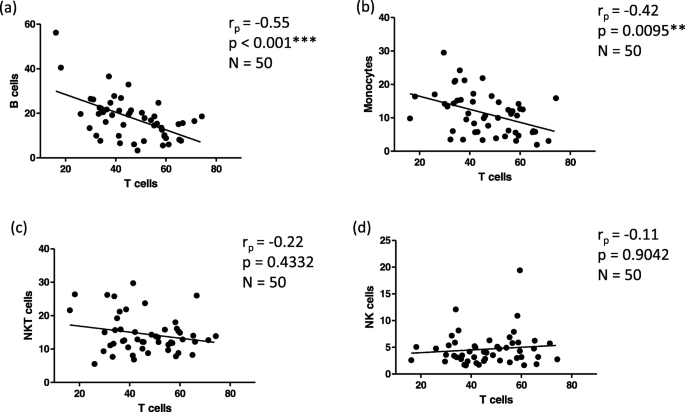
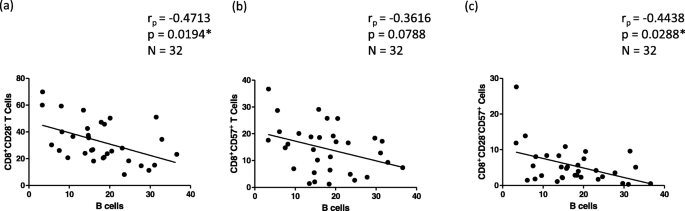
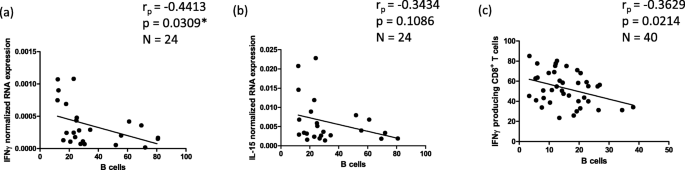
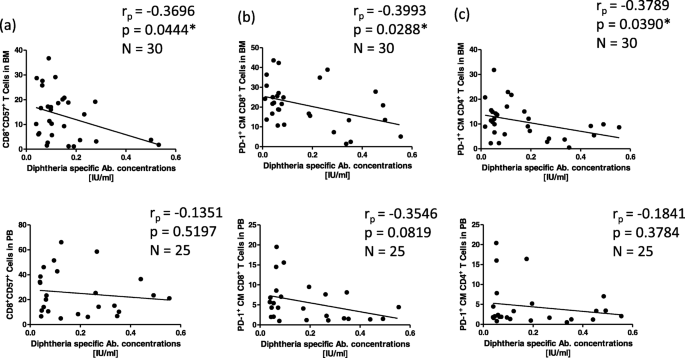
李志刚,李志刚,李志刚。记忆型T细胞的增殖与存活研究。中华免疫杂志2009;39:2088-94。
文章中科院PubMed谷歌学者
赵娥,徐华,王磊,Kyczek I,吴凯,胡凯,王刚,邹伟。骨髓与免疫控制。细胞免疫杂志2012;9:11-9。
文章中科院PubMed谷歌学者
张俊杰,王志强,王志强。效应和记忆T细胞分化的分子调控。中华免疫杂志2014;15:1104-15。
文章中科院PubMed公共医学中心谷歌学者
Nguyen DC, Garimalla S, Xiao H, Kyu S, Albizua I, Galipeau J, Chiang K-Y, Waller EK, Wu R, Gibson G, Roberson J, Lund FE, Randall TD, Sanz I, Lee FE-H。支持人类浆细胞存活和免疫球蛋白分泌的骨髓微池因子。自然通讯。2018; 9:3698。
文章PubMed公共医学中心谷歌学者
Herndler-Brandstetter D, Landgraf K, Tzankov A, Jenewein B, Brunauer R, Laschober GT, Parson W, Kloss F, Gassner R, Lepperdinger G, Grubeck-Loebenstein B.衰老对记忆T细胞表型和功能的影响。中华生物医学杂志,2012;
文章PubMed谷歌学者
陈丽,苍蝇DB。T细胞共刺激和共抑制的分子机制。中华免疫杂志,2013;13:227-42。
文章PubMed公共医学中心谷歌学者
Pangrazzi L, Naismith E, Meryk A, Keller M, Jenewein B, Trieb K, Grubeck-Loebenstein B.巨细胞病毒患者骨髓中IL-15的产生和高分化CD8+效应/记忆T细胞的积累增加。边界。2017;8:1-9。
谷歌学者
牟东,埃斯皮诺萨J,罗DJ,柯克AD。CD28阴性T细胞:它们的损失是我们的收获吗?中华外科杂志。2014;14(2):349 - 349。
文章中科院PubMed公共医学中心谷歌学者
Herndler-Brandstetter D, Landgraf K, Jenewein B, Tzankov A, Brunauer R, Brunner S, Parson W, Kloss F, Gassner R, Lepperdinger G, Grubeck-Loebenstein B.人骨髓中含有与il -15产生细胞密切接触的多功能记忆CD4+和CD8+ T细胞。中华免疫杂志2011;186:6965-71。
文章中科院PubMed谷歌学者
Strioga M, Pasukoniene V, characteriejus D. CD8+CD28-和CD8+CD57+ T细胞及其在健康和疾病中的作用。Immunol。2011;134:17-32。
文章中科院谷歌学者
Pangrazzi L, Meryk A, Naismith E, Koziel R, Lair J, Krismer M, Trieb K, Grubeck-Loebenstein B.“炎症衰老对人骨髓免疫细胞生存因子的影响”。中华免疫杂志,2017;47:481-92。
文章中科院PubMed公共医学中心谷歌学者
Pritz T, Lair J, Ban M, Keller M, Weinberger B, Krismer M, Grubeck-Loebenstein B.老年患者骨髓浆细胞数量减少。中华免疫杂志,2015;29(5):349 - 349。
文章中科院PubMed谷歌学者
Tokoyoda K, Zehentmeier S, Hegazy A, Albrecht I, Gruen J, Loehning M, Radbruch A.专业记忆CD4+ T淋巴细胞优先停留在骨髓中。免疫力。2009;30:721-30。
文章中科院PubMed谷歌学者
洛佩斯-奥廷C,布拉斯科MA,帕特里奇L,塞拉诺M, Kroemer G.老化的特征。细胞。2013;153:1194 - 217。
文章中科院PubMed公共医学中心谷歌学者
Coppé J-P, Desprez P-Y, Krtolica A, Campisi J.衰老相关的分泌表型:肿瘤抑制的阴暗面。《病理学年鉴》2010;5:99-118。
文章PubMed公共医学中心谷歌学者
Daste A, Domblides C, Gross-goupil M, Chakiba C, Quivy A, Cochin V, de Mones E, Larmonier N, Soubeyran P, Ravaud A.免疫检查点抑制剂与老年人:综述欧洲癌症杂志。2017;82:155-66。
文章中科院PubMed谷歌学者
Althubiti M, Lezina L, Carrera S, Jukes-Jones R, Giblett SM, Antonov A, Barlev N, Saldanha GS, Pritchard CA, Cain K, Macip S.新型衰老标志物的表征及其在癌症中的预后潜力。细胞死亡&Amp;疾病。2014;5:e1528。
文章中科院谷歌学者
p53靶基因的普查和评价。致癌基因。2017;36:3943。
文章中科院PubMed公共医学中心谷歌学者
Yosef R, Pilpel N, Papismadov N, Gal H, Ovadya Y, Vadai E, Miller S, Porat Z, Ben-Dor S, Krizhanovsky V. p21通过抑制JNK和caspase信号通路来维持持续DNA损伤反应下的衰老细胞活力。Embo j . 2017; 36:2280-95。
文章中科院PubMed公共医学中心谷歌学者
欧阳Q, Wagner WM, Voehringer D, Wikby A, Klatt T, Walter S, Müller CA, Pircher H, Pawelec G.表达抑制性杀伤细胞凝集素样受体G1 (KLRG1)的cmv特异性CD8+ T细胞的年龄相关积累。中华人民共和国学报。2003;29(4):344 - 344。
文章中科院PubMed谷歌学者
Taylor S, Huang Y, Mallett G, Stathopoulou C, Felizardo TC, Sun M-A, Martin EL, Zhu N, Woodward EL, Elias MS, Scott J, Reynolds NJ, Paul WE, Fowler DH, Amarnath S. 2017。PD-1调节KLRG1<sup>+</sup>第2组先天淋巴样细胞。实验医学杂志.
卡塔科维奇K, Klieser E, Neureiter D, Geisberger R. T细胞衰竭:从病理生理学基础到肿瘤免疫治疗。细胞通信和信号:CCS。2017; 15:1。
文章公共医学中心谷歌学者
Simon S, Labarriere N. PD-1在肿瘤特异性T细胞中的表达:免疫治疗的朋友还是敌人?Oncoimmunology。2018;7:e1364828。
文章谷歌学者
洪俊杰,李志强,李志强,李志强。SIV感染过程中PD-1在T细胞中的表达及其与免疫衰竭的关系。科学通报。2013;8:e60186。
文章中科院PubMed公共医学中心谷歌学者
whry EJ, Kurachi M.对T细胞衰竭的分子和细胞见解。中华免疫杂志2015;15:486-99。
文章中科院PubMed公共医学中心谷歌学者
Wang H, Gonzalez-Garcia I, Traba J, Jain S, Conteh S, Shin D-M, Qi C, Gao Y, Sun J, Kang S, Abbasi S, Naghashfar Z, Yoon J, DuBois W, Kovalchuk AL, Sack MN, Duffy P, Morse HC。能降解atp的ENPP1是长寿命浆细胞存活(或持久)所必需的。科学通报2017;7:17867。
文章PubMed公共医学中心谷歌学者
Grasse M, Meryk A, Schirmer M, Grubeck-Loebenstein B, Weinberger B.破伤风和白喉加强疫苗接种:对年轻人和老年人白喉保护不足。免疫与衰老:I & a 2016;13:26。
文章谷歌学者
世界卫生组织。白喉疫苗——世卫组织立场文件。《流行病学杂志》2006;81:24-31。
谷歌学者
涂伟。T细胞免疫衰老的机制:衰老与巨细胞病毒感染。前沿微生物,2016;7:1-12。
文章谷歌学者
Pawelec G, Akbar A, Beverley P, Caruso C, Derhovanessian E, Fülöp T, Griffiths P, Grubeck-Loebenstein B, Hamprecht K, Jahn G, Kern F, Koch SD, Larbi A, Maier AB, Macallan D, Moss P, Samson S, Strindhall J, Trannoy E, Wills M. 2010。免疫衰老和巨细胞病毒:十年后我们处于什么位置?免疫与衰老:I & A 7:13 -。
王晓明,王晓明,王晓明,等。巨细胞病毒在免疫衰老中的作用。病毒决议2011;157:175-9。
文章中科院PubMed谷歌学者
Moser K, Tokoyoda K, Radbruch A, MacLennan I, Manz RA。基质生态位,浆细胞分化和存活。《免疫杂志》2006;18:265-70。
文章中科院PubMed谷歌学者
林乔松,孙文杰,Kärrholm。人骨髓中的长寿浆细胞可以是CD19(+)或CD19(−)。《血液科学进展》2017;1:835-8。
文章中科院PubMed公共医学中心谷歌学者
杨晓明,杨晓明,杨晓明,等。免疫衰老对外周血T细胞数量的影响。机械老化发展,2003;124:433-43。
文章PubMed谷歌学者
陈晓明,陈晓明,陈晓明,等。IL-7:维持t细胞记忆和实现稳态。免疫学杂志2005;26:172-6。
文章中科院PubMed谷歌学者
Corfe SA, Paige CJ。IL-7在B细胞发育中的多种作用;生存、增殖和分化的中介。中华免疫杂志2012;24:198-208。
文章中科院PubMed谷歌学者
Sammicheli S, Ruffin N, Lantto R, Vivar N, Chiodi F, Rethi B. IL-7通过诱导T细胞中BAFF和CD70的表达来调节B细胞的存活和激活。《中国科学》,2012;
文章中科院PubMed谷歌学者
李R, Paul A, Ko KWS, Sheldon M, Rich BE, Terashima T, Dieker C, Cormier S, Li L, Nour EA, Chan L, Oka K.白细胞介素7诱导单核/巨噬细胞向内皮募集。《心》杂志,2012;
文章PubMed谷歌学者
N-p W, Akbar AN, Goronzy J. CD28(−)T细胞:它们在年龄相关免疫功能衰退中的作用。中华免疫杂志2009;30:306-12。
文章谷歌学者
Kared H, Martelli S, Ng TP, Pender SL, Larbi A. CD57在人自然杀伤细胞和t淋巴细胞中的表达。《中华癌症杂志》2016;65:441-52。
文章中科院PubMed谷歌学者
Fry TJ, Mackall CL。IL-7的许多方面:从淋巴细胞的生成到外周T细胞的维持。中华免疫杂志,2005;
文章中科院PubMed谷歌学者
Tohyama T, Takano T, Yamamura H. B细胞对氧化应激的反应。10. Curr Pharm Des. 2004;
文章中科院PubMed谷歌学者
Frasca D, Diaz A, Romero M, Landin AM, Blomberg BB。年龄对人类B细胞和体液免疫的影响老龄化研究综述,2011;10:330-5。
文章中科院谷歌学者
德·马丁尼,M·莫德斯蒂,M·洛雷托·MF, Quaglino D, Ginaldi L.老年人外周血淋巴细胞亚群粘附分子的研究。生命科学,2000;68:139-51。
文章谷歌学者
de Bruin AM, Voermans C, Nolte MA。干扰素γ对造血功能的影响。血。2014;124:2479 - 86。
文章PubMed谷歌学者
Stavnezer J, Amemiya CT。同型转换的演变。中华免疫杂志2004;16:257-75。
文章中科院PubMed谷歌学者
Brandsma C, Hylkema M, Geerlings M, vanGeffen W, Postma D, Timens W, Kerstjens H.当前吸烟者外周血中(类别转换)记忆B细胞水平升高。呼吸,2009;10:108。
文章PubMed公共医学中心谷歌学者
Larbi AR, Vasudev A, Low I, Binte Shadan N, Mustafa S, Ayyadhury S, Fulop T.老年人的免疫系统:与疾病的公平斗争?老年健康,2013;9:35-47。
文章中科院谷歌学者
Gao Y, Grassi F, Ryan MR, Terauchi M, Page K, Yang X, Weitzmann MN, Pacifici R. IFN-γ通过抗原驱动的T细胞激活促进体内破骨细胞形成和骨丢失。中华临床医学杂志,2007;
文章中科院PubMed谷歌学者
Slifka MK, Matloubian M, Ahmed R.骨髓是急性病毒感染后长期产生抗体的主要部位。中国病毒学杂志,1995;69:1895-902。
中科院PubMed公共医学中心谷歌学者
通过预先存在的中和抗体滴度和预先激活的T细胞来保护“免疫”,而不是通过所谓的“免疫记忆”。免疫杂志2006;211:310-9。
文章中科院PubMed谷歌学者
Duraiswamy J, Ibegbu CC, Masopust D, Miller JD, Araki K, Doho GH, Tata P, Gupta S, Zilliox MJ, Nakaya HI, Pulendran B, Haining WN, Freeman GJ, Ahmed R.健康成人程序化Death-1 HI CD8 T细胞的表型、功能和基因表达谱。中华免疫杂志2011;186:4200-12。
文章中科院PubMed谷歌学者