摘要
背景
分期特异性胚胎抗原-4 (SSEA-4)是鉴定多能胚胎细胞的标志。它在神经上皮细胞、前神经细胞(NPC)和人牙髓细胞中也呈阳性。本研究旨在评价人脱落乳牙SSEA-4阳性干细胞向鼻咽癌的形态分化和组织分化潜力。
方法
通过磁细胞分离,培养得到一个对SSEA-4呈阳性的SHED群体。采用免疫组化和流式细胞术对细胞进行特征分析。随后,在添加碱性成纤维细胞生长因子(bFGF)和表皮生长因子(EGF)的培养基中进行神经球测定;随后,细胞用神经基础培养基进行神经分化。最后,采用间接免疫组化方法鉴定神经元标记物。
结果
用表皮生长因子和成纤维细胞生长因子在神经基础培养基中诱导SSEA-4阳性的shed,观察其形态学和组织学变化。在诱导结束时,鉴定出Nestin、TuJ-1和GFAP标记。
结论
研究结果表明,SSEA-4阳性的shed具有类似于神经元前体细胞的行为。我们的研究结果表明,乳牙髓是神经退行性疾病或周围神经改变相关的再生治疗的一个有前途的来源。
简介
神经系统中的神经前体细胞(NPC)可分化为神经元、星形胶质细胞和少突胶质细胞。与神经干细胞(NSC)相比,NPC的自我更新有限[1].以前人们认为这种细胞群只存在于发育中的人类大脑中。后来,在成人大脑中也报道了NPC的存在[1,2].
在医疗过程中或之后发生的退行性疾病、创伤事件和损伤会在中枢神经系统(CNS)和周围神经系统(PNS)中产生神经元改变、炎症、细胞死亡和细胞结构畸形。常规医学治疗对神经损伤后功能恢复的疗效有限。由于神经系统的成熟,尽管存在鼻咽癌,生成新的神经元和胶质细胞的能力随着年龄的增长而降低和限制[3.].
基于间充质干细胞(MSC)的治疗诱导神经元再生。这些细胞位于骨髓、脂肪组织、脐带和口面区域[4].MSC已被证明具有多种神经营养和抗炎因子,有利于神经修复,并作为细胞治疗CNS和SNP改变的潜在候选者。
间充质干细胞在口面区域的壁龛为乳牙和恒牙的牙髓组织、牙滤泡、牙周韧带、口腔黏膜和双帽脂肪垫[5,6].
在牙髓组织中,人牙髓干细胞(DPSC)是从恒牙中分离出来的MSC;来自人类脱落乳牙(SHED)的干细胞位于临时牙齿中。两种细胞群都来自发育中的神经板槽内的细胞;这些是高度克隆性的,具有多系分化,有助于组织修复的平衡和特定条件[7].
DPSCs和SHED之间的一个相关差异是,两种细胞群都可以从不同年龄组的个体中获得,这使得它们能够表达不同的基因类型[8].特别是,由于其起源和初始形成,SHED可以表达胚胎阶段基因,如用于识别鼻咽癌的抗原- SSEA-4 [9,10].
本研究的目的是分析用SSEA-4抗体磁分离获得的乳牙间充质细胞神经系的形态分化和组织分化能力。我们假设在人脱落乳牙的牙髓中存在类似NPC的细胞群。
材料与方法
髓组织收集
牙髓组织取自40颗6至10岁儿童的乳牙。纳入的儿童男女皆有,无临床病理资料,牙齿健康,处于脱落状态,需要进行治疗性去核(生殖细胞切除术)和正畸或矫形治疗。6岁以下或10岁以上患有任何疾病、牙齿健康但无拔牙指征或牙齿有某些病理的儿童被排除在外。父母或监护人必须接受孩子的参与,并签署书面知情同意书。新莱昂自治大学牙科学院伦理委员会评估并批准了该方案。
拔牙
该研究共对40颗牙齿进行了研究,对每个患者样本进行了一次独家检测。给予每位参与者(患者或家长监护人)的适应症是在获得样本前一周到牙科诊所进行牙科预防,每天刷牙,每天3次,低碳水化合物饮食。样本采集当天进行二次预防,用2%洗必泰(Consepsis-Ultradent)浸泡的纱布直接清洁牙面5min。获得的牙科样本用50ml Falcon试管(康宁)与1X磷酸盐缓冲盐水(PBS)、100µg/ ml链霉素、100 U/ ml青霉素和0.25 mg/ ml两性霉素B (Sigma)一起运送到实验室。
牙髓拔除
取出的牙齿样本在牙釉质交界处(牙冠和牙根的界限)的水平上用中等金刚石颗粒圆盘(NTI)进行牙齿切片,安装在低速电动微电机(Dremel)上,用0.9%无菌盐水溶液(PISA)持续冲洗。在根尖开放的样本中,使用no.20作为去除髓组织的通路三根管拔牙器和锉(Kerr)。
随后,将提取的组织髓与1ml 1X PBS、100µg/mL链霉素、100 U/ mL青霉素和0.25 mg/mL两性霉素B (Sigma)一起放入2 mL Eppendorf管中,在4℃冷藏保存,提取后不超过48小时。
组织分离
组织髓在C管(Miltenyi Biotec)的GentleMACS™分离器中分离,并加入4.7 mL 1X PBS。分离后,样品在300x g下离心10分钟。
获得细胞颗粒后,加入3 mg/mL的I型胶原酶(Sigma)和4 mg/mL的消散酶(Sigma)。悬液在37°C下孵育30分钟。孵育后,悬液再次以300x g离心10分钟。随后,去除上清,用5 mL DMEM F12培养基(Gibco)和10%胎牛血清(Gibco)洗涤灭活酶。悬浮液用80 μm薄膜(Millipore)过滤;最后在1ml培养基中重悬。
细胞计数
使用血球计或纽鲍尔室(Marienfeld)来确定细胞的数量和它们的活力。均质前,用微量移液管(Eppendorf)取10µl细胞悬液和10µl 0.05%台潘蓝(Sigma);将20 μ l混合在2 ml Eppendorf管中,并置于Neubauer室进行细胞计数。
细胞培养
原代细胞培养(PCC)采用Dulbecco 's Modified Eagle 's Medium/Nutrient mix F12 Ham (DMEM-F12)、10% FBS (Gibco)、100 mg/mL链霉素、100 U/ mL青霉素和0.25µg/ mL amphotericin B (Sigma)。计数后的细胞悬液重悬于5ml培养基中,置于25cm处2Falcon小瓶(康宁)用于细胞培养。
PCC保存在5% CO的容器中237°C (Thermo Scientific)。72 h后,去除非贴壁细胞;每3天更换一次培养基。去除培养基,将粘附在培养瓶上的细胞用1X PBS冲洗3次。然后,用0.25%胰蛋白酶和1 mM EDTA (Fisher Scientific)进行细胞胰蛋白酶化。加入胰蛋白酶/EDTA,在含5% CO的腔室中37°C孵育5min2.孵育后,按与烧瓶中内容物体积相等的比例用培养基灭活酶;300x g离心10 min。细胞重悬于培养基中,离心;之后,将它们重新悬浮在含1%牛血清白蛋白(BSA)的1X PBS中(Sigma-Aldrich)。将50 nm磁性微球与SSEA-4抗体(MACS/Miltenyi Biotec)结合,与细胞悬液在4℃下孵育15分钟,以实现第三阶段的细胞生长和扩张。从牙髓中分离间充质干细胞使用MACS磁选系统(Miltenyi Biotec)。最后,收集15 mL试管(康宁)的含量以回收SSEA-4抗体阳性部分。
流式细胞术染色
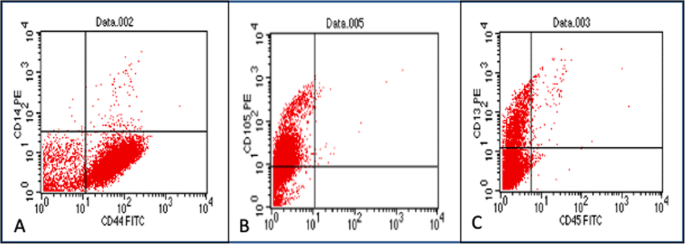
用CD45 FITC、CD14 PE(存在于造血干细胞中)、CD13 PE、CD44 FITC和CD105 PE(存在于间充质干细胞中)抗体进行流式细胞术染色,以识别和研究SSEA-4阳性部分的细胞群(表2)1).
直接免疫细胞化学
用一抗进行免疫组织化学鉴定间充质细胞标志物。这些细胞在16孔室载玻片中进行细胞培养(Nunc™Lab-Tek)。当细胞在每个孔内达到80%合流时,取出培养基。用1X PBS清洗细胞,并在−2°C的甲醇中放置10分钟以固定细胞。1X PBS + 2% BSA环境温度孵育30min, 30min后加入待鉴定抗体,环境温度暗处孵育3h。
在孵育时间结束时,去除上清液,用1X PBS冲洗3次。为了鉴定核酸,加入1:1000 DAPI (Sigma-Aldrich);细胞在黑暗中孵育15分钟,用1X PBS洗一次。
染色后,去除载玻片腔中的结构,加入10µl安装液(Dabco),并在每个场上放置一个覆盖物进行分析。盖玻片用珐琅质密封在玻片上,玻片用倒置荧光显微镜进行分析(蔡司Z1,卡尔蔡司,美国)。
神经元分化培养
神经元分化方案分为两个阶段,使用不同的培养基:神经元A培养基(NA)(神经球测定)预诱导以维持SHED神经球的多能性、生长和分裂;神经元B培养基(NB),定向细胞分化。
神经元A培养基(神经球试验)
预诱导培养基组成为DMEM-F12 (Gibco)、50 μ l/mL Supplement (Gibco)、2% FBS (Gibco)、3 μ l/mL l -谷氨酰胺(Gibco)、20 ng/mL epidermal growth factor (EGF)、20 ng/mL成纤维细胞生长因子(FGF)、100 μ l/mL链霉素、100 U/mL青霉素、0.25 mg/mL amphotericin B (Sigma-Aldrich)。将先前用SSEA-4抗体偶联的磁微珠分离的细胞置于25厘米的培养液中2培养瓶(康宁)用于扩展。在进行第二次细胞传代后,对细胞进行胰蛋白酶化,并在5 mL NA中重新播种,在预诱导阶段等待神经球形成7天;每3天更换一半培养基。
神经介质B
细胞分化培养基成分为一半Neurobasal (Gibco)、70 μ l/mL补品B27、3 μ l/mL l -谷氨酰胺(Gibco)、500 nM维甲酸(Sigma Aldrich)、100 μ g/mL链霉素、100 U/mL青霉素、0.25 mg/mL两性霉素B (Sigma-Aldrich)。细胞在NB中保存7 d;每3天更换一半培养基。
将细胞种在带有两孔培养室的载玻片上进行细胞培养(Nunc™LabTek)。细胞粘附时,用0.1 mg/mL Poly-L-Lysine (Sigma-Aldrich)制备载玻片表面。在每个孔中总共添加60 μ l,并在37°C下孵育12 h。然后,去除上清液,每孔用500ml milliq (mQ)双蒸馏水冲洗。细胞在400 μ l NB中接种,培养7天;每3天更换一半培养基。
间接免疫组织化学
在NB中7天后,采用间接免疫组化方法,使用Nestin、B-III微管蛋白(TuJ-1)和胶质纤维酸性蛋白(GFAP)的二抗鉴定神经元标记物。
在相衬显微镜下观察培养板后,去除NB培养基,用400µl 1X PBS洗涤细胞。细胞在−2°C下用甲醇固定10分钟;去除上清液,用1X PBS冲洗2次。
用0.5% Triton X-100渗透细胞膜,细胞孵育5min。孵育后,用1X PBS洗涤3次,每次5min;然后加入阻断液(10%胎山羊血清[FGS]在1X PBS中)。然后将细胞在环境温度下孵育一小时,以避免非特异性反应。
抗体稀释滴定,制备1% FGS + 1X PBS,加入一抗(鼠抗人)、抗nestin、抗b - iii微管蛋白、抗gfap。溶液在4°C下孵育12小时(夜间)。第二天除去上清液,用1X PBS冲洗3次,每次5 min。随后加入抗nestin、抗b - iii微管蛋白、抗gfap (Alexa Fluor 568偶联抗体)(兔抗小鼠)二抗。该溶液在环境温度和黑暗中孵育一小时。孵育后,用1X PBS冲洗3次,每次5分钟。
细胞核染色时,加入1:1000 DAPI (Sigma-Aldrich),在黑暗中孵育10分钟。去除DAPI后,用1X PBS冲洗一次。
用一抗和二抗染色后,去除载玻片腔室的结构,加入10µl安装液(Dabco),在每个场放置一个盖玻片进行分析。安装溶液通过盖排出24小时,以去除多余的;最后,用珐琅质将封面密封,并使用倒置荧光显微镜进行分析(蔡司Z1,卡尔蔡司,美国)。
结果
牙齿生物样本的获取
这些牙齿分别来自于牙去核(正常出牙前永久性前磨牙胚芽拔除)、牙脱落和连续拔牙。男性患者居多;年龄范围为8至9岁。每个样品获得的细胞数量是可变的,但考虑到平均有50,000个活细胞。
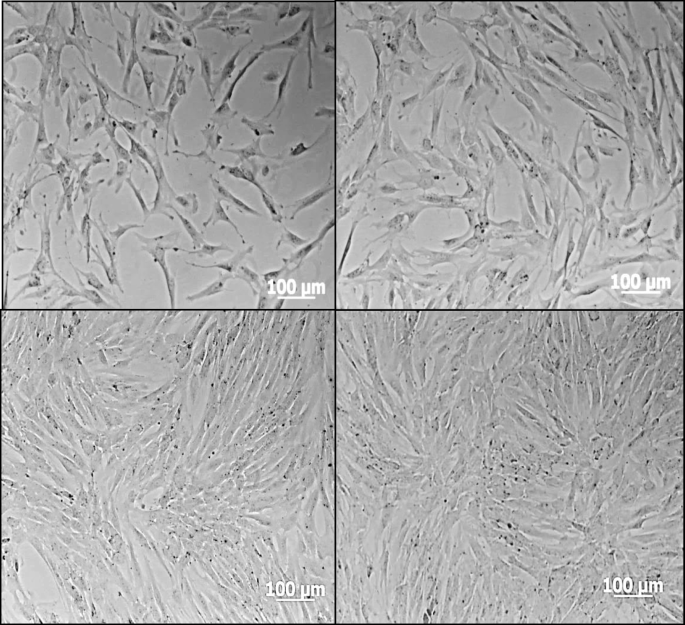
人牙髓细胞的复制时间为21.89 h。粘附在培养瓶上的细胞在形状和大小上具有异质性,呈梭形形态,有的较短较宽,有的较长较薄,细胞质延伸呈分支状,核为椭圆形,细胞质稀少。它们生长迅速,第10天达到80%,第14天达到100%。进行了三次细胞传代,每一次都增加了细胞的膨胀率。1).
SHED的分离与表征
与SSEA-4抗体偶联的磁微珠分离阳性间充质细胞粘附在培养瓶上,具有均匀的形态大小,纺锤形,椭圆形核,稀少的细胞质,具有集落或集落形成单位(CFU)的生长特征(大约每CFU 100个细胞)和高膨胀率,与未纯化的培养相似(图4)。2).
流式细胞术鉴定了磁珠和SSEA-4抗体分离的细胞群的免疫表型。细胞间充质细胞膜标志物CD44、CD71、C13和CD105阳性,造血抗体CD45 FITC、CD14 PE阴性。用直接免疫细胞化学鉴定细胞群间充质细胞膜标记物呈阳性。3.;表格2).
神经分化
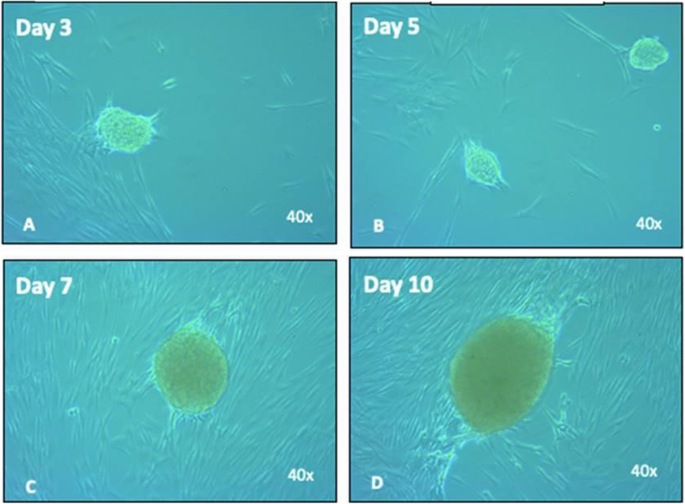
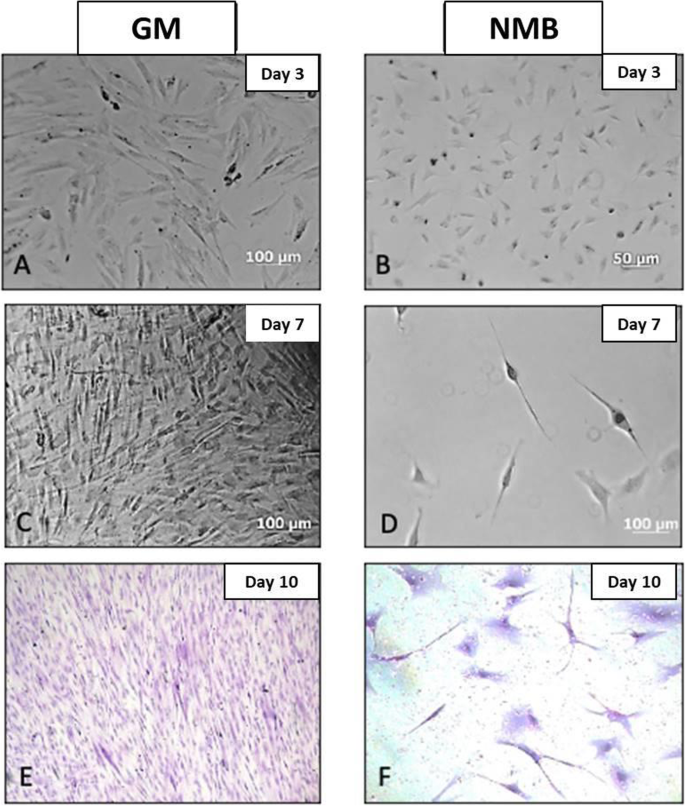
神经元A培养基中的细胞最初表现为单层粘附在培养瓶上,在cfu中组织成纤维细胞形态。在接下来的48至72小时内,观察到每个CFU的细胞密度都有所增加。细胞逐渐改变形态,纵向压实集落。到第3天,观察到细胞聚集,失去对培养瓶表面的粘附,形成球体状和间充质细胞结构的体。球形体或神经球在诱导前培养基中继续发育和生长,直到第10天(图2)。4).
从神经球中提取的细胞,在聚l -赖氨酸处理过的表面和神经元B培养基中,出现了彻底的形态改变,平均大小为20-50 μm(图2)。5).在维甲酸诱导的分化培养中,它们的长度增加了50%以上,产生了多个扩展,其核致密且清晰,胞体或胞体内部显示出稀少的细胞质和颗粒。细胞密度显著降低诱导神经元分化超过70%。
神经元标记的鉴定
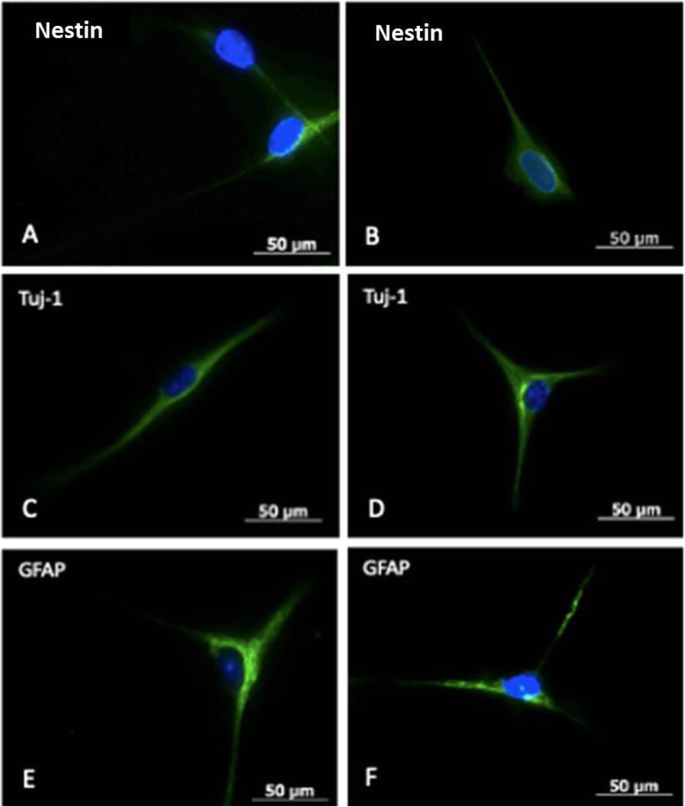
NB诱导10天后的免疫细胞化学检测结果为nestin标记物阳性,存在于神经上皮或前神经细胞中;B-III微管蛋白(TuJ-1),神经元活性阳性,与神经发生和轴突生长有关;胶质纤维酸蛋白(GFAP),存在于细胞骨架的中间细丝中,主要存在于胶质细胞中(图2)。6而且7).
讨论
牙髓是由富含不同细胞群的神经上皮细胞和中胚层细胞的外胚层形成的外胚质形成的特化组织[11,12].
在这项研究中,样本来自6至9岁的儿童。样本为自然脱落的牙齿或因治疗原因需要去除的牙齿;还包括9岁儿童的去核前磨牙。本研究是关于这类样本的第一份研究报告。另一些则记录了来自成年患者第三磨牙的牙齿细菌[13].
本研究首次报道了利用SSEA-4抗体对人脱落乳牙(SHED)间充质干细胞进行磁分离。另一项研究通过流式细胞术鉴定了牙髓干细胞(但未使用该抗体纯化细胞群)[11].另一方面,对于胚胎阶段的细胞标记物,它也被确定为神经元分化状态的细胞标记物[14,15].
SSEA-4是一种特异性抗原,可从人脱落乳牙中分离纯化干细胞。用SSEA-4抗体磁分离获得间充质细胞是相关的,因为该抗原在胚胎着床前阶段、胚胎发生以及随后的未分化间充质细胞中表达[16].我们可以推断,在乳牙牙髓中存在一个表达SSEA-4的细胞群;以同样的方式,神经上皮细胞和神经元祖细胞在分化过程中表达它。这些发现使我们能够将我们的细胞群的潜力与naïve呈现多能性的细胞进行比较[10,17,18].
通过磁分离获得的SHED被鉴定为从间充质细胞纯化的细胞群,经免疫细胞化学和流式细胞术证实,Bianco等人所述,获得了与间充质细胞对应的抗体阳性结果,而对造血细胞抗体阴性。[19]用于间充质细胞的鉴定。在培养中,这些细胞依赖于梭形的表面粘附,并组织成高度克隆性的菌落[20.,21].
本研究结果证明,在SHED培养物中添加生长因子EGF、FGF和低浓度FBS,可导致神经球从第3天开始快速形成,而其他研究报告的神经球在6天后形成,并使用DPSC进行治疗[22,23].
需要指出的是,这项工作是用乳牙的牙髓进行的,因为处于人类生长发育早期阶段的儿童的细胞比成人的细胞具有更大的增殖和分化潜力。
出生后神经发生的过程需要多个步骤,如增殖、分化、迁移、细胞生长和突触整合。这些阶段中的每一个都表达不同的标记物或抗原,如巢蛋白。1990年,在大多数神经元前体细胞以及神经元和胶质细胞的形态发育中发现了其表达。关于TuJ-1标记物,它是β -微管蛋白家族的一部分。其在神经元细胞有丝分裂和运动中的作用已被报道,并在神经发生、发育和轴突维持等过程中被鉴定。梅内塞斯和罗斯金[24用它来标记有丝分裂后未成熟的神经元细胞。据报道,在神经元前体细胞的增殖状态下,单独在胶质细胞分化阶段,特别是星形胶质细胞中,GFAP抗原或标记物与巢estin一起被鉴定[3.,25,26].
在我们的神经标记nestin, TuJ-1和GFAP的免疫细胞化学研究中获得了积极的结果,我们可以声明,乳牙的牙髓细胞经过神经元诱导后,表现为神经元前体细胞,具有成熟为神经元和胶质谱系的能力。我们还可以考虑它们的多能性行为和起源于中胚层和外胚层的细胞谱系的能力。
关于从人类胚胎组织中获得的干细胞和诱导多能干细胞的伦理和治疗方面,从乳牙中获得的牙髓的伦理考虑没有争议,因为从牙髓中获得的组织样本被认为是不会对生命造成伤害的生物废物。另一方面,虽然诱导多能细胞被认为优于从胚胎组织中获得的多能细胞,但在分化试验中已经确定了可形成细胞肿瘤的基因组不稳定性。这一发现与重新编程过程有关;因此,该细胞系在临床应用中并不安全。因此,我们可以认为shed是一种潜在的细胞来源,可用于个性化再生医学治疗[27,28].
我们的研究始于2000年,在人类牙髓中鉴定间充质干细胞[20.]后来在原发牙列中发现的[21,29].在诱导它们形成骨骼、软骨、肌肉甚至牙本质时,它们的分化能力已在几项研究中得到证实[21,30.].它们向神经元谱系分化的能力,就像神经前体细胞一样,是全世界细胞研究的最新领域之一。特别是在墨西哥,这条牙科研究线及其与神经科学的关系正在得到巩固。
结论
我们在神经分化方面的研究结果表明,SSEA-4阳性的shed具有类似于神经元前体细胞的行为。因此,我们认为乳牙牙髓是一种很有前途的间充质干细胞来源,可用于神经退行性疾病和周围神经疾病的再生治疗。
数据和材料的可用性
数据可根据合理要求从通讯作者处获得。
参考文献
Dibajnia P, Morshead CM。神经前体细胞在脑卒中后修复中的作用。药物学报。2013;34(1):78-90。doi:https://doi.org/10.1038/aps.2012.107.
Reynolds BA, Weiss S.从成年哺乳动物中枢神经系统的分离细胞生成神经元和星形胶质细胞。科学。1992;255(5052):1707 - 10。doi:https://doi.org/10.1126/science.1553558.
冯·伯和哈尔巴赫。O.成年海马内增生事件、胶质瘤发生和神经发生的免疫组织学标记物。中国生物医学工程学报,2011;34(1):1 - 19。doi:https://doi.org/10.1007/s00441-011-1196-4.
Ciaramitaro P, Mondelli M, Logullo F, Grimaldi S, Battiston B, Sard A,等。外伤性周围神经损伤:158例患者的流行病学调查结果、神经性疼痛和生活质量。环境神经系统学报,2010;15(2):120-7。doi:https://doi.org/10.1111/j.1529-8027.2010.00260.x.
Iohara K, Zheng L, Ito M, Tomokiyo A, Matsushita K, Nakashima M.从猪牙髓组织中分离出的具有自我更新和多能的牙本质发生、软骨发生、脂肪发生和神经发生的侧群细胞。干细胞。2006;24(11):2493-503。doi:https://doi.org/10.1634/stemcells.2006-0161.
Robey PG, Bianco P.成人干细胞在重建人脸中的应用。中国机械工程学报。2006;37(7):961-72。doi:https://doi.org/10.14219/jada.archive.2006.0317.
隋波,吴东,向玲,付勇,寇霞,石松。牙髓干细胞:从发现到临床应用。中国生物医学工程学报,2020;46(9s):46-s55。doi:https://doi.org/10.1016/j.joen.2020.06.027.
石霞,毛娟,刘勇。人乳牙和恒牙髓干细胞的生物学特性及治疗应用。中国生物医学工程学报。2020;9(4):445-64。doi:https://doi.org/10.1002/sctm.19-0398.
Kawanabe N, Fukushima H, Ishihara Y, Yanagita T, Kurosaka H, Yamashiro T.人乳牙髓细胞ssea -4阳性亚群的分离与鉴定。临床口腔调查。2015;19(2):363-71。doi:https://doi.org/10.1007/s00784-014-1260-z.
王勇,赵超,侯震,杨勇,毕勇,王宏,等。在naïve状态下,人类体细胞重新编程诱导多能干细胞(iPSCs)过程中的独特分子事件。Elife。2018;7:e29518。doi:https://doi.org/10.7554/eLife.29518.
川边N,村田S,福岛H,石原Y,柳田T,柳田E,等。阶段特异性胚胎抗原-4鉴定人类牙髓干细胞。中国科学(d辑),2012;
Barry FP, Murphy JM。间充质干细胞的临床应用及生物学特性。中国生物化学杂志,2004;36(4):568-84。
武田T,手冢Y,堀内M,细野K,饭田K,畑山D,等。人牙胚牙髓干细胞的特性研究。中国科学(d辑:自然科学),2008;
Brøchner CB, Møllgård K. SSEA-4和YKL‐40在发育中的人类新皮层脑室下区的阳性祖细胞亚型。神经胶质。2016;64(1):90 - 104。
巴罗德,李志刚,Møllgård K,李志刚,Björklund a .共表达SSEA4和CD133的人神经祖细胞的体外鉴定。中华神经科学杂志,2007;29(2):344 - 344。
韩德胜J, Draper J, Baillie H, fisher S, Thomson J, Moore H,等。植入前人类胚胎和胚胎干细胞在胚胎抗原的表达上具有可比性。干细胞。2002;20(4):329-37。
Dodsworth BT, Flynn R, Cowley SA。naïve人类多能性的现状。中国生物医学工程学报。2015;33(11):3181-6。
刘志刚,刘志刚,刘志刚,等。具有与小鼠ESCs相似的生物学和表观遗传特征的人类胚胎干细胞。中国科学(d辑:自然科学),2010;doi:https://doi.org/10.1073/pnas.1004584107.
Bianco P, Riminucci M, Gronthos S, Robey PG.骨髓基质干细胞:性质,生物学和潜在应用。干细胞,2001;19(3):180-92。doi:https://doi.org/10.1634/stemcells.19-3-180.
郭志强,王志强,王志强,王志强。人牙髓干细胞(DPSCs)的体外和体内研究。中国科学(d辑),2000;29(3):344 - 344。doi:https://doi.org/10.1073/pnas.240309797.
Miura M, Gronthos S,赵m, Lu B, Fisher LW, Robey PG,等。SHED:人类脱落乳牙的干细胞。中国科学(d辑),2003;26(3):349 - 349。doi:https://doi.org/10.1073/pnas.0937635100.
Gervois P, Struys T, Hilkens P, Bronckaers A, Ratajczak J, Politis C,等。人牙髓干细胞在神经球生成后的神经源性成熟诱导功能神经元的形态学和电生理特征。中国生物医学工程杂志,2015;24(3):296-311。doi:https://doi.org/10.1089/scd.2014.0117.
刘珊,曲勇,Stewart TJ, Howard MJ, Chakrabortty S, Holekamp TF,等。胚胎干细胞在培养和脊髓移植后分化为少突胶质细胞和髓鞘细胞。中国科学(d辑),2000;29(1):1 - 6。doi:https://doi.org/10.1073/pnas.97.11.6126.
Menezes JR, Luskin MB.在发育中的端脑增殖层中,神经元特异性微管蛋白的表达定义了一个新的群体。中华神经科学杂志,1994;14(9):5399-416。doi:https://doi.org/10.1523/jneurosci.14-09-05399.1994.
蔡杰,王志强,王志强,等。Sox2的表达定义了成年小鼠大脑中神经球形成细胞的异质群体。衰老细胞,2005;4(4):197-207。doi:https://doi.org/10.1111/j.1474-9726.2005.00158.x.
Carlén M, Cassidy RM, Brismar H, Smith GA, Enquist LW, Frisén J.成人出生神经元的功能整合。动物学报,2002;12(7):606-8。doi:https://doi.org/10.1016/s0960 - 9822 (02) 00771 - 6.
高桥,山中。多能干细胞的诱导从小鼠胚胎和成人成纤维细胞培养的定义因素。细胞。2006;126(4):663 - 76。doi:https://doi.org/10.1016/j.cell.2006.07.024.
瓦拉列维奇V,马尔科维奇BS,加迪奇M,瓦拉列维奇A,约维奇N,阿尔塞尼耶维奇N,等。干细胞治疗的伦理与安全问题。国际医学杂志,2018;15(1):36-45。doi:https://doi.org/10.7150/ijms.21666.
人骨髓和牙髓中出生后间充质干细胞的血管周围生态位。中国生物医学工程学报,2003;18(4):696-704。doi:https://doi.org/10.1359/jbmr.2003.18.4.696.
姜伟,马安,王涛,韩凯,刘勇,张勇,等。间充质干细胞的归巢和分化在体内静脉输送到缺血心肌:一个时间序列研究。中国科学院学报(自然科学版),2006;doi:https://doi.org/10.1007/s00424-006-0117-y.
确认
我们感谢Sergio Lozano-Rodriguez, M.D.在翻译和编辑手稿方面的帮助。
资金
这项研究没有得到任何公共、商业或非营利机构的具体资助。
作者信息
作者及隶属关系
贡献
Ada Pricila Lopez-Lozano-研究的构思及设计;构想和设计数据的分析、获取、分析和解释;起草手稿。Katiushka Arevalo-Nino-对数据采集、分析和解释做出贡献;对重要的知识内容进行了批判性的修改。尤兰达Gutierrez-Puebte-对数据采集、分析和解释做出贡献;严格修改了知识内容,并审查了草案。Jose Luis Montiel-Hernandez-对数据采集、分析和解释做出贡献;回顾流式细胞术数据,严格修改知识内容。维克多·雨果·乌鲁蒂亚-巴卡-严格修改了知识内容,并审查了草案。Casiano Del Angel-Mozqueda-对概念、数据采集、分析和解释做出了贡献,并对智力内容进行了批判性的修改。Angelica De la Garza-Ramos-对作品的构思和设计有贡献;对数据采集、分析和解释做出了贡献;参与起草工作,对知识内容进行批判性修改。作者阅读并批准最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了新莱昂自治大学牙科学院伦理委员会的批准,注册号为SPSI010613/00245。
发表同意书
参与者的父母提供了书面的知情同意以供发表。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
洛佩斯-洛萨诺,A, Arevalo-Niño, K,古铁雷斯-普恩特,Y。et al。乳牙SSEA-4阳性牙髓干细胞及其对神经前体细胞的诱导。头面医学18, 9(2022)。https://doi.org/10.1186/s13005-022-00313-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13005-022-00313-6
关键字
- 牙髓
- 乳牙
- Neuroesphere化验
- 神经分化
- 神经前体细胞