摘要
位于美国加利福尼亚州沙斯塔县铁山的里士满矿为研究酸性矿井水(AMD)生成的化学和生物控制提供了绝佳的机会原位,并确定控制溶液化学的关键因素。在这里,我们整合了四年的野外地球化学数据、16S rRNA基因克隆文库和基于rRNA探针的微生物种群结构研究、基于培养的代谢实验、毒砂表面定殖实验和中间硫种动力学实验结果来描述Richmond Mine AMD系统。因氧化约1 × 10而产生的极酸性流出物(pH值在0.5至0.9之间)5到2 × 105摩尔黄铁矿/天含有高达24克/1铁,数克/1锌和数百毫克/升铜。地球化学条件随着时间的推移而显著变化,并反映在微生物种群的变化中。在低温(<32°C)、高pH(>0.8)条件占优势的采样时间内,来自6个位点的232个小亚单位核糖体RNA (16S rRNA)基因序列的分子分析表明,铁氧化原核生物占优势,如能源而且Leptospirillum在主要排水社区。Leptospirillum第三类占大多数Leptospirillum序列,我们将其归因于当时异常的物理和地球化学状态。主排水系统周边的“红池”和黄铁矿“坍落”的pH值更高(>1),群落组成反映了这种地球化学条件的变化。在古菌中发现了几种新的谱系Thermoplasmatales红池(pH为1.4)中仅有黄铁矿类种群Acidithiobacillus.相对较小的种群Sulfobacillus种虫害和Acidithiobacillus caldus在硫化物氧化成硫酸盐的过程中,单质硫作为中间产物代谢。实验表明,形成在黄铁矿表面的单质硫能抵抗大多数氧化剂;它被未附着的细胞溶解可能表明涉及微生物衍生的电子穿梭。硫代硫酸盐的分离(S2O3.2 -)作为黄铁矿氧化过程中的离去基,在低pH的富铁AMD溶液中形成并持续存在四硫酸盐。然而,没有观察到四硫酸盐。虽然是S2O3.2 -类物种可以形成表面结合的中间产物,数据表明Fe3 +将大部分硫氧化为黄铁矿表面的硫酸盐。这可能解释了为什么与里士满矿区的铁氧化类群相比,可以利用中间硫物种的微生物稀少。
简介
研究地点的相关性
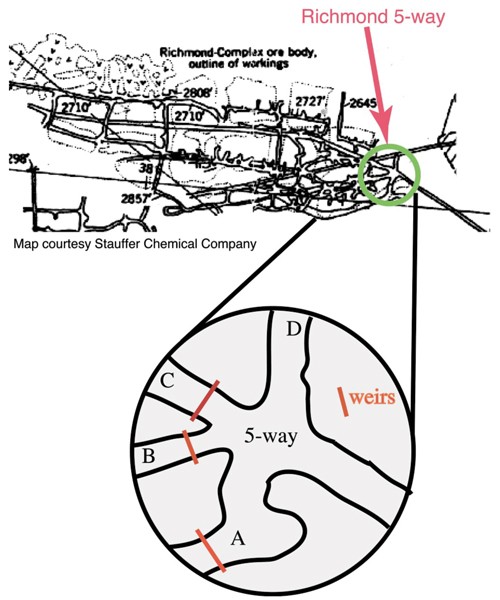
增强氧化的硫化物矿物主要是黄铁矿(FeS2),因为采矿活动会导致酸性、富含金属的水的生成,因此是一个具有重大环境利益的世界性问题。位于美国加州北部铁山的里士满矿是一个难得的机会,可以在一个活跃氧化的黄铁矿体中研究地下酸性矿井排水过程。许多AMD位点的特征是铁氧氢化物的沉淀,而这个位点的特征是由微生物黄铁矿氧化产生的溶解化学物质。具体来说,该现场允许研究在形成酸性矿井水的氧化反应中重要的化学和微生物因素,这些氧化反应从发生二次氢氧化物沉淀的系统部分分离出来。在里士满矿床内的一个被称为“5路”的交汇处,一个入口隧道与四个矿井隧道相交。1).基本上,从矿山排出的所有溶液都收集在5-way,从而可以确定和监测来自系统的金属和硫的通量。以前对5路附近的地质、水化学和微生物群落的研究[1- - - - - -5]为现场正在进行的工作提供了基础。
场地位置及历史
铁山位于加利福尼亚州雷丁市西北约9英里处(图2)。1).通往里士满矿的通道是一条430米长的水平通道,这条隧道是美国政府超级基金项目整治工作的一部分。5-way区域位于Richmond矿床主体的边缘,这是一个大型透镜体,最初超过800米长,60米宽,60米厚。主体含有大约90-95%的黄铁矿(FeS2),在当地盛产矿石。该矿位于一个含有黄铜矿(CuFeS)的黑子型火山成因块状硫化物矿床内2)、闪锌矿(ZnS)、方铅矿(PbS)、斑铜矿(Cu5菲斯4)、毒砂(FeAsS)和四赤铁矿-田纳西铁矿(Cu12某人4年代13铜12作为4年代13),以及块状黄铁矿和晚期细粒黄铁矿矿脉。[6]矿石产于泥盆纪的Balaklala流纹岩中,由石英、钠长石、绿泥石和绢云母组成,[7]以非常有限的酸缓冲能力为特征。在里士满矿的硫铁矿材料的测定平均为1%的铜和2%的锌。[8伴生的次生硫酸盐矿物包括多种铁2 +、铁2 +菲3 +和Fe3 +硫酸盐(详情见Alpers)等.[2,9])。在19世纪60年代到1962年之间,有几个矿间歇地开采金、银、铜、铁、锌和黄铁矿。在原先估计为1150万吨的储备中,大约350万吨被移走。[2矿场的酸性废水被认为是在处理开始前造成萨克拉门托河大量鱼类死亡的罪魁祸首。2]自1983年起,该地点已被列入环保署超级基金的国家优先项目名单[8现在,所有来自矿山的废水都被收集起来,并通过添加石灰(CaO)进行现场处理,以去除铜中的金属,使其低于美国环保局饮用水标准(Joe Cobliati,私人通信)。
黄铁矿氧化和AMD溶液
黄铁矿的氧化过程是每摩尔FeS转移15摩尔电子2(转化硫化物硫铁矿,S1 -,到硫酸盐,S6 +O42 -和菲2 +对菲3 +).氧化还原反应以1或2个电子的增量发生。10因此,硫化物氧化的整个过程必须由许多步骤组成。所有的电子都是通过一系列的阳极(氧化)半反应失去的,这些反应的总和可以表示为:
菲斯2+ 8小时2→阿菲3 ++ 2 + 14小时++ 15e-(1)
+ 14小时++ 15e-(1)
产物硫酸氢盐用来表示pH值低于2 [pK2硫酸= 1.99(参考文献11)],就像在现场一样。阳极反应必须耦合到阴极反应(在没有外加电位的情况下)。表中给出了描述黄铁矿氧化的可能的阳极和阴极反应的子集我.
在黄铁矿氧化途径中,并非所有耦合氧化还原反应都能产生质子。反应产生单质硫,一种常见的黄铁矿溶解的部分产物,[12- - - - - -14不产生质子:
菲斯2+ 2 Fe3.+→3铁2 ++ 2秒0.(2)
该反应是由黄铁矿中的硫硫直接形成单质硫。有人认为,在低pH值下生产硫代硫酸盐可以产生大量的单质硫,[15]但最近的研究[16关于硫代硫酸盐和四硫酸盐在含过量铁的酸性水中的转化清楚地表明,在这些条件下,硫代硫酸盐不能形成显著的单质硫。在实验室研究黄铁矿在过量铁的酸性条件下氧化时,观察到高达20%的单质硫产物,因此,这表明通过另一种来源产生单质硫的反应,如硫铁矿的氧化。
硫代硫酸盐被许多研究者称为黄铁矿氧化的第一个产物。[17- - - - - -21]黄铁矿经若干步骤反应生成硫代硫酸盐(由路德[17]),然后与铁反应生成四硫酸盐3 +,[16,22]可以用整体反应来表示:
菲斯2+ 7 Fe3 ++ 3小时2O→8 Fe2 ++ 0.5秒4O62 -+ 6小时+.(3)
黄铁矿反应生成四硫酸盐,在一定条件下的实验室黄铁矿氧化实验中检测到的另一种中间物种,[18,19,21]每摩尔黄铁矿产生6摩尔质子。
黄铁矿的总氧化反应,假设所有步骤的电子受体都是铁,通常写成(对于pH值低于2的反应):
菲斯2+ 14 Fe3 ++ 8小时2O→15 Fe2 ++ 2 hso4-+ 14小时+.(4)
AMD体系中没有铁铁的直接来源,因此铁铁必须根据反应由氧氧化再生:
14铁2 ++ 3.5 o2+ 14 H+→14铁3 ++ 7小时2o . (5)
一些Fe储层3 +以溶解的铁池的形式存在3 +作为不同的硫酸铁和氧化物矿物,在移动/溶解携带铁之前,它们基本上可以将这种氧化剂储存不同的时间3 +与黄铁矿表面接触。将反应(4)和反应(5)相加,则黄铁矿溶解的总体反应为
菲斯2+ 3.5 o2+ H2O→Fe2 ++ 2 hso4-.(6)
如果反应(4)和反应(5)恰好平衡产生反应(6),总铁:质子:硫酸盐的比例应为1:2:2。铁和质子的摩尔比:如果铁和硫被适当地计算(即,如果在取样前没有硫酸盐矿物或氧化铁矿物沉淀),如果质子可以适当地计算(即,如果碳、二氧化硅、铁、硫酸盐等的质子化形式可以被计算),硫酸盐将反映黄铁矿的完全氧化。具有混合铁价的矿物可以在这些水中沉淀,氧化铁沉淀的变化也可以影响S摩尔比(通过施氏锰矿的沉淀或SO的吸附)42例如,在goe-thite上)强调需要小心地解释组成数据。
虽然很明显,质子的产生与硫的氧化是耦合的,但溶液的pH值是由超过复杂阴离子(主要是硫酸盐)所需的多余质子决定的。如果用反应(6)描述该体系,将有足够的质子以HSO的形式形成硫酸盐4-,意味着pK附近的pH值1HSO汽车贸易公司的4-,即~ ph2。然而,并非所有由反应(5)和(6)产生的质子都是络合硫酸盐所必需的,因为会形成其他硫酸盐络合物(特别是Fe2 +硫酸的物种)。某些硫酸盐矿物的蒸发浓度和沉淀[如黄钾铁、钾铁]3 +3.(所以4)2(哦)6]会降低pH值,而铁氧化则会提高pH值[23模拟结果表明,黄铁矿氧化可以解释将pH值降低到大约0.0。[24在某些条件下,通过蒸发浓缩可获得极低的pH值。环境样品的最低pH值(-3.6)来自里士满矿床内的蒸发池。[25]
虽然氧气供应最终控制环境中的黄铁矿氧化,但铁是最有效的氧化剂。铁的最低的未占据分子轨道(LUMO)3 +的能量比O2(通常产生较低的活化能势垒),这就解释了为什么铁是最有效的氧化剂。[26另外,O2由于反应顺磁性O2(2个未配对电子)与抗磁性黄铁矿(全部电子配对)[18因为黄铁矿被铁氧化3 +比O2,并考虑到无机慢铁2 +在低pH值下的再氧化速率,有人提出Fe2 +再氧化限制了黄铁矿在AMD溶液中的氧化速率。[27由于微生物催化亚铁的氧化,因此有假设认为它们控制了环境中黄铁矿的氧化速率。[27在黄铁矿氧化环境中,利用中间硫物种作为代谢能的生物也很活跃。[28]微生物种群可能会随着当地环境的变化而发生显著变化,[4,29]以及在不同酸度的地点之间。[3.控制硫物种氧化的中间反应可能随pH、O、O的变化而变化2和Fe3 +竞争反应的浓度取决于氧化剂的可用性或黄铁矿表面成分。因此,了解黄铁矿氧化途径的差异作为pH值的函数,可以更好地理解酸性环境中微生物活性和氧化还原动力学之间的相互依存关系。
以前对里士满矿床微生物学的研究
微生物活动在黄铁矿溶解和AMD形成中的重要性已得到充分证明。1,19,23,27,30.- - - - - -33迄今为止,大多数AMD系统的微生物学研究都是基于培养生物体的生理学和特性。诺德斯特龙及索瑟姆[32]和约翰逊[33回顾从这些研究中产生的概念。关键的发现是,微生物将亚铁氧化为铁酸铁,增加了这种重要氧化剂在溶解硫化物矿物表面的供给速率。
Nordstrom (1]首次注意到铁山微生物的潜在重要性。随后在该地点进行的几项研究应用了分子生物学方法来描述存在的微生物,并将微生物群落结构与其环境的地球化学联系起来。罗杰斯等.[34]从该位点创建了第一个小亚单位核糖体RNA (16S rRNA)基因库(见Edwards[35])。随后,荧光现场Schrenk基于氢化(FISH)的研究等.[3.确定了古细菌、细菌和真核生物的相对丰度。Schrenk等.[3.也证实了罗杰斯的发现等.[34) (Acidithiobacillus ferrooxidans在矿床AMD的活跃生成区,非重要生物)。
爱德华兹等.[4]对微生物种群进行了一年多的追踪,并进一步确定了在。ferrooxidans.这项研究还表明,另一种著名的铁氧化嗜酸菌,Leptospirillum ferrooxidans,不能解释大多数群落样本中的大多数微生物。爱德华兹等.[29]建立了古细菌的丰富,特别是在低ph值,高离子强度的环境中。
爱德华兹从该遗址中分离出一种新的微嗜氧铁氧化古菌等.[36在某些样品中,这种有机体占微生物细胞的85%。孤立的,被称为能源acidarmanus(strain ferl),是目前详细生理学(Bond)的课题等.[37)和基于基因组的研究(Allen等)研究。债券等.[37]分析了里士满矿内几种特定微环境的16S rRNA基因多样性。与罗杰斯相反等, (34他的目标是AMD溶液和沉积物中的浮游物种,邦德等.[37主要取样的生物膜。已知古生菌的多样性,特别是在该目内Thermoplasmatales的观点被这项研究拓宽了。委员会成员Thermoplasmatales其中包括来自公共数据库的克隆体,它们被命名为“字母等离子体”。38)债券等.[37]还确定了三个不同的系统发育组Leptospirillum(第一组,第二组,第三组)。第二组随后被命名Leptospirillum ferriphilum.[39这些发现为更详细的研究奠定了基础。
方法
地球化学分析
在目前的调查中,加州北部铁山里士满矿的实地工作已经进行了4年多,这是10年研究该地点与金属硫化物氧化相关的微生物活动的一部分。里士满矿井的水对传统水分析中使用的分析技术提出了一些有趣的挑战。值得注意的是,pH标准要求特别注意H的活度系数+在高离子强度的样品中[25使用标准的膜电极或滴定方法测量氧浓度几乎是不可能的。在建立USGS协议后,常规对水样进行Eh、电导率和温度的现场分析。[40pH值测量标准由H2所以4在诺德斯特龙在同一地点开发的测量极低ph值水的方法之后储存等.[25在分析铂电极检查之前,立即准备了ZoBell溶液。正如诺德斯特龙所指出的,[23Eh的测量结果与从Fe中计算出的Eh高度一致2 +/铁3 +夫妇(通常在5%以内)。
水样用60 ml无菌注射器收集,经0.2μM注射器过滤成几个部分,供以后分析。样品储存在15毫升的Falcon试管中,填充以堵塞任何顶空气体,并储存在冰上和冰箱中,直到分析完成。亚铁使用1,10菲罗啉法现场测量,总铁使用哈希便携式数字分光光度计的铁锌法测量。在实验室中,重复的分裂被测量铁2 +和菲3 +直接,使用To的方法等.[41]和海洋光学紫外可见分光光度计(2000系列)。使用这两种方法测量铁在分析不确定度范围内是一致的,这主要是由于分光光度法分析这些样品所需的高度稀释。收集的样品在Dionex系列500离子色谱仪上进行色谱分析,配备电导率检测器和收集于230 nm的UV-Vis检测器。使用等容5毫米NaHCO可在数十微摩尔水平检测到硫酸盐、亚硫酸盐、硫代硫酸盐、二硫代酸盐和硫化物3./5 mM Na2有限公司3.以1.0 ml/min的流速通过IonPac AS16色谱柱洗脱。虽然氯化物、磷酸盐、硝酸盐、亚硝酸盐和氟化物也可以用色谱方法分解,但由于与硫酸盐相比,这些离子的浓度相对较低,因此极高的硫酸盐浓度使得对这些离子的定量分析成为不可能。
尝试测量聚硫酸酯使用等容30%乙腈:H2O洗脱液含有2 mM四溴化氢氧化铵,用3 mM NaHCO缓冲3./ 3mm Na2有限公司3.并通过IonPac NS1色谱柱运行,该色谱柱在色谱法检测单个聚硫酸盐方面取得了一些进展。[42三、四、五硫酸盐都能分解到5μM浓度用25μL样本回路。直接从矿井出水中采集水样,现场离心(~4000 rpm)的水样上清液,经Druschel法保存在阴离子交换树脂上的水样等.[43]都被用来分析聚硫酸盐和硫代硫酸盐。采用Shimadzu系统UV-Vis 254 nm、Alltech C18色谱柱和等分95%甲醇:H的高效液相色谱法提取和分析单质硫2O洗脱液1.0 ml/min后,详细的方法在McGuire和Hamers。[44微量金属、阳离子和二氧化硅通过ICP-MS (VG PlamsaQuad 3)分析,在温莎大学地质系以跳峰模式运行。所有标准品、坯料和样品均用超纯(蒸馏)2% HN0制备3..多个内部标准被用来校正在质量范围内小于2%的机器漂移。
矿物分析
利用Scintag PadV x射线衍射仪(XRD)对铁矿现场的矿物样品进行了XRD分析。利用JCPDS粉末衍射仪进行峰匹配,对XRD分析的样品进行矿物识别。采用LEO 1530扫描电子显微镜(SEM)和Cameron SX50电子探针(EMP)对精选的净化矿物等分进行分析。利用EMP中的后向散射电子图像和能量色散谱仪分析测定了硫铁矿物质中As、Cu和Zn的富集程度。
地球化学建模
使用地球化学家的工作台程序套件进行地球化学建模[45]用于计算溶液中的物种形态。里士满矿的水有很高的离子强度。因此,正确计算感兴趣物种的活度系数需要应用能够解释简单双分子静电相互作用之外的相互作用的模型,如Pitzer方程或HMW模型。[46使用PHRQPITZ数据库对AMD溶液进行了形态计算,该数据库在计算铁山高离子强度溶液活度系数时更为准确。然而,这个数据库并没有包括所有合适的离子对,尤其是FeS04 (aq)物种。使用PHRQPITZ进行的物种形成计算使用了包括可用维里系数在内的热力学数据。试图评估使用数据库的错误是什么,该数据库遗漏了潜在的重要物种(特别是FeS04 (aq)),使用GWB 3.1 React代码提供的hot .dat数据库对这些水域进行了额外和单独的计算。
特别关注溶液中铁、硫和质子的总摩尔数,以评估铁和硫的运输和与控制黄铁矿氧化和微生物活性的途径相关的潜在下沉。在分析上,铁和硫酸盐的测量量准确地反映了溶液中每种元素的量。总H+在黄铁矿氧化产生的溶液中,游离H+在溶液中(从pH和H+活性系数)和原生物质的摩尔浓度,如硫酸氢盐(这受到FeSO丰度的强烈影响4 (aq)复杂的)。硫酸氢盐可用于配合物H+也受到铁物种形成的强烈影响,因为亚铁更强烈地与SO42比H+.结果报告总H+是根据物种形成结果计算的,在功能上等价于自由H+和HSO汽车贸易公司4-在解决方案。这些溶液中还有其他物种,但超过99%的H+包含在这两个物种中。因此,这种计算与从酸度滴定中发现的略有不同,因为阳离子会包含或吸收OH-没有明确考虑。
使用GWB 3.1和hot .dat热力学数据会导致误差,因为平衡常数的外推远远超出了离子强度的有用范围。然而,目前还没有建模协议来达到更好的解决方案。我们用H+根据H的活度系数的比较,这些计算得出的值在严格的定性意义上,因为误差可以大于50%+HSO汽车贸易公司,4-, FeSO4 (aq).PHRQPITZ计算中的错误,其中总H+相当于目前硫种类的30-50%。在试图使用这些数字时,除了定性意义之外,应该谨慎。
毒砂溶解和表面定殖研究
来自里士满矿的铁和硫氧化微生物对黄铁矿和毒砂的表面定殖和溶解已经有报道(例如,Edwards等.[47,48])。采用拉曼光谱的表面敏感光谱研究表明,单质硫是黄铁矿和毒砂溶解的重要产物。49,50在非生物毒砂溶解的情况下,大部分被氧化的硫化物转化为高度不溶的硫8,积聚在矿物表面。[50因此,在本研究中,我们进行了旨在探索硫氧化微生物与溶解性毒砂表面相互作用的实验。这些实验使用了在。caldus因为这种硫氧化生物不能通过铁影响硫化物溶解2 +因此,其主要的生物地球化学效应是对中间硫物种的氧化,如S8.一个需要解决的重要问题是,微生物对硫的利用是否通过去除限制扩散的硫来影响硫化物的溶解速率8涂层。圆柱形的聚四氟乙烯室被组装起来进行三个平行实验。1室配置了0.22μM孔径聚碳酸酯膜将腔室分为两个隔室。腔室的每一端都装有一个端口,用于将材料移出和添加到腔室中。2室和3室的配置方式与1室相同,但没有膜隔断。
毒砂的制备和表面积测量是按照McGuire的描述进行的等.[12等比例的(按质量)压碎的毒砂被加入,这样每个室大约含有0.015米2的材料。将打磨后的毒砂切片切成3 × 3 × 1 mm的薄片,放入2室进行细胞附着研究。这些平板被放置在穿孔的0.5 ml微量离心管中,并连接着一根通过腔室端口延伸的特氟龙电线。压碎后的毒砂和抛光后的试样放入实验室内,然后进行高压灭菌。灭菌技术可能氧化了矿物的表面,但这些实验的微生物培养不能还原的长期性质不应该受到这一影响。
每个装有毒砂的灭菌室,用总共210毫升的生长培养基填满一半容量。我们准备了9k介质,[51]因省略FeSO而修改4添加0.01% (w/v)酵母浸膏。将介质调整到pH值1.6,并在使用前进行高压灭菌。文化的在。caldusTC1的制备方法如上文所述[31用作无辜者。从毒砂材料中分离出来的腔室1室接种在。caldus细胞。2室也接种同样体积的培养物(与毒砂材料接触)。3号室保持无菌,作为非生物对照。在37°C的水平位置孵育。
在规定的时间间隔内从每个室中采集总溶解铁和细胞密度的样品。在23小时、67小时、161小时、286小时、384小时和477小时的采样过程中,分别从2号室提取了一个毒砂券。将样品在3% (w/v)的多聚甲醛中固定4小时,用PBS(磷酸盐缓冲液)冲洗,并在-20°C的1:1 PBS:乙醇溶液中保存。
用铁锌法测定总溶解铁。在光学显微镜下使用Petroff-Hausser计数室对悬浮液中的细胞进行直接计数。通过DAPI染色观察附着在毒砂片上的细胞,并使用荧光显微镜观察。使用CCD相机和NIH图像软件捕获数字图像。校准1000×处的一幅图像的面积,并对15幅随机图像进行计数和平均,以确定细胞密度。
里士满矿的微生物取样
为了扩展之前对微生物种群与地球化学栖息地之间相关性的研究,我们从A-、B-、c -漂移和5-way区域的6个地点收集了样品(图2)。1)。这些照片是从矿井的以下地点拍摄的;a -漂移中黄铁矿堆表面生长的潮湿生物膜,称为“a -漂移滑塌”(0lIMlAslump, pH 1.1),“a -漂移红池”(01IM1red Pool, pH 1.4),“a -漂移Slime Streamers”,位于将“a -漂移堰”(01IM1A1, pH 0.9)与“5路”(01IM1A1, pH 0.89)隔开的瀑布下方,以及“b -漂移堰”(01IM1B1, pH 0.75)和“c -漂移堰”(01IM1C1, pH 0.85)上的生物膜。
微生物培养
所有富集均含有0.8 g/l (NH)的基础培养基4)2所以4, 0.4 g/l KH2阿宝4, 0.16 g/1 MgSO4.碳源添加0.25 g/1胰蛋白酶大豆汤(TSB)和0.2 g/1酵母浸膏至20 g/1 FeSO4并在250毫升带通气盖的烧瓶中培养。为了对可以利用5 mM中间硫化合物的成员进行富集,将硫代硫酸盐、四硫酸盐和S°与10 mM葡萄糖添加到螺旋盖管中并密封(带有空气顶隙)。在矿中常见的温度范围(24°C、37°C、45°C和60°C)下进行浓缩。所有培养基pH调整为0.8 ~ 1.0。一旦观察到生长,< 10[10]稀释系列,以分离新的生物。
16S rRNA基因文库的构建与分析
2001年1月,从六个地点采集的样本被收集到无菌容器中,放在冰上,然后运回实验室。在25%甘油中冷冻保存的样品在PBS缓冲液中洗涤(pH值为1.2,以防止专性嗜酸菌的裂解),以去除细胞外离子。然后将样品重新悬浮在pH值为7.0的PBS中,并按照前面所述进行DNA提取[37然后再用氯仿洗去可能抑制PCR反应的残留苯酚。一套域级引物(27F5' - agagtttgatcctggctcac -3';21Fa5' -TTCC GGTTGATCCYGCCGGAA-3';A16f235 ' -tcyggttgat cctgcc-3 ';利用1492R5'-GGWDACCTTGTTACG ACTT-3')从每个样本的总基因组DNA提取液中扩增16S rRNA基因。16S rRNA基因扩增、克隆、测序和文库分析的细节在其他地方提供。[52通过对偶树比较发现了少数chi-meric序列,但未纳入最终的系统发育分析。序列存入GenBank,登录号为AF543496至AF543512。系统发育树使用ARB软件包生成,拓扑结构使用前面描述的贝叶斯推理进行确认。[52]
鱼(荧光原位杂交)分析
在同一地点采集的样品与克隆文库建设所用的样品同时用pH值为1.2的PBS缓冲液冲洗,并在收集后12小时内用4%多聚甲醛固定。按照先前报道的方案进行杂交。53所有探针合成、序列和特异性的细节在其他地方描述。[53对所有FISH载玻片进行DNA染色,DAPI (4'6-Diamidino-2-Phenylindole盐酸盐)。使用Leica LEITZ DMRX外荧光显微镜观察载玻片。使用Axiovision软件,使用Hamamatsu数字电荷耦合设备相机拍摄图像。
结果
矿物学
大部分黄铁矿矿石是细粒的,因此很容易通过溶解从矿床中析出。在某些地区,这种细粒物质以沉积物的形式堆积在坑道地面上,厚度可达几米。通过光学显微镜、扫描电镜和电子探针分析表明,沉积物以黄铁矿为主,平均粒径为~10 ~ 1000μM.沉积物中还含有百分之几的石英。颗粒表面因溶解而变得粗糙。2).硫酸盐矿物(包括蓝绿色黑镍铁矿、黄褐色黄钾铁矾、铜铜矿、蓝绿色绿铜矿、粉红色高锰矿和一种立方晶形化合物,成分与伏泰石一致)通过蒸发浓缩形成,局部丰富(见图2)。[8电子探针数据表明,黄铁矿颗粒中含有局部富集Zn、Cu和As的区域。这些杂质可能占黄铁矿正离子的百分之几。在沉积物中没有观察到离散的金属硫化物包裹体,也没有检测到其他硫化物(尽管在沉积物中确实存在其他硫化物相)。然而,可以想象,观察到的Zn、Cu和As富集区是ZnS、CuFeS和feas的小包裹体,太小了,无法在电子探针中成像。
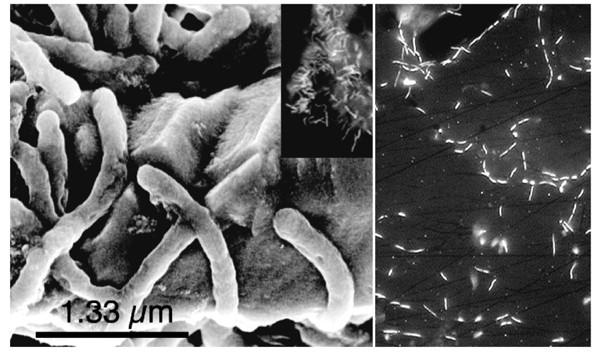
沉积物中黄铁矿的某些表面含有较深的自形坑。3.).在坑底和坑壁上偶尔会出现非常薄的、细长的细胞。这些坑微生物的关联与爱德华兹所指出的非常相似等.[35,54的抛光黄铁矿表面的扫描电镜研究现场从现场取回的实验。一般来说,沉积物黄铁矿表面被形态多样性有限的细胞定植,这表明直接相互作用只涉及少数物种。
毒砂溶解和表面定殖研究
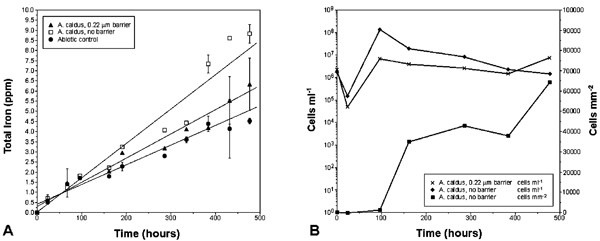
Acidithiobacillus caldus在一些实验中,允许细胞直接接触毒砂,并将细胞与矿物基质保持0.2的距离μM过滤器在其他。总可溶性铁测量结果显示,与非生物对照相比,有细胞存在的毒砂溶解速率仅略高[图4(a)]。在第2室中,细胞被允许接触矿物表面,溶解速度最快。然而,两种生物反应和非生物反应之间的速率差异很小。鉴于之前的实验已经表明α-S8在毒砂溶解过程中在表面积聚,[12,14非生物速率和生物速率之间的相似性(用FeT作为反应进展变量)表示缺乏抑制溶解的表面产物。
在。caldus观察到细胞无论是否附着在矿物表面都能生长[图4(b)]。这一观察表明,一种微生物产物可能参与了转化单质硫的过程,在实验条件下,单质硫是极其不溶的,[55]变成生物可利用的形式。这种化合物可能是将电子从单质硫转移到细胞表面的穿梭器。铁不太可能像电子那样穿梭在。caldus不能氧化Fe2 +在实验条件下,无机铁的氧化动力学极其缓慢。
微生物学
生物膜、水下和水面拖缆出现在5路区域(图。5).显微观察表明与黄铁矿沉积物有关的微生物数量不同。沉积物中细胞数量与取样点深度之间没有简单的变化趋势。
表2而且3列出Fe元素2 +、铁3 +,所以42、铜2 +、锌2 +,艾尔。3 +,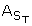 、Cd2 +K+、镁2 +、锰T, Na+、铅T,和SiO2微生物样本采集地点的浓度。2001年a -漂移滑塌处可供分析的流体不足,从a -漂移样品中只收集了一个样品,因为它们之间仅相隔几米的流道。
、Cd2 +K+、镁2 +、锰T, Na+、铅T,和SiO2微生物样本采集地点的浓度。2001年a -漂移滑塌处可供分析的流体不足,从a -漂移样品中只收集了一个样品,因为它们之间仅相隔几米的流道。
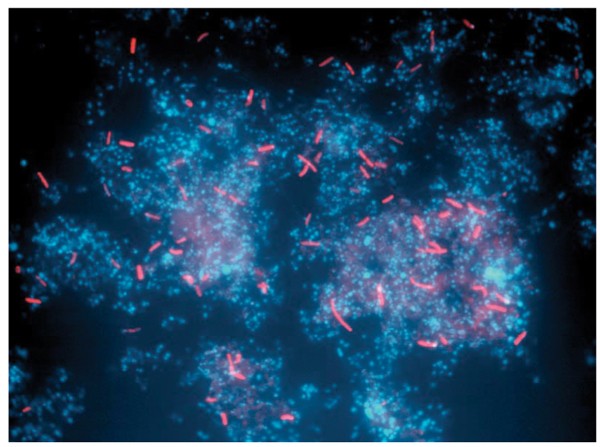
由于PCR偏差,克隆丰度不能作为物种丰度的代表。因此,现场杂交研究使用专为结合通过克隆文库分析检测的生物体的RNA而设计的探针进行。由于大多数样品的细胞密度较高,基于探针的研究只是半定量的。代表性图像如图所示。6,突出显示Sulfobacillus生物膜中的细胞。结果证实了先前的推论[5不同的生物类型(一种类型是在16S rRNA序列中通常具有97%同源性的系统类型)的数量很少。
Cultivation-based研究
在选定的中间硫化合物(硫代硫酸盐、四硫酸盐和S°)上孵育几个月后,未检测到生长。含有酵母提取物和TSB的富集通常会导致生长。稀释这些文化在很大程度上导致孤立能源.一些Sulfobacillus酵母提取物和FeSO分离得到的菌株4.数字7显示了在37°C的异养(酵母提取物作为碳源)培养基上从矿山(SB6和SB37)获得的三个分离株的系统发育位置,这些分离株与先前鉴定的生物非常密切相关(美国thermosulfidooxidansVKM和美国disulfidooxidans)和克隆(见下文,BW7)。尝试在S°上分离SB37未成功。
不依赖培养的分子研究
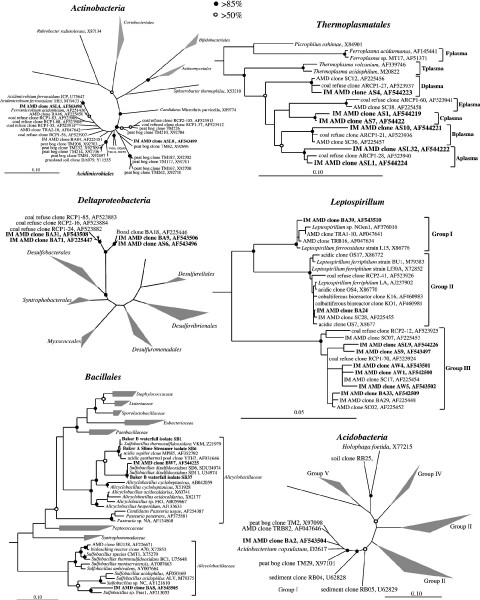
如表所示42001年1月19日,从6个文库分离的微环境中获得232个克隆。在所有样本中检测到的不同生物谱系不超过六种。以前的研究也表明AMD群落的特征是有限的分类群。[38[中文属于硝化螺旋菌,硅藻,阿尔法变形菌,三角洲变形菌,γ变形菌,放线菌,酸杆菌,鉴定了古菌“字母表等离子体”群,获得了接近完整的16S rRNA基因序列(图。7).其中一些谱系与之前在里士满矿发表的序列密切相关[37]和一个森林湿地地点(美国能源部的萨凡纳河地点)受到来自煤炭的酸性溶液的影响[56)(见图中煤矸石克隆。7).
这部小说Deltaproteobacteria仅在a漂移滑塌和红池样品中发现。LeptospirillumIII组在本研究抽样的社区中无处不在。l . ferriphilum(II组)无性系只在a向滑塌样中发现。结果将2001年1月这些地点的微生物群落与以前工作中检测到的微生物群落区分开来。[5]
该目内的克隆与先前鉴定的克隆(>93% 16S rRNA基因序列相同)显著不同Thermoplasmatales从A-drift坍落度和A-drift Slime Streamer样品中测序。所有这些克隆都属于A、B、C和“Dplasma”亚群(图2)。7)即Baker和Banfield所定义的。[38这些“字母等离子体”仅限于最低pH值的环境(即,它们没有在pH值为1.4 a漂移的红池中被发现)。其他与分裂有关的小说谱系放线菌包括克隆ASL8,其16S rRNA基因序列与兰斯等.[57克隆TM214。
Sulfobacillus嗜酸的例如,克隆从所有但一下滑和黏液飘带。FISH分析证实了它们在一些地方的存在,包括A-, B-, c -漂移Weir群落(图2)。6).这一血统之前与里士满矿无关,与Sulfobacillus disulfidoxidansSD-11是在b漂移Weir样本的克隆库中检测到的。此外,还获得了属于该组的分离物(SB37)。
一群新的Alphaproteobacteria在A-drift Red Pool和A-drift坍落度库中被识别。的Alphaproteobacteria与原生生物有直接联系。52]
16S rRNA基因文库来自更氧化,pH值1.4,a -漂红池的独特之处在于它含有高丰度(37个中的21个)在。ferrooxidans(表4).红池也是唯一一个I组Leptospirillum,Acidobacteria被检测到。荧光现场杂交(FISH)分析证实在。ferrooxidans占主导地位Acidobacteria在红池中数量较少(数据未显示)。发现在。ferrooxidans这与基于寡核苷酸探针的Schrenk研究相一致等.[3.对a漂移红池样本的显微镜调查也揭示了原生生物的存在。该样本和其他样本是当前真核生物研究的焦点。58]
水化学
于1999年11月5日、2000年12月6日、2001年1月19日及2002年12月3日在列治文矿收集的水样的实地及实验室分析结果载于附表2而且3.在任何样品中都没有中间硫物种(包括含水硫化物、硫代硫酸盐、聚硫酸盐或单质硫)在检测范围内。
表格V列出了Fe:S:H+使用地球化学家工作台对矿井中的几个样品计算出的比率。总H+使用GWB 3.1程序React进行计算,但算法准确表示H+H的活度系数计算中存在误差,对荷载的影响较大+(参见上面方法部分的讨论)。比较物种形成的计算使用热。phrqpitz database and the thermo database indicates that only a first-order determination of the total H+在解决方案中可以做出。
讨论
里士满矿中的微生物群落
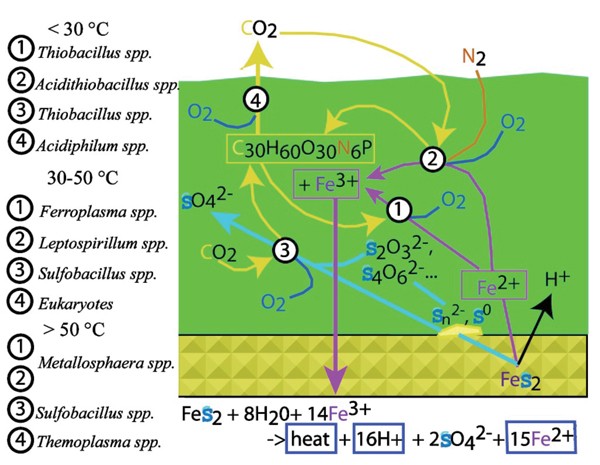
位于山里的研究地点由铁和硫氧化维持的微生物群落定居。微生物获得所有必需的营养物质(磷酸盐和其他离子),物质(CO2阿,2N2),以及来自空气、黄铁矿和酸性矿井排水溶液的能量。尽管单个生物膜中的生物混合物各不相同,但大多数群落都是由相同的相对有限的生物类型组成的,其中许多都有培养代表。根据里士满矿分离物的生理测量结果(f . acidarmanus,[36和鲍姆勒et al。[59]l . ferriphilum第二组,Smriga,未发表;罗等.未发表的;Sulfobacillusspp。贝克等,未发表的;在。caldus[4]),公布了近缘物种的测量结果(Acidithiobacillusspp。,60]Acidimicrobiumspp。,61]Ferromicrobiumspp。,62]Leptospirillum ferriphilum[39,63]和基于系统发育位置的推论(Leptospirillum大多数原核生物通过铁氧化物的再生或中间硫化合物的代谢参与AMD的生成。
我们已经记录了矿井内不同位置微生物群落结构的变化,以及随着时间的推移。群落的结构和成员的活动水平当然与地球化学因素密切相关,这些因素随季节而变化。例如,周期性高温通常与高降雨时期相对应,而高离子强度则与低流量时期相对应。群落结构也可以由与生物量浓度相关的非地球化学因素形成,包括真菌生长、相捕食和原生生物放牧。[64这些又受到温度和溶液浓度的影响。为了评估控制AMD生成速率的许多过程之间的耦合,我们研究了作为生物地球化学系统基础的物理和化学过程。
地球化学和微生物过程的净效应
由于水文、微生物和地质条件有利于大量黄铁矿的快速氧化,里士满矿AMD废水酸性极强,金属含量丰富。用Alpers模拟了AMD放电的低pH值(~0.5)等, (2他指出,每年大约有2000吨黄铁矿从里士满矿床中溶解(~1.6 × 107摩尔或日平均通量为~4.4 × 104摩尔数/天)。利用矿山流量计上可用的流量数据(在里士满矿山流出管采样时记录的数据,主要是在5路收集的数据)和5路样品的铁浓度测量值,可以确定该特定采样期间从5路流出矿山的金属通量。对于我们研究中的四个采样点,5-way处的通量相当于大约1 ×10之间的溶解5到2 × 105摩尔菲斯2/d,与Alpers的平均值吻合较好等.[2考虑到这些数据在季节尺度上的显著可变性。
菲:年代:H +比率
如上所述,在式(6)中,预测黄铁矿完全氧化为硫酸的铁与硫酸盐与质子的比率为1:2:2。使用表中的化学数据3而且4(其中总H+如方法部分所述,使用GWB计算),我们计算了每次采样行程的研究地点的Fe:S:H比。菲:H+表中的值VH+值为大多数样本的比值。关键是要再次注意到,由于正确定义总H的困难+只有定性地讨论这个比率在不同采样时间之间和在同一时间采样的不同地区之间的总体差异是可能的。例如,比较1:2.1:2.0与1:2.5:2.0的比例是不合适的,而比较1:2.1:2.0与1:4.1:4.2的比例是合适的,考虑到与H相关的误差+计算。
对于大多数地点在大多数时间的比率Fe:S:H+接近1:2:2。这个值的偏差(实验和计算误差之外)从1:2:2可能是由于
- (1)
硫铁矿的不完全氧化(如α-S)8或比SO氧化程度低的另一种亚砜亚氧离子42),
- (2)
铁的不完全再氧化2 +对菲3 +,
- (3)
在里士满矿中发现的多种硫酸铁矿物之一的净沉淀或溶解,[9]
- (4)
硅酸盐、粘土、其他含硫矿物的溶解或沉淀;
- (5)
析出或溶解氧化铁矿物铝,或
- (6)
与受(1)-(4)影响的另一溶液混合。
硫铁矿硫的不完全氧化(如单质硫的形成)会显著改变H+溶液中的平衡[例如,等式]。(2)及(3.)]。大量的S8残留在表面也会影响溶液Fe:S:H+(大多数其他中间硫物种是相当可溶的)。不完全再氧化x菲2 +对菲3 +(作为主要氧化剂)增加H的量+在系统中[式(5)],并且会提高H+比例为1:2:2+ x.
硫酸盐矿物沉淀/溶解可影响Fe、S和/或H+预算,取决于所涉及的硫酸盐矿物。在研究区域已经观察到各种各样的硫酸盐矿物(详细回顾,见Jambor)等.[65]),每一种对整个溶液化学的影响都非常不同。例如,黄钾铁矾(KFe3.(所以4)2(哦)6)沉淀会使pH降低,而菱石沉淀((H .3.O) Fe (4)2.3H2O)会使pH值上升。然而,对Fe:S比值的扰动更为显著,因为硫酸盐矿物是1:1的亚铁盐或1。x:1米ixed ferrous-ferric sulfate minerals (no combination approaches the 1:2 ratio of pyrite, as the charge of sulfate is twice that of pyritic sulfide).
与Balakla流纹岩和矿化事件有关的其他矿物也被溶解,可溶铝的数量证明了这一点3.+、钙2 +、镁2 +,以及这些样品中的其他离子。流纹石溶解对溶液的质子收支有一定影响;例如,钙长石的反应将消耗每摩尔8个质子,释放1摩尔Ca2 +2mol A13.+,和2mol SiO2 (aq).大量的铝3 +可能会影响到Fe:S:H+通过消耗一些H+(可达约200-250 mmolar,可达总H的~ 30-50%+在一些样本中)。
氢氧化铁沉淀/溶解会影响铁的析出T然而,在铁山观察到的大多数溶液的pH值远低于与氢氧化铁溶解度对应的pH值,即使存在非常高的铁含量。只在a漂红池(01IM1A2;pH 1.4, Fe:S:H+比例= 1:4.1:3.3),在矿床外较高的pH环境中是FeOOH积累的证据(见下文)。那里的矿井上有一层gossan层,这表明在采矿之前,铁被重新活化成氢氧相。5-way区域与大多数AMD站点不同,因为采样可以在溶液有机会中和和沉淀重要的氢氧化铁矿物之前进行。
结果表明,预测Fe:S:H+根据总体化学计量学,AMD溶液的值与预期基本吻合,表明山内硫酸盐矿物的储层是相对恒定的,即每年2000吨黄铁矿的氧化并没有产生快速生长的硫酸盐矿床。硫酸矿床已知存在于矿井内,但矿井也有明显的季节性洪水,至少溶解了一部分。8,9铁:S:H+在2000年6月12日的采样行程中,比例有显著差异(接近1:4:4)。
黄钾铁矾沉淀能以1:1左右的比例隔离铁和S,产生更多的H+保持S和H的1:1的比例+.2000年,通过XRD分析,在矿井底板多处发现黄钾铁矾、钴铁矿、绿铜矿、高锰矿等黄色物质(数据未显示)。2000款Fe:S:H+比值可能反映了显著的硫酸盐矿物沉淀,并表明硫酸盐积累随时间的推移是不均匀的。
氧通量
总体Fe: H+出矿量最终由O2供应[式(6)]。3.5摩尔O的要求2每升溶液溶解黄铁矿,生成1m铁T解决方案使氧气需求的角度[见式(6)]。O的溶解度2海拔3000米,40°C, 1摩尔离子强度约为140μm (66这意味着在流体从5路充电到排放的过程中,每升水必须完全再充氧约7500次。
尽管作为AMD现场解决方案开发的一部分,铁山“呼吸”这一事实已得到充分证实,也是必要的,[2,25我们对里士满矿的水文地质知之甚少。当然,有一些水文地质领域存在缺陷。溶液可能沿着裂缝控制的流道、明渠流动、通过沉积物中的渗流带渗透,或通过饱和的地下流动流动。据估计,在5路隧道观测到降雨事件后流体脉冲所需的时间从几小时到几个月不等(P. Eko-niak,私人通信),这取决于穿过固体岩石的裂缝的饱和状态和覆盖隧道地板的黄铁矿沉积物中的孔隙。然而,单个脉冲的传输时间可能变化很大,通过饱和沉积物的路径的上限可能在几年到几十年的范围内(D. Dodds,私人通信)。
根据历史地图,流体路径的长度可以近似地从几百米到几公里。使用这个范围,我们估计溶液必须沿着其流动路径每1-100厘米重新氧化一次。流体沿着这条路径的运动可能非常不规则(流体可能在冲洗前长时间停留在池或孔隙中,或快速通过沉积物),因此再氧化的速度和机制可能有很大差异。
O2分子溶解到溶液中包括(i)扩散:使用估计扩散的计算表明O2在黄铁矿沉积物中的渗透距离在毫米至厘米范围内(不确定度较高);(2) evaporation-condensation。在一年中温度高的时候,蒸汽与流动的AMD有关。在温度超过50°C的山区深处,这可能代表着一种有效的水再氧化机制。此外,任何流体的再氧速率都受到流体流动和湍流的影响,因此任何扩散速率的计算都是对速率的最小(最慢)估计。
矿井中水的最短停留时间可能在一天到一个月之间;上限可能是几年到几十年。在一天的过境时间内,为了产生0.3 M的FeSO,水流路径上的再氧化必须以每10秒一次的速度发生4解决方案。如果停留时间在一个月左右,则必须每5分钟进行一次再氧化。假设扩散梯度为140μM/mm(假设O2在1 mm内由饱和到厌氧),取O2按2.1 × 10入水9米2年代-1,[67菲克扩散的O2大约在3μ摩尔米-2年代-1.用另一种方法来考虑再氧化的时间,如果一升水的表面积是1002厘米2(1升几何深度100厘米× 100厘米× 1毫米),再氧化140μ摩尔啊2大概需要45秒。一升水,表面积为102厘米2(1升,深度为10 × 10 × 10厘米)需要一个多小时才能氧化140μ摩尔啊2.只有在坡度极其陡峭的情况下,进入沉积物的氧气通量才可能足够快,以支持较短的停留时间,这必须通过维持陡峭坡度的过程来支持。这种过程很可能是微生物驱动的氧化,但由于不确定的细胞数量、扩散通量、平流运输效应和氧化速率,因此不可能对其进行定性分析。
热量衡算
Richmond溶液在5-way上的温度通常在30°C-50°C之间3).矿井深处的温度高于56°C。以前有人认为热是黄铁矿放热氧化的结果。8使用平均[Fe]aq0.23 M时,由于溶解0.23 mol的黄铁矿,每升溶液释放约350 kJ(= 83卡路里)的热量。假设这些水的热容与纯水的热容没有显著差异,并且所有的热都积聚在溶液中,黄铁矿氧化可以很容易地解释AMD流体的温度。
还有其他几个过程可能会导致矿井的总体热收支,特别是在系统中观察到的与高降雨和系统内流量增加有关的温度变化。假设大部分流体从地表移动到5路至少需要一年的时间,高降雨后5路的高温(没有显著的pH值变化)可以简单地归因于来自系统较热区域的流体的充电驱动运动。
如果有快速的流体流动路径,允许稀雨水和酸性溶液之间的混合,混合的热量也可能是热能的来源。计算两种不同溶液混合所产生的热量可以用
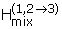
= H (x(3)) - [X1H (x(1)) +X2H (x(2)), (7)
混合焓是由溶液1和溶液2的摩尔分数的焓推导出来的x按摩尔分数混合X的总解,3(源自Zeleznik[68])。基于H的摩尔分数2所以4诺德斯特龙报告的一些pH值极低的溶液等.[25]和更高的pH值溶液(通常在其他AMD区域发现),可以计算出几种假设情况下混合产生的热量。相当数量的极低pH值溶液与较高pH值溶液(50% pH -3 +50% pH 2)混合,甚至需要接近每升20卡路里才能将溶液提高到观察温度。这种程度的混合降低了所产生的溶液pH值,比观察到的从矿井流出的大多数水的pH值更大。另一种方案可能包括将周围中性雨水(从地表迅速输送,没有明显的反应或混合)与pH值极低的黄铁矿沉积物孔隙溶液膜混合。在这种情况下,5% pH -3溶液+95% pH - 7溶液导致溶液pH约为0.5,但只贡献1.7卡路里的溶液(即,足以使1升水1.7°C)。因此,可以假设里士满矿中不同溶液混合产生的热量不是导致温度升高的重要因素。
当降雨将静止的氧化水池冲入相邻的细粒黄铁矿沉积物时,也可能产生温度脉冲。这些池可能类似于红色池(本研究)或蒸发池,其中一些包含300毫米铁3.+.25冲刷先前停滞的大型铁池3.+富含硫铁矿的溶液可以通过局部的、增加的黄铁矿氧化为系统贡献大量的热量。这一过程可以解释在里士满矿区不同时间观察到的显著温差。
发生在矿井内的大量蒸发可能是一个热沉。在40°C时,蒸发1摩尔纯H需要10.36卡路里2O.然而,由于矿井中的风量没有得到很好的约束,而且我们不知道这些系统中的蒸发-冷凝速率,因此不可能评估这一过程在矿井内的热预算中所起的作用。
黄铁矿氧化途径及其对微生物代谢的影响
微生物群落结构受到黄铁矿氧化途径的影响,因为这些途径决定了生长底物的数量和类型。利用铁的微生物2 +作为底物取决于无机和生物反应,减少铁3 +(通过与硫或有机化合物反应)来关闭循环。不同中间体硫与铁的反应性3 +会影响Fe2 +再生后作为微生物底物使用。
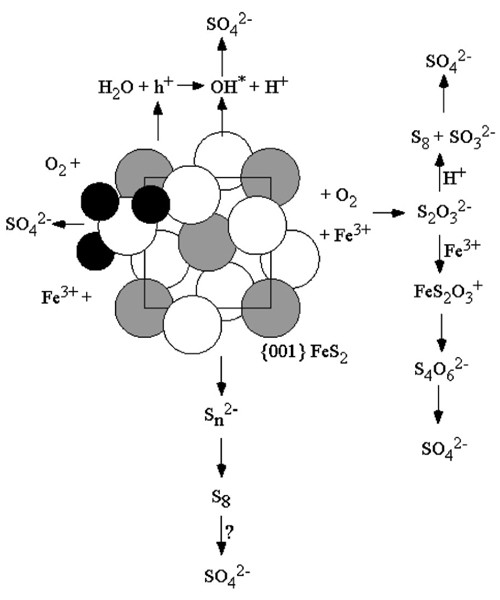
黄铁矿氧化机理已在一系列条件下利用广泛的技术和理论进行了深入研究。17- - - - - -19,21,31,69)图8说明了几种可能的途径,通过硫化物硫铁矿可能氧化为硫酸盐。我们将研究低pH值下的硫氧化,并考虑微生物可能发挥的潜在作用。供参考,表格6(无花果。9)介绍在列治文矿场发现的每一种/组生物体的代谢推论。
一些研究已经观察到多硫化物的形成(见图。8)在黄铁矿表面。[70,71(胡)71]表明,多硫化物是暴露于低ph值铁表面的黄铁矿单质硫形成的前体。单质硫已在许多黄铁矿氧化实验中以不同量形成。[12- - - - - -14]研究还表明,在低pH条件下,单质硫的表面归一化氧化速率比黄铁矿的氧化速率慢几个数量级。[72因此,单质硫应该可供微生物利用。
没有证据表明在里士满矿的黄铁矿表面有单质硫的积累。l . ferrooxidans(组I和组II),构成群落的大多数,没有显示利用任何S种(表6).的Sulfobacillus菌株利用多种硫化合物以及有机化合物和其他底物。尽管有证据表明存在Sulfobacillus在AMD溶液和溶液-空气界面的生物膜中,对沉积物的FISH工作没有发现显著性Sulfobacillus人群。[5]在。caldus已从站点隔离(尽管在基于克隆库的研究中不常被检测到)。在。caldus可以在不接触矿物的情况下氧化单质硫,这表明梭式机制在单质硫氧化中很重要。电子梭是指小的氧化还原活性有机分子,能够在还原和氧化物种之间携带电子,作为微生物为细胞生长和/或维持获取能量的一般机制。[73] Druschel [72]回顾了该系统中潜在电子穿梭的标准。正在进行的工作的目标是识别和描述潜在的航天飞机。
黄铁矿通过硫代硫酸盐氧化(图中A)。8)是最被广泛接受的黄铁矿氧化模型之一,并以实验证据为基础[18,21]加上分子轨道理论描述。[17]随后关于硫代硫酸盐在低ph值溶液中稳定性的研究表明,硫代硫酸盐通过不同的途径分解:[15,22,74]
4 S2O3.2 -+ 4小时+→年代8+ 4 hso4-(8)
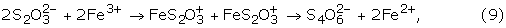
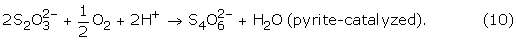
硫代硫酸盐在与里士满矿类似的溶液中的命运动力学模型表明,在这种环境中形成的任何硫代硫酸盐几乎会立即氧化为四硫酸盐。[38,75Druschel详细研究了聚硫酸盐在溶液中的命运等.[75,76结果表明,聚硫酸盐氧化动力学与铁耦合3 +或O2在酸性条件下还原很慢。在里士满矿中没有观察到任何聚硫酸盐物种,这表明要么黄铁矿不通过这种途径氧化,要么存在能够快速氧化该物种的微生物。克隆库的结果(表4),培养结果并没有清楚地表明有大量的微生物直接利用中间硫物种。然而,这是可能的能源Spp .,“字母等离子体”和/或LeptospirillumIII组在微亲氧环境中可以偶联中间硫氧化和交替电子受体的还原。基于以下结果Ferroplasmsa应变MT17, (77]f . acidarmanus可氧化中间硫化合物。Okibe等.[77建议能源菌株MT16和MT17能够利用四硫酸盐作为电子受体,因为观察到四硫酸盐浓度在一个显著的滞后阶段后下降。然而,成长了一个能源该研究中的菌株在聚硫酸盐浓度下降的同时停止生长,并且在里士满矿中发现的菌株没有表现出利用中间硫物种作为底物的能力。
硫铁矿氧化模型的关键是硫代硫酸盐从表面分离。8),以S-S和Fe-S键的相对键强为基础。[78,79比较是基于体积值和关于氧化导致的电子密度转移的一般观察结果。这些键的强度肯定会受到这两种氧化过程的影响e-对称性下降)和由于在表面(对称性下降)的结果。这些相互作用导致的电子重分布将影响Fe-S和S - S键的相对强度,这将决定S2O3.2 -会以自由离子的形式脱离。去除S所需力的实验观察2O3.2 -从表面看,[18]和缺乏显著的观察S2O3.2 -或年代xO62 -在低pH值时;[13,18,75]表明低ph时Fe-S键比S-S键更强等.[20.]在积极氧化的黄铁矿上检测到类似硫代硫酸盐的表面结合基团,但没有发现证据表明该物种在溶液中分离并氧化为硫酸盐。因此,尽管路德的分子轨道论点[17在很大程度上,S2O3.类表面基(Fe-S-S-O3.)可能不会产生可观的自由S2O3.2 -在低ph值条件下。有限的(或没有)S2O3.2 -因此,硫代硫酸盐的微生物利用可能受到硫代硫酸盐是表面结合还是释放到溶液中的影响。如果硫代硫酸盐仍然与黄铁矿表面结合(如Fe-S-S-O)3.),然后细胞必须附着,或者需要其他步骤将硫代硫酸盐释放到溶液中。
黄铁矿氧化的另一种可能途径是形成中间氧自由基(图2)。8).[18,79- - - - - -81羟基自由基(OH*)在黄铁矿表面形成,是由于水(以游离的形式存在于溶液中或作为铁水化球的一部分)与孔洞(空位)反应后解离而形成的e-处于充满能量的水平;这个空穴是由水中失去的电子填满的。82孔洞可能是由氧化反应(在溶液中或在空气中)、缺陷或矿物中的掺杂物造成的。天然黄铁矿可能含有大量杂质,两者皆有n——p型黄铁矿(p型黄铁矿有额外的孔洞)是天然矿床中丰富的。[79]
黄铁矿被OH*氧化生成亚氧基,其中氧来源于水(与上述同位素结果一致):
菲斯2+铁3 +→菲斯2+h++铁2 +(11)
H2O +h+→oh * + h+(12)
菲斯2+ OH*→FeS2O-+ H+(13)
在哪里h+是黄铁矿中的一个孔洞点。在此过程中,中间硫的氧化速率受到OH*的生成的限制。OH*的形成是由于内在缺陷和/或p型掺杂剂是一种不依赖氧气供应的硫氧化途径。
除了单质硫之外,大多数S中间产物会很快与羟基自由基发生反应。[72许多中间硫物种与OH*的非生物氧化速率在微秒级或更快。[76因此,环境系统中的羟基自由基途径可能会在从中间硫物种中获得潜在能量的竞争中击败微生物,这可能解释了里士满矿山系统中这些生物的明显稀缺。羟基自由基的产生可能与氧化表面的润湿有关。[72,80这种OH*的来源也可能在干旱期后的洪涝期影响矿井中中间硫物种的分布。
如图所示我黄铁矿衍生硫化物形成的硫酸盐中氧的来源为H2所有的阴极反应都是O2是主要氧化剂。同位素分析表明,在实验室和自然条件下,硫铁矿氧化产生的硫酸盐中大部分氧的来源是H2O而不是O2.[83然而,在低pH值时,亚硫酸盐-水的同位素交换被认为是非常快的,任何直接的O2以前黄铁矿氧化过程中形成的中间硫的氧化作用可以被抹去[84),因此不能很好地反映铁山的反应途径。
有毒金属
隧道中水运移的黄铁矿堆积物(沉积物)中的砷、铜或锌可能以单独的矿物颗粒、黄铁矿颗粒中离散矿物的小包裹体或局部富集的形式存在。此外,这些元素在矿体中的分布可能是不均匀的,在新近暴露的矿石中可能比在风化较久的沉积物中含量更高。
硫化物矿物之间的电偶相互作用导致毒砂、黄铜矿和闪锌矿的快速损失。[85这种电偶联可以保护黄铁矿的阴极,而其他硫化物的选择性阳极溶解继续进行。EMP分析发现的局域As、Cu、Zn杂质会通过影响黄铁矿局域电子结构而改变其反应性。夹杂物或富集区域的选择性氧化可能导致局部点蚀,如图所示。3.,并影响微生物附着模式。有毒金属如as、Cu、Cd、Hg和Ag的浓度也会影响微生物群落结构,因为不同的物种和菌株可能有不同的金属耐受性。
空间和时间变异性
各堰(A漂、B漂、c漂)取样点的地球化学数据和4个采样日期的5向区域数据见表2和表3相关矩阵如表所示7.该表列出了每个变量与其他统计显著变量的皮尔逊相关系数。温度与铁有很强的相关性2 +、铁3.+, Eh说明黄铁矿氧化热控制温度。H的强相关性+有这么42说明了黄铁矿氧化过程中硫的氧化对质子生成的依赖。有趣的是,Cu与Fe相关2 +而Zn则没有,这表明不同的因素控制着它们的浓度。这种相关性可能是由电原反应释放的,也可能是由黑白石溶解引起的,因为该矿中的黑白石中含有大量的铜和锌。[9]
随着时间的推移,Eh以同样的方式在漂移中变化(表2).这表明,由于季节变化引起的扰动对整个系统的影响是一致的,并意味着在所有漂移和相关采场中都发生了类似的过程。
2001年观测到异常高Eh。取样旅行前一周的高降雨量可能导致黄铁矿表面形成的富硫酸薄膜和干旱月份形成的水池被冲刷,硫酸盐矿物溶解,O2.在时间上,Fe3 +由于黄铁矿氧化而消耗的Eh值返回到由O和O之间的平衡所决定的值2扩散,表面氧化反应,微生物活性。
~0.14 mol /L的过量Fe3 +与之前的采样次数相比,2001年1月在溶液中观察到的需要额外提供3.5 × 10-2摩尔啊2/ L。即使整个溶液体积是新的雨水(2.5 × 104摩尔啊2)有超过两个数量级的赤字2供应。事实上,为了提供3.5 × 10-2摩尔啊2考虑到O . /L的溶解度,需要将溶液复氧200次以上2AMD中<1.40 × 104因此,单靠降雨不能解释高铁3 +与其他采样次数相比。其他可能提高系统Eh的因素包括由于通过系统的平流速率或铁氧化原核生物活性水平的变化而引起的亚铁/铁铁比值的改变。
控制微生物群落结构的地球化学因素
铁氧化微生物在所有被研究的群落中都是丰富的(Bond等.[5和这项研究)。好氧铁氧化微生物形成明显的生物膜(通常由Leptospirillum(Spp .)在沉积物-或溶液-空气界面。这些生物膜内的活性产生溶液,其中水溶液铁浓度通常比氧浓度大几个数量级。这些溶液渗透到沉积物中,在那里它们诱导黄铁矿和相关中间硫化合物的厌氧氧化。铁的供给3 +对于将S化合物(或有机碳)的氧化与Fe的还原耦合在一起的生物来说是重要的3 +(无花果。9).氧扩散与氧化反应的解耦表明,氧饱和的黄铁矿沉积物中可能存在不同于生长在好氧或微嗜氧区域的微生物群落。
在2001年1月19日的旅行中,在不同的采样地点观察到一些微生物种群组成的差异(表2)4).在氧化程度较高的A-drift Red Pool和A-drift暴跌区,微生物群落与较高的pH溶液相关,金属和硫酸盐浓度通常较低(可降低5-10倍,见表)2而且3).红池的地球化学和微生物特征最为明显。a -漂移红池里只有在。氧化亚铁,L. ferrooxidans,Acidobacteria,与这些细菌的已知最佳pH值和温度相一致。[39,60,86a漂移滑塌区含有大量的“字母等离子体”(表2)4).这些也出现在a漂移黏液拖缆和暴跌(表V).由于“字母等离子体”克隆与特征有显著差异(> %)热原体属sp .菌株(图;7),它们是嗜热兼性厌氧菌,[87]根据系统发育位置推断它们的代谢作用是不可能的。在A-drift暴跌泥泥中,可能导致“字母等离子体”增殖的因素是较低的温度、较高的pH值和高丰度的生物膜聚合物。系统相关热原体属已从一个受煤矸石影响的湿地中报告,其pH值和温度与a型漂移滑塌相似。[56]
B漂移和c漂移所有地点的克隆文库和FISH结果是相似的,基于地球化学和温度的普遍相似性。人口主要由能源acidarmanus而且Leptospirillum(III组)微生物。的优势Leptospirillum2001年1月的第三组将这些群落与以前记录在这些地点的群落区分开来[5和泰森等一个/.[88])。最可能的地球化学控制是异常高的铁3.+:铁2 +在2001年1月的溶液中,这可能意味着参与铁氧化的电子传递链酶的氧化还原电位在两种溶液中不同Leptospirillum组。
之前已经注意到,该地点的微生物种群对季节性降雨的响应有很大变化,这与离子强度和温度的变化有关。一般来说,古细菌种群在pH值和离子强度较高的干燥月份占优势,而细菌和真核生物种群在湿润月份更为显著。[29,892001年1月古菌种群相对较低的丰度与这一结论一致。
结论
降雨主要发生在一年的早些时候,引入了相对少量的氧气,这些氧气在矿井内与黄铁矿的反应中迅速被消耗,微生物将其还原为亚铁的氧化。演进中的AMD溶液必须沿着其流动路径进行数千次的再氧化,以获得在退出系统时观察到的金属和硫负荷。微生物呼吸作用促进氧气扩散到溶液中。铁氧化细菌和古细菌在AMD生成中的一个关键作用是加速原本缓慢的铁氧化反应(在低pH值下尤其缓慢),这促进了黄铁矿的溶解并导致铁的快速积累2 +,所以42,和H+沿着流动路径。黄铁矿的放热氧化是主要的热源。然而,将高度氧化的溶液(在干燥的夏秋两个月形成)冲入黄铁矿沉积物中可能会导致高降雨后的热峰值。Fe:S:H的比值+表明在很长一段时间内没有一致的硫酸盐矿物、单质硫或其他亚基化合物的积累。然而,如前所述,季节性变化可能归因于硫酸盐矿物的积累和溶解。[9这些结果表明,矿山中的硫酸盐矿物在季节性的时间框架内沉淀和溶解,但随着时间的平均,排出物通常反映完全的黄铁矿氧化。
如前所述,微生物群落包含相对较少的不同类群。[37,38对微生物群落进行的与栽培无关的调查揭示了一些新认识的谱系。很多新奇之处就在于Thermoplasmatales秩序和放线菌,主要在a漂移的地面生境内探测到。只有在较高的pH值,较低的金属和硫酸盐浓度的环境中,才出现诸如酸化氧化亚铁硫杆菌,酸杆菌sp。Leptospirillum ferrooxidans发现。铁氧化生物的明显优势表明,由于铁的高通量和氧自由基的形成,硫氧化的非生物途径是快速的。然而,进一步的代谢特征尚未培养的“字母血浆”和Leptospirillum为了测试它们氧化中间硫的能力,需要III组物种。
在里士满矿,铁氧化微生物的优势(能源acidarmanus而且Leptospirillumspp.)确保了铁的持续供应,使得黄铁矿氧化路径上的所有步骤都有可能变成SO42含铁铁对中间硫种的氧化作用。硫代硫酸盐和四硫代酸盐在这些条件下的氧化动力学,[22,74- - - - - -76]表明,在低ph环境下,硫代硫酸盐的分离不会显著促进黄铁矿的氧化途径。即使黄铁矿氧化机制包括氧自由基的产生,单质硫作为中间硫物种的生物利用度也是可能的,因为单质硫不容易通过迄今为止测试的自由基途径溶解。某些中间产物(如单质硫)不易与铁反应3 +并且可以被Sulfobacillus种虫害和Acidithiobacillus caldus通过直接接触或酶促穿梭过程,使生物体与黄铁矿表面保持一定距离。这种推测需要进一步分析。
参考文献
Nordstrom DK: 1977年,斯坦福大学博士论文
Alpers CN, Nordstrom DK, Burchard JM:水资源调查-美国地质调查报告WRI。1992
李志强,李志强,李志强,李志强。中国科学:地球科学,2004,26(3):344 - 344。
刘志强,李志强,李志强。微生物学与微生物学学报,2004,24(3):344 - 344。
王志强,王志强,王志强,等。微生物学与微生物学研究。2000,26(3):489 -497。
Kinkel AR, Hall WE, Albers JP:美国地质调查局专业论文报告第285号。1956
南BC,泰勒:经济学,1985,80:2177-
Nordstrom DK, Alpers CN: Proc Natl Acad Sci USA。1999, 26 (3): 369 - 369 /pnas. 674。
李志强,李志强,李志强:硫化物氧化的环境地球化学研究。编辑:Alpers CN, Blowes DW。1994,美国化学学会,华盛顿特区,550:324-
皮尔逊RG:化学反应的对称性规则:轨道拓扑和基本过程。1976,威利,纽约,1
李德:2004年,CRC出版社,博卡拉顿
王志强,王志强,王志强,等。应用物理学报,2001,29(1):1 -8。
王志强,王志强,王志强。微生物学与生物技术。1999,29(4):457 - 457。
王志强,王志强,王志强,王志强。地球化学与地球化学学报,2004,29(3):366 - 366。
王志强,王志强,王志强,等。高分子材料学报,2003,26(3):379 - 379。
王志强,王志强,王志强。中国地质大学学报(自然科学版),2003,29(3):388- 388。
刘国强:地球化学与地球化学学报,2004,19(3):366 - 366。
刘志强,王志强,王志强,等。中国地质大学学报,2004,27(1):1- 7。
王志强,王志强,王志强,等。环境微生物的应用。1999,29 (3):319-
Borda MJ, Strongin DR, Schoonen MAA:未发表
杨文杰:《中华医学杂志》,2003,30 (3):344 - 344
王志强,王志强,王志强,等。地球化学与地球化学学报,2003,29(3):379 - 379。
诺德斯特龙DK: Int Geol Rev. 2000, 42: 499-
李国强,李国强。中国经济,1999,6:89-
中国环境科学与技术,2000,29(1):1 - 2 / 3。
路德·GW:水生化学动力学。编辑:斯图姆W. 1990,威利,纽约,173-G。W.路德和J. I.波普,水生地球化学
王志刚,王志刚。科学与技术。1997,16 (1):1- 7
王志刚,王志刚,王志刚,等。生物技术与生物工程学报。2003,23(3):388 - 388。A. M.约翰逊和D.B .布里奇,应用。环绕。微生物学。2181 (1998);J.凯利和D. P.梅森,Arch。微生物。149,317
王志强,王志强,王志强,等。环境微生物的应用。1999,29 (3):329 -
王志强,王志强,王志强,等。环境微生物的研究进展。2004,29(3):377 - 377。拉尔森,G.奥尔森,O.霍尔斯特,H.卡尔松,同前.56,697 (1990);K. J.爱德华兹,莫施伦克,R.哈默斯等,我。矿物83,1444 (1998);W.桑,T.格尔克,P. G.约萨等,湿法冶金59,159 (2001);t·a·福勒,p·r·霍姆斯和f·k·克伦德威尔,同前.59 257 (2001);A.希普斯,P. G.乔萨,W.桑等, Geomicrobiol。J. 17, 151 (2000);W. Sand和H. von Rege,在生物膜(1999),第310卷,第361页;B.埃尔伯林,A.希普斯,W.桑,J.康威。生物化学41,225 (2000);T. A.福勒,P. R.霍姆斯,F. K.克伦德威尔,应用。环绕。微生物学杂志,65,2987 (1999);P. R.霍姆斯,T. A.福勒和F. K.克伦德韦尔,j .电化学。Soc. 146, 2906 (1999);M. Boon和J. J. Heijnen,湿法冶金48,27 (1998);H. Tributsch和J. A. Rojas-Chapana, electrochim。 Acta 45, 4705 (2000); F. Battaglia-Brunet, P. d'Hugues, T. Cabral等(1998)。
刘志强,李志强,李志强,等。中国地质大学学报(自然科学版),2004,29(1):1- 7。
Nordstrom DK, Southam G:地球微生物学:微生物与矿物之间的相互作用。编辑:Nealson KH1997,美国矿物学会,35:361-
杨晓明,张晓明,张晓明,等。中国生物医学工程学报,1998,26(4):457 - 457。
罗杰斯TM: 1996,威斯康辛大学硕士论文
爱德华兹KJ: 1999,博士论文,威斯康星大学
刘国强,李志强,李志强。中国科学院学报,2000,27(3):397 - 397 / 397。
刘志强,王志强,王志强,等。微生物学与微生物学学报。2000,26(3):379 - 379。
王志强,王志强,王志强,等。中国微生物学杂志,2003,44:139-10.1016/S0168-6496(03)00028-X。
王志强,王志强,王志强,等。微生物学与微生物学学报,2003,26(3):344 - 344。
王尔德FD,拉德克DB:美国地质调查局TWRI卷9。2001, u.s.g s, 9:
李志强,李志强,李志强。环境科学与技术。1999,29(1):1 - 7。
王志强,王志强,王志强,等。2006 .色谱研究进展,39(1):1- 8。施特劳斯,费森尤斯。化学326,543 (1987);欧莱利,迪基诺斯基,邵氏等,肛交。詹。学报432,165 (2001);S. B.拉宾和D.斯坦伯里M .安纳。化学57,1130 (1985);邹海红,贾哲,张勇等,肛交。詹。学报284,59(1993)。
徐勇,徐志伟,李志强,陈志强,陈志强。地球化学学报,2003,23 (3):344 - 344
王晓明,王晓明,王晓明,等。环境科学与技术,2000,34:4651-10.1021/es0011663。
Bethke CM:地球化学家的工作台版本3.0:Rxn, Act2, Tact, React和Gtplot的用户指南。1998,伊利诺伊大学,厄巴纳-香槟
《地球化学反应模拟》,1996年,牛津大学出版社,纽约,1
李志强,李志强,李志强,黄志强。中国有色金属学报,2004,19 (3):344 -
刘志强,李志强,王志强,等。环境微生物学研究。2000,2:324-10.1046/j.1462-2920.2000.00111.x。
刘志强,李志强,李志强,等。中国地质大学学报(自然科学版),2001,29(1):1- 7。
刘志刚,刘志刚,刘志刚。地球物理学报,2001,4:(数字对象标识符)10.1039/bl04111h
银曼MP,龙格DG:细菌学杂志,1959,78:
王志强,王志强,王志强,等。微生物学与微生物学研究进展。2006,29(4):457 - 457。
邦德PL, Banfield JF: Microb生态,2001,41:
爱德华兹KJ,鲁滕贝格AD:化学Geol 2001, 180:
王志强,王志强,王志强,等。化学工程学报,1998,26(3):379 - 379。
王志强,王志强,王志强,等。环境微生物学研究。2002,4:764-10.1046/j.1462-2920.2002.00337.x。
王志强,王志强,王志强,等。中国生物医学工程学报,2004,18(3):379 - 379。
Baker BJ, Lutz MA, Dawson SC, Bond PL, Banfield JF:应用环境微生物。
王志强,王志强,王志强。微生物学与微生物学研究。2004,29 (4):529 - 531
王志强,王志强,王志强。微生物学与微生物学研究。1999,29 (3):344 - 344
《微生物学》1996年第1期,第2期。李志刚,李志刚,李志刚。微生物学杂志。17,159(1996)。
约翰逊DB,罗伯托FF:生物明:理论,微生物和工业过程。编辑:罗林斯DE。259-279。
中华微生物学杂志,2002,2:1- 5
王志强,王志强:中国微生物学杂志,2003,29 (3):344 - 344
王志强,王志强,王志强,王志强,中国:含硫矿物的结晶学、地球化学特征及环境意义。2000,20 (4):377 - 377
Clesceri LS, Greenberg AE, Eaton AD:《水和废水检查标准方法》/由美国公共卫生协会、美国水工程协会、水环境联合会联合编写和出版,1996年,美国公共卫生协会,华盛顿特区
王志强,王志强,王志强,等。环境科学学报,2004,29(1):1 - 8。
刘志军:《化学与物理学报》,2001,30 (4):344 - 344
马志强,李志强,李志强:地球化学与地球化学学报,2004,25(1):1 - 8。m。a。Williamson和Rimstidt JD,同前.58,5443 (1994);b·c·博斯蒂克,s·芬多夫,b·t·鲍伊等,环境。科学。技术科学34,1494 (2000);C. O.摩西和J. S.赫尔曼,Geochim。Cosmochim。学报55,471 (1991);C. L. Wiersma和J. D. Rimstidt,同前.48,85 (1984);斯库宁MAA, A.埃尔斯提诺,M.博尔达等Geochem。译,1,23 (2000);A. G. SchaufauB, H. W. Nesbitt, I. Kartio等电子能谱学。遗传代数。《天工异类》96,69 (1998);C. M.埃格尔斯顿、J. J.艾哈特和W.斯图姆。矿物81,1036 (1996);j·m·格夫蒙特,a·r·埃尔斯提诺,d·r·斯特朗金等,同上.83,1353 (1998);A. R.埃尔斯提诺,斯库南MAA和D. R.斯特朗金,Environ。科学。科技学报,35,2252 (2001);罗索,贝克尔,霍切拉,美国。矿物84,1549(1999)。
李志刚,李志刚,李志刚,李志刚:中国有色金属。2004,19(3):344 - 344。Smart SC, Skinner WM和Gerson AR, Surf。界面分析,28,101(1999)。
胡B: 2001年,美国威斯康星大学博士学位论文
Druschel GK: 2002,博士论文,威斯康星大学
王志强,李志强,李志强。细胞生物学与生命科学,2004,29(3):344 - 344。
徐勇,徐永平,李志强,等。地球化学与地球化学学报,2004,29(3):366 - 366。
Druschel GK, Hamers RJ, Banfield JF:地球化学宇宙化学学报。
Druschel GK, Hamers RJ, Luther GW,等:未发表
王志强,王志强,王志强,等。环境微生物的研究进展。2003,23 (4):344 - 344 / aem . 64.36 - 343。
刘国强:地球化学与宇宙化学学报,1997,33(3):366 - 366。
王志强,王志强,王志强,王志强。电化学学报,2003,26(3):357 - 357。
王志强,王志强,王志强,等:天体生物学。2001,1:283-10.1089/15311070152757474
王志强,王志强,王志强,王志强:地球化学与宇宙化学学报,2003,23(3):357 - 357。
Kelsall GH:矿物表面。编辑:Vaughan DJ, Patrick RAD。1995,查普曼和霍尔,纽约,219 m。徐永勇,史考宁,史强金,地球化学。探索62,201(1998)。
刘志强,李志强,李志强。地球化学与地球化学学报,2004,26(3):379 - 379。l·托兰和r·f·哈里斯,同前.53,2341(1989)。
印章RR:矿山废物的环境方面。编辑:Jambor JI, Blowes DW, Ritchie AIM。2003,加拿大矿物学协会,渥太华,31:430-
刘志强,李志强,李志强,等。湿法冶金,2004,29(3):357 - 357。
刘志强,王志强,王志强,等。中国微生物学杂志,1997,22(1):1-10。
刘志刚,刘志刚,刘志刚,等:《中国科学》杂志,2000,30(3):344 - 344。达成。微生物学报,10,161(1988)。
Tyson GW, Chapman J, Hugenholtz P, Allen EE, Ram RJ, Richardson PM, Solovyev VV, Rubin EM, Rokhsar DS, Ban-field JF: Nature(伦敦)。2004, 428: 37-10.1038/nature02340。
刘志刚,刘志刚,刘志刚,等:化学与化学学报,2000,29 (3):389 -10.1016/S0009-2541(00)00216-3。
确认
作者要感谢Gene W. Tyson博士、Philip Hugenholtz博士、Ian Lo、Katrina Edwards博士、D. Kirk Nordstrom博士、Mark Williamson博士、George Luther III博士、martin Schoonen博士、Mike Borda博士和Don Dodds博士在这项工作过程中的有益讨论。我们也要感谢Ted Arman(我们)(Iron Mountian Mines Ltd), Joe Cobliatti, Don Dodds和Rick Sugareck博士(EPA)允许进入研究现场。本研究得到了美国国家科学基金会资助号CHE 9521731, CHE 9807598和MCB 9978205,以及劳伦斯伯克利国家实验室的LDRD资助。
作者信息
作者及隶属关系
相应的作者
额外的信息
Gregory K Druschel和Brett J Baker对这项工作做出了同样的贡献。
权利和权限
关于本文
引用本文
杜鲁切尔,g.k.,贝克,b.j.,吉林,T.M.et al。加利福尼亚铁山酸性矿井排水生物地球化学。Geochem反式5, 13(2004)。https://doi.org/10.1186/1467-4866-5-13
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1467-4866-5-13
关键字
- 黄铁矿
- 酸性矿井排水
- 砷黄铁矿
- 黄铁矿氧化
- 硫酸盐矿物