摘要
背景
2型糖尿病(T2DM)的发展受到遗传和环境(饮食和生活方式)因素之间复杂的相互作用的高度影响。虽然维生素C(抗坏血酸,AA)已被建议作为T2DM的补充营养治疗,但迄今为止尚无证据表明AA在T2DM中的意义和有益作用。我们怀疑有关该主题的临床研究可能需要考虑可能影响AA对代谢的影响的遗传和饮食因素的组合。在这项研究中,我们使用具有饮食诱导代谢功能障碍遗传倾向的小鼠模型来验证这一大致观点。特别是,我们利用携带人类同源基因的小鼠GLUT10G128E变体(GLUT10G128E小鼠),它们对高脂肪饮食(HFD)诱导的代谢失调高度敏感。该遗传变异与人群高度相关,因为葡萄糖转运蛋白10 (GLUT10)的遗传多态性与非糖尿病人群中的T2DM中间表型相关。
结果
我们研究了AA补充剂对野生型(WT)小鼠代谢的影响GLUT10G128E喂食正常饮食或高热量饮食的小鼠。总的来说,AA对hfd喂养的代谢的有益影响更大GLUT10G128E与hfd喂养的WT小鼠相比。在出生后早期阶段,AA改善了受损附睾白色脂肪组织(eWAT)的发育GLUT10G128E老鼠。在成年动物中,AA的补充减弱了易感性GLUT10G128E与WT小鼠相比,hfd引发的eWAT炎症、脂肪因子失调、异位脂肪酸积累、代谢失调和体重增加。
结论
综上所述,我们的研究结果表明AA对hfd喂养的代谢有更大的有益影响GLUT10G128E小鼠比hfd喂养的WT小鼠。因此,AA在支持eWAT发育和减弱hfd诱导的代谢失调中起着重要作用GLUT10G128E老鼠。我们的研究结果表明,适当的WAT发育对于晚年的代谢调节至关重要。此外,在考虑使用AA作为预防和治疗2型糖尿病的补充营养时,应考虑到遗传和饮食模式的个体差异。
背景
2型糖尿病(T2DM)是世界范围内的主要医学问题,其发展受到遗传和环境(饮食和生活方式)因素之间复杂相互作用的高度影响[1].虽然在人群研究中遗传因素与2型糖尿病相关[2],所识别的变量的效应量通常非常小。除了边际效应外,许多遗传因素被认为会通过环境因素改变易感性[3.],例如高脂肪饮食(HFD)会加速T2DM的发展。因此,更好地了解基因和环境的相互作用,对于改善疾病易感性和进展的评估,以及预防和治疗策略都是重要的。然而,确定基因与环境之间的特定相互作用仍然是一个主要挑战[4].
抗氧化剂,如维生素C(抗坏血酸,AA),已被提出至少部分通过减弱白色脂肪组织(WAT)炎症来预防2型糖尿病[5].WAT通过储存脂质和分泌脂肪因子积极调节全身能量稳态[6], hfd诱导的肥胖通常与WAT脂肪沉积增加、WAT炎症诱导、脂肪因子调节异常、异位脂肪堆积,最终导致T2DM [7].然而,迄今为止,研究AA对T2DM影响的临床试验尚无定论[8,9].我们怀疑AA对代谢的有益作用可能受到遗传和环境因素的共同影响。各种遗传危险因素组合与特定饮食或生活方式特征之间的复杂相互作用,使得AA对T2DM影响的临床研究难以设计。因此,我们使用小鼠模型来解决这个问题,该模型在遗传上易于引起hfd诱导的代谢失调。通过这些小鼠,我们试图确定AA对代谢的影响是否可能由特定的遗传变异和饮食共同调节。
我们之前已经证明过了GLUT10G128E小鼠对hfd诱导的T2DM高度敏感[10].葡萄糖转运体10 (GLUT10)基因功能缺失突变(SLC2A10)导致一种罕见的常染色体隐性结缔组织疾病,称为动脉弯曲综合征(ATS;奥米姆208,050)[11].我们和其他人证明了GLUT10运输AA(脱氢抗坏血酸,DHA)的氧化形式,并调节成纤维细胞、主动脉平滑肌细胞(ASMCs)和GLUT10高表达的脂肪细胞中的细胞内AA状态[10,12,13,14,15].有趣的是,染色体周围的区域SLC2A10在兄弟姐妹对研究中,基因座与T2DM相关[16,17];然而,与2型糖尿病相关的基因并未直接在全基因组关联研究(10,18,19,20.,21,22,23].沿着这些思路,我们演示了SLC2A10在非糖尿病人群中,基因座与T2DM中间表型相关[10].我们还研究了GLUT10遗传变异对代谢的影响,使用小鼠模型携带一种罕见的人类遗传变异SLC2A10(GLUT10G128E老鼠);研究显示,GLUT10G128E与WT小鼠相比,小鼠WAT发育受损,对hfd诱导的肥胖和代谢失调高度敏感[10].由于GLUT10缺乏会损害维持AA内稳态的能力,但小鼠可内源性合成AA [24,我们怀疑GLUT10G128E当喂食高热量食物时,小鼠可能需要补充AA来维持正常的生理功能和代谢。
为了测试AA对代谢的影响是否可能受到遗传和环境因素的联合影响,我们确定了AA补充剂是否可能对野生型(WT)小鼠的代谢产生差异GLUT10G128E以正常饮食(CD)或高热量饮食喂养的小鼠。我们发现,AA补充剂对代谢的影响取决于遗传变异和饮食。因此,我们的研究为AA在T2DM预防中的作用的临床研究应考虑饮食和特定遗传变异之间的相互作用这一观点提供了强有力的支持。
结果
AA补充剂可减轻hfd诱导的代谢失调GLUT10G128E老鼠
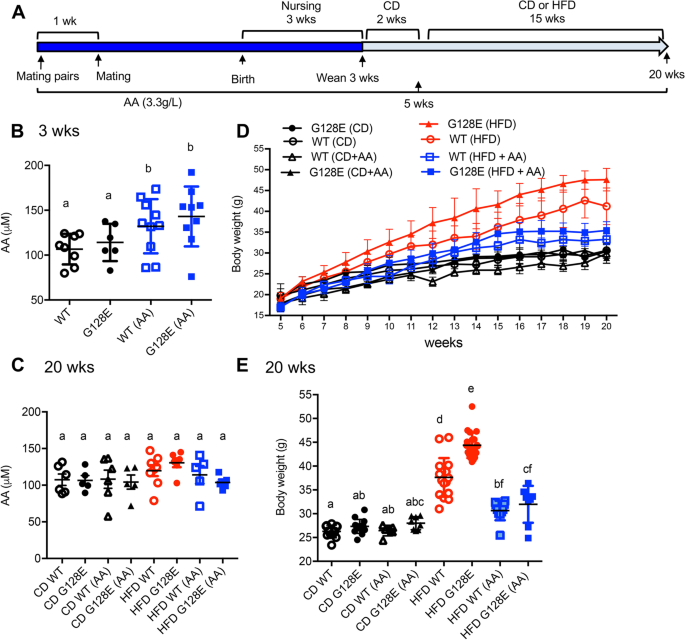
评价添加AA对野生大鼠和野生大鼠代谢的影响GLUT10G128E饲喂CD或HFD小鼠时,我们开始为繁殖对、哺乳期母鼠和断奶后的小鼠补充饮用水(3.3 g/L AA)。这种补充AA的方案先前被证明可以在AA合成缺陷小鼠中维持最佳的生理AA水平(血清中75 μm) [25].然后,5周龄的雄性小鼠被放置在CD或HFD上。1),我们首先分析了AA补充对血清WT AA含量的影响GLUT10G128E3周龄和20周龄的小鼠。我们发现,怀孕和哺乳期雌性小鼠补充AA后,WT和哺乳期雌性小鼠血清AA水平均显著升高GLUT10G128E3周龄的幼崽(图;1B),即使老鼠可以从头合成AA [26].相反,在20周龄时,不同基因型或饮食组的血清AA水平没有观察到显著差异,尽管继续补充AA(图2)。1C).由此可见,在繁殖对和哺乳期雌性小鼠的饮水中添加AA可提高子代血清AA水平,但断奶小鼠添加AA后,WT和哺乳期雌性小鼠的血清AA水平均未进一步提高GLUT10G128E老鼠。
补充抗坏血酸(AA)可以减少hfd引起的体重增加。一个实验的概述。GLUT10G128E或WT交配对、怀孕母鼠、哺乳期母鼠和断奶小鼠均给予添加或不添加AA (3.3 g/L)的饮用水。断奶小鼠先用正常饮食(CD)喂养2周,然后在5 - 20周龄时被分配到正常饮食或高热量饮食组。B而且CAA补充剂增加了3周龄小鼠的血清AA水平。在3周龄时测定血清AA水平(B)及20周龄(C)使用抗坏血酸检测试剂盒。D而且E补充AA可以减少WT和GLUT10G128E老鼠。D在指定年龄测定体重;n每组20只。E20周龄禁食体重。数据以均数±标准差表示。采用单因素方差分析(ANOVA)及Tukey多重比较检验确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
然后,我们比较了AA对CD或hfd喂养的WT和大鼠体重和代谢相关参数的影响GLUT10G128E老鼠。GLUT10G128E食用HFD的小鼠比食用WT的小鼠增重更多(图2)。1D和E) [10].AA有效地降低了hfd诱导的WT小鼠体重增加(图2)。1D和E),补充更容易防止hfd引起的体重增加GLUT10G128E与WT小鼠相比(图;1AA对WT小鼠和E小鼠的体重均无影响GLUT10G128E小鼠乳糜泻(图;1值得注意的是,在任何一种基因型的HFD小鼠中,补充AA对食物摄入量、体力活动(步行和休息时间)或能量消耗(VO2、VCO2、RER和产热)均没有显著影响(图S . 2)1).
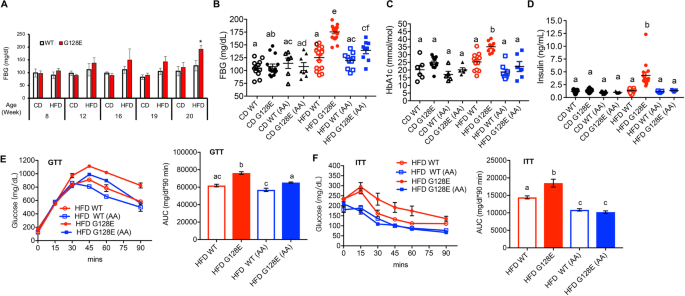
然后,我们分析了AA对CD或hfd喂养的WT代谢结果的影响GLUT10G128E老鼠。我们首先监测高热量饮食后小鼠空腹血糖(FBG)水平的变化。hfd喂养组FBG水平显著升高GLUT10G128E在喂食hfd 15周(20周龄)后,对照组小鼠的免疫功能显著高于对照组。2因此,我们通过测量CD喂养或hfd喂养的WT和大鼠20周龄时的代谢参数来分析补充AA对代谢的影响GLUT10G128E老鼠。读数包括空腹血糖水平、糖化血红蛋白水平(糖化血红蛋白水平,每日平均血糖水平的指标)。27),以及胰岛素水平。在这个时间点,hfd喂养组FBG水平、HbA1c水平和胰岛素水平显著升高GLUT10G128E与hfd喂养的WT小鼠相比(图;2B, C, D)[答案解析]10],并且补充AA减弱了hfd诱导的FBG、HbA1c和胰岛素水平的升高GLUT10G128E老鼠(图。2此外,AA显著改善hfd诱导的葡萄糖耐受不良和胰岛素抵抗GLUT10G128E分别通过葡萄糖耐量试验(GTT)和胰岛素抵抗试验(ITT)进行测量(图。2虽然AA对hfd喂养的WT小鼠的FBG、HbA1c或胰岛素水平没有显著影响,但补充AA确实显著改善了hfd喂养的WT小鼠的胰岛素抵抗(图。2F).尽管如此,HFD-fed的改善GLUT10G128E与hfd喂养的WT相比,小鼠的改善更为显著。2F).综上所述,这些结果表明,AA补充剂对减弱hfd诱导的代谢失调的易感性有特别明显的效果GLUT10G128E老鼠。
AA补充剂挽救hfd诱导的代谢失调GLUT10G128E老鼠。对小鼠进行如图所示的处理。1一个。一个高果糖饲料显著提高了大鼠的空腹血糖水平GLUT10G128E20周龄的小鼠。在指定的时间点测定CD和hfd喂养的WT和FBG水平GLUT10G128E老鼠。数据以均数±标准差表示。统计学意义由双尾学生来确定t以及。*P< 0.05。B- - - - - -D补充AA可改善hfd喂养的代谢相关读数GLUT10G128E老鼠。数据采集于喂食结束时(20周龄)的小鼠。B空腹血糖,C空腹糖化血红蛋白水平,以及D空腹胰岛素水平。E而且F添加AA对改善hfd喂养的葡萄糖耐量和胰岛素敏感性的效果更为显著GLUT10G128E老鼠。E对16周龄小鼠进行葡萄糖耐量试验(GTT)F对18周龄动物进行胰岛素耐量试验(ITT)。右边的面板E而且F分别为GTT和ITT曲线下面积(AUC)。使用GraphPad Prism 7软件计算AUC。n每组4只。B-F数据以均数±标准差表示。采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验(multiple comparison)确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
补充AA可减少hfd诱导的eWAT炎症,改善脂肪因子失调GLUT10G128E老鼠
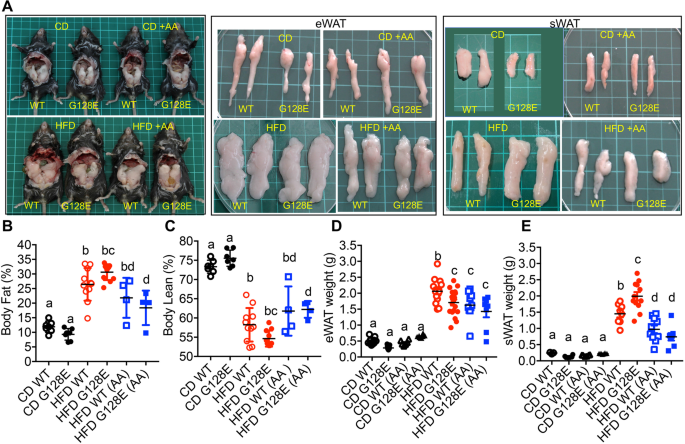
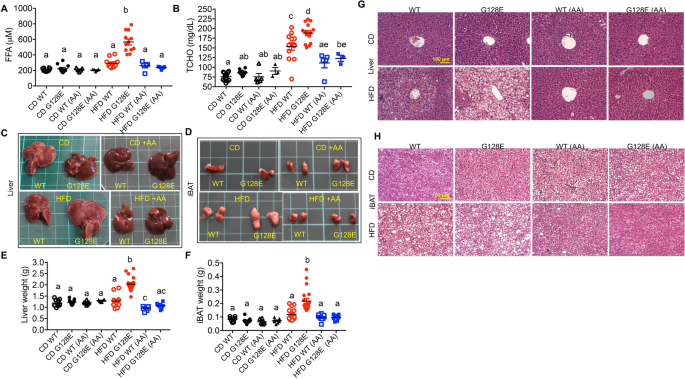
然后,我们试图阐明AA如何优先改善hfd诱导的代谢失调GLUT10G128E老鼠。首先,我们确定了补充AA对野生型和野生型大鼠整体脂肪和瘦肉成分的影响GLUT10G128E老鼠在HFD上。AA组在hfd喂养的WT小鼠中有降低体脂组成的趋势,但差异没有达到统计学意义(图2)。3.相比之下,AA的添加显著降低了hfd喂养的体脂组成GLUT10G128E老鼠(图。3.A和B)。此外,高热量膳食降低了WT和GLUT10G128E但AA只显著减弱了hfd喂养小鼠体瘦成分的减少GLUT10G128E老鼠(图。3.因此,我们分析了AA对CD或hfd喂养的WT的两大脂肪垫,附睾WAT (eWAT)和腹股沟皮下WAT (sWAT)的影响GLUT10G128E老鼠。AA对cd饲养WT的eWATs重量无影响GLUT10G128E老鼠。添加AA降低了hfd喂养WT小鼠的eWATs重量,但hfd喂养小鼠没有降低eWATs重量GLUT10G128E老鼠(图。3.D).值得注意的是,在hfd喂养下sWAT的重量大幅增加GLUT10G128E与hfd喂养的WT小鼠相比,AA的添加对降低sWAT小鼠体重的效果更明显GLUT10G128E与WT小鼠相比。
补充AA可降低hfd喂养小鼠的体脂组成和WAT重量。对小鼠进行如图所示的处理。1A.数据采集于喂食结束时(20周龄)的小鼠。一个实验小鼠的代表性照片,eWAT和sWAT。绿垫上的每一方格为1厘米× 1厘米。B体脂和C身体瘦身成分。DeWAT权重和E斯瓦特的重量。数据以均数±标准差表示。采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验(multiple comparison)确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
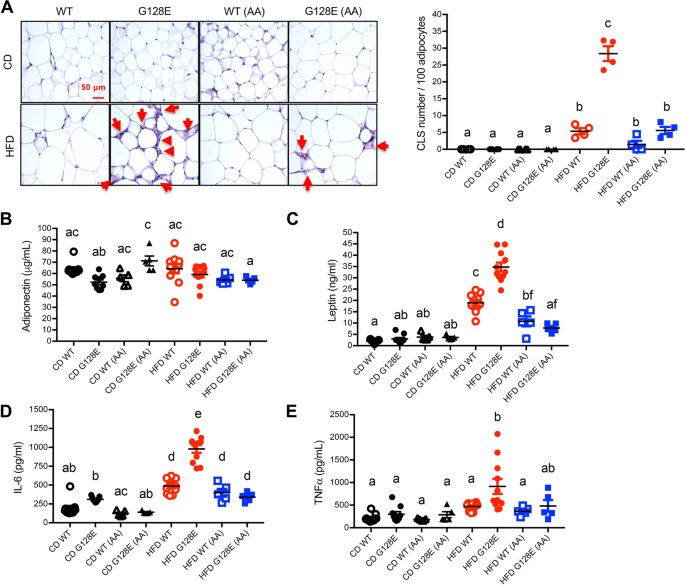
我们已经表明,HFD喂养专门诱发炎症和纤维化eWAT(一种内脏脂肪)GLUT10G128E但HFD在sWAT小鼠中未诱导类似反应GLUT10G128E或WT小鼠的eWAT和sWAT(图S2) [10],尽管sWAT的重量在hfd喂养中显著增加GLUT10G128E老鼠。由于中枢性肥胖(内脏脂肪过度积聚)与局部和全身炎症有关,并容易使个人代谢失调[6,28],因此,我们分析了AA对hfd喂养WT和wat的影响GLUT10G128E老鼠。为了评估AA补充剂对WAT中hfd诱导的炎症的影响,我们首先检测了死亡脂肪细胞周围的冠状结构(CLSs),这表明WAT中存在炎症[29].在cd喂养的小鼠中未观察到CLSs,而在hfd喂养的eWAT中更频繁地发现CLSsGLUT10G128E与hfd喂养的WT小鼠相比(图;4A). AA的补充减少了hfd诱导的CLSs在eWAT内的增加GLUT10G128E老鼠(图。4A).相比之下,无论是hfd喂养的WT还是hfd喂养的sWAT均未观察到CLSsGLUT10G128E小鼠(图S2).此外,添加AA对hfd喂养的WT小鼠和hfd喂养的WT小鼠sWAT脂肪细胞的大小和结构没有影响GLUT10G128E小鼠(图S2).因此,我们得出结论,AA补充剂对减轻hfd诱导的炎症有显著作用GLUT10G128EeWATs。
补充AA可减少hfd诱导的eWAT炎症,改善脂肪因子失调GLUT10G128E老鼠。对小鼠进行如图所示的处理。1A.数据采集于喂食结束时(20周龄)的小鼠。一个AA的添加减少了hfd喂养的eWAT中的冠状结构(CLSs)GLUT10G128E老鼠。CLSs是eWAT炎症的标志。eat切片采用H&E染色。所示为代表图像,红色箭头指向推定的脂肪细胞周围的CLSs(左图)。利用ImageJ分析eWAT切片中cls的频率[54],并以每100个脂肪细胞的CLS数表示(右图);n每组4只。B- - - - - -E补充AA可改善hfd诱导的脂肪因子失调GLUT10G128E老鼠。血清中B脂联素,C瘦素,Dil - 6,ETNFα测定。数据以均数±标准差表示。采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验(multiple comparison)确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
eWAT炎症可改变脂肪因子的表达,使个体易患代谢失调[6,28].因此,我们确定了AA对CD和hfd喂养的WT全身脂肪因子水平的影响GLUT10G128E通过分析血清中控制全身能量稳态的脂肪因子水平,包括脂联素、瘦素、白细胞介素-6 (IL-6)和肿瘤坏死因子-α (TNF-α);这些脂肪因子在hfd喂养的eWAT中被高度失调GLUT10G128E老鼠(10].值得注意的是,补充AA只增加了脂联素的血清水平,脂联素是cd喂养中的一种保护性脂肪因子GLUT10G128E老鼠(图。4B).相反,AA对hfd喂养的血清脂联素水平没有影响GLUT10G128E或在CD和hfd喂养的WT小鼠中(图。4B). AA的添加显著抑制了升高的血清瘦素水平,这是一种与体脂肪组成相关的细胞因子,并且这种抑制在hfd喂养中表现得更高GLUT10G128E与hfd喂养的WT小鼠相比(图;4C).最重要的是,添加AA显著抑制了血清中炎症细胞因子IL-6的水平,而hfd喂养时IL-6水平高度升高GLUT10G128E老鼠(图。4D)。此外,AA补充剂对hfd喂养的血清TNF-α水平(另一种炎症因子)升高有不显著的抑制趋势GLUT10G128E老鼠(图。4E)。相反,在CD-或hfd -喂养的WT小鼠中,AA补充不影响血清IL-6和TNF-α水平(图。4D和E)。
总之,这些发现使我们得出结论,补充AA抵消了易感GLUT10G128E小鼠hfd诱导的eWAT炎症和脂肪因子失调。
补充AA可减少hfd诱导的异位脂质堆积GLUT10G128E老鼠
eWAT炎症和脂肪因子失调可导致血清游离脂肪酸(FFA)和总胆固醇(TCHO)水平升高,导致其他器官的脂质沉积,包括肝脏和肩胛间棕色脂肪组织(iBAT) [30.,31,32].我们已经证明了HFD-fedGLUT10G128E小鼠血清FFA和TCHO水平升高,肝脏和iBAT中脂质积累增加,表现为组织体积和重量增加,组织切片中脂肪液泡出现频率增加[10].因此,我们开始确定补充AA对hfd诱导的异位脂质堆积的影响GLUT10G128E通过测试这些参数。值得注意的是,添加AA降低了hfd诱导的血清FFA和TCHO水平GLUT10G128E老鼠(图。5此外,添加AA降低了hfd喂养的肝脏和iBAT的大小和组织重量以及这些组织中脂肪液泡的外观GLUT10G128E老鼠(图。5碳氢键)。相比之下,AA对hfd喂养的WT小鼠血清FFA水平、肝脏和iBAT的大小和组织重量以及这些组织中脂肪液泡的外观没有显著影响(图2)。5a)。因此,我们得出结论,补充AA可以防止hfd诱导的异位脂质积聚GLUT10G128E老鼠。
补充AA可减少hfd诱导的异位脂质堆积GLUT10G128E老鼠。对小鼠进行如图所示的处理。1A.数据采集于喂食结束时(20周龄)的小鼠。一个- - - - - -BAA补充剂可降低hfd诱导的游离脂肪酸(FFA)水平和总胆固醇(TCHO)水平GLUT10G128E老鼠。一个FFA水平和B测定血清TCHO水平。C- - - - - -H补充AA可挽救hfd诱导的肝脏和iBAT异位脂质积聚。代表照片C肝脏和D来自实验小鼠的iBAT。绿垫上的每一方格为1厘米× 1厘米。E肝脏重量。FiBAT权重。H&E染色G肝脏切片及HiBAT部分。数据以均数±标准差表示。采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验(multiple comparison)确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
补充AA可以改善eat的发育GLUT10G128E老鼠
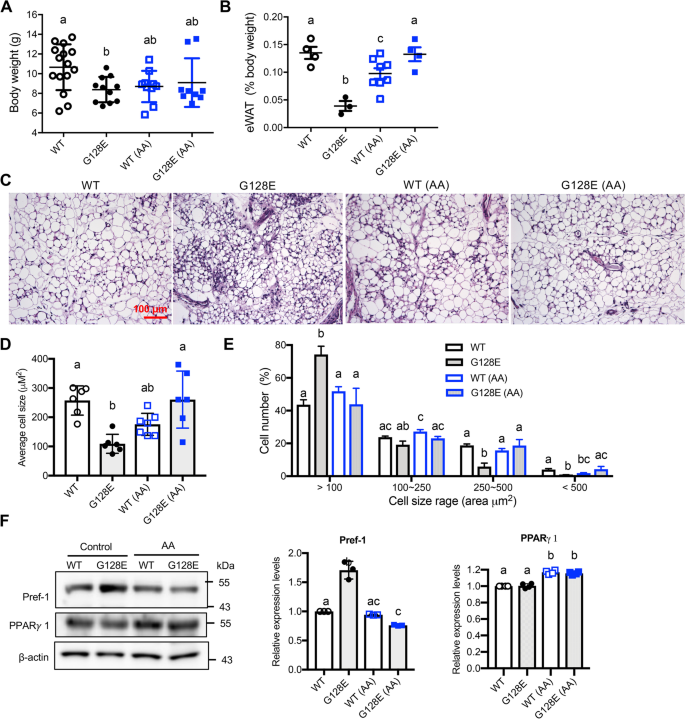
接下来,我们试图确定AA如何减少hfd诱导的eWAT炎症并改善随后的代谢失调GLUT10G128E老鼠。作为GLUT10G128Emice have compromised eWAT development, which plays a critical role in predisposing the mice to HFD-induced metabolic dysregulation [10,我们决定测试AA补充剂是否可以改善受损的eWAT发育GLUT10G128E老鼠。eWAT沉积发生于胚胎晚期和新生儿发育期间[33].我们通过监测3周龄时eWAT的体重和组织学发现aa介导的早期eWAT发育的改善。在怀孕和哺乳期的雌性小鼠中补充AA对WT和哺乳期雌性小鼠的体重均无影响GLUT10G128E幼崽(无花果。6值得注意的是,AA的补充逆转了eWAT体重的下降GLUT10G128E幼崽(无花果。6B).此外,补充AA还逆转了小鼠平均脂肪细胞大小的减少GLUT10G128EeWAT通过降低小脂肪细胞(< 100 μm)的百分比2),增加大脂肪细胞(> 250 μm)的百分比2),根据eWAT切片中脂肪细胞大小的定量(图;6一部)。相比之下,补充AA不影响eWAT的重量,也不影响WT小鼠eWAT中脂肪细胞的平均大小或大小范围(图2)。6抵扣)。因此,补充AA扭转了体重减轻和脂肪细胞大小减少的eWATGLUT10G128E幼崽。
补充AA可以改善eat的发育GLUT10G128E老鼠。对小鼠进行如图所示的处理。1A.数据收集自3周龄的幼崽。一个而且B补充AA可增加小鼠eWAT体重的百分比GLUT10G128E老鼠。一个体重和B测量了体重占总体重的百分比。C- - - - - -E补充AA可增加小鼠eWAT中脂肪细胞的大小GLUT10G128E老鼠。CeWAT切片苏木精和伊红(H&E)染色的代表照片。eWAT中脂肪细胞的横截面积表示为D单元格的平均大小和E给定大小范围内的单元格百分比。在D而且E,n每组= 6只;在每只小鼠中分析了超过1000个脂肪细胞。F补充AA可降低小鼠eWAT中Pref-1蛋白水平GLUT10G128E老鼠。Western blotting检测eWAT中Pref-1和PPARγ 1蛋白水平。每组6只小鼠的蛋白质样本汇总。蛋白质水平被量化,归一化至β-肌动蛋白水平,并与WT no- aa处理的对照组进行比较。数据显示为汇集样本的三次重复Western blotting实验的平均值±SEM。采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验(multiple comparison)确定统计学意义。紧凑的字母显示表明在两两比较中有显著差异;不同字母的组有显著差异
接下来,我们研究了脂肪生成的增加是否也参与aa介导的eWATs体重减轻的逆转GLUT10G128E幼崽。在之前的研究中,发现在培养细胞中添加AA可以不同程度地诱导glut10缺乏的脂肪生成并控制前脂肪细胞[10].特别是,与对照组(包括小鼠胚胎成纤维细胞(mef))相比,发现补充AA对glut10缺陷前脂肪细胞的脂肪生成有更明显的影响GLUT10G128E以及glut10敲除前脂肪细胞(3T3-L1细胞)[10].然后,我们通过检测WT和eWATs中前脂肪细胞标记物前脂肪细胞因子1 (Pref-1)和关键的脂肪生成转录因子过氧化物酶体增殖物激活受体γ 1 (PPARγ 1)的表达,确定了AA在体内对脂肪生成的影响GLUT10G128E3周龄的小鼠。Pref-1在前脂肪细胞中高表达,脂肪细胞分化后不表达[34].GLUT10G128EeWATs的Pref-1蛋白水平高于WT eWATs, AA的添加降低了eWATs中Pref-1蛋白水平GLUT10G128EeWATs(无花果。6F).这些结果表明,更多的前脂肪细胞存在GLUT10G128EeWATs比WT eWATs低,AA的添加减少了前脂肪细胞GLUT10G128EeWATs。此外,AA的添加增加了GLUT10 eWATs中PPARγ - 1的表达水平G128E小鼠和WT小鼠。这些体内研究结果以及之前的体外研究结果使我们得出结论,就促进脂肪生成和减少eWATs中未分化的前脂肪细胞而言,AA补充剂具有更有益的效果GLUT10G128E与WT小鼠eWATs相比。
讨论
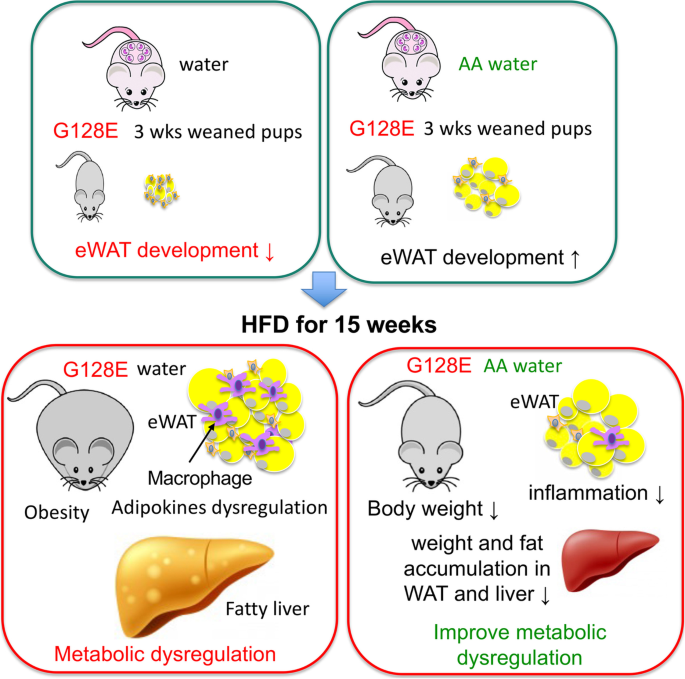
2型糖尿病的发展涉及遗传和环境因素的相互作用,习惯饮食模式的转变(如转向高热量饮食)极大地促进了肥胖患病率的增加,并加速了2型糖尿病在全球范围内的蔓延。至少部分基于其抗氧化特性,AA被认为是2型糖尿病的补充营养治疗。然而,到目前为止,AA在T2DM中的意义和有益作用的证据尚不确定[8,9].我们怀疑这种不确定证据的一个原因是遗传和饮食因素可能会极大地影响AA对代谢的影响。为了验证这一想法,我们在遗传和饮食风险因素结合的情况下评估了AA补充剂对代谢的影响,即小鼠携带同源人GLUT10G128E变型和HFD加料。我们选择这个组合是因为在非糖尿病人群中GLUT10基因的遗传多态性与T2DM中间表型相关GLUT10G128E小鼠对hfd诱导的代谢失调高度敏感[10].我们的实验证明AA更有益于GLUT10G128E在减轻hfd引起的肥胖和代谢失调方面,保护机制部分是通过aa介导的改善受损的eWAT发展GLUT10G128E这减少了后来hfd诱导的eWAT炎症和代谢失调GLUT10G128E老鼠(图。7).总之,我们的研究结果支持这样的观点,即在考虑AA用于T2DM的预防和治疗时,应考虑个体基因变异和饮食模式。我们的研究还表明,年轻时适当的WAT发育对晚年的代谢调节至关重要。此外,较高的全身AA水平可能促进WAT的正常发展,并保护具有其他危险因素的个体免受hfd诱导的代谢失调,因为许多遗传变异和环境因素都可能损害AA状态[35,36].在这些人群中,较高水平的AA摄入量可能有利于维持代谢稳态。
我们发现,添加AA显著提高了3周龄(断奶前)幼崽的血清AA水平。然而,我们没有观察到20周龄小鼠血清AA水平显著增加,即使继续补充AA(图。1).像大多数哺乳动物一样,小鼠可以在肝脏中合成AA [24].动物在胚胎期开始合成AA,大约在妊娠中期。然而,胎儿和幼龄动物(断奶前)的AA合成能力仍然相对较低,AA合成的主要增加发生在断奶前后[37,38,39].由于AA对妊娠后期胎儿和出生早期的快速生长发育至关重要,母体AA通过乳汁将高水平的AA转移给胎儿和幼崽,以满足AA的需求[39].基于这一时间轴,我们预计我们在3周龄小鼠中观察到的血清AA水平的增加可能主要是由于大坝的贡献。成年小鼠合成AA的能力相对较高[40],而且这些动物可能还具有在成年阶段掩盖AA补充效果的稳态机制。然而,成年小鼠AA内稳态的具体机制尚不清楚。有趣的是,哺乳期雌性补充AA已被证明对幼龄动物的发育有益,尽管母鼠和幼崽体内都有内源性的AA合成[39].结合这些先前的研究和我们的发现,孕妇和哺乳期女性在需要高水平AA的情况下,补充AA似乎有助于胎儿和产后的快速生长。
我们发现AA补充剂对hfd诱导的肥胖和代谢失调有不同的影响GLUT10G128E老鼠。在不同的肥胖模型中,AA减少肥胖和改善代谢失调的机制可能是复杂的。孕妇和哺乳期女性补充AA显著增加血清AA水平,改善eWATs的发展GLUT10G128E幼崽(无花果。1而且6).WAT通过储存脂质和分泌脂肪因子积极调节全身能量稳态[6],先天性脂肪营养不良(WAT发育受损)可导致代谢综合征的几乎所有特征[41,42].因此,aa介导的改善损害WAT的发展GLUT10G128E幼崽可能对hfd诱导的代谢失调的后期衰减负有很大责任GLUT10G128E老鼠。因此,这些结果强调了适当的WAT发展对终身代谢调节的重要性。
已经提出了几种将AA与减少肥胖联系起来的机制,并在不同的肥胖啮齿动物模型中提出了代谢失调。在自助饮食诱导的肥胖大鼠中,AA补充剂已被证明可以对抗肥胖和代谢综合征[43]、肥胖老鼠(ob / ob老鼠)[44],以及去卵巢大鼠[45],而不会影响食物的摄入量。据推测,AA的作用可能部分是通过抗氧化和抗炎特性来实现的[46,47,48,49].此外,来自培养细胞的证据表明AA参与调节细胞内脂肪积累[45,50].由于在我们的hfd喂养的WT小鼠中没有观察到明显的炎症迹象,AA减少脂质积累可能是其能够降低hfd喂养的WT小鼠体重和体脂的关键原因。除了改善妥协WAT的发展GLUT10G128E在hfd喂养的幼崽中,抗氧化和抗炎活性可能参与aa介导的脂质积累的减少,从而产生减少肥胖和改善代谢失调的最终结果GLUT10G128E老鼠。
AA也是许多重要生物功能所必需的酶辅因子[51].在这种能力下,AA调节DNA去甲基化、组蛋白去甲基化以及胶原蛋白和肉碱的合成[51,52].We have demonstrated that AA supplementation induces adipogenesis through increasing DNA demethylation in the regulatory regions of two central adipogenesis-regulating transcription factors,Cebpa而且Pparg,增加他们的表达式(10].以上结果提示,添加AA可促进脂肪生成,从而改善小鼠的发育GLUT10G128EeWATs通过DNA去甲基化。AA的其他功能是否也可能影响高热量fd喂养背景下的脂肪功能和代谢仍有待研究。
在这项工作中,我们利用GLUT10G128E老鼠携带一个同源的人GLUT10G128EGLUT10功能受损的变体。在CD饮食下,这些小鼠的血清糖化血红蛋白水平升高,并且在遗传上易于发生hfd诱导的代谢失调。同样,编码glut10的人类基因(SLC2A10)位点与非糖尿病人群血清糖化血红蛋白水平升高相关[10].此外,脂肪生成不仅减少GLUT10G128Emef也存在于glut10敲除3T3-L1细胞中[10].鉴于有超过700种已确认的罕见变异SLC2A10基因,我们的研究结果表明,其他的变异SLC2A10与GLUT10表达或功能受损相关,可能也会对eWAT的发育产生负面影响,AA可能会减弱hfd诱导的这些变异携带者的代谢失调。
结论
总的来说,我们在本研究中的发现证明了AA在存在或不存在遗传和环境t2dm危险因素的情况下对代谢有不同的影响。我们预计这些结果将促进更复杂的人群研究,以准确评估AA是否是易感人群T2DM的适当治疗或预防药物。
方法
老鼠
所有动物议定书均由中央研究院机构动物保育及利用委员会批准(议定书编号:;14-12-795)。GLUT10G128E小鼠在C3HeB/FeJ背景下生成[53],并回交叉到C57BL/6 J背景,如前所述[13].WT和GLUT10G128E本研究中的小鼠以C57BL/ 6j为背景,通过杂合mattings维持。小鼠被安置在特定的无病原体控制环境中,光照周期为14小时,暗周期为10小时,温度为21-23°C。AA补充组在饮用水中添加AA (3.3 g/L)和0.01 mM EDTA,每周更换一次。如前所述,采用高效液相色谱法测定水中AA的含量,以检验饮用水中AA的稳定性[15].配制好水后,连续7天每天测量该水平。在监测期间,水中AA的含量没有变化,说明在该条件下AA是稳定的。在繁殖对、怀孕母鹿、哺乳母鹿和断奶后添加AA。对于饮食治疗,在断奶后,小鼠被喂食CD 2周,然后在5至15周龄期间被放置CD或高热量饮食(图2)。1A).标准啮齿动物饲粮(CD)含有13%的脂肪能量(LabDiet 5010啮齿动物饲粮,PMI营养国际公司,Brentwood, MO, USA),而HFD含有60%的脂肪能量(58Y1, Young Li贸易公司,新北市,台湾)。这项研究使用的是雄性小鼠。分析中不排除任何数据。
葡萄糖和胰岛素耐量试验(GTT和ITT)
为了测量空腹血糖,空腹一晚后从尾静脉采集血液样本。GTT和ITT的执行如前所述[10].简单地说,在16周龄的小鼠中分析GTT,小鼠禁食18小时后腹腔注射葡萄糖(2 g/kg)。ITT在18周龄的小鼠身上进行;小鼠禁食8小时,随后腹腔注射胰岛素(0.75 U/kg, Humulin R U100, Lilly, Eli and Company, Indianapolis, IN, USA)。在注射前和注射后15、30、45、60、75和90 min分别从尾静脉采集血液样本。使用血糖仪(Accu-Chek Performa,罗氏医疗诊断设备有限公司,台湾)评估血糖水平。
测量食物摄入量和代谢率
使用Tecniplast®代谢笼(Tecniplast, Via I Maggio,意大利)将小鼠单独安置以测量食物摄入量和水摄入量。代谢率在中央研究院台湾小鼠诊所使用CLAMS-home cage (CLAMS-HC)系统(Columbus Instruments, Columbus, OH, USA)测量。在48小时的驯化期后进行第一次读数。测定了产热率、RER、耗氧率(VO2)和二氧化碳产量(VCO2)。在指定温度下,在76小时内每17分钟测量一次VO2、VCO2和热量,并将其归一化至体重。
血液化学和脂肪因子测定
血液化学和脂肪因子测定,在实验结束时采集心脏穿刺的血液。在中央研究院台湾小鼠诊所,使用富士生化载片和富士drii - chem 4000i分析仪(Fujifilm Cooperation, Taipei, Taiwan)分析血清样本中的TCHO水平。使用小鼠ELISA试剂盒检测血浆脂联素、瘦素、IL-6和胰岛素水平(默克Millipore,台北,台湾)。使用ELISA试剂盒(ab65341, Abcam, Cambridge, MA, USA)测量血浆游离脂肪酸,使用小鼠血红蛋白A1c (HbA1c)检测试剂盒(Crystal Chem, Elk Grove Village, IL, USA)测量血液HbA1c。
血清AA测定
使用抗坏血酸检测试剂盒(Abcam, Cambridge, England, UK)测定血清AA水平。
组织学分析和免疫组化
组织切片用苏木精和伊红染色(H&E)。
免疫印迹
组织总蛋白裂解物用于分析。蛋白质转移到PVDF膜(Millipore, Billerica, MA)。然后将膜与抗Pref-1 (DLK1)的一抗(Proteintech, Rosemont, IL)、PPARγ 1 (Santa Cruz, Dallas, TX)或β-actin (GeneTex, Irvine, CA)和适当的二抗一起孵育。信号通过增强化学发光检测(Millipore Merck,台北,台湾)。
身体成分
小鼠体成分在中央研究院台湾小鼠诊所使用Bruker公司的Minispec LF50体成分分析仪进行分析。
统计数据
在GraphPad Prism 7 (GraphPad Software, La Jolla, CA, USA)中进行统计分析。数据以均数±均数标准误差(SEM)表示。采用单因素方差分析(ANOVA)及Tukey多重比较检验确定统计学意义。一个紧凑的字母显示被用来表明显著差异的两两比较。P-值小于0.05被认为有统计学意义。
缩写
- 2型糖尿病:
-
2型糖尿病
- AA:
-
抗坏血酸,维生素C
- 美国胸科协会:
-
动脉弯曲综合征
- GLUT10:
-
葡萄糖转运体10
- CD:
-
控制饮食
- HFD:
-
高脂肪饮食
- WT:
-
野生型
- 窟:
-
白色脂肪组织
- eWAT:
-
附睾白色脂肪组织
- 斯瓦特:
-
腹股沟皮下WAT
- iBAT:
-
肩胛间棕色脂肪组织
- 光纤光栅:
-
空腹血糖
- FFA:
-
游离脂肪酸
- TCHO:
-
总胆固醇
参考文献
糖尿病的全球化:饮食、生活方式和基因的作用。糖尿病护理。2011;34(6):1249-57。
弗兰尼克J,弗洛雷斯JC。2型糖尿病:基因数据共享促进复杂疾病研究。植物学报,2016;17(9):535-49。
DeFronzo RA, Ferrannini E, Groop L, Henry RR, Herman WH, Holst JJ, Hu FB, Kahn CR, Raz I, Shulman GI,等。2型糖尿病。Nat Rev Dis primer . 2015;1:15 19。
McAllister K, Mechanic LE, Amos C, Aschard H, Blair IA, Chatterjee N, Conti D, Gauderman WJ, Hsu L, Hutter CM,等。复杂疾病基因-环境相互作用研究的当前挑战和新机遇。中华流行病学杂志,2017;186(7):753-61。
波拉克RM, Donath MY, LeRoith D, Leibowitz g抗炎药在治疗糖尿病及其血管并发症。糖尿病护理。2016;39(增刊2):S244-252。
崔ss,许志勇,黄仁杰,金智,金杰比。脂肪组织重塑:其在能量代谢和代谢紊乱中的作用。前内分泌(洛桑)。2016; 7。
Kloting N, Bluher M.脂肪细胞功能障碍,炎症和代谢综合征。中国生物医学工程学报。2014;15(4):277-87。
Tareke AA, Hadgu AA。补充维生素C对2型糖尿病患者血脂的影响:临床试验的系统回顾和荟萃分析中华糖尿病杂志,2021;13(1):24。
黄雪芹,陈琪,伊玛-尼瓦娜。维生素C在代谢综合征管理中的作用综述。中华医学杂志2020;17(11):1625-38。
蒋春林,任伟平,曹春春,张立龙,陈超,李玉春。葡萄糖转运蛋白10通过抗坏血酸介导的途径调节脂肪形成,保护小鼠免受饮食诱导的代谢失调。PLoS Genet, 2020;16(5):e1008823。
Coucke PJ, Willaert A, Wessels MW, Callewaert B, Zoppi N, De Backer J, Fox JE, Mancini GM, Kambouris M, Gardella R,等。促进葡萄糖转运蛋白GLUT10的突变改变血管生成并引起动脉弯曲综合征。王志刚。2006;38(4):452-7。
Nemeth CE, Nemoda Z, Low P, Szabo P, Horvath EZ, Willaert A, Boel A, Callewaert BL, Coucke PJ, Colombi M,等。动脉弯曲综合征患者成纤维细胞核抗坏血酸积累减少,基因组甲基化模式改变。中国生物医学工程学报。2019;2019:8156592。
徐耀文,赖宏伟,蒋春林,蔡海燕,林成昌,李玉春。GLUT10通过调节氧化还原稳态和线粒体功能来维持大动脉的完整性。中国生物工程学报。2018;27(2):307-21。
Nemeth CE, Marcolongo P, Gamberucci A, Fulceri R, Benedetti A, Zoppi N, Ritelli M, Chiarelli N, Colombi M, Willaert A,等。葡萄糖转运蛋白10型-缺乏动脉弯曲综合征-促进脱氢抗坏血酸的运输。FEBS快报,2016;590(11):1630-40。
李玉春,黄海燕,张佳杰,郑超,陈宜勇。线粒体GLUT10促进脱氢抗坏血酸的输入和保护细胞对抗氧化应激:动脉弯曲综合征的机制洞察。中国生物科学。2010;19(19):3721-33。
Ghosh S, Watanabe RM, Hauser ER, Valle T, Magnuson VL, Erdos MR, Langefeld CD, Balow J Jr, Ally DS, Kohtamaki K,等。2型糖尿病:716对芬兰患病兄弟姐妹中染色体20的连锁证据。中国科学院学报(自然科学版),1999;26(5):366 - 366。
Zouali H, Hani EH, Philippi A, Vionnet N, Beckmann JS, Demenais F, Froguel P.早发型非胰岛素依赖型(2型)糖尿病易感位点定位于磷酸烯醇丙酮酸羧酸激酶基因近端染色体20q。胡文杰,1997;6(9):1401-8。
Andersen G, Rose CS, Hamid YH, Drivsholm T, Borch-Johnsen K, Hansen T, Pedersen O. GLUT10葡萄糖转运蛋白(SLC2A10)的遗传变异及其与2型糖尿病和中介性状的关系。糖尿病。2003;52(9):2445 - 8。
Bento JL, Bowden DW, Mychaleckyj JC, Hirakawa S, Rich SS, Freedman BI, Segade F.美国白人2型糖尿病中GLUT10葡萄糖转运蛋白(SLC2A10)多态性的遗传分析。BMC Med Genet 2005;6:42。
Mohlke KL, Skol AD, Scott LJ, Valle TT, Bergman RN, Tuomilehto J, Boehnke M, Collins FS。SLC2A10 (GLUT10)作为芬兰人2型糖尿病的候选基因及其相关性状的评估。中国生物医学工程学报,2005;85(4):323-7。
玫瑰CS,安徒生G,哈米德YH,颖C, Drivsholm T, Borch-Johnsen K,约根森T,皮德森O,汉森T之间的关系的研究GLUT10 Ala206Thr多态性和胰岛素分泌受损。糖尿病杂志2005;22(7):946-9。
林文辉,庄明林,陈超,叶骥,谢培平,程超,陈宜勇。台湾人群SLC2A10基因多态性与2型糖尿病的相关性研究Diabetologia。2006;49(6):1214 - 21所示。
蒋永德,常玉春,赵玉峰,常廷杰,李海燕,林文辉,袁海燕,陈宜涛,庄丽林。SLC2A10基因多态性预测2型糖尿病患者外周动脉疾病的发生SLC2A10和PAD在2型糖尿病中的作用。BMC医学Genet。2010;11:126。
德劳因G,戈丁JR,页B.遗传的维生素C损失在脊椎动物。中国生物医学工程学报。2011;12(5):371-8。
金浩,裴森,俞勇,金勇,金宏,黄毅,姜杰,李文杰。停用维生素C后古罗(-/-)小鼠各器官维生素C浓度的分析。免疫杂志,2012;12(1):18-26。
Linster CL, Van Schaftingen E.哺乳动物维生素C的生物合成、循环和降解。中华医学杂志,2007;26(1):1 - 22。
Han BG, Hao CM, Tchekneva EE, Wang YY, Lee CA, Ebrahim B, Harris RC, Kern TS, Wasserman DH, Breyer MD,等。小鼠血糖控制的标志物:6小时和夜间禁食血糖与糖化血红蛋白的比较。中华内分泌杂志。2008;29(4):381 - 381。
Chait A, den Hartigh LJ。脂肪组织分布、炎症及其代谢后果,包括糖尿病和心血管疾病。前沿心血管医学2020;7:22。
Altintas MM, Azad A, Nayer B, Contreras G, Zaias J, Faul C, Reiser J, Nayer A.小鼠的肥大细胞,巨噬细胞和冠状结构区分皮下脂肪和内脏脂肪。中国油脂杂志,2011;52(3):480-8。
Sun K, Kusminski CM, Scherer PE。脂肪组织重塑与肥胖。中国科学(d辑),2011;
Olefsky JM, Glass CK。巨噬细胞、炎症和胰岛素抵抗。物理学报。2010;72:219-46。
菅上,田中,小川。脂肪组织炎症与异位脂质堆积。中国科学(d辑),2012;
胡达克CS,古丽雅娃O,王勇,朴SM,李林,姜c,南HS。Pref-1标志着脂肪组织发育和扩张所需的非常早期间充质前体。Cell . 2014;8(3): 678-87。
王艳,金佳,金志华,南夏。Pref-1,一种抑制脂肪生成的前脂肪细胞分泌因子。中国生物医学工程学报,2006;36(12):344 - 344。
Michels AJ, Hagen TM, Frei B.人类遗传变异通过改变维生素C运输和抗氧化酶功能影响维生素C稳态。《营养学》2013;33:45-70。
影响维生素C状态和缺乏症流行的因素:全球健康视角。营养。2020;12(7):1963。
Kratzing CC, Kelly JD。大鼠妊娠期抗坏血酸的组织水平。中华医学杂志,2002;22(3):326 - 326。
Kratzing CC, Kelly JD, Oelrichs BA。神经组织中的抗坏血酸。神经化学杂志,1982;39(3):625-7。
陈志强,陈志强,陈志强,等。猪抗坏血酸合成的发育特征及影响因素。2004; 24:79-103。
Harrison FE, Dawes SM, Meredith ME, Babaev VR, Li L, May JM。在缺乏钠依赖性维生素C转运体SVCT2的小鼠中,低维生素C和氧化应激和细胞死亡的增加。自由基生物学杂志,2010;49(5):821-9。
黄多兰I,雪橇A,罗奇福德JJ,奥拉希利S,萨维奇DB。脂肪营养不良:一种罕见疾病的代谢见解。中华内分泌杂志,2010;37(3):344 - 344。
心胸狭窄的人SM。脂肪组织和代谢综合征:太多,太少或两者都没有。中国科学(d辑),2015;
坎皮恩J,米拉格罗FI,费尔南德斯D,马丁内斯JA。在自助餐厅肥胖模型中补充抗坏血酸诱导的差异基因表达和脂肪减少。中国生物医学工程学报。2006;36(2):344 - 344。
王晓明,王晓明,王晓明。维生素C对肥胖高血糖(ob/ob)小鼠胰岛素糖基化的影响。51新陈代谢。2002;(4):514 - 7。
金斌,崔明明,任海生,朴海涛,任志华,李明明。抗坏血酸对去卵巢大鼠的成脂作用。延世医学杂志,2018;39(1):85-91。
韩春。活性氧在脂肪组织胰岛素抵抗中的作用。糖尿病杂志,2016;40(4):272-9。
Zatterale F, Longo M, Naderi J, Raciti GA, Desiderio A, Miele C, Beguinot F.肥胖与胰岛素抵抗和2型糖尿病相关的慢性脂肪组织炎症。《前沿物理》2019;10:1607。
加西亚-迪亚兹D,坎皮恩J,米拉格罗FI,马丁内斯JA。肥胖依赖的顶elin基因表达:与氧化和炎症标志物的关系。生物化学学报,2007;30(1):344 - 344。
坎皮恩J,米拉格罗FI,费尔南德斯D,马丁内斯JA。维生素C补充影响体脂量和类固醇生成相关基因时,喂食高脂肪饮食。中华实用医学杂志,2008;29(2):344 - 344。
Garcia-Diaz DF, Lopez-Legarrea P, Quintero P, Martinez JA。维生素C在治疗和/或预防肥胖中的作用J Nutr Sci Vitaminol(东京)。60 2014;(6): 367 - 79。
Padayatty SJ, Levine M.维生素C:已知的和未知的以及金发姑娘。口腔杂志2016;22(6):463-93。
抗坏血酸的生物学和生物化学新概念。中华实用医学杂志,2000;26(4):529 - 529。
郑春,田菊池,陈永华,吴sabbagha,李玉春,潘海杰,张春,陈宜勇。SLC2A10基因突变导致小鼠动脉异常。中华心血管病杂志,2009;32(2):381-8。
Schneider CA, Rasband WS, Eliceiri KW. NIH图像到ImageJ: 25年的图像分析。自然科学进展。2012;9(7):675 - 5。
确认
我们感谢由台湾科技部(MOST)资助的台湾老鼠诊所在血液化学、代谢笼、家笼活动和身体成分分析方面的技术支持。我们感谢台湾中央研究院ICOB的Marcus Calkins的英文编辑。
资金
本研究由台湾中央研究院(AS 105-TP-B04)及台湾科技部(MOST) (MOST107-2320-B-001-024及MOST 108-2320-B-001-022)资助予YCL。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
作者信息
作者及隶属关系
贡献
CLJ和CYT进行实验,分析数据,解释结果。YCL构想并监督这项工作,设计实验,分析数据,解释结果,获得资金,并撰写手稿。作者们阅读并批准了最终的手稿。
相应的作者
道德声明
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
来自不同基因型或治疗组的小鼠在食物摄入量、水摄入量、体力活动或能量消耗方面没有显着差异。图S2。添加AA对hfd喂养的sWAT组织无明显影响GLUT10G128E和WT小鼠。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
江,CL。,Tsao, CY. & Lee, YC. Vitamin C attenuates predisposition to high-fat diet-induced metabolic dysregulation in GLUT10-deficient mouse model.基因减轻17, 10(2022)。https://doi.org/10.1186/s12263-022-00713-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12263-022-00713-y
关键字
- 维生素C
- 2型糖尿病
- 高脂肪饮食
- 遗传素质
- 白色脂肪组织