摘要
镰刀菌毒素脱氧雪腐镰刀菌醇(DON)的产生与氧化应激有关,已被表明是重要的小麦真菌对氧化应激的适应性反应的一部分镰刀菌素graminearum.在本研究中,我们发现抗氧化剂没食子酸甲酯(MG)对菌丝生长、分生孢子的形成和萌发以及DON的生物合成具有抑制作用f . graminearum以剂量依赖的方式。0.05% MG (w/v)处理导致分生孢子形态异常肿胀。的表达式三在mg处理的菌丝体中,参与DON生物合成的基因显著减少,球形和新月形毒体中Tri1-GFP绿色荧光信号的诱导被取消。mg处理的RNA-Seq分析f . graminearum结果表明,0.5% MG (w/v)可能通过改变膜功能和氧化还原酶活性来抑制DON的产生。同时观察到MG处理降低了过氧化氢酶、POD和SOD活性f . graminearum.本研究结果表明,MG通过调节DON的氧化反应表现出抗真菌活性。综上所述,目前的研究揭示了MG在抑制真菌毒素的潜力f . graminearum.
图形抽象
简介
委员会成员镰刀菌素graminearum物种复合体(FGSC)可侵染小麦、大麦等小粒谷类植物,在世界范围内引起镰状头疫病(FHB)。赤霉病的流行导致很大的产量损失和谷物品质下降。此外,镰刀菌毒素(如B型毛霉烯)通常由镰刀菌素寄主植物生长过程中的孢子虫对人畜健康构成严重威胁。脱氧雪腐镰刀菌醇(DON)是最常见的B型毛霉烯之一,已被证明通过抑制蛋白质合成对真核细胞具有毒性(**am & Doohan)2013).DON在世界范围内普遍存在(Ji et al。2014,2019).由于DON的毒性、引起食品安全担忧和普遍存在的性质,包括中国在内的许多国家和地区都对小麦和其他谷物类产品中的DON含量设定了最高水平,因此,全球迫切需要一种有效的FHB和DON污染控制策略。
由于缺乏抗赤霉病和DON的小麦品种(Jansen et al。2005),在中国,在小麦开花期施用系统性杀菌剂已成为控制病害和DON污染的主要工具之一(Chen et al。2019).目前,杀菌剂包括固醇去甲基化抑制剂戊康唑和原硫康唑(Yin等。2009),新型肌凝蛋白抑制剂phenamacril (Zhang et al.,2010,2015)和羧酰胺杀菌剂pydiflumetofen (Chen等。2020;Sun等人。2020)在国内广泛使用,可有效控制小麦赤霉病和DON积累。然而,由于广泛的使用,领域镰刀菌素asiaticum已分离出对戊康唑低耐药性的菌株,据报道,中国一些省份对杀菌剂phenamacril和pydiflumetofen有中度至高度或高度耐药风险(Chen et al.;2020;陈&周2009;Sun等人。2020).此外,以前的研究表明镰刀菌素多菌灵是一种自20世纪70年代以来在中国广泛用于控制赤霉病的杀菌剂,具有耐药性的分离株倾向于在受感染的谷物中产生更多的DON (Zhang et al。2009;Zhou等。2020).此外,某些杀菌剂的应用低于其推荐剂量可能引发DON的产生(Audenaert等。2010;段等。2020).
因此,开发新的、高效和可持续的工具或具有不同作用模式的新型化学品来控制小麦中的赤霉病和DON污染是极其迫切的。具有多种生物活性的植物次生代谢产物在寻找安全环保的抗真菌药物方面具有重要意义。其中,具有抗氧化特性的代谢物已被证明在植物对入侵微生物的防御反应中发挥重要作用(Atanasova-Penichon et al.)。2016;Balmer等人。2013),从而显示抗真菌活性,一些可以干扰毒素合成(Gauthier等人,2016;赵等。2018).
没食子酸甲酯(MG)是一种普遍存在的酚类化合物,广泛分布在药用和食用植物中(Farhoosh & Nyström)2018).MG具有重要的生物学作用,包括抗氧化、抗炎、抗凋亡和抗肿瘤活性(Kamatham等。2015;Kang等。2009).MG以其保护细胞免受氧化应激引起的DNA损伤的能力而闻名(Rahman et al。2016),防止脂质氧化。此外,MG是一种抗多药耐药的有效抗菌化合物志贺氏杆菌属、耐萘啶酸菌、植物致病菌r . solanacearum(Acharyya等。2015;Choi等人。2009;范等人。2014).MG还显示出抗真菌化学物质的潜力,对水稻真菌病原体有效Magnaporthe oryzae(Ahn et al。2005).
本研究的目的是i)确定MG对真菌生长和DON产生的抑制活性f . graminearum;ii)探讨MG抑制真菌生长和毒素合成的分子机制f . graminearum本研究旨在探讨强抗氧化剂MG作为抗真菌剂的潜力,并为MG作为一种安全、天然的病原体抑制剂的进一步开发和利用提供指导。
材料与方法
菌株、培养基和培养条件
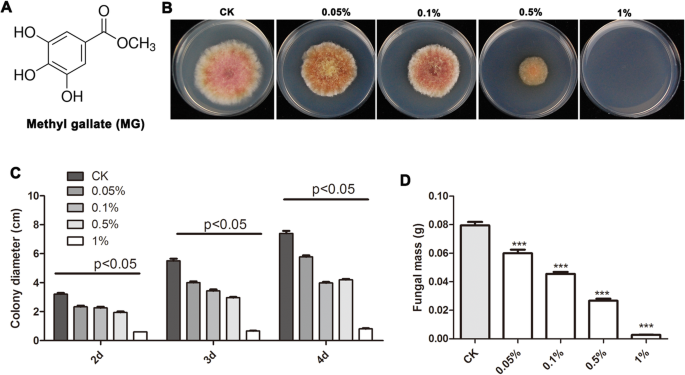
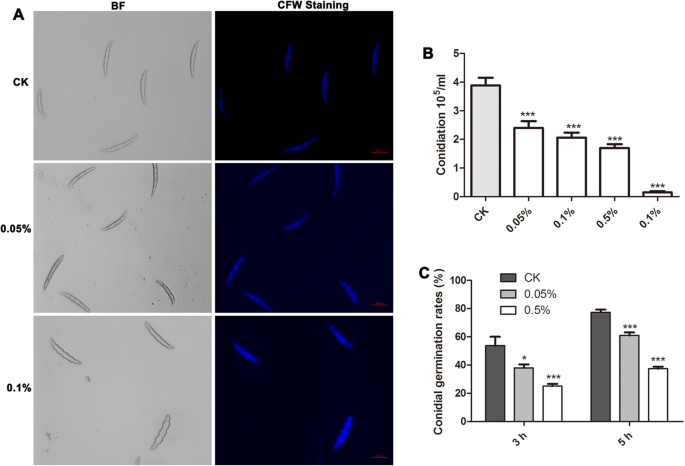
镰刀菌素graminearum菌株PH-1 (NRRL 31084,最初从密歇根分离)被用作亲本野生型(Cuomo et al。2007).在图中所示的MG浓度下,在PDA(马铃薯葡萄糖琼脂)培养皿中比较菌丝生长情况,并在25°C下孵育。在25°C的摇床(180 rpm)中,从3天前的PDB(土豆葡萄糖肉汤)培养液中收集菌丝,比较真菌生物量。通过将5个5毫米的菌落边缘的菌丝塞接种到150毫升的三角瓶中,瓶中含有50毫升CMC(羧甲基纤维素)培养基,按图中所示的浓度加或不加MG处理,并在25°C, 180转/分,光摇床中培养4天(Iida等人,2008;Zhang等。2015).用血细胞计计数CMC培养基中分生孢子的数量,用钙荧光白(CFW)染色显微镜观察分生孢子的形态。分生孢子在25℃下,在添加0.05%或0.1% MG (w/v)的2%蔗糖溶液中重新悬浮3 h或5 h,比较分生孢子的萌发率。实验重复三次,每个样品重复三次。
RNA提取及基因表达分析(RNA- seq)
对于RNA-Seq分析,分生孢子(105)f . graminearum菌株PH-1接种于50 ml FMM(镰刀菌最小培养基)(Leslie & Summerell2007),在25°C, 180转/分的条件下,在摇床中培养2天。菌丝用无菌无菌布过滤收集,清洗后等分。一半菌丝在相同的条件下生长,另一半转移到0.05% (w/v) MG处理24 h。采集菌丝,清洗,液氮冷冻,冻干。总RNAf . graminearum使用TaKaRa RNAiso Plus (TaKaRa,大连,中国)提取菌株,使用TaKaRa PrimeScript™RT Master Mix (TaKaRa,大连,中国)反转录cDNA。
制备RNA样本,使用BGISEQ-500平台,采用RNA-seq方法(华大基因,深圳,中国)进行数字转录组分析。干净的读取被映射到f . graminearumPH-1基因组(https://www.ncbi.nlm.nih.gov/assembly/GCF_000240135.3)使用Bowtie2 (Langmead & Salzberg)2012)和RSEM (Li & Dewey2011).频率大于每百万3个标签计数(TPM)的标签用于数据分析(Jongeneel等人)。2003;Liu等。2010).比较0.05% (w/v) MG处理和未处理样品中各测序标记的频率,并计算其统计学意义(q值)。使用DEGseq选择差异表达基因,fold change≥2且q值≤0.001的基因被认为是显著差异表达基因(significant differential expression genes, DEGs) (Wang et al.)。2009).采用phyper (R包)进行GO和KEEG分析。
并分析
分生孢子(105)f . graminearum将菌株PH-1接种到图中不同浓度MG修饰或不添加MG的30 ml TBI液中,28℃黑暗培养7天。每个处理设3个重复。分别收集滤液和真菌体,液氮冷冻冻干24 h。将滤液重新溶解在甲醇中,使用高效液相色谱-质谱-质谱(HPLC-MS/MS)系统(Shimadzu 30A LC系统耦合到Triple Quad 6500 plus, Sciex,美国)测定DON浓度。质谱分析参数根据先前描述的方法(Qiu et al。2016).将DON的量归一化为每个样品的干菌丝体重量。实验重复了三次。
qRT-PCR检测基因相对表达量
的表达三采用实时荧光定量PCR (qRT-PCR)法测定参与DON生物合成的基因,引物对如表S所示1.qRT-PCR扩增在LightCycler®96(罗氏分子系统)中使用TaKaRa SYBR®Premix Ex Taq™II (Tli RNaseH Plus) (TaKaRa,大连,中国)进行。每个基因的相对表达量用2计算−ΔΔCT方法,并使用f . graminearumβ-微管蛋白基因(Livak & Schmittgen2001).
脂质氧化水平及抗氧化酶活性分析
了解MG处理对植物抗氧化反应系统的影响f . graminearum,比较过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)活性。如前所述,从MG最终浓度为0.1%或0.5% (w/v)处理或未处理的样品中收集菌丝,并如前所述用于酶活性测定(Zhang et al.)。2010;赵等。2018).酶活性归一化到干菌丝的重量。
统计分析
所有数据以均数±标准差(SD)表示。用未配对的Student 's进行比较,差异有统计学意义t-使用GraphPad Prism软件(La Jolla, CA, USA)进行测试。一个p-value小于0.05为有统计学意义。通过层次聚类分析比较6个RNA-Seq样本的相关关系。
结果
MG的抑制作用f . graminearum菌丝的生长
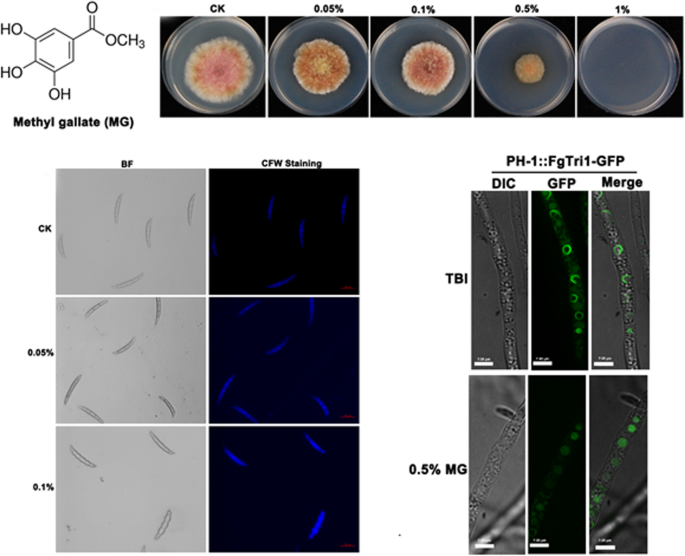
不同浓度MG处理(0.05、0.1、0.5和1%,w/v)显著降低f . graminearum与对照组相比,PDA板中的菌丝生长呈剂量依赖关系(p< 0.05)(图1c)。1% MG (w/v)的添加完全抑制f . graminearum菌丝的生长。从PDB中收获的不同浓度mg处理样品的真菌生物量与对照组相比也显著降低(p< 0.001)(图1D)。
MG处理影响分生孢子形态发生f . graminearum
在产孢子液体培养基CMC中,以0.05%或0.1% (w/v) MG处理,可引起孢子形态变化f . graminearum应变PH-1。mg处理后的分生孢子结构肿胀,顶端断裂,大小变短,间隔变少,经氟钙白(CFW)染色证实(图。2A). MG浓度分别为0.05、0.1、0.5和1% (w/v)后,液体CMC中的孢子化显著降低(p< 0.001)(图2B).用等量的分生孢子在2%蔗糖溶液中重悬,MG浓度分别为0.05和0.5% (w/v),比较分生孢子的萌发率。结果表明,MG处理显著降低了孢子萌发率f . graminearum在3小时和5小时的两种浓度测试(图。2C)。
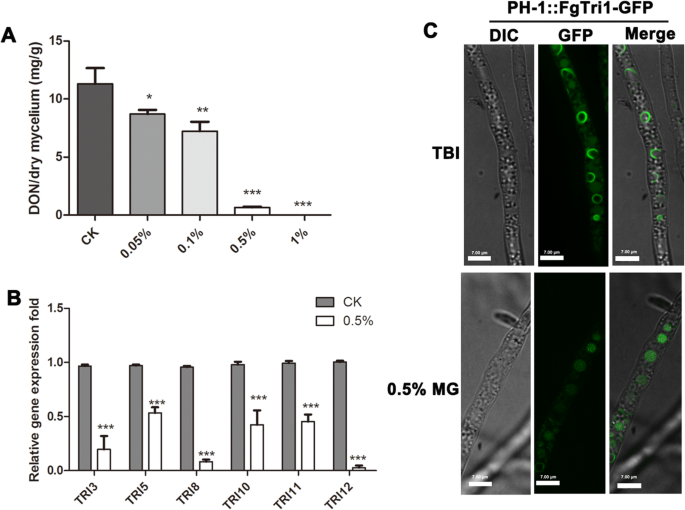
MG抑制DON的生物合成f . graminearum
等量的f . graminearum菌株PH-1分生孢子分别接种于MG浓度为0、0.05、0.01、0.5%、1% (w/v)的TBI液中7 d。滤液和菌丝体分别采集。DON产量归一化为干菌丝体质量(mg DON/g干菌丝体)。如图所示。3.A, MG处理显著抑制DON的产生f . graminearum以剂量依赖的方式。此外,表达水平为6三采用qRT-PCR方法检测毛霉烯生物合成基因簇的相关基因。与未处理对照组相比,蛋白的相对表达量TRI3,TRI5,TRI8,TRI10,TRI11而且TRI12均大幅下调(p< 0.001)。
最近的研究表明DON是在有组织的内质网结构中合成的,这种内质网结构被称为毒体f . graminearum.当在DON生物合成诱导条件下培养时(例如,液态TBI或在小麦穗感染期间),表达三基因上调,翻译的Tri与DON-toxisome共定位。Tri1是一种细胞色素P-450加氧酶,参与毛孢烯DON生物合成的后期步骤,被证实定位于DON-毒体(Menke et al.)。2013;Zhang等。2015).在液体TBI中培养时,可以在带有DON-toxisome的Tri1 GFP(绿色荧光蛋白)标记突变体(ΔTri1:: FgTri1-GFP)中检测到共定位荧光;然而,0.5% MG (w/v)处理强烈抑制don -毒体的形成,因为在MG处理的菌丝中只观察到微弱的荧光信号(图2)。3.C)。
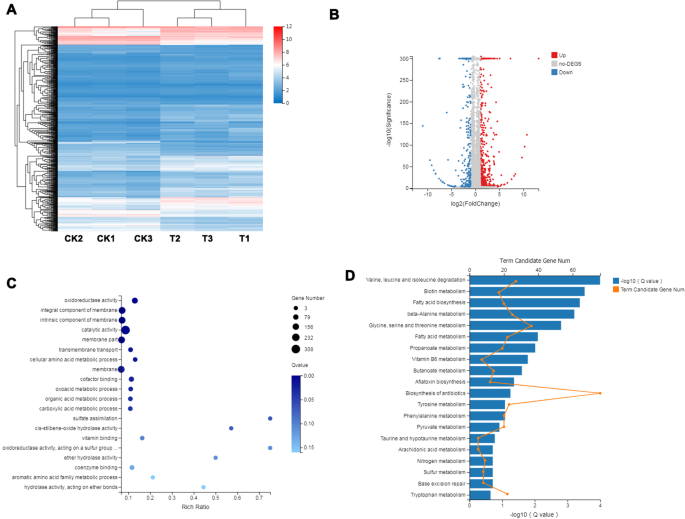
基因转录谱分析f . graminearumMG治疗
为了进一步了解MG如何抑制真菌生长和DON的生物合成f . graminearum,通过RNA-seq鉴定0.5% (w/v) MG处理24 h后差异表达的基因。对照组和MG处理各设3个重复。根据6个样品的相关关系进行聚类分析,结果表明对照组和MG处理组的基因表达不同(图2)。4A). fold change≥2,调整后Q值≤0.001的基因被认为是差异表达基因(differential expression Genes, DEGs)。与对照组相比,mg处理的样品中分别有664个和312个基因上调和下调(图2)。4B、表S2).mg处理样品中deg的富集基因本体(GO)项列在表S中3..参与催化活性、膜的整体/内在成分、膜部分、膜和氧化还原酶活性的基因在MG处理响应的DEGs中富集(图)。4C).京都基因与基因组百科(KEGG)通路分析显示MG处理引起的DEGsf . graminearum主要集中在氨基酸代谢(甘氨酸、丝氨酸、苏氨酸、支链氨基酸、色氨酸)、脂肪酸的生物合成和代谢。MAPK信号通路、抗生素生物合成和过氧化物酶体相关基因也富集在MG处理应答的deg中(图2)。4D,表S4).
MG对枸杞抗氧化酶活性的影响f . graminearum
比较了过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性f . graminearum以0.1%或0.5% MG (w/v)处理或不加MG处理的菌丝。如图所示。5结果表明,mg处理后,这三种抗氧化酶的活性均显著降低f . graminearum以剂量依赖的方式(图;5a - c)。
讨论
有效和实质性地控制由FGSC成员引起的FHB和毒素污染仍然是小麦行业的一个挑战。由于抗性小麦品种的缺乏、有效杀菌剂的局限性以及新出现的抗性风险,迫切需要开发和应用一种综合管理策略。抗氧化剂在植物抗病方面的潜力先前已经有报道(Pani等。2014;Picot等人。2013).在黄曲霉毒素产生过程中观察到抗氧化剂对真菌生长和毒素产生的抑制作用黄曲霉赵等。2018)和产生伏马菌素黄萎病镰刀菌和增殖镰刀菌Picot等。2013).在本研究中,我们发现抗氧化剂MG有效地抑制了重要小麦真菌的真菌生长和DON的合成f . graminearum以剂量依赖的方式。MG的抗菌活性先前在其他植物和人类致病菌和真菌(Acharyya et al。2015;Ahn等人。2005;Choi等人。2009).到目前为止,抗氧化剂MG的作用机制还知之甚少。进一步阐明MG抑制真菌生长和DON合成的机制,是将其有效应用于农业疾病和毒素防治的必要条件。
天然抗氧化剂在真菌入侵引起的氧化应激的植物防御反应中起着至关重要的作用(Pani等。2014;Picot等人。2013).DON是一种b型毛孢烯,是一种至关重要的毒力因子,它的合成是在面对寄主植物在感染期间作为防御反应产生的活性氧(ROS)时诱导的f . graminearum.DON的产生与氧化应激有关,并已被表明是这种真菌对氧化应激的适应性反应的一部分。MG处理后,在液态DON诱导培养基中,真菌的DON产量正常化。在转录水平上,我们发现DON生物合成的表达三MG处理后基因下调。最近,参与DON生物合成晚期途径的关键酶Tri1主要定位于毒素诱导条件下或感染期间内质网衍生的DON-毒体(Menke et al.)。2013;Tang等。2018,2020).荧光共聚焦显微镜观察表明,MG对细胞don -毒体的形成也有抑制作用f . graminearum.
基于这一发现,我们进一步进行了RNA-seq分析,以阐明MG抗真菌活性的机制。结果表明,0.5% (w/v) MG处理抑制了DON的产生,可能是通过MG的抗氧化活性和氧化应激的裂解,以及改变氧化还原酶活性、脂质氧化和膜的酶功能。再加上MG处理降低了小鼠体内CAT、SOD和POD的酶活性f . graminearum本研究结果表明,MG通过调节真菌氧化反应对DON的产生具有抗真菌活性。
真菌分生孢子是特化的生殖结构。分生孢子的形成和萌发是植物无性生命周期中至关重要的第一步f . graminearum和对成功的植物定植很重要(Seong et al。2008).侵染成功后,菌丝在小麦小花和颖片的外表面形成,并通过气孔或其他部位渗透(Bushnell et al.,2003).在mg处理的孢子中也观察到异常的分生孢子形态。MG在图中所示的浓度下显著抑制分生孢子的形成、萌发和菌丝的生长。2这表明MG具有抑制真菌在植物内定植和传播的潜力,从而有效地控制疾病。
结论
综上所述,抗氧化剂没食子酸甲酯(MG)被发现对菌丝生长、分生孢子形态发生和DON生物合成具有抑制作用f . graminearum以剂量依赖的方式。RNA-Seq分析发现,对0.5% (w/v) MG处理有反应的DEGs具有丰富的膜功能和氧化还原酶活性。MG还影响大豆中CAT、SOD和POD的酶活性f . graminearum.本研究结果表明,MG对DON产生具有抗真菌活性,可能是通过调节真菌的氧化反应来实现的。综上所述,这项研究揭示了抗氧化剂抑制真菌毒素的潜力f . graminearum控制小麦中的赤霉病及其可能的作用机制。
数据和材料的可用性
不适用。
缩写
- MG:
-
没食子酸甲基酯
- FGSC:
-
镰刀菌素graminearum种类复杂
- FHB:
-
赤霉病
- 唐:
-
Deoxynivalenol
- PDA:
-
马铃薯葡萄糖琼脂
- PDB:
-
土豆葡萄糖汤
- CMC:
-
羧甲基纤维素
- CFW:
-
Calcofluor白
- FMM:
-
赤霉病最小培养基
- TPM:
-
每百万标签数
- 创伤性脑损伤:
-
毛霉烯生物合成诱导
- 存在:
-
实时定量PCR
- 猫:
-
过氧化氢酶
- SOD:
-
超氧化物歧化酶
- 圆荚体:
-
过氧化物酶
- SD:
-
标准偏差
- 绿色荧光蛋白:
-
绿色荧光蛋白
- dg:
-
差异表达基因
- 走:
-
基因本体论
- KEGG:
-
京都基因与基因组百科全书
- ROS:
-
活性氧
参考文献
Acharyya, S., Sarkar, P., Saha, D. R., Patra, A., Ramamurthy, T., & Bag, P. K.(2015)。没食子酸甲酯的胞内和膜损伤活性榄仁树属chebula针对耐多药志贺氏杆菌spp。医学微生物学杂志,64(8), 901 - 909。https://doi.org/10.1099/jmm.0.000107.
安、y . J。李,h·S。哦,h·S。金,h·T。& Lee黄懿慧(2005)。五倍子酚类物质对植物病原真菌的抗真菌活性及作用方式。农药生物化学生理学,81(2), 105 - 112。https://doi.org/10.1016/j.pestbp.2004.10.003.
**am, C., & Doohan, F. M.(2013)。真核生物中的毛霉烯毒性:植物和动物的细胞和分子机制。毒物学字母,217(2), 149 - 158。https://doi.org/10.1016/j.toxlet.2012.12.003.
Atanasova-Penichon, V., Barreau, C., & Richard-Forget, F.(2016)。谷物中的抗氧化次生代谢物:潜在参与抵抗镰刀病和真菌毒素积累。微生物学前沿,7, 1卷。https://doi.org/10.3389/fmicb.2016.00566.
Audenaert, K., Callewaert, E., Höfte, M., De Saeger, S., & Haesaert, G.(2010)。杀菌剂原硫康唑诱导过氧化氢产生脱氧雪腐镰刀醇(DON)镰刀菌素graminearum.BMC微生物学,10(1) 3-21。https://doi.org/10.1186/1471-2180-10-112.
Balmer, D., Flors, V., Glauser, G., & mach - mani, B.(2013)。生物胁迫下谷物代谢组学:现有知识和技术。植物科学前沿,4, 1 - 12。https://doi.org/10.3389/fpls.2013.00082.
W。陈,魏、L。赵,W,王,B。,郑,H,张P。,……陈,c(2020)。新型琥珀酸脱氢酶抑制剂吡氟甲醚的耐药风险评估镰刀菌素asiaticum.病虫害管理科学,77(1), 538 - 547。https://doi.org/10.1002/ps.6053.
陈勇,基斯特勒,H. C.和马,Z.(2019)。毛霉烯真菌毒素:生物合成、调控和管理。植物病理学年度评论,57, 1 - 25。
陈勇,周明国(2009)。描述的镰刀菌素graminearum对多菌灵和一种新型杀菌剂JS399-19耐药的分离株。植物病理学,99(4), 441 - 446。https://doi.org/10.1094/PHYTO-99-4-0441.
康,崔J·G。o . H。李,y。,哦,y . C,崔,H·S。张成泽,H·J。……Kwon, d . y(2009)。从五倍子中分离的没食子酸甲酯或果瓣醇联合萘啶酸对萘啶酸耐药菌的抑菌活性。分子,14(5), 1773 - 1780。https://doi.org/10.3390/molecules14051773.
库莫,C. A., Güldener, U.,徐,J. R., Trail, F., Turgeon, B. G., Di Pietro, A.等(2007)。的镰刀菌素graminearum基因组揭示了局部多态性和病原体专门化之间的联系。科学,317(5843), 1400 - 1402。https://doi.org/10.1126/science.1143708.
段,Y。,陆,F。,,Z,赵,H。,,,,Y。,…周,m(2020)。醌类外部抑制剂影响DON生物合成、线粒体结构和毒体形成镰刀菌素graminearum.危险物质杂志,398, 122908年。https://doi.org/10.1016/j.jhazmat.2020.122908.
风扇,W·W。元,g . Q。李,问:问,林&,W(2014)。没食子酸甲酯的抗菌机制Ralstonia solanacearum.《大洋洲植物病理学,43(1)、1 - 7。https://doi.org/10.1007/s13313-013-0234-y.
法胡什,R. & Nyström, L.(2018)。向日葵油三酰甘油中没食子酸、没食子酸甲酯及其组合在高温下的抗氧化能力。食品化学,244, 29-35。https://doi.org/10.1016/j.foodchem.2017.10.025.
Gauthier, L., Bonnin-Verdal, M. N., Marchegay, G., Pinson-Gadais, L., Ducos, C., Richard-Forget, F., & Atanasova-Penichon, V.(2016)。绿原酸和咖啡酸的真菌生物转化镰刀菌素graminearum:关于酚酸对谷物中脱氧雪腐镰刀菌醇积累抗性贡献的新见解。国际食品微生物学杂志,221, 61 - 68。https://doi.org/10.1016/j.ijfoodmicro.2016.01.005.
Iida, Y., Kurata, T., Harimoto, Y., & Tsuge, T.(2008)。亚硝酸盐还原酶基因在分生孢子形成过程中被上调尖孢镰刀菌.植物病理学,98(10) 1099 - 1106。https://doi.org/10.1094/PHYTO-98-10-1099.
詹森,C.,冯·维特斯坦,D.,谢弗,W.,科格尔,K.-H.。(2005)。用野生型和三苯二烯合酶基因接种大麦和小麦穗的侵染模式被破坏镰刀菌素graminearum.美国国家科学院院刊,102, 16892 - 16897。https://doi.org/10.1073/pnas.0508467102.
D, F。,他,Olaniran, a . O。Mokoena, m . P。,J。,&史,J .(2019)。镰刀菌毒素的发生、毒性、生产及检测研究进展。食品生产、加工与营养“,,1(1)、1 - 14。https://doi.org/10.1186/s43014-019-0007-2.
霁,F。,徐、J。,X。,阴,X。,&史,J .(2014)。江苏小麦中脱氧雪腐镰刀醇和玉米赤霉烯酮的自然存在。食品化学,157, 393 - 397。https://doi.org/10.1016/j.foodchem.2014.02.058.
Jongeneel, c.v, Iseli, C, Stevenson, b.j, Riggins, g.j, Lal, A, Mackay, A,…Strausberg, R.(2003)。利用大规模并行签名测序对人类细胞系中的基因表达进行全面采样。美国国家科学院院刊,One hundred., 4702 - 4705。https://doi.org/10.1073/pnas.0831040100.
Kamatham, S., Kumar, N., & Gudipalli, P.(2015)。罗氏Givotia rottleriformis Griff种皮中没食子酸和没食子酸甲酯的分离与表征。研究了其对人表皮样癌A431细胞的抗增殖作用。毒物学报告,2, 520 - 529。https://doi.org/10.1016/j.toxrep.2015.03.001.
张成泽,康,m . S H·S。哦,j·S。杨,K . H。崔n . K。Lim H·S。&金,S m(2009)。没食子酸甲酯和没食子酸对口腔上皮细胞产生炎症介质白介素-6和白介素-8的影响梭菌属nucleatum.微生物学杂志,47(6), 760 - 767。https://doi.org/10.1007/s12275-009-0097-7.
朗米德,B. &萨尔茨伯格,S. L.(2012)。快速gap -read对齐领结2。自然方法,9(4), 357 - 359。https://doi.org/10.1038/nmeth.1923.
莱斯利,J. F. &萨梅尔,B. A.(2007)。镰刀菌实验室手册.https://doi.org/10.1002/9780470278376.
李,B.和杜威,C. N.(2011)。RSEM:从RNA-Seq数据中精确的转录物定量,有或没有参考基因组。BMC生物信息学,12(1).https://doi.org/10.1186/1471-2105-12-323.
J。,刘,X。,江邵,J。,,Y。,z &马(2010)。基因转录谱镰刀菌素graminearum用唑类杀菌剂戊康唑处理。应用微生物学与生物技术,85(4), 1105 - 1114。https://doi.org/10.1007/s00253-009-2273-4.
利瓦克,K. J. &施米特根,T. D.(2001)。相关基因表达数据的分析采用实时定量PCR和2——ΔΔCT方法。方法,25(4), 402 - 408。https://doi.org/10.1006/meth.2001.1262.
门克,J.,韦伯,J.,布罗兹,K., &基斯特勒,H. C.(2013)。谷物镰刀菌丝状真菌诱导真菌毒素合成相关的细胞发育。《公共科学图书馆•综合》,8(5).https://doi.org/10.1371/journal.pone.0063077.
Pani, G., Scherm, B., Azara, E., Balmas, V., Jahanshiri, Z., Carta, P.等(2014)。天然和类天然的B型毛霉烯类酚类抑制剂在体外小麦产量(小麦属植物sp病原体)。镰刀菌素culmorum.农业与食品化学杂志,62(22), 4696 - 4978。
Picot, A, Atanasova-Pénichon, V., Pons, S., Marchegay, G., Barreau, C., Pinson-Gadais, L.,……Richard-Forget, F.(2013)。玉米籽粒抗氧化剂及其在抗镰刀病中的潜在作用。农业与食品化学杂志,61(14), 3389 - 3395。https://doi.org/10.1021/jf4006033.
秋J。董,F。,,,,,与,J .(2016)。前茬作物对镰刀菌素小麦品种和真菌毒素污染。食品和农业科学杂志,96(13), 4536 - 4541。https://doi.org/10.1002/jsfa.7670.
拉赫曼,N., Jeon, M., & Kim, Y. S.(2016)。没食子酸甲酯是一种有效的抗氧化剂,通过损伤有丝分裂克隆扩增抑制小鼠和人类脂肪细胞的分化和脂肪细胞的氧化应激。BioFactors,42(6), 716 - 726。https://doi.org/10.1002/biof.1310.7.
成桂云,赵晓霞,徐建荣,Güldener, U. & Kistler hc .(2008)。丝状真菌中的分生孢子萌发镰刀菌素graminearum.真菌遗传学与生物学,45(4), 389 - 399。https://doi.org/10.1016/j.fgb.2007.09.002.
太阳,H . Y。崔,j . H。田,b . H。曹,s . L。张X X, &陈H . g .(2020)。耐药风险评估镰刀菌素graminearum对新型琥珀酸脱氢酶抑制剂吡氟甲醚的研究。病虫害管理科学,76, 1549 - 1559。https://doi.org/10.1002/ps.5675.
唐,G。,Chen, Dawood, d·H。梁,J。,,Y。,z &马(2020)。冠状蛋白调节真菌发育,don -毒体的形成和毒力镰刀菌素graminearum.分子植物病理学,21(2), 173 - 187。https://doi.org/10.1111/mpp.12887.
唐,G。,陈,Y。,j . R。Kistler, h·C。&马z(2018)。真菌肌球蛋白I对镰刀菌毒体的形成至关重要。PLoS病原体,14(1) e1006827。https://doi.org/10.1371/journal.ppat.1006827.
Wang L。,冯,Z,王,X, X, X。,&张(2009)。DEGseq:用于从RNA-seq数据中识别差异表达基因的R包。生物信息学,26(1), 136 - 138。https://doi.org/10.1093/bioinformatics/btp612.
尹勇,刘霞,李斌,马忠(2009)。甾醇去甲基化抑制剂耐药菌株的鉴定镰刀菌素asiaticum而且f . graminearum采自中国的小麦。植物病理学,99(5), 487 - 497。https://doi.org/10.1094/PHYTO-99-5-0487.
张、C。陈,Y。,,Y。,霁,H·H。垫片,w•B。侯,Y。,…妈,z(2015)。一种特异性抑制镰刀菌肌球蛋白I的小分子物种。环境微生物学,17(8), 2735 - 2746。https://doi.org/10.1111/1462-2920.12711.
张、y . J。,J . J。张y . N,张,X。,Cheng c . J。,J . X。……周,m . g .(2009)。多菌灵抗性对毛霉烯生成和侵袭性的影响镰刀菌素graminearum.分子植物-微生物相互作用,22(9), 1143 - 1150。https://doi.org/10.1094/mpmi-22-9-1143.
张、y . J。,X。,陈,c . J。周,m·G。h . c & Wang(2010)。杀菌剂JS399-19、偶氮菌酯、丁唑唑、多菌灵对冬小麦生理生化指标及籽粒产量的影响农药生物化学与生理,98(2), 151 - 157。https://doi.org/10.1016/j.pestbp.2010.04.007.
赵,X。,智,问:问,李,j . Y。凯勒,n . P。&他z . m .(2018)。抗氧化剂没食子酸通过调节转录因子farb和creA抑制黄曲霉毒素的形成。毒素(巴塞尔),10(7), 270年。https://doi.org/10.3390/toxins10070270.
周志,段勇,周敏(2020)。多菌灵抗性相关的β2-微管蛋白取代通过减少β2-微管蛋白与IDH3的相互作用来增加脱氧雪腐镰刀菌醇的生物合成镰刀菌素graminearum.环境微生物学,22(2), 598 - 614。https://doi.org/10.1111/1462-2920.14874.
布什内尔,W. R.,黑森,B. E.和普里奇,C.(2003)。赤霉病的组织生理学研究。《小麦和大麦枯萎病》(Leonard, K.J.和Bushnell, W.R主编)。圣保罗,明尼苏达:APS出版社,44-83页。
确认
感谢浙江大学马中华教授为我们提供f . graminearumPH-1:: Tri1-GFP突变。我们感谢American Journal Experts (Durham, North Carolina, USA)的英语母语科学家编辑我们的手稿。
资金
国家自然科学基金项目[31772118,31901936]、江苏省自然科学基金项目[BK20181246]、西藏自治区重点研发计划项目[XZ202001ZY0038N]资助。
作者信息
作者及隶属关系
贡献
Xin Liu参与了数据的获取,文章的初稿和关键修改,最后的审批;数据分析由方欣、王爽、吴德良、高涛参与;Yin-Won Lee, Sherif Ramzy Mohamed和Jianhong Xu参与数据采集和数据咨询;本论文由纪方、史建荣两人构思设计。所有作者都阅读并批准了手稿。
作者的信息
刘鑫,方鑫,王爽,季芳,徐建宏,石建荣(江苏省农业科学院食品安全与营养研究所;江苏大学);吴德良,高涛(江苏省农业科学院食品安全与营养研究所),李胤元(江苏省农业科学院和首尔国立大学食品安全与营养研究所),Sherif Ramzy Mohamed(埃及国家研究中心)。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益冲突。史建荣博士和李胤元博士是《食品生产、加工和营养》编辑委员会的成员,他们没有参与杂志对这篇手稿的评审或相关决定。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
本研究使用的寡核苷酸引物及其相关特性。表S2。差异表达基因(DGEs)对0.5% (w/v) MG处理的反应f . graminearum.表S3。用GO分析了0.5% MG (w/v)处理对DGEs的响应f . graminearum.表S4。用KEEG分析了对0.5% MG (w/v)处理的DGEs反应f . graminearum.
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
刘X,方X,王S。et al。抗氧化剂没食子酸甲酯抑制真菌生长和脱氧雪腐镰刀醇的产生镰刀菌素graminearum.食品生产加工与营养3., 27(2021)。https://doi.org/10.1186/s43014-021-00070-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s43014-021-00070-0
关键字
- 镰刀菌素graminearum
- 抗氧化剂没食子酸甲酯
- Deoxynivalenol生产
- 作用机制