摘要
客观的
本研究的目的是测量特发性常压脑积水(INPH)和阿尔茨海默病(AD)患者侧脑室、高凸蛛网膜下腔和Sylvian裂区的脑脊液(CSF)体积,并评估这些体积在INPH组和AD组以及健康对照组之间的差异。
方法
49例INPH患者、59例AD患者和26例健康对照者采用自动三维体积MRI成像。
结果
INPH患者侧脑室和脑脊液间隙比其他组大,高凸蛛网膜下腔间隙比其他组小,AD患者侧脑室和脑脊液间隙比对照组大。INPH组侧脑室容积与高凸蛛网膜下腔容积呈负相关,AD组侧脑室容积与Sylvian裂区脑脊液间隙容积呈正相关。侧脑室与高凸蛛网膜下腔体积之比曲线下面积为0.990,可作为INPH与AD的鉴别指标。
结论
脑脊液容量之间的关联表明,在INPH和AD之间可能存在不同的机制来解释它们各自的侧室扩张。侧脑室与高凸蛛网膜下腔容积的比值区分INPH与AD具有良好的诊断敏感性和特异性。我们建议将这一比率称为VOSS(脑室/蛛网膜下腔)指数。
介绍
特发性常压脑积水(INPH)是一种可治疗的神经系统疾病,其特征为脑室扩张(埃文斯指数> 0.3),腰椎穿刺时脑脊液(CSF)压力正常,并伴有认知障碍、步态障碍和尿功能障碍的症状[1]。脑室肿大是INPH的独特形态学特征。
阿尔茨海默病(AD)是老年人痴呆症的最常见原因。虽然脑室肿大是INPH的主要形态学特征,但在AD中也可见[2]。AD患者表现为弥漫性脑萎缩,导致继发性脑室增大。此外,脑萎缩作为衰老的结果可以延长心室扩张。在临床情况下,步态障碍也是AD中常见的[3.]。
仅根据标准MRI表现很难将伴有非阻塞性心室增大的INPH与伴有室性膨大的AD区分开来[1]。由于临床表现和病程的多变性,INPH的诊断变得复杂。1]。然而,诊断INPH也很重要,因为INPH被认为是一种可逆的神经退行性疾病。因此,通常需要进行额外的鉴别诊断检查。
高凸性和内侧蛛网膜下腔的紧密性,在冠状面MRI切片上最为明显,是INPH的一个众所周知的特征[4]。因此,高凸性紧密度被认为是区分INPH和AD的另一种影像学特征[2]。脑室肿大、高凸性紧性和Sylvian裂扩张的影像学特征被称为“不成比例增大的蛛网膜下腔脑积水”(DESH) [2]。在一些研究中,已经注意到DESH在将INPH与其他神经系统疾病区分开来方面的作用[2]。然而,对于缺乏经验的医生来说,在MRI图像上评估DESH可能很困难。这种视觉解释的定性性质已被认为是其临床应用的主要缺点[5]。一般而言,与目测方法相比,自动测量方法更为客观和可靠,并能提供精确的区域脑容量测量[6]。
关于脑脊液间隙的体积测量有三项研究,包括侧脑室、高凸蛛网膜下腔和脑脊液裂隙区脑脊液间隙;然而,这些研究分别只包括11名、12名和19名INPH参与者[7,8,9]。其中一项研究使用人工圈定方法进行体积分析[7]。然而,在连续的脑切片上手动跟踪ROI是耗时的,并且在测量过程中可能包含很大的误差[8]。其中两篇报道了基于体素形态学(VBM)的脑脊液空间分析可用于确定INPH患者脑脊液空间的特征性改变[8,9]。然而,他们只检查了两个脑脊液空间容积,因为他们在一个容积中结合了侧脑室和Sylvian裂缝区域,在另一个容积中结合了高凸起的蛛网膜下腔。先前一项针对29例INPH患者的研究报告称,在疑似INPH患者的计算机断层扫描中,Sylvian裂缝的二维面积与蛛网膜下腔空间之间的比例是一种可靠的工具,可以轻松量化DESH,但他们没有检查AD患者[5]。
在这项研究中,我们利用自动三维容积法研究了三组患者的关键脑脊液间隙(即侧脑室、高凸蛛网膜下腔和Sylvian裂区脑脊液间隙)的体积:(1)脑脊液穿刺试验(CSFTT)阳性反应的INPH患者,(2)年龄匹配的AD患者,(3)健康对照。本研究的目的是评估三组患者脑脊液空间体积的差异,并探讨INPH和AD患者侧脑室体积、高凸蛛网膜下腔体积和Sylvian裂区脑脊液空间体积之间的关系。由于侧脑室扩张和高凸性紧密性经常在INPH中同时发生,我们研究了两者的比例,以区分INPH和AD。
方法
参与者
前瞻性招募2013年6月至2017年3月访问韩国庆北国立大学七谷医院神经退行性疾病中心的INPH患者。采用Relkin等标准诊断INPH [1]。对每例INPH患者进行腰椎穿刺,抽出30 - 50ml脑脊液。脑脊液穿刺后,对患者进行韩国迷你精神状态检查(K-MMSE)、INPH评分量表(INPHGS)和定时向上和向前测试(TUG)重新评估。在7天内多次评估步态变化,并在1周时评估认知和排尿的变化。CSFTT反应的定义采用以下3个主要量表[10]。根据日本的INPH指南,对CSFTT有积极反应的INPH患者被纳入[10]。
随机选择本院AD患者和健康对照,按年龄与INPH患者匹配。AD的诊断采用McKhann等人的标准[11]。健康对照标准为:检查神经功能正常;无活动性神经、全身或精神疾病;以及独立工作的能力。使用K-MMSE评估健康对照者的整体认知。
核磁共振成像采集
MRI数据使用3.0 T系统(GE Discovery MR750, GE Healthcare)获得。获得全头部三维t1加权、矢状面和反转恢复快速破坏梯度回波(IR-FSPGR) MRI图像,该图像被设计为最佳区分脑组织(矢状面切片厚度1.0 mm,无间隙,TR = 8.2 ms, TE = 3.2 ms,翻转角度12°,矩阵尺寸256 × 256像素,视场= 240 mm)。
图像分析
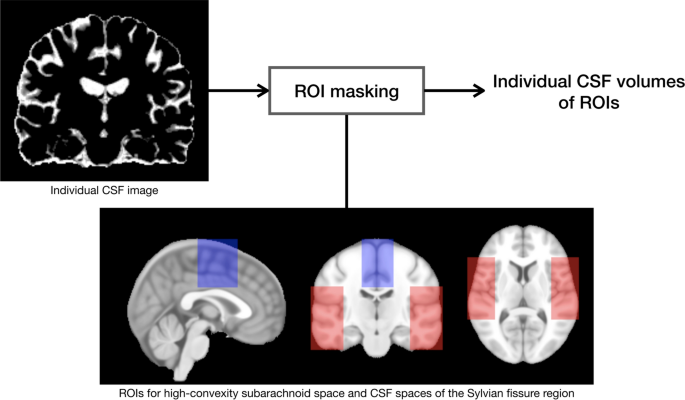
为了定义CSF空间的不平衡分布,应用了以下图像预处理步骤。首先,使用线性变换将原生空间的MR图像注册到国际脑映射协会(ICBM) 152对称模板中,并对强度非均匀性伪像进行校正[12,13]。其次,我们通过自动脑提取算法去除MR图像中所有不需要的部分,包括颅骨、颅外组织、小脑和脑干[14],应用人工神经网络分类器将脑组织分为灰质(GM)、白质(WM)和脑脊液[15]。部分体积水平,由于成像设备的有限分辨率,在组织界面处的MRI强度混合,使用修剪的最小协方差行列式方法进行估计和校正[16]。
我们采用图切算法结合基于图谱的分割来定义侧脑室,这将为下面的图切算法使用先验信息[17]。在ICBM 152对称模板上手工绘制侧脑室,通过非线性配准从单个数据中定义侧脑室[17]。它为图切算法提供了先验信息作为前景种子,用于在图上寻找具有最小切/最大流量算法的全局能量最小函数[17]。通过对每个体素的部分体积概率进行估计,进一步阐述了初始种子的定义[17]。经过图割计算后,对分割结果进行形态学开孔的精细后处理,减少过分割和欠分割的部分[18]。
Talairach坐标系统有一个基于立体定位空间的比例网格,由大脑细分成1056个细胞的扇区组成[19]。这些细胞能够定义特定的区域或解剖结构,以选择同源细胞,并对主体间比较有用。在划分成比例网格之前,将所有数据对齐到一个立体定向空间,该空间将设置位于一条直线水平线上的前连合(AC)和后连合(PC),即所谓的AC-PC线[20.]。我们将塔拉拉赫网格覆盖在立体空间的每个大脑图像上。先前描述的方法用于定义高凸区域和Sylvian裂缝区域的感兴趣区域(roi) [21]。简单地说,确定了侵蚀图像的极端上、下、左、右、前和后边缘,它们定义了Talairach边界框的边缘[21]。在前后方向上,在骶髂关节前和骶髂关节后分别等分四段[21]。AC和PC之间的区域被分成三个相等的部分[21]。从上到下,大脑在AC-PC以上被分成八个相等的区域,在AC-PC以下被分成四个相等的区域[21]。左右脑半球被分成四个相等的矢状区[21]。下面定义的坐标相对于Talairach参考平面表示为网格坐标的数量[例如,vPC(−2)= PC后的两条垂直网格线][21]。
High-convexity区域
该区域AC-PC(+ 3)至AC-PC(+ 8)的优劣程度。该区域矢状地从中线(M)延伸到M(±1个矢状网格分割)。该区域的前后延伸范围从vAC(+ 1)到vPC(0)。
Sylvian裂缝区
该区域从AC-PC(−2)到AC-PC(+ 3)的高低程度。内侧边界用M(±2)定义。侧边用M(±4)定义。该区域的前后延伸范围从vAC(+ 2)到vPC(- 1)。
根据每个细胞限制的CSF分类图估计高凸区和Sylvian裂隙区的CSF数量(图2)。1).除此之外,还将最大连接分量标记操作应用于Sylvian裂隙区域CSF的估计,以去除假阳性[17]。对于体积测量,提取的脑脊液图像被反向配准到每个原生空间。然后,通过脑容量(ICV)对区域脑脊液体积进行归一化,以补偿脑形态和总头大小的个体间差异,这些差异是在预处理步骤中通过自动脑提取算法获得的。归一化后的脑脊液空间体积以ICV比率表示。
统计分析
R版本4.0.3 (https://www.r-project.org)进行统计分析。通过方差分析或Kruskal-Wallis检验比较INPH组、AD组和对照组的脑脊液空间体积,然后进行Tukey事后分析。采用Pearson相关法研究INPH和AD患者侧脑室容积、高凸蛛网膜下腔容积和Sylvian裂区脑脊液容积之间的关系。侧脑室容积/高凸蛛网膜下腔容积比区分INPH和AD的诊断准确性通过曲线下面积、敏感性、特异性和受试者工作特征(ROC)曲线获得的截止水平来计算。统计学显著性设为P< 0.05。
结果
我们招募了49名INPH患者,59名AD患者和26名健康对照。患者和对照组的特征见表1。三组之间没有明显的年龄差异。
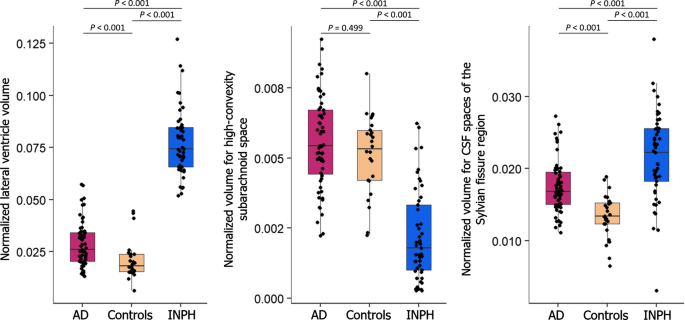
体积测量结果汇总于表中2。三个临床组中所有受试者的单独数据点的箱形图如图所示。2侧脑室、高凸蛛网膜下腔和脑脊液裂隙区的归一化容积。INPH组大鼠侧脑室和脑脊液裂隙区平均容积明显大于其他两组。AD组侧脑室和脑脊液裂隙区平均容积也明显大于对照组。INPH组高凸蛛网膜下腔平均体积明显小于其他两组。AD组与对照组在高凸蛛网膜下腔容积方面无显著差异。
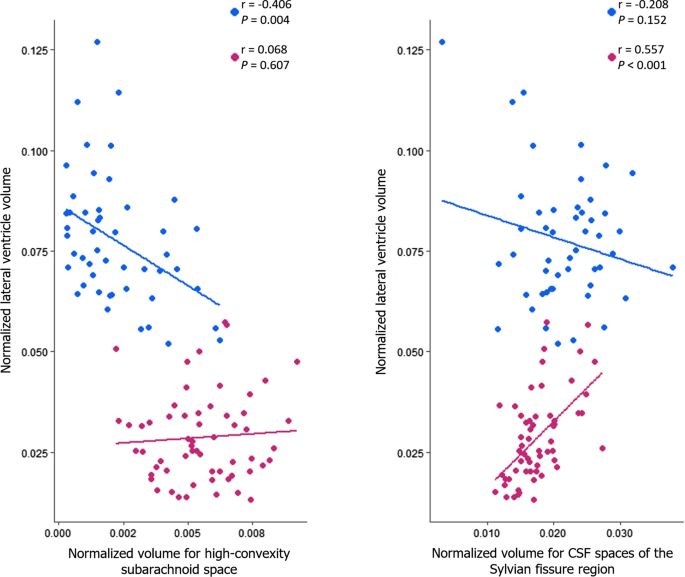
INPH组侧脑室归一化容积与高凸蛛网膜下腔归一化容积呈显著负相关(r = - 0.406;P= 0.004),而在AD组中,两者之间没有相关性(r = 0.068,P= 0.607)。3.).AD组侧脑室归一化容积与Sylvian裂区脑脊液空间归一化容积呈显著正相关(r = 0.557;P< 0.001),而在INPH组中,这两项指标之间没有相关性(r = - 0.208,P= 0.152)(图。3.).
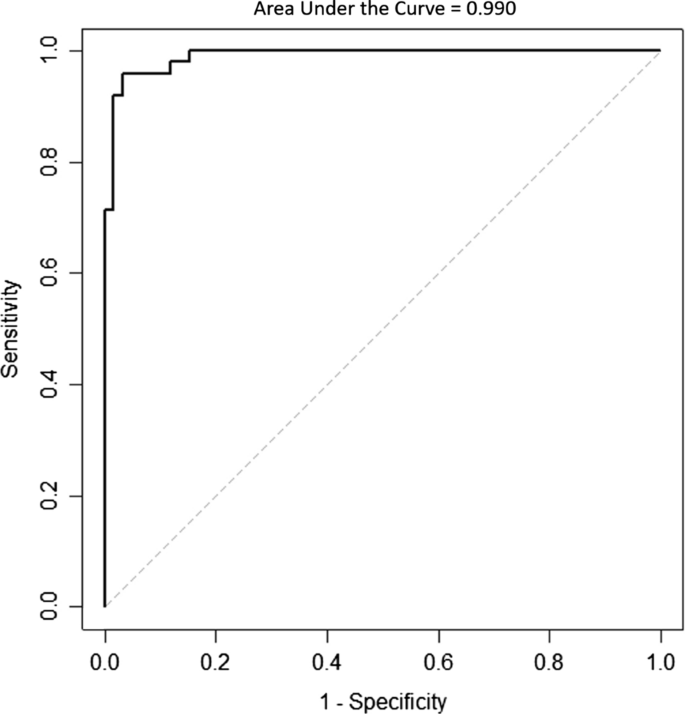
INPH组平均侧脑室容积/高凸面蛛网膜下腔容积比为74.385±80.591,AD组平均侧脑室容积/高凸面蛛网膜下腔容积比为5.742±3.404(平均值±标准差),两者差异有统计学意义(P< 0.001)。ROC曲线显示,侧脑室容积/高凸蛛网膜下腔容积比的临界值为11.714分,在区分INPH和AD患者方面具有最高的敏感性和特异性(图2)。4).ROC曲线下面积为0.990,说明该比值具有较好的判别能力。
讨论
我们的研究结果如下:(1)与其他组相比,INPH患者侧脑室和脑脊液空间在Sylvian裂区较大,蛛网膜下腔高凸性空间明显较小,AD患者侧脑室和脑脊液空间在Sylvian裂区较大;(2) INPH组侧脑室容积与高凸蛛网膜下腔容积呈显著负相关,AD组侧脑室容积与Sylvian裂区脑脊液间隙容积呈显著正相关;(3)侧脑室容积与高凸蛛网膜下腔容积之比在INPH组与AD组间差异有统计学意义,ROC曲线下面积为0.990,截断分数为11.714,对INPH与AD具有较高的敏感性和特异性,具有较好的区分能力。
关于侧室扩张,我们的结果与之前的研究一致,即与AD患者和健康对照相比,INPH患者在该区域的扩张通常最大。与AD患者相比,INPH患者脑室(包括侧脑室、第三脑室和第四脑室)的脑脊液体积显著增加[7]。INPH患者的平均心室容积(包括侧脑室和第三脑室)均大于AD患者和健康对照者的平均心室容积[22]。与对照组相比,AD组有更大的侧室增大[23]。由于先前的研究也显示了类似的结果,INPH患者也显示了Sylvian裂区最大的脑脊液间隙,这是意料之中的结果[7]。此外,INPH患者主要在双侧侧脑室的上部表现出明显的表面扩张,该部分被内侧额叶和额顶区域的高凸起所包围[24]。INPH患者在顶叶、额叶和枕叶的高凸起区域的皮质明显比对照组厚[25],这可能是由于反应性胶质瘤[25],已知常发生于脑积水[26]。反应性胶质瘤的核心过程与细胞肥大有关,而细胞肥大可能与星形胶质细胞增殖有关[27],因此我们谨慎地提出这些可能的机制来解释我们在INPH患者中发现的明显更小的高凸蛛网膜下腔。
如上所述,INPH患者侧脑室容积与高凸面蛛网膜下腔容积呈负相关,其原因可能是侧脑室高凸面周围皮层增厚,侧脑室上部扩张,从而导致高凸面蛛网膜下腔缩小。侧脑室容积与Sylvian裂区脑脊液空间容积呈正相关,这可能与AD患者侧脑室扩张的类型——脑积水有关,这是由萎缩引起的。内侧颞叶萎缩是阿尔茨海默病的中心特征,也是阿尔茨海默病患者大脑最先出现的变化之一[28]。众所周知,颞叶萎缩也可以通过评估颞叶裂的大小来评估[29]。这些区域脑实质的萎缩性改变可使这些区域的脑脊液空间相应增大。因此,解释这些相关性的机制可能在AD和INPH患者之间有很大的不同,但需要进一步的研究来调查这些发现以及可能涉及的任何确切的潜在机制。
侧脑室与高凸蛛网膜下腔容积的比值在INPH组和AD组之间有显著差异。可能将生物标志物组合成一个比率可以消除混杂因素,如个体间差异,或者它们可以更有效地反映病理过程,正如一些关于脑脊液淀粉样蛋白-β和脑脊液tau的研究所表明的那样[30.]。因此,计算侧脑室容积与高凸蛛网膜下腔容积之比似乎也是合理的。我们建议使用术语“VOSS指数”(用于侧脑室与高凸蛛网膜下腔容积的比值),其中“VOSS”是“脑室/蛛网膜下腔”的首字母缩略词。进一步的研究需要更大的研究人群和各种统计工具来建立该指数作为区分INPH和AD的神经成像生物标志物。
这里应用的图像处理方法的优点如下。首先,包括部分体积效应校正在内的分割方法定义了脑室外CSF,使我们能够正确检查特定roi中的CSF体积。然后,将每张MR图像分别转换成一个标准化的立体定向空间,即ICBM 152模板,然后我们使用比例Talairach网格坐标来定义该立体定向空间中高凸区域和Sylvian裂隙区域的roi。一种常见的自动化ROI分析方法是将每个参与者的结构脑图像在空间上归一化为模板脑图像,并使用图谱确定ROI [31]。其次,我们使用了一种自动侧脑室分割方法,该方法采用了一种结合形态学开放和基于图集的分割的图切割算法。该方法通过引入基于图集的分割结果作为图切算法的起始模型来减少用户偏差[18]。此外,对每个组织的部分体积效应的估计可以帮助更准确地定义图形切割的初始模型[18]。形态学打开的作用是去除图像中的小特征。因此,还引入了形态学开口来限制图切方法的错误结果[18]。一般来说,手工定义roi是非常耗时和劳动密集型的,它依赖于专业知识;因此,它带有实验者之间差异的风险[31]。此外,虽然大脑的某些区域可以可靠地定义,但其他区域没有明确的解剖标志,因此可能更难区分[31]。因此,我们所描述的技术组合可能有助于检测INPH患者脑脊液间隙的形态学特征。
所有INPH患者均从我院前瞻性入组的INPH注册表中按连续顺序选择。本研究的一个局限性是我们没有纳入有CSFTT阴性反应的INPH患者。我们这样做是为了提高CSFTT诊断INPH的准确性。伴有CSFTT阴性反应的INPH患者更容易出现其他脑合并症[32]。第二个限制是我们在这项研究中没有确定ad特异性的生物标志物。此外,INPH患者的AD病理也无法确定。脑脊液不能排除可能的有毒代谢物可导致AD或INPH患者的淀粉样肽积聚[33]。脑脊液停滞在INPH患者也可能表现为ad样脑萎缩[34]。然而,我们也认为,在一项针对INPH患者的大型研究中,可能有理由使用脑脊液空间的自动体积测量,包括侧脑室、高凸蛛网膜下腔和Sylvian裂区脑脊液空间。第三个限制是,我们没有比较这里应用的图像处理方法与传统的体积技术(如手动跟踪方法)相比的优势。然而,由于缺乏脑脊液含量评估的金标准,因此无法对不同脑脊液分割技术的价值得出明确的结论[35]。我们的研究结果鼓励未来更大规模的研究,包括其他神经退行性疾病,如血管性痴呆和非典型帕金森病(如进行性核上性麻痹),以及侧脑室与高凸蛛网膜下腔空间体积的比例,以研究利用自动三维体积分析作为区分INPH与其模拟物的成像标记的可能性。影像学特征对INPH诊断准确性的研究主要是将其与健康对照或AD患者进行比较[36]。阿尔茨海默病的神经症状通常与INPH不同[36]。相反,血管性痴呆和非典型帕金森病,如进行性核上性麻痹,通常表现为类似于脑ph和脑室增大的症状,并且可能具有挑战性的鉴别诊断[36]。
总之,本研究提供了一种自动三维容积法来评估脑脊液空间。INPH患者侧脑室与高凸蛛网膜下腔体积呈负相关,而AD患者侧脑室与Sylvian裂区脑脊液体积呈正相关。脑脊液容量之间的这些关联表明,在INPH和AD之间可能存在不同的机制来解释它们各自的侧室扩张。侧脑室与高凸蛛网膜下腔容积的比值区分INPH与AD具有良好的诊断敏感性和特异性。我们建议将这一比率称为VOSS指数。这些发现可能对INPH和AD的鉴别诊断有指导意义。
数据和材料的可用性
支持本研究结果的数据可应通讯作者(K.K.和U.Y.)的要求提供。由于研究所的政策,这些数据是不公开的。
参考文献
李建军,李建军,李建军,李建军。特发性常压脑积水的诊断。神经外科。2005;57(3增刊):S4−16。
成田W, Nishio Y, Baba T, Iizuka O, Ishihara T, Matsuda M,等。高凸紧度预测特发性常压脑积水的分流反应。[J] .神经学报,2016;37(10):1831-7。
O 'Keeffe ST, Kazeem H, Philpott RM, Playfer JR, Gosney M, Lye M.老年痴呆症步态障碍的临床研究。老龄化。1996;25(4):313-6。
Hashimoto M, Ishikawa M, Mori E, Kuwana N.特发性正常压力脑积水的诊断支持基于mri的方案:一项前瞻性队列研究。脑脊液杂志。2010;7:18。
Benedetto N, Gambacciani C, Aquila F, Di Carlo DT, Morganti R, Perrini P.一种评估特发性常压脑积水患者蛛网膜下腔过大(DESH)的新定量方法:SILVER指数。中华神经外科杂志。2017;38(4):391 - 391。
van den Heuvel DM, ten Dam VH, de Craen AJ, admiral - behloul F, van Es AC, Palm WM,等。测量纵向白质变化:视觉评定量表与体积测量的比较。刘志强,刘志强,刘志强,等。中国生物医学工程学报。2006;27(4):875 - 878。
Kitagaki H, Mori E, Ishii K, Yamaji S, Hirono N, Imamura T.特发性常压脑积水脑脊液间隙的形态学和容量测定。刘志强,刘志强,刘志强,等。中国生物医学工程学报。1998;19(7):1277 - 1284。
山下F,佐佐木M,高桥S,松田H,工藤K, Narumi S,等。基于体素的形态测量法检测特发性常压脑积水脑脊液间隙的变化。神经放射学。2010;52(5):381 - 6。
Yamashita F, Sasaki M, Saito M, Mori E, Kawaguchi A, Kudo K,等。基于体素的不成比例脑脊液空间分布形态学在特发性常压脑积水鉴别诊断中的应用。中华神经医学杂志,2014;24(4):359-65。
石川M,桥本M, Kuwana N, Mori E, Miyake H, Wachi A,等。特发性常压脑积水的治疗指南。中华神经医学杂志。2008;48(增刊):1-23。
McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR, Jr., Kawas CH等。阿尔茨海默病引起的痴呆的诊断:来自国家衰老研究所-阿尔茨海默病协会工作组关于阿尔茨海默病诊断指南的建议。老年痴呆症。2011;7(3):263-9。
李建军,李建军,李建军,等。磁共振成像数据强度非均匀性自动校正的非参数方法。医学影像学报。1998;17(1):87-97。
张建军,李建军,李建军,等。基于三维空间的三维磁共振体配准方法。计算机辅助设计[J] .计算机工程学报,1994;18(2):192-205。
史密斯SM。快速稳健的自动大脑提取。人类大脑绘图。2002; 17(3): 143 - 55。
张建军,张建军,张建军,等。三维MRI数据自动“流水线”分析:在多发性硬化症临床试验中的应用。医学影像学报。2002;21(10):1280-91。
张建军,张建军,张建军,等。脑MRI统计部分体积模型的快速鲁棒估计。科学杂志。2004;23(1):84 - 97。
李志强,李志强。基于图割算法和形态学的侧脑室自动分割。生物医学工程学报,2017;38(2):82-8。
郭坤,尹宇,李德奎,金根根,徐世文,罗德林,等。基于图谱分割和形态学开放的全自动海马分割方法。磁共振成像,2013;31(7):1190-6。
Desco M, Pascau J, Reig S, Gispert JD, Santos A, Benito C,等(编)使用Talairach网格的多模态图像量化。医学成像2001:图像处理。国际光学与光子学学会。2001
Andreasen NC, Rajarethinam R, Cizadlo T 2nd, Arndt S, Swayze VW, Flashman LA,等。基于地图集的磁共振图像人脑区域体积自动估计。计算机辅助设计[J] .计算机工程学报,1996;20(1):98-106。
戴德,高方强,Kovacevic N, Roy P, Rockel C, O 'Toole CM,等。半自动脑区提取:一种从结构磁共振图像中分割脑区的方法。科学杂志。2004;22(4):1492 - 502。
Miskin N, Patel H, Franceschi AM, Ades-Aron B, Le A, Damadian BE,等。正常压力脑积水的诊断:在体积磁共振成像时代使用传统方法。放射学。2017;285(1):197 - 205。
Nestor SM, Rupsingh R, Borrie M, Smith M, Accomazzi V, Wells JL等。使用阿尔茨海默病神经成像倡议数据库验证了心室扩大作为阿尔茨海默病进展的可能测量。脑科学,2008;131(9):2443-54。
姜坤,郭坤,尹宇,李建民。特发性常压脑积水患者侧脑室增大和皮质变薄。科学通报,2018;8(1):13306。
姜坤,韩军,李世文,郑世文,林玉华,李建民,等。特发性常压脑积水的异常皮质增厚和变薄。科学通报,2020;10(1):1 - 2。
米勒JM,麦卡利斯特JP 2。脑脊液分流治疗实验性脑积水减少星形胶质细胞和小胶质细胞增生。脑脊液杂志,2007;4:5。
Sofroniew MV。反应性星形胶质细胞在神经修复和保护中的作用。神经学家。2005;11(5):400 - 7。
de Leeuw FE, Korf E, Barkhof F, Scheltens P.白质病变与阿尔茨海默病内侧颞叶萎缩进展相关。中风。2006;37(9):2248 - 52。
Davis PC, Mirra SS, Alazraki N.,老年痴呆症患者的大脑:MR, PET和SPECT图像的发现。杨建军,刘建军,刘建军,等。生物医学工程学报。2009;32(6):1263 - 1268。
李建军,李建军,李建军,等。脑脊液神经颗粒蛋白/BACE1比值是阿尔茨海默病认知能力下降的潜在相关因素。阿尔茨海默病杂志,2016;53(4):1523-38。
Garrison KA, Rogalsky C, Sheng T, Liu B, Damasio H, Winstein CJ,等。受损大脑的功能性MRI预处理:手动与自动感兴趣区域分析。《前沿神经杂志》2015;6:196。
姜坤,高鹏伟,靳敏,石坤,李宏伟。特发性常压脑积水、脑脊液生物标志物和脑脊液抽头试验。临床神经科学杂志,2014;21(8):1398-403。
Silverberg GD, Mayo M, Saul T, Rubenstein E, McGuire D.阿尔茨海默病、常压脑积水和脑脊液循环生理衰老变化的假设。中华神经科杂志,2003;2(8):506-11。
Hilal S, Xin Xin, Ang SL, Tan CS, Venketasubramanian N, Niessen WJ,等。亚洲人群皮质厚度的危险因素和后果。医学。2015;94 (23):e852。
Via E, Cardoner N, Pujol J, Martinez-Zalacain I, Hernandez-Ribas R, Urretavizacaya M,等。忧郁性抑郁症的脑脊液间隙改变。PLoS ONE。2012; 7 (6): e38299。
Fällmar D, Andersson O, Kilander L, Löwenmark M, Nyholm D, Virhammar J.特发性常压脑积水的影像学特征与血管性痴呆和非典型帕金森病的相关性较高。液体阻碍中枢神经系统。2021; 18(1): 35。
致谢
作者要感谢Emareye的Wade Martin对本书进行了批判性的英文修订。
资金
本研究由教育部国家研究基金(NRF)基础科学研究计划(NRF- 2019r1d1a3a03103893, NRF- 2019r1i1a3a01053926, NRF- 2021r1i1a3058731)资助。
作者信息
作者及单位
贡献
JH:概念化、方法论、验证、形式分析、调查、数据整理、撰写原稿、可视化。MNK:数据管理,原创写作,可视化。H-WL:资源,数据管理。SYJ:概念化、方法论、形式分析、数据管理、资金获取。S-WL:概念化、方法论、形式分析、数据管理。y:概念化、方法论、验证、形式分析、调查、数据管理、写作审查和编辑、可视化、监督、项目管理、资金获取。KK:概念化、方法论、验证、形式分析、调查、数据管理、写作审查和编辑、可视化、监督、项目管理、资金获取。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究方案经庆北大学漆谷医院机构审查委员会批准。所有的方法和程序都是按照相关的指导方针和规定进行的。所有的研究参与者都对这项研究给予了知情的书面同意,包括临床数据和MRI相关的信息。每位患者还同意接受脑脊液穿刺测试。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
韩杰,金,M.N,李,HW。et al。特发性常压脑积水和阿尔茨海默病脑脊液分布的独特体积特征。流体屏障19, 66(2022)。https://doi.org/10.1186/s12987-022-00362-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12987-022-00362-8
关键字
- 特发性常压脑积水
- 脑脊液间隙
- 磁共振成像
- 阿尔茨海默病