摘要
背景
动物门的发育策略范围很广,但大多数关于成体计划形成的见解来自于直接发育的物种。对于间接发育的物种,有不同的幼虫和成虫的身体计划,通过变态连接在一起。在间接发育生物的发育过程中,一些悬而未决的问题包括幼虫组织在蜕变过程中发生细胞死亡的程度,以及将产生成虫的组织起源于何时何地。细胞分裂和细胞死亡的过程如何重新设计间接发育者的身体计划?在本研究中,我们介绍了半蒴虫幼虫体计划发育、变态和成虫体计划形成过程中细胞增殖和细胞死亡的模式Schizocardium锎(Cameron and Perez in Zootaxa 3569:79-88, 2012)来回答这些问题。
结果
我们发现在幼虫和成虫体平面形成之间有明显的细胞增殖模式美国californicum.我们发现一些成虫组织在明显变态开始前的幼虫后期增殖。此外,使用辐射和转录组学方法,我们描述了增殖细胞在生活史状态中共享的遗传标记,以及幼虫或幼崽状态所特有的标记。最后,我们观察到细胞死亡在幼虫阶段是最小的,但开始于变态的开始。
结论
发育过程中的细胞增殖美国californicum在形成幼虫和成虫的身体计划方面有不同的模式。然而,细胞死亡在幼虫中是非常有限的,并在变态开始时开始,并在特定区域进入幼年发育早期。增殖并产生幼虫和幼体的细胞群具有一种遗传特征,表明增殖祖细胞群是异质的,而不是一种单独的多能细胞群。综上所述,我们提出美国californicum在细胞水平上反映,可能更能代表许多后生动物变态的发育策略。
背景
动物身体形态的发展在很大程度上是通过对一些关键模式物种的研究得知的,这些模式物种在胚胎发生期间形成了成体形态,这种策略被称为直接发育。然而,这种类型的发育并不代表许多动物群体,在这些动物群体中,胚胎发生产生的幼虫的身体结构与成虫的截然不同,这种策略被称为间接发育[2,3.,4].在直接发育过程中,成虫直接由胚胎形成,而在间接发育过程中,胚胎过程产生幼虫体,然后转化为成虫。幼虫和成虫之间的这种转变是一种被称为变态的发育过程,其特征是幼虫特有结构的丧失和成虫结构的出现[5,6,7,8,9,10,11].这种发育策略在动物门中的普遍存在清楚地表明,更好地理解间接发育的机制对于更全面地理解身体计划进化的发育基础是至关重要的。
许多海洋生物利用间接发育,首先发育为幼虫,在达到变态之前进食和生长[12,13].在一些物种中,例如有绒毛幼虫的腹足类,幼虫和成虫体平面的形态差异不是很明显,因为在这些生物中,变态只代表生态位的重大转移,而不是较大的形态变化[14,15].在光谱的另一端,正如在一些棘皮类动物中发现的那样,幼虫和成虫的身体计划在组织上可能完全不同,具有“灾难性的变态”。在这种情况下,成虫在幼虫中作为雏形发育,而变态除了失去幼虫结构外,还导致身体在新的发育轴周围完全重组[5,16,17].同样地,在一些有柱头幼虫的nemerte蠕虫中,成虫由几个雏形发育而成,并在幼体吞噬幼虫组织时达到变态的高潮[17,18].然而,具有不同幼虫和成虫体结构的物种的变态并不总是涉及分离的初始形态或灾难性的变态——相反,幼虫组织似乎迅速重塑成成虫,而没有明显的幼虫体结构的剧烈组织分解[2,15,19].在这种类型的变态中,成体结构起源于一小部分增殖细胞吗?幼虫组织的命运如何?间接发育的半齿果代表了这种特殊类型的变态,并为探索这种类型的发育策略提供了机会。
半足虫由两类组成,一是独居的肠虫,二是大量聚居的管栖翼支虫[20.,21,22,23].虽然半绳动物是棘皮动物的姐妹,与脊索动物密切相关的地位已经得到了很好的确立[24,25,26,27],新的研究对这一观点提出了挑战[28].在肠虫中,有一个科,哈里虫科,是直接发育的,而Spengelidae和Ptychoderidae,是间接发育的,具有独特的幼虫体计划,称为tornaria。对托纳螺幼虫及其对应的成体的形态学研究可追溯到19世纪晚期[29,30.]和更近的形态描述的幼虫和成虫体计划已在一系列的enteropneust种;Ptychodera黄颜色[31,32),Balanoglossus misakiensis[33),Balanoglossus simodensis[34),美国californicum[35].在这些物种中,托纳鱼的幼虫是在胚胎发生后形成的,而底栖动物的成虫则是在延长的浮游期后通过变形形成的[31,33,34,35,36].半芒枣复杂生命周期的研究主要基于形态特征,也有一些描述性的模式研究[37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53].然而,通过变态的细胞和发育机制在很大程度上仍未被描述。例如,我们不知道成虫是由幼虫组织通过转分化转化形成的,还是由大规模幼虫细胞死亡后成虫特异性细胞的增殖形成的。
为了开始解决这些问题,我们通过细胞的发育和变态来描述细胞的增殖和死亡美国californicum.为了我们的研究目的,我们将变态定义为美国californicum作为一个明显的形态事件。在短短的48小时内,游动的浮游幼虫转变为穴居底栖成虫,幼虫的外胚层压实并凝结在底层的中胚层和内胚层上[35].我们发现在幼虫和成虫的身体计划之间有明显的细胞增殖模式,并且明显的明显变态的开始与细胞死亡的增加相对应。为了确定增殖细胞是否存在不同的遗传标记,以及这些标记是否在生命历史阶段不同,我们采用了辐射策略来耗尽增殖细胞,并发现了许多差异表达的转录本。
结果
幼虫和成虫的增殖模式。
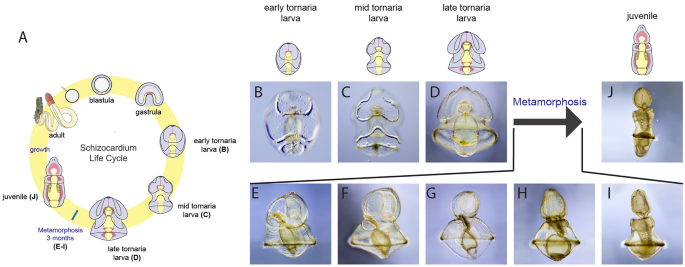
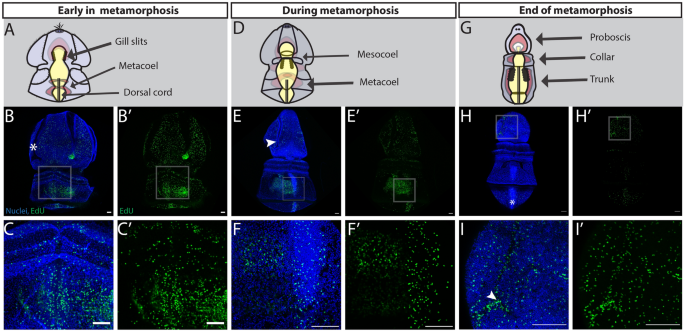
我们想要测试参与浮游幼虫发育的细胞增殖模式是否与底栖幼体发育期间的模式相似或不同。描述增殖细胞在发育过程中的分布s . californicum我们评估了胸苷类似物5-乙基-29-脱氧尿苷(EdU)的掺入,它标记S期细胞[54],在一系列发育阶段:早期幼虫发育(图;1B),幼虫中期发育(图;1C),幼虫发育后期(图;1D),变质(图;1E-I)和青少年发育(图。1J)。
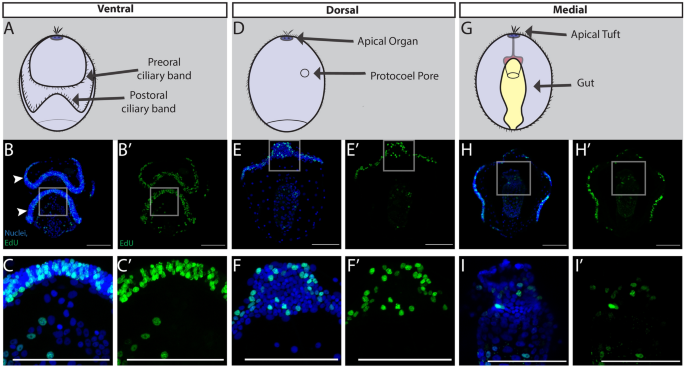
幼虫最早的发育阶段包括紧密包裹在幼虫周围的纤毛带、薄而宽的鳞状上皮、一根尖簇和三部肠(图2)。1B,2).在腹面我们检测到EdU+细胞遍及口周睫状带的口前袢和口后袢(图2)。2B, C).睫状带在此阶段用于游泳和粒子捕获[55,56,57]并在外胚层中占很大比例。我们测试了纤毛带是否比一般的外胚层更具增殖能力,或者仅仅是具有更高的细胞密度。睫状带细胞核密集排列:睫状带细胞数量比所有其他组织(成对)多59%t测试,p = 0.016),它们的增殖能力也更高,Edu增加了约22%+细胞比所有其他组织(配对ttest, p = 0.008)(附加文件1: S1A, B)。这表明,虽然纤毛带是核密集区域,但它们似乎是这一阶段最具增殖性的结构之一。这种模式与其他游动动物的纤毛带相一致,如双鳍虫幼虫海星ochraceus而且Patiria miniata[58].在幼虫的背侧最前面的区域,EdU+在根尖器官周围检测到细胞(图;2E, F),是幼虫神经系统的突出结构[59,60,61,62].幼虫的其他重要增殖结构包括消化道,被纤毛带捕获的微藻从口腔进入咽,最后进入胃,在那里它们被消化(图2)。2H, I)。一般来说,在幼虫早期,大多数区域和组织都含有增殖细胞。
随着托纳虫继续生长,并达到幼虫发育的中期(图2)。1C,3.),表现为背鞍和腹鞍的分化以及后尖突的出现,增殖继续贯穿睫状肌束。这在腹侧口前和口后睫状带最为明显。3.B).在发育中的前突、睫状肌后运动带中检测到增殖细胞(图。3.C).端突突突是半齿状托纳亚目最独特的结构之一,具有长而复合的纤毛,通过拍打推动幼虫在水中游动[57].在背表面,原生孔在此阶段增生(图。3.E, F).该结构是幼虫原肠泌系统的一部分,该排泄系统使用纤毛驱动的气流对原肠泌液进行超滤[63,64].最后,在这一阶段,最后一个值得注意的结构是由咽、胃和肠组成的三方肠道,它继续增殖和生长(图2)。3.H, I)。
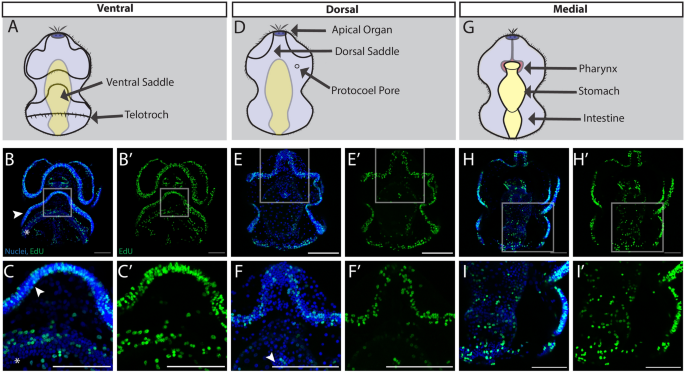
在接近变态时,金枪鱼幼虫达到完全大小(约3毫米),并形成另外两对体腔,即中腔和中腔,以及鳃缝的前体[65,66(无花果。1D,4),我们观察到增殖模式与早期发育阶段有显著变化。增殖细胞仍然分布于腹侧外胚层,包括睫状带,但现在也更广泛地分布于睫状带之间的鳞状上皮(图2)。4B).也有一些EdU+细胞广泛分布于幼虫的后外胚层,这是一个在变态过程中会压缩和伸长的区域(图2)。4C).在晚期幼虫的背表面,有大量的增殖细胞分布在整个上皮细胞(图。4E)+细胞遍及末突和背脊索开始形成的背中线两侧(图2)。4F).也许最有趣的是,在这个阶段,肠道停止增殖和EdU+在形成的成体结构中检测到细胞(图;4H).我们特别观察到EdU+鳃缝内的细胞是幼鱼体平面的一个显著的内胚层特征,但在晚期幼虫中还没有功能[67(图。4我)。EdU+细胞也富集在单一的前路方案(图。4J),以及更多的成对后中膜(图。4K)和元孔(图。4L),它们将分别形成成人的喙、颈圈和躯干的中胚层衍生物。根据之前的形态学观察,在幼虫晚期,幼体计划的结构开始增殖,在变态前构建成体解剖结构[35].
幼虫发育后期细胞增殖美国californicum.全部:前上;蓝色= Hoechst,绿色= EdU;比例尺为100 um。腹侧平面图(一个)、背侧(D)和内侧(G)带有键结构标签的视图。EdU染色最大强度投影B)、背侧(E)和内侧(H)部分。B晚期幼虫腹面,C附页(B),突出腹侧后表皮及睫状带E晚期幼虫背表面,F附页(E)以白色星号标出背索,H幼虫晚期内侧部分,箭头突出的区域将产生主孔、中孔和中孔。我幼虫晚期内侧侧面图插图,箭头突出鳃条。J原型,形成长鼻的中胚层,K中胚层,形成项圈的中胚层,l中胚层,形成树干。米,N抗组蛋白H3 (phospho S10)和EdU阳性细胞在睫状体带的分布,洋红色= pHH3.3,灰色=乙酰化微管蛋白
我们还更详细地观察了睫状肌束的增生模式(图2)。4为了达到这一目的,我们将EdU检测与乙酰化微管蛋白的免疫荧光染色相结合,以显示纤毛和组蛋白H3的磷酸化丝氨酸10 (pHH3.3),这标志着细胞处于G2/M期。我们发现增殖细胞在一排EdU上有明显的空间分布+然后是纤毛外侧一排分化的磷酸化组蛋白h3.3细胞(图2)。4M, N). EdU的区域定位+与分化的磷酸化组蛋白h3.3细胞相关的细胞表明,可能存在一种特定的增殖细胞群,产生纤毛带。
增殖模式在变态时发生变化
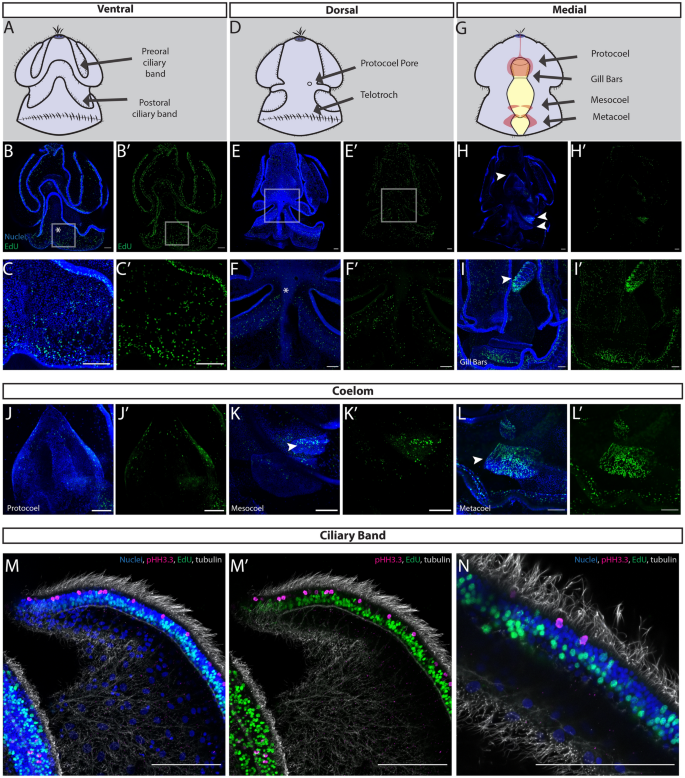
年开始变态的第一个形态学标志美国californicum是幼虫表皮的压实和重组,以及所有体腔的扩张,导致胚腔空间缩小(图。1E, f) [35].在变态早期,初级腹侧裂片和初级背侧裂片的外胚层围绕着侧食物槽紧密相连,如在p .黄色的[66]和EdU+细胞分布于外胚层的多个区域(图;5B)。EdU+在形成长鼻和增厚颈圈周围的后野和原发背鞍处检测到细胞。5B)在这个阶段,EdU+在颈圈和发育中的背索区域也发现了细胞。5C).在腹面,EdU+细胞的分布与背侧相似,在口前野、项圈周围、鳃缝的生长区和腹索最终形成的表皮中都有增殖细胞(附加文件)1:就是S1C)。
随后,随着胚腔减少,未来的喙外胚层继续增厚,使其与扩张的前体腔接触(图。1G, H).后外胚层随着形成干的继续伸长而继续扩张。在这一阶段,外胚层增殖继续在长鼻的一般表皮,但在纤毛带的残余部分不存在。5E).当幼虫开始呈现蠕虫形时,喙的表皮转变为柱状组织。这个阶段的其他增殖区域包括发育中的鳃缝、中孔和背索(图。5F).在这一阶段,前外胚层腹侧表面发生增生,类似于背侧表面,没有睫状带所在的位置(补充文件)1: S1D)。EdU+在项圈周围和腹侧索形成的区域周围也检测到细胞(附加文件)1: S1D)。
最后,喙胚腔空间被消除,中胚层和外胚层直接接触,喙外胚层和颈圈转变为柱状上皮,后体腔随着躯干的拉长和变窄而扩张分化(图。1在这一阶段,我们在喙部、颈圈、背索以及更广泛的近端外胚层和中胚层下部检测到增殖细胞(图2)。5H).在长鼻外胚层有EdU+细胞分布,EdU明显富集+侧沟的细胞,这一区域以前是幼虫的食物沟(图2)。5I).变态阶段的侧面视图,突出了鳃缝和肠道以及产生神经索的背侧和腹侧中线的细胞增殖(附加文件)1: S1E)。
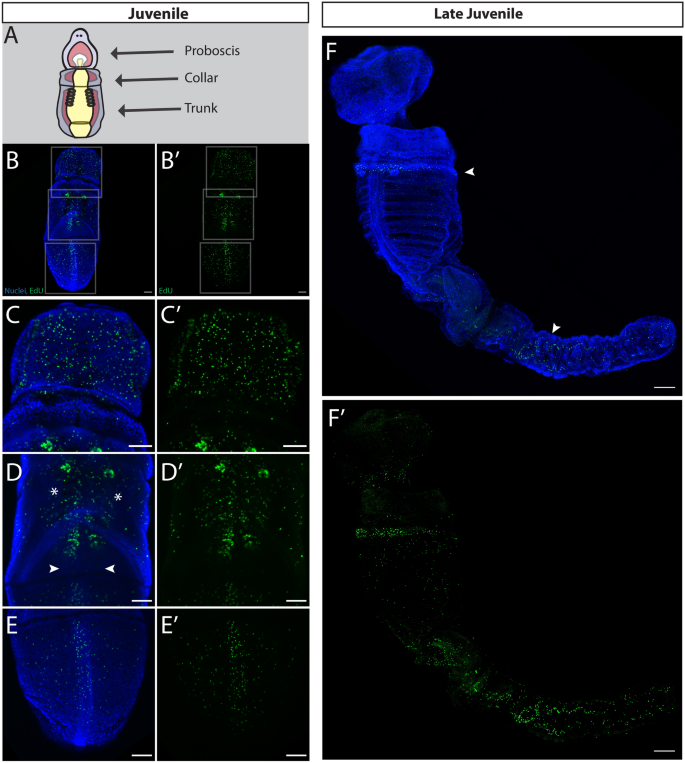
在新形成的幼鱼的三个主要区域(图。1J),在喙部、项圈、鳃孔、鳃棒、干等部位均有细胞增殖(图。6B)幼鱼的前部,EdU+细胞定位于表皮,并沿外侧沟和前领排列(图2)。6C)动物的这一区域神经高度支配[35].在鳃背孔中也发现了增殖细胞,这些孔已经穿孔,使水可以流过鳃缝并从鳃孔中流出。6D)。最后,在新形成的幼龙的后部,增殖细胞位于躯干的背索(图。6E).在这个阶段,我们在腹侧表面检测到EdU+细胞在长鼻,鳃缝,和腹索(附加文件1: S1F)。为了观察这些幼体的生长模式在变态后是否能很好地继续下去,我们在沙子中培养了几周的动物,并重复EdU标记,清除组织,以便能够在更大、更厚的组织中观察增殖的分布。在幼体的持续生长中(图;6F)在项圈底部发现增殖细胞与色氨酸能神经元一致[35].有趣的是,在这个后期,鳃缝和背索的细胞增殖不太明显,但大量EdU+细胞在躯干的肠道中部发现,这可能是一个新的后部生长区域[68].
作为美国californicum增殖细胞从不同的幼虫通过变态转化为幼虫,它们的分布发生了变化,限制在幼虫体内的特定区域。总的来说,我们的数据表明,成虫体计划的增殖开始于幼虫后期,早于变态本身的开始。
辐照后的RNAseq揭示了增殖细胞在两种不同生活史状态下的遗传特征
目的:进一步探讨细胞增殖的分子特性美国californicum,我们利用了增殖细胞对辐照的敏感性[69,70,71,72,73].我们假设,辐射敏感基因的转录本将局限于我们的EdU+,增殖细胞群。考察EdU的形态+用荧光原位杂交(FISH)检测组蛋白h2b信使RNA,一种已知的细胞周期基因,我们发现EdU+细胞在其细胞核周围具有h2b mRNA的狭窄细胞质边缘,这些细胞通常显示细胞质投影(附加文件)1: S1G, H)。这种形态使人联想到在其他生物中研究的增生性细胞,如涡虫新生细胞,其特征是圆形间充质细胞,核质比高,通常延伸细胞质投影[74,75].有了这些额外的特征,我们接下来想知道这些增殖细胞是否可能与其他生物中的增殖细胞共享任何核心遗传特征。一种假设是美国californicum会有一个干细胞样的群体,表达许多经典的多能性或生殖细胞多能性因素,比如匹威,“瓦萨”号,而且nano[71,76].
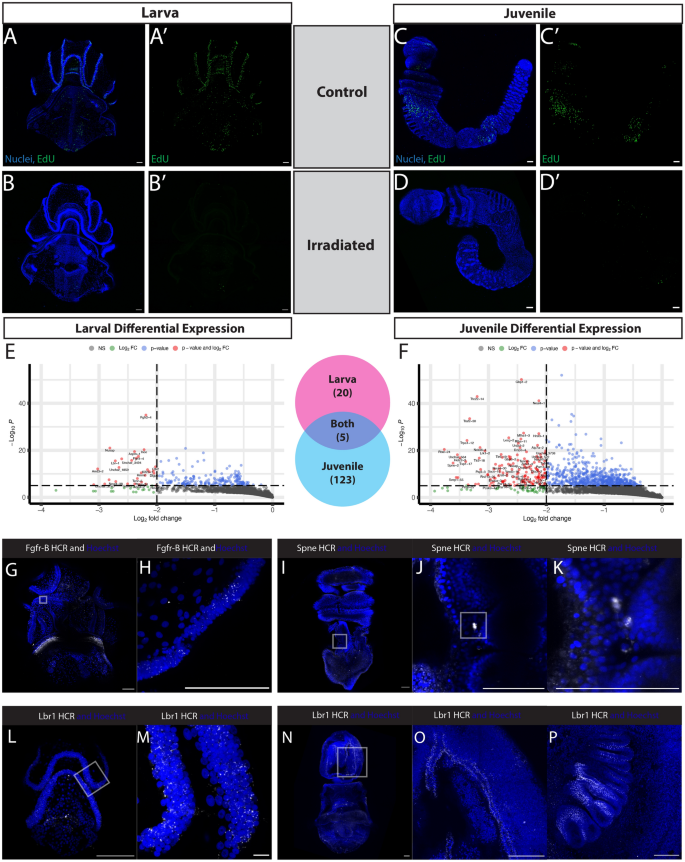
为了做到这一点,我们用辐照处理了幼虫和幼鱼。治疗三天后,动物在形态上看起来与对照组相同,但EdU掺入在幼虫和幼虫中都被消除了(图。7模拟)。我们从辐照后3天的同一阶段的5个个体中提取总RNA,并建立RNA测序文库(Nugen-Tecan Genomics)。辐照与未辐照的RNAseq分析发现,幼虫中有20个基因和幼鱼中有123个基因表达差异显著(log2倍变化≥−2),p调整值≤10-6幼鱼(图2)。7E),有5个基因在两个阶段都下调。
幼虫和幼体辐照敏感EdU细胞的遗传特征。所有;蓝色= Hoechst,绿色= EdU;比例尺为100um。一个对照幼虫代表此阶段正常EdU模式,代表5/5只动物。B在接受120 Gy x射线照射后,代表EdU模式的实验幼虫,代表5/5只动物。C对照幼崽代表此阶段正常EdU模式,代表4/4只动物。D在接受200 Gy x射线照射后,代表此阶段EdU模式的实验幼崽,代表2/2只动物。E火山图显示对照与辐照幼虫的表达差异。每组N = 3。F火山图显示对照与辐照幼鼠的表达差异。每组N = 3。G用HCR探针检测Fgfr-B的幼虫。H纤毛带与Fgfr-B转录本的高倍放大。我幼崽用HCR探针检查纺锤型e。J,K外胚层和鳃条之间表达的Spindle-E转录本的放大倍数更高。l用HCR探针检测Lbr-1的幼虫。米带有Lbr-1转录本的H片段分布在睫状带。N一个青少年用HCR探针检测Lbr-1。O插图I, Lbr-1转录本分布在整个侧沟。PLbr-1转录本分布于鳃条
在幼虫阶段,20个候选基因是特定的,包括fgfr-B(成纤维细胞生长因子受体B)和一些参与细胞分裂的基因,如恩斯(内着丝粒蛋白)[77]aspm-1纺锤体微管组装异常)[78,79,80),而dlgp5(磁盘大相关蛋白5)[81,82](附加文件2: S2A)。在幼鼠中,123个基因表现出显著的差异表达,其中包括一个潜在的生殖系标记spne-2 (纺锤体- e),参与增殖的基因,如anln(苯胺)和与潜在免疫反应相关的基因traf2(TNF受体相关因子2),tlr2(toll样受体2),和tlr6(toll样受体6)(附加文件2:开通)。
最后,幼虫和幼鱼之间共有5个表达差异的基因:lbr-1(纤层蛋白B受体),nusap(核仁和纺锤体相关蛋白1)tenr-5(Tenascin-R),tlr6-1(toll样受体6),和unchar_4293(一种未鉴定的基因)。nusap在纺锤体微管组织中起作用,也与WNT信号通路和转移有关[83],而且tenr-5(Tenascin-R),属于一组细胞外基质蛋白,在脊椎动物干细胞生态位中对组织形成、细胞黏附调节以及增殖和分化调控起重要作用[84].
在幼虫对辐射敏感的转录本中,fgfr-B是最引人注目的。已知脊椎动物中的FGF受体可调节细胞增殖、分化,并在多能干细胞中发挥关键作用[85].两种半核FGF受体Fgfr-A和Fgfr-B源于半核FGF特异性复制[86]和直接发育的半茎状体木舌藻,fgfr-B在原肠形成期早期的内胚层中表达,也在原肠形成期晚期至后期的外胚层中表达[87].在美国californicum的分布fgfr-BmRNA和发现的表达遍布区域,在那里我们也观察到EdU+细胞,特别是睫状带(图;7G H)。
在幼年转录组中,差异表达spne-2 (纺锤e)是最引人注目的。在黑腹果蝇spindle-E参与生殖细胞piwi- interaction - rnas (piRNAs)和s的DExD-box解旋酶结构域的生成pindle-E是种系中转座因子沉默所必需的[88,89].在S.加利福尼亚州,纺锤状e特异性地表达在鳃棒后部周围的间充质细胞中(图。7I, K),与中的Vasa表达式一致p .黄色的[90].考虑到spindle-E表达在相似的区域,并涉及生殖系调节,我们假设spindle-E有可能是半齿菊生殖细胞增殖的标志。
层膜B受体基因,lbr-1其在系留染色质中起重要作用,在幼虫期和幼期表达差异显著。这表明它可能是一种普遍的增殖细胞标记美国californicum.有两种类型的染色质附着在层膜上,一种是在胚胎和未分化的细胞中由层膜B受体执行,另一种是在分化的细胞中由特定的层膜a/c结合蛋白执行[91].之前在海鞘和棘皮动物的研究已经证实lbr-1并提出该基因可能是后口动物所特有的[92].我们检查了的表达式lbr-1在幼虫中发现它局限于纤毛带(图。7L, M),我们之前证明是活跃的细胞增殖区域(图。3.A).同样,在青少年阶段我们发现lbr-1在相似的区域中,我们观察到EdU的分布+细胞(无花果。5F,6B, C),如长鼻侧沟(图;7N, O)和鳃条(图。7P).我们的研究结果表明lbr-1可能作为一个有用的标记标记增殖细胞跨越两种生命历史状态。
最后,经典的多能性或种系多能性因素,如匹威,“瓦萨”号,而且nano, (71,76没有明显的差异表达(附加文件2: S2C, D)。相反,我们恢复的是与特定增殖种群相关的基因(fgfr-B spne-2,而且lbr-1)从而揭示了增生性祖细胞之间可能存在的异质性。
细胞死亡在变态时重塑幼虫组织
经过考察细胞的整个生命周期的增殖和变态s . californicum接下来,我们测试了增殖模式是否与细胞死亡模式相关。幼虫在变态过程中丢失或大量重塑的一种结构是环状纤毛带,也称为纵向纤毛带,这是幼虫特有的摄食结构[57,61]这是没有保留在少年。我们用TUNEL(末端脱氧核苷酸转移酶dUTP缺口末端标记)研究了细胞死亡的分布,TUNEL检测DNA断裂作为细胞凋亡的代理[93].TUNEL实验标记所有游离的3 ' -羟基末端,这意味着TUNEL染色可以检测到细胞凋亡、程序性细胞死亡和坏死[94,95].我们利用click - it技术克服了以前TUNEL检测的局限性,该技术利用了一种改性dUTP,具有小的生物正交炔部分(EdUTP),并在炔和吡啶叠氮化物染料之间进行铜催化的共价咔哒反应[96,97].
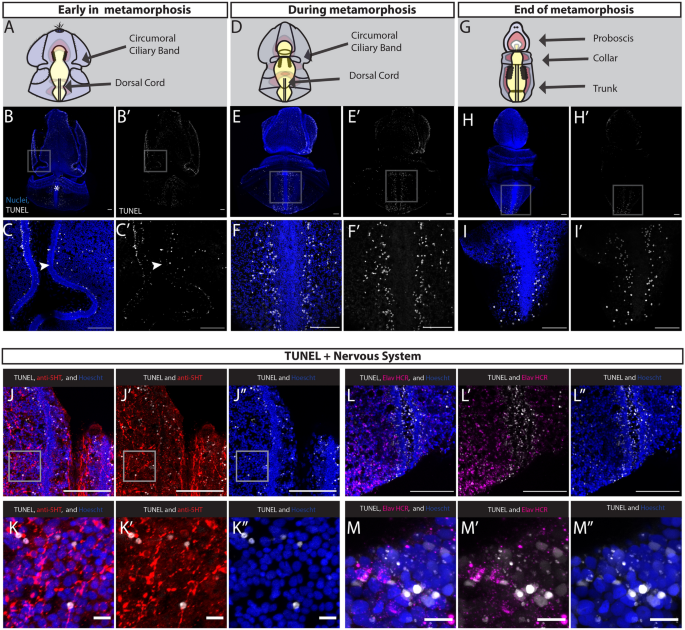
在整个幼虫发育过程中,在幼虫后期,我们发现很少TUNEL+细胞,表明非常有限的细胞死亡在幼虫阶段(附加文件3.: S3A-C)。然而,一旦变态开始,以幼虫上皮增厚为标志,TUNEL大幅增加+细胞(图。8B)。TUNEL+细胞广泛分布于整个外胚层,大部分分布在发育中的背索两侧,以及口睫状带内和周围(图2)。8C).睫状带标记有许多TUNEL+细胞,支持形态学观察,这种结构在这个阶段开始分解。有一小部分TUNEL+在协议的前端(附加文件3.: s3d, e). tunel+在这一阶段,肠道也没有细胞,这与从幼虫到成虫的整个转变过程中肠道保持的形态学观察是一致的[35].为了确认TUNEL标记充分渗透到更深的组织层,我们用DNAse-1人工切割DNA末端进行阳性对照(附加文件)3.: s3g, h)。
在蜕变中期,TUNEL+细胞分布在表皮各处,并继续标记互相融合的纤毛带(图2)。8E).在这个阶段,我们继续探测到很少的TUNEL+中胚层和内胚层的细胞。外胚层的另一个区域,TUNEL的数量最多+在背神经束的正外侧(图。8F),这个区域我们在同一阶段观察到了许多增殖细胞。我们在背侧看到的这些一般模式与TUNEL在腹侧观察到的大致相似+细胞分布在睫状带和广泛的外胚层,但不包括腹神经索(补充文件3.: S3F)。TUNEL的存在+睫状带内和周围的细胞与先前的观察一致,即睫状带周围退化,该区域的血清素能神经系统在变态过程中经历了广泛的重组,因为睫状带融合时,睫状带沟中存在的神经突束消失[35,98,99].
在变态后期,TUNEL数量减少+细胞检测。在前部,很少有TUNEL+细胞在外胚层或中胚层(图。8H).那些TUNEL+剩下的细胞分散在长鼻的表皮上,但不再分布在侧沟中,从我们的EdU研究中,我们观察到在这个阶段细胞开始增殖(图2)。5F).在后部,剩下的TUNEL+背索两侧均可见细胞,最显著的是在后部,那里的幼虫表皮已被压实(F我g。8我)。
为了了解细胞死亡与神经系统的相互作用,我们在变态早期检查了5 -羟色胺定位和TUNEL定位,发现5 -羟色胺能共定位+TUNEL细胞+细胞(图。8J, K)的表达弱电TUNEL为泛神经元标记物(图;8L, M),并发现几个共定位弱电+和TUNEL+表皮边缘的细胞。我们的研究结果表明,幼虫神经系统的部分在变态过程中发生细胞死亡,而前纤毛带的神经系统可能不会像之前提出的那样在幼年体计划中保持不变[66].
总的来说,从我们对细胞死亡的描述中,我们发现TUNEL的增加+细胞与变态相关。我们观察到TUNEL+细胞广泛分布于表皮,且随着时间的推移,从前到后的限制,与外胚层增厚从前到后的时间进展的形态学观察相关[35].虽然我们不能排除其他形式的组织重塑或组织分解,但我们的研究结果表明,细胞死亡在重塑幼虫结构中起着重要作用,特别是在前纤毛带中,前纤毛带在蜕变过程中融合。
讨论
虽然通过幼虫转化发育成虫在双侧动物中非常常见,但我们对这一过程在细胞水平上如何发生的细节了解甚少,特别是考虑到不同生活史策略的群体之间的变态过程是如何不同的[11,One hundred.,101,102].这项研究在半枣树美国californicum重点描述细胞增殖和细胞死亡的模式在两个不同的生活史阶段和在变态。与模式物种不同d .腹,在此阶段,幼虫组织主要发生组织分解,成虫从影像盘中出现[103的形态学研究美国californicum[35],间接发展广泛的半足形[36],提示变态是通过幼虫组织的重塑和幼虫向成虫的转变而发生的。我们的工作说明了在不同的生命历史状态下,细胞增殖和死亡模式的异同美国californicum揭示了这些独特的身体轮廓是如何以及何时形成的。
由增殖形成的幼虫体平面
对于间接发育的生物来说,幼虫的快速生长是必不可少的。卵虽小,但幼体在变态时的大小是个体适应性的良好指标,因此在变态前幼体的生长是至关重要的[13,104].我们观察到早期幼虫发育(图。1B) tornaria幼虫主要是通过细胞增殖和有限数量的细胞死亡形成的(图。2,3.,附加文件3.: S3A-C)。我们观察到的增殖模式突出了生长的区域差异;EdU+细胞分布于幼虫表皮、肠道,并主要分布于睫状带(图2)。2一个,3.A).在幼虫发育的这个阶段,我们使用TUNEL试验观察到很少有细胞死亡(附加文件)3.: S3A)。有一些TUNEL+细胞分布在整个幼虫,但似乎没有这些细胞集中到任何结构或组织。虽然还没有对两侧幼虫发育中的细胞死亡进行广泛的调查,但已经对一些海洋幼虫的细胞增殖进行了评估,并观察到在美国californicum证实并扩展了在其他物种中发现的东西[58].
成虫体计划的起源开始于幼虫晚期
幼虫和成虫之间形态上的不连续一直是动物学家们好奇心的源泉[30.,36,105].虽然变态通常被认为是成年动物从幼虫的痕迹中出现的时间,但细胞增殖可能先于变态时更明显的形态变化。在幼虫晚期(图;1D)的美国californicum在发育中的成体的特定区域,其特征是在生物体在变态期间从浮游生物过渡到底栖生物之前,细胞增殖(图2)。4).在这个阶段,幼虫有能力[9]开始变形,但可能以游泳托纳症的形式持续数周或数月。这在体腔的增殖中最为明显:分别产生喙部中胚层、领部中胚层和干部中胚层的中胚层(图2)。4h l)。这些形态标志的形成之前的变态已经在先前的描述美国californicum[35]以及在enteropneusts中广泛使用[36,65,99,105但我们的研究澄清了这些结构是通过广泛增殖产生的。我们对增殖模式的描述说明了增殖在变态开始前这些组织起源中的重要性,并支持了长期以来的假设,即变态前成体结构的开始对于生物体为重大生活史转变做准备至关重要[2,105,106].
在间接发育的物种中,成虫起源的问题围绕着时间和地点。海胆成虫形成的时间Strongylocentrotus purpuratus曾被描述为通过“隔离细胞”发生,在这种细胞中,幼鱼从一群隔离细胞的幼虫体内的一个小雏形生长而来[17].我们倾向于更广泛的异时性概念,而不是“预留细胞”的细胞识别定义[107,108]或“延迟发育”,其重点是一些细胞群相对于其他细胞群的规格化和末端分化的时间[109].异时性或“延迟发展”的范式构成了S。californicum与海胆相比,更类似于海洋环节动物的延迟生活史转变[110,111,112].在美国californicum,我们在晚期幼虫中观察到这种成虫的延迟,在那里成虫身体计划的结构发生增殖之前到变态开始(图;4).
变态结合了细胞增殖和细胞死亡
我们发现细胞死亡与变态的开始相关,并且在幼虫发育后期开始的区域化细胞增殖持续到成虫。在幼虫特定结构被重塑的区域检测到细胞死亡(图。8B, C)和likely在形成正在形成的成人结构的形态发生中很重要,例如正在形成的成人神经系统的背索(图。8E, F, H, I)。显然,成体形态发生的开始和显性变态的开始导致增殖和细胞死亡模式的重大转变。
长期以来,幼虫特定结构中的细胞死亡一直与变态研究有关,事实上,第一个有记录的细胞凋亡观察是在蟾蜍的变态中,Alytes obstetricans,其中注意到脊索细胞消失,并被椎骨细胞所取代[113].从那时起,关于细胞死亡在无铀变态过程中的作用有了重要的发现,这些发现扩展了时间在这一过程中的重要性[114,115,116].蝴蝶和果蝇等昆虫的变态机制也为程序性细胞死亡作为这一过程中的关键事件所起的作用提供了重要的比较视角[117,118].最后,当海洋无脊椎动物从浮游幼体转变为底栖幼体时,细胞死亡也与它们的蜕变有关[119],尤其是腹足类动物幼虫神经系统的重塑[120,121].在美国californicum我们探测到TUNEL+形态变态开始时的细胞,最明显的是在前纤毛带周围,这些纤毛带参与幼虫的摄食,并在变态过程中融合(图2)。8B).这与在海胆中观察到的情况相似,在有能力的幼虫的臂和纤毛带中检测到凋亡细胞[122,123,124].类似于在企业界观察到的情况p .黄色的[66],在美国californicum与睫状带相关的血清素能神经元在变态时丢失,我们观察到TUNEL和血清素双阳性细胞,这表明细胞死亡是变态时这些系统可能发生变化的一种方式(图)。8J, K)。
虽然细胞死亡在变态时去除幼虫特异性结构中起着重要作用,但它也可能参与变态过程中塑造幼虫组织,这让人想起脊椎动物的手指发育[125],并形成腿部关节和头部节段d .腹[126].变形的一个决定性特征美国californicum是一种从前到后的整体缩小。我们发现背侧表皮的细胞死亡由前向后进行(图2)。8E, F)表明这可能是整合和移除幼虫组织的重要过程,类似于在老鼠爪子或苍蝇幼虫中观察到的细胞凋亡[127].然而,要更全面地了解细胞死亡、凋亡或坏死或程序性细胞移除的类型[128将需要用更复杂的功能方法进行更严格的测试。总的来说,虽然我们发现细胞死亡不仅发生在幼虫特定的结构中,而且在蜕变过程中也广泛发生在幼虫组织中,但也有一些区域的细胞死亡更为有限,如前外胚层、领外胚层和三部肠,这导致并非所有幼虫细胞都死亡的可能性,而是可能被纳入成体计划。我们对细胞死亡的描述美国californicum支持经典形态学描述,即enteropneusts没有“灾难性变形”[129],现已在细胞水平上得到证实。
在成人的身体计划中,生长的增殖模式不同,这些增殖种群的标记也不同
少年美国californicum(无花果。1J)具有明显的生长-增殖模式,继续在不属于幼虫的功能部分的结构中富集。背索和腹索、鳃棒、喙外胚层和侧沟都是成鱼结构区域增殖的明显例子(图2)。6B、附加文件1: S1F)。我们还观察了后来的幼崽发育,发现在继续生长的动物的躯干区域,增殖最为显著(图2)。6F).这种变质后生长的模式让人联想到直接发育的半核状突起中所描述的后轴延长的后生长时期美国kowalevskii[68].
鉴于细胞增殖模式在幼虫和幼虫之间存在差异,我们想要测试增殖细胞的遗传特征在生活史状态之间是否相似或不同,以及是否存在特定的多能干细胞群体或广泛的增殖祖细胞群体。在生物中,如群居海鞘[130], acoels [131]、扁虫[132,133]、刺胞动物[134,135]和海绵[136],成体干细胞保留了产生种系细胞和几种体细胞类型的潜力,并表明可能存在一种祖先动物干细胞[137].与具有明确新母细胞群体的生物(如扁形蠕虫和小珊瑚虫)相比,我们没有恢复清楚的多能干细胞群体[71].与多能性或种系多能性相关的基因也没有显著的差异表达(附加文件4: s4c, s4d)。相反,我们发现了基因的差异表达,比如lbr-1在幼虫和幼体中,表明了染色质状态的重要性,与增殖细胞的类型无关。之前有人认为lbr而且喇嘛/ C在许多不同哺乳动物细胞类型中的表达可能表明外周异染色质系调控分化,也许这是后口动物中更大的联合趋势[91].
当我们观察辐照和非辐照幼虫的差异表达时,我们发现相对有限数量的显著差异表达基因,例如那些参与细胞分裂的基因(例如因斯,asmp-1, dlgp5),最有趣的是fgfr-B(成纤维细胞生长因子受体B)曼氏裂体吸虫发现FGF受体在辐照下下调,并进一步表明RNAi抑制FGF信号通路导致EdU掺入减少和细胞周期相关转录物下调[138].在幼年动物中,虽然我们确实恢复了可能是种系特异标记的表达spindle-E,我们的辐射实验也有一些转录本表明了潜在的免疫反应,例如traf2,tlr2而且tlr6.我们的结论是,这些基因的差异表达可能与辐照敏感转录物的损耗关系不大,而更可能是对辐照的免疫反应。
同时还需要做额外的工作来确定是否标记物,如fgr-B而且spindle-E作为谱系和生活史特定的增殖标记,我们的结果肯定支持幼虫和幼崽结构的形成依赖于不同的增殖种群的假设。对直接发育的物种的强烈关注可能会错过与复杂生命周期发展相关的不同增殖细胞群的一些有趣的调节特征。为了更全面地了解发育多样性及其如何塑造动物身体计划,我们既需要更广泛的系统发育采样,也需要更广泛地代表复杂的发育策略。
幼虫和成虫体计划的整合
我们对细胞增殖和细胞死亡之间的平衡和时间的研究表明,成体形态元素增殖先于变态的开始,变态的开始与细胞死亡的开始相关。然而,这项研究也提出了更多的问题,特别是大多数幼虫细胞的神秘命运,这些细胞似乎维持到了变态的阈值。最令人兴奋的可能性是幼虫细胞在成体计划中具有新的身份。在海胆中,作为保留细胞的灾难性变形的关键例子,由于在被吸收的幼虫臂中发生区域化凋亡,幼虫上皮组织得以保留[124].对其他棘皮动物,如海参和cidaroids的形态学研究表明,它们的幼虫表皮在幼年阶段得以保留,在变态阶段也没有丢失[139,140].即使在被描述为“最大间接开发”的nemerteans等例子中[141],我们现在知道,产生影像盘的细胞也对幼虫的身体有贡献[142].即使是在d .腹分化后的幼虫气管细胞随着其特化的成体盘细胞而增殖,形成成体气管和成体特异的气囊[143,144].在烟草角虫中,Manduca sexta,幼虫腿的分化细胞形成成虫腿[145].也许幼虫细胞和成虫细胞之间的这种联系是相当普遍的。虽然需要开发遗传工具来详细研究这一点,但对转化变态的研究有可能测试细胞类型的转分化是否作为具有复杂生活史的生物体正常本体论发展的一部分发生。如果这确实是真的,我们就有了一个诱人的问题,当许多幼虫细胞仍然存在时,它们如何在成虫体内承担相应的功能?
我们对成人发育的所有理解几乎都来自于直接的发育,即成人的身体规划从胚胎开始出现。尽管代表间接发育的物种的普遍性和系统发育的广度,但我们对成体发育如何通过转化发生知之甚少。显然,需要更多地关注后生动物变态特征的发育策略范围。只有通过对生活史策略进行更广泛的取样,我们才有希望更全面地了解成人身体规划形成的发育机制。
结论
本研究通过间接显影来描述细胞增殖和细胞死亡美国californicum.此种幼虫和成虫有不同的体型,与其他间接发育的半足虫一样[31,33,98这是一种变革性而非灾难性的变化。我们的数据代表了对常见的、尚未得到充分研究的、通过转变幼虫体计划形成成虫体计划的双侧发育策略的细胞调查。尽管这种生活史策略很流行,但我们对这一过程是如何发生的却知之甚少。我们的研究发现,在任何明显的变形之前,成人身体计划成分的广泛增殖就开始了。虽然细胞死亡是变态和成体发育的一个显著特征,但成体的整个细胞补体不太可能用幼虫细胞死亡和一个独特的成体干细胞群的增殖来解释。未来的研究将需要澄清幼虫细胞通过变态的命运。总而言之,我们的研究建立了幼虫和成虫身体形态形成的细胞特征,以及通过变态的转变s . californicum通过细胞、发育和进化生物学的视角来理解这一转化过程的重要物种。
方法
采集、产卵和饲养幼虫
成人Schizocardium californicum在加利福尼亚州莫罗湾州立公园的泥滩上收集,该泥滩位于″N 120°50 ' 35.6″W。动物如[35]将雌性个体放入过滤过的海水碗中,并置于24-26°C的光照培养箱中。孵化后,将幼虫转移到1加仑的玻璃罐中,不断搅拌,并以1:1的混合饲料喂养幼虫杜氏盐藻tertiolecta而且Rhodomonas镜头.每隔两到四天,就会对容器进行清洗,将水换成干净的过滤海水,并添加新鲜的藻类。为了繁殖更多的动物,一些幼虫被转移到扩散管中,放在一个连续的流动系统上[146].一旦动物开始变形,它们就被转移到装有玻璃容器沙子的玻璃碗中。
EdU标签
使用Click-it Plus EdU 488 Imaging Kit (Life Technologies)进行增殖细胞的标记和检测,并进行了以下修改。幼虫和幼虫在FSW中培养,FSW中添加10 μM EdU,从10 mM的DMSO中稀释。除非另有说明,实验动物先用EdU脉冲30分钟,然后用3.7%多聚甲醛在MOPS固定缓冲液(0.1 M MOPS, 0.5 M NaCl, 2 mM EGTA, 1 mM MgCl2, 1× PBS)中固定1小时,室温(RT)。为了检测EdU的掺入,将标记胚胎转移到PBS溶液中,并按照制造商的方案进行检测,在0.5% Triton®X-100的PBS中增加渗透时间40分钟,并将检测时间增加45分钟。
TUNEL检测
使用Click-iT Plus TUNEL Assay检测凋亡细胞,使用Alexa FluorTM染料进行原位凋亡检测,并进行了以下修改。动物用标准方案(3.7%多聚甲醛MOPS固定缓冲液)固定,用1 × PBS洗涤2次,蛋白酶- k在室温下渗透15 min。TdT反应混合物在37℃孵育60 min, Click-iT Plus反应在37℃孵育30 min。
抗体标记
固定和抗体标记如前所述[35].为了使增殖细胞可视化,我们使用兔多克隆抗组蛋白H3 (phospho S10) (Abcam ab5176)在阻断液中1:200稀释。为了观察纤毛,我们使用小鼠单克隆抗乙酰化微管蛋白抗体(Sigma T7451)在阻断溶液中稀释1:400。为了可视化血清素能神经系统,我们使用兔抗血清素抗体(Sigma S5545)在阻断溶液中稀释1:300。二抗(ThermoFisher, Alexa Fluor)按1:1000稀释添加到阻断液中。
成像
细胞核用Hoechst 33,342(1:1000)在PBS中染色,用粘土脚抬高的盖玻片在PBS中固定。对于幼虫,将样品转移到50%甘油中30-60分钟,然后70%甘油进行成像。样品在蔡司LSM 700上用10X、20X和40倍物镜成像。对于大于视场的样本,来自几个堆栈的最大强度投影被缝合在一起(斐济)。
辐照和转录谱分析
幼虫和幼虫在CellRad Faxitron源上暴露于120和200 Gy的x射线照射下。照射3天后在FSW中培养动物,使用Qiagen RNeasy从5只动物的池中制备纯化的总RNA。对照组和辐照实验组分别进行三个独立的生物学重复。准备了用于RNA-seq的单独标记文库(Nugen-Tecan Genomics Universal mRNA-seq Kit),汇集在单个通道中,并在Chan-Zuckerberg Biohub使用Illumina HiSeq2000生成75 bp的对读。结果读取被映射到注释美国californicum使用CLC Genomics Workbench (CLC Bio)进行基因组(v2.0),用DeSeq2进行差异表达。apeglm用于对数折叠变化收缩[147),vSt(方差稳定变换)用于可视化[148].
原位杂交
样品在固定前使用3.5% MgCl2放松,在室温(RT)下在MOPS固定缓冲液中3.7%甲醛中固定1小时,在固定缓冲液中洗涤,在100%乙醇中脱水,并在−20℃保存。用随机六聚体从阶段特异性cDNA中扩增基因,克隆到pGEM-T Easy (Promega)中。用SP6或T7 RNA聚合酶(Promega)合成了双加氧素标记反义探针。原位杂交是结合前面所描述的[52,149].RNA探针稀释至0.1-1 ng/ml,在60°C下杂交过夜,使用Anti-DIG AP抗体和TSA-Cy3进行观察。
原位HCR 3.0版。
特定于感兴趣基因的互补DNA序列被提交到Ozpolat实验室的原位探针生成器[150].通过收集相关物种感兴趣的序列,建立基因树,确定基因的同源性。序列以MUSCLE [151],使用MrBayes 3.1.2版本的贝叶斯推断树计算树[152]在1,000,000代中,每100代取样树木,老化期为25%(附加文件4: S4)。软件生成的序列用于从Integrated DNA Technologies公司排序DNA寡核苷酸池(50 μmol DNA pools oligo Pool),在50 mM Tris缓冲液中重悬至1 μmol/μl, pH为7.5。含荧光团B1-Alexa氟-546、B2-Alexa氟-488和B3-Alexa氟-647的HCR放大器由Molecular Instruments, Inc.订购。HCR是基于Choi等人,2018年和Patel实验室的原位杂交链式反应(HCR)方案进行的[153,154].对于涉及HCR和TUNEL标记的实验,先进行HCR,然后再进行额外标记。
数据和材料的可用性
与本研究相关的测序原始reads和处理计数矩阵可在NCBI基因表达Omnibus (GEO)中获得,https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE196326.
参考文献
Cameron CB, Perez M. Spengelidae,来自东太平洋,包括一个新种,Schizocardium californicum他来自加州。据研究。2012;3569:79 - 88。
Jäegersten G.后生动物生命周期的演化;一个全面的理论。纽约:学术出版社;1972.
孙文杰,李文杰,李文杰,等。扬节体理论:生命周期系统发育的一个例子。进:康威·莫里斯S,乔治·JD,吉布森R,普拉特HM,编辑。低等无脊椎动物的起源与关系,分类学协会专卷;28.牛津:牛津大学出版社;1985.28-41页。
拉夫拉。后生动物体型的起源:幼虫革命。《现代科学》,2009;43:1473-9。
海曼LH。无脊椎动物,第4卷。纽约:McGraw-Hill;1955.
《动物进化:活门的相互关系》第三版。牛津:牛津大学出版社;2012.
吉尔伯特L,弗里登E,编辑。变态,发育生物学中的一个问题。第二版。纽约:全会出版社;1981.
McEdward LR, Janies DA。小行星的生命周期进化:幼虫是什么?生物通报。1993;184(3):255-68。
王志刚,王志刚,王志刚。海洋无脊椎动物幼虫变异能力的研究进展。中国科学。2001;41(5):1123-31。
Strathmann RR。关于海洋幼虫起源的假说。生态学报。1993;24(1):89-117。
Bishop CD, Erezyilmaz DF, Flatt T, Georgiou CD, Hadfield MG, Heyland A,等。什么是变态?中国生物医学工程学报。2006;46(6):655-61。
Emlet RB。从卵看棘皮动物幼虫生态学。棘皮类动物,1987;2:55-136。
Strathmann RR。海洋无脊椎动物摄食与非摄食幼虫发育与生活史演化。生态学报。1985;16(1):339-61。
达门P,迪克图斯WJ。的原细胞谱系髌骨vulgata(腹足纲软体动物类)。中国生物医学工程学报。1994;32(2):364-83。
LR的页面。软体动物幼体:远洋幼体还是慢慢变态的幼体?生物通报。2009;216(3):216 - 25。
冈崎K.正常发育到变态。入:Czihak G,编辑。海胆胚胎。柏林:施普林格;1975.p . 177 - 232。
Peterson KJ, Cameron RA, Davidson EH。在最大间接发育中放置细胞:进化和发育的意义。BioEssays。1997; 19(7): 623 - 31所示。
Maslakova SA。nemerteanpildium幼虫发育到变态。Front Zool. 2010;7(1):30。
Nielsen C. Trochophora幼虫:细胞谱系,纤毛带和身体区域。1.环节动物和软体动物。中国生物医学工程学报。2004;30(1):35-68。
范德霍斯特CJ。半索动物。在:克拉森和秩序的Tierreichs wissenschaftlich dargestellt。Akademische -;1939.(Wort und Bild;卷4)。
海曼LH。无脊椎动物:较小的体腔动物类群,角齿目,半齿目,角齿目,齿形目,腕足目,四爪目,双侧体腔动物,第5卷。纽约:McGraw-Hill;1959.
卡梅隆CB。基于形态特征的半齿蕨的系统发育。中国生物医学工程学报。2005;33(1):366 - 366。
加农JT,雷切尔AL,埃克莱斯顿H, Halanych KM,斯瓦拉BJ。半足类的分子系统发育及深海肠道生物的最新进展。分子系统进化学报,2009;52(1):17-24。
Bromham LD, Degnan BM。半枸杞和后口动物进化:半枸杞+棘皮动物分支的强大分子系统发育支持。环境科学进展。1999;1(3):166-71。
Cameron CB, gary JR, Swalla BJ。脊索动物体计划的进化:后口门系统发育分析的新见解。自然科学进展,2000;29(4):469 - 472。
贝叶斯系统发育分析支持单胞菌和圆口菌的单胞性。动物科学,2002;19(5):593-9。
Cannon JT, Kocot KM, Waits DS, Weese DA, Swalla BJ, Santos SR,等。半棘皮类和棘皮类分支的系统基因组解析。动物学报,2014;24(23):2827-32。
李文杰,李志强,李志强,等。后口畸形缺乏支持,提示对第一双侧畸形的重新解释。科学通报2021。https://doi.org/10.1126/sciadv.abe2741.
摩根TH。巴拉舌龙的发展。中华医学杂志。1894;9(1):1 - 86。
阿加西斯A.巴拉舌龙和托纳利亚的历史。中国科学院学报。1873;9(2):421-36。
林春英,董超,余建科,苏永华。半核橡子虫的繁殖周期、产卵诱导和幼虫变态Ptychodera黄颜色:橡子虫动物资源Ptychodera黄颜色.中国生物医学工程学报,2016;26(1):457 - 457。
哈德菲尔德毫克。半索动物。在:海洋无脊椎动物的繁殖[互联网]。爱思唯尔;1975[引用于2022年3月29日]。p . 185 - 240。https://linkinghub.elsevier.com/retrieve/pii/B9780122825026500121.
浦田,山口。半樱草的发育Balanoglossus misakiensisKuwano。中国动物科学,2004;21(5):533-40。
宫本荣,齐藤。日本下田一新种的形态与发育(半足纲:肠足纲:肢足科)。动物科学,2007;24(12):1278-85。
Gonzalez P, Jiang JZ, Lowe CJ。间接发育橡子虫的发育与变态Schizocardium californicum(肠鳃纲:Spengelidae)。Front Zool, 2018。https://doi.org/10.1186/s12983-018-0270-0.
摩根TH。Tornaria的生长和变态。J Morphol, 1891; 5:407-58。
原田勇,田口勇,田川勇,韩汉文,佐藤勇,等。半齿藓属植物的发育表达。机械开发,2000;91(1-2):337-9。
原田Y,冈井N,田口S, Shoguchi E,田川K,汉弗莱斯T,等。半核状远端基因的胚胎表达。动物科学,2001;18(1):57-61。
原田Y, Shoguchi E,田口S, Okai N, Humphreys T, Tagawa K,等。BMP-2/4在半horhordate橡子蠕虫和棘皮类海参胚胎中的保守表达模式动物科学通报2002;19(10):1113-21。
Ogasawara M, Wada H, Peters H, Satoh N. Pax1/9基因在尾脊索动物和半脊索动物鳃中的发育表达:对咽上皮细胞功能和进化的认识。中国科学(d辑),1999;26(4):344 - 344。
田川,李志刚,李志刚。橡子虫鳃特异性基因的研究进展Ptychodera黄颜色.科学通报,2000;17(3):309-19。
彼得森KJ,卡梅伦RA,田川K,佐藤N,戴维森EH。一种比较分子方法研究基底后口动物中胚层模式:Brachyury基因在半核菊中的表达模式Ptychodera黄颜色.发展。1999;126(1):85 - 95。
李志强,李志强,李志强,等。半足果胚Brachyury基因表达的研究进展。机械发展,1998;75(1-2):139-43。
Tagawa K, Humphreys T, Satoh N.在半齿鸟幼虫顶端器官的T脑表达表明其与脊椎动物前脑的进化联系。中华医学杂志,2000;31:23-31。
李志刚,李志刚,李志刚。半脊索动物发育的分子生物学研究:理解双侧动物和脊索动物进化的关键。生物科学进展。2001;3(6):443-54。
Taguchi S, Tagawa K, Humphreys T, Nishino A, Satoh N, Harada Y.半砧木叉头/HNF-3基因表达的特征。中国生物医学工程学报,2000;21(1):11-7。
Taguchi S, Tagawa K, Humphreys T, Satoh N.有助于脊椎动物大脑规范的B组sox基因在半足虫幼虫的根尖器官和纤毛带中表达。动物科学,2002;19(1):57-66。
Takacs CM, Moy VN, Peterson KJ。测试脊索背神经系统和内柱的推定半脊索同源物:NK2.1 (TTF-1)在橡子蠕虫中的表达Ptychodera黄色的(半索动物Ptychoderidae)。生物科学进展。2002;4(6):405-17。
Röttinger E,马丁戴尔MQ。NiCl2间接发育的半绳果的腹侧化表明了在Ambulacraria(半绳果和棘皮动物)中背腹侧(D/V)模式的保守机制。中国生物医学工程学报,2011;36(1):339 - 344。
Röttinger E, DuBuc TQ, Amiel AR, Martindale MQ。在间接发育的半胚乳中,中胚层和腹胚层需要节点信号,而背胚层则不需要Ptychodera黄色的.生物公开,2015;4(7):830-42。
张志刚,张志刚,张志刚。企业家颈管神经管与脊索神经管具有高度的保守性。科学通报2017;7(1):7003。
Gonzalez P, Uhlinger KR, Lowe CJ。间接发育的半足虫的成虫体平面是通过在前部幼虫领地上增加一个有钩状图案的躯干来发育的。中国动物医学杂志,2016;27(1):1 - 9。
范大鹏,丁浩辉,余建科,苏永华。FGF信号在中胚层发育过程中反复使用的胚胎发生和变态Ptychodera黄颜色.中国生物医学工程杂志,2018;18(1):120。
Salic A, Mitchison TJ。一种快速、灵敏地检测体内DNA合成的化学方法。中国科学:自然科学,2008;29(2):344 - 344。
Garstang W. Spolia百慕大。2Tornaria的纤毛摄食机制。中国生物医学工程学报(英文版)。
Lacalli TC, Gilmour THJ。梭鱼幼虫的运动和摄食效应Balanoglossusbiminiensis:托纳亚结构和进料。动物科学学报,2002;82(2):117-26。
黄志伟,王志伟,王志伟,黄志伟,黄志伟Ptychodera黄颜色(半索动物:肠鳃纲)。生物学报。1976;34(4):317-24。
A.海洋无脊椎动物纤毛浮游幼虫细胞增殖模式的比较分析(理学硕士)。俄勒冈大学;2012.
Lacalli TC。顶端器官,上皮结构域,脊索中枢神经系统的起源。中国科学。1994;34(4):533-41。
马洛,马志刚,马志刚,马志刚,马志刚,等。在动物进化过程中,幼虫的体型和根尖器官是保守的。中国生物医学工程学报。2014;12(1):7。
Nakajima Y, Humphreys T, Kaneko H, Tagawa K.夏威夷半足虫Tornaria幼虫的发育和神经组织,Ptychodera黄色的.动物科学,2004;21(1):69-78。
尼尔森C.幼虫和成人大脑。环境科学进展。2005;7(5):483-9。
李志刚,李志刚。半足虫和棘皮动物幼虫中的肾虫。生物通报。1986;171(1):188-96。
gsiorowski L, Andrikou C, Janssen R, Bump P, Budd GE, Lowe CJ,等。基于超滤的排泄器官单一起源的分子证据。中国生物医学杂志,2021;31(16):3629-3638.e2。
吉尔摩THJ。半圆腹圆腹螺幼虫的取食与鳃缝的发育。《中华人民共和国学报》,2002;30(12):344 - 344。
尼尔森,海-施密特。企业的发展Ptychodera黄颜色:睫状肌束和神经系统。中国生物医学杂志,2007;29(7):357 - 357。
Gillis JA, Fritzenwanker JH, Lowe CJ。脊椎动物咽部转录网络的茎-后口起源。中国生物医学工程学报(自然科学版),2012;
Fritzenwanker JH, Uhlinger KR, Gerhart J, Silva E, Lowe CJ。通过分析半心形轴伸长的机制,解开后部生长和分割。中国生物医学工程学报,2019;36(4):344 - 344。
巴丁CR,贝特杰FH。伦琴射线对涡虫再生的抑制作用。中华医学杂志,2004;1(1):191-5。
李志刚,李志刚,李志刚。正常小鼠骨髓细胞辐射敏感性的直接测量。辐射科学,1961;14(2):213-22。
艾森霍夫GT,康H,阿尔瓦拉多AS。涡虫干细胞及其子代细胞在细胞周转和再生过程中的分子分析Schmidtea mediterranea.细胞干细胞。2008;3(3):327-39。
杨晓燕,王晓燕,王晓燕,等。利用组合RNA-seq、RNA干扰和照射方法定义涡虫多能干细胞的分子谱。中国生物医学工程学报,2012;13(3):R19。
瓦格纳·德,何俊杰,雷迪恩。通过RNAi和克隆分析鉴定涡虫多能成体干细胞系统的遗传调控因子。细胞干细胞,2012;10(3):299-311。
纽马克PA, Sánchez AA。溴脱氧尿苷特异性地标记涡虫的再生干细胞。中国生物医学工程学报,2000;29(2):339 - 344。
Baguña J, Auladell C.涡虫的再生和模式形成新母细胞是全能干细胞和母细胞来源的证据。发展。1989;86:77 - 86。
Juliano CE, Swartz SZ, Wessel GM.保守的种系多能性计划。发展。2010;137(24):4113 - 26所示。
分析INCENPs在有丝分裂过程中的分布,揭示了在卵裂沟形成的中期和早期事件中存在染色体结构变化的途径。中国生物医学工程学报,2001;29(4):344 - 344。
Fish JL, Kosodo Y, Enard W, Paabo S, Huttner WB。Aspm特异性地维持神经上皮细胞的对称增殖分裂。自然科学进展,2006;29(3):344 - 344。
Gonzalez C, Saunders RDC, Casal J, Carmena M, Ripoll P, Glover DMasp轨迹的果蝇在合胞胚中导致多个游离中心体,但在幼虫成神经细胞中限制中心体复制。细胞科学,1990。https://doi.org/10.1242/jcs.96.4.605.
Ripoll P, Pimpinelli S, Valdivia MM, Avila j果蝇纺锤体功能异常。细胞。1985;41(3):907 - 12。
斯图尔特M,墨菲C,弗里斯特姆JW。影响影像学椎间盘x染色体突变体的恢复及初步鉴定黑腹果蝇.Dev Biol, 1972年。https://doi.org/10.1016/0012 - 1606 (72) 90113 - 3.
伍兹防守,科比防守。椎间盘大肿瘤抑制基因果蝇编码一种鸟苷酸激酶同源物,定位于间隔连接处。细胞。1991;66(3):451 - 64。
Vanden Bosch A, Raemaekers T, Denayer S, Torrekens S, Smets N, Moermans K,等。在早期胚胎发生过程中,NuSAP是染色质诱导纺锤体形成所必需的。中国生物医学工程学报,2010;29(4):344 - 344。
Chiquet- ehrismann R, Orend G, Chiquet M, Tucker RP, Midwood KS。干细胞利基中的腱蛋白。中国生物工程学报。2014;37:112-23。
刘志强,李志强,李志强。FGF/Erk信号通路在多能性细胞中的作用。发展。2010;137(20):3351 - 60。
Rebscher N, Deichmann C, Sudhop S, fritzzenwanker JH, Green S, Hassel M. FGFR基因中保守的内含子位置反映了FGFR的模块化结构,并揭示了在已经复杂的祖先FGFR上逐步添加结构域。中国生物医学工程学报,2009;26(4):344 - 344。
格林SA,诺里斯RP,寺崎M,洛CJ。FGF信号通路诱导中胚层形成Saccoglossus kowalevskii.发展。2013;140(5):1024 - 33所示。
Malone CD, Brennecke J, Dus M, Stark A, McCombie WR, Sachidanandam R,等。专门的piRNA通路作用于种系和体细胞组织果蝇卵巢。细胞。2009;137(3):522 - 35。
高晓明,陈晓明,陈晓明。DExH解旋酶结构域在反转录转座子沉默和轴向图化过程中是必要的果蝇卵子发生。G3。2014; 4(11): 2247 - 57。
林超,余娟,苏勇。bmp介导的间接发育半核菊原始生殖细胞特异性的证据。中国生物医学工程学报。2021;23(1):28-45。
王志刚,王志刚,王志刚,王志刚,等。LBR和Lamin A/C依次连接外周异染色质并反向调节分化。细胞。2013;152(3):584 - 98。
Olins AL, Rhodes G, Welch DBM, Zwerger M, Olins DE. Lamin B受体:核膜多任务。核。2010;1(1):53 - 70。
加夫列利,谢尔曼,本-萨森。通过核DNA片段的特定标记来鉴定原位程序性细胞死亡。中国生物医学工程学报,2001;29(3):344 - 344。
安萨里B,科茨PJ,格林斯坦BD,大厅PA。原位末端标记检测细胞凋亡和其他生理病理状态中的DNA链断裂。中华病毒学杂志,1993;17(1):1 - 8。
Charriaut-Marlangue C, Ben-Ari Y.关于使用TUNEL染色测定细胞凋亡的警告。NeuroReport。1995; 7(1): 61 - 4。
Kolb HC, Finn MG, Sharpless KB。点击化学:不同的化学功能来自几个良好的反应。化学学报。2001;40(11):2004-21。
罗斯托夫采夫VV,绿色LG,福金VV,夏普莱斯KB。一种逐步的惠氏根环加成过程:铜(I)催化叠氮化物和末端炔的区域选择性“连接”。化学学报。2002;41(14):2596-9。
宫本N,中岛Y,和田H,斋藤Y。橡子虫神经系统的发育Balanoglossus simodensis:神经系统进化的洞见:半足状神经系统的发展。生物科学进展。2010;12(4):416-24。
张志刚,张志刚,张志刚,张志刚。网状和绳状肠的神经发生。组织潜水员学报。2015;15(2):405-22。
Strathmann MF。北太平洋海岸海洋无脊椎动物的繁殖和发育:卵、胚胎和幼虫研究的数据和方法。西雅图:华盛顿大学出版社;1987.
海洋无脊椎动物的繁殖。纽约:学术出版社;1974.
Grant PT, Mackie AM,编辑。海洋生物的化学接受。伦敦:学术出版社;1974.
维格斯沃斯VB。昆虫生理学。第七版。纽约:施普林格;2013.
哈德菲尔德毫克。海洋无脊椎动物的幼虫为何如此快速地蜕变。中国生物医学工程学报,2000;11(6):437-43。
里特。来自加利福尼亚海岸的一种新的舌蛛幼虫,它拥有内胚囊。Zool Anz, 1894; 17:24-60。
棘皮动物的发育和幼虫形态的研究。哥本哈根:比安科·卢诺斯;1921.p。261。
海洋幼虫的进化发育。进:Carrier T, Reitzel A, Heyland A,编辑。海洋无脊椎动物幼虫的进化生态学。牛津:牛津大学出版社;2017.
Brambell FWR, Cole HA。肠气菌的口前纤毛器官:它的发生、结构和可能的系统发育意义。环境科学学报。1939;B109(2): 181-93。
C主教,b厅,延缓发育:将细胞留作将来在发育和进化中使用。博卡拉顿:CRC出版社/泰勒和弗朗西斯集团;2020.
Seaver EC, Thamm K, Hill SD。两种多毛类环节动物的生长模式,Capitellasp.而且水螅虫线虫:不同生活史阶段的比较。生物科学进展。2005;7(4):312-26。
Strathmann RR。胚胎和幼虫进化中的功能设计。中国生物医学工程学报,2000;11(6):395-402。
C.后生动物的间接发育、转分化和宏观调控演化。中国生物医学工程学报(英文版);2010;29(3):344 - 344。
Vogt KC. Untersuchungen Über Die Entwicklungsgeschichte der Geburtshelferkröte (Alytes Obstetricans).1842.
埃斯塔贝尔J,默瑟A, König N,埃克斯布雷亚特J- m。细胞程序性死亡非洲爪蟾蜍光滑的脊髓,尾巴和其他组织,在变态前和变态期间。中国生物医学工程学报,2003;29(3):339 - 344。
冈田明,米勒TC,文玲,史永斌。Mad和Myc的平衡表达决定了幼虫细胞凋亡和成体干细胞的发育非洲爪蟾蜍肠道蜕变。细胞死亡,2017;8(5):e2787-810。
石矢冈A,史永波。甲状腺激素对成人肠上皮干细胞发育的调节作用非洲爪蟾蜍光滑的蜕变。科学通报,2007;36(12):3358-68。
默瑟,Pflüger H-J。程序性细胞死亡特别消除了蝗胸腋肌的一部分后,想象蜕皮。中国生物医学工程学报,1998;21(2):366 - 366。
李志刚,李志刚。完全变态过程中的细胞死亡。中国生物医学工程学报(英文版);
海胆发育过程中细胞程序性死亡的激素调控。生态环境学报。2021;8(9):733787。
Leise EM, Kempf SC, Durham NR, Gifondorwa DJ。海洋腹足类动物的变态诱导Ilyanassa obsoleta: 5HT, NO和程序性细胞死亡。中国生物学报。2004;55(1-4):293-300。
软体动物的细胞凋亡及其功能意义。细胞凋亡。2010;15(3):313 - 21所示。
李志刚,李志刚,李志刚。海胆幼虫变态发育过程中细胞凋亡的研究进展。中国生物医学工程学报。2002;26(2):344 - 344。
刘志强,李志强,李志强,等。海胆组胺受体1对细胞凋亡的调控作用Strongylocentrotus purpuratus.科学通报2018;8(1):4002。
Sato Y, Kaneko H,根岸S, Yazaki I.在海胆变态过程中,幼虫臂吸收与程序性细胞死亡同时进行Hemicentrotus pulcherrimus.中国生物医学工程学报,2006;26(3):851-60。
Lindsten T, Ross AJ, King A, Zong W-X, Rathmell JC, Shiels HA,等。促凋亡Bcl-2家族成员Bak和Bax的联合功能对多个组织的正常发育至关重要。生物化学学报,2000;6(6):1389-99。
罗曼一世,麦金尼斯N,博德默M,麦金尼斯w果蝇Hox基因畸形通过直接调控凋亡激活因子塑造头部形态收割者.细胞。2002;110(4):457 - 66。
动物发育与疾病中的程序性细胞死亡。细胞。2015;147(4):742 - 58。
赵国强,马杰提,魏士曼。程序性细胞移除:癌症发展道路上的一个新障碍。中华癌症杂志,2012;12(1):58-67。
浮游幼虫的生长与变态Ptychodera黄颜色(半索动物:肠鳃纲)。入:哈德菲尔德M,编辑。海洋无脊椎动物幼虫的沉降和变态。纽约:爱思唯尔;1978.247 - 54页。
布朗FD, Tiozzo S, Roux MM, Ishizuka K, Swalla BJ, De Tomaso AW。殖民海鞘中长寿种系前体的早期谱系规范Botryllus schlosseri.发展。2009;136(20):3485 - 94。
李志强,王志强,王志强,等。颅内干细胞系统的特征Isodiametra pulchra.生物医学工程学报,2009;9:469。
阿形K,中岛E,船山N,柴田N,齐藤Y,梅野勇。干细胞系统的两种不同进化起源及其分子基础。中国生物医学工程学报。2006;17(4):503-9。
柴田N,林林T,福村R,藤井J,库多-高松T,西村O,等。一种涡虫多能干细胞的综合基因表达分析Dugesia粳稻.中华流行病学杂志,2012;29(3):344 - 344。
Hemmrich G, Khalturin K, Boehm A-M, Puchert M,安东- erxleben F, Wittlieb J,等。水螅中三个干细胞谱系的分子特征和多细胞基础上干细胞功能的出现。中国生物医学杂志,2012;29(11):3267-80。
勒克莱尔,M Jager, Barreau C, Chang P, Le Guyader H, Manuel M,等。母体定位的细胞质mrna和刺胞动物的生殖细胞/干细胞形成Clytia.中国生物医学工程学报,2012;36(2):339 - 344。
脱绒海绵中的干细胞系统:建议涉及两种类型的细胞:原始细胞(活性干细胞)和囊泡细胞(食物包裹鞭毛细胞)。中国生物医学工程学报,2013;23(1):1 - 3。
闭合生殖细胞和干细胞的圆圈:原始干细胞假说。EvoDevo。2013; 4(1): 2。
Collins JJ, Wang B, Lambrus BG, Tharp ME, Iyer H, Newmark PA。人类寄生虫中的成体干细胞曼氏裂体吸虫.大自然。2013;494(7438):476 - 9。
贾世峰,李国强。海洋无脊椎动物幼虫的沉降与变态。入:贾家富,编辑。海洋无脊椎动物幼虫的定居和变态研讨会(1977年:多伦多,安大略省)。阿姆斯特丹:爱思唯尔;1978.
Emlet RB。“原始”海胆的幼虫形态和变形,Eucidaris thouarsi(棘皮科:棘皮总科:刺毛科),具有发育和系统发育研究的意义。生物通报,1988;174(1):4-19。
戴维森EH,彼得森KJ,卡梅伦RA。双侧体计划的起源:发育调节机制的进化。科学。1995;270(5240):1319 - 25所示。
Bird AM, von Dassow G, Maslakova SA。绒毛幼虫如何生长。EvoDevo。2014; 5(1): 13。
古哈,林林。器官更新和细胞分裂由分化的细胞组成果蝇.自然科学进展,2008;29(3):344 - 344。
中山石村A,昌本J,堀江文,佐藤N,佐仓杨。海鞘中变质路径的描述Ciona intestinalis.中国生物医学工程学报。2009;32(2):357-67。
田中K,杜鲁门JW。成人腿表皮的发育Manduca sexta:不同幼虫细胞群的贡献。中国生物医学工程学报,2005;26(2):344 - 344。
派瑞·刘,布贝尔M,汉森C,诺尔斯T.扩散管:一种大规模培养栉水母和其他远洋海洋无脊椎动物的方法。PeerJ。2020; 7 (8): e8938。
朱A,易卜拉欣JG,爱米。序列计数数据的重尾先验分布:去除噪声和保留大差异。生物信息学,2019,35(12):2084 - 92。
李志强,李志强。序列计数数据的差分表达式分析。基因组生物学。2010;11:12。
Lowe CJ, Tagawa K, Humphreys T, Kirschner M, Gerhart J.半hordate胚胎的获取,培养和基本方法。进:Lowe CJ,编辑。海胆、海鞘和其他无脊椎后口动物的细胞生物学发育方法,第74卷。剑桥:学术出版社;2004.p . 171 - 94。
Kuehn E, Clausen DS, Null RW, Metzger BM, Willis AD, Özpolat BD.段数阈值决定幼年种系集群扩张的开始沙蚕蠕虫.中国生物医学工程学报,2015;26(4):344 - 344。
埃德加钢筋混凝土。MUSCLE:多序列比对,精度高,通量大。中国生物工程学报,2004;32(5):1792-7。
Huelsenbeck JP, Ronquist F. MRBAYES:系统发生树的贝叶斯推断。生物信息学。2001;17(8):754 - 5。
Bruce H, Jerz G, Kelly S, McCarthy J, Pomerantz A, Senevirathne G,等。杂交链式反应。原位协议。2021。https://doi.org/10.17504/protocols.io.bunznvf6.
崔HMT, Schwarzkopf M, Fornace ME, Acharya A, Artavanis G, Stegmaier J,等。第三代原位杂交链式反应:多路,定量,灵敏,万能,稳健。发展。2018;145(12):dev165753。
确认
我们要感谢霍普金斯海洋站的工作人员和莫罗湾州立公园的工作人员,特别是文斯·西塞罗,约翰·塞耶斯和凯蒂·德雷克夏吉,他们为我们的收集提供了便利。我们要感谢太平洋生物科学的David Rank, Paul Peluso和Greg concepton, UC Berkeley的Dan Rokhsar和Biohub的Norma Neff对基因组资源开发的支持Schizocardium.我们感谢劳实验室的成员,特别是奥斯顿·拉特利奇,他培养了许多人Schizocardium幼虫,是收藏的宝贵伙伴。我们也感谢实验室成员Laurent Formery, Veronica Pagowski, José Andrade-Lopez, Nat Clarke, Paul Minor, Mark Salvacion和Catherine Rogers的有益讨论。我们特别感谢Lowe实验室前成员Paul Gonzalez在Schizocardium.最后,我们感谢Thurston Lacalli和审稿人对这篇手稿的有益评论。
资金
这项工作得到了合作CZ Biohub校园间研究奖和美国国家科学基金会(NSF)授予c.j.l.p.b.的1656628奖的支持,得到了美国国家科学基金会博士预科奖学金(DGE-1147470)、迈尔斯信托奖和哈德利纪念奖的支持。
作者信息
作者及隶属关系
贡献
PB和CJL构思了这项研究并撰写了论文。PB设计并进行实验,获取共焦图像,进行数据分析,生成所有图形。PB和MK设计并进行了辐照实验和分析。CS进行克隆,核糖体探针合成现场杂交,并为项目的智力发展做出了贡献。NEM对附加文件进行统计分析1: S1。JY进行Illumina测序。BW和CJL对思想的写作和发展做出了贡献。所有作者均已阅读并批准稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
不适用。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:S1。
中增殖细胞的附加特征美国californicum.A)睫状带与非睫状带Hoesch +数量的柱状图,误差柱为±1标准差(66%置信区间)。B)睫状带中EdU +细胞与非睫状带的柱状图,误差柱为±1 SD(66%置信区间)。C-F)全部:前向上;比例尺为100um。蓝色= Hoechst,绿色= EdU。C)变质早期EdU分布的腹侧图。D)变质中期EdU分布的俯视图。E)蜕变结束时EdU分布的侧面图。F)青少年EdU分布的腹侧视图。 G–H) Expression of h2b mRNA and EdU positive cells in the juvenile proboscis blue = Hoechst, yellow = h2b mRNA, green = EdU.
附加文件2:S2。
幼虫和幼虫转录组的差异表达,辐照和未辐照。A)幼虫转录组baseMean、log2FoldChange、lfcSE、pvalue、padj的差异表达。B)幼年转录组差异表达baseMean, log2FoldChange, lfcSE, pvalue, padj。C)的微分表达式匹威,“瓦萨”号,而且nano幼虫中含有baseMean, log2FoldChange, lfcSE, pvalue, padj。D)的微分表达式匹威,“瓦萨”号,而且nano在未成年的baseMean, log2FoldChange, lfcSE, pvalue, padj。
附加文件3:S3。
幼虫发育和变态过程中TUNEL的附加特征。全部:蓝色= Hoechst,灰色= TUNEL,比例尺100um。A)中翼体平面侧面图。B)晚期幼虫,TUNEL +细胞很少。C,突出区域B,少量TUNEL +细胞。C). D)在变形早期从图。7TUNEL +细胞增加。E)在中胚层中发现TUNEL +细胞。F)蜕变中期的腹侧图。G) DNAse-1变态人工切取DNA末端TUNEL标记阳性对照H)更深组织层检测TUNEL阳性对照插入
附加文件4:S4。
HCR候选基因的基因树。A) Lbr-1 B) Fgfr C) Spne-2的基因树
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
巴姆,P.,哈里顿,M.,斯塔伯特,C.。et al。半足虫幼虫与幼虫细胞增殖与死亡的比较Schizocardium californicum.EvoDevo13, 13(2022)。https://doi.org/10.1186/s13227-022-00198-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13227-022-00198-1
关键字
- 蜕变
- Hemichordate
- 柱头幼虫
- 细胞增殖
- 细胞死亡