摘要
背景
新兴研究表明,环状RNA hsa_circ_ 0023404及其靶标miR-217/MARK1轴在非小细胞肺癌和宫颈癌等癌症进展中发挥关键作用。然而,hsa_circ_0023404/miR-217/MARK1在子宫内膜癌(EC)中的作用尚未被研究。本研究旨在探讨hsa_circ_0023404在子宫内膜癌(EC)中的作用及其潜在的分子机制。
方法
我们采用RT-qPCR和Western blot方法检测EC细胞系中相关基因的表达水平。转染的siRNAs用于敲低细胞中相关mRNA的水平。采用CCK-8法和集落形成法检测细胞增殖情况。Transwell迁移侵袭试验用于检测细胞的迁移侵袭。
结果
RT-qPCR结果显示,3株子宫内膜癌细胞株hsa_circ_0023404和MARK1 mRNA表达上调,而mir -217 mRNA表达下调。siRNA敲低hsa_circ_0023404显著提高了miR-217水平,降低了Ishikawa细胞的增殖。对细胞迁移和侵袭也有抑制作用。Anti-miR-217可以逆转si-circ_0023404介导的石川细胞的增殖、迁移和侵袭。si- circ_0023404和anti-miR-217共转染Ishikawa细胞后,si- mark1恢复了被抑制的细胞增殖、迁移和侵袭。
结论
hsa_circ_0023404通过调控miR-217/MARK1轴在子宫内膜癌中发挥促瘤作用。hsa_circ_0023404像海绵一样抑制miR-217,抑制子宫内膜癌细胞的生长和转移。MARK1是miR217的下游靶点,经hsa_circ_ 0023404/miR-217轴上调,参与子宫内膜癌的进展。
简介
子宫内膜癌(EC)是最常见的妇科癌症之一,也是女性中第四大常见癌症。全球EC患者的发病率和死亡率仍然很高[1].每年,全世界约有14万女性患上子宫内膜癌,估计有4万女性死于这种癌症。大多数EC病例在绝经后诊断,最高发病率在70岁左右。生存期通常由疾病的分期和组织学决定,不同分期和组织学类型的子宫内膜癌预后差异很大。最常见的病变(I型)通常是激素敏感的,分期低,预后好,而II型肿瘤分级高,即使在早期也容易复发[2].
最近大规模的基因组研究表明,大量的非编码rna(如microRNAs和长链非编码rna)与妇科疾病的发生有关[3.,4].Circular RNAs (circRNAs) belongs to a new class of non-coding RNAs and are formed by a peculiar pre-mRNA with a covalently closed continuous loop. Due to its structures, circRNA are resistant to degradation by exonuclease activity and more stable than linear RNAs. circRNAs have been implicated in microRNA (miRNA) sequestration, modulation of protein–protein interactions and regulation of mRNA transcription. Among them, the most striking function is acting as a miRNA sponge and regulate the expression of their downstream genes [5,6].MicroRNAs (miRNAs或miRs)是一类非编码RNA分子,通过与3′非翻译区(UTR)的互补位点相互作用,负向调节信使(m) RNA的翻译[7].许多miRNAs通过直接靶向癌基因或肿瘤抑制基因作为肿瘤调节基因[8].CircRNAs不仅涉及细胞生理功能,而且涉及包括癌症在内的各种人类病理。研究发现,环状rna在人类癌症组织中被异常调节。此外,目前的研究重点是了解环状rna在人类癌症诊断、预后预测和最终治疗干预中的可能意义[3.].
CircRNA hsa_circ_0023404 (chr11: 71668272-71671937)来源于无名指蛋白121 (RNF121, NM_018320)的mRNA。越来越多的证据支持hsa_circ_0023404在癌症进展中发挥关键作用。如hsa_circ_0023404可通过调控miR-217/ZEB1轴促进非小细胞肺癌(non-small cell lung cancer, NSCLC)的增殖、迁移和侵袭[9].与miR-con组相比,过表达miR-217在体外降低了pGL3-circ_0023404-WT报告载体的相对荧光素酶活性,并强烈验证了hsa_circ_0023404与miR-217相互作用并吸附miR-217。另有研究表明hsa_circ_0023404通过调控miR-5047和miR-136/TFCP2 /YAP通路参与宫颈癌[10].最近,越来越多的证据表明miR - 217可以根据细胞类型调节肿瘤生物学[11,12].据观察,WNT、丝裂原活化蛋白激酶(MAPK)和PI3K/AKT信号通路是miR-217在不同癌症中的重要分子靶点,并有助于癌症进展[13].MAPK1被确定为miR - 217的新靶点,是RAS/RAF/MAPK通路的关键成分,在约30%的人类癌症组织中被激活。活化的MAPK1转位到细胞核,催化ETS(红母细胞转化特异性)、ELK-1 (ETS Like-1蛋白)、c-Fos等多种核转录因子磷酸化,激活ErbB、VEGF等多种靶基因,促进肿瘤的进展[14,15].研究表明,抑制MAPK1可阻断前列腺癌肿瘤的生长和转移[16].研究发现miR - 217可以抑制以MAPK1为靶点的结直肠癌的致瘤性[17].
这表明hsa_circ_0023404及其靶细胞miR-217/MARK1轴在非小细胞肺癌和宫颈癌等癌症进展中发挥关键作用,但hsa_circ_0023404/miR-217/MARK1在子宫内膜癌中的作用尚未被研究。在本研究中,我们研究了hsa_circ_0023404在促进与miR-217/MAPK1轴相关的子宫内膜癌细胞中的作用。
方法
细胞培养
人子宫内膜内皮细胞(HEEC)和人子宫内膜癌细胞(Ishikawa, RL95-2和KLE)购自美国类型培养收藏(ATCC, USA)或国家细胞系资源基础设施(Beijing, China)。细胞在含有10%胎牛血清(FBS;PAN生物技术,德国)和1%青霉素/链霉素(Solarbio,中国)在37°C和5% CO2.
RT-qPCR
用Neurozol试剂(machery - nagel, Germany)提取总RNA,用反转录试剂盒(PROMEGA, USA)生成cDNA。采用SYBR Green PCR试剂盒(TaKara,中国)进行实时PCR。U6和GAPDH是内部控制。然后根据制造商提供的说明在ABI 7500 Real-time PCR系统(Applied Biosystems, Thermo Fisher Scientific, USA)上进行qPCR分析。通过与U6或GAPDH比较,使用2−ΔΔCT法计算基因的相对表达量。引物的使用方法如下:
miR-217 FORWARD: CGCGTACTGCATCAGGAACTG;
miR-217 REVERSE: AGTGCAGGGTCCGAGGTATT;
miR-217-5p RT (anti-miR-217)引物:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCCAAT;U6转发:ctcgttcggcagcaca;
U6 reverse: aacgcttcacgaatttgcgt;
circ_0023404 FORWARD: ACCGTGGCCATGAAGCTATG;
circ_0023404REVERSE: GGTCACCATATTGTAGGAGCGT;
Gapdh转发:agaaggctggggctcatttg;
Gapdh反转:aggggccatccacagtcttc;
Mapk1转发:cagttcttgacccctggtcc;
Mapk1 reverse: gtacatactgccgcaggtca。
细胞转染
si-NC(阴性对照)序列:UUCUCCGAACGUGUCACGUTT, si-circRNA (si-hsa_circ_0023404 # 1-3;#3序列:GGUUCCUGCUAAUCUAUAATT, miR-217或anti-miR-217由GenePharma(中国上海)合成。使用Lipofectamine 3000试剂(Life Technologies, USA)转染Ishikawa细胞,然后在37°C和5% CO中培养248-72小时。
CCK-8法检测细胞增殖
将Ishikawa细胞以2 × 10E3个/孔的比例在96孔板中,在含10% FBS的培养基中培养24 h。siRNA转染后,在每孔中加入10 μl细胞计数试剂盒-8 (CCK-8, CK04, Dojindo, Japan), 5% CO中培养2 h237°C恒温箱。在GloMax™96 MICROPLATE (Promega, USA)中读取每孔在450nm处的吸光度。
菌落形成试验
siRNA转染Ishikawa细胞48 h后胰蛋白酶化,分配到6孔板,密度为800个细胞/孔。当菌落中细胞数量大于50个时,用10%甲醛固定菌落10 min,用0.5%结晶紫染色菌落5 min。拍照,用ImageJ计算菌落数量。
Transwell迁移和侵袭试验
迁移实验中,转染的Ishikawa细胞(1 × 10E5细胞)悬浮在200 ul无血清培养基中,然后在顶部室中播种。下腔中加入含10% FBS的培养基。孵育24 h后,用4% PFA固定下腔下表面的细胞,用0.1%晶体染色。从五个随机选择的显微镜视野中计数细胞。对于入侵检测,Transwell插入物(Fisher Scientific, USA)涂有Matrigel (BD, USA)。孵育24 h后,轻轻去除Transwell膜上表面的细胞,将Transwell膜下表面的细胞固定,用结晶紫染色,从5个随机选择的显微镜视野中计数。
西方墨点法
收集细胞并用RIPA缓冲液(Beyotime,中国)裂解。等量的蛋白质在SDS-PAGE上分离,转移到PVDF (Millipore, USA)。然后,将膜与抗mark1 (Cat:125403, Novopro,中国)和抗肌动蛋白(Sigma,美国)一起孵育。ECL底物用于蛋白质条带的可视化(Millipore,美国)。
统计分析
所有实验重复3次,所有数据以均数±标准差(SD)表示。所有统计分析均采用GraphPad 8.0软件。分别采用学生t检验和单向方差分析以及Bonferroni事后检验对2组或多组进行分析。*意味着p< 0.05;* *意味着p< 0.01;* * *意味着p< 0.001。
结果
Hsa_circ_0023404、miR-217和MARK1 mRNA在子宫内膜癌细胞系中的表达
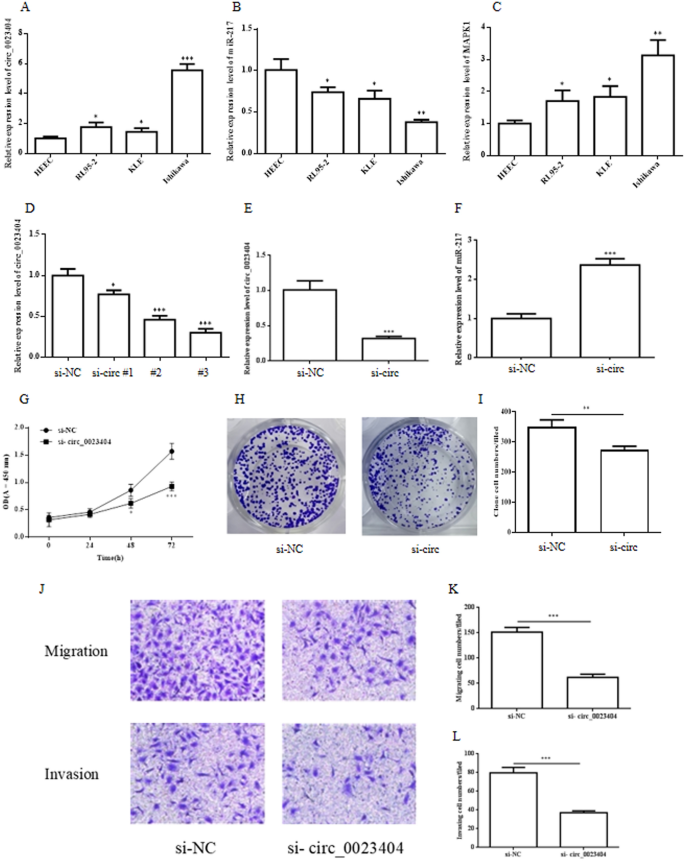
为了研究hsa_circ_0023404及其靶标miR-217/MARK1轴在子宫内膜癌细胞系中的作用,应用RT-qPCR检测hsa_circ_0023404、miR-217和MARK1 mRNA在人子宫内膜内皮细胞(HEEC)和三种人子宫内膜癌细胞(RL95-2、KLE和Ishikawa)中的表达水平。结果表明,hsa_circ_0023404(图;1A)和MARK1(图;1C)与HEEC相比,RL95-2、KLE和Ishikawa细胞系中表达上调。相反,miR-217(图;1B)与HEEC相比,RL95-2、KLE和Ishikawa细胞系下调。在三个细胞系中,石川细胞的结果最为显著,我们将石川细胞用于进一步的研究。
hsa_circ_0023404基因敲除在子宫内膜癌细胞中的作用收集HEEC和Ishikawa、RL95-2、KLE子宫内膜癌细胞株的总RNA,进行RT-qPCR检测。RT-qPCR检测hsa_circ_0023404 (一个), miR-217 (B)和MARK1 mRNA (C)在HEEC、Ishikawa、RL95-2、KLE子宫内膜癌细胞系中表达。用对照si-NC和si-circ_0023404 # 1-3转染Ishikawa细胞48 h, RT-qPCR分析。RT-qPCR分析Ishikawa细胞中si-circ_0023404(si-circ) # 1-3下调hsa_circ_0023404水平(D).hsa_circ_0023404 (E)和miR-217 (F)转染si- circ# 3后采用RT-qPCR方法进行分析。CCK-8法检测细胞增殖(G)和菌落形成试验(H,我)转染si-NC或si-circ_0023404的Ishikawa细胞。石川细胞转染si-NC或si-circ_0023404 (J).Transwell迁移的统计数据(K)和入侵(l)对转染si-NC或si-circ_0023404的石川细胞进行检测
hsa_circ_0023404下调可诱导miR-217抑制子宫内膜癌细胞增殖、迁移和侵袭
由于hsa_circ_0023404在子宫内膜癌细胞中表达上调,我们通过在Ishikawa细胞中用si-circ_0023404敲低hsa_circ_0023404来研究其在子宫内膜癌中的生物学作用。结果显示,与RT-qPCR分析的对照siRNA (si-NC)相比,所有针对hsa_circ_0023404的三种siRNA均显著降低了Ishikawa细胞中hsa_circ_002340 mRNA的表达(图2)。1D).在所有siRNA中,siRNA#3效率最高,并被用于后续实验。接下来,我们检测了si-circ_0023404对Ishikawa细胞中miR-217表达的影响,结果显示si-circ_0023404 #3降低了circ_0023404的水平(图2)。1E)而miR-217水平上调(图。1F).这与circ_0023404作为miRNA海绵抑制miR-217表达一致。我们的数据进一步表明,hsa_circ_0023404的下调显著降低了CCK-8法检测到的Ishikawa细胞的增殖(图2)。1G)。与对照组相比,hsa_circ_0023404的下调也显著降低了Ishikawa细胞的集落形成能力(图。1通过Transwell迁移实验分析,hsa_circ_0023404基因的下调抑制了Ishikawa细胞的迁移和侵袭(图2)。1J, K)和Transwell侵袭试验(图;1这些数据表明hsa_circ_0023404促进了子宫内膜癌细胞的增殖、迁移和侵袭。
miR-217在子宫内膜癌细胞中抑制细胞增殖、迁移和侵袭
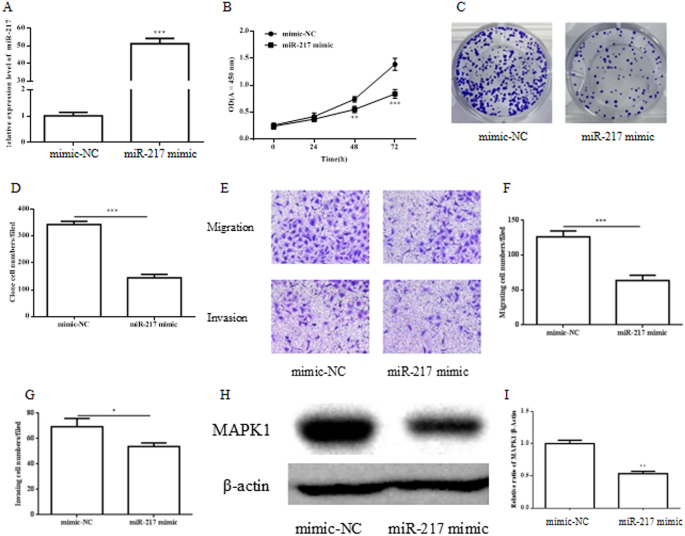
为了研究miR-217在子宫内膜癌细胞中的作用,Ishikawa细胞转染mimic NC和miR-217 mimic。通过RT-qPCR验证转染miR-217 mimic的表达。2A). CCK-8实验表明,miR-217模拟物显著降低了Ishikawa细胞的增殖(图。2B).与mimic NC相比,miR-217 mimic也显著降低了Ishikawa细胞的集落形成能力(图。2C, D)。同时,它表明miR-217减少了Transwell迁移实验分析的Ishikawa细胞的细胞迁移和侵袭(图。2E, F)和Transwell侵袭试验(图。2E, G)。MARK1是miR-217的靶点,WB分析表明miR-217模拟转染降低了Ishikawa细胞中MARK1蛋白的表达(图。2H, I)。这些数据表明,miR-217在抑制子宫内膜癌细胞增殖、迁移和侵袭中起着关键作用,MARK1蛋白是miR-217的下游靶点之一。
hsa_circ_0023404通过海绵miR-217促进子宫内膜癌细胞的增殖、迁移和侵袭
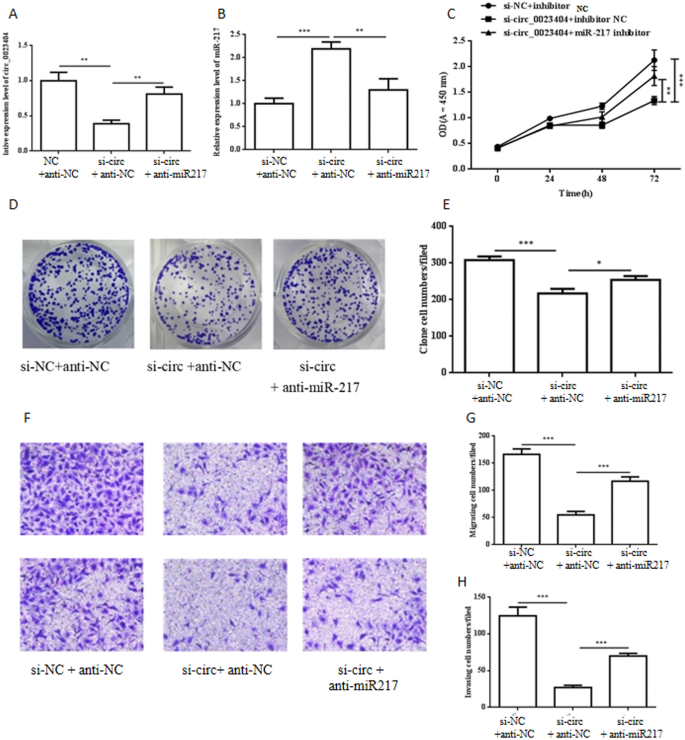
研究表明,miR-217是hsa_circ_0023404的一个海绵靶点,我们通过与si-circ_0023404和anti-miR-217 (miR-217抑制剂)共转染来检测它们的相互作用。共转染显示si-circ_0023404降低了hsa_circ_0023404的表达水平,而anti-miR-217则增加了hsa_circ_0023404的表达水平。3.一个);si-circ_0023404增加了miR-217的表达水平,而anti-miR-217阻断了增加的miR-217(图。3.B). CCK-8实验显示,hsa_circ_0023404的下调降低了Ishikawa细胞的增殖,但anti-miR-217逆转了这种下降(图。3.C, D). Transwell迁移和侵袭试验(图;3.E, F)也表明anti-miR-217阻断了si-circ_0023404介导的石川细胞的迁移和侵袭。综上所述,这些数据表明anti-miR-217可以通过si-circ_0023404阻断石川细胞的增殖、迁移和侵袭,与hsa_circ_0023404作为miR-217的海绵作用一致。
MARK1参与hsa_circ_0023404/ mir -217介导的子宫内膜癌生物学行为
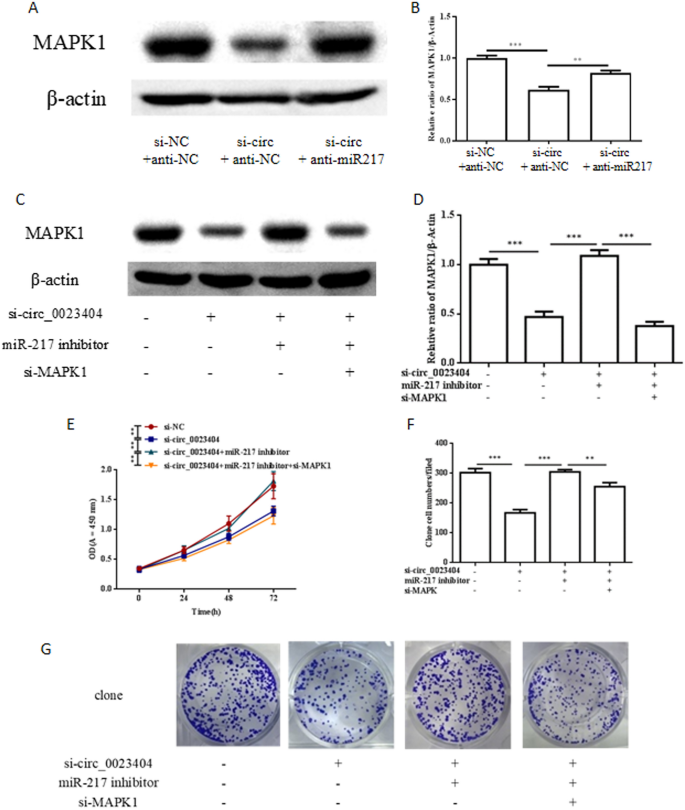
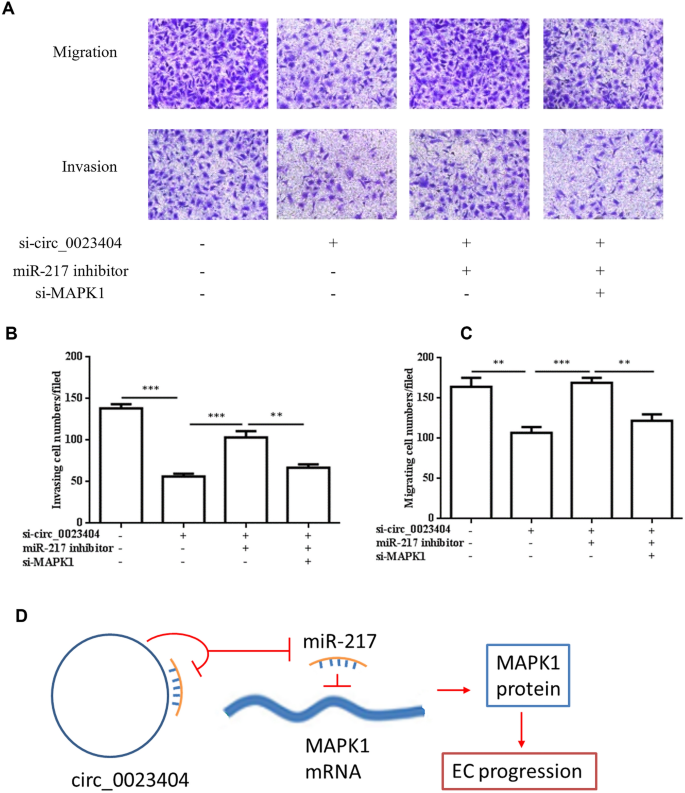
MARK1是miR-217的潜在靶标,我们的数据显示,anti-miR-217增加了被si_circ_0023404和anti-miR-217共转染阻断的MARK1蛋白水平,支持MARK1位于hsa_circ_0023404/mirR217轴的下游(图2)。4A). Western blot显示si-MARK1可通过与si_circ_0023404和anti-miR-217共转染下调诱导的MARK1。通过CCK8实验分析,si- circ_0023404和anti-miR-217共转染Ishikawa细胞后,si- mark1恢复了被抑制的细胞增殖。4E)和菌落形成试验(图。4F, G)。同时,这表明si-MARK1恢复了迁移中的抑制(图。5A, B)和入侵(图;5通过Transwell迁移和侵袭实验分析si-circ_0023404和anti-miR-217共转染Ishikawa细胞的A, C)。这些数据支持MARK1位于hsa- circ_0023404/miR-217轴的下游,si-MARK1敲低MARK1可以阻断si-circ_0023404/miR-217轴介导的癌症生物学的促进作用。
讨论
大量研究支持环状RNA hsa_circ_0023404与肿瘤发生有关。在本研究中,我们发现hsa_circ_0023404在子宫内膜癌细胞系中表达上调,miR-217下调。hsa_circ_0023404下调导致miR-217升高,抑制子宫内膜癌细胞的增殖和转移。Anti-miR-217可逆转si-circ_0023404的吸吸作用。这些数据表明hsa_circ_0023404通过海绵miR-217促进子宫内膜癌细胞的增殖、迁移和侵袭。在进一步的研究中,敲低MARK1阻断了si-circ_0023404/miR-217轴介导的癌症生物学的促进,支持MARK1是miR-217的靶标,参与了circ_0023404/miR-217介导的子宫内膜癌生物学。
在人类癌症中,环状rna参与了肿瘤细胞增殖、上皮-间质转化、侵袭、转移和化疗耐药等致癌活性的控制。最广泛描述的环状rna的作用机制是它们能够作为mirna、lncrna和mrna的竞争内源性rna (ceRNAs),从而沿其轴影响[2,18,19].多项研究表明,circRNA hsa_circ_0023404在肿瘤发生中起着关键作用。例如,它通过海绵miR-5047通过VEGFA和自噬信号增强宫颈癌转移和化疗耐药性[10].hsa_circ_0023404也通过/miR-136/TFCP2/YAP轴参与宫颈癌进展。hsa_circ_0023404通过抑制miR-136促进TFCP2表达,从而激活YAP信号通路[20.].hsa_circ_0023404被证明与miR-217/ZEB1轴相互作用,促进NSCLC细胞的生长、迁移和侵袭[9].本研究为hsa_circ_0023404通过调控miR-217/MARK1轴促进子宫内膜癌细胞增殖、迁移和侵袭提供了有力证据。
miRNA表达异常参与恶性肿瘤,miRNA可能作为肿瘤抑制因子或癌基因参与人类癌症的进展。作为一种miRNA, miR - 217与肿瘤进展和不良预后密切相关[21,22].先前的研究报道miR - 217与其靶mRNA结合抑制肿瘤的形成和进展,包括胃癌[22].生物信息学鉴定MARK1蛋白是癌细胞miR - 217的靶标。在MAPK1 3' utr中有两个miR - 217的结合序列,荧光素酶活性测定证实了这一点[23].既往研究一致表明,miR-217下调MAPK1促进肝癌细胞的转移和EMT过程,提示miR-217通过负调控MAPK1表达抑制肝癌[24].多项证据表明miR217-MAPK轴参与了肿瘤的发生。例如,研究发现miR-217-5p的诱导凋亡潜能可通过阻断结直肠癌细胞的多个靶基因PRKCI、BAG3、ITGAV和MAPK1诱导细胞凋亡[25].也有报道称circMAN2B2在HCC中作为肿瘤mirna通过海绵miR-217促进MAPK1的表达[26].
MAPK通路通过激活转录因子ELK1、C-Fos、ErbB、VEGF等靶基因,有效参与调控癌细胞增殖、侵袭和存活,促进肿瘤的进展[14,15].既往研究证实MAPK1表达增加在人肝细胞癌(HCC)中可作为肿瘤启动子[27,28]、卵巢癌[29]及子宫颈癌[30.].lncRNA RHPN1-AS1激活ERK/MAPK通路,促进子宫内膜癌细胞增殖、迁移和侵袭[31].另一项研究表明II型跨膜丝氨酸蛋白酶4TMPRSS4激活MAPK和AKT与子宫内膜癌的进展有关[32].这些数据证明MAPK可以被非编码RNA (non-coding RNA, ncRNA)调控,包括lnRNA和cirRNA等。在本研究中,我们的数据显示MARK1是hsa_circ_0023404/miR-217轴的下游靶点,参与了子宫内膜癌的进展。
随着RNA测序技术的进步和生物信息学的快速发展,发现大量环状RNA广泛参与多种癌症相关发病机制和耐药,并在人类癌症中作为诊断和预后的生物标志物和治疗靶点[33].环状rna强大的功能和独特的性质使其成为科学和临床研究的焦点。由于共价闭合连续环的结构,circRNAs相对稳定,在血浆、血清、外泌体和尿液等体液中稳定存在,含量较高。因此,circRNA有可能作为一种基于液体活检的新型生物标志物,用于监测包括肺癌在内的癌症的发生和进展[34]、子宫内膜癌[35]、膀胱癌[36]、前列腺癌[37)等。卵巢癌患者的circBNC2水平下调,circSETDB1水平升高[38].Hsa_circ_ 0109046和hsa_circ_0002577在子宫内膜癌患者血清中升高[39].circRNA独特的细胞稳定性和吸收miRNA和蛋白质的能力可能使circRNA成为一种有前途的癌症治疗载体[40].
在本研究中,我们揭示了hsa_circ_0023404/miR-217/MAPK参与子宫内膜癌进展的分子机制。然而,有几个限制。首先,完全依靠体外实验得出结论是有局限性的,因此,我们将进一步开展hsa_circ_0023404/miR-217/MAPK轴参与子宫内膜癌的体内实验。第二,hsa_circ_0023404在液体活检中的应用没有应用于子宫内膜癌患者。我们将收集患者,研究其血液样本中hsa_circ_0023404/miR-217/MAPK的水平,并研究其作为子宫内膜癌新型生物标志物的潜力。
结论
在本研究中,我们的数据表明hsa_circ_0023404通过调节miR-217/MARK1轴在子宫内膜癌中发挥促瘤作用。hsa_circ_0023404作为海绵抑制miR-217, miR-217抑制子宫内膜癌细胞的生长和转移。MARK1是miR217的下游靶点,hsa_circ_0023404通过抑制miR217诱导的MARK1有助于子宫内膜癌的进展(图2)。5D).短发夹RNA (short hairpin RNA, shRNA)或CRISPR技术靶向或敲除hsa_circ_0023404将是子宫内膜癌的一种潜在治疗方法,将在未来进行研究。
数据可用性
在当前研究期间生成和/或分析的数据集可根据合理要求从通信作者处获得。
参考文献
Braun MM, Overbeek-Wager EA, Grumbo RJ。子宫内膜癌的诊断和治疗。美国内科医生杂志。2016;93(6):468-74。
郭娟,童娟,郑娟。环状rna在子宫内膜癌诊断中的应用前景。癌症管理决议2021;13:1651-65。
冯temaggi G, Turco C, Esposito G, Di Agostino S.环状rna在人类癌症中的新分子机制和临床影响。癌症。2021;13(13):3154。
阿纳斯塔西亚杜E,雅各布LS, Slack FJ。癌症中的非编码RNA网络。中华癌症杂志,2018;18(1):5-18。
尼萨尔,Bhat AA,辛格M, Karedath T, Rizwan A, Hashem S,等。深入了解circrna的作用:生物发生、特征、功能和人类恶性肿瘤的临床影响。前沿细胞发育生物学。2021;9:617281。
唐旭,任宏,郭明,钱杰,杨勇,顾晨。环状rna及其在癌症中的作用研究进展。中国生物工程学报,2017;19(2):394 - 397。
Kalla R, Ventham NT, Kennedy NA, Quintana JF, Nimmo ER, Buck AH,等。MicroRNAs: IBD的新参与者。肠道。2015;64(3):504 - 17所示。
孔永伟,孙晓明,王晓明,王晓明。microrna在肿瘤治疗中的应用。中华肿瘤学杂志,2012;13(6):e249-58。
刘超,张振,齐迪。环状RNA hsa_circ_0023404通过调控miR-217/ZEB1轴促进非小细胞肺癌的增殖、迁移和侵袭。Onco Targets Ther. 2019; 12:6181-9。
郭洁,陈敏,艾刚,毛伟,李华,周杰。Hsa_circ_0023404通过海绵miR-5047通过VEGFA和自噬信号增强宫颈癌转移和化疗耐药。Biomed Pharm, 2019;115:108957。
Menghini R, Casagrande V, Cardellini M, Martelli E, Terrinoni A, Amati F,等。MicroRNA 217通过沉默信息调节器调节内皮细胞衰老循环。2009;120(15):1524 - 32。
夏浩,黄璐,许克明。MicroRNA-216a/217诱导的上皮-间充质转化靶向PTEN和SMAD7促进肝癌耐药和复发。肝脏病学。58 2013;(2):629 - 41。
张志刚,张志刚,张志刚,张志刚,张志刚,等。MicroRNA-217:一种治疗和诊断肿瘤标志物。中国生物医学工程学报。2002,22(1):61-76。
杨林,郑林,程文杰,丁建林。ERK1/2底物对潜在联合免疫治疗的综合分析。药物动态,2019;40(11):897-910。
郭玉杰,潘文文,刘树生,沈泽峰,徐勇,胡丽丽。ERK/MAPK信号通路与肿瘤发生。实验医学2020;19(3):1997-2007。
张艳,刘瑞,李震,王玉玲。rna结合蛋白PCBP1通过抑制丝裂原活化蛋白激酶1在前列腺癌中的抑癌作用。中国生物化学杂志,2018;48(4):1747-54。
张楠,陆超,陈磊。miR-217在结直肠癌中通过靶向MAPK信号通路调控肿瘤生长和凋亡。生态学报,2016;12(6):4589-97。
吴俊,M Cieslik,张勇,舒克拉,肖林,张勇,等。环状RNA在癌症中的分布。2019;176(4):869-81 e13。
Tran AM, Chalbatani GM, Berland L, De Los C, Santos M, Raj P, Jalali SA,等。女性生殖系统和乳腺癌生物标志物和治疗的新世界:环状rna。前置细胞发育生物学,2020;8:50。
张娟,赵霞,张娟,郑霞,李峰。环状RNA hsa_circ_0023404通过调控miR-136/TFCP2/YAP通路在宫颈癌中发挥致癌作用。生物化学学报。2018;501(2):428-33。
田玉文,沈强,姜庆峰,王彦宇,李凯,薛兆辉。miR-34a和miR-217水平下降是肝细胞癌侵袭性进展和不良预后的预测生物标志物。中国医学杂志,2017;
张强,袁勇,崔娟,肖涛,姜东。MiR-217通过靶向DACH1促进乳腺癌肿瘤增殖。中华癌症杂志,2015;6(2):184-91。
朱玲,杨珊珊,王娟。miR-217通过调控MAPK1抑制HeLa细胞的迁移和侵袭。中华分子医学杂志,2019;44(5):1824-32。
王华,柯洁,郭强,Barnabo Nampoukime KP,杨萍,马凯。Long非编码RNA CRNDE通过miR-217/MAPK1轴促进肝癌细胞增殖、迁移和侵袭。中华细胞医学杂志,2018;22(12):5862-76。
Flum M, Kleemann M, Schneider H, Weis B, Fischer S, Handrick R等。miR-217-5p通过直接靶向PRKCI、BAG3、ITGAV和MAPK1诱导结直肠癌细胞凋亡。中国生物医学工程学报,2018;12(2):451-66。
王丽萍,王建平,王xp。HOTAIR通过靶向miR-217促进肝癌的生长。中国生物医学工程学报,2018;15(5):7963-72。
Guegan JP, Ezan F, Theret N, Langouet S, Baffet G. MAPK信号通路在顺铂诱导死亡中的作用:ERK1优于ERK2在人肝癌细胞中的作用。致癌作用。2013;34(1):38-47。
林玲,韩敏敏,王峰,徐丽丽,于海霞,杨碧。CXCR7刺激MAPK信号通路调控肝细胞癌进展细胞死亡,2014;5:e1488。
T奕伟,华华,G辉,M毛,向玲。HOTAIR与MAPK1相互作用调控卵巢癌skov3细胞增殖、迁移和侵袭。医学科学,2015;21:1856-63。
李晓文,Tuergan M, Abulizi G. MAPK1在宫颈癌中的表达及MAPK1基因沉默对上皮-间质转化、侵袭和转移的影响。中华热带医学杂志,2015;8(11):937-43。
张新军,齐国涛,张新民,王玲,李富峰。lncRNA RHPN1-AS1通过激活ERK/MAPK通路促进子宫内膜癌的进展。《妇产科杂志》2021;47(2):533-43。
肖华,张珍,彭东,魏晨,马波。Type II跨膜丝氨酸蛋白酶4 (TMPRSS4)通过激活MAPK和AKT促进子宫内膜癌细胞(HEC1A和Ishikawa)的增殖、侵袭和上皮-间质转化。Anim Cells Syst(首尔)。2021; 25(4): 211 - 8。
唐强,韩军。环状RNA在人类癌症中的生物学作用及机制。Onco Targets Ther. 2020; 13:2067-92。
Ferreira D, Miranda J, martinez - lopes P, Adega F, Chaves R.在非小细胞肺癌患者液体活检中检测EGFR和ALK基因改变的未来展望。中国生物化学杂志,2015;22(8):381。
Muinelo-Romay L, Casas-Arozamena C, Abal M.子宫内膜癌的液体活检:个性化肿瘤学的新机遇。国际分子化学杂志,2018;19(8):2311。
Crocetto F, Barone B, Ferro M, Busetto GM, La Civita E, Buonerba C,等。膀胱癌的液体活检:技术现状和未来展望。暴击Rev Oncol Hematol. 2022;170: 103577。
Crocetto F, Russo G, Di Zazzo E, Pisapia P, Mirto BF, Palmieri A,等。液体活检在前列腺癌治疗中的应用——当前的挑战和未来的展望。癌症。2022;14(13):3272。
王伟,王娟,张霞,刘刚。血清circSETDB1是预测高级别浆液性卵巢癌铂-紫杉联合化疗反应和复发的有前景的生物标志物。Onco Targets Ther. 2019; 12:7451-7。
徐红,龚震,沈勇,方勇,钟珊。子宫内膜癌患者血清细胞外囊泡中环状RNA的表达。表观基因组学,2018;10(2):187 - 97。
何亚平,刘杰,李峰,杨宝宝。靶向环状rna作为治疗方法:当前策略和挑战。信号传输目标,2021;6(1):185。
确认
不适用。
资金
本研究由福建省自然科学基金(No. 2020J011335)资助。
作者信息
作者及隶属关系
贡献
ZC、QH和CH设计了研究;ZC、MH、JY、YL进行实验,收集并分析数据;ZC, QH和CH撰写了手稿。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
未裁剪的Western blot图像。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
陈震,黄敏,游杰,陈震。et al。环状RNA hsa_circ_0023404通过调控miR-217/MAPK1轴促进子宫内膜癌细胞增殖、迁移和侵袭。欧洲医学杂志27, 242(2022)。https://doi.org/10.1186/s40001-022-00866-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s40001-022-00866-x
关键字
- hsa_circ_0023404
- mir - 217
- MARK1
- 环状RNA
- 子宫内膜癌