摘要
外泌体是一种细胞外囊泡(EVs),是由核酸、蛋白质和DNA等异质内容物组成的脂质颗粒。这些双层颗粒由各种细胞(如肿瘤细胞)自然释放到细胞外周。鉴于外泌体具有独特的特性,它们可以作为生物和药物颗粒(如药物)的载体和载体,用于输送到所需的区域。b细胞恶性肿瘤中循环外泌体所包含的蛋白质和rna被认为是诊断和预后生物标志物以及治疗药物的有前途的来源。外泌体还可以在任何特定时间提供肿瘤和转移景观的“快照”视图。此外,临床研究表明,由树突状细胞等免疫细胞产生的外泌体可以刺激免疫系统,因此这些外泌体可以用于抗肿瘤疫苗。尽管外泌体在诊断和治疗领域具有巨大的潜力,但仍需要进一步的研究以达到趋同的目的。本文综述了外泌体在多种免疫相关疾病中的应用,包括慢性淋巴细胞白血病、多发性硬化症和关节炎类风湿性关节炎,并解释了外泌体治疗的各个方面以及外泌体在疾病诊断中的功能。
简介
b细胞疾病包括一类高度异质性的疾病。虽然有一部分病人没有出现症状,在不接受治疗的情况下仍保持稳定,但也有一部分病人表明病情进展迅速,需要紧急治疗[1].新出现的证据表明,在b细胞相关的恶性肿瘤中,如b细胞慢性淋巴细胞白血病(B-CLL),癌细胞需要与肿瘤微环境(TME)相互作用才能生存和增殖[2,3.].实际上,肿瘤细胞在体内的生长主要受TME的影响,TME包括免疫细胞和细胞外基质成分,如细胞因子和基质成分[4,5].最近,CLL细胞的“远程”通信工具被发现,它们参与新的分子结构,即细胞外囊泡(EVs)。这些颗粒根据其大小和生物发生机制被分为四类,所有类型的细胞都分泌这些颗粒[6,7].电动汽车第一次被发现时,人们认为它们是一种“垃圾桶”,用来清除来自外部电池的不寻常物质。后来,越来越多的证据表明,ev充当了从亲代细胞释放到其他组织的功能递送信封。目前,它们被认为是在近距离和远距离的细胞交叉对话中发挥关键作用的新角色,促进了健康和疾病的细胞通信[8,9].
外泌体作为ev之一,负责脂质、蛋白质和核糖核酸物种等生物活性分子(包括mrna、miRNAs和lncRNAs)的功能转移[10].外泌体可以被大多数类型的细胞分泌和吸收,包括免疫细胞。细胞内蛋白质和细胞外刺激调节来自免疫细胞的外泌体的生物发生、分泌和摄取。免疫细胞衍生的外泌体可调节癌症的进展和转移,促进先天免疫和适应性免疫之间的相互作用[11].在免疫细胞中,B细胞作为体内外泌体的潜在主要来源越来越明显[12].B细胞来源的外泌体可以通过抑制抗肿瘤T细胞反应在疾病发病机制如癌症中发挥关键作用[13].
外泌体被称为双层脂膜囊泡,含有丰富的脂类,特别是鞘磷脂、磷脂酰丝氨酸、糖脂GM3和磷脂酰乙醇胺[14].这些分子来源于亲本细胞,在胞吐过程中,外泌体能够携带它们的货物通过血流和淋巴管到达靶细胞,从而影响靶细胞的代谢和表型[15].事实上,在正常和肿瘤情况下,外泌体的数量和货物的组成可能是不同的,这是肿瘤异质性的一个指标[16].外泌体的含量反映了细胞的激活状态,并可能受到来自起源组织的病理过程的影响。事实上,释放外泌体是一种细胞适应机制,外泌体的生物成因组成及其分泌受到细胞微环境的影响。由于目前高通量转录组评估方法的进展,分析整个外泌体的微量生物材料已变得可行[17].
在抗原提呈细胞分泌的外泌体上,糖基磷脂酰肌醇锚定蛋白以及作为补体调节因子的CD55和CD59是外泌体特异性的脂质标记物[18,19].外泌体本身不能合成功能蛋白,但当RNA货物被转移到受体细胞时,外泌体有能力在第一时间改变功能蛋白[20.].有说服力的证据表明,外泌体mrna的调控是通过附着miRNA进行的[21].与蛋白质或miRNA不同,外泌体mrna还没有引起学者的注意,被用作疾病相关的生物标志物。除了一些技术挑战之外,由于外泌体内容物的选择性包装,外泌体mrna并不能真正代表原始细胞的状态。此外,外泌体mrna可能暴露于降解机制中,而没有内部RNA控制可以考虑不同的外泌体产量[22].此外,有研究表明外泌体同时具有线粒体(mtDNA)和基因组(gDNA) DNA。第一种DNA被设想为由一条染色体组成,并能够编码参与特定代谢途径的特定蛋白质,而后一种DNA则由标准的46条染色体组成。外泌体mtDNA可在大量细胞类型中发现,尤其是胶质母细胞瘤和星形胶质细胞[23].gDNA,表示总基因组,在外泌体中丰富。然而,还没有足够的证据证明外泌体DNA是疾病的生物标志物。此外,与蛋白质和RNA分子不同,DNA可以在一些外泌体中被选择性地和细胞依赖地检测到。尽管已经对类风湿关节炎(RA)中的外泌体DNA、mrna和脂质进行了有价值的调查,但以下提供的数据描述了RA中外泌体蛋白、mirna和lncrna的功能[22].
本文重点介绍了外泌体在不同自身免疫性疾病中的应用,如多发性硬化症(MS)、RA以及慢性和急性淋巴细胞白血病,并讨论了外泌体治疗的各个方面以及在该领域的持续尝试。(无花果。1.)
外泌体的结构和功能
外泌体是由各种细胞类型产生的40-150纳米的球形纳米载体,包括不含细胞器的细胞质部分。这些类型的囊泡被双层脂膜包围,朝向原始细胞。外泌体通过CD9、CD81和CD82含有丰富的内体途径蛋白,已观察到各种细胞将其分泌到细胞外空间[24].外泌体消除细胞内多余的碎片或在细胞之间建立信号网络。外泌体的生物发生始于内体系统。过早的核内体能够成熟为晚期核内体,以及多泡体(MVBs) [25].在整个过程中,晚期核内体经历了膜的内部出芽,因此在大的MVBs内部产生腔内囊泡(ilv) [25],其中含有大量胆固醇、鞘脂筏和网格蛋白。然而,转运组分所需的内体分选复合物(ESCRT)具有更强的形成ilv的能力,其大量的ilv被分泌为外泌体,而剩余的ilv则被自噬体复合物和细胞溶酶体降解[26].小的Rab GTPases由大约70种不同的蛋白质组成,能够控制细胞内运输和从质膜释放外泌体。Rab11、Rab35和Rab27属于可直接控制外泌体分泌的Rabs [27].
ESCRT由大约30个蛋白质成员组成,它们被分为5个功能亚复合物。ESCRT-0 -第一个复合物-通过ALIX, Vps4和Tsg101识别无处不在的货物(大部分是蛋白质,很少是rna)。第二,第三和第四个复合体,即ESCRT-I, ESCRT-II和ESCRT-III,管理ILV的萌芽。Vps4 -最后和第五个复合物-不仅介导最终的膜分裂,而且介导ESCRT循环[28].RNA在外泌体中的分选机制是迄今为止仍然模糊和不明确的主题。然而,通过分布EXO-motif,外泌体rna促进了它们在外泌体中的分类。外泌体装载过程受细胞RNA丰度的影响。也有不同的机制有助于细胞的吸附,如包括大胞饮、内吞、吞噬、网格蛋白依赖和网格蛋白不依赖的内吞、直接结合和配体-受体相互作用[29].而外泌体上的跨膜整合素排列是这些囊泡组织特异性释放的必要标志[29].外泌体通过其外部或装载的大分子,触发各种信号通路。在细胞应激期间,外泌体的分泌增强了细胞止血的保存,并限制了先天免疫反应。过度释放外泌体抑制细胞周期,导致细胞凋亡诱导。在细胞通信网络中,外泌体是各种生理和病理情况下的中心介质,如自身免疫和感染性疾病、神经系统疾病、癌症、模糊炎症、再生医学和组织修复[30.].基于外泌体的给药系统具有稳定性、特异性和安全性等特殊优点。为了以特定的方式递送货物(即干扰RNA或活性药物),外泌体可以到达远距离目标。外泌体也可以作为完美的载体,能够逃脱溶酶体的降解和吞噬作用。在与质膜融合后,外泌体有效地将它们的货物运送到预定的细胞。此外,外泌体能够持续存在于血液循环中,而不会引起明显的免疫反应[31,32].
外泌体与癌症诊断
生物标记物被定义为“在介入治疗中被客观评估和分析作为标记物的特征”。在癌症的背景下,这些可以进一步分类为预后,预测和药效学。癌症的正常病程可以通过预后生物标志物来预测。患者对特定治疗的反应可以通过使用预测性生物标志物来评估,抗肿瘤治疗的疗效可以通过药效学生物标志物来衡量[33,34].然而,为了成为一种有用的临床工具,生物标志物必须有不同的标准。每个癌症生物标志物必须代表肿瘤的特征,具有高度的特异性和敏感性,实用性强,手术微创,可重复,成本最小[35].外泌体内容物代表原代细胞,再现原代细胞的转录组和蛋白质组[36].因此,在过去十年中,研究外泌体作为疾病生物标志物可能性的研究数量显著增加[37].
总而言之,外泌体是产生它们的亲本细胞的真实再现。对B细胞恶性肿瘤患者中携带蛋白质和rna的循环外泌体的随访可能是预测生物标志物的可靠来源。此外,由于隔离的侵入性较低,可以进行定期采样。在抗癌治疗之前或之后,可以通过评估外泌体含量来跟踪患者体内恶性肿瘤的进展,使医生能够为每个病例选择适当的治疗方案[38].从头颈癌患者血液中分离出的外泌体具有蛋白质特征和致癌miRNA特征[39].在发现非小细胞肺癌(NSCLC)的原发期突变时,外泌体比无细胞DNA (cfDNA)更敏感(分别为25.7%和14.2%),也更特异性(分别为96.6%和91.7%)[40,41].此外,Allenson等人的一项研究表明,在胰腺癌早期患者中,更大比例的外泌体DNA (exoDNA)中可检测到的kirsten rat sarcoma病毒癌基因同源物(KRAS)突变多于cfDNA [42].
肿瘤细胞外泌体分泌的增加可能是由于特定的机制。早期的研究表明,TME中的缺氧和应激是可以解释外泌体分泌增加的两个原因[43].Heparanase、p53蛋白和Rap GTPase蛋白均被发现可调节外泌体的产生和分泌[44].也有人提出,肿瘤第一阶段分泌的外泌体可能是早期疾病识别的一种可能手段。在通过影像学方法识别肿瘤之前,外泌体相关蛋白标记物在胰腺癌体内模型中升高[45].通过介导生物大分子转移,外泌体在介导对各种疗法的耐药性方面发挥了关键作用。对乳腺癌、结肠癌和软组织肉瘤等各种癌症的多项研究表明,来自耐药细胞的外泌体也可以通过改变药物相关的信号通路,使药物敏感细胞产生耐药性[46,47,48,49].简而言之,这些发现意味着肿瘤外泌体生物标志物可能具有预测和预后的效用[50].
在癌症中,外泌体是特别有趣的,因为它们遍布全身,可以是生理或病理生物印迹。它们可以在任何特定时间提供肿瘤和转移情况的“快照”视图。外泌体的内容物,如遗传物质,有望避免降解,从而加强临床相关改变的识别[51].在人类黑色素瘤的情况下,外泌体在调节抗肿瘤免疫反应中起着至关重要的作用[52].Zmigrodzka等人通过流式细胞仪检测发现,癌狗从血浆中分离出的外泌体数量高于正常对照组。这项研究包括一只受黑色素瘤影响的狗;然而,它主要关注血小板和白细胞释放的外泌体[53].
外泌体在慢性淋巴细胞白血病中的应用
B-CLL被认为是世界上最常见的成人恶性血液病。65岁以上的人易患此病,占40%以上。每年的平均患病率接近10万分之5,发病率范围随着年龄的增长而上升。CLL的诊断方法包括临床表现、外周血涂片(PBS)中淋巴细胞数量和比例的变化、体格检查、骨髓涂片镜检,最后通过流式细胞术检测白血病B细胞表面标志物的表达[54].cll相关单核苷酸多态性(SNPs)已在高表达蛋白中发现,如淋巴增强子结合因子1 (LEF1)、b细胞淋巴瘤2 (BCL2)和磷-12-肉豆蔻酸-13-乙酸诱导蛋白1 (PMAIP1) [55].在pre-B细胞和T细胞中表达的LEF1与T细胞受体增强子(TCRA)结合,使增强子活性达到最大,并控制造血细胞的增殖、存活和分化[56].此外,BCL2家族蛋白在细胞死亡调控中起着核心作用,可调控细胞凋亡、坏死和自噬等多种死亡机制。它们是线粒体凋亡途径的关键调节因子。这种途径是正常胚胎发育和预防癌症所必需的[57].PMAIP1也在细胞凋亡的激活中发挥作用[58].miRNAs的异常调节已被证明与CLL的发生和发展有关。例如,CLL的发生和进展都与miR-15a和miR-16-1的失调控有关[59].由于BCL2和zeta-chain-associated protein kinase 70 (ZAP70)的表达水平被miR-15a和miR-16-1抑制,从而导致BCL2和ZAP70的表达水平升高,而这两种蛋白参与抑制细胞凋亡[60].各种各样的程序被用于治疗CLL。几十年来,氯霉素被用作CLL的常规标准疗法。这些药物的使用已被证明与一些限制有关,如不良反应和毒性风险。在过去的十年中,新的靶向治疗方法,如布鲁顿酪氨酸激酶(BTK)抑制剂和Bcl2阻滞剂,以及调节针对癌细胞的免疫反应的创新疗法[61,62].在许多研究中,非编码rna与CLL的发展和进展有关。其中一些非编码rna,如microRNAs (miRNAs)和trna衍生的小rna (tsRNAs),已被发现是重要的生物标志物,可用于诊断、监测和预测药物耐药性,协助临床医生选择适合患者需求的治疗方案[63].
CLL的发病机制与肿瘤支持环境有关。淋巴细胞高度依赖其生存环境,因此外泌体已成为细胞间对话的主要机制,为刺激CLL进展提供了一个有希望的环境[64].与健康患者相比,cll来源的外泌体水平相当高[65].携带CD标记的外泌体蛋白载体已被证明在CLL患者的许多疾病阶段中作为预测性生物标志物。通过对血浆外泌体中含有的膜蛋白进行抗体微阵列分析,检测到HLA-DR、HLA-C、HLA-B、HLA-A、CD82、CD62L、CD55、CD44、CD31、CD19和CD5水平升高,CD63、CD49c和CD21水平降低,而健康个体血浆外泌体中未显示出这些变化[66].特别是,来自血浆外泌体的CD19和CD37在晚期临床阶段表现出高度升高,并与相对较高的癌症负担相关[67].b细胞受体(BCR)信号通路在CLL中起重要的致病作用[68].导致下游激酶持续激活的BCR信号传导成分突变是常见的[68].外泌体分泌在B细胞中没有表现出一种建设性机制,但它是由几种信号相互作用支持的外部刺激触发的[69].这些刺激物的抑制剂可用于防止或抑制CLL细胞分泌外泌体,以防止与肿瘤微环境接触并防止肿瘤进展[69,70].
B-CLL中的miRNAs外泌体
失调的小非编码rna被认为是改变癌细胞基因表达的主要原因。这一杰出的发现为开发新的、更有效的癌症治疗方法铺平了道路。在B-CLL中,不平衡的miRNA谱促进了抗ror1抗体和Bcl2抑制剂的发展[63].
在外泌体运输的各种分子中,我们将重点研究CLL细胞差异表达的mirna。MicroRNAs是由约20个核苷酸组成的短而高度保守的非编码RNA分子,通过直接转录降解或翻译抑制在转录后干扰蛋白质表达。MicroRNA的表达并不总是固定的,它取决于细胞来源和生理或病理情况。mirna引起了许多科研人员的注意,因为它们似乎是干扰哺乳动物RNA基因的有益工具,用于体外研究,以确定目标基因的职责[71,72].miRNAs对基因表达的调控作用在癌症的发生和发展中起着关键作用。肿瘤细胞相关微环境决定miRNAs的表达水平,增加促生存基因的表达,抑制抗肿瘤基因的表达。例如,癌症中c-Myc处理因子的表达上调是由于抑制其靶肿瘤抑制转录物的一组miRNAs的表达水平升高[73].此外,mirna可以发挥致瘤作用,即所谓的“oncomiRs”,同时抑制促凋亡或抗增殖靶点[74].
一些研究表明,来自CLL的外泌体释放mirna。表格1总结了在cll衍生的外泌体中观察到的最丰富的mirna及其潜在作用。
microrna被CLL白血病细胞选择并包装到循环外泌体中,以调节其靶基因的表达,以支持肿瘤细胞的增殖和进展[69].来源于CLL细胞的外泌体具有高水平的miR-202-3p [80,81].另外两个在cll来源的外泌体中差异上调的mirna是miR-146a和miR-451,它们将基质细胞转换为癌症相关成纤维细胞(CAFs) [82].事实上,从CLL细胞释放的外泌体携带miR-146a和miR-451的货物,通过将货物运送到基质细胞,通过磷酸化几个激酶蛋白激活它们的靶基因。此外,CAFs还能产生多种炎症信号,如细胞因子、原血管生成因子等,从而促进肿瘤的发展和侵袭[83].miRNAs的表达水平(血清水平或细胞内水平)相对依赖于侵袭性CLL的表型特征。在这些miRNAs中,miR-150在造血事件中起着关键作用,特别是在淋巴系的发育和分化中[84].当检查预后不良的共同分子特征时,miR-150的功能与ZAP-70表达的ζ链相关蛋白或未突变的免疫球蛋白重变量(IGHV)基因相关[85].尽管miR-150的表达大量上调,无论是游离的还是与循环中的血清蛋白结合的,cll来源的外泌体可以保护其不被RNAse分解,从而维持其促肿瘤特性[86].有趣的是,外泌体中miR-155和miR-150的表达与BCR的激活呈正相关。血清外泌体中的miR-155和miR-150可能是BCR通路激活患者的有价值的诊断生物标志物,这些患者可能利用BCR相关激酶抑制剂进行治疗。此外,血清EV-miR-155可能是疾病从单克隆b细胞淋巴细胞增多症(MBL)向CLL转化的有用指标。Ferrajoli等人。血浆miR-155外泌体水平可能是从MBL向CLL转变概率的有价值的生物标志物[87].
miR-155家族在成熟B细胞和T细胞中高度表达,在造血谱系分化、病毒感染、炎症和癌症以及免疫系统调节中发挥关键作用[88].对源自CLL的外泌体的检查显示,这些囊泡具有大量的miR-155,可以在维生素d相关阶段触发并维持髓源性抑制细胞(MDSCs) [89].MDSCs是新发现的未成熟骨髓细胞,其特征是能够抑制免疫反应,并在癌症、感染和炎症性疾病期间扩张[90].
最近的一项研究调查了CLL白血病细胞中的循环外泌体,发现miR-19b上调是CLL化疗耐药性发展的预测因子[91].Yeh等人研究了CLL来源的外泌体和CLL细胞中可能失调的全部mirna。他们发现miR-29在CLL细胞和正常B细胞中表达相似,但CLL获得的外泌体比正常外泌体的miR-29含量更高[68].miR-29似乎通过调节t细胞白血病/淋巴瘤蛋白1 (TCL1)、髓细胞白血病1 (MCL1)和dna甲基转移酶在血癌中起着至关重要的作用[92].一些研究表明,与健康个体相比,miR-223在cll来源的外泌体中表达降低。此外,miR-223在CLL侵袭期被下调,并与不良预后有关[93].在著名的CLL细胞系MEC-1中检测到富集mt-circRNAs和上调mt-COX2的体外分泌外泌体[81].MEC1和MEC2是ebv污染的细胞系,是早期从慢性淋巴细胞白血病(CLL)患者的血液来源细胞中建立的,这些细胞处于前淋巴细胞转化的不同进展阶段。在很多方面,这些线条都是独一无二的。通过免疫球蛋白基因的重排,证明了它们的共同克隆来源。在体外,同样的本地爱泼斯坦-巴尔病毒(EBV)菌株导致细胞增殖。它们的表型差异表明从CLL种群中产生了后续的亚克隆[94].
显然,mt-COX2过表达与白血病发生和不良预后有关。这一发现为mt-COX2作为一种新的CLL预后生物标志物的接受奠定了基础[95].
外泌体在其他白血病中的应用
外泌体在慢性髓系白血病中的应用
慢性髓系白血病(CML)是一种影响成人的恶性血液病,预计患病率为每10万例1-2例[96,97].近年来,微环境在白血病发展中的重要性已被证实。外泌体被认为是白血病细胞和间质微环境中重要的交流媒介。CML细胞获得的外泌体可被内皮细胞吸收并促进内皮管的形成[98].值得一提的是,红白血病型K562细胞系的外泌体可诱导达沙替尼敏感的Src磷酸化并激活内皮细胞下游蛋白[99].此外,一项研究表明,源于K562外泌体的premiR-92a可以降低靶基因整合素a5的表达,进而改善内皮细胞的运动和管的形成[One hundred.].来自CML外泌体的miR-210也被证明与靶基因Ephrin-A3相互作用,并在血管生成和血管内皮生长因子(VEGF)信号通路中发挥重要作用[101].
这些研究表明了白血病细胞如何向微环境传递信号,并证明了外泌体来源的miRNAs与目前可获得的VEGF抑制剂联合使用的治疗潜力[One hundred.,101].此外,来自CML的外泌体可以通过配体-受体相互作用与其亲本细胞建立自分泌环路。这种循环是由外泌体相关转化生长因子β1 (TGF-β1)介导的,随后激活细胞外信号调节激酶(ERKs)、蛋白激酶B (PKB),也称为AKT和核因子κB (NF-κB)信号通路,导致CML细胞扩增和存活增强[102].
这些数据显示了外泌体在癌症生物学中的重要性。在k562衍生的外泌体与骨髓间充质干细胞(BM-MSCs)和巨噬细胞共培养中,包括肿瘤坏死因子α (TNF-α)、Wnt家族成员5a (Wnt5a)、白细胞介素-6 (IL-6)、C-X-C motif趋化因子12 (CXCL12)和dickkopf相关蛋白1 (DKK1)在内的几个基因的表达被改变。这导致一氧化氮(NO)的产生增加,从而活性氧(ROS)的产生以时间和剂量依赖的方式减少[103].
来自人脐带间充质干细胞(hUCMSC)的外泌体可以通过增加Bcl-2相关X (Bax)表达和降低Bcl-2水平来激活caspase凋亡通路,从而改善K562细胞对伊马替尼(IM)的敏感性。因此,IM与hucmsc衍生的外泌体的联合可能是提高CML治疗效率的一种有希望的方法[104].Min QH表明,来自耐药CML细胞的外泌体中miR365的水平明显高于敏感细胞。同时,与对照组相比,转染pre-miR365的IM敏感CML细胞表现出较低的化学敏感性和凋亡率。miR-365的外泌体传递可能通过阻止非耐药CML细胞中促凋亡蛋白的产生而导致耐药[105].
此外,在来自CML细胞系和CML患者血清的外泌体中发现了BCR-ABL转录本,这表明外泌体有可能成为BCR-ABL的检测靶点[106].
急性髓系白血病中的外泌体
急性髓系白血病(Acute myeloid leukemia, AML)是一种细胞增殖快、预后差的恶性血液病。与亲本细胞相比,已知AML细胞衍生的外泌体中mirna的存在更多。九种造血/白血病相关因子(即C - myc、肌细胞增强因子2c (MEF2C)) [20.], CCAAT/增强子结合蛋白α和-β (CEBP-α/-β), E2F转录因子1 (E2F1), DNA结合抑制剂1 (ID1),含有sh2结构域的肌醇5 ' -磷酸酶1 (SHIP1),叉头盒P3 (FOXP3), gata结合因子1 (GATA1)和五个特定的生物标志物(即胰岛素样生长因子1型受体(IGF-1R),基质金属蛋白酶9 (MMP9), C-X-C趋化因子受体4型(CXCR4), fms相关受体酪氨酸激酶3 (FLT3),在相关外泌体中发现与AML预测相关的核色素1 (NPM1)。Kaplan-Meier分析同样显示miR-125b水平升高与较高的累计复发率和总死亡率相关[107].这些数据表明外泌体可能对AML的发展有很强的调控作用。此外,与亲本细胞相比,AML细胞来源的外泌体中发现了更高水平的miR-223、miR-191、miR-155、miR150、miR-99b、miR-9和let-7a(范围从2倍到40倍不等)[108].例如,在细胞和外泌体样本中都存在的成熟miRNAs中,Hornick等人发现了一组上调的血清外泌体miRNAs,如miR-150、miR-155和miR-1246,作为AML的早期生物标志物[109骨髓间充质干细胞能够吸收AML细胞释放的外泌体。在一项实验中,在与AML细胞源性外泌体共培养后,骨髓间质干细胞中miR150的靶标CXCR4的表达显著下降,AML细胞向趋化因子基质细胞源性因子-1 (SDF-1)的运动显著减少[108].
此外,张。L等人研究了骨髓间充质干细胞衍生的外泌体中装载的miR-425-5p对AML的影响。他们表明,与骨髓健康病例或一般健康病例相比,参与不同癌症类型的miR-425-5p在AML患者的CD34 + CD38-AML细胞和外泌体以及AML细胞系中表达降低。bmm - mscs衍生的外泌体miR-425-5p通过上调cleaved poly (adp -核糖)聚合酶(PARP)和cleaved caspase3和下调wilms肿瘤1相关蛋白(WTAP)显著抑制细胞活力、侵袭和迁移,并诱导AML细胞凋亡[110].
AML细胞来源的外泌体也被证明可以直接或通过介导基质元素抑制广泛的白血病骨髓转移前的残余造血功能。来源于AML细胞的外泌体可以下调干细胞中的关键保留因子(如C-X-C基序趋化因子配体12 (CXCL12)和干细胞因子(SCF)),并导致骨髓中造血基质和祖细胞(HSPC)的动员。另一方面,这些外泌体通过降低克隆性和降低c-Kit、CXCR4和其他造血转录因子(即c-Myc)的表达直接调节HSPCs。此外,白血病细胞外泌体可间接抑制造血祖细胞(HPC)活性。这种抑制通过对生态位保留因子的基质重编程间接发生,并将骨髓生态位重新安排到允许白血病进展的微环境中[111].aml来源的外泌体还可以抑制造血因子DKK1的表达,诱导骨髓基质细胞中造血干细胞启动子的下调,为白血病细胞的增殖和生存创造有利的微环境。此外,通过过表达miR-21和miR-29, AML外泌体促进健康造血干细胞的存活,并诱导其出现白血病样功能特征[112,113].
化疗耐药是AML细胞中常见的恶性事件。外泌体也被发现参与髓系肿瘤的耐药过程[111].AML细胞释放含有VEGF/VEGFR因子的外泌体,可引起hUVECs的糖酵解,导致血管重排和耐药[114].aml来源的血浆外泌体介导调控蛋白的细胞间传递,如MCL-1、BCL-2- like 1 isoform 1 (BCL-XL)和BCL-2。因此,这些外泌体被认为是治疗耐药的重要原因,即外泌体已被发现影响髓系肿瘤耐药的进展[114].Liu等人发现,抗im CML细胞株K562 (K562RIMT)中PI3K/AKT/ mTOR信号通路和自噬活性显著增强。此外,mtor独立的beclin-1/Vps34信号通路被发现参与了相关细胞的外泌体释放[115].达沙替尼可以通过干扰AKT/mTOR功能促进细胞凋亡,还可以通过降低K562RIMT细胞中Vps34和beclin-1的表达来阻止外泌体释放和防止自噬。在另一项研究中,通过aml衍生的miR-1246研究了白血病干细胞(LSCs)的生物活性。结果表明,AML衍生的miR-1246高表达,直接靶向人富亮氨酸重复序列和免疫球蛋白样结构域1 (LRIG1),作为受体酪氨酸激酶信号通路的负调控因子,激活信号传感器和转录激活因子3 (STAT3)通路,通过上调LRIG1,miR-1246 inhibitor/ ev包封的miR-1246 inhibitor可以抑制LSCs的生存能力和集落形成能力,但通过灭活STAT3通路促进LSCs的凋亡和分化[116].表中显示了与CML和AML相关的外泌体miRNAs2.
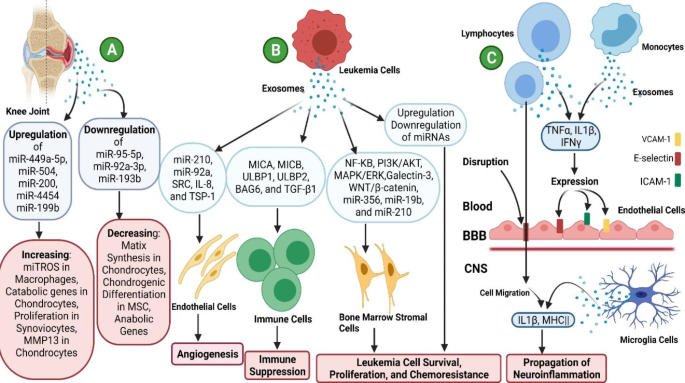
Szczepanski等人。[117]发现AML患者血清中细胞来源的外泌体含有大量的TGF-β1蛋白,可以抑制NK细胞的细胞毒性。在AML患者中分析了外泌体在预测治疗反应(如化疗)方面的潜在功能。很明显,AML外泌体中TGF-β1水平较高。这些值在诱导化疗后下降,在巩固化疗期间上升,在长期和完全缓解期间恢复正常。数字2.显示来自白血病细胞的外泌体对免疫系统的各种影响。如图所示。2在美国,白血病进展的原因之一是由晚期核内体与细胞质膜融合引起的,随后,白血病细胞产生外泌体。这些外泌体含有促进白血病的TGF-β等分子。外泌体TGF-β降低CD4细胞毒性和活性,增加CD4细胞凋亡+和CD8+T细胞。TGF-β对B细胞活性也有类似的影响。TGF-β通过降低表面受体NKG2D (c型凝集素样受体)数量和细胞毒性作用于自然杀伤细胞(NK细胞)。这种受体在NK细胞上的存在和它的配体在癌细胞上的存在导致癌细胞溶解。因此,降低NKG2D在逃避免疫系统中起着至关重要的作用。TGF-β通过阻止树突状细胞(dc)的成熟,在白血病细胞从免疫系统逃逸中发挥重要作用。TGF-β通过增加调节性T细胞(Treg细胞)的活性来影响它们,并与前列腺素E2 (PGE2)和IL-6一起促进MDSCs的活性。
外泌体与多发性硬化(MS)的相关性
多发性硬化症(MS)是一种自身免疫性疾病,定义为慢性炎症、脱髓鞘,导致神经功能损害[118,119青壮年神经功能障碍最常见的原因是多发性硬化症[120].炎症、脱髓鞘和神经轴突损伤是多发性硬化症的著名特征,可影响中枢神经系统并导致长期持续性残疾[120].多发性硬化的治疗选择有限,包括常见的免疫抑制剂、免疫调节剂或抑制淋巴细胞浸润到中枢神经系统的化合物[121].
自动反应性CD4细胞的侵袭+T细胞(尤其是th17和Th1细胞)进入中枢神经系统,是多发性硬化症的主要免疫病理特征,导致神经轴突变性和残疾。根据文献,microRNAs在MS的病理中也起着至关重要的作用[74,122,123].由于外泌体可以穿过血脑屏障,一些来自受影响的CNS细胞或相关炎症微环境的循环外泌体很可能参与了MS患者[124,125].细胞的外泌体是mirna进入循环的主要载体,保护它们不被降解。因此,外泌体mirna似乎比游离mirna更稳定,白细胞来源的外泌体mirna可以为MS发病机制提供有用的信息[126,127,128].Ebrahimkhani等人假设与MS发生和发展相关的生理变化反映在血清中的各种外泌体mirna中。他们发现,通过下一代测序(NGS)和综合生物信息学,血清外泌体miRNA谱可以准确地从健康对照中识别MS患者,以及从进行性疾病中识别复发缓解型多发性硬化症(RRMS) [129].
此外,研究表明,miR-155和mir-326可诱导Th1和Th17炎症细胞的发育。Du等人指出,缺乏MicroRNA-155的小鼠对实验性自身免疫性脑脊髓炎(EAE)具有耐药性[130].另一方面,一些miRNAs,如miR-146a和miR-29,与预防自身免疫性疾病有关。MicroRNA-146a通过激活调节性T细胞抑制Th1细胞活性[122,123].此外,γ干扰素(IFN-γ)的产生受到miR-29的抑制,与正常细胞相比,miR-29缺陷细胞产生的IFN-γ明显更多[131].此外,在MS患者的白细胞中,miRNA谱异常明显[132,133].Keller等人证明,在RRMS患者中,与健康对照组相比,165个miRNAs大幅上调或下调[134].同样,miR-106b和miR-25可能调控TGF-β信号通路,在MS患者的调节性T细胞中表达降低[135].因此,MS的病理可能受到miRNA表达改变的影响。Azimi等人最近的一项研究发现,来自MS患者的常规T细胞的外泌体中miR-326的丰度发生改变[136].先前的研究表明,miR-326通过Th17细胞的成熟和分化在MS的免疫发病机制中发挥着重要作用[130].因此,外泌体miR-326可能是ms过程中的一个临床目标。此外,对该miRNA的调控可能被用作诊断和预后的生物标志物[137].
树突状细胞(Dendritic cells, DC)是一种重要的适应性免疫反应调节剂,近年来被认为是ms体外外泌体的可扩展来源,其组成因外界因素和细胞条件的不同而不同。例如,成熟和未成熟的脂多糖刺激dc的外泌体mirna的谱有显著差异[138].
Pusic等人发现,低水平IFNγ的阶段性刺激可以显著改善培养的脑切片或鼻给药动物后的髓鞘形成。然后,他们使用低水平的IFNγ进行原代DC培养刺激,并评估影响外泌体功能的miRNA [139].先前的实验表明,外泌体可能通过miR-219的传递影响脑髓鞘形成[139].推测ifn刺激的dc释放的外泌体(IFNγ-DC-Exos)可以改善髓鞘形成过程和氧化耐受。此外,在切片培养中给予IFNγ-DC-Exos可增加ms样脱髓鞘的恢复。经鼻给药IFNγ-DC-Exos可改善体内脑髓鞘形成。体外跟踪研究表明,少突胶质细胞和小胶质细胞(在较小程度上)优先吸收IFN-DC-Exos。这是理解外泌体介导的髓鞘发育机制以及引入外泌体作为重新髓鞘形成的治疗剂的基本步骤[140].
对miRNA在MS中的作用的理解在过去十年中有了显著的进展。在一项开创性研究中,miR-155被认为是炎症反应的主要调节因子。在小鼠中,该基因的靶向缺失导致中枢神经系统和外周淋巴器官中Th1和Th17的细胞分化减少。此外,miR-155缺失和药物靶向均导致EAE病程和严重程度的延迟[141].在另一项研究中,miR-155-3p被发现通过调节热休克蛋白(HSP)引起自身免疫性脱髓鞘的发展[142].MiR-301a还被发现在髓磷脂反应性t辅助17型细胞的调节中发挥核心作用,支持mirna作为调节自身免疫性脱髓鞘的治疗药物的作用[143].除了调节效应T细胞的反应外,它们还在调节Treg细胞群中发挥作用,在正常情况下,Treg细胞群可以平衡前者。令人惊讶的是,Treg的形成和功能也受到miR-155的影响,以至于miR-155受到Foxp3的调控,Foxp3是这种细胞类型的特征性转录因子[144].同一miRNA在不同细胞中的相反功能突出了免疫系统调节网络的复杂性。在前面的病例中,miRNA在EAE中促炎反应中的调节作用被强调,进一步的研究也揭示了它们在调节髓鞘形成本身中的主要作用。例如,过表达miR-23a可使小鼠的髓鞘厚度增加,也有研究表明,在体内,miR-23a可增加髓鞘的合成和少突胶质细胞分化[145].
尽管已经发现了许多药物递送系统,如化学小分子药物、蛋白质药物或核苷酸药物,但外泌体已被证明在现代医学中有很多用途[146].研究表明,外泌体能够穿过血脑屏障(BBB),并负责将大脑抗原扩散到外周。小胶质细胞来源的外泌体被注射到EAE动物的中枢神经系统(CNS),这增加了炎症并加重了疾病[147].
IFNγ产生的外泌体刺激间充质干细胞(MSCs)已被证明对治疗EAE有显著作用。这些发现表明,来自间充质干细胞的外泌体可用于自身免疫和中枢神经系统疾病的无细胞治疗[148].应用过表达TGF-1树突状细胞衍生的外泌体治疗EAE可增强Treg的产生,抑制Th1和Th17的分化,导致EAE强度减弱[149].Casella G.等人设计了一种小鼠小胶质细胞系,可分泌大量携带抗炎细胞因子IL-4的工程外泌体。使用上述外泌体后,EAE的临床评分显著下降[150].此外,对患有脂多糖(LPS)诱导脑炎的小鼠鼻腔注射姜黄素外泌体可通过靶向小胶质细胞减少神经炎症[151].此外,外泌体包裹的姜黄素在lps诱导的炎性脱髓鞘模型中表现出更好的抗炎作用[152].
Pusic等人指出,骨髓来源的树突状细胞产生的外泌体可作为少突细胞成熟的治疗介质[125].体内研究表明,使用这些外泌体可以促进少突胶质细胞的成熟和髓鞘损伤的恢复。因此,外泌体在EAE过程中不仅可能加重炎症,还可能促进髓鞘再生[146].
利用循环外泌体携带的mirna和其他分子货物作为多种疾病的生物标志物的新数据引起了人们对这些微泡作为MS状态和疾病监测的可能指标的意义的极大兴趣[153)(表3.)。有趣的是,血液中的外泌体揭示了源自大脑的中枢神经系统标记的存在[154].对这些外泌体的分析可以为了解中枢神经系统的状态提供一种独特的工具,并消除活检的需要[155].此外,外泌体可能是血脑屏障交叉CNS抗原的来源[154]这可能会引发对外泌体分析的更多研究,以了解中枢神经系统状况和MS [156].
外泌体和风湿性关节炎
类风湿关节炎(RA)是一种自身免疫性炎症性疾病,全世界0.5-1%的成年人都患有这种疾病[160].女性是男性的三倍,这种自身免疫性疾病的最高发病率在40-50岁之间。类风湿性关节炎通常会导致关节损伤和残疾。早期诊断和治疗可以预防关节破坏,也可以取得良好的长期疗效。由于大多数不可逆的关节损伤发生在发病的头两年,因此在发病的前3至6个月进行最佳的疾病管理至关重要[161,162,163,164].因此,需要一种可靠的生物标志物对疾病进行及时诊断和有效的疾病管理。类风湿关节炎的一些特征是关节内免疫细胞浸润、关节疼痛和骨侵蚀。在RA疾病中,根据不同的抗原类型已经鉴定出不同的自身抗体,这些自身抗体最常见的两种类型是抗瓜氨酸蛋白抗体(ACPA)和类风湿因子(RF)。与其他类风湿疾病一样,RA的发病机制涉及多种因素,包括环境、遗传背景和血清学因素。已有研究发现,遗传的影响约为50% ~ 60%,因此遗传因素在RA疾病的发生发展中起着重要作用。引起类风湿关节炎的基因,约占引起类风湿关节炎的遗传因素的30 - 50%,大部分属于人类白细胞抗原(HLA)基因[164,165,166,167].与RA相关的多个风险等位基因位于HLA-DRB1基因中,导致保守氨基酸序列的产生。近年来全基因组关联研究(genome wide association studies, GWAS)的进展增强了我们对遗传因素对RA发展影响的认识,也揭示了RA是一种多遗传疾病。这些研究将100多个增加患类风湿关节炎风险的基因位点联系起来[165,168,169,170,171].其中一个起着重要作用的重要基因,尤其是在日本人群中,是肽基精氨酸脱亚胺酶4 (PADI4)基因。此外,PTPN22中的R620W突变是RA疾病的另一个误义风险变体。PTPN22在造血细胞中编码蛋白质酪氨酸磷酸酶。在T细胞和B细胞中,这种酶作为抗原受体信号通路的负调制器。R620W风险等位基因是一种功能获得性突变,在携带该风险等位基因的细胞中减弱TCR和BCR信号通路。HLA位点与较高的血清瓜氨酸蛋白抗体水平有关,并与血清阳性RA有关[165,168,169,170,171].
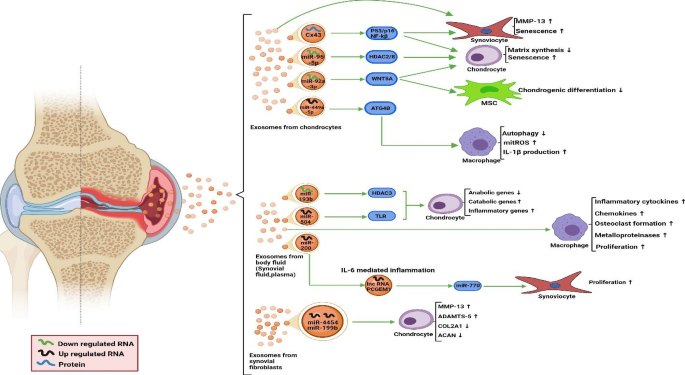
此外,有一些针对炎症因子如TNF-α的RA生物治疗方法。这些抗体和蛋白质大多具有镇静作用,不能逆转RA的症状。最近,基因治疗取得了令人鼓舞的初步成果;尽管如此,其不同方面仍在调查中[172].大量研究表明,囊泡由于其独特的性质,可以成为良好的药物载体。外泌体能够将它们的药物货物运送到目标,因为它们能够穿过不同的生物膜,如滑膜[172].在血液中,外泌体填充的姜黄素比游离的姜黄素有更长的半衰期。因此,将药物包裹在外泌体中可增加药物的半衰期[173].因此,在炎症性疾病和类风湿性关节炎中,外泌体似乎是多种药物的有前途的转移工具。例如,在miR-146a/miR-155下调的胶原诱导关节炎(CIA)小鼠中,miR-146a/miR-155转导的msc来源的外泌体显著改变CIA小鼠细胞的Treg细胞水平,并恢复其适当的反应[174一项类似的研究是关于msc衍生的miR-150-5p外泌体(Exo-150)对胶原诱导的关节炎小鼠的治疗作用。结果显示,注射Exo-150可减少模型小鼠的后腿厚度和临床关节炎评分。此外,Exo-150通过靶向MMP14和VEGF,减少RA成纤维细胞如滑膜细胞(FLS)的迁移和侵袭,并下调HUVECs中的管形成[175].
外泌体可以将抗tnf -α和其他抗炎药物运送到目的地,而不被不同的酶降解。在这方面,外泌体的一些特征,如免疫抑制和抗炎特性,已在不同的疾病中被确认,如CIA和炎症性肠病(IBD) [176,177].
大量的研究表明,外泌体在细胞-细胞通信中起着有效的作用(图。3.)。
此外,外泌体还参与其他活动,如遗传信息和信号化合物的传递、抗原递呈和免疫调节。外泌体转运受体和配体,以及肽- mhc复合物和抗原物质,因此它们在调节免疫反应中发挥有效作用。研究表明,在液体中发现的外泌体是由渗透到膝盖液体中的细胞释放出来的。不同的细胞浸润到滑膜关节,释放外泌体到滑膜液中,损伤关节,从而缓解RA不良症状。这些外泌体可以含有不同的miRNAs,如hsa-miR-151a-3p、hsa-miR-199a-5p、hsa-miR-370-3p、hsa-miR-589-5p、hsa-miR-769-5p,与RA的共同发病机制有关[178].
大约,在风湿性关节炎患者的滑液中,最常见的外泌体来源于血小板[179].此外,来自中性粒细胞、单核细胞和粒细胞的外泌体的存在已被描述。根据文献,B细胞和T细胞可在滑液中释放外泌体,因为T细胞中提取的外泌体在RA滑液中更丰富,且与类风湿因子血清水平有显著相关性[179].
人T淋巴细胞也可以释放含有大量miR-204-5p的外泌体,这些外泌体可以转移到滑膜成纤维细胞并抑制细胞增殖。外泌体miR-204-5p表达与类风湿因子、红细胞沉降率、c反应蛋白等RA患者疾病参数呈负相关[180].
一般来说,在风湿性关节炎等炎症性疾病中,来自滑膜细胞的外泌体促进邻近细胞释放炎症剂,引起软骨损伤。已经发现,用IL-10处理的树突状细胞可以释放外泌体,减轻RA的严重程度。来自il -1刺激的成纤维细胞样滑膜细胞的外泌体被证明可诱导软骨细胞的骨关节炎改变[181].在RA模型中,外泌体具有激发细胞凋亡、抗原提呈给T细胞和细胞外损伤等免疫活性[182].这一证据证实了使用滑膜来源的外泌体作为RA生物标志物来预测疾病阶段并开发新的和更有效的治疗方法。RA的发病机制可能是由于外泌体建立了细胞间的通信,并参与了许多功能,如炎症、mirna的传递、细胞外基质的破坏、抗原递呈和免疫复合物的形成[183].综上所述,外泌体在滑膜细胞、免疫细胞、软骨细胞和内皮细胞之间起连接作用,影响RA的不同过程。综上所述,这些发现确定了外泌体在RA发病机制中的作用,并可能用于开发新的治疗方案[181,184].
外泌体可以通过多种功能改变关节结构,包括抗原呈递、血管生成、炎症调节、细胞间通信的改变和细胞外基质降解[185].来自RA FLS的外泌体可能诱导CD4+通过干预活化诱导的细胞死亡,增强上述细胞中IL-2和IFNγ的释放,增加Akt和NF-κB的活性,防止caspase 8和caspase 3的降解[181,186].RA FLS分泌外泌体,通过基质金属蛋白酶1 (MMP-1)的自分泌激活或金属蛋白酶的直接活性破坏软骨和骨骼。另一方面,RA FLS的TNF激活增加了外泌体miR-221-3p的产生,进而抑制骨形成[187,188].除了外泌体分泌,FLS还可以靶向其他免疫细胞(如单核细胞和活化T细胞)分泌的外泌体。在这种情况下,FLS可能会增加MMPs的释放,以及趋化因子和细胞因子,如单核细胞趋化蛋白1 (MCP-1)、MCP-2、IL-8和IL-6。此外,CXCL6、CXCL5、CXCL3、CXCL2和CXCL1趋化因子基因的转录可能增加[184].来源于滑液的外泌体可能作为NF-κB激活剂受体和核因子kappa-Β配体受体激活剂(RANKL)的受体,可激活破骨细胞的功能和骨吸收[189].来自严重疾病活动的RA患者血浆的外泌体增强了自体外周血单核细胞产生的促炎细胞因子,如TNF、IL-17和IL-1 [181].此外,C1q数量的增加表明RA中的循环外泌体通过运输补体成分来扩大炎症。在滑膜细胞如FLS和炎症关节中的免疫细胞之间的连接中,外泌体被分泌到滑膜组织和液体中。促炎细胞因子释放量的增加将激活增殖、免疫细胞浸润和血管生成。因此,外泌体在整个炎症阶段提供正反馈。关节炎症可能增强中性粒细胞来源的外泌体的浸润,这可能减少RA中软骨的额外退化[190].
已有研究表明,适应性和先天免疫反应都是由dc产生的外泌体调节的。由细胞因子/细胞因子抑制剂调节的基因改变和反应可能导致产生免疫抑制性和耐受性的未成熟dc。来自过表达Th2细胞因子(如IL-4)的基因工程未成熟dc的外泌体已被发现对CIA治疗模型疾病有效[191,192].这些外泌体可以有效地降低体液免疫反应,当被抗原激活时,脾脏中的免疫细胞被激活并导致Th-2显性反应[191].
表达FasL的树突状细胞能有效地阻止胶原反应性T细胞活化,并降低小鼠CIA的进展。在小鼠迟发型超敏反应(DTH)模型中,这些dc释放的外泌体被发现具有抗炎特性。这种DTH反应抑制是特定于抗原的,依赖于II类MHC。此外,DC/FasL外泌体在治疗CIA小鼠模型中的疗效已通过全身注射显示出来。在动物DTH和CIA治疗过程中,已经证明来自免疫抑制dc的外泌体与原发dc的外泌体具有相同或更强的效果,因此它们可能被用于治疗RA。除了DCs在体外的有效性外,DCs产生的外泌体在整个分离过程中更稳定,在体内传递似乎比自体细胞更安全。外泌体具有更长的寿命,并且由于其独特的生物学特性,与其他细胞类型相比,它们在注射后更容易被检测到[177,191].研究了由未成熟dc产生的外泌体作为小鼠CIA无细胞治疗的有效性。研究发现,经IL-10处理的未成熟DCs产生外泌体,通过抑制促炎细胞因子IL-1和TNF-α抑制炎症和自身免疫反应,并降低Hsp70水平。据报道,这些外泌体通过调节T细胞反应降低了对侧关节的DTH反应[176].此外,用IL-10处理的dc外泌体可以防止小鼠CIA的入侵,并降低现有关节炎的严重程度。其他研究表明,dc产生的外泌体抑制了炎症和自身免疫。这种抑制是通过调节内源性T细胞和APCs活性、MHC ii类依赖和抗原特异性途径来实现的。由dc产生的外泌体与其原始分泌细胞相比具有相似甚至更强的免疫抑制作用[176,193].研究表明,吲哚胺吡咯2,3 -双加氧酶(IDO)降解色氨酸,在各种条件下具有免疫抑制能力,如类风湿关节炎。虽然这种作用的主要机制尚未完全发现,但有人提出可能是通过预防CD8+效应T细胞反应和诱导Treg细胞,通过剥夺它们的必需色氨酸。重要的是,具有较高稳定性和适当生物活性的免疫抑制外泌体可由表达IDO的dc释放[194].另一方面,也有其他研究结果表明,与上述抗炎外泌体不同,外泌体可能在RA中具有促炎能力。例如,在Lim的一项研究中。M等研究表明,RA疾病血清外泌体中Has-miR-1915-3p和has-miR-6511b-5p显著升高,因此血清c反应蛋白(CRP)水平与其呈负相关[195].
结论
外泌体的出现及其不同的活性无疑是近年来医学和生物科学领域最重要的发现之一。鉴于外泌体具有独特的生物学特性,它们已被注意到在各种疾病的治疗和诊断中,特别是b细胞疾病,如白血病、多发性硬化症和类风湿性关节炎。外泌体的一些特点包括:独特的物理化学性质和结构、低毒性和免疫原性、高效的细胞进入、固有的靶向性、固有的跨越生物屏障的能力以及血液循环的高稳定性。外泌体在维持正常生理状态和疾病状态方面发挥着重要作用。因此,健康状态下释放的外泌体类型与疾病状态下分泌的外泌体类型不同;这一特征可作为精确和个性化诊断和治疗各种疾病(如b细胞疾病)的先进策略。外泌体由于其独特的性质,可以作为生物和药物等颗粒的载体和载体,将其输送到所需的区域。临床研究表明,免疫细胞(如树突状细胞)产生的细胞外囊泡可以刺激免疫系统,因此这些外泌体可以用于抗肿瘤疫苗。外泌体与肿瘤的生存、增殖、转移和复发密切相关,在肿瘤的诊断和病理鉴定中发挥着重要作用,为免疫治疗提供了新的途径。尽管外泌体在诊断和治疗领域具有巨大的潜力,但还需要进一步的研究,因此医生和生物学家的互补合作可以进一步揭示细胞外囊泡的基本功能及其不同应用。
数据可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- B-CLL:
-
b细胞慢性淋巴细胞白血病。
- 开心的:
-
肿瘤微环境。
- 电动汽车:
-
细胞外囊泡。
- mtDNA:
-
线粒体DNA。
- gDNA:
-
基因组DNA。
- 类风湿性关节炎:
-
类风湿性关节炎。
- 女士:
-
多发性硬化症。
- AML:
-
慢性淋巴细胞白血病。
- 多功能车辆总线:
-
Multi-vesicular尸体。
- ILVs:
-
Intra-luminal囊泡。
- ESCRT:
-
转运所需的内体分选复合物。
- 非小细胞肺癌:
-
非小细胞肺癌。
- cfDNA:
-
游离DNA。
- 喀斯特:
-
柯尔斯顿大鼠肉瘤病毒癌基因同源物。
- exoDNA:
-
Exosomal DNA。
- 美国公共电视台:
-
外周血涂片。
- 单核苷酸多态性:
-
单核苷酸多态性。
- LEF1:
-
淋巴增强因子结合因子1。
- BCL2:
-
b细胞淋巴瘤
- PMAIP1:
-
磷-12-肉豆蔻酸-13-乙酸诱导蛋白1。
- TCRA:
-
t细胞Receptor-alpha。
- ZAP70:
-
泽塔链相关蛋白激酶70。
- BTK:
-
布鲁顿酪氨酸激酶。
- microrna:
-
小分子核糖核酸。
- tsRNAs:
-
trna衍生的小rna。
- BCR:
-
b细胞受体。
- 战乱国家:
-
癌症相关的成纤维细胞。
- IGHV:
-
免疫球蛋白重变量。
- MBL:
-
b细胞淋巴球增多。
- MDSCs:
-
骨髓来源的抑制细胞。
- TCL1:
-
t细胞白血病/淋巴瘤
- MCL1:
-
髓细胞白血病
- 慢性淋巴细胞白血病:
-
慢性淋巴细胞白血病。
- EBV:
-
巴尔病毒。
- CML:
-
慢性髓系白血病。
- VEGF:
-
血管内皮生长因子。
- 转化生长因子-β1:
-
转化生长因子β 1。
- 的兵:
-
细胞外信号调节激酶。
- PKB:
-
蛋白激酶B。
- NF -κB:
-
核因子Kappa B。
- BM-MSCs:
-
骨髓间充质干细胞。
- 肿瘤坏死因子-α:
-
肿瘤坏死因子α。
- Wnt5a:
-
Wnt家庭成员
- il - 6:
-
白细胞介素- 6。
- CXCL12:
-
C-X-C基序趋化因子
- DKK1:
-
Dickkopf-related Protein1。
- 没有:
-
一氧化氮。
- hUCMSC:
-
人脐带间充质干细胞。
- 即时通讯:
-
伊马替尼。
- 伯灵顿:
-
Bcl-2关联X。
- AML:
-
急性髓系白血病。
- MEF2C:
-
肌细胞增强因子2c。
- CEBP -α/β:
-
CCAAT/增强子结合蛋白α和β。
- E2F1:
-
E2F转录因子
- ID1:
-
DNA结合抑制剂
- SHIP1:
-
含有sh2结构域的肌醇5 ' -磷酸酶
- FOXP3:
-
P3。
- GATA1:
-
gata绑定因子1。
- IGF-1R:
-
胰岛素样生长因子1型受体。
- MMP9:
-
矩阵Metalloproteinase-9。
- 趋化因子受体CXCR4:
-
C-X-C趋化因子受体4型。
- FLT3:
-
Fms相关受体酪氨酸激酶3。
- NPM1:
-
Nucleophosmin 1。
- SDF-1:
-
基质细胞衍生因子-1。
- PARP:
-
聚(adp -核糖)聚合酶。
- WTAP:
-
肿瘤1相关蛋白。
- 自洽场:
-
干细胞因子。
- 公司:
-
造血基质和祖细胞。
- HPC:
-
造血祖细胞。
- lsc:
-
白血病干细胞。
- LRIG1:
-
富亮氨酸重复序列与免疫球蛋白样结构域
- STAT3:
-
信号换能器和转录激活子
- NK细胞:
-
自然杀手细胞。
- Treg细胞:
-
调节性T细胞。
- PGE2:
-
前列腺素E2。
- 女士:
-
多发性硬化症。
- 名RRMS:
-
复发缓解型多发性硬化症。
- 总会在:
-
下一代测序。
- 运算单元:
-
实验性自身免疫性脑脊髓炎。
- 干扰素-γ:
-
γ干扰素。
- DCs:
-
树突细胞。
- 干扰素γ-DC-Exos:
-
由ifn刺激的dc释放的外泌体。
- HSP:
-
热休克蛋白。
- BBB:
-
血脑屏障。
- 中枢神经系统:
-
中枢神经系统。
- msc:
-
间充质干细胞。
- 有限合伙人:
-
脂多糖。
- 类风湿性关节炎:
-
类风湿性关节炎。
- ACPA:
-
抗瓜氨酸蛋白抗体。
- 射频:
-
类风湿因子。
- HLA:
-
人类白细胞抗原。
- GWAS:
-
全基因组关联研究。
- PADI4:
-
肽基精氨酸脱亚胺酶4。
- FLS的:
-
类似滑膜细胞的成纤维细胞。
- 炎症性肠病:
-
炎症性肠病。
- 金属蛋白酶- 1:
-
基质金属蛋白酶1。
- MCP-1:
-
单核细胞趋化蛋白1。
- RANKL:
-
核因子Kappa受体激活剂-Β配体。
- 潜:
-
迟发型超敏反应。
- 被罩:
-
吲哚胺吡咯2,3 -双加氧酶。
- c反应蛋白:
-
c反应蛋白。
参考文献
慢性淋巴细胞白血病患者的预后和预测因素:与新治疗方法时代相关?临床肿瘤学杂志:临床肿瘤学杂志2014;32(9):869-72。
赫利沙努Y, Katz B-Z, Lipsky A, Wiestner A.慢性淋巴细胞白血病在不同微环境中的生物学:临床和治疗意义。中华血液学杂志,2013;27(2):173-206。
Burger JA, Gribben JG,编辑。慢性淋巴细胞白血病(CLL)和其他B细胞恶性肿瘤的微环境:深入了解疾病生物学和新的靶向治疗。癌症生物学研讨会。爱思唯尔;2014.
Hanahan D, Coussens LM。犯罪的附属品:被招募到肿瘤微环境的细胞的功能。中华癌症杂志,2012;21(3):309-22。
史华兹马,Iida N, Roberts EW, Sangaletti S, Wong MH, Yull FE,等。肿瘤微环境复杂性:肿瘤治疗中的新角色。AACR;2012.
Colombo M, Raposo G, Théry C.外泌体和其他细胞外囊泡的生物发生、分泌和细胞间相互作用。中国生物医学工程学报。2014;30:529 - 529。
Raposo G, Stoorvogel W.细胞外囊泡:外泌体,微囊泡和朋友。中国生物医学工程学报,2013;29(4):339 - 344。
细胞间通讯中的外泌体和外泌体。中国生物医学杂志,2018;28(8):R435-R44。
Wortzel I, Dror S, Kenific CM, Lyden D.外泌体介导的转移:远距离通讯。生物工程学报。2019;49(3):347-60。
Matsuno Y, Kanke T, Maruyama N, Fujii W, Naito K, Sugiura K.猪卵泡液外泌体样囊泡mRNA谱的研究。PLoS ONE。2019; 14 (6): e0217760。
闫伟,姜松。肿瘤免疫循环中的免疫细胞源外泌体。癌症的趋势。2020; 6(6): 506 - 17所示。
McLellan A.原代B细胞释放外泌体。免疫评论™,2009;29(3)。
杨晓东,杨晓明,杨晓明,等。靶向腺苷在癌症免疫治疗中增强t细胞功能前沿免疫。2019;10:925。
拉尼耶K, Motta C, Hamdi S, Roy S, Fauvelle F, pagaux J-F,等。肥大细胞和树突状细胞衍生的外泌体显示特定的脂质组成和不寻常的膜组织。中国生物化学杂志,2004;30(1):319 - 319。
Vidal M.外泌体。重新审视他们“垃圾袋”的角色。交通。2019;20(11):815 - 28。
Khatun Z, Bhat A, Sharma S, Sharma A.阐明外泌体多样性:生物物理和分子表征方法。纳米医学。2016;11(17):2359 - 77。
Das S, Abdel-Mageed AB, Adamidi C, Adelson PD, Akat KM, Alsop E,等。细胞外RNA通讯联盟:建立细胞外RNA研究的基础知识和技术。细胞。2019;177(2):231 - 42。
Clayton A, Harris CL, Court J, Mason MD, Morgan BP。抗原提呈细胞外泌体通过CD55和CD59的表达免受补体介导的裂解。中华免疫杂志2003;33(2):522-31。
Rabesandratana H, Toutant J-P, Reggio H, Vidal M.在网织红细胞体外成熟过程中,外泌体释放衰变加速因子(CD55)和反应性裂解膜抑制剂(CD59)。美国血液学杂志,1998;91(7):2573-80。
Mittelbrunn M, Gutiérrez-Vázquez C, Villarroya-Beltri C, González S, Sánchez-Cabo F, González M,等。装载microrna的外泌体从T细胞单向转移到抗原提呈细胞。地理学报。2011;2(1):1 - 10。
Yuyama K, Sun H, Mitsutake S, Igarashi Y.鞘脂调节外泌体分泌促进小胶质细胞清除淀粉样蛋白β。中国生物医学工程学报,2012;
张勇,刘勇,刘宏,唐文辉。外泌体:生物起源、生物学功能和临床潜力。细胞与生物科学。2019; 9(1):队。
外泌体在癌症中的起源和功能。Front Oncol. 2018;8:66。
王伟,朱楠,闫涛,史艳娜,陈杰,张春杰,等。串扰:外泌体和脂质代谢。手机通信与信令,2020;18(1):1 - 12。
古隆,裴洛乔,杜曼尼杜,巴鲁托。外泌体之旅:从生物起源到摄取和细胞内信号。手机通信与信令,2021;19(1):1 - 19。
Lakkaraju A, Rodriguez-Boulan E.巡回外泌体:在细胞和组织极性中的新兴角色。细胞生物学杂志,2008;18(5):199-209。
Blanc L, Vidal M.对Rab GTPases在外泌体分泌中的功能的新认识。小gtpase。2018; 9(1 - 2): 95 - 106。
Schmidt O, Teis D. ESCRT机器。中国生物医学杂志,2012;22(4):R116-R20。
McKelvey KJ, Powell KL, Ashton AW, Morris JM, McCracken SA。外泌体:摄取机制。J循环生物标志物。2015; 4。
Yáñez-Mó M,许丽娟PR-M,安德烈Z, Bedina Zavec A, Borràs FE, Buzas EI,等。细胞外囊泡的生物学特性及其生理功能。J萃取囊泡。2015; 4(1): 27066。
Antimisiaris SG, Mourtas S, Marazioti A.外泌体和外泌体激发囊泡用于靶向药物传递。制药学。2018;10(4):218。
李强,王华,彭华,胡燕,卡卡拉诺。外泌体:免疫调节的多功能纳米介质。癌症。2019;11(10):1557。
路德维希JA,韦恩斯坦JN。癌症分期、预后和治疗选择中的生物标志物。中华癌症杂志,2005;5(11):845-56。
Hosseini K, Ranjbar M, Pirpour Tazehkand A, Asgharian P, Montazersaheb S, Tarhriz V,等。利用高通量测序评估癌症中的外泌体非编码rna。中华实用医学杂志,2022;20(1):1 - 15。
吴玲,曲霞。癌症生物标志物检测的最新进展与挑战。化学学报,2015;44(10):2963-97。
Hurwitz SN, Rider MA, Bundy JL, Liu X, Singh RK, Meckes DG Jr. NCI-60胞外囊泡的蛋白质组学分析揭示了常见的蛋白质负载和癌症类型特异性生物标志物。Oncotarget。2016;7(52):86999。
周斌,徐坤,郑旭,陈涛,王杰,宋勇,等。外泌体液体活检在临床诊断中的应用。信号传导靶向治疗。2020; 5(1): 1 - 14。
贾志强,李志强,李志强,李志强。细胞外囊泡在b细胞恶性肿瘤中的诊断和治疗潜力。肿瘤学前沿。2020; 10。
Momen-Heravi F, Saha B, Kodys K, Catalano D, Satishchandran A, Szabo G.循环外泌体数量增加及其microRNA货物是酒精性肝炎潜在的新型生物标志物。翻译医学杂志,2015;13(1):1 - 13。
张海燕,张海燕,张海燕,马泰,等。外泌体中的双链DNA:癌症检测中的一种新型生物标志物。科学通报,2014;24(6):766-9。
sofiyani SR, Hosseini K, Soleimanian A, Abkhooei L, Hoseini AM, Tarhriz V,等。miR-451在肺癌诊断、治疗和预后中的作用综述MicroRNA。2021; 10(3): 181 - 90。
Allenson K, Castillo J, San Lucas F, Scelo G, Kim D, Bernard V,等。早期胰腺癌患者循环外泌体衍生DNA中突变kras的高流行率。学报学报。2017;28(4):741-7。
邵波,莫门- heravi, F.细胞外囊泡在肝脏疾病中的潜在生物标志物和治疗靶点。《胃肠肝病》杂志,2017;14(8):455。
肿瘤来源的外泌体及其在癌症进展中的作用。Adv临床化学。2016;74:103-41。
Melo SA, Luecke LB, Kahlert C, Fernandez AF, Gammon ST, Kaye J,等。Glypican-1识别癌症外泌体并检测早期胰腺癌。自然。2015;523(7559):177 - 82。
马晓,陈忠,华达,何东,王磊,张鹏,等。含trpc5的细胞外囊泡在乳腺癌化疗耐药中的重要作用美国科学院学报,2014;111(17):6389-94。
魏勇,赖旭,余松,陈松,马勇,张勇,等。外泌体miR-221/222增强受体er阳性乳腺癌细胞对他莫西芬的耐药性乳腺癌治疗与治疗。2014;34(2):423-31。
倪hornick, Doron B, Abdelhamed S, J欢,Harrington CA,沈R,等。AML通过释放含有靶向c-MYB的microrna的外泌体来抑制造血。科学通报,2016;9(444):ra88-ra。
付峰,姜伟,周玲,陈哲。循环外泌体miR-17-5p和miR-92a-3p预测结直肠癌的病理分期和分级。中国生物医学工程学报,2018;11(2):221-32。
马晓明,王艳,王晓明。细胞外囊泡在肿瘤免疫治疗中的应用。癌症。2020;12(10):2825。
张志刚,张志刚,张志刚,等。细胞外囊泡的分离提高了转移性黑色素瘤患者血浆中突变DNA的检测。科学通报2020;10(1):1 - 12。
杰。天然黑色素瘤衍生的细胞外囊泡。癌症生物学研讨会。爱思唯尔;2019.
Żmigrodzka M, witkowska - piwoaszewicz O, Rzepecka A, cywizynska A, Jagielski D, Winnicka A.癌症犬血液中的细胞外囊泡初步研究。动物。2019;9(8):575。
李志刚,李志刚,李志刚。慢性淋巴细胞白血病的临床和流行病学研究。中华癌症杂志,2004;13(3):279-87。
徐志伟,李志强,李志强,等。慢性淋巴细胞白血病分子谱的生物学和临床意义。Blood Rev. 2010;24(3): 135-41。
Metzeler KH, Heilmeier B, Edmaier KE, Rawat VP, Dufour A, Döhner K,等。淋巴增强子结合因子-1 (LEF1)的高表达是细胞遗传学正常的急性髓系白血病的一个新的有利预后因素。中华血液学杂志2012;120(10):2118-26。
王志强,王志强,王志强,等。BCL-2家族蛋白的多种功能研究。中国生物医学工程学报。2013;5(2):a008722。
Hagenbuchner J, Ausserlechner MJ, Porto V, David R, Meister B, Bodner M,等。在成神经细胞瘤中,抗凋亡蛋白BCL2L1/Bcl-xL被促凋亡的PMAIP1/Noxa中和,从而确定硼替zomib的敏感性不依赖于促生存的MCL1表达。中国生物医学工程学报,2010;29(4):489 - 497。
叶c - h,摩尔R,尼克C. microRNAs在慢性和急性人类白血病中的临床意义。中华肿瘤杂志,2016;15(1):1 - 16。
Klasen C, Ohl K, Sternkopf M, Shachar I, Schmitz C, Heussen N,等。MIF通过受体CXCR4和CD74和ZAP-70信号通路促进B细胞趋化。中华免疫杂志,2014;19(11):5273-84。
李志强,李志强,李志强,等。慢性淋巴细胞白血病:ESMO临床实践诊断,治疗和随访指南。安·昂科尔。2015;26:v78-84。
Payandeh Z, Rajabibazl M, Mortazavi Y, Rahimpour A, Taromchi AH, Dastmalchi S. ofatumumab单克隆抗体的亲和成熟和鉴定。中国生物医学工程学报,2019;29(1):344 - 344。
Pepe F, Balatti V.非编码rna在慢性淋巴细胞白血病靶向治疗和免疫治疗方法发展中的作用。中华临床医学杂志2020;9(2):593。
Caivano A, La Rocca F, Laurenzana I, Trino S, De Luca L, Lamorte D,等。恶性血液病中的细胞外囊泡:从生物学到治疗。国际分子化学杂志,2017;18(6):1183。
高希AK, Secreto CR,诺克斯TR,丁W, Mukhopadhyay D,凯NE。b细胞慢性淋巴细胞白血病循环微泡可刺激骨髓基质细胞:对疾病进展的影响血。2010;115(9):1755 - 64。
Belov L, Matic KJ, Hallal S, Best OG, Mulligan SP, Christopherson RI。癌细胞胞外囊泡的广泛表面蛋白谱可提供血液样本的诊断特征。J萃取囊泡。2016; 5(1): 25355。
De Luca L, D 'Arena G, Simeon V, Trino S, Laurenzana I, Caivano A,等。慢性淋巴细胞白血病循环微泡的特征及其预后相关性。中国肿瘤杂志。2017;58(6):1424-32。
叶艳艳,Ozer HG, Lehman AM, Maddocks K, Yu L, Johnson AJ,等。CLL外泌体的特征揭示了独特的microRNA特征和通过激活BCR信号增强的分泌。美国血液学杂志2015;125(21):3297-305。
Nisticò N, Maisano D, Iaccino E, Vecchio E, Fiume G, Rotundo S,等。慢性淋巴细胞白血病(CLL)衍生外泌体在肿瘤进展和生存中的作用药品。2020;13(9):244。
巨噬细胞作为肿瘤免疫和免疫治疗的调节因子。中华免疫杂志2019;19(6):369-82。
Javandoost E, Firoozi-Majd E, Rostamian H, khakpur - koosheh M, Mirzaei HR。microrna在慢性淋巴细胞白血病发病机制中的作用。高等医学学报,2020;27(2):282-97。
Tarhriz V, Eyvazi S, Musavi M, Abasi M, Sharifi K, Ghanbarian H,等。Cdk9在分化早期的瞬时诱导对肌生成至关重要。中国生物医学工程学报,2019;20(11):18854-61。
张天春,于东,李永生,文泽尔,Arking DE, West KM,等。广泛的microRNA抑制Myc有助于肿瘤的发生。中国科学。2008;40(1):43-50。
杜波,林超,边智,徐波。真菌β -葡聚糖抗炎作用的研究。食品科学与技术,2015;41(1):49-59。
Farzadfard E, Kalantari T, Tamaddon G.慢性淋巴细胞白血病患者7种microrna的血清表达。J血医学2020;11:97。
郭刚,吴春燕,杨海燕。MiR-17-92聚类与免疫。中华医学杂志2019;118(1):2-6。
Mardani R, Jafari Najaf Abadi MH, Motieian M, Taghizadeh-Boroujeni S, Bayat A, Farsinezhad A,等。白血病中的MicroRNA:具有预后潜力的肿瘤抑制因子和癌基因。中国生物医学工程学报。2019;34(6):866 - 866。
Favero A, Segatto I, Perin T, Belletti B. miR-223在癌症中的许多方面:抑癌因子,致癌驱动因素,治疗靶点和反应的生物标志物Wiley跨学科评论:RNA。2021: e1659。
Driedonks助教。细胞外囊泡和核蛋白复合物中的循环y - rna;对免疫系统的影响。前沿免疫。2019;9:3164。
Hegde GV, Peterson KJ, Emanuel K, Mittal AK, Joshi AD, Dickinson JD,等。刺猬诱导的b细胞慢性淋巴细胞白血病细胞在基质细胞微环境中的生存:一个潜在的新的治疗靶点。中华肿瘤杂志2008;6(12):1928-36。
Farahani M, rubi C, Liu L, Slupsky JR, Kalakonda N. CLL外泌体调节受体基质细胞的转录组和行为,并选择性富集miR-202-3p。PLoS ONE。2015; 10 (10): e0141429。
张晓东,张晓东,张晓东,等。慢性淋巴细胞白血病细胞释放的外泌体诱导基质细胞转变为癌症相关的成纤维细胞。血。2015;126(9):1106 - 17所示。
El-Daly SM, Bayraktar R, anfosi S, Calin GA。在b细胞恶性肿瘤中MicroRNAs和肿瘤微环境组分之间的相互作用。中华分子生物学杂志,2020;21(9):3387。
何颖,姜霞,陈娟。miR-150在正常和恶性造血中的作用。致癌基因。2014;33(30):3887 - 93。
Mraz M, Chen L, Rassenti LZ, Ghia EM, Li H, Jepsen K,等。miR-150通过调节GAB1和FOXP1的表达影响慢性淋巴细胞白血病b细胞受体信号通路。血。2014;124(1):84 - 95。
斯塔马托波洛斯B,范·达姆M,克伦波特E,德萨斯B,埃尔·豪尼H,米纳尔P,等。慢性淋巴细胞白血病患者细胞和血清循环microRNA-150的相反预后意义Mol medical . 2015;21(1): 123-33。
李文杰,李文杰,张文杰,等。miR-155在单克隆B细胞淋巴细胞增多症和B慢性淋巴细胞白血病患者中的预后价值血。中华临床血液学杂志,2013;29(4):344 - 344。
Elton TS, Selemon H, Elton SM, Parinandi NL。MIR155宿主基因在生理病理过程中的调控。基因。2013;532(1):1 - 12。
Bruns H, Böttcher M, Qorraj M, Fabri M, Jitschin S, Dindorf J,等。维生素d干扰外泌体miR-155转移介导的cll细胞介导的MDSC诱导。白血病。2017;31(4):985-8。
吕敏,王凯,黄晓杰。血液系统恶性肿瘤中的骨髓源性抑制细胞:朋友还是敌人。中华血液病杂志2019;12(1):1 - 12。
Jurj A, Pop L, Petrushev B, Pasca S, Dima D, Frinc I,等。外显体携带的基于microrna的特征是慢性淋巴细胞白血病演变为里克特综合征的细胞触发因素。危重症临床实验室,2018;55(7):501-15。
Kollinerova S, Vassanelli S, Modriansky M. miR-29家族成员在恶性造血中的作用。生物医学论文,2014;158(4):489-501。
Stamatopoulos B, Meuleman N, Haibe-Kains B, Saussoy P, Van Den Neste E, Michaux L等。microRNA-29c和microRNA-223下调在慢性淋巴细胞白血病中具有体内意义,改善疾病风险分层。美国血液学杂志2009;113(21):5237-45。
拉苏尔E, Salamon D, Nagy N, Leveau B, Banati F, Szenthe K,等。MEC1和MEC2系代表两个CLL亚克隆在不同的进展阶段向前淋巴细胞白血病。PLoS ONE。2014; 9 (8): e106008。
Haderk F, Schulz R, Iskar M, Cid LL, Worst T, Willmund KV,等。肿瘤来源的外泌体调节PD-L1在单核细胞中的表达。科学免疫学。2017; 2(13)。
Jafarzadeh N, Gholampour MA, Alivand M-R, Kavousi S, Arzi L, Rad F,等。CML衍生的外泌体在T细胞中促进肿瘤良好的功能表现。中国生物医学工程学报,2021;21(1):1 - 11。
Hamidi AA, Khalili-Tanha G, Nasrpour Navaei Z, Moghbeli M. Long非编码rna作为结直肠癌细胞上皮间充质转化的关键调控因子:综述。癌症杂志,2022;22(1):1 - 15。
Ohyashiki JH, Umezu T, Ohyashiki K.外泌体促进血液肿瘤中的骨髓血管生成:缺氧的作用。中国临床血液学杂志,2016;23(3):268-73。
Mineo M, Garfield SH, Taverna S, Flugy A, De Leo G, Alessandro R,等。K562慢性髓系白血病细胞释放的外泌体以src依赖的方式促进血管生成。血管生成。2012;15(1):33-45。
梅子T,大洋洲K,黑田M,大洋洲JH。白血病细胞通过外泌体miRNAs与内皮细胞通信。致癌基因。2013;32(22):2747 - 55。
Tadokoro H, memezu T, Ohyashiki K,平野T, Ohyashiki JH。来源于低氧白血病细胞的外泌体促进内皮细胞管的形成。中国生物医学工程杂志,2013;29(4):344 - 344。
Raimondo S, Saieva L, Corrado C, Fontana S, Flugy A, Rizzo A,等。慢性髓系白血病来源的外泌体通过自分泌机制促进肿瘤生长。手机通信与信令,2015;13(1):1 - 12。
Jafarzadeh N, Safari Z, Pornour M, Amirizadeh N, Forouzandeh Moghadam M, Sadeghizadeh M. K562慢性髓系白血病细胞来源外泌体对骨髓间充质干细胞和巨噬细胞细胞和免疫相关特性的改变。中国生物医学工程学报。2019;34(4):366 - 366。
刘勇,宋波,魏勇,陈峰,迟勇,范华,等。间充质间质细胞外泌体通过激活caspase信号通路增强伊马替尼诱导的人白血病细胞凋亡。Cytotherapy。2018;20(2):181 - 8。
闵庆华,王学忠,张杰,陈庆国,李世强,刘学强,等。来自耐伊马替尼慢性髓系白血病细胞的外泌体通过传递miR-365介导耐药性状的水平转移。Exp Cell res 2018;362(2): 386-93。
姜国伟,郑建辉,许伟,朴杰,申华,崔波,等。来自慢性骨髓性白血病细胞的外泌体作为生物标志物的潜力。抗癌决议2018;38(7):3935-42。
蒋玲,邓涛,王东,肖燕。血清外泌体miR-125b水平升高是中危急性髓系白血病预后不良的潜在标志。中华血液学杂志,2018;140(3):183-92。
王欢J, Hornick NI, Shurtleff MJ, Skinner AM, Goloviznina NA, Roberts CT,等。急性髓性白血病外泌体的RNA运输。癌症研究,2013;73(2):918-29。
倪浩尼克,王欢,王伟,张晓燕,等。血清外泌体microRNA作为AML的微创早期生物标志物。科学通报2015;5(1):1 - 12。
张磊,Khadka B,吴娟,冯勇,龙波,肖锐,等。骨髓间充质干细胞来源的外泌体miR-425-5p通过靶向WTAP抑制急性髓系白血病细胞增殖、凋亡、侵袭和迁移肿瘤靶标和治疗。2021; 14:4901。
王欢,霍尼克,戈洛维兹尼娜,卡米美-兰宁,大卫·L,威尔玛斯·P,等。通过旁分泌转运AML外泌体协调调节残余骨髓功能。白血病。2015;29(12):2285 - 95。
胡晓东,杨晓东,杨晓东,杨晓东,等。急性髓系白血病通过外泌体分泌将骨髓生态位转化为白血病允许的微环境。白血病。2018;32(3):575 - 87。
Szymczyk A, machheta A, Podhorecka M.恶性血液病过程中异常microRNA表达。癌症管理决议2018;10:4267。
黎文涛,郭春梅,王丽娟,Perdigão-Henriques R,等。含mir -200的细胞外囊泡促进乳腺癌细胞转移。中华临床医学杂志,2014;29(12):559 - 28。
潘M, Reid MA, Lowman XH, Kulkarni RP, Tran TQ,刘X,等。肿瘤局部谷氨酰胺缺乏通过抑制组蛋白去甲基化促进去分化。细胞生物学杂志,2016;18(10):1090-101。
陈玲,郭志,周勇,倪娟,朱军,樊晓,等。急性髓系白血病细胞含microrna -1246的胞外囊泡通过lrig1介导的STAT3通路促进白血病干细胞的存活。衰老。2021;13(10):13644。
Szczepanski MJ, Szajnik M, Welsh A, Whiteside TL, Boyiadzis M.急性髓系白血病患者血清中的blast衍生微泡通过膜相关转化生长因子-β1抑制自然杀伤细胞功能。Haematologica。2011;96(9):1302。
张志刚,张志刚,张志刚,张志刚,等。多发性硬化症(PwMS)患者的听力损失:一项系统综述和荟萃分析多发性硬化症及其相关疾病。20122:103754。
Zalpoor H, Akbari A, Samei A, Forghaniesfidvajani R, Kamali M, Afzalnia A,等。Eph受体、神经蛋白酶-1、P2X7和CD147在covid -19相关神经退行性疾病中的作用:炎症小体和JaK抑制剂是潜在的有前途的治疗方法。细胞分子生物学杂志,2022;27(1):1 - 21。
尼古拉斯R,拉希德w,多发性硬化症。中国内科杂志。2013;37(10):344 - 344。
Pusic AD, Pusic KM, Kraig RP。什么是外泌体,它们如何用于多发性硬化症治疗?神经科学。2014;14(4):353-5。
杨玲,刘春春,刘春春,李志刚,李志刚,等。miR-146a对小鼠T细胞应答的抑制作用。中华检验医学杂志,2012;29(4):344 - 344。
周松,董旭,张超,陈鑫,朱军,李伟,等。MicroRNAs与CD4 + CD25 +调节性T细胞抑制CD4 + CD25 -常规T细胞增殖有关。中华免疫杂志2015;63(2):464-72。
李志强,李志强,李志强,李志强。通过系统注射靶向外泌体将siRNA传递到小鼠大脑。中国生物工程学报。2011;29(4):341-5。
Pusic AD, Pusic KM, Kraig RP。什么是外泌体,它们如何用于多发性硬化症治疗?神经科学。2014;14(4):353-5。
Gallo A, Tandon M, Alevizos I, Illei GG.血清和唾液中检测到的microRNAs大部分集中在外泌体中。PLoS ONE。2012; 7 (3): e30679。
Okoye IS, Coomes SM, Pelly VS, Czieso S, Papayannopoulos V, Tolmachova T,等。含有microrna的T调节细胞来源的外泌体抑制致病的T辅助1细胞。免疫力。2014;41(1):89 - 103。
葛强,周勇,卢杰,白勇,谢晓,卢哲。血浆外泌体中miRNA在不同储存条件下稳定。分子。2014;19(2):1568 - 75。
Ebrahimkhani S, Vafaee F, Young PE, Hur SS, Hawke S, Devenney E,等。多发性硬化症的外泌体microRNA特征反映疾病状况。科学通报2017;7(1):1 - 10。
杜超,刘超,康杰,赵刚,叶铮,黄松,等。MicroRNA miR-326调节T H-17分化,与多发性硬化症的发病机制有关。中华免疫杂志2009;10(12):1252。
Jeker LT,蓝石JA。MicroRNA对t细胞分化和功能的调控。中国生物医学工程学报,2013;
Cox MB, Cairns MJ, Gandhi KS, Carroll AP, Moscovis S, Stewart GJ,等。MicroRNAs miR-17和miR-20a抑制T细胞激活基因,在MS全血中低表达。PLoS ONE。2010; 5 (8): e12132。
Junker A, Hohlfeld R, Meinl E. microrna在多发性硬化症中的新兴作用。神经科学综述,2011;7(1):56-9。
李志强,李志强,李志强,等。多发性硬化症:microRNA表达谱准确区分复发缓解疾病患者与健康对照。PLoS ONE。2009; 4 (10): e7440。
De Santis G, Ferracin M, Biondani A, Caniatti L, Tola MR, Castellazzi M,等。多发性硬化过程中T调节细胞中miRNA表达的改变。中华神经免疫杂志,2010;26(1):1 - 6。
Azimi M, Ghabaee M, Moghadasi AN, Izad M.复发缓解型多发性硬化症患者T细胞来源外泌体miR-326表达的改变。伊朗过敏、哮喘和免疫学杂志,2019。
Hartman ZC,魏杰,Glass OK,郭华,雷刚,杨晓燕,等。通过外泌体抗原靶向提高疫苗效力。疫苗。2011;29(50):9361 - 7。
尹伟,欧阳山,李勇,肖波,杨慧。未成熟树突状细胞来源的外泌体:一种有希望的亚细胞疫苗。炎症。2013;36(1):232 - 40。
Pusic A, Kraig R,编辑。外泌体介导的氧化应激和脱髓鞘缓解。Soc >;2012.
普西克AD,普西克KM,克莱顿BL,克瑞格RP。ifn γ刺激树突状细胞外泌体作为脱髓鞘的潜在治疗方法。中华神经免疫杂志,2014;26(1):1 - 3。
Murugaiyan G, Beynon V, Mittal A, Joller N, Weiner HL。沉默microRNA-155可改善实验性自身免疫性脑脊髓炎。中华免疫杂志,2011;19(5):529 - 529。
micko MP, Cichalewska M, Cwiklinska H, Selmaj kww . miR-155-3p通过调节热休克蛋白40驱动自身免疫性脱髓鞘的发展。中华神经科学杂志,2015;35(50):16504-15。
Mycko MP, Cichalewska M, Machlanska A, Cwiklinska H, Mariasiewicz M, Selmaj KW. MicroRNA-301a对t辅助性17免疫反应的调节控制自身免疫性脱髓鞘。中国科学院学报,2012;39(4):344 - 344。
卢丽芳,泰T-H, Calado DP, Chaudhry A, Kubo M, Tanaka K,等。foxp3依赖的microRNA155通过靶向SOCS1蛋白赋予调节性T细胞竞争适应性。免疫力。2009;30(1):80 - 91。
林世涛,黄燕,张玲,恒美,Ptáček林杰,付艳华。MicroRNA-23a促进中枢神经系统的髓鞘形成。美国国家科学院学报。2013; 110(43): 17468 - 73。
田娟,李晓霞,张艳,罗stami A。细胞外囊泡在自身免疫性疾病病理生理、诊断和治疗中的潜在作用。中国生物医学工程学报,2020;16(4):620。
Selmaj I, Mycko MP, Raine CS, Selmaj KW.外泌体在中枢神经系统炎症中的作用及其与多发性硬化的关系。中国神经免疫杂志,2017;6:1 - 10。
李志强,李志强,李志强,等。干细胞来源的外泌体作为自身免疫和神经退行性疾病的纳米疗法。中国生物医学工程学报。2019;13(6):6670-88。
于林,杨峰,姜林,陈勇,王凯,徐峰,等。来自基因修饰的树突状细胞的具有膜相关TGF - β1的外泌体独立于MHC限制抑制小鼠EAE。中华免疫杂志,2013;43(9):2461-72。
Casella G, Colombo F, Finardi A, Descamps H, Ill-Raga G, Spinelli A,等。含有IL-4的细胞外囊泡调节多发性硬化症小鼠模型的神经炎症。生物化学学报,2018;26(9):2107-18。
庄X,向X, Grizzle W,孙东,张松,Axtell RC,等。通过将外泌体包裹的抗炎药物从鼻腔运送到大脑来治疗脑炎症性疾病。生物化学学报,2011;19(10):1769-79。
孙东,庄旭,向旭,刘勇,张松,刘超,等。一种新型的纳米颗粒给药系统:姜黄素的抗炎活性被包裹在外泌体中时增强。分子化学,2010;18(9):1606-14。
Sáenz-Cuesta M, Irizar H, Castillo-Triviño T, Muñoz-Culla M, Osorio-Querejeta I, Prada A,等。循环微粒反映多发性硬化症的治疗效果和临床状况。生物标记医学,2014;8(5):653-61。
Galazka G, Mycko MP, Selmaj I, Raine CS, Selmaj KW.多发性硬化症:血清来源的外泌体表达髓鞘蛋白。中国生物医学工程学报,2018;24(4):449-58。
王志刚,王志刚,王志刚。细胞外囊泡:沿中枢神经系统屏障病理的介质和生物标志物。中枢神经系统的液体和屏障。2018; 15(1): 21。
田娟,李晓霞,张艳,罗stami A。细胞外囊泡在自身免疫性疾病病理生理、诊断和治疗中的潜在作用。中国生物医学工程学报,2020;16(4):620-32。
木村K, Hohjoh,福冈M,佐藤W,大木S,富美C,等。循环外泌体通过let-7i抑制多发性硬化症中调节性T细胞的诱导。地理学报。2018;9(1):1 - 14。
Ebrahimkhani S, Vafaee F, Young PE, Hur SSJ, Hawke S, Devenney E,等。多发性硬化症的外泌体microRNA特征反映疾病状况。科学通报2017;7(1):14293。
Selmaj I, Cichalewska M, Namiecinska M, Galazka G, Horzelski W, Selmaj KW,等。全球外泌体转录组分析揭示多发性硬化症的生物标志物。中华神经科学杂志,2017;31(5):344 - 344。
刘玲,左颖,徐颖,张震,李颖,庞杰。MiR-613通过直接下调DKK1抑制类风湿性关节炎滑膜成纤维细胞增殖和侵袭并诱导细胞凋亡。细胞分子生物学杂志2019;24(1):1 - 14。
de Brito Rocha S, Baldo DC, Andrade LEC。自身抗体在类风湿关节炎中的临床和病理生理意义。中国风湿病杂志,2019;59(1):1 - 13。
李志强,李志强,李志强,等。抗瓜氨酸蛋白抗体在类风湿关节炎中的临床应用。中华风湿病杂志,2013;16(4):379-86。
张志刚,张志刚,张志刚,等。抗瓜氨酸蛋白抗体在类风湿关节炎发病机制中的作用及其作为诊断工具的潜力。风湿病杂志,2013;33(7):1669-73。
Szodoray P, Szabó Z, Kapitány A, gyetai Á, Lakos G, Szántó S,等。抗瓜氨酸蛋白/肽自身抗体与遗传和环境因素相关,可作为类风湿性关节炎疾病结局的指标。自动化学报,2010;9(3):140-3。
Imboden简森-巴顿。类风湿关节炎的免疫发病机制。2009; 4:417-34。
克拉列斯科格L, Malmström V,伦德伯格K,帕尤科夫L,阿尔弗雷德松L,编辑。吸烟、瓜氨酸化和类风湿关节炎免疫发病机制中的遗传变异。免疫学研讨会。爱思唯尔;2011.
刘志刚,刘志刚,刘志刚。类风湿和银屑病关节炎的生物标志物。中国临床免疫杂志,2015;61(1):2-10。
Vang T, Congia M, Macis MD, Musumeci L, Orrú V, Zavattari P,等。自身免疫相关的淋巴样酪氨酸磷酸酶是一种功能获得型。中国科学。2005;37(12):1317-9。
Kochi Y, Suzuki A, Yamada R, Yamamoto K.类风湿关节炎的遗传学:潜在的种族差异的证据。中国机械工程学报。2009;32(3-4):158-62。
谢国强,谢国强,李志强,等。全基因组关联研究荟萃分析确定了7个新的类风湿关节炎风险位点。中国科学。2010;42(6):508。
McAllister K, Eyre S, Orozco G.类风湿关节炎的遗传学:GWAS及其他。《风湿病学:研究与评论》2011;3:31。
Cloutier N, Paré A, Farndale RW, Schumacher HR, Nigrovic PA, Lacroix S,等。血小板可增强血管通透性。中华血液学杂志2012;120(6):1334-43。
孙东,庄旭,向旭,刘勇,张松,刘超,等。一种新型的纳米颗粒给药系统:姜黄素的抗炎活性被包裹在外泌体中时增强。分子化学,2010;18(9):1606-14。
Tavasolian F, Hosseini AZ, Soudi S, Naderi M. miRNA-146a改善了msc衍生外泌体在类风湿性关节炎中的免疫调节作用。中国生物医学工程学报。2020;20(4):297-312。
陈忠,王辉,夏艳,闫飞,陆燕。MMP14和VEGF调控间充质细胞来源的mirna -150-5p外泌体在类风湿性关节炎中的治疗潜力。中华免疫杂志,2018;201(8):2472-82。
金世华,李志强,李志强,李志强,等。来自il -10处理的树突状细胞的外泌体可以抑制炎症和胶原诱导的关节炎。中华免疫杂志,2005;29(4):344 - 344。
蔡智,张伟,杨峰,于磊,于智,潘杰,等。来自TGF-β1基因修饰的树突状细胞的免疫抑制外泌体通过诱导调节性T细胞来减弱th17介导的炎性自身免疫性疾病。中国生物医学工程学报,2012;22(3):607-10。
陈晓明,赵颖,吴晓东,王明杰,于辉,陆建军,等。银屑病关节炎、寻常型银屑病、类风湿关节炎和痛风性关节炎患者血浆外泌体microrna共同表达的新发现。《医学发现》2019;28(151):47-68。
Schioppo T, Ubiali T, Ingegnoli F, Bollati V, Caporali R.细胞外囊泡在类风湿关节炎中的作用:系统综述。临床风湿病。2021:1-17。
吴丽峰,张强,莫晓波,林杰,吴彦林,陆旭,等。从血浆外泌体中鉴定新型类风湿性关节炎相关MiRNA-204-5p。实验与分子医学。20122:1 - 12。
韦思罗,刘勇,刘志强,刘志强,刘志强。类风湿性关节炎和骨关节炎发病机制中的细胞外囊泡。关节炎治疗。2016; 18(1): 1 - 12。
张海光,刘超,苏凯,于生,张磊,张松,等。外泌体呈现的TNF-α膜形式延缓T细胞活化诱导的细胞死亡。中华免疫杂志,2006;17(12):785 - 93。
陈建平,陈建平,陈建平,等。细胞外囊泡在关节修复和再生中的应用。风湿风湿病杂志,2016;12(4):243。
付华,胡东,张玲,唐鹏。细胞外囊泡在类风湿关节炎中的作用。中华免疫杂志2018;93:125-32。
Buzas EI, György B, Nagy G, Falus A, Gay S.细胞外囊泡在炎症性疾病中的作用。风湿病杂志,2014;10(6):356-64。
Stanczyk J, Ospelt C, Karouzakis E, Filer A, Raza K, Kolling C,等。类风湿性关节炎滑膜成纤维细胞microRNA-203表达的改变及其在成纤维细胞激活中的作用。王晓明。2011;32(2):373-81。
Miller MC, Manning HB, Jain A, Troeberg L, Dudhia J, Essex D,等。膜1型基质金属蛋白酶是类风湿性关节炎滑膜浸润的重要促进因子。关节炎与风湿病:美国风湿病学会官方杂志。2009;60(3):686-97。
Maeda Y, Farina NH, Matzelle MM, Fanning PJ, Lian JB, Gravallese EM.滑膜来源的microrna调节类风湿性关节炎的骨通路。中国生物医学工程学报,2017;32(3):461-72。
邢L,施瓦茨EM,博伊斯BF。破骨细胞前体、RANKL/RANK和免疫学。免疫杂志2005;208(1):19-29。
Tran T-H, Mattheolabakis G, Aldawsari H, Amiji M.外泌体作为癌症和炎症疾病免疫治疗的纳米载体。中国临床免疫杂志,2015;160(1):46-58。
Kim SH, Bianco NR, Shufesky WJ, Morelli AE, Robbins PD。用表达IL-4的基因修饰树突状细胞衍生的外泌体有效治疗炎症疾病模型中华免疫杂志,2007;17(4):2242-9。
杨C,罗宾斯警局。免疫抑制外泌体:治疗关节炎的新方法。国际风湿病杂志。2012年,2012年。
Payandeh Z, Pirpour Tazehkand A, Azargoonjahromi A, Almasi F, Alagheband Bahrami A.细胞器在类风湿关节炎中的作用。中国生物医学工程学报。2021;23(1):20。
Bianco NR, Kim SH, Ruffner MA, Robbins PD。吲哚胺2,3 -双加氧酶阳性树突状细胞外泌体在胶原诱导的关节炎和延迟型超敏反应疾病模型中的治疗作用关节炎与风湿病:美国风湿病学会官方杂志。2009;60(2):380-9。
林敏奎,刘杰,辛D-H,任c,李sk,金萨。血清外泌体miRNA-1915-3p与韩国类风湿性关节炎疾病活动性相关体内。34(5): 2941 - 2020; 5。
确认
作者感谢大不里士医学科学大学。
资金
这项研究是一篇综述文章,所以不需要资助。
作者信息
作者及隶属关系
贡献
DSh, E, MKF和NJ构思并设计了研究。MNA, HZ, ZP对稿件进行了修改。ZP, HZ和DSh监督了这项研究。所有作者都阅读并批准了手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究不涉及人或动物。
发表同意书
所有其他作者声明没有利益冲突。
相互竞争的利益
所有其他作者声明没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
卡拉米·法斯,M.,阿扎米,J.,贾法里,N。et al。外泌体在b细胞疾病治疗和诊断中的应用:白血病,多发性硬化症和类风湿关节炎。细胞Mol生物学2774岁(2022年)。https://doi.org/10.1186/s11658-022-00377-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s11658-022-00377-x
关键字
- 外来体
- 癌症
- 慢性淋巴细胞白血病
- 急性髓系白血病
- 风湿性关节炎
- 多发性硬化症