摘要
背景
大别班达病毒,也被称为严重发热伴血小板减少综合征病毒(SFTSV),于2010年在中国首次分离出来。在这个时候,病毒被发现已经传播到韩国、日本等国家。据报告,热休克综合征的病死率很高,各种来源的病死率从12-50%不等。一些用于SFTS患者临床研究的组学研究以及培养的SFTSV研究试图描述该疾病的相关分子生物学和流行病学特征。然而,迄今为止尚未报道对SFTS患者进行全球血清蛋白质组学分析。
方法
在目前的研究中,我们评估了SFTS患者(8名康复患者和3名死亡患者)的血清蛋白质组学比较,目的是确定与SFTS临床表现相关的蛋白质表达模式。
结果
本研究的蛋白质组学结果显示,凝血因子蛋白S和蛋白C在死亡患者中下调具有统计学意义。补体系统下调以及延长中性粒细胞激活也被观察到。此外,肿瘤坏死因子α、中性粒细胞激活细胞因子和炎症细胞因子白介素-1β下游蛋白均过表达。
结论
血小板减少和多器官功能衰竭是SFTS患者死亡的主要直接原因。在这项研究中,记录了SFTS患者中与血小板减少、异常免疫反应和炎症激活相关的血清蛋白质组学变化。这些发现为了解SFTS的临床表现提供了有用的信息。
背景
发热伴血小板减少综合征(SFTS)首次报道于2009年。该综合征由大别班达病毒引起,也称为发热伴血小板减少综合征病毒(SFTSV)。SFTSV病毒于2010年在中国首次分离出来,并被确定属于该家族Phenuiviridae家庭(1].SFTS于2012年在日本首次报道,2013年在韩国首次报道。虽然不同地区的平均病死率有所不同,但报告的热休克综合征病死率总体上相对较高,从12%至50%不等[2,3.,4].发热伴血小板减少、白细胞减少和肝损伤。死亡病例通常表现为弥散性血管内凝血(DIC)以及多器官功能衰竭[5,6].与这些临床症状相关,肝功能测试中的生物标志物水平,包括血清天门冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)和乳酸脱氢酶(LDH),通常较高。同样,在SFTS患者的多器官衰竭阶段,活化部分凝血活蛋白时间(aPTT)通常延长[7].此外,SFTS患者炎症细胞因子水平也升高。先前的一份报告证实,与健康个体相比,SFTS患者中肿瘤坏死因子(TNF)-α、干扰素(IFN)-α、白介素6 (IL-6)和白介素10 (IL-10)的表达较高[8,9].TNF-α、INF-α和IL-6水平与临床严重程度高度相关。
自SFTSV被分离报道以来,近十年来,人们通过临床分析和细胞因子产生分析等多种方法来确定SFTSV的发病机制。虽然组学技术为病原学研究提供了高效的方法,但SFTSV或SFTS患者的组学研究最近才有报道[10,11,12,13].患者年龄是SFTS疾病严重程度的一个重要已知危险因素。例如,一项雪貂模型分析证实,感染SFTS的老年雪貂有严重血小板减少、高热和白细胞计数减少等症状。在转录组分析中,干扰素介导的抗病毒信号在年轻雪貂中被强烈观察到,炎症反应相关基因在老年雪貂中上调[10].在SFTSV感染细胞的蛋白质组学研究中,发现宿主细胞的未折叠蛋白反应在SFTSV感染中发挥重要作用[11].另一项对SFTSV感染细胞的蛋白质组学研究报告称,线粒体DNA在SFTSV感染时被释放,诱导NLRP3炎性小体活化[12].除了这些宿主反应机制研究外,SFTS患者的血清免疫谱分析以及外周血单个核细胞(pmcs)的单细胞RNA-seq研究报告称,过表达的炎症细胞因子与SFTS患者的疾病严重程度相关[13].这些研究为SFTSV在体内和体外感染提供了有价值的信息。
血液生物标记物对于明确疾病状况很重要。然而,对SFTS患者血清的全球蛋白质组学分析尚未报道。因此,在本研究中,我们对SFTS患者进行血清蛋白质组学研究,以确定与疾病临床表现相关的蛋白质,并根据疾病严重程度来表征其变化。据我们所知,这是第一个在SFTS患者血清中检测蛋白质组学结果的临床研究。
方法
患者及临床样本
从全北大学医院收治的11名SFTS患者中分离出血清。在确认感染SFTS病毒后6小时内从血液中提取血清样本。实验室确认的SFTS病毒感染根据以下标准进行定义:(1)临床症状(如发热),(2)支持蜱虫叮咬可能性的流行病学证据,以及(3)通过逆转录聚合酶链反应(RT-PCR)鉴定病毒RNA。为了检测SFTSV RNA,使用QIAamp病毒RNA迷你试剂盒(Qiagen, Hilden, Germany)根据制造商说明从血清中提取RNA。一步RT - PCR采用ToPscript™一步RT - PCR DryMix (enzymatic ics, Daejeon, Korea),引物为MF3 (5 ' - GATGAGATGGTCCATGCTGATTCT-3 ')和MR2 (5 ' - TCATGGGGTGGAATGTCCT ca3 ')。
LC-MS /MS进行蛋白质组学分析
液相色谱-串联质谱(LC-MS /MS)分析是根据先前一份报告所载的方法[14].简单地说,用12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总提取蛋白,然后进行凝胶内胰蛋白酶消化。使用MGU30-18捕集柱(LC填料)清洗胰蛋白酶肽混合物中的化学污染物。以300 nL/min的流速,将从色谱柱中洗脱的肽直接导入10 cm × 75 μm的IDC18反相色谱柱(PROXEON,欧登塞,丹麦)。多肽用0-65%乙腈梯度洗脱80分钟。使用Q Exactive Plus质谱仪(Thermo Scientific公司,Waltham, MA, USA)在数据依赖模式下进行串联质谱(MS/MS)。每次全质谱(MS)扫描(m/z范围400-2000)之后进行三次MS/MS扫描,确认质谱中前体离子含量最高。
公共SFTS患者数据集
蛋白质组的结果为阐明基于蛋白质组水平的疾病病因的生物学过程提供了有用的信息。然而,蛋白质组学分析需要互补组学工具来确认大规模的变化。蛋白质组学单独只能提供有限的信息,有关差异表达蛋白(DEP)。因此,我们使用从美国国家生物技术信息中心(NCBI)测序阅读档案(SRA;https://www.ncbi.nlm.nih.gov/sra).我们重新分析了RNA-seq下的GSE144358数据集。利用SFTS患者血清mRNA进行分析[12].以下GSE144358数据集的原始FASTQ文件从基因综合表达式(GEO)接入下载:GSM4286781到GSM4286858。该数据集包含21名健康对照,15名康复SFTS患者和19名死亡SFTS患者。差异表达基因(DEG)使用DESeq2 R包进行鉴定(R项目用于统计计算,维也纳,奥地利)[15],以hg38为参考序列。
统计和生物信息分析
我们表演了学生t-test使用R统计包评估单变量相关性。采用匠心通路分析(IPA)进行网络分析和富集r [16]用于DEPs的功能分析。蛋白定量采用Maxquant 2.6.1 (Munich, Germany)进行鉴定,Uniprot Human proteome序列(UP000005640)作为参考数据库[17].蛋白质搜索参数使用orbitrap默认条件,错误发现率设置为0.01。dep在Persous 1.6.2 (Maxquant内部的软件平台)中计算,使用Maxquant生成的无标签量化(LFQ)值作为输入数据[18].DEP的临界值为< 0.05t-test p-values and fold changes > 2 (|fold-change|> 2)。
伦理批准
根据全北国立大学医院机构审查委员会(IRB)批准的注册方案收集受试者血清样本,所有患者在参与前提供书面知情同意(IRB注册号2019-06-020)。这项研究是根据赫尔辛基宣言的原则进行的。
结果与讨论
临床样本评价
从2018年至2019年在全北大学医院住院的11名SFTS患者中分离出血清。在血清分离时,11名入选患者的白细胞和血小板计数没有统计学上的显著差异。然而,在入选的患者中,有3名患者最终死亡。这些患者的AST、ALT、l -乳酸脱氢酶(LD)、肌酐和高敏c反应蛋白(hs-CRP)水平有统计学意义上的显著升高。此外,与正常范围相比,SFTS患者的aPTT延长。SFTS患者通常死于器官衰竭伴血小板减少症。然而,在本研究评估的死亡患者中,没有观察到血小板计数有统计学意义的下降。我们发现,与康复患者相比,死亡患者的aPTT延长。在这项研究中,我们的目的是通过血清蛋白质组学分析确定与SFTSV感染引起的死亡相关的几个因素。入组患者的详细临床特征见表1.
蛋白质组学分析
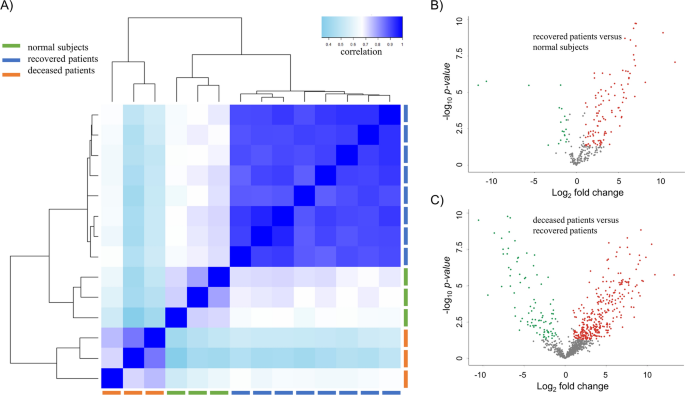
通过LC-MS /MS对11例SFTS患者和3例正常人的血清进行了蛋白质组学分析。我们将SFTS患者分为两组:康复患者组(8名患者)和死亡患者组(3名患者)。总蛋白质组数据的样本相关热图显示,三组被明确划分为三个聚类(图;1A).正常受试者和康复患者比死亡患者更紧密地聚集在一起。对比康复患者与正常人的蛋白定量结果,康复患者中有85种蛋白过表达,17种蛋白下调(图2)。1B和附加文件1:表S1)。在死亡患者与康复患者的比较中,死亡患者中有315个蛋白过表达,91个蛋白下调(图。1C和附加文件1:表S1)。死亡患者的937个鉴定蛋白中,有406个蛋白(43.3%)与康复患者相比存在差异表达。然而,当将康复患者与正常受试者进行比较时,我们证实,在康复患者中鉴定的蛋白质中只有20.9%表达差异。因此,将死亡患者的DEPs与康复患者的DEPs进行比较,可能有助于阐明SFTS患者的严重程度。
典型通路的比较分析
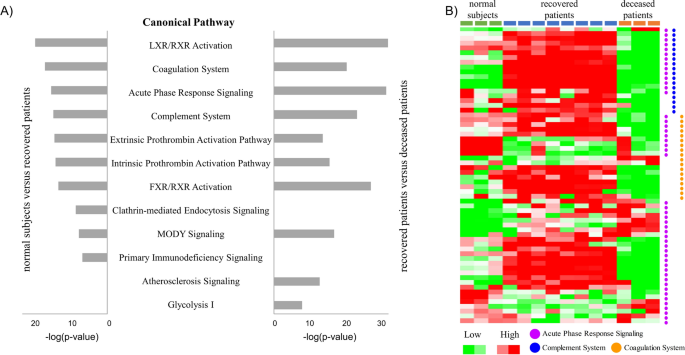
为了确定SFTS患者的关键分子特征,我们进行了富集通路分析。具体来说,根据SFTS患者的预后,使用DEP的IPA分析来研究丰富的典型通路(图。2在已确定的典型通路中,我们最感兴趣的是三个典型通路(急性期反应、凝血系统和补体系统),所有这些都在两种比较条件下(正常受试者与康复患者、康复患者与死亡患者)检测到(图。2A).与这三种途径相关的蛋白在康复患者中有过表达的趋势,而在死亡患者中有下调的趋势(图。2B和表格2).
补体系统是抵御病毒感染的第一道先天免疫防线。然而,在死亡患者中,与康复患者相比,补体系统的组成蛋白(除MASP2外)下调(图2)。2B和表格2)和正常受试者(数据未显示)。我们推断,补体系统似乎在死亡患者中没有被激活。然而,与正常受试者相比,康复患者的补体蛋白C4A、C4B、C1S和C1R均上调(表2)2).此外,与正常受试者相比,康复患者的补体C6和C7蛋白表达降低(表2)2).据报道,许多病毒通过逃避补体策略来逃避宿主的免疫反应[19].然而,据我们所知,还没有报道SFTSV的补体规避策略,它属于沙属。目前的研究为SFTSV存在补体系统回避的可能性提供了线索,这是迄今为止未知的。因此,需要进一步的分析来确定SFTSV内的补体规避策略。
在目前的研究中,凝血系统(另一个排名靠前的典型途径)的蛋白表达在不同的患者组中发生了显著的变化(图。2B和表格2).凝血相关蛋白中,凝血因子S、凝血因子C、凝血因子V、凝血因子IX在康复患者中过表达(表2)2).虽然康复患者的aPTT (33.6 ~ 52.4 s)比正常范围(21.0 ~ 35.0 s)长,但蛋白C的上调提示康复患者抗凝系统仍有功能。相比之下,在死亡患者中发现凝血蛋白和蛋白C的急剧下调。凝血系统是介导先天免疫反应和血小板减少症的重要机制[20.],这是至关重要的,因为血小板减少是SFTS患者死亡结局的最关键因素之一[5,6].此外,蛋白C和蛋白S是抗凝系统中起重要作用的主要蛋白[21].死亡患者中凝血蛋白和蛋白C的下调可能是由于在死亡患者中观察到的肝功能障碍[22].因此,我们可以假设死亡患者在SFTSV感染过程中凝血系统蛋白被消耗。高度延长的aPTT时间(78.5-90.0 s)和凝血系统失活在死亡患者中始终可见,提示血栓形成系统已经处于DIC状态。
总之,我们观察到,在死亡患者中,初始免疫反应(即补体系统)对SFTSV感染过程没有适当的反应。此外,我们观察到患者由于凝血系统功能障碍而进展到DIC状态。
差异表达蛋白
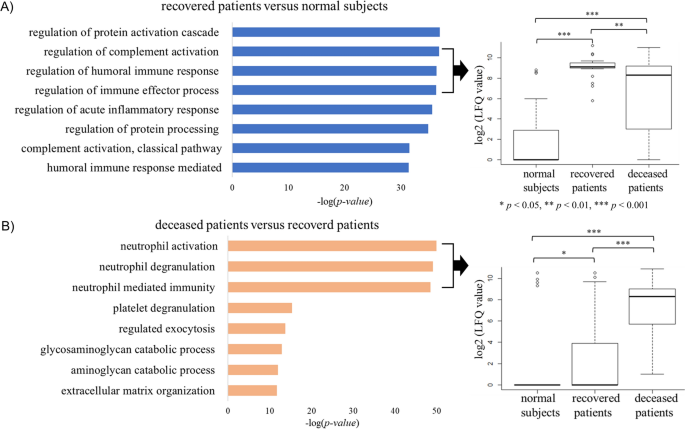
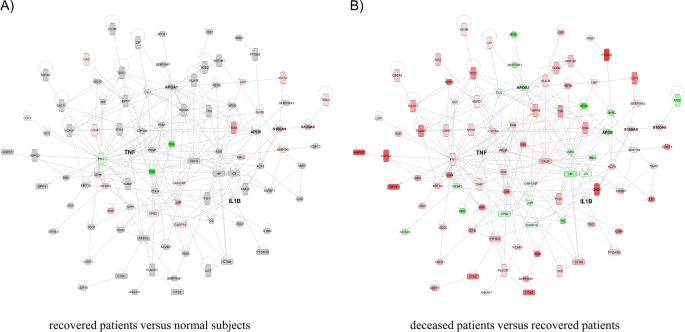
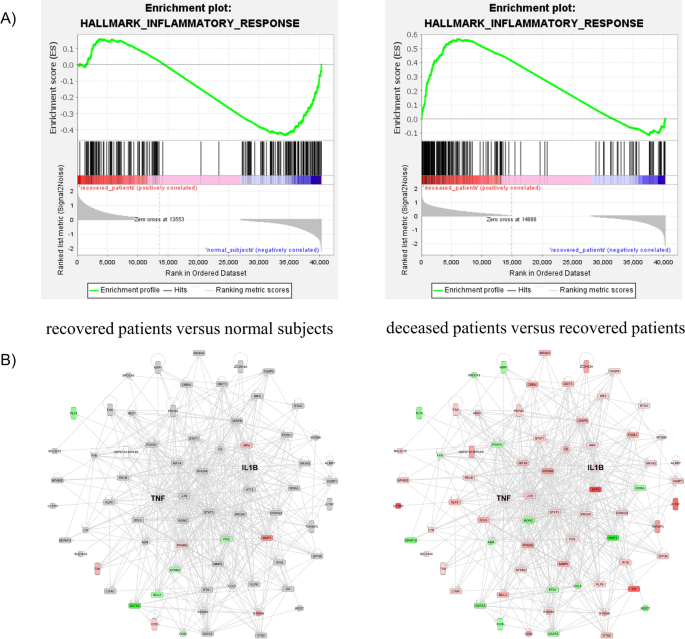
进行氧化石墨烯富集试验以评估各组之间的DEP,目的是确定SFTS患者中存在的生物学过程。各组中排名前8位的生物过程如图所示。3..在正常受试者和康复患者之间的比较中,我们发现免疫调节相关蛋白是排名较高的生物过程(图2)。3.A).传统医学智慧表明,在SFTSV感染期间,宿主的免疫系统会做出反应,从而导致随后的康复。然而,在本研究中,比较康复患者和死亡患者的氧化石墨烯富集试验结果显示,在死亡患者中,中性粒细胞激活相关过程的发生率要高得多(图。3.B和附加文件1:表S1)。SFTS患者的白细胞(WBC)计数低于正常范围。然而,在康复患者和死亡患者之间,WBC计数没有统计学上的显著差异1).然而,与康复患者相比,死亡患者中所有参与中性粒细胞激活相关过程(即中性粒细胞激活、中性粒细胞脱颗粒和中性粒细胞介导免疫)的蛋白质都过表达。中性粒细胞被认为是入侵感染性病原体的第一个免疫应答者[23].然而,中性粒细胞的长期激活会损害宿主细胞,因此已知对患者有害[24].中性粒细胞中表达的细胞因子具有与免疫反应和炎症相关的各种活性[25].因此,本研究使用IPA上游调控分析进行血清蛋白质组学分析,证实存在受细胞因子影响的蛋白质。我们的结果表明,TNF-α和白细胞介素1β (IL-1β)是SFTS患者中最重要的上游调节因子。TNF-α是诱导中性粒细胞活化的必要细胞因子之一,IL-1β是中性粒细胞分泌的主要促炎细胞因子[26].因此,我们在本研究中证实了TNF-α和IL-1β的表达。虽然在蛋白质组学分析中未检测到TNF-α和IL-1β,但已有报道称TNF-α和IL-1β在SFTS患者中被诱导[8].此外,我们研究中的蛋白质组学结果证实了下游靶蛋白TNF-α和IL-1β在患者组之间的表达变化(图2)。4和附加文件1:表S1)。在这些蛋白中,S100A8和S100A9在SFTS患者中显著过表达,载脂蛋白A-I和载脂蛋白E在SFTS患者中显著下调2).S100A8和S100A9在中性粒细胞和单核细胞中表达,在刺激白细胞募集、诱导细胞因子分泌、调节炎症过程等方面发挥重要作用。与康复患者相比,死亡患者中S100A8和S100A9过表达程度更高,说明死亡患者炎症过程更活跃。相反,APOA1及其具有抗炎功能的调节蛋白APOE的表达在死亡患者中降低(表2)2) [27].大多数其他下游靶蛋白在康复患者的蛋白表达水平与正常人相比没有明显差异(图2)。4然而,TNF和IL-1β调节的蛋白表达水平在死亡患者中更高(图1)。4B和附加文件1:表S1)。这些结果表明,在死亡患者中,中性粒细胞的激活过度激活了炎症过程。
最近,李等人。12]报道了SFTS患者的转录组学研究结果。我们使用原始转录组数据进行基因集富集分析,发现炎症反应基因在死亡患者中表现出更高的激活(图2)。5A). TNF-α和IL-1β下游靶点基因网络分析显示,相关基因在死亡患者中显著过表达。这些结果与我们的蛋白质组学发现相关联(图。5B)。
结论
SFTSV是最近在东亚报道的一种新型静脉病毒[1].关于SFTS/SFTSV的病毒生命周期、感染机制和致病性的许多方面仍然未知。在本研究中,我们对SFTS患者进行血清蛋白质组学研究,并对其进行比较分析,以确定蛋白质组学水平上的宿主反应。样本量小是本研究的局限性。我们使用公共数据库确认了SFTS患者血清RNA-Seq的蛋白质组学结果,以克服这一限制。然而,需要进一步的研究来证实在更大样本的SFTS患者中蛋白质表达的变化。尽管存在这种局限性,但该研究揭示了血清蛋白质组学变化与SFTS临床表现之间的联系。除aPTT和肝功能外,死亡患者和康复患者的临床症状无明显差异(表2)1).此外,死亡患者的精神状态比康复患者更倾向于嗜睡。然而,SFTS患者的血清样本是在症状出现后的相似时间收集的(附加文件)2:图S1)。虽然有一些偏差,但三名死亡患者中有两名患者的样本是在症状出现后1天和2天采集的,而其余1名患者的样本是在症状出现后10天采集的。康复患者的样本是在症状出现后2-8天获得的。因此,死亡患者的样本采集时间为SFTS症状加重前。SFTS患者的血清蛋白质组学研究显示,死亡患者先天免疫反应存在问题,包括补体系统以及中性粒细胞活化时间延长,更有可能由于凝血系统功能障碍而发展为进行性DIC。此外,在致命的SFTS病例中,TNF-α和IL-1β下游靶标的炎症蛋白被发现过表达。此前有报道在SFTS患者的血清样本中进行转录组学和细胞因子检测。然而,据我们所知,此前没有关于SFTS患者血清蛋白质组学研究的报道。因此,这些发现为了解SFTS的临床表现提供了有用的信息。
数据和材料的可用性
本研究中产生的所有数据都包含在这篇发表的文章中。已鉴定蛋白质的总列表已作为附加文件上传。质谱蛋白质组学数据已存入ProteomeXchange Consortium(数据集标识符:PXD033989)。
缩写
- aPTT:
-
活化部分凝血活酶时间
- ALT:
-
丙氨酸转氨酶
- AST:
-
天冬氨酸转氨酶
- 度:
-
差异表达基因
- 部:
-
差异表达蛋白
- 迪拜国际资本:
-
弥散性血管内凝血
- 地理:
-
基因综合表达
- hs-CRP:
-
高敏c反应蛋白
- 干扰素:
-
干扰素
- il - 1ß:
-
白介素1ß
- il - 6:
-
白介素- 6
- il - 10:
-
白介素10
- 异丙醇:
-
匠心路径分析
- IRB:
-
机构检讨委员会
- 质/女士:
-
液相色谱串联质谱
- LD:
-
L-lactate脱氢酶
- LDH:
-
乳酸脱氢酶
- 女士:
-
质谱分析
- 女士/小姐:
-
串联质谱法
- NCBI:
-
国家生物技术信息中心
- PMBCs:
-
外周血单个核细胞
- rt - pcr:
-
逆转录聚合酶链反应
- sds - page:
-
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
- sft:
-
伴有血小板减少综合征的高烧
- SFTSV:
-
伴有血小板减少综合征病毒的高烧
- SRA:
-
排序读归档
- 肿瘤坏死因子:
-
肿瘤坏死因子
参考文献
于晓军,梁文敏,张淑云,刘勇,李建德,孙玉良,张磊,张庆峰,Popov VL,李超,等。中国与一种新型布尼亚病毒相关的发热伴血小板减少症。中华实用医学杂志,2011;29(4):344 - 344。
詹娟,王强,程杰,胡斌,李娟,詹峰,宋勇,郭东。中国发热伴血小板减少综合征的现状。中国病毒学杂志,2017;32(1):51-62。
Baba M,富山M, Sakakibara N,冈本M, Arima N, Saijo M.发热伴血小板减少综合征病毒抑制剂抗病毒检测体系的建立和鉴定。红伞化学,2017;25(3):83-9。
传染病门户。https://www.kdca.go.kr/npt/biz/npp/ist/simple/simplePdStatsMain.do?icdCd=NC0025&icdgrpCd=03&icdSubgrpCd.2022年5月5日
刘强,何斌,黄淑云,魏峰,朱晓强。发热伴血小板减少综合征,一种新出现的蜱传人畜共患病。《柳叶刀》感染杂志2014;14(8):763-72。
崔宁,刘荣,卢庆宝,王丽丽,秦世林,杨志东,庄林,刘凯,李华,张兴安,等。发热伴血小板减少综合征布尼亚病毒相关人类脑炎。中华感染杂志,2015;30(1):52-9。
张玉珍,何耀文,戴亚,熊勇,郑辉,周德杰,李娟,孙强,罗晓玲,程玉玲,等。中国一种新型布尼亚病毒引起的出血热:发病机制及致命结局的相关性。中华流行病学杂志,2012;54(4):527-33。
邓波,张松,耿勇,张勇,王勇,姚伟,文勇,崔伟,周勇,顾强,等。发热伴血小板减少综合征病毒患者的细胞因子和趋化因子水平PLoS ONE。7 (7): 2012; e41365。
刘敏敏,雷晓霞,于慧,张建忠,于新军。细胞因子水平与发热伴血小板减少综合征严重程度的相关性。中国病毒学杂志,2017;14(1):6。
朴世杰,金毅,朴A,权喜,金娥娥,司玉杰,宋ms,李忠,郑凯,申文杰,等。发热伴血小板减少综合征雪貂动物模型人致死性静脉病毒感染及发病机制。中国微生物学杂志,2019;4(3):438-46。
张丽龙,王波,辛强,尚伟,沈松,肖刚,邓峰,王宏,胡志,王敏。热伴血小板减少综合征病毒感染的展开蛋白反应的定量蛋白质组学分析中国病毒学杂志,2019;93(10):e00308。
李松,李华,张玉玲,辛清良,关志强,陈旭,张兴安,李小科,肖广峰,Lozach PY,等。SFTSV感染诱导BAK/ bax依赖的线粒体DNA释放,触发NLRP3炎症小体激活。Cell rep 2020;30(13):4370-4385 e4377。
Park A, Park SJ, Jung KL, Kim SM, Kim EH, Kim YI, Foo SS, Kim S, Kim SG, Yu KM,等。发热伴血小板减少综合征患者炎症特征和b细胞功能的分子特征mBio。2021; 12 (1): e02583。
朴智贤,李世善,尹硕,崔长武,李浩,宋宏,俊生,金高生,李cs,金思。恙虫病感染的临床蛋白质组学分析。临床蛋白质组学。2018;15:6。
Love MI, Huber W, Anders S.用DESeq2调节RNA-seq数据的折叠变化和分散估计。中国生物医学工程学报。2014;15(12):550。
Kuleshov MV, Jones MR, Rouillard AD, Fernandez NF, Duan Q, Wang Z, Koplev S, Jenkins SL, Jagodnik KM, Lachmann A,等。enrichment:一个全面的基因集富集分析web服务器2016年更新。核酸研究,2016;44(W1):W90-97。
杨晓东,张晓明,张晓明,等。基于质谱的蛋白质组学研究。Nat Protoc 2016;11(12): 2301-19。
Tyanova S, Temu T, Sinitcyn P, Carlson A, Hein MY, Geiger T, Mann M, Cox J.用于蛋白质组学数据综合分析的Perseus计算平台。Nat Methods. 2016;13(9): 731-40。
王晓明,李志强,王晓明,等。病毒互补逃避策略研究进展。前沿微生物,2017;8:1117。
宿主防御中的凝血系统。中华外科杂志,2018;2(3):549-57。
Dahlback B, Villoutreix BO。通过蛋白C抗凝途径调节血液凝固:结构-功能关系和分子识别的新见解。中华动脉血栓与血管杂志,2005;25(7):1311-20。
Northup PG, Sundaram V, Fallon MB, Reddy KR, Balogun RA, Sanyal AJ, Anstee QM, Hoffman MR, Ikura Y, Caldwell SH,等。肝脏疾病中的高凝和血栓形成。中华血液学杂志,2008;6(1):2-9。
Fine N, Tasevski N, McCulloch CA, Tenenbaum HC, Glogauer M.中性粒细胞:恒定的防御者和第一反应者。免疫前沿杂志2020;11:571085。
中性粒细胞在组织损伤与修复中的作用。中国生物医学工程学报,2018;36(3):331 - 9。
Tecchio C, Micheletti A, Cassatella MA。中性粒细胞来源的细胞因子:无法表达的事实。前沿免疫。2014;5:508。
Mantovani A, Cassatella MA, Costantini C, Jaillon S.中性粒细胞在先天和适应性免疫的激活和调节。免疫学杂志,2011;11(8):519-31。
Getz GS, Reardon CA.载脂蛋白E, A-I和SAA在与动脉粥样硬化发生相关的巨噬细胞病理生物学中。《前线药典》2019;10:536。
资金
这项工作由韩国健康产业发展研究院(KHIDI)支持的韩国健康技术研发项目,由韩国卫生福利部(批准号:KHIDI)资助。HI20C0033),由韩国科学与信息通信技术部(Ministry of Science and ICT)资助的国家科学技术研究理事会(NST)(批准号:HI20C0033)。CRC22021-100),以及韩国政府(MSIT)资助的韩国国家研究基金会(NRF)资助(资助号:2020R1C1C1009941)。
作者信息
作者及隶属关系
贡献
概念化、SIK和CSL;方法,西尔维;软件:SYL、HL、YGL;形式分析,SHY, HL, YGL, GS;调查、ECP、NHK、YGL、SYL;资源,共青团;数据管理、SYL和HL;写作-初稿准备,SYL和SIK;《SYL》、《CSL》、《SIK》;西尔维可视化; supervision, SIK and CSL; project administration, SIK; funding acquisition, SYL and SIK. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准并同意参与
根据全北国立大学医院机构审查委员会(IRB)批准的注册方案采集受试者血清样本,所有患者提供书面知情同意(IRB注册号2019-06-020)。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
发热伴血小板减少综合征(SFTS)患者血清蛋白质组学分析结果
附加文件2:图S1。
SFTS患者的住院时间。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
李,SY。,Yun, S.H., Lee, H.et al。发热伴血小板减少综合征患者血清蛋白质组学研究。中国Proteom19, 32(2022)。https://doi.org/10.1186/s12014-022-09368-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12014-022-09368-8
关键字
- sft
- SFTSV
- 质/女士
- 血清蛋白质组学