摘要
背景
急性移植物抗宿主病(aGVHD)是异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allogeneic hsct)的一种危及生命的并发症。越来越多的证据表明,Treg/Th17比例不平衡加速了aGVHD的进展。芳基烃受体(AhR)是一种基本的螺旋-环-螺旋转录因子,通过同源配体结合激活。目前的证据支持AhR在Treg和Th17细胞的分化中起着关键的调节作用。然而,AhR和aGVHD之间的关系尚不清楚。
结果
我们的结果显示,AhR在CD4细胞中的表达显著下调+aGVHD患者的T细胞与非aGVHD组比较。我们还发现在激活AhR后CD4细胞缺乏+T细胞、活化标志物cd40l、CD134、CD137的表达水平及细胞增殖活性均显著高于表达ahr的CD4+T细胞。恢复aGVHD CD4细胞中AhR的表达+T细胞导致treg和相关基因转录物的百分比显著增加,包括Foxp3, IL-10和CD39。相比之下,Th17细胞数量和相关基因(包括RORγt、IL-17A和IL-17F)的转录显著降低。我们证实CTCF招募EP300和TET2结合到AhR启动子区域,并通过介导该区域组蛋白H3K9/K14的高乙酰化和DNA去甲基化促进AhR的表达。CTCF低表达导致AhR启动子组蛋白低乙酰化和DNA高甲基化,导致aGVHD CD4表达不足+T细胞。
结论
CTCF是AhR转录的重要诱导因子。CTCF表达不足导致AhR过度下调,导致CD4大量增加+T细胞活化和Th17/Treg比值增加,从而介导aGVHD的发生。
简介
虽然异基因造血干细胞移植(异基因造血干细胞移植)被认为是造血恶性肿瘤的唯一治疗方法,但急性移植物抗宿主病(aGVHD)是异基因造血干细胞移植后非复发性死亡的主要原因[1,2,3.].aGVHD是一个复杂的炎症过程,其中免疫反应是由同种异体供体T淋巴细胞识别宿主同种异体抗原触发的。激活后,异源反应供体T细胞迁移到目标器官,主要是皮肤、肺、肝脏和胃肠道,在那里它们引起aGVHD特有的组织损伤[4,5,6].因此,控制T淋巴细胞的过度激活是防治aGVHD的关键。
CD4细胞比例不平衡+T细胞亚型Treg和Th17细胞(Treg/Th17)加速aGVHD的进展[7,8,9].treg抑制多种T细胞相关炎症疾病并缓解GVHD而不削弱移植物抗白血病作用[10,11].临床研究表明,与无aGVHD患者和健康供体相比,重度和轻度aGVHD患者Treg率和Foxp3表达明显降低[12,13].Th17细胞与aGVHD的病理生理相关,并显著影响疾病的严重程度[14,15].重度和轻度aGVHD患者的Th17细胞率和RORγt表达明显高于无aGVHD患者和健康供体[12].因此,探索Treg/Th17失衡的分子机制是分析aGVHD发病机制、制定适当治疗方案的关键。
芳基烃受体(AhR)是一种基本的螺旋-环-螺旋转录因子,通过同源配体结合激活。它位于细胞的细胞质中,是一种含有大量蛋白质的非活性复合物。在配体结合后,AhR易位到细胞核并发生构象变化,招募辅激活子或辅抑制子与目标基因的启动子结合并调节其表达[16,17].目前的证据显示AhR在免疫系统调节中起着关键作用[18,19],特别是Treg和Th17细胞的分化[20.,21,22,23].AhR被2,3,7,8-四氯二苯并-对二恶英(TCDD)、(1 ' h -吲哚-3 ' -羰基)-噻唑-4-羧酸甲酯(ITE)、Kynurenine (Kyn)或Laquinimod代谢产物激活会增加Foxp3+Treg细胞通过不同的机制,包括直接转激活和诱导控制Foxp3转录的表观遗传修饰[23,24,25,26,27].另一方面,6-Formylindolo [3,2-b]咔唑(FICZ)激活AhR可通过诱导RORC表达促进Th17细胞分化[28].这些AhR激活后的不同结果被解释为反映配体对CD4的内在作用+T细胞分化,尽管没有明确的解释这种差异的报道。
AhR已被证实可抑制agvhd相关炎症因子如IL-1β、IL-6和NLRP3的表达[29,30.].据报道,TCDD可诱导CD4细胞的调节功能+T细胞以ahr依赖机制抑制小鼠aGVHD [31].此外,研究发现接受AhR的受体小鼠-/-在两种不同的小鼠异基因骨髓移植模型中,T细胞提高了生存率并降低了aGVHD [32].因此,AhR与aGVHD的关系尚不清楚,AhR在人aGVHD CD4细胞中的表达状况也不清楚+T细胞也不清楚。
在本研究中,我们证实了AhR在CD4中被下调+aGVHD患者与非aGVHD患者的T细胞。探讨CD4细胞中AhR下调的分子机制+在aGVHD的T细胞中,我们使用生物信息学方法发现AhR启动子区域包含多个CCCTC结合因子(CTCF)结合位点,以及多个CpG岛。有报道称CTCF与靶基因结合导致被占领区域DNA去甲基化,但具体机制尚不清楚[33].蛋白-蛋白相互作用分析表明,CTCF可与TET2、EP300相互作用。
TET2是10 - 11易位(TET)家族成员,可将5-甲基胞嘧啶(5mC)氧化为5-羟甲基胞嘧啶(5hmc),从而促进DNA去甲基化[34].E1A结合蛋白p300 (EP300)是一种组蛋白乙酰转移酶,通过染色质重塑调节转录,在细胞增殖和分化过程中起重要作用[35].组蛋白H3 Lys 9 (H3K9)和H3K14是EP300修饰的常见乙酰化位点,被认为是激活基因转录的标志[36,37].我们前期的研究证实CTCF在CD4细胞中表达减少+aGVHD患者与非aGVHD患者的T细胞比较[38].因此,我们推测CTCF低表达可能减少了TET2与EP300在AhR启动子上的相互作用,导致AhR启动子DNA高甲基化和组蛋白H3K9/K14低乙酰化,导致AhR表达不足。
结果
AhR在CD4中降低+来自aGVHD患者的T细胞
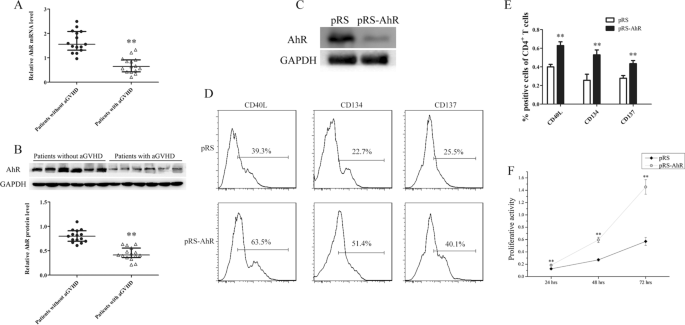
研究AhR在CD4细胞中的异常表达+GVHD患者T细胞CD4中AhR的表达水平+检测来自aGVHD和非aGVHD患者的T细胞。Real-time PCR和Western blot结果显示,CD4细胞中AhR的表达明显下调+aGVHD患者的T细胞与非aGVHD组比较(图2)。1A、B)。
AhR在CD4细胞中的表达+来自aGVHD患者和非aGVHD患者的T细胞。一个CD4细胞中AhR的相对mRNA水平+aGVHD患者的T细胞(n= 15)及非agvhd个案(n= 15),归一化为GAPDH。BCD4中AhR蛋白表达的代表性Western blot结果+T细胞来自aGVHD患者和非aGVHD患者(上)。GAPDH归一化AhR蛋白水平条带强度的定量分析(下)(aGVHD患者:n= 15,无aGVHD患者:n= 15)。C具有代表性的Western blot显示正常CD4细胞中AhR蛋白水平+转染AhR干扰质粒(pRS-AhR)或阴性对照质粒(pRS)的T细胞。D转染后的细胞用AhR激动剂ITE培养,并用Dynabeads T细胞扩张剂刺激。采用流式细胞术检测不同转染组T细胞活化标志物(CD40L、CD134、CD137)的表达水平。E流式细胞术数据的统计分析。F正常的CD4+用pr - ahr或pRS质粒转染T细胞,并在IL2抗cd3 /抗cd28抗体存在的情况下用ITE处理。CCK8检测细胞增殖情况。数据代表三个独立实验的均值(**P< 0.01)
探讨AhR表达降低对CD4的影响+T细胞活化后,我们将AhR干扰质粒(pRS-AhR)或阴性对照质粒(pRS)转染到CD4细胞中+来自健康捐献者的T细胞。转染后的细胞用AhR激动剂ITE培养,然后用Dynabeads T细胞扩张剂(TCR刺激)刺激。Western blot结果显示,与pRS组相比,rs -AhR组的AhR表达明显降低(图。1C).采用流式细胞术检测不同转染组T细胞活化标志物(CD40L、CD134、CD137)的表达水平;与pRS组相比,pRS- ahr组CD40L、CD134、CD137的表达水平明显升高(图。1d e)。此外,观察AhR下调对CD4的影响+T细胞增殖,CD4正常+分别用pRS- ahr和pRS质粒转染T细胞,并在含有IL2的抗cd3 /抗cd28抗体的情况下给予ITE。CCK8检测结果显示,转染pRS- ahr的细胞增殖明显高于转染pRS组(图2)。1F).这些结果表明,AhR下调可能是aGVHD CD4过度激活和增殖的重要原因+T细胞。
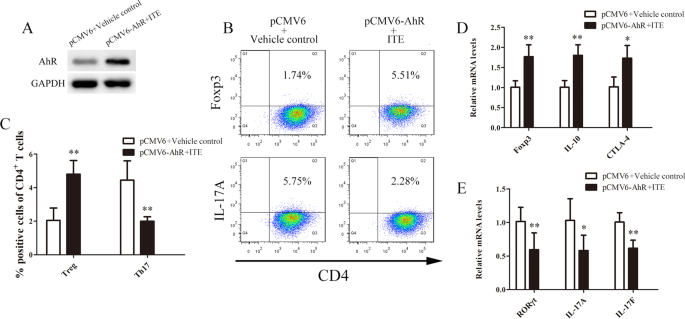
恢复aGVHD CD4中AhR的表达+T细胞增加Treg细胞数量,降低Th17细胞水平
评价恢复CD4细胞中AhR表达的效果+从aGVHD患者的Tregs和Th17细胞上提取AhR表达质粒(pCMV6-AhR)或对照质粒(pCMV6)转染到aGVHD CD4细胞上+T细胞。AhR表达组用ITE处理,pCMV6转染组用载体对照。流式细胞术显示treg在CD4细胞中的百分比+与转染对照组+载体对照组相比,AhR + ITE治疗组的T细胞表达显著升高(图.2a - c)。相比之下,AhR表达+ ITE处理组Th17细胞比例明显低于转染对照组+载体对照组(图.2a - c)。此外,我们还通过real-time PCR分析了Tregs和Th17细胞相关基因的表达水平。AhR表达和ITE处理导致treg相关基因转录物显著上调,包括Foxp3、IL-10和CTLA-4(图2)。2D)。相反,AhR表达和ITE处理降低了th17相关基因转录物的表达,包括rar γt, IL-17A和IL-17F(图。2E).总的来说,这些结果表明在aGVHD CD4中恢复AhR的表达+T细胞可以纠正Treg/Th17细胞失衡。
CTCF不足会下调CD4细胞的AhR+来自aGVHD患者的T细胞
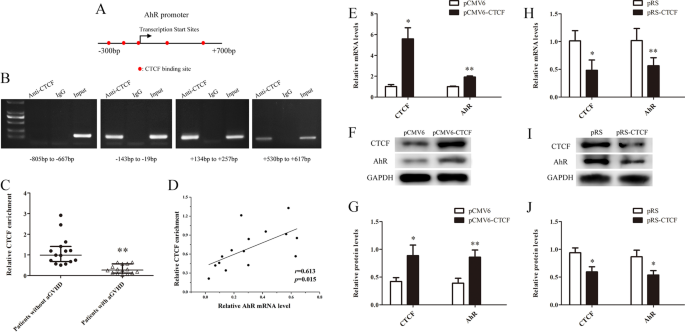
探讨CD4细胞中AhR下调的分子机制+aGVHD患者的T细胞,我们用在线软件分析AhR启动子(http://jaspar.binf.ku.dk/),发现−204 bp至+ 611 bp区域包含多个CTCF结合位点(图2)。3.A).在CTCF过表达的Jurkat细胞中,利用ChIP-PCR分析CTCF是否能与AhR启动子相互作用。采用覆盖AhR启动子(−805 ~ + 617 bp)区域的4对real-time PCR引物进行检测。如图所示。3.B, ChIP-PCR证实CTCF结合在AhR启动子的- 204 ~ + 611 bp区域。
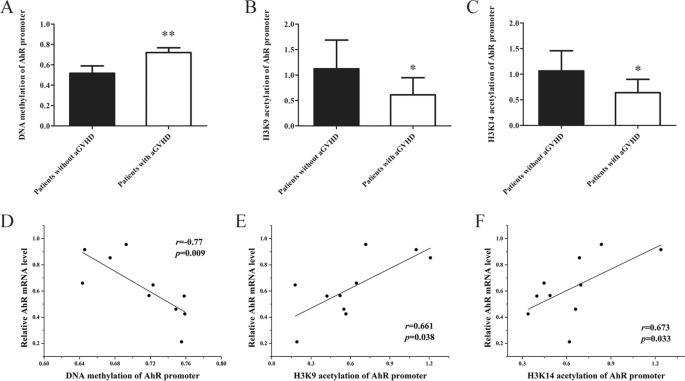
CTCF不足会降低aGVHD CD4中的AhR+T细胞。一个AhR启动子区CTCF结合位点示意图。BChIP-PCR显示CTCF结合在AhR启动子区域(- 204 bp至+ 611 bp)。C从CD4提取的染色质片段中AhR启动子中CTCF富集的ChIP-qPCR分析+aGVHD患者的T细胞(n= 15)和非agvhd组(n= 15)。数据是相对于从未经处理的染色质制备的输入DNA。DaGVHD CD4细胞中CTCF富集与AhR mRNA水平的相关性+T细胞(n= 15)。E- - - - - -GaGVHD CD4细胞中CTCF和AhR的表达水平+CTCF表达后的T细胞(n= 3)。E相对mRNA水平。F代表性的Western blot结果。G波段强度的定量分析。数据代表三个独立实验的均值。H- - - - - -J正常CD4细胞中CTCF和AhR的表达水平+CTCF沉默后的T细胞(n= 3)。H相对mRNA水平。我代表性的Western blot结果。J波段强度的定量分析。数据代表三个独立实验的均值(*P< 0.05, **P< 0.01)
我们之前的研究证实了CTCF在CD4细胞中的表达减少+aGVHD患者与非aGVHD患者的T细胞比较[38].进一步探讨CTCF在CD4细胞AhR启动子区的结合水平+从aGVHD患者的T细胞中,我们评估了CD4中AhR启动子区CTCF的结合水平+利用抗ctcf抗体ChIP-qPCR检测aGVHD和非aGVHD患者的T细胞。如图所示。3.C, aGVHD患者与非aGVHD患者相比,CTCF与AhR启动子的结合减少。相关分析表明,CTCF结合与CD4细胞中AhR表达呈明显正相关+来自aGVHD患者的T细胞(图;3.D)。
为了进一步证实CTCF对AhR表达的促进作用,我们将CTCF表达质粒(pCMV6-CTCF)或对照质粒(pCMV6)转染到aGVHD CD4细胞中+T细胞转染CTCF干扰质粒(pRS-CTCF)或阴性对照质粒(pRS)到正常CD4细胞+T细胞。Real-time PCR和Western blot结果显示,aGVHD CD4细胞中AhR显著上调+CTCF表达后的T细胞(图.3.E-G), AhR在正常CD4细胞中显著下调+CTCF沉默后的T细胞(图.3.H-J)。上述结果提示CTCF是诱导AhR表达的重要转录因子,CTCF表达降低可能是aGVHD CD4中AhR下调的主要原因之一+T细胞。
CTCF招募TET2和EP300与AhR启动子区域相互作用
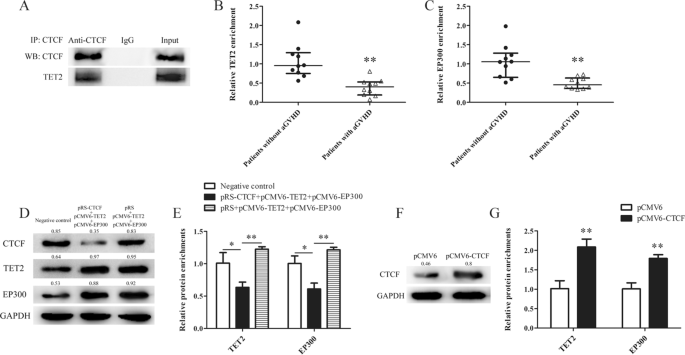
为了进一步揭示CTCF促进AhR表达的分子机制,hTFtarget数据库(http://bioinfo.life.hust.edu.cn/hTFtarget#!/)预测可能与CTCF共同调节AhR表达的调控因子。TET2和EP300,甲基胞嘧啶双加氧酶和组蛋白乙酰化酶分别预测与CTCF相互作用。我们之前的研究证实了CTCF在CD4中的作用+T细胞可以与EP300结合;所以在这里我们只评估了CTCF与TET2的相互作用[38].首先,将CTCF和TET2表达质粒转染Jurkat细胞,采用免疫共沉淀法检测CTCF是否能与TET2形成复合物。如图所示。4A,免疫共沉淀证实TET2与CTCF共沉淀。通过ChIP-qPCR检测CD4细胞中AhR启动子区TET2和EP300的结合水平+来自aGVHD患者和非aGVHD患者的T细胞。如图所示.4B-C, aGVHD患者与对照组相比,TET2和EP300在AhR启动子上的结合水平降低。
CTCF招募TET2和EP300与AhR启动子区域相互作用。一个CTCF和TET2表达后,在Jurkat细胞中共免疫沉淀抗CTCF抗体,Western blot检测CTCF结合和TET2。B,CTET2富集水平的ChIP-qPCR分析(B)和EP300C在从CD4提取的染色质部分的AhR启动子中+aGVHD患者的T细胞(n= 10)和非agvhd组(n= 10)。结果是相对于输入DNA制备未经处理的染色质。D正常的CD4+将T细胞分为三组,分别转染对照pRS和pCMV6质粒或CTCF沉默质粒(pRS-CTCF)和TET2和EP300表达质粒(pCMV6-TET2和pCMV6-EP300),或pRS和pCMV6-TET2和pCMV6-EP300。Western blot检测CTCF、TET2、EP300蛋白水平。EChIP-qPCR分析AhR启动子TET2和EP300的富集水平。结果是相对于输入DNA制备未经处理的染色质。数据代表三个独立实验的均值。FaGVHD CD4+T细胞分为两组,分别转染对照pCMV6和CTCF表达质粒(pCMV6-CTCF)。Western blot检测CTCF蛋白水平。GChIP-qPCR分析AhR启动子TET2和EP300的富集水平。结果是相对于输入DNA制备未经处理的染色质。数据代表三个独立实验的均值(*P< 0.05, **P< 0.01)
为了证实CTCF在介导TET2和EP300与AhR启动子结合中的重要作用,分别将CTCF干扰质粒和阴性对照质粒共转染到正常CD4细胞中+转染TET2和EP300表达质粒(pCMV6-TET2和pCMV6-EP300)的T细胞,采用ChIP-qPCR方法评估TET2和EP300与AhR启动子的结合。在CTCF干扰TET2和EP300表达组中,TET2和EP300在AhR启动子区域的结合水平明显低于打乱对照TET2和EP300表达组和阴性对照组(图.4d e)。此外,我们将CTCF表达质粒(pCMV6-CTCF)或对照质粒(pCMV6)转染到aGVHD CD4中+T细胞。如图所示.4aGVHD CD4细胞中AhR启动子区F-G、TET2和EP300结合水平明显升高+CTCF表达后的T细胞。这些结果表明CTCF是促进TET2和EP300与CD4中AhR启动子结合的重要转录因子+T细胞。TET2和EP300在AhR启动子中的结合减少与aGVHD CD4中CTCF表达不足有关+T细胞。
CD4中AhR启动子的DNA高甲基化和组蛋白H3K9/14低乙酰化+来自aGVHD患者的T细胞
TET2和EP300分别是介导DNA去甲基化和组蛋白H3K9/K14乙酰化的关键酶。确认TET2和EP300在AhR启动子中的结合减少是否会导致aGVHD CD4中的DNA高甲基化和组蛋白低乙酰化+在CD4的AhR启动子区,我们检测到DNA甲基化和组蛋白H3K9/K14乙酰化水平+有或没有aGVHD患者的T细胞。BSP显示CD4细胞中AhR启动子的DNA甲基化水平+aGVHD患者T细胞明显高于CD4细胞+来自非agvhd病例的T细胞(图;5A). ChIP-qPCR检测aGVHD CD4中AhR启动子组蛋白H3K9和K14乙酰化水平+T细胞明显低于对照组(图.5c)。此外,AhR启动子区DNA甲基化和组蛋白H3K9/K14乙酰化水平与AhR表达相关。结果表明,DNA甲基化与AhR表达呈负相关(图2)。5D), H3K9/K14ac与aGVHD CD4细胞中AhR的表达呈正相关+T细胞(图.5E-F)。
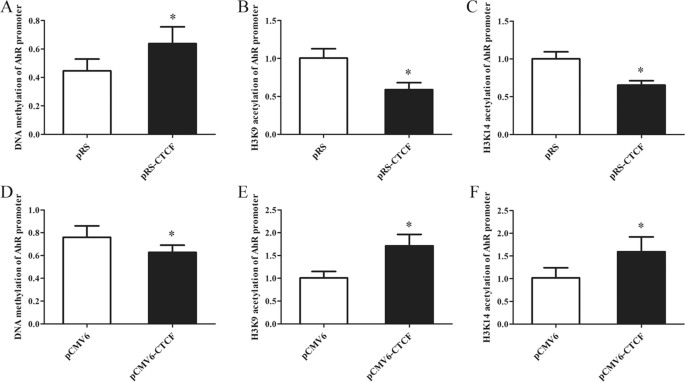
为了进一步证实CTCF对AhR启动子区DNA甲基化和组蛋白H3K9/H3K14乙酰化的影响,在正常CD4细胞中检测AhR启动子区DNA甲基化和组蛋白H3K9/H3K14乙酰化水平+T细胞转染CTCF干扰质粒,或aGVHD CD4+用CTCF表达质粒转染T细胞。在正常CD4细胞中,我们观察到AhR启动子区DNA甲基化增加,组蛋白H3K9/K14ac减少+CTCF沉默后的T细胞(图.6a - c)。相应的,aGVHD CD4细胞DNA甲基化减少,H3K9和K14ac显著上调+CTCF表达后的T细胞(图.6D-F)。综上所述,这些结果表明CTCF缺失是aGVHD CD4中AhR启动子DNA高甲基化和组蛋白H3K9/K14低乙酰化的重要因素+T细胞。
讨论
CD4+T细胞是重要的免疫效应细胞,其功能的改变会严重影响炎症反应和免疫耐受[39].最近,越来越多的实验和流行病学研究表明,AhR在免疫功能中起着重要作用,特别是在CD4领域+T细胞介导的炎症[17,21].
TCDD激活AhR促进Foxp3分化+体内及体外treg [21,27].分泌il -10的T调节类型1 (Tr1)细胞是CD4的一个重要子集+通过抑制抗原提呈细胞和抗原特异性效应T细胞的功能来控制过度炎症和自身免疫的T细胞[40].tcdd介导的AhR激活CD4+T细胞直接改变IL-10、CTLA4、CD39、GITR等基因的表达,促进CD4+T细胞分化为Tr1细胞[41,42,43,44].与TCDD增加treg相反,另一种高亲和力AhR配体FICZ已被报道在几种小鼠模型中增强Th17反应并加剧免疫介导疾病[21,45].这些看似矛盾的结果可能与AhR信号的激活强度有关。新的研究发现,低剂量的AhR配体(TCDD, FICZ)不会诱导treg,也不会改变异体反应,而是增加CD4的百分比+产生IL-17的T细胞。当给予高剂量时,TCDD和FICZ诱导Tr1细胞并增加Foxp3+treg与抑制异体反应[46].这些数据表明AhR对Treg和Th17的分化都有影响,但Treg可能对AhR信号的激活强度有更大的需求。Th17对AhR信号更为敏感,少量AhR激活可维持Th17分化。我们推测CD4细胞中AhR信号的衰减+T细胞对treg的分化有较大影响,导致Th17细胞占优势。
在本研究中,AhR在CD4细胞中的表达明显下调+aGVHD患者的T细胞与非aGVHD患者的T细胞进行比较。此外,我们的结果证实,激活AhR后CD4不足+T细胞、活化标志物cd40l、CD134、CD137的表达水平及细胞增殖活性均显著高于表达ahr的CD4+T细胞。研究表明,aGVHD患者血浆中AhR内源性配体明显减少,提示aGVHD患者AhR信号通路被抑制[47,48].这些结果表明,AhR的正常表达和激活是阻止CD4的重要因素+T细胞过度活化和增殖,这可能与AhR促进Treg细胞分化和功能有关。恢复aGVHD CD4细胞中AhR的表达+T细胞,充分激活它可以促进Tregs的分化,诱导功能基因的表达,抑制CD4的激活和增殖+T细胞。
CTCF是一种广泛表达的多功能转录因子,涉及许多关键的细胞过程,包括启动子激活和抑制、激素反应性基因沉默和基因组印迹。它从果蝇到小鼠和人类都是必需的,而且高度保守[49,50].值得注意的是,最近有研究表明CTCF可能与Th2细胞和Treg分化密切相关。ctcf缺陷CD4的Th2极化+T细胞被阻断,IL-4、IL-5、IL-13转录水平明显降低。此外,ctcf缺陷CD4的分化+T细胞转化为Tregs也受到抑制,Foxp3表达降低[51].CTCF与Oct-1合作,直接与IL-17位点相互作用,调控Th17细胞分化和IL-17的产生[52].这些研究表明CTCF参与增加treg和减少Th17细胞。
我们前期研究证实CTCF与EP300相互作用,直接与p53启动子区结合,通过上调该区域组蛋白H3K9/K14乙酰化水平促进p53表达。CTCF在CD4细胞中的低表达+aGVHD病例中的T细胞是导致p53启动子组蛋白H3K9/K14低乙酰化和p53下调的重要因素。恢复CD4细胞中CTCF的表达+aGVHD患者的T细胞增加p53数量并纠正Th17细胞/ treg的不平衡[38].在本研究中,我们证实CTCF是AhR转录的重要激活因子。它招募EP300和TET2结合到AhR启动子区域,通过介导该区域组蛋白H3K9/K14的高乙酰化和DNA去甲基化促进AhR的表达。CTCF低表达导致AhR启动子组蛋白低乙酰化和DNA高甲基化,导致aGVHD CD4表达不足+T细胞。
EP300是调节Foxp3乙酰化及其功能的几种乙酰转移酶之一。Foxp3中EP300的条件缺失或药理学抑制+Tregs增加T细胞受体诱导的Treg细胞凋亡,损害Tregs的抑制功能以及外周Treg细胞诱导[53,54].TET2是催化Foxp3基因treg特异性去甲基化区域(TSDR)去甲基化的关键因子。TET2介导TSDR去甲基化并激活Foxp3转录,驱动调节性T细胞分化。TET2缺失导致Foxp3高甲基化,损害Treg细胞分化和功能,以及自身免疫性疾病[55,56].由此可见,EP300和TET2通过上调Foxp3来促进Treg细胞的分化和功能维持。目前的研究结果为EP300和TET2调控Treg/Th17细胞比例平衡和参与免疫抑制的分子机制提供了新的见解。
结论
目前的数据强调了CTCF在维持AhR稳定表达中的关键作用。CTCF表达不足导致AhR表达过低,导致CD4过度活化+T细胞和Th17细胞/Treg比例失衡,从而介导aGVHD的发生。
材料与方法
主题
纳入2017 - 2021年湘雅医院造血干细胞移植中心收治的55例同种异体造血干细胞移植患者。所有受试者根据《赫尔辛基宣言》提供了签署的知情同意书。这项研究是根据涉及人体的生物医学研究国际伦理准则的建议进行的。研究方案经中南大学湘雅医学院人类伦理委员会批准。纳入患者的临床特征见表1.调理疗法是基于我们之前的研究[57].aGVHD是根据临床症状及普遍接受的标准评估的[58,59].我们分析了aGVHD发病患者的样本(n= 55)和来自无aGVHD患者的时间匹配样本(n= 55)。在aGVHD诊断后和开始治疗前尽快收集外周血样本。此外,我们还收集了正常的CD4细胞+从湘雅医院招募12名医务人员进行T细胞转染。
CD4细胞的分离、培养和转染+T细胞
采用Ficoll密度梯度法获得外周血单个核细胞。CD4+T细胞使用人CD4珠(Miltenyi, Bergisch Gladbach, Germany)从PBMCs中纯化,并在含有10%胎牛血清和1%青霉素/链霉素的RPMI 1640 (Thermo Fisher Scientific, MA, USA)中培养。分离的CD4+以2 × 10电转染T细胞6/样品。使用人T细胞核载体Kit和Amaxa核载体(Lonza, MD, USA)将基因表达(pCMV6)和干扰(pRS)质粒转染到CD4细胞+T细胞。简单地说,CD4+将T细胞与质粒混合在100 μl人T细胞核载体溶液中。在Amaxa核载体中使用核载体程序V-024对混合物进行电转染。转染细胞在RPMI 1640完全培养基中培养48 h。
ITE治疗,CD4激活和增殖+T细胞
(1 ' h -吲哚-3 ' -羰基)-噻唑-4-羧酸甲酯(ITE) (MedChemExpress, NJ, USA)溶解于DMSO中。CD4+将健康供体的T细胞分别转染pRS- ahr和pRS质粒,并用ITE (40 μM)刺激[60].然后用Dynabeads T细胞扩张剂(anti-CD3/CD28;Invitrogen, CA, USA) 3天。采用流式细胞术检测T细胞活化标志物CD40L、CD134、CD137的表达水平。此外,CD4+分别用pRS- ahr和pRS质粒转染T细胞,并用ITE处理;用Dynabeads T细胞扩张剂+ IL-2刺激细胞增殖。4天后,将细胞接种于96孔板中。然后,每个孔中加入10µL Cell Counting Kit-8 (CCK-8, MedChemExpress),并在37℃的5% CO中孵育1小时2孵化器。在450nm的微孔板阅读器上测量吸光度。
aGVHD之后是CD4+转染AhR表达的T细胞(pCMV6-AhR)或对照质粒(pCMV6),过表达AhR的细胞用ITE处理,对照细胞用载体对照(DMSO)处理。同时,用Dynabeads T细胞扩张剂刺激所有转染细胞3天。流式细胞术检测各组Treg、Th17细胞百分比。实时荧光定量PCR检测Treg (Foxp3、IL-10和CTLA-4)和Th17 (RORγt、IL-17A和IL-17F)细胞相关基因的表达水平。
流式细胞术和细胞内细胞因子染色
采用流式细胞术检测T细胞活化标志物CD40L、CD134、CD137的表达水平。简单地说,将活化的细胞悬浮在冰冷的FACS缓冲液(PBS-2% FBS)中,并与氟色素标记的单抗(包括抗cd40l - pe (eBiosciences, Thermo Fisher, 24-31)、抗cd134 - fitc (eBiosciences, ACT-35)和抗cd137 - apc (eBiosciences, 4- 1bb)在4℃下孵育20分钟。作为对照,细胞用同型对照单克隆抗体染色。然后将细胞在冰冷的FACS缓冲液中清洗,并使用Cell Quest软件(BD Biosciences, NJ, USA)在BD FACScan上进行分析。
treg细胞用抗cd4 - percp (eBiosciences, MEM-241)和抗foxp3 - pe单抗(eBiosciences, PCH101)检测,Th17细胞用抗cd4 - percp和抗il - 17a - fitc单抗(eBiosciences, eBio64DEC17)检测。简单地说,对于Tregs,活化的细胞首先用抗cd4 - percp单抗表面染色。然后,分别用4%多聚甲醛固定液和Perm/Wash缓冲液(BD Biosciences, NJ, USA)对细胞进行固定和渗透,进行细胞内染色。固定和渗透后,用抗foxp3 - pe染色,并在BD FACScan上分析。同时,Th17细胞在37℃、5% CO的组织培养箱中,加入50 nM PMA (Sigma Aldrich)和0.5 μg/ml ionomycin (Invitrogen, Thermo Fisher),加入5 g/ml brefeldin A (eBiosciences),孵育4 h2.然后用抗cd4 - percp单克隆抗体标记细胞,固定和渗透,并用抗il - 17a - fitc单克隆抗体染色。作为对照,细胞也用同型对照单克隆抗体染色。
RNA分离和实时PCR
TRIzol试剂(Invitrogen, CA, USA)用于从CD4中分离总RNA+T细胞。DNase处理后,用SuperScript II逆转录酶(Invitrogen)逆转录RNA,然后用荧光染料SYBR Green Master Mix (Thermo Fisher Scientific, MA, USA)用ABI Prism 7500 (Thermo Fisher Scientific)实时PCR扩增cDNA。以管家基因人甘油醛-3-磷酸脱氢酶(GAPDH)为内标进行样品归一化。数据分析由2−ΔΔCt方法;ΔΔCt = (Ct目标基因−Ct内部控制)样本−(Ct目标基因−Ct内部控制)控制.引物列于表中2.
免疫印迹
CD4+T细胞在含有蛋白酶抑制剂的低温裂解缓冲液中裂解(赛默飞世尔科学公司)。然后,裂解液在4˚C下,以12000 g离心15 min。用Bradford蛋白测定试剂盒(Bio-Rad, CA, USA)测定蛋白浓度。接下来,等量的蛋白质被8%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分解,然后电转移到聚偏二氟乙烯(PVDF)膜上(Bio-Rad, CA, USA)。37°C用5%牛奶在含有0.1% Tween-20的PBS中阻塞2小时后,在4°C下用一抗孵育过夜。一抗包括抗ahr、抗ctcf、抗tet2、抗ep300和抗gapdh (Cell Signaling Technology, MA, USA)。大量洗涤后,将膜与辣根过氧化物酶偶联二抗在室温下孵育2小时。使用Quantity One软件(Bio-Rad, CA, USA)评估免疫反应条带。
染色质免疫沉淀(ChIP)
根据制造商的说明,使用SimpleChIP®Plus Sonication Chromatin IP Kit(细胞信号技术)进行ChIP分析。简单地说,CD4+T细胞用1%甲醛室温固定10min。然后,在0.125 m时用甘氨酸停止交联。用冰冷的PBS清洗细胞两次,然后裂解。染色质被剪成500-1000个碱基对片段。接下来,将抗ctcf、抗tet2、抗ep300、抗h3k9ac、抗h3k14ac和对照兔IgG (Cell Signaling Technology)分别加入裂解液中孵育一夜。免疫复合物用蛋白A琼脂糖珠沉淀,100 μl含有0.5% SDS和200 μg/ml蛋白酶k的TE缓冲液洗涤洗脱,纯化后的DNA通过PCR或real-time PCR扩增目标片段。向前引物如下:1(787年805−−):5 ' CCCTTCACTCCCCCTACA 3 '和扭转1(667年685−−):5 'tgggcctgcaaataacat3”,提出2(143−121−):5 ' GCCCTCAAGGAAGACGGAATG3”和反向2(40−−19):5 ' ACCGGCTGAATAGCAGGAGCA3”,提出3 (+ 134 + 155):5 ' GCGGGAAGCACCCTGGATTTA”和反向3 (+ 236 + 257):5 ' TAGAATCCTGGCCTGGGTCGC”,提出4 (+ 530 + 552):5 ' CCGCAGTGGTCCCAGCCTACAC”和扭转4 (+ 598 + 617):5 ' TCATGGTGCCCAGCCGACG”。
Co-Immunoprecipitation
来自CD4的核蛋白+T细胞用NE-PER™核和细胞质提取试剂(赛默飞世尔科学公司)提取。然后,在核提取物中分别加入抗ctcf抗体和对照兔IgG,在4℃孵育过夜。蛋白A/G +琼脂糖珠(Millipore)加入到每个IP反应中,在4˚C旋转2小时。通过3000克离心2分钟收集琼脂糖珠。用SDS样品加载缓冲液从固体载体中洗脱结合蛋白。利用抗ctcf和抗tet2一抗进行Western blot分析。
基因组DNA提取和亚硫酸氢盐测序
从CD4细胞中分离基因组DNA+T细胞与TIANamp基因组DNA试剂盒(天根,北京,中国)。亚硫酸氢盐转化使用EpiTect Bisulfite Kit (Qiagen, CA, USA)进行。通过PCR扩增AhR启动子区域的两个CpG岛。然后,将PCR产物亚克隆到pGEM-T载体(Promega, WI, USA)。对每个扩增片段分别测序8个独立克隆。所用引物如下:5 ' -GGTGGGGTTTTTAAGGAAGA-3 '(正向1)和5 ' -AAACTCCCCAACCACTACCTC-3 '(反向1);5 ' - ggtatttttttttttaaggggt -3 ' (forward2)和5 ' -TACAAATAAACTACCTAAACCTAAC-3 ' (reverse2);
统计分析
采用SPSS 22.0软件进行统计。具有正态分布的连续变量用均值±标准差表示;非正态分布变量报告为具有四分位范围的中位数。正态分布连续变量采用独立样本进行比较t测试。非正态分布变量比较采用Mann-Whitney法U测试。相关性分析采用斯皮尔曼相关系数。统计学意义定义为P< 0.05。
数据和材料的可用性
支持本文结论的数据集包含在本文中。在研究过程中使用和分析的所有其他数据集均可根据合理要求从通讯作者处获得。
参考文献
Martin PJ, Rizzo JD, Wingard JR, Ballen K, Curtin PT, Cutler C, Litzow MR, Nieto Y, Savani BN, Schriber JR, Shaughnessy PJ, Wall DA, Carpenter PA。急性移植物抗宿主病的一线和二线全身治疗:美国血液和骨髓移植协会的建议。中国生物医学杂志2012;18:1150-63。
Wolff D, Ayuk F, Elmaagacli A, Bertz H, Lawitschka A, Schleuning M, Meyer RG, Gerbitz A, Hilgendorf I, Hildebrandt GC, Edinger M, Klein S, Halter J, Mousset S, Holler E, Greinix HT。当前诊断和治疗急性移植物抗宿主病的实践:来自德国-奥地利-瑞士造血干细胞移植中心的调查结果。《生物血液骨髓移植杂志》2013;19:767-76。
陈艳,徐颖,付刚,刘艳,彭娟,付斌,袁鑫,辛红,朱艳,何强,吴东,舒艳,李霞,赵霞,陈峰。急性白血病患者异基因造血干细胞移植。中国癌症杂志2013;25:39 - 39。
蔡泽R, Socie G, Blazar BR。急性移植物抗宿主病的发病机制:从肠道菌群改变到供体T细胞活化。中国生物医学杂志,2016;
Zitzer NC, Snyder K,孟X, Taylor PA, Efebera YA, Devine SM, Blazar BR, Garzon R, Ranganathan P. MicroRNA-155通过影响T细胞扩张迁移和效应功能调节急性移植物抗宿主病中华免疫杂志,2018;20:4170 - 9。
徐玉娟,李林,陈勇,付波,吴道生,李小玲,赵小玲,陈普平。HMGB1在aGVHD患者异基因造血干细胞移植后CD4(+) T细胞中STAT3表达调控中的作用clinin Immunol(奥兰多,佛罗里达州)。2015; 161:278 - 83。
韩玲,金华,周玲,张霞,范智,戴敏,林青,黄峰,宣玲,张宏,刘强。植入时肠道菌群通过Treg/Th17平衡影响异基因造血干细胞移植受者急性移植物抗宿主病。前沿免疫,2018;9:669。
Di Ianni M, Falzetti F, Carotti A, Terenzi A, Castellino F, Bonifacio E, Del Papa B, Zei T, Ostini RI, Cecchini D, Aloisi T, Perruccio K, Ruggeri L, Balucani C, Pierini A, Sportoletti P, Aristei C, Falini B, Reisner Y, Velardi A, Aversa F, Martelli MF。treg在hla -单倍同源移植中预防GVHD并促进免疫重建。血。2011;117:3921-8。
移植物抗宿主病和移植物排斥反应的新见解。《病理学年鉴》2018;13:19 19 - 45。
卢伦科EV, La Cava .自然调节性T细胞在自身免疫中的作用。自身免疫。2011;44:33-42。
金斯利CI,卡里姆M,布歇尔AR,伍德KJ。CD25+CD4+调节性T细胞预防移植物排斥反应:CTLA-4-和il -10依赖的免疫调节异体反应。中华免疫杂志2002;168:1080-6。
刘艳,蔡颖,戴玲,陈刚,马霞,王艳,徐涛,金松,吴霞,邱红,唐霞,李晨,孙安,吴东,刘慧。th17相关细胞因子在人急性移植物抗宿主病中的表达。《生物血液骨髓移植》2013;19:1421-9。
Fujioka T, Tamaki H, Ikegame K, Yoshihara S, Taniguchi K, Kaida K, Kato R, Inoue T, Nakata J, Ishii S, Soma T, Okada M, Ogawa H. hla错配异基因造血SCT后早期CD4(+)FOXP3(+)调节性T细胞频率预测急性GVHD的发生率。《骨髓移植杂志》2013;48:859-64。
Delens L, Ehx G, Somja J, Vrancken L, Belle L, Seidel, Grégoire C, Fransolet G, Ritacco C, Hannon M, Dubois S, Beguin Y, Baron F, Servais S.体外th17极化的人CD4(+) T细胞加剧异种移植物抗宿主病。《生物血液骨髓移植》2019;25:204-15。
Malard F, Gaugler B, Lamarthee B, Mohty M.靶向Th17轴在急性移植vs。宿主疾病。黏膜免疫杂志,2016;9:299-308。
Shinde R, Hezaveh K, Halaby MJ, Kloetgen A, Chakravarthy A, da Silva Medina T, Deol R, Manion KP, Baglaenko Y, Eldh M, Lamorte S, Wallace D, Chodisetti SB, Ravishankar B, Liu H, Chaudhary K, Munn DH, Tsirigos A, Madaio M, Gabrielsson S, Touma Z, Wither J, De Carvalho DD, McGaha TL.凋亡细胞诱导的AhR活性是小鼠和人免疫耐受和抑制系统性红斑狼疮所必需的。中华免疫杂志2018;19:571-82。
辛德,麦嘉哈。芳基烃受体:连接免疫与微环境。免疫学杂志2018;39:1005-20。
Stevens EA, Mezrich JD, Bradfield CA.芳基烃受体:免疫系统中潜在角色的视角。免疫学。2009;127:299 - 311。
Gutiérrez-Vázquez C,金塔纳FJ。芳基烃受体对免疫反应的调节。免疫力。2018;48:19-33。
王志刚,王志强,王志强,王志强,等。芳基烃受体对Th17介导的体外和体内反应的影响。PLoS ONE。2013; 8: e79819。
Quintana FJ, Basso AS, Iglesias AH, Korn T, Farez MF, Bettelli E, Caccamo M, Oukka M, Weiner HL。芳基烃受体对T(reg)和T(H)17细胞分化的控制。大自然。2008;453:65 - 71。
Abdulla OA, Neamah W, Sultan M, Chatterjee S, Singh N, Nagarkatti M, Nagarkatti P. AhR配体差异调节miRNA-132, miRNA-132靶向HMGB1并在延迟型超敏反应中控制treg和Th-17细胞的分化。前沿免疫杂志2021;12:635903。
Kerkvliet NI, Steppan LB, Vorachek W, Oda S, Farrer D, Wong CP, Pham D, Mourich DV。TCDD激活芳基烃受体可预防NOD小鼠糖尿病,并增加胰腺淋巴结中的Foxp3+ T细胞。免疫疗法。2009;1:539-47。
Goettel JA, Gandhi R, Kenison JE, Yeste A, Murugaiyan G, Sambanthamoorthy S, Griffith AE, Patel B, Shouval DS, Weiner HL, Snapper SB, Quintana FJ。AHR激活在人源化小鼠中对T细胞驱动的结肠炎具有保护作用。Cell rep 2016; 17:1318-29。
Kaye J, Piryatinsky V, Birnberg T, Hingaly T, Raymond E, Kashi R, Amit-Romach E, Caballero IS, Towfic F, Ator MA, Rubinstein E, Laifenfeld D, Orbach A, Shinar D, Marantz Y, Grossman I, Knappertz V, Hayden MR, Laufer R. Laquinimod通过激活芳香烃受体来阻止实验性自身免疫性脑脊髓炎。美国国家科学研究院。2016; 113: E6145-e6152。
Mezrich JD, Fechner JH, Zhang X, Johnson BP, Burlingham WJ, Bradfield CA.犬尿氨酸与芳基烃受体相互作用产生调节性T细胞。J Immunol(巴尔的摩,MD :1950)。1950, 185(2010): 3190 - 8。
Singh NP, Singh UP, Singh B, Price RL, Nagarkatti M, Nagarkatti PS.芳香烃受体(AhR)的激活导致FoxP3和IL-17表达的相互表观遗传调控和实验性结肠炎的改善。PLoS ONE。2011; 6: e23522。
de Araújo EF, Loures FV, Preite NW, Feriotti C, Galdino NA, Costa TA, Calich VLG。AhR配体调节先天淋巴样细胞和T辅助细胞亚群的分化,控制肺部真菌感染的严重程度。前沿免疫杂志2021;12:630938。
怀伟,赵睿,宋慧,赵娟,张玲,张玲,高成,韩玲,赵伟。芳基烃受体通过抑制NLRP3转录负调控NLRP3炎性小体活性。Nat Commun. 2014;5:4738。
Masuda K, Kimura A, Hanieh H, Nguyen NT, Nakahama T, Chinen I, Otoyo Y, Murotani T, Yamatodani A, Kishimoto T.芳基烃受体通过抑制巨噬细胞中组胺的产生负调控脂多糖诱导的IL-6的产生。国际免疫杂志2011;23:637-45。
罗尔曼D,彭杰S,彭宁顿J, Bradford S, Kerkvliet NI。TCDD对急性移植物抗宿主反应的抑制与CTLA-4-IFN-γ-IDO途径无关。中国生物医学工程学报,2013;
唐太斯TA,林KL,布鲁斯DW,蒙哥马利SA, Kolupaev OV, Bommiasamy H, Bixby LM, Woosley JT, McKinnon KP, Gonzalez FJ, Blazar BR, Vincent BG, Coghill JM, Serody JS。AhR的t细胞表达抑制急性GVHD胃肠道pT(reg)细胞的维持血。2017;130:348-59。
王海平,王志强,王志强,王志强,李志强,王志强。DNA甲基化在转录因子占用调节中的作用。Cell rep 2015; 12:1184-95。
丛斌,张强,曹霞。TET2在先天免疫和炎症中的作用及调控。中国生物医学工程学报。2021;12:165-73。
亨利·拉,郭YM,安德鲁斯AJ。CBP与p300乙酰化组蛋白H3和H3/H4特异性和选择性的差异。生物化学。2013;52:5746-59。
Gates LA, Shi J, Rohira AD, Feng Q, Zhu B, Bedford MT, Sagum CA, Jung SY, Qin J, Tsai MJ, Tsai SY, Li W, Foulds CE, O 'Malley BW。组蛋白H3赖氨酸9的乙酰化介导转录起始到延伸的转换。中国生物医学工程学报。2017;
Karmodiya K, Krebs AR, Oulad-Abdelghani M, Kimura H, Tora L. H3K9和H3K14乙酰化同时发生在许多基因调控元件中,而H3K14ac标记小鼠胚胎干细胞中非活性诱导启动子的子集。BMC基因组学。2012;13:424。
华杰,陈勇,付斌,陈鑫,徐新军,杨帅,陈超,徐玉军。CD4(+) T细胞CTCF不足导致p53下调是诱导急性移植物抗宿主病的重要因素。免疫前沿杂志2020;11:568637。
Yamane H, Paul WE。早期信号事件,基础的命运决定幼稚CD4(+) T细胞向不同的T辅助细胞亚群。免疫学杂志2013;252:12-23。
Roncarolo MG, Gregori S, Battaglia M, Bacchetta R, Fleischhauer K, Levings MK.啮齿动物和人类中白细胞介素10分泌型调节性T细胞。免疫Rev. 2006; 212:28-50。
Apetoh L, Quintana FJ, Pot C, Joller N, Xiao S, Kumar D, Burns EJ, Sherr DH, Weiner HL, Kuchroo VK。芳基烃受体与c-Maf相互作用,促进IL-27诱导的1型调节性T细胞分化。中华免疫杂志2010;11:854-61。
Ehrlich AK, Kerkvliet NI。快速代谢配体的慢性AhR激活对免疫介导疾病的治疗安全吗?《毒理学杂志》2017;2:72-8。
Ehrlich AK, Pennington JM, Tilton S, Wang X, Marshall NB, Rohlman D, Funatake C, Punj S, O 'Donnell E, Yu Z, Kolluri SK, Kerkvliet NI。AhR激活通过异反应性CD4(+) T细胞增加IL-2的产生,启动粘膜归巢Tim3(+) Lag3(+) Tr1细胞的分化。中华免疫杂志,2017;47:1989-2001。
Gandhi R, Kumar D, Burns EJ, Nadeau M, Dake B, Laroni A, Kozoriz D, Weiner HL, Quintana FJ。芳基烃受体的激活诱导人1型调节性T细胞样细胞和Foxp3(+)调节性T细胞。中华免疫杂志2010;11:846-53。
Singh NP, Singh UP, Rouse M, Zhang J, Chatterjee S, Nagarkatti PS, Nagarkatti M.饮食吲哚通过调节微rna诱导促炎Th17细胞向抗炎调节性T细胞转换来抑制迟发性超敏反应。J Immunol (Baltimore MD)。196(2016): 1108 - 1950; 22。
Ehrlich AK, Pennington JM, Bisson WH, Kolluri SK, Kerkvliet NI。TCDD、FICZ和其他高亲和力AhR配体剂量依赖性地决定CD4+ T细胞分化的命运。毒理学杂志,2018;161:310-20。
Michonneau D, Latis E, Curis E, Dubouchet L, Ramamoorthy S, Ingram B, de Latour RP, Robin M, de Fontbrune FS, Chevret S, Rogge L, Socié g人类急性移植物抗宿主病代谢组学分析揭示宿主和微生物源代谢产物的变化。Nat Commun. 2019;10:5695。
Kumari R, Palaniyandi S, Hildebrandt GC。代谢重编程——预防和治疗异基因造血干细胞移植后移植物抗宿主病的新时代已经开始。Front Pharmacol. 2020; 11:588449。
肖t, Wongtrakoongate P, Trainor C, Felsenfeld G. CTCF通过不寻常的CTCF结合位点将着丝点蛋白CENP-E招募到染色体的着丝点周围/着丝点区域。Cell代表2015;12:1704-14。
侯晨,赵海红,谷本凯,陈晓明。ctcf增强子阻断的研究进展。中国科学院学报(自然科学版),2008;
Ribeiro de Almeida C, Heath H, Krpic S, Dingjan GM, van Hamburg JP, Bergen I, van de Nobelen S, Sleutels F, Grosveld F, Galjart N, Hendriks RW。转录调节因子cctc结合因子在控制Th2细胞因子表达中的关键作用。J Immunol (Baltimore MD)。1950, 182(2009): 999 - 1010。
Kim LK, Esplugues E, Zorca CE, Parisi F, Kluger Y, Kim TH, Galjart NJ, Flavell RA。Oct-1通过与CTCF联合在T细胞中指导染色体间关联来调节IL-17的表达。Mol Cell, 2014; 54:56-66。
刘宇,王林,Predina J, Han R, Beier UH, Wang LC, Kapoor V, Bhatti TR, Akimova T, Singhal S, Brindle PK, Cole PA, Albelda SM, Hancock WW。抑制p300会损害Foxp3+T调节细胞功能,促进抗肿瘤免疫。2013; 19:1173-7。
杜涛,杨永井,肖燕,米格林,张华。溶酶体依赖的p300/FOXP3降解和限制Treg细胞功能并增强癌症靶向治疗。中华药理学杂志,2013;29(5):344 - 344。
杨蓉,曲超,周勇,Konkel JE,石松,刘勇,陈超,刘松,刘东,陈勇,Zandi E,陈伟,周勇,石森。硫化氢促进Tet1和tet2介导的Foxp3去甲基化驱动调节性T细胞分化并维持免疫稳态。免疫力。2015;43:251 - 63。
岳晓霞,李晓霞,李晓霞,饶毅。调节T细胞TET2和TET3缺失的效应因子功能。Nat Commun. 2019;10:2011。
徐玉娟,陈福平,陈勇,付斌,刘恩义,邹玲,刘丽霞。诱发急性移植物vs。造血干细胞移植后的-宿主病:CD4(+) T细胞缺乏sirtuin-1。前沿免疫。2018;9:3078。
Glucksberg H, Storb R, Fefer A, Buckner CD, Neiman PE, Clift RA, Lerner KG, Thomas ED.从hl -A匹配的兄弟姐妹捐赠者骨髓中移植抗宿主病的临床表现。移植。1974;18:295 - 304。
Przepiorka D, Weisdorf D, Martin P, Klingemann HG, Beatty P, Hows J, Thomas ED.急性移植物抗宿主病分级会议。骨髓移植。1994;15:825-8。
Abron JD, Singh NP, Mishra MK, Price RL, Nagarkatti M, Nagarkatti PS, Singh UP。内源性芳烃受体配体,ITE,诱导调节性T细胞和改善实验性结肠炎。美国医学杂志。2018;315:G220-g230。
确认
不适用。
资金
国家自然科学基金项目(No. 81974002)、中国科学院转化研究基金项目(No. 2021WWC02)资助。
作者信息
作者及隶属关系
贡献
CZ、TTC和YJX参与了实验的设计和计划。XM, YL和JH提供了样品。CZ、TTC、XM、XC、YL、SYW进行了实验室实验工作。CZ、TTC、XM、JH、XC和YJX参与了研究结果的报道和手稿的撰写。所有作者都对手稿进行了严格的修改,并最终批准了要提交的版本。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
相互竞争的利益
作者声明,这篇文章的发表不存在利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
曾志刚,郑志刚,曾志刚。,妈,X。et al。CD4中AhR的缺失+急性移植物抗宿主病患者中的T细胞可能与CTCF表达不足有关。中国Epigenet14, 109(2022)。https://doi.org/10.1186/s13148-022-01330-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13148-022-01330-7
关键字
- aGVHD
- AhR
- CTCF
- TET2
- EP300