摘要
丁酸是一种短链脂肪酸,来源于结肠中膳食纤维的微生物发酵。在过去的十年中,丁酸盐在肠道和肠外水平上的多种有益作用已被证明。丁酸盐的作用机制是不同的,其中许多涉及通过抑制组蛋白去乙酰化酶对基因表达的表观遗传调控。人们对丁酸盐越来越感兴趣,因为它对表观遗传机制的影响将导致更具体和有效的治疗策略,用于预防和治疗从遗传/代谢疾病到神经退行性疾病等不同疾病。本文综述了丁酸盐在人类医学中具有潜在临床意义的表观遗传效应的最新数据。
简介
肠道菌群在建立和维持人体健康方面起着至关重要的作用。共生菌参与结肠中膳食纤维的发酵,从而产生短链脂肪酸(SCFAs)、2-碳到5-碳弱酸,包括乙酸(C2)、丙酸(C3)、丁酸(C4)和戊酸(C5)。在SCFAs中,丁酸盐因其从肠道到外周组织的多种有益作用而受到特别关注[1].最重要的丁酸盐生产者似乎是Faecalibacterium prausnitzii,属于leptum梭状芽胞杆菌(或梭状芽孢杆菌簇IV)真细菌rectale / Roseburia属属球菌样的梭状芽胞杆菌(或梭状芽胞杆菌簇XIVa)厚壁菌群[2].丁酸盐的作用机制是多种的,但其中许多与丁酸盐对基因表达的调控作用有关。丁酸盐是一种众所周知的表观遗传物质,称为组蛋白去乙酰化酶抑制剂(HDACi)的一部分。表观遗传学关注的是在不改变核苷酸序列的情况下,塑造染色质结构和稳定调节基因表达的机制,从而确定细胞的身份和功能,使细胞适应环境。有三种不同但密切相互作用的表观遗传机制(组蛋白乙酰化、DNA甲基化和非编码microRNAs)负责修改与生理和病理过程相关的关键基因的表达[3.].组蛋白尾部乙酰化被认为可以增强基因对转录机制的可及性,而去乙酰化的尾部高度荷电,被认为与DNA主干紧密相关,因此限制了基因对转录因子的可及性[4].通过环境因素调节组蛋白乙酰化和去乙酰化,包括饮食化合物,可以预防疾病和保持健康。在更广泛的背景下,人们对膳食HDACi越来越感兴趣,特别是丁酸盐,因为它对表观遗传机制的影响将导致在预防和治疗不同疾病方面更具体和有效的治疗策略。本文综述了丁酸盐在人类医学中具有潜在临床意义的表观遗传效应的最新数据。
癌症治疗和化学预防
近年来,在癌症生物学领域,人们越来越关注表观遗传改变在癌症病因学中的作用。一个特别活跃的研究领域涉及HDACi,不仅用于癌症治疗,而且用于癌症化学预防。与遗传缺陷相比,表观遗传畸变是可逆的:这一特征代表了它们作为治疗靶点的潜力的一个关键方面。HDACi改变染色质和其他非组蛋白的乙酰化状态,导致基因表达改变,诱导凋亡,细胞周期阻滞,抑制血管生成和转移[5,6].几种HDACi正处于不同的开发阶段,包括作为单一疗法的临床试验,以及与其他抗癌药物和放射疗法联合使用[7,8].然而,癌症患者对HDACi反应的分子机制尚不完全清楚。丁酸盐和苯丁酸盐已在市场上用于非肿瘤用途多年,并已被证明具有HDACi活性。这些SCFAs在毫摩尔浓度下具有HDACi活性。丁酸盐能够抑制癌细胞中的表观遗传沉默基因,如细胞周期抑制剂p21和促凋亡蛋白Bcl-2同源拮抗剂/杀伤因子(BAK),并激活正常细胞中的这些基因,这对癌症预防和治疗具有重要意义[9].HDACi还能诱导自噬细胞死亡。凋亡蛋白酶激活因子1 (Apaf-1)敲除或B细胞淋巴瘤特大号(Bcl-XL)过表达的HeLa细胞在丁酸盐培养下诱导自噬细胞死亡,并在细胞质中形成自噬空泡[10,11].此外,HDACi已被描述为具有抗血管生成和抗转移作用。丁酸盐被发现抑制血管生成在体外而且在活的有机体内,并降低促血管生成因子的表达,包括缺氧诱导因子(HIF-1a)和血管内皮生长因子(VEGF) [12- - - - - -14].一些研究假设,增加结肠丁酸盐浓度可能是观察到的可发酵膳食纤维对结直肠癌的保护作用的重要中介因素[15,16].膳食纤维及其分解产物丁酸盐对结直肠癌的保护作用可以通过调节典型Wnt信号来确定,这是一种在大多数结直肠癌中组成性激活的途径[17].丁酸盐被认为具有减缓结肠癌细胞生长和激活细胞凋亡的二级化学预防作用,但它也可以作用于一级化学预防[18].提出的机制是解毒酶的转录上调,如谷胱甘肽s转移酶(GST)。GST基因的调节可能保护细胞免受基因毒性致癌物,如H2O2和4-羟基壬烯醛(HNE) [19,16].一种名为pivanex (pivaloyloxymethil butyrate)的新化合物在治疗非小细胞肺癌中表现出抗肿瘤活性。它的作用基于丁酸盐的快速水解和释放,允许有效地传递到亚细胞目标。Pivanex已被证明在预处理的非小细胞肺癌患者中是有效和安全的,这些有趣的结果导致该药物与多西他赛联合使用[20.].
抗炎作用
丁酸发挥其抗炎作用的主要机制是抑制核因子κB (NFkB)的激活,抑制干扰素γ的产生和上调过氧化物酶体增殖物激活受体γ (PPARγ),这可能是由于抑制HDAC [21].丁酸盐的这些特性使我们评估其在炎症性肠病(IBD)中的可能治疗用途。对溃疡性结肠炎(UC)患者的干预研究表明,在腔内给药丁酸盐或通过摄入膳食纤维刺激腔内产生丁酸盐可改善炎症和症状[22,23].Hallert等.指导22例静止性UC患者在日常饮食中添加20克膳食纤维。总共4周的治疗使粪便丁酸盐浓度显著增加,腹部症状显著改善[22].Vernia等.在一项双盲、安慰剂对照的多中心试验中,51例活动性远端UC患者使用含有5-氨基水杨酸(5-ASA)或5-ASA加丁酸钠(80 mM,每天两次)的直肠灌肠治疗。与单独使用5-ASA治疗的患者相比,外用5-ASA联合丁酸钠治疗可显著改善疾病活动性评分[23].
对肥胖、胰岛素抵抗和心血管疾病的影响
丁酸盐的抗炎作用,通过抑制HDAC介导,也可能能够防止免疫细胞从血液渗透到脂肪组织[24].在这方面,评估丁酸盐在预防/治疗慢性低度炎症中的作用可能很有趣,这种炎症常见于肥胖,与胰岛素抵抗、2型糖尿病和心血管疾病的风险增加有关。在一项临床前研究中,高等.表明膳食中添加丁酸盐可以预防和治疗小鼠饮食性肥胖和胰岛素抵抗。丁酸盐通过刺激过氧化物酶体增殖物激活受体-γ共激活物1α (PGC-1α)活性起作用,这是由于抑制HDAC和激活amp活化蛋白激酶(AMPK) [25].在高胆固醇血症中,最近的证据表明丁酸盐的整体效应是下调参与肠道胆固醇生物合成的9个关键基因的表达,因此可能抑制这一途径[26].这些数据表明丁酸盐在预防和治疗所谓的人类代谢综合征的主要成分方面可能有潜在的应用。丁酸盐对心血管疾病有更直接的保护作用。最近,马修等.丁酸盐显示出动脉粥样硬化保护/抗动脉粥样硬化的潜力,通过其染色质重塑活性改变g1特异性细胞周期蛋白,以阻止血管平滑肌细胞增殖,血管平滑肌细胞是血管的关键细胞成分,在动脉粥样硬化的发展中发挥重要作用。本研究结果表明丁酸盐作为一种药物分别在心血管疾病预防和动脉再狭窄和支架内再狭窄的治疗干预中具有潜在作用[27].
对免疫系统的影响
另一个新兴的研究领域涉及丁酸盐对免疫系统的表观遗传调节。表观遗传途径在许多层面上调节免疫功能:在免疫系统发育中,在对感染的反应中,在对肿瘤的免疫监测中,在自身免疫中[28].特别是丁酸盐似乎通过影响免疫细胞迁移、粘附、细胞因子表达以及影响细胞增殖、激活和凋亡等过程来发挥广泛的抗炎活性[24].丁酸盐对先天免疫系统也有影响。抗菌蛋白cathelicidin在对抗细菌感染的防御机制中起着重要作用。多项研究表明丁酸钠可诱导人结肠、胃和肝细胞cathelicidin基因的表达[29- - - - - -31].智库等.研究了丁酸钠诱导人肺上皮细胞系EBC-1 cathelicidin基因表达的机制。本研究表明丁酸钠可诱导cathelicidin mRNA和蛋白的表达。此外,他们还证明了激活蛋白1 (AP-1)和cathelicidin启动子的组蛋白乙酰化参与了可诱导的cathelicidin基因表达的调控[32].因此,利用HDACi增强cathelicidins的表达可能成为增强先天免疫的新途径。
对遗传疾病的影响
丁酸盐也可以被认为是胎儿血红蛋白(HbF)合成的诱导物,是治疗β-血红蛋白病(如镰状细胞病和β-地中海贫血)的一种有趣的策略。HbF合成的诱导涉及γ-珠蛋白基因表达的表观遗传调控,这是由HDAC抑制介导的。镰状细胞病和β-地中海贫血患者的临床试验证实丁酸盐能够增加HbF的产生[33,34].
丁酸盐及其衍生物已被研究为治疗囊性纤维化的潜在方法[35].通过操纵伴侣蛋白/CFTR与化学伴侣或影响基因调控的药物(如丁酸盐)的相互作用,囊性纤维化跨膜传导调节因子(CFTR)的II类突变可以恢复到蛋白质转运途径。调查表明在体外活性以增加成熟CFTR的生产和氯离子在细胞表面的运输的形式出现。其机制尚不完全清楚,但可能涉及转录水平的上调和蛋白质折叠步骤的调节。丁酸可能对其他具有可上调的替代酶途径的遗传疾病表现出活性,如x -连锁肾上腺白质营养不良(X-ALD),这是一种由于ABCD1基因突变引起的过氧化物酶体疾病,其特征是代谢改变和长链脂肪酸的积累。组蛋白去乙酰化酶抑制剂可减少X-ALD细胞的氧化损伤,并可诱导与ABCD1最接近的同源基因——冗余基因ABCD2的表达,从而弥补X-ALD患者ABCD1功能缺失的缺陷[36].先天性氯化物腹泻(CLD)是另一种遗传性疾病,丁酸盐治疗已被证明是有益的[37,38].CLD是一种罕见的遗传性疾病,由编码溶质连接载体家族26个成员A3 (SLC26A3)蛋白的基因突变引起,该蛋白作为Cl的质膜阴离子交换剂-和HCO3.-.这种治疗作用的机制可能与刺激Cl有关-或者丁酸盐可能诱导SLC26A3基因的表达,该基因在残基-398和-688之间有一个290 bp的区域,这对于丁酸盐诱导的高水平转录激活至关重要。这可能解释了受CLD影响的患者对丁酸盐的不同反应;事实上,根据患者的基因型不同,SLC26A3基因上述调控区域的突变也会影响基因的转录速率。
神经保护作用
丁酸盐的一个新的应用领域是缺血性卒中:丁酸盐在缺血性损伤后似乎具有长期的有益作用。脑缺血增强了成年动物缺血脑的神经源性和非神经源性区域的神经发生。一项临床前研究表明,丁酸钠损伤后处理可通过上调脑源性神经营养因子(BDNF)来刺激永久性脑缺血大鼠缺血脑内细胞增殖、迁移和分化[39].丁酸盐在亨廷顿病(HD)转基因小鼠模型中也具有显著的神经保护作用,因此代表了一种非常有前途的HD治疗方法。有证据表明,突变的亨廷顿蛋白与转录因子相互作用导致组蛋白乙酰化降低。在HD转基因小鼠模型出现症状后给药HDACi苯丁酸酯可显著延长生存期并减弱神经元萎缩[40].丁酸盐对记忆的影响也很有趣。使用非特异性HDACs(如丁酸钠)阻断HDAC活性,可增强突触可塑性和记忆,这表明HDACs实际上可能有助于将染色质恢复到压抑状态,并抑制长期记忆形成所需的转录[41].此外,HDAC抑制可以将通常不会导致物体识别的长期记忆的学习事件转化为持久形式的记忆[42].总之,这些结果表明HDACs可能是关键的记忆抑制基因,并表明HDACi,如丁酸盐,可能产生更持久的长期记忆形式,这具有巨大的治疗和翻译价值。
对干细胞的影响
丁酸盐通过促进表观遗传重塑和多能性相关基因的表达,极大地提高了诱导多能性干细胞来源于人成人或胎儿成纤维细胞的效率[43].因此,丁酸盐作为一种细胞渗透性小分子,为进一步研究细胞重编程的分子机制提供了一个简单的工具。此外,丁酸刺激提供了一种有效的方法来重编程各种人类成人体细胞,包括来自患者的细胞更难以重编程。不同的证据表明,癌症干细胞样细胞存在于几种恶性肿瘤中,如白血病、乳腺癌和脑肿瘤,并且这些干细胞在每个组织中表达的表面标记与正常干细胞表达的表面标记相似[44- - - - - -46].在最近的一项研究中,加藤等.分离的侧群细胞和非侧群细胞来自表达人[12Val] KRAS (RK12V细胞),并确定侧群表型。RK12V-SP细胞具有自我更新能力,具有向基质细胞发展的潜力,分化标志物表达水平降低,培养中具有长期增殖能力,致瘤性增强,表明RK12V-SP细胞具有癌干细胞样细胞特征。RK12V-SP细胞对常规化疗药物也表现出较高的耐药性。相反,丁酸钠处理降低了软琼脂中RK12V-SP细胞的自我更新能力,并完全抑制了RK12V-SP细胞的菌落形成,表明丁酸钠对子宫内膜癌干细胞样细胞的增殖具有抑制作用[47].
结论
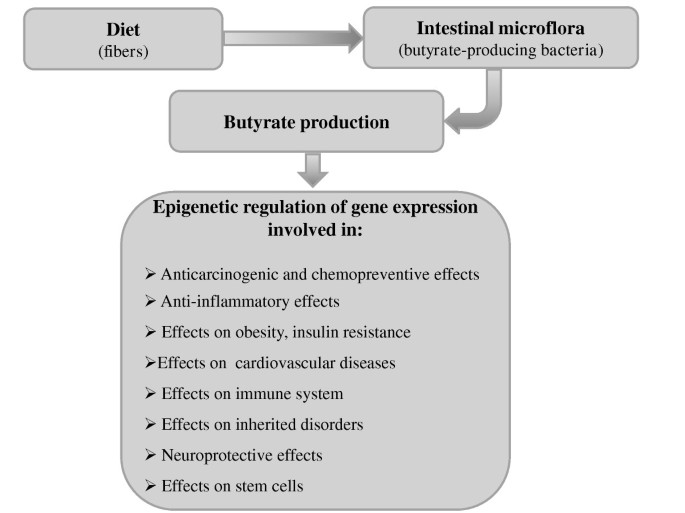
胃肠道在很多方面有助于身体健康。在这种背景下,特别令人感兴趣的是“肠道健康”的新兴概念和可以解释它的机制。“肠道健康”是医学文献中越来越多使用的一个术语。它涵盖了胃肠道的多个积极方面,如没有胃肠道疾病、正常稳定的肠道微生物群和有效的免疫状态,这些也能决定一种健康状态[48].现在有充分的证据表明,实现和维持“肠道健康”有两个功能实体是至关重要的。49,50].这些实体是肠道微生物群和肠道屏障。肠道菌群的任何损害,例如,由不平衡饮食引起的,如富含碳水化合物的饮食,都可能影响肠道功能,从而影响“肠道健康”[51].因此,如果我们更多地了解如何实现和保持“肠道健康”,就可以为预防医学提供一种新的方法。生活方式特征,如均衡饮食、适度但有规律的锻炼和避免慢性压力,以及选定的益生元和益生菌等产品,可以支持肠道健康[48].在这种情况下,肠道菌群在生命早期阶段产生SCFA的重要作用导致了益生菌代表一种新的慢性疾病治疗或预防策略的想法,通过调节微生物环境恢复SCFA水平(图1) [52].最近,Licciardi等.假设益生菌通过产生SCFAs(尤其是丁酸盐)引起的表观遗传机制是理解它们如何从肠道到外周组织调节其众多促进健康作用的关键[53].丁酸盐在“肠道/身体健康”方面起着关键作用。它的产生依赖于饮食和肠道菌群的组成,但它也能够通过调节腔内pH来调节肠道菌群,并通过表观遗传机制发挥许多有益的肠外作用[52].在更广泛的背景下,丁酸盐可能用于预防和治疗不同的慢性疾病,包括癌症、代谢综合征、心血管疾病、遗传疾病、免疫介导的慢性疾病和神经退行性疾病。此外,丁酸盐可能有助于通过促进表观遗传重塑和多能性相关基因的表达来开发改进的再生医学策略。总之,在过去十年中获得了大量的临床前数据,这些发现为未来的临床研究提供了基础,旨在阐明丁酸盐在人类医学中的潜在预防和治疗作用。
参考文献
Berni Canani R, Di Costanzo M, Leone L, Bedogni G, Brambilla P, Cianfarani S, Nobili V, Pietrobelli A, Agostoni C:早期营养诱导的表观遗传机制。环境科学学报,2011,18:1-8。
张建平,张建平,张建平:人大肠丁酸盐产生菌的多样性、代谢及微生物生态学研究。微生物学通报,2009,29(1):1-8。10.1111 / j.1574-6968.2009.01514.x。
McKay JA, Mathers JC:饮食诱导的表观遗传变化及其对健康的影响。物理学报,2011,202:103-118。10.1111 / j.1748-1716.2011.02278.x。
Delage B, Dashwood RH:饮食对组蛋白结构和功能的控制。生态学报,2008,28:347-366。10.1146 / annurev.nutr.28.061807.155354。
Ma X, Ezzeldin HH, Diasio RB:组蛋白去乙酰化酶抑制剂的现状及近期临床试验综述。中华医学杂志,2009,29(4):344 - 344。10.2165 / 11315680-000000000-00000。
Rajendran P, Ho E, Williams DE, Dashwood RH:饮食植物化学物质,HDAC抑制和癌细胞中的DNA损伤/修复缺陷。中华临床医学杂志,2011,3:4-10.1186/1868-7083-3-4。
Kim HJ, Bae SC:组蛋白去乙酰化酶抑制剂的分子作用机制及其作为抗癌药物的临床试验。学报学报,2011,30(3):366 - 366。
Wagner JM, Hackanson B, Lübbert M, Jung M:组蛋白去乙酰化酶(HDAC)抑制剂在近期癌症治疗临床试验中的应用。中华临床医学杂志,2010,1:117-136。10.1007 / s13148 - 010 - 0012 - 4。
膳食组蛋白去乙酰化酶抑制剂:从细胞到小鼠再到人。中华肿瘤杂志,2007,17:363-369。10.1016 / j.semcancer.2007.04.001。
邵毅,高志,马志平,姜欣:组蛋白去乙酰化酶抑制剂诱导细胞凋亡和自噬死亡。美国国家科学研究院。2004, 30(4): 528 - 528。10.1073 / pnas.0408345102。
徐WS Parmigiani RB,标志着PA:组蛋白脱乙酰酶抑制剂:分子机制的行动。致癌基因,2007,26:5541-52。10.1038 / sj.onc.1210620。
Deroanne CF, Bonjean K, Servotte S, Devy L, Colige A, Clausse N, Blacher S, Verdin E, Foidart JM, Nusgens BV, Castronovo V:组蛋白脱乙酰酶抑制剂作为改变血管内皮生长因子信号的抗血管生成剂。癌症基因。2002,21:427-436。10.1038 / sj.onc.1205108。
张志刚,张志刚,张志刚。组蛋白去乙酰化酶抑制剂的抗肿瘤活性研究。中国药物学杂志,2006,5:769-784。10.1038 / nrd2133。
梁东,孔霞,桑宁:组蛋白去乙酰化酶抑制剂对HIF-1的影响。中国生物医学工程学报,2006,30(4):344 - 344。10.4161 / cc.5.21.3409。
宾汉山,天,Luben R,法拉利P, Slimani N, Norat T, Clavel-Chapelon F, Kesse E, Nieters,波音公司H, Tjonneland, Overvad K,马丁内斯C, Dorronsoro M,冈萨雷斯CA,关键TJ Trichopoulou, Naska, Vineis P, Tumino R,克罗V, Bueno-de-Mesquita HB,此人PH值,巴瑞克,Hallmans G,隆德E, Skeie G, Kaaks R, Riboli E:膳食纤维在食品和预防结直肠癌的欧洲癌症与营养前瞻性调查(史诗):一项观察性研究。《医学杂志》,2003,37(3):344 - 344。10.1016 / s0140 - 6736(03) 13174 - 1。
Scharlau D, Borowicki A, Habermann N, Hofmann T, Klenow S, Miene C, Munjal U, Stein K, Glei M:膳食纤维在肠道菌群发酵过程中形成的丁酸盐和其他产物预防原发性癌症的机制地球科学进展,2009,30(3):344 - 344。10.1016 / j.mrrev.2009.04.001。
Bordonaro M, Lazarova DL, Sartorelli AC:丁酸盐和Wnt信号:膳食纤维和结肠癌风险之谜的可能解决方案?中国生物医学工程学报,2008,27(3):344 - 344。10.4161 / cc.7.9.5818。
schppach W, Weiler F:丁酸盐的故事:新瓶装旧酒?中国临床医学杂志,2004,7:563-567。10.1097 / 00075197-200409000-00009。
Pool-Zobel B, Veeriah S, Bohmer FD:抗癌药物对异种代谢酶的调节——重点研究谷胱甘肽S转移酶及其在结直肠癌发生中的饮食化学预防靶点作用。兵工学报,2005,29(4):344 - 344。10.1016 / j.mrfmmm.2005.04.020。
Reid T, Valone F, Lipera W, Irwin D, Paroly W, Natale R, Sreedharan S, Keer H, Lum B, Scappaticci F, Bhatnagar A:组蛋白脱乙酰酶抑制剂Pivanex (Pivanex, AN-9)治疗晚期非小细胞肺癌的II期试验。中华癌症杂志,2004,45:381- 381。10.1016 / j.lungcan.2004.03.002。
Hamer HM, Jonkers D, Venema K, Vanhoutvin S, Troost FJ, Brummer RJ:综述文章:丁酸盐对结肠功能的作用。中国药理学杂志,2008,27:104-119。
Hallert C, Björck I, Nyman M, Pousette A, Grännö C, Svensson H:通过饮食增加溃疡性结肠炎患者的粪便丁酸盐:对照试点研究。中华肠道疾病杂志,2003,19(3):344 - 344。10.1097 / 00054725-200303000-00005。
Vernia P, Annese V, Bresci G, d'Albasio G, d 'Incà R, Giaccari S, Ingrosso M, Mansi C, Riegler G, Valpiani d, Caprilli R:局部丁酸盐提高5-ASA治疗顽固性远端溃疡性结肠炎的疗效:一项多中心试验的结果。中国经济研究,2003,33(1):1 - 4。10.1046 / j.1365-2362.2003.01130.x。
Meijer K, de Vos P, Priebe MG:丁酸盐和其他短链脂肪酸作为免疫调节剂:与健康有什么相关性?中国临床医学杂志,2010,13:715-721。10.1097 / MCO.0b013e32833eebe5。
高铮,尹娟,张娟,Ward RE, Martin RJ,李维敏,叶娟:丁酸能提高小鼠胰岛素敏感性,增加能量消耗。中华糖尿病杂志,2009,28(3):357 - 357。10.2337 / db08 - 1637。
Alvaro A, Solà R, Rosales R, Ribalta J, Anguera A, Masana L, Vallvé JC:人肠上皮细胞系的基因表达分析揭示了短链脂肪酸对胆固醇生物合成的下调反应。中国生物工程学报,2008,30(4):344 - 344。10.1002 / iub.110。
Mathew OP, Ranganna K, Yatsu FM:丁酸盐,一种HDAC抑制剂,刺激组蛋白H3的不同翻译后修饰之间的相互作用,并不同地改变血管平滑肌细胞中g1特异性细胞周期蛋白。中国生物医学工程学报,2010,29(4):344 - 344。10.1016 / j.biopha.2010.09.017。
Fernández-Morera JL, Calvanese V, Rodríguez-Rodero S, Menéndez-Torre E, Fraga MF:免疫系统在健康和疾病中的表观遗传调控。中国生物医学工程学报,2010,27(3):344 - 344。10.1111 / j.1399-0039.2010.01587.x。
Schauber J, Svanholm C, Termén S, Iffland K, Menzel T, Scheppach W, Melcher R, Agerberth B, Lührs H, Gudmundsson GH:肠细胞中cathelicidin LL-37的表达受短链脂肪酸调节:信号通路的相关性。肠科学,2003,52:735-741。10.1136 / gut.52.5.735。
Schauber J, Iffland K, Frisch S, Kudlich T, Schmausser B, Eck M, Menzel T, Gostner A, Lührs H, Scheppach W:组蛋白去乙酰化酶抑制剂诱导胃肠道细胞中的cathelicidin LL-37。分子免疫学杂志,2004,41:847-854。10.1016 / j.molimm.2004.05.005。
Hase K, Murakami M, Iimura M, Cole SP, Horibe Y, Ohtake T, Obonyo M, Gallo RL, Eckmann L, Kagnoff MF:人胃上皮细胞表达LL37作为潜在的宿主防御机制幽门螺杆菌.中华胃肠病学杂志,2003,29(4):426 - 426。10.1053 / j.gastro.2003.08.028。
Kida Y, Shimizu T, Kuwano K:丁酸钠通过激活蛋白-1和组蛋白乙酰化上调人肺上皮细胞系EBC-1启动子区cathelicidin基因的表达。中华免疫杂志,2006,43:72- 81。10.1016 / j.molimm.2005.11.014。
Atweh GF, Sutton M, Nassif I, Boosalis V, Dover GJ, Wallenstein S, Wright E, McMahon L, Stamatoyannopoulos G, Faller DV, Perrine SP:脉冲丁酸盐治疗镰状细胞病胎儿血红蛋白的持续诱导。《血》1999,93:1790-1797。
Perrine SP, Ginder GD, Faller DV, Dover GH, Ikuta T, Witkowska HE, Cai SP, Vichinsky EP, Olivieri NF:丁酸盐刺激β -珠蛋白障碍中胎儿珠蛋白基因表达的短期试验。中华实用医学杂志,1998,28(3):344 - 344。10.1056 / NEJM199301143280202。
Zeitlin PL:囊性纤维化的未来药物治疗。呼吸。2000,67:351-357。10.1159 / 000029528。
Berger J, Pujol A, Aubourg P, fss - petter S: x -连锁肾上腺脑白质营养不良的当前和未来药物治疗策略。中国脑疾病杂志,2010,20:845-56。10.1111 / j.1750-3639.2010.00393.x。
Berni Canani R, Terrin G, Cirillo P, Castaldo G, Salvatore F, Cardillo G, Coruzzo A, Troncone R:丁酸盐对先天性氯化物腹泻的有效治疗。中华胃肠病学杂志,2004,27(3):344 - 344。10.1053 / j.gastro.2004.03.071。
Berni Canani R, Terrin G, Cardillo G, Tomaiuolo R, Castaldo G:先天性腹泻疾病:对基因缺陷了解的提高导致肠道生理学和临床管理的进步。中华儿科胃肠病杂志,2010,50:366 - 366。
Kim HJ, Leeds P, Chuang DM: HDAC抑制剂丁酸钠刺激缺血脑的神经发生。中华神经化学杂志,2009,29(4):349 - 349。10.1111 / j.1471-4159.2009.06212.x。
Gardian G, Browne SE, Choi DK, Klivenyi P, Gregorio J, Kubilus JK, Ryu H, Langley B, Ratan RR, Ferrante RJ, Beal MF:苯基丁酸酯对亨廷顿舞蹈病n71 -82q转基因小鼠模型的神经保护作用。中国生物医学工程学报,2005,29(4):457 - 457。
Vecsey CG, Hawk JD, Lattal KM, Stein JM, Fabian SA, Attner MA, Cabrera SM, McDonough CB, Brindle PK, Abel T, Wood MA:组蛋白去乙酰化酶抑制剂通过CREB: cbp依赖的转录激活增强记忆和突触可塑性。神经科学杂志,2007,27:6128-6140。10.1523 / jneurosci.0296 - 07.2007。
Stefanko DP, Barrett RM, Ly AR, Reolon GK, Wood MA:通过HDAC抑制调节物体识别的长期记忆。美国国家科学研究院。2009, 26(4): 457 - 457。10.1073 / pnas.0903964106。
Mali P, Chou BK, Yen J, Ye Z, Zou J, Dowey S, Brodsky RA, Ohm JE, Yu W, Baylin SB, Yusa K, Bradley A, Meyers DJ, Mukherjee C, Cole PA, Cheng L:丁酸盐通过促进表观遗传重塑和多能相关基因的表达,极大地促进了人诱导多能干细胞的生成。中国生物医学工程学报,2010,28:713-720。10.1002 / stem.402。
Bonnet D, Dick JE:人类急性髓系白血病是一种起源于原始造血细胞的层次结构。中华医学杂志,1997,3:731 - 731。10.1038 / nm0797 - 730。
AI-Hajj M, Wicha MS, bento - hernandez A, Morrison SJ, Clarke MF:肿瘤性乳腺癌细胞的前瞻性鉴定。美国国家科学研究院。2003, 30(4): 379 - 379。10.1073 / pnas.0530291100。
陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强,陈志强:人脑肿瘤中肿瘤干细胞的鉴定。癌症决议,2003,63:5821-5828。
Kato K, Kuhara A, Yoneda T, Inoue T, Takao T, Ohgami T, Dan L, Kuboyama A, Kusunoki S, Takeda S, Wake N:丁酸钠通过诱导DNA损伤反应抑制子宫内膜肿瘤旁群细胞的自我更新能力。中华癌症杂志,2011,10:1430-9。1535 - 7163. - 10.1158 / mct - 10——1062。
Bischoff SC:“肠道健康”:医学的新目标?中国生物医学工程学报,2011,26(2):344 - 344。
J:肠道屏障在疾病中的意义。肠道杂志,2008,57:438-440。
Groschwitz KR, Hogan SP:肠屏障功能:分子调节与疾病发病机制。中华过敏临床免疫杂志,2009,29(4):344 - 344。10.1016 / j.jaci.2009.05.038。
Sonnenburg ED, Zheng H, Joglekar P, Higginbottom SK, Firbank SJ, Bolam DN, Sonnenburg JL:肠道拟杆菌中多糖使用的特异性决定饮食诱导的菌群改变。电子学报,2010,34(4):344 - 344。10.1016 / j.cell.2010.05.005。
Berni Canani R, Di Costanzo M, Leone L, Pedata M, Meli R, Calignano A:丁酸盐在肠道和肠外疾病中的潜在有益作用。中华胃肠病杂志,2011,17:1519-1528。10.3748 / wjg.v17.i12.1519。
李夏帝,王世峰,唐明明,王世峰:益生菌代谢产物的表观基因组靶向研究。肠道病原学杂志,2010,2:24-10.1186/1757-4749-2-24。
确认
作者感谢母亲和儿童健康协会对他们的研究工作的承诺。感谢AIFA (FARM6FJ728)的资助。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
BCR和DCM负责稿件的概念化和实施。BCR, DCM和LL负责撰写稿件。所有作者都阅读并批准了最终的手稿。
作者提交的图片原始文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
Berni Canani, R., Di Costanzo, M. & Leone, L.丁酸盐的表观遗传效应:临床实践的潜在治疗意义。中国Epigenet4, 4(2012)。https://doi.org/10.1186/1868-7083-4-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1868-7083-4-4
关键字
- 表观基因组
- 组蛋白去乙酰酶抑制剂
- 短链脂肪酸