摘要
在癌症中,休眠指的是一种临床状态,在这种状态下,微观残留的疾病变得不增殖,并且在很大程度上对化疗是难治的。休眠最早被描述在乳腺癌中,疾病可以保持几十年未被发现,最终导致复发和原始恶性肿瘤的临床表现。潜伏期长可以解释为细胞增殖停止(细胞休眠),或在增殖和细胞死亡之间保持平衡,保留低水平的残余疾病(肿瘤大规模休眠)。对细胞休眠的研究揭示了这种状态的特征。它们包括阻止细胞增殖,改变细胞代谢,以及独特的细胞依赖性和与微环境的相互作用。这些特征可以由来自不同原发疾病部位的休眠细胞共享,这表明它们之间存在共同特征。
高级别浆液性卵巢癌(HGSOC)通过称为球形的细胞聚集体扩散到腹腔各处。这些生长受阻和抗治疗细胞是疾病复发的重要因素。在这篇综述中,我们讨论了球形卵巢癌细胞与其他癌症疾病位点报道的休眠特性之间的异同。这揭示了休眠的要素,如细胞周期控制机制和代谢变化,在大多数形式的细胞休眠中可能是相似的。然而,球形生物学的hgsoc特异性方面,包括细胞外基质组织和微环境,是强制性疾病部位特异性的。总的来说,我们对当前文献的批判性回顾强调了HGSOC细胞休眠可能提供一个更容易掌握的实验方法来理解癌症中细胞休眠的广泛原理。
简介
上皮性卵巢癌是全球女性第七大常见癌症。它很难治疗,因为它最常在晚期诊断,并伴有转移[1].总的来说,上皮性卵巢癌包括侵袭性较低的组织类型,如低级别浆液性、子宫内膜样、透明细胞性和粘液性(1型),以及侵袭性较高的高级别浆液性卵巢癌(2型)[2].高级别浆液性卵巢癌(HGSOC)占病例的70%以上,加之其传播速度较快,导致卵巢癌的发病率和死亡率大大增加[3.].HGSOC通常采用手术减体积和由卡铂和紫杉醇组成的辅助化疗治疗[3.].此外,靶向药物如贝伐单抗和PARP抑制剂可改善预后[1,3.,4].虽然最初通常对化疗有反应,但微小残留疾病(MRD)耐药性的出现强调了了解治疗后相对罕见的HGSOC细胞的生物学和生存策略的必要性[3.,5].因此,本文将主要关注HGSOC的疾病特征,以及它们与其他疾病部位的癌症休眠的相似或对比。
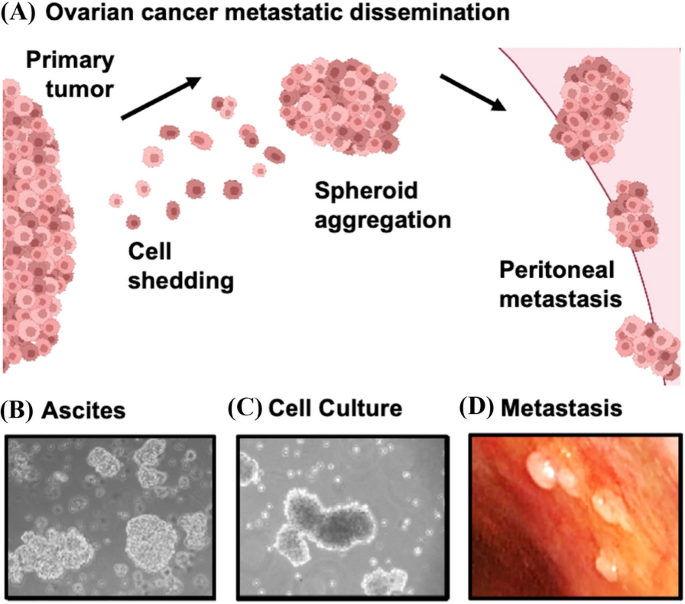
HGSOC的转移性扩散与大多数形式的人类癌症不同,细胞从输卵管和卵巢脱落到腹膜空间,在腹膜空间聚集并扩散到盆腔区域的其他器官以及腹腔更高的目的地(图2)。1) [1,5].从卵巢癌患者腹水中分离出的癌细胞聚集物揭示了具有假定休眠特征的非增殖细胞群[6],这表明它们可能是传播和治疗耐药性的来源。HGSOC球体的细胞培养模型揭示了细胞增殖减少、细胞代谢改变的机制,具有独特的生存和传播策略[7,8,9,10].这些进一步表明,HGSOC具有一种与本病临床病程相关的休眠形式。
在文献中对癌细胞休眠的定义各不相同,有些文献将其定义为最低限度地抑制癌细胞的增殖[11].从更广泛的意义上讲,休眠包含了一系列细胞特征,包括新的代谢策略、生存机制、茎状特性和独特的微环境接触[12,13].值得注意的是,在骨骼中的乳腺癌或前列腺癌细胞中,与休眠支持微环境的独特相互作用是细胞寿命的关键[14,15].在这篇综述中,我们考虑了目前HGSOC休眠的证据,以及它与其他休眠范式的比较。我们关注的是细胞休眠的概念,而不是肿瘤块休眠[12,13],因为它最符合HGSOC中球状体的生物学特征。癌细胞休眠是乳腺癌的一个重要范式,即癌前细胞在原发肿瘤形成前从早期病变扩散到远处组织[16].这种情况与HGSOC的扩散特征不太一致,因为大多数患者被诊断为晚期疾病,原发肿瘤和转移性扩散同时存在[5].有趣的是,罕见的HGSOC患者最初被诊断为播散性疾病,其中原发肿瘤无法检测到,临床上称为原发性腹膜癌[1].这表明癌前细胞可能很早就扩散,导致晚期HGSOC的出现,而没有原发肿瘤[17,18].虽然与乳腺癌类似,但进一步的讨论超出了本文的范围,本文旨在分析HGSOC疾病进展最常见过程的细胞休眠特征。
也许休眠研究的最大挑战是所研究细胞的稀缺。17,18].这导致了在乳腺癌和前列腺癌的最佳情况下了解这些细胞的艰难进展,这些细胞通常定植在遥远的组织,如骨骼,含有罕见的细胞[14].尽管一些数据表明,当细胞聚集物扩散时,转移可能更有效[19],大多数转移和休眠的范式都是基于孤立细胞。HGSOC具有与乳腺癌和前列腺癌疾病进展不同的特征,这使得在临床样本中识别它们的挑战较小。此外,由于体外球形和转移模型,在培养中模拟生长停滞和假定休眠的HGSOC细胞更容易处理[7,20.].出于这个原因,HGSOC可能提供了机会来促进我们对适用于其他疾病部位的休眠原理的理解,这促使我们对与HGSOC有关的休眠数据与其他癌症类型进行严格的审查。
了解HGSOC中球状体的基本生物学的动机是开发更好的治疗方法来消除这一关键的耐药性来源。正如在其他休眠范式中所详述的那样,“唤醒”休眠细胞以使其对为增殖细胞设计的化疗重新敏感的前景具有在其他地方已经审查过的缺陷[14,21].另外,也存在强化休眠的治疗策略,但最终仍会导致复发[22].出于这个原因,我们将休眠研究合理化,以寻求破译生存依赖,其去除杀死这些细胞而不恢复疾病进展。下面几节将探讨支持生存和生长停滞的不同休眠特征。组织和讨论这些类别的目的是寻找新的辅助治疗机会,并强调有希望进行进一步研究的领域。
休眠细胞处于休眠状态,或缓慢增殖的细胞
Hanahan和Weinberg描述的癌症的两个特征与细胞周期控制有关[23].生长信号的自给自足和对负生长信号的回避描述了细胞周期中的两个概念输入,在大多数癌症中都发生了改变。细胞休眠,即来自晚期疾病的细胞达到静止状态或增殖大大减慢,这意味着某些负生长控制手段被保留或可以获得。此外,主要的生长促进信号可以被这些负信号通路覆盖,因为它们能够阻止增殖以支持进入细胞休眠。这种反直觉的生长停滞可能是由癌细胞扩散过程中受到的压力引发的。13,14],或者在HGSOC的情况下,从原发肿瘤释放到形成球形的腹膜间隙。
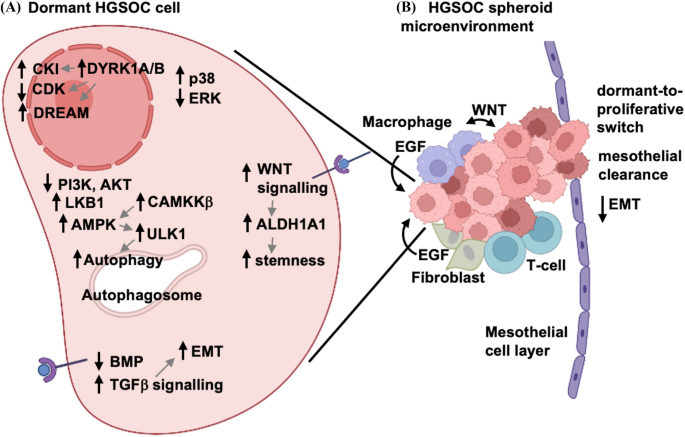
在增殖控制中,休眠癌细胞信号转导的一个基本原理反映了上述特征推理,即通过Ras-MAPK途径的促生长信号通常被下调,这可以通过降低磷酸化erk得到证明。同时,应激反应的MAPK p38被激活,并已被证明可诱导生长停滞机制。这种核心信号改变已在多种实体肿瘤类型的休眠病例中报道过[24,25,26],这种信号开关在HGSOC的细胞培养模型中也得到了证实(图2)。2) (27].
HGSOC球体中控制细胞休眠的机制。一个HGSOC球形细胞经历多次应激诱导的重编程事件,通过p38和ERK调节诱导细胞静止。这些导致CDK抑制剂表达增加,DREAM的组装和CDK活性的抑制。其他途径有助于休眠表型,包括代谢重编程通过增加LKB1和AMPK活性,减少PI3K-AKT信号,以及诱导巨自噬。EMT和干性分别由TGFβ和WNT信号通路促进,这些配体可由HGSOC细胞或微环境生态位内的其他细胞直接产生。B腹膜腔和恶性腹水独特的微环境中多种不同类型的细胞可直接影响HGSOC球体。这些包括肿瘤相关的巨噬细胞、成纤维细胞和t细胞,所有这些细胞都可以提供细胞因子信号或直接细胞-细胞接触来影响休眠表型。球状体直接与腹膜表面的间皮细胞相互作用,导致间皮清除并侵入下基质。在此过程中,HGSOC细胞可以经历休眠到增殖的转换,以及在建立继发性肿瘤沉积时逆转其间充质表型
细胞增殖减少意味着休眠信号阻断了细胞周期蛋白/CDK活性,降低Myc水平,并诱导了其他的静止特征。休眠的实验细胞培养模型揭示了CDK抑制剂蛋白水平的增加,特别是在生长停滞的条件下[14,28,29].此外,体内异种移植模型长期以来一直使用组织学染色来证明CDK抑制蛋白p21、p27和p16作为休眠细胞的标记物和表征其生长抑制状态的水平升高[30.].这些数据来源于代表乳腺癌、黑色素瘤和鳞状癌类型的癌细胞。在某些情况下,CDK抑制剂基因的转录上调表明休眠触发的基因表达模式控制了这种效应[14,29,31].其他研究表明F-box蛋白调节通过稳定CDK抑制剂表达来控制休眠[32],提示翻译后机制也可以影响处于休眠状态的CDK调节。
类似的CDK抑制增殖的实验证据存在于hgsoc来源的细胞和球形细胞中(图2)。2A).增殖和球形形成减少伴随p27水平升高和磷酸化skp2同时减少[7],提示翻译后机制诱导CDK抑制。这种结合siRNA敲除的细胞休眠培养模型的扩展揭示了许多CDK抑制剂在HGSOC休眠中的作用[33].CDKN1家族成员似乎是HGSOC细胞系中最常需要的,但一些低传代患者来源的培养也显示出对CDKN2家族成员的依赖性[33].
与促进休眠的应激依赖信号一致,生存激酶DYRK1A/B与休眠细胞周期阻滞和生存能力维持有关[14].DYRK激酶通常受蛋白质表达调控,并具有独立于T-loop磷酸化的活性状态[34],表明表达水平可能是参与休眠的最佳指标。DYRK1激酶能够通过许多靶点抑制细胞增殖,包括Cyclin D降解[35,36], p27稳定[37]和DREAM[二聚体伙伴(DP),视网膜母细胞瘤(RB)样,E2F和MuvB]复合物通过磷酸化LIN52蛋白组装[38].DYRK1A的表达较为广泛,在卵巢癌和胰腺癌的特定病例中有扩增DYRK1B基因和对它的依赖而不是DYRK1A[33,37,39].DREAM的组装与RB家族蛋白p130的表达增加相一致,p130是静止的标志[33,38].总的来说,这些研究表明DYRK1激酶家族成员在应激反应诱导的静止中具有重要作用。有趣的是,DYRK激酶在癌症休眠中的作用主要是通过对卵巢癌细胞的研究而开发的,而在乳腺癌或前列腺癌的单独休眠细胞中的平行作用尚未被报道。
的MYC癌基因在多种癌症类型中过度表达或过度激活[40],包括HGSOC [41,42].它的活性与静止不相容,在休眠的癌细胞或对治疗有抗药性的残留疾病中,它的表达基本不存在。Downregulation的MYC在许多实验模型中诱导休眠和化疗耐药[43,44,45,46].使用FBXW7或NFATC4降低其在休眠状态下表达的MYC调控途径也在文献中出现[32,47].鉴于MYC在增殖中的关键作用和在静止状态下失活的必要性,关于其在休眠状态下的调控仍有许多有待了解的地方。
负增长控制在休眠中的广泛重要性表明它是灭活根除残留疾病的一个有吸引力的目标。然而,它的去除表明,促进增殖的致癌途径可能恢复细胞周期进程,导致恶性肿瘤。对卵巢癌细胞休眠过程中DYRK1A和DREAM成分缺失的体外研究表明,短暂的DNA复制之后是快速的细胞死亡,没有持续增殖的证据[33].此外,在有条件的成年小鼠突变体中,DREAM组装的缺失表明其在正常组织中对细胞静止的贡献的丧失是可以容忍的,没有增殖的证据[48].这些研究表明,针对负生长控制可能是可行的抗休眠治疗方法。最终,需要在可靠的临床前休眠模型中测试特定的药物,这类工作仍未报道。
处于休眠状态的信号通路依赖
PI3K-AKT-mTOR通路是人类癌症中最广泛突变和激活的信号通路之一。它具有促进细胞增殖、mRNA翻译、阻断细胞凋亡、增强细胞活力和迁移、促进上皮-间充质转化、调节自噬等作用[49].然而,进入休眠通常伴随着这一信号通路的减少。在乳腺癌休眠时,弥散性肿瘤细胞被发现具有低Ser473磷酸化akt,即使分离培养和重新扩增时也是如此[50].类似地,休眠的鳞状癌细胞在使用不同的途径激活mTOR的同时降低了AKT的磷酸化,从而使来自PI3K的增殖信号被抑制以促进细胞休眠,同时保持细胞活力[51].对结肠癌细胞的研究表明,进入休眠而不是发生凋亡高度依赖于AKT信号的减少而不是完全丢失[52].总体而言,PI3K对AKT的影响在休眠状态下下调,而来自mTOR的生存信号通常持续。
PI3K-AKT-mTOR通路突变,如激活错义突变PIK3CA或PTEN在HGSOC中很少观察到缺失[42].然而,在大多数HGSOC肿瘤中,其他拷贝数事件确实会导致PI3K信号能力的增强[42].在球状体中,AKT介导的PI3K信号活性持续且明显降低[7].尽管AKT活性可被预期在悬浮状态下支持HGSOC细胞存活以阻断anoikis,但其反直觉的下调对于推动HGSOC球体中至少两个关键现象至关重要:细胞静止和自噬[7,53,54].
已经并将继续有许多使用PI3K/mTOR抑制剂的临床试验,包括用于上皮性卵巢癌的临床试验。这种策略可能是由非hgsoc卵巢组织型中该途径激活驱动突变的优势驱动的[2].然而,HGSOC球体的临床前实验数据表明,这种治疗策略可能会诱导肿瘤休眠[7].由于这些抑制剂策略通常在复发铂耐药的患者中进行测试,因此可能已经错过了适当的机会窗口。PI3K/mTOR通路抑制也可能通过支持休眠来延长无进展生存期;然而,使用这种靶向药物的长期维持治疗可能会产生除卵巢癌中已经普遍存在的铂耐药之外的其他耐药疾病机制的出现[55].
当恶性细胞从原发肿瘤分离并扩散到远处时,它们通常会引发应激反应。由于HGSOC在腹膜腔内的独特进展,涉及其转移的固有细胞机制可能不同于其他癌症。当转移的HGSOC细胞分离成悬浮液,以及被剥夺生长因子、ECM成分、营养物质和氧气时,会触发细胞内应激信号。监测这些应激源的关键途径是肝激酶B1 (LKB1)和amp活化蛋白激酶(AMPK)信号通路(图。2A). AMPK作为一个关键的枢纽激酶,通过从合成代谢转向更多的分解代谢表型,重新编程癌细胞的整体代谢[56].因此,AMPK信号在能量和底物耗尽的癌细胞中产生了新的能量生产底物。AMPK激活通常需要低水平的ATP来促进其催化亚基t -环的变构转移和随后的苏氨酸磷酸化。事实上,HGSOC球体具有降低的细胞内线粒体氧化还原电位和ATP水平,并伴随AMPK磷酸化和活性的增加[27,57].然而,HGSOC球形细胞并不利用典型的LKB1活性磷酸化AMPK,而是利用钙钙调素依赖的激酶激酶β (CAMKKβ) [27],尽管LKB1是球状体存活所必需的[27,57].在EOC球体中,AMPK活性介导的一个主要下游效应是诱导巨自噬。AMPK的表达和活性,特别是由CAMKKβ控制的AMPK表达和活性,是诱导HGSOC球体自噬所必需的[58].在营养受限的条件下,AMPK活性还通过诱导细胞停滞来控制细胞增殖[57].在球形内的HGSOC细胞中,AMPK激活导致细胞停滞,除了观察到的AKT下调外,它可能有助于休眠表型。
虽然应激信号介质LKB1可能不是控制HGSOC球形细胞中AMPK所必需的,但它对球形细胞的活力和转移进展仍然至关重要[27],强调了未来研究的重要领域。目前,AMPK和LKB1在其他癌症类型或传播部位的休眠中所起的作用尚不清楚。这是诱人的推测,从卵巢癌休眠机制的见解可能会产生新的共性的细胞信号事件在肿瘤休眠更广泛。
自噬和休眠特异性代谢
大多数疾病部位的原发肿瘤利用糖酵解来促进生长和增殖,这种现象被称为Warburg效应[23].已知弥散性癌细胞从糖酵解代谢转变为依赖于脂肪酸氧化的代谢,最终氧化磷酸化以满足能量需求[59,60].毫不奇怪,这些细胞在代谢上也依赖于抗氧化程序来生存,从而产生活性氧[61,62].播散性癌症中的这些代谢适应是否反映了真正的休眠尚不清楚。大多数描述休眠癌细胞代谢变化的文献都是基于卵巢癌的研究[14,22].他们描述了HGSOC球体向脂肪酸氧化的代谢转变,并促进休眠表型,增加悬浮状态下的细胞存活率[63].在更广泛的肿瘤休眠背景下,代谢变化可能是对原发肿瘤中先前营养来源损失的反应,或者是在新的休眠环境中需要替代营养物质[11],提出了一个问题,不同的休眠模式是否可能有相同的代谢需求。
巨自噬,又称自噬,是细胞器、大分子和某些情况下病原体的一般细胞内降解过程。通常情况下,自噬是一种在营养匮乏和类似饥饿的条件下普遍存在的应激诱导现象,以促进产生用于能量生产的替代基质[64].自噬在早期恶性状态下具有抑制肿瘤的活性,因为它可以驱动衰老或细胞死亡。然而,它被广泛认为是在无血管肿瘤缺氧、快速生长肿瘤营养和生长因子耗竭或面对化疗和放疗时促进癌细胞存活的关键机制[64].
自噬在HGSOC球体中被迅速诱导(图。2A),这是由两条反平行信号通路驱动的,即AKT的下调和AMPK的上调,这两条反平行信号通路在前面的信号部分已经介绍过了[53,58].最近,AMPK的一个主要靶点,即自噬起始复合体(AIC)中的unc51样蛋白激酶1 (ULK1)被激活,并被证明是HGSOC球体存活所必需的[65].自噬是维持细胞在球形内存活所必需的,但它具有更广泛的意义,因为已知它可以促进其他癌症在休眠状态下的化疗耐药性。此外,自噬直接参与了卵巢肿瘤转移过程中的生长,特别是通过肿瘤抑制因子的表达和活性ARHI,一种RAS家族蛋白,其信号通路可维持异种移植物肿瘤细胞的休眠状态[66,67].
当与上面关于信号机制的部分一起考虑时,我们的知识中有许多重要的差距是显而易见的。首先,目前尚不清楚在卵巢以外的癌症休眠模式中,自噬机制是否或在多大程度上受PI3K-AKT和AMPK-ULK1的控制。类似地,HGSOC球形生物学的各个方面都表明依赖于脂肪酸代谢和活性氧的中和,但它不像在其他残留疾病范式中那样被建立起来。例如,据报道,脂质去饱和对HGSOC中茎状球形细胞的生物学至关重要,这可能与肿瘤休眠有关[68].未来在这一领域的努力有望揭示细胞休眠中常见代谢原理的更统一的观点。
鉴于上述PI3K通路抑制的挑战,自噬可能提供了一个更直接的结果,细胞信号在休眠作为治疗靶点。大多数针对晚期人类癌症自噬的临床试验使用羟氯喹,可能是因为它在疟疾预防和类风湿关节炎中使用的已知安全性[69].羟氯喹通常与化疗或放疗联合进行测试,因为这些是已被证明能诱导细胞保护性自噬的标准治疗方法。不幸的是,在这种情况下使用一般的溶酶体靶向药物存在局限性,而且很少有临床试验显示使用羟氯喹对自噬抑制有任何有益作用[70].鉴于自噬在MRD中类似休眠条件下维持细胞存活的功能,也许未来的临床前研究应该解决直接自噬抑制的重要性,特别是在休眠而不是进展性疾病的情况下。
休眠状态下上皮细胞向间充质转化和干细胞特征
细胞因子的转化生长因子- β (TGFβ)超家族在人类癌症中具有广泛的意义,具有上下文肿瘤抑制和促进转移的作用[11].一般来说,TGFβ家族成员(包括骨形态发生蛋白)已被证明在骨壁龛中产生,其信号抑制增殖并刺激休眠[71,72,73].在癌细胞扩散的情况下,这些信号可以解释为EMT支持[11],从而使这些细胞具有适应性的表型,可以促进转移。
使用HGSOC球体的研究已经观察到骨形态发生蛋白(BMP)和TGFβ信号之间的相互表达和活性(图2)。2A),前者在椭球体中减少,后者在椭球体中增加[74,75].这些互反信号活动是高效球体形成和完整性所必需的,可能是通过诱导和维持上皮-间充质可塑性[75].类似于球形中AKT活性差异介导的休眠-增殖开关[7],这种EMT表型的TGFβ信号控制在球体再附着时是可逆的[75].这种重新附着球状体的能力可能解释了转移性HGSOC细胞在原发和继发肿瘤中都具有上皮标记物的表达,但在活跃扩散期间球状体中有更多的间充质标记物[6].我们认为这种可塑性对于晚期HGSOC独特的腹膜环境中继发性病变的有效扩散和建立至关重要。
罕见的休眠癌细胞能够启动新的临床可检测的转移,这表明休眠和干细胞样表型是密切相关的。最近对弥散性癌细胞的研究表明,WNT信号的负调控抑制了增殖,并阻止了血管周围生态位的免疫检测[76].这一发现表明,与干细胞相关的调控途径有助于弥散性癌细胞的行为。在卵巢癌中,有新的证据表明,至少在HGSOC球体中存在的一些细胞具有茎样特性。研究表明,在卵巢癌球体中,去饱和脂肪酸积累与SOX2、Nanog和OCT4干细胞转录因子和标记物ALDH1A1的高表达有关[68].抑制脂肪酸去饱和酶会降低NFκB活性和这些干细胞标志物的表达。ALDH1A1的表达同样依赖于β-catenin的表达,特别是在球形细胞中,而不是在粘附的单层培养中[77,78].实验小分子抑制剂抑制ALDH1A1酶活性可杀死球形细胞[77,79],进一步表明休眠球状体含有癌症干细胞样细胞,这对促进转移至关重要。
贯穿本综述的一个主题是,HGSOC和其他疾病位点之间存在着共同的控制休眠的途径。TGFβ家族和WNT信号通路在EMT和休眠干细胞生物学中起关键作用。同样,这些通路在HGSOC球体中的作用也有不同的方面,这就提出了将一种疾病位点范式中的发现应用于另一种范式的问题。然而,在不同疾病部位的肿瘤休眠研究表明,TGFβ和WNT信号通路是靶向休眠的治疗干预的候选。因此,了解肿瘤休眠的疾病部位特定方面的微妙机制差异可能对未来成功使用休眠定向治疗至关重要。
微环境和免疫细胞与休眠细胞的相互作用
对休眠癌细胞生态位的研究强调了这些细胞居住的三个主要位置[22].血管周围的生态位是一个常见的位置,它靠近毛细血管床,表明播散的癌细胞从血液外渗后到达这个位置。在骨骼中,循环的癌细胞可以与造血干细胞竞争并占据它们的生态位[22].数据表明,它们可以竞争相同的配体-受体相互作用,因为CXCR4阻断剂破坏了与CXCL12的相互作用,并将休眠的乳腺癌细胞和造血干细胞释放到循环中[80,81,82].最后,同样在骨内,来源于实性或血行性原发肿瘤的休眠细胞可占据成骨细胞生态位[15].除了与生态位的物理相互作用外,休眠癌细胞还与免疫系统相互作用以逃避检测并在这些位置存活[22].
这些例子之间很难看出共同点,因为每个微环境都涉及不同的细胞-细胞接触和由不同细胞因子介导的信号事件[22].这些休眠细胞-生态位特异性相互作用的复杂性和特异性可能最好地说明了密切相关的TGFβ家族成员在不同生态位之间的相反作用。具体而言,肺内驻留内皮细胞建立的血管周围生态位利用Thrombospondin-1诱导新播散的乳腺癌细胞的静止[83,84].最终血管发芽激活TGFβ1,进而刺激这些休眠癌细胞恢复增殖[84].另外,弥散到骨的头颈部鳞状细胞癌依赖TGFβ2进入静止状态,而该信号轴的破坏会诱导该位置的转移性生长[71].
所有位置的休眠癌细胞都有一个共同的结果,即逃避免疫系统的消灭[14].在某些情况下,与免疫细胞的相互作用有助于形成休眠微环境。已知在一些疾病部位的情况下,生长受阻的癌细胞会下调I类MHC的表达[22].这使癌细胞不受细胞毒性免疫细胞的影响,而细胞毒性免疫细胞通常可能被癌细胞显示的“外来”表位激活。此外,t调节细胞和巨噬细胞可以通过干扰素γ (IFNγ)的产生来促进免疫抑制微环境[14,22],而IFN信号通路可在癌细胞休眠时抑制生长[14].鉴于罕见的弥散细胞所占据的特定休眠微环境的复杂性[15],因此,HGSOC球体的休眠生态位预计也具有类似的不同也就不足为奇了。
来自HGSOC患者的球状体代表了一个独特的微环境,它是可移动的,具有独立的特征,对于卵巢癌的生存和扩散至关重要(图2)。2B).球形包含从原发肿瘤部位释放出来的HGSOC癌细胞。这些细胞由成纤维细胞、t细胞和巨噬细胞加入,这些细胞有助于形成休眠细胞生态位[85,86].一些证据表明,HGSOC细胞和它们的球形相关巨噬细胞形成了一种共生关系,促进癌细胞存活并最终导致疾病进展(图)。2A).巨噬细胞提供WNT和EGF配体向附近的癌细胞发出信号[9,10],而卵巢癌细胞产生WNT激活M2巨噬细胞[87].这有助于细胞-细胞粘附和癌症干细胞表型,有助于球形形成和疾病传播,以及化疗耐药性[88].此外,免疫抑制巨噬细胞以WNT途径依赖的方式被招募到球状体[89].腹水中高水平的WNT配体也可预测卵巢癌的疾病进展[90].这些研究说明了巨噬细胞和HGSOC细胞之间的相互依赖关系。此外,成纤维细胞向球形HGSOC细胞贡献EGF,进一步促进疾病传播[86].在HGSOC细胞微环境中也检测到t细胞,巨噬细胞对t细胞的吸引与患者更长的生存期相关[85].此外,据报道,低CD47在HGSOC干细胞上的表达使它们容易受到免疫清除,但球形中大量的非茎类HGSOC细胞有助于保护这些细胞免受常驻免疫系统的侵害[91].总的来说,球形微环境是一个复杂的结构,其中三维结构和不同的细胞群有助于其休眠和传播的生物学特性。
HGSOC休眠与其他实体肿瘤的另一个区别是,原生球形病理生物学能够通过腹腔内与间皮表面的独特相互作用实现转移扩散。这些相互作用涉及细胞-细胞信号,其中HGSOC细胞激活间皮以帮助附着和浸润[10]和间皮清除过程中的细胞-基质相互作用[5,92(图。2B).附着球体驱动的肌球蛋白衍生力的产生有助于清除间皮细胞,使其浸润到底层间质[8].网膜是HGSOC转移最常见的部位,该器官有许多常驻细胞类型、生长因子和营养物质,可能会影响HGSOC的休眠[5].大网膜特异性生长因子,如脂肪因子,通过AMPK活性重新编程HGSOC细胞代谢,并可能与逆转休眠样表型有关,从而在该次要部位重新建立肿瘤生长[93,94].这些例子进一步说明了HGSOC球形微环境的独特方面,有助于最终从休眠中出现并恢复增殖以产生转移。
结论卵巢癌靶向休眠期的治疗意义
影响晚期HGSOC患者无进展生存率和总生存率的最重要因素是在积极减细胞手术和联合化疗后达到最低水平的残留疾病[1,4].当然,在MRD的背景下,靶向并根除HGSOC休眠细胞的其他治疗策略可能会进一步提高生存率。从这个角度来看,关键问题是如何利用休眠作为一种治疗弱点来杀死残留的HGSOC细胞或加强它们的休眠表型。
流行病学资料显示糖尿病药物二甲双胍对卵巢癌有保护作用[95];由于二甲双胍影响线粒体呼吸链并刺激AMPK活性,其作用机制可能包括维持肿瘤细胞休眠。PI3K/mTOR通路活性的复杂性可能使其一般抑制对促进HGSOC的休眠作用减弱,但特定的下游成分可能是更有吸引力的靶点。例如,AKT抑制剂与抑制自噬的药物联合使用将更专注于PI3K信号在休眠状态下的最相关方面[53].作为针对休眠进展进行测试的新策略,其实施将需要对可能出现的阻力机制有新的见解,以便判断其潜在的好处。
大多数研究表明,肿瘤休眠在疾病晚期的背景下,作为一种逃避治疗损伤或免疫介导清除的机制。然而,HGSOC肿瘤细胞在疾病进展早期有能力从输卵管扩散,早在休眠机制影响治疗耐药性之前。HGSOC早期播散的概念尤其相关,因为有证据表明,恶性前浆液性输卵管上皮内癌(STIC)病变的细胞会扩散到卵巢,或在极少数情况下直接扩散到腹膜[18].HGSOC病因学中的一个关键问题是,这些早期的、输卵管来源的弥散性细胞是否遵循与本文所述的晚期休眠范式相似的休眠途径。如果他们这样做,那么当早期疾病的检测成为可能时,休眠可能是另一个关键的靶点。不幸的是,涉及小鼠输卵管上皮的HGSOC启动实验模型在文献中仍然相对罕见[96,97,98,99],而且还需要获得癌前临床STIC标本来推进这一领域的研究。
肿瘤休眠的概念在许多人类癌症中具有广泛的意义,并可能影响获得持久治疗反应的能力。然而,我们认为简化主义者试图用单一的定义来描述它,或者用一套针对所有疾病部位的特定标准来描述它是适得其反的。在这篇综述中,我们强调在癌症类型之间有许多共同的休眠要素,但潜在的分子机制在不同的疾病部位之间往往是不同的。意识到休眠疾病位点范式之间的相似性可能会通过研究人员之间的思想交叉受精来加速我们的理解。同时,我们从这篇综述中得出结论,休眠范式之间的差异是广泛的,因此在不同肿瘤类型中接受这种多样性的发现对该领域的进一步发展也是至关重要的。我们希望通过总结晚期HGSOC背景下的肿瘤休眠获得的一些知识,对研究其他恶性肿瘤和转移位点的类似范式有价值。
数据和材料的可用性
不适用。
缩写
- 3 d:
-
三维
- ALDH1A1:
-
乙醛脱氢酶1A1
- AMPK:
-
amp活化蛋白激酶
- ARHI:
-
再生障碍性发育Ras同源成员I
- CAMKKβ:
-
钙/钙调素依赖性蛋白激酶激酶β
- CD47:
-
分化簇47
- CDK:
-
细胞周期蛋白依赖性激酶
- CDKN:
-
周期蛋白依赖性激酶抑制剂
- CXCL12:
-
趋化因子配体12
- 趋化因子受体CXCR4:
-
C-X-C趋化因子受体4
- 梦想:
-
二聚体伙伴(DP):视网膜母细胞瘤(RB)样,E2F和MuvB
- DYRK:
-
双特异性酪氨酸调节激酶
- ECM:
-
细胞外基质
- 表皮生长因子:
-
表皮生长因子
- EMT:
-
Epithelial-to-mesenchymal过渡
- 兵:
-
细胞外信号调节激酶
- HGSOC:
-
高级浆液性卵巢癌
- 干扰素γ:
-
干扰素γ
- LKB1:
-
肝激酶B1
- MAPK:
-
丝裂原活化蛋白激酶
- MHC:
-
主要组织相容性复合体
- MRD:
-
微小残留疾病
- mTOR:
-
雷帕霉素的哺乳动物/机制靶点
- NFκB:
-
核因子B
- PI3K:
-
磷酸肌醇3-kinase
- 核:
-
RNA携带
- SKP2:
-
s期激酶相关蛋白2
- 不现实:
-
浆液性输卵管上皮内癌
- TGFβ:
-
转化生长因子
- ULK1:
-
类unc51蛋白激酶1
- WNT:
-
无翼相关整合网站
参考文献
莱乌拉斯,高利C,维哥特I,奥扎AM。上皮性卵巢癌。柳叶刀》。2019;393(10177):1240 - 53年。
史爱明。卵巢癌发生的二元模型:回顾、修订和扩展。中国生物医学工程学报。2016;26(4):344 - 344。
Bowtell DD, Bohm S, Ahmed AA, Aspuria PJ, Bast RC, Jr., Beral V,等。重新思考卵巢癌II:降低高级别浆液性卵巢癌的死亡率。中华癌症杂志,2015;15(11):668-79。
莱乌鲁,布朗斯坦,奥扎。上皮性卵巢癌:精准医疗时代的管理演进。中华癌症杂志2019;69(4):280-304。
卵巢癌的发展和转移。中华流行病学杂志。2010;29(3):344 - 344。
Shield K, Ackland ML, Ahmed N, Rice GE。卵巢癌转移中的多细胞球体:生物学和病理学。中华妇产科杂志,2009;29(1):344 - 344。
Correa RJ, Peart T, Valdes YR, DiMattia GE, Shepherd TG。AKT活性的调控与腹水来源的卵巢上皮性癌球状体的可逆休眠有关。致癌作用。2012;33(1):49-58。
Iwanicki MP, Davidowitz RA, Ng MR, Besser A, Muranen T, Merritt M,等。卵巢癌球体利用肌球蛋白产生的力量来清除间皮。癌症杂志,2011;1(2):144-57。
陈文伟,杨树生,钱明明,华春明,吴佳杰,肖明明,等。STAT3-miRNA-92-Wnt信号通路调控卵巢癌的球形形成和恶性进展。癌症研究,2017;77(8):1955-67。
尹敏,李霞,谭松,周海杰,纪伟,Bellone S,等。卵巢癌早期经体腔转移过程中肿瘤相关巨噬细胞驱动球体形成。中国临床医学杂志,2016;29(4):357 - 357。
马志刚,王志刚。转移起始细胞与生态系统。中国生物医学工程学报,2015;29(4):344 - 344。
潘TG,裘槎派。休眠的癌细胞生命周期。癌症杂志,2020;20(7):398-411。
叶AC, Ramaswamy S.癌细胞休眠机制——癌症的另一个标志?癌症杂志2015;75(23):5014-22。
索萨MS, Bragado P, Aguirre-Ghiso JA。播散性癌细胞休眠机制:一个觉醒场。中华癌症杂志,2014;14(9):611-22。
萨莫斯文学硕士,麦克唐纳文学硕士,裘槎派。转移中的癌细胞休眠。冷泉哈布远景医院,2020年。https://doi.org/10.1101/cshperspect.a037556.
张晓明,张晓明,张晓明,等。肿瘤细胞休眠与应激反应机制的关系。F1000Res。2017; 6:2134。
Bergsten TM, Burdette JE, Dean M.输卵管引发高级别浆液性卵巢癌和卵巢转移:机制和治疗意义。癌症杂志2020;476:152-60。
马凯德,潘,陈志强,陈志强,等。卵巢癌进展的基因组学揭示了不同的转移轨迹,包括上皮内转移到输卵管。癌症杂志,2016;6(12):1342-51。
埃西托N,托纳M,马赫斯瓦兰S,哈伯DA。转移途中:循环肿瘤细胞群和上皮细胞向间质细胞转变。癌症杂志2015;1(1):44-52。
李志强,李志强,李志强,等。上皮性卵巢癌实验模型。致癌基因。2014;33(28):3619 - 33所示。
Recasens A, Munoz l靶向癌细胞休眠。药理学进展,2019;40(2):128-41。
戈达德ET,博兹奇I,里德尔SR,加贾尔CM。休眠的肿瘤细胞,它们的生态位和免疫的影响。中国生物医学工程学报,2018;20(11):1240-9。
Hanahan D, Weinberg RA。癌症的特征:下一代。细胞。2011;144(5):646 - 74。
Aguirre-Ghiso JA, Estrada Y, Liu D, Ossowski L. ERK(MAPK)活性与肿瘤生长和休眠的关系p38(SAPK)调节。癌症,2003;63(7):1684-95。
Aguirre-Ghiso JA, Liu D, Mignatti A, Kovalski K, Ossowski L.尿激酶受体和纤维连接蛋白调节ERK(MAPK)和p38(MAPK)活性比值,决定癌细胞在体内的增殖或休眠。Mol生物细胞,2001;12(4):863-79。
agirre - ghiso JA, Ossowski L, Rosenbaum SK.细胞外信号调节激酶和p38通路的绿色荧光蛋白标记揭示了原发性和转移性生长过程中通路激活的新动态。癌症决议2004;64(20):7336-45。
Buensuceso A, Ramos-Valdes Y, DiMattia GE, Shepherd TG。不依赖ampk的LKB1活性是卵巢癌有效转移的必要条件。Mol Cancer res 2019。https://doi.org/10.1158/1541-7786.MCR-19-0530.
王勇,王志强,王志强,王志强,等。弥散性肿瘤细胞的表型异质性是由原发性肿瘤缺氧微环境所预设的。中国生物医学工程学报,2017;19(2):120-32。
刘勇,吕娟,刘娟,梁霞,金霞,谢娟,等。STAT3/p53通路激活破坏ifn - β诱导的肿瘤再生细胞休眠。中国临床医学杂志,2018;29(3):344 - 344。
Barkan D, Kleinman H, Simmons JL, Asmussen H, Kamaraju AK, Hoenorhoff MJ,等。通过靶向细胞骨架抑制单个休眠肿瘤细胞的转移生长。癌症研究,2008;68(15):6241-50。
刘勇,吕娟,梁旭,殷霞,张玲,陈东,等。纤维蛋白硬度通过cdc42驱动的tet2表观遗传程序介导肿瘤再生细胞的休眠。癌症决议2018;78(14):3926-37。
张伟,任志,贾琳,李霞,贾霞,韩云。Fbxw7和Skp2在肺腺癌中调节干细胞在静止和有丝分裂之间的切换。生物医学杂志2019;2019:9648269。
MacDonald J, Ramos-Valdes Y, Perampalam P, Litovchick L, DiMattia GE, Dick FA。一项对负生长控制的系统分析表明,梦复合体与癌细胞休眠有关。中华肿瘤杂志,2017;15(4):371-81。
DYRK家族蛋白激酶在细胞周期控制中作为蛋白质稳定性调节器的新作用。中国生物医学工程学报。2012;11(18):3389-94。
Thompson BJ, Bhansali R, Diebold L, Cook DE, Stolzenburg L, Casagrande AS,等。DYRK1A通过破坏Cyclin D3的稳定来控制淋巴细胞发育过程中从增殖到静止的转变。中华检验医学杂志,2015;29(6):344 - 344。
邹艳,eston DZ,邓X, Mercer SE, Friedman E. Mirk/dyrk1B激酶在苏氨酸288位点的磷酸化使cyclin D1不稳定。中国生物医学工程学报,2004;26(2):339 - 339。
邓X, Mercer SE, Shah S, Ewton DZ, Friedman E.周期蛋白依赖性激酶抑制剂p27Kip1通过Mirk/dyrk1B激酶在G(0)中稳定。中国生物医学工程学报,2004;29(4):344 - 344。
Litovchick L, Florens LA, Swanson SK, Washburn MP, DeCaprio JA。DYRK1A蛋白激酶通过DREAM复合物组装促进静态和衰老。基因开发,2011;25:8 1 - 13。
eston DZ, Hu J, Vilenchik M, Deng X, Luk KC, Polonskaia A,等。mirk/dyrk1b激酶失活靶向静止的胰腺癌细胞。中华癌症杂志,2011;10(11):2104-14。
王志强,王志强,王志强,王志强。MYC,新陈代谢和癌症。中国癌症杂志,2015;5(10):1024-39。
Jung M, Russell AJ, Kennedy C, Gifford AJ,澳大利亚卵巢癌研究,Mallitt KA,等。Myc家族癌基因畸变在上皮性卵巢癌中的临床意义。中国癌症杂志,2018;2(3):pky047。
癌症基因组图谱网络。卵巢癌的综合基因组分析。大自然。2011;474(7353):609 - 15所示。
杜晓东,王晓东,王晓东,等。抑制myc活性的胚胎滞育样适应使肿瘤治疗持续。中国生物医学杂志,2018;39(2):240-56 e11。
劳森,Bhakta NR, Kessenbrock K, Prummel KD, Yu Y, Takai K,等。单细胞分析揭示了人类转移性乳腺癌细胞中的干细胞程序。大自然。2015;526(7571):131 - 5。
Scognamiglio R, Cabezas-Wallscheid N, Thier MC, Altamura S, Reyes A, Prendergast AM,等。Myc衰竭诱导多能休眠状态,模拟滞育。细胞。2016;164(4):668 - 80。
沙沙夫,柯佩尔曼,阿瓦尼蒂斯,卡尔松,比尔,曼德尔,等。MYC失活揭示肝细胞癌多能分化和肿瘤休眠。大自然。2004;431(7012):1112 - 7。
Cole AJ, Iyengar M, Panesso-Gomez S, O 'Hayer P, Chan D, Delgoffe GM,等。NFATC4促进卵巢癌的平静和化疗耐药。JCI Insight, 2020。https://doi.org/10.1172/jci.insight.131486.
Perampalam P, Hassan HM, Lilly GE, Passos DT, Torchia J, Kiser PK,等。破坏DREAM转录抑制因子复合物可诱导载脂蛋白过表达和小鼠系统性淀粉样变。J clinin Invest, 2021。https://doi.org/10.1172/JCI140903.
Fruman DA, Chiu H, Hopkins BD, Bagrodia S, Cantley LC, Abraham RT.人类疾病中的PI3K通路。细胞。2017;170(4):605 - 35。
Balz LM, Bartkowiak K, Andreas A, Pantel K, Niggemann B, Zanker KS,等。HER2/HER3/PI3K和EGFR/HER2/ plc -gamma - 1信号在乳腺癌细胞迁移和传播中的相互作用中华病毒学杂志,2012;26(2):344 - 344。
Schewe DM, Aguirre-Ghiso JA。atf6 α - rheb - mtor信号通路促进体内休眠肿瘤细胞存活。美国国家科学研究院。105(30): 10519 - 2008; 24。
Dey-Guha I, Wolfer A, Yeh AC, Darp JGA, Leon R,等。AKT调控的不对称癌细胞分裂。美国国家科学研究院。2011; 108(31): 12845 - 50。
Correa RJ, Valdes YR, Peart TM, Fazio EN, Bertrand M, McGee J,等。AKT抑制联合自噬阻断可有效降低腹水来源的卵巢癌细胞活力。致癌作用。2014;35(9):1951 - 61。
Correa RJ, Valdes YR, Shepherd TG, DiMattia GE。Beclin-1表达在高级别浆液性卵巢癌中保留,但在体外不是诱导自噬所必需的。J Ovar res 2015;8:52。
Klempner SJ, Myers AP, Cantley LC。我们编织了一张多么复杂的网:对磷酸肌醇3-激酶途径抑制的新兴抗性机制。中国癌症杂志,2013;3(12):1345-54。
Kottakis F, Bardeesy N. LKB1-AMPK轴重访。科学通报,2012;22(12):1617-20。
Peart T, Ramos Valdes Y, Correa RJ, Fazio E, Bertrand M, McGee J,等。完整的LKB1活性是休眠的卵巢癌球形瘤存活所必需的。Oncotarget。2015;6(26):22424 - 38。
王晓东,王晓东,王晓东,王晓东。camkkβ - ampk信号通路在卵巢肿瘤转移的球形模型中促进自噬。中国科学(d辑),2011;
黄玉华,田玲,王志强,王志强,等。Flura-seq在早期转移定殖过程中识别器官特异性代谢适应。Elife》2019。https://doi.org/10.7554/eLife.4362.
Davis RT, Blake K, Ma D, Gabra MBI, Hernandez GA, Phung AT,等。通过单细胞RNA测序揭示人类乳腺癌转移的转录多样性和生物能量转移。中国生物医学工程学报,2020;22(3):310-20。
Oren Y, Tsabar M, Cuoco MS, Amir-Zilberstein L, Cabanos HF, Hutter JC,等。循环的癌症持久细胞来自具有不同程序的谱系。自然。2021;596(7873):576 - 82。
张志强,张志强,张志强,等。氧化应激抑制人类黑色素瘤细胞的远处转移。自然。2015;527(7577):186 - 91。
金世勇,Gupta Vallur P, Jones VM, Worley BL, Shimko S, Shin DH,等。环境依赖的SIRT3激活对于卵巢癌细胞的锚定独立生存和转移是必要的。致癌基因。2020;39(8):1619 - 33所示。
自噬在肿瘤发生和能量代谢中的作用:白天是朋友,晚上是敌人。中国生物医学工程学报。2011;21(1):113-9。
辛哈B,拉斯基J,拉莫斯瓦尔德斯Y,刘娥,DiMattia GE,谢博德TG。抑制ULK1激酶会降低高级别浆液性卵巢癌球体的自噬和细胞活力。中国癌症杂志,2020;10(5):1384-99。
陆震,罗荣志,陆勇,张旭,于强,卡瑞寿,等。肿瘤抑制基因ARHI调节人卵巢癌细胞的自噬和肿瘤休眠。中华临床医学杂志。2008;29(12):344 - 344。
李志强,李志强,李志强,等。ARHI (DIRAS3)诱导自噬改变卵巢癌模型的基本代谢途径。BMC癌症杂志,2016;16(1):824。
李娟,Condello S, thomas - pepin J, Ma X,夏勇,Hurley TD,等。脂质去饱和是卵巢癌干细胞的代谢标志物和治疗靶点。细胞干细胞,2017;20(3):303-14 e5。
阿玛拉瓦迪RK, Kimmelman AC, Debnath J.靶向自噬在癌症:最新进展和未来的发展方向。中国癌症杂志,2019;9(9):1167-81。
肿瘤治疗中的溶酶体靶向药物。Oncotarget。2017;8(68):112168 - 9。
张志刚,张志刚,张志刚,张志刚,等。TGF-beta2通过TGF-beta-RIII和p38alpha/beta信号通路决定靶器官中弥散的肿瘤细胞命运。中国生物医学工程学报,2013;15(11):1351-61。
高虹,李林,李志强,李志强,等。BMP抑制剂Coco在肺转移部位重新激活乳腺癌细胞。细胞。2012;150(4):764 - 79。
小林A,奥田H,邢F,潘迪PR,渡边M,广田S,等。骨形态发生蛋白7在前列腺癌骨干细胞休眠和转移中的作用。中华检验医学杂志,2011;29(4):344 - 344。
Peart TM, Correa RJ, Valdes YR, Dimattia GE, Shepherd TG。BMP信号通路通过AKT激酶激活控制腹水来源的人上皮性卵巢癌球体的恶性潜能。临床分析。2012;29(4):293-313。
李志强,李志强,李志强,等。tgf - β信号通路调节卵巢癌腹水源性球状体上皮-间质可塑性中国癌症杂志,2016;23(3):147-59。
Malladi S, Macalinao DG, Jin X,何玲,Basnet H,邹勇,等。通过自分泌抑制WNT的转移潜伏期和免疫逃避。细胞。2016;165(1):45 - 60。
Condello S, Morgan CA, Nagdas S, Cao L, Turek J, Hurley TD,等。β - catenin调控的ALDH1A1是卵巢癌球体的靶点。致癌基因。2015;34(18):2297 - 308。
康黛罗,李志强,李志强,李志强,等。组织松氨酰胺酶调节卵巢癌干细胞和肿瘤小生境之间的相互作用。癌症决议2018;78(11):2990-3001。
吴nwani, Condello S, Wang Y, Swetzig WM, Barber E, Hurley T,等。一种新的ALDH1A1抑制剂靶向卵巢癌中具有干细胞特征的细胞。癌症(巴塞尔)。2019.https://doi.org/10.3390/cancers11040502.
李志强,李志强,李志强,等。休眠的乳腺癌微转移存在于特定的骨髓壁龛中,调节它们进出骨骼的转运。中国生物医学工程学报,2016;26 (4):340ra73。
张晓东,张晓东,张晓东,等。人类前列腺癌转移靶向造血干细胞生态位,在小鼠骨髓中建立立足点。中华临床医学杂志,2011;29(4):344 - 344。
Sugiyama T, Kohara H, Noda M, Nagasawa T.骨髓基质细胞生态位CXCL12-CXCR4趋化因子信号通路对造血干细胞库的维持。免疫力。2006;25(6):977 - 88。
王淑娟,王志强,高东,等。骨髓来源的Gr1 +细胞可以通过诱导分泌血栓反应蛋白-1产生抗转移的微环境。中国癌症杂志,2013;3(5):578-89。
贾贾尔,裴纳多,莫里,马泰,埃瓦森,等。血管周围生态位调节乳腺肿瘤休眠。中国生物医学工程学报。2013;15(7):807-17。
Worzfeld T, Finkernagel F, Reinartz S, Konzer A, Adhikary T, Nist A,等。蛋白质转录组学揭示卵巢癌微环境中的信号网络。分子细胞蛋白质组学。2018;17(2):270-89。
高强,杨震,徐松,李霞,杨霞,金鹏,等。异型caf -肿瘤球状体促进卵巢癌早期腹膜转移。中华检验医学杂志,2019;21(3):688-703。
在3D工程微环境中,卵巢癌干细胞和巨噬细胞通过WNT通路相互作用促进促肿瘤和恶性表型。中华免疫杂志,2019;7(1):190。
王勇,赵刚,康德洛,黄华,Cardenas H, Tanner EJ,等。卷曲-7鉴定易受铁下垂影响的耐铂卵巢癌细胞。癌症研究,2021;81(2):384-99。
宋敏,叶库OO, Rafiq S, Purdon T,董霞,朱林,等。肿瘤源性UBR5通过诱导免疫抑制巨噬细胞促进卵巢癌的生长和转移。网络学报。2020;11(1):6298。
Kotrbova A, Ovesna P, Gybel T, Radaszkiewicz T, Bednarikova M, Hausnerova J,等。腹水中WNT信号通路诱导活性预测卵巢癌预后不良。开展。2020;10(2):537 - 52。
张春林,吴春成,徐益东,徐玉春。由于CD47低表达,卵巢癌干细胞的免疫脆弱性受到周围大块肿瘤细胞的保护。Oncoimmunology。2020;9(1):1803530。
肯尼PA,李GY,比塞尔MJ。靶向肿瘤微环境。《生物科学》2007;12:3468-74。
Ladanyi A, Mukherjee A, Kenny HA, Johnson A, Mitra AK, Sundaresan S,等。脂肪细胞诱导CD36表达促进卵巢癌进展和转移致癌基因。2018;37(17):2285 - 301。
Nieman KM, Kenny HA, Penicka CV, Ladanyi A, Buell-Gutbrod R, Zillhardt MR,等。脂肪细胞促进卵巢癌转移,为肿瘤快速生长提供能量。中华外科杂志,2011;17(11):1498-503。
老药,新把戏:二甲双胍用于妇科癌症?中华妇产科杂志。2014;35(3):614-21。
翟勇,吴瑞,Kuick R, Sessine MS, Schulman S, Green M,等。高级别浆液性癌通过与人类疾病相关的缺陷在小鼠输卵管中发生。中华病理学杂志,2017;43(1):16-25。
Perets R, Wyant GA, Muto KW, Bijron JG, Poole BB, Chin KT,等。在Brca;Tp53;Pten模型中,输卵管分泌上皮的转化导致高级别浆液性卵巢癌。中华癌症杂志,2013;24(6):751-65。
马尼提E,伯拉托C,戈皮纳坦G,希斯O,科坦塔基P,拉克哈尼A,等。小鼠卵巢癌模型概括了人类肿瘤微环境和患者对治疗的反应。Cell rep 2020;30(2): 525-40 e7。
贾东,长冈Y,胜俣M, Orsulic S.炎症是卵巢癌细胞播种的关键因素。科学通报2018;8(1):12394。
确认
我们感谢Dominique Lanvin医生提供腹膜转移的图像。
作者的信息
TGS是伦敦地区癌症项目的卵巢转化肿瘤学科学家。他的实验室开创了球形细胞的分离和培养,并研究了球形细胞存活的信号和代谢机制。FAD是西部大学肿瘤抑制基因Wolfe高级研究员。他的实验室研究增殖控制机制及其对癌症的贡献。
资金
资金来源,他们对这篇文章的内容没有任何意见。
作者信息
作者及隶属关系
贡献
FAD和TGS研究并撰写了手稿。所有作者都已阅读并批准了最终稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
谢泼德,t.g.,迪克,F.A.:高级别浆液性卵巢癌中明显的休眠原则。细胞Div17, 2(2022)。https://doi.org/10.1186/s13008-022-00079-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13008-022-00079-y
关键字
- 肿瘤休眠
- 高级浆液性卵巢癌
- 球体
- 转移
- 细胞静止
- 应激适应信号
- 自噬
- 肿瘤微环境
- 微小残留疾病