摘要
背景
热休克因子1 (HSF1)是热休克反应的主调节因子,支持恶性细胞转化。最近的研究表明,HSF1可以在有丝分裂过程中访问热休克蛋白(HSPs)的启动子并允许HSP的表达。它还充当有丝分裂调节剂,控制染色体分离。在本研究中,我们研究了HSF1的转激活活性是否需要有丝分裂纺锤体的组装。
结果
我们的研究结果表明,在有丝分裂过程中,HSF1的丝氨酸326 (S326)位点的磷酸化及其激活活性增加。在有丝分裂过程中,抑制KRIBB11或CCT251263对HSF1的活化活性可显著增加有丝分裂细胞中异常纺锤体的比例。它还通过阻碍染色体微管母细胞的形成,阻碍了诺可达唑治疗和冲洗后纺锤体微管的重组。HSF1的缺失导致有丝分裂纺锤体组装缺陷,随后减弱细胞增殖和锚定依赖性细胞生长(AIG)。通过异位表达野生型HSF1或组成活性突变体(∆202-316,caHSF1),而不是S326A或显性阴性突变体(∆361-529,dnHSF1),可以挽救这些HSF1耗损诱导的效应。此外,HSP70的过表达部分减少了HSF1耗竭引起的纺锤体异常。这些结果表明,HSF1可能通过其转激活活性维持梭形体的完整性,从而支持细胞增殖和AIG。此外,抑制KRIBB11或CCT251236的HSF1转激活活性可以增强抗有丝分裂药物诱导的纺锤体缺陷和细胞死亡。
结论
在有丝分裂过程中,HSF1的活化活性增加似乎是有丝分裂纺锤体精确组装所必需的,因此支持细胞活力,可能还支持AIG。此外,抑制HSF1的转激活活性可能会增强抗有丝分裂药物诱导的有丝分裂错误和细胞死亡。
背景
热休克因子-1 (HSF1)是细胞对热和各种其他应激反应的主要转录调节因子[1].在对这些应激的反应中,不活跃的单体HSF1形成三聚体,并被过度磷酸化而变得具有转录活性。然后,活性HSF1结合靶基因的热休克元件(HSEs)[例如,热休克蛋白(HSP) 27, HSP70和HSP90],以驱动其表达[1].由此产生的热休克反应(HSR)的快速而强大的诱导涉及细胞适应和保护机制,可以对抗许多环境压力和病理生理条件[2].由HSF1协调的保守的全基因组转录程序不仅恢复了正常的蛋白质折叠环境,还调节信号通路和代谢网络,以增强细胞在各种应激下的生存能力[3.].除了对高敏感蛋白的作用外,HSF1还控制着许多其他基因的转录,这在很大程度上与温度无关。HSF1的许多非hsp靶基因都与各种生理过程有关[4].
HSF1参与致癌的几个步骤[5].广泛的癌症表现出高水平的核活性HSF1,这表明HSF1可能发挥致癌作用,并作为多种癌症的关键促进因子[6,7].此外,HSF1的激活与放疗反应差有关[8]和化疗耐药[9],表明HSF1是治疗结果的关键决定因素。值得注意的是,HSF1促进恶性肿瘤的功能可能超出其众所周知的蛋白质质量控制作用[10].
已有研究表明,HSF1可以在有丝分裂过程中访问HSP启动子并允许HSP表达[11],提示HSF1在有丝分裂过程中具有转录激活功能。也有研究表明,高表达HSP70 mRNA和蛋白的热应激有丝分裂细胞能更好地防止热诱导的有丝分裂错误[12].另一方面,与载体控制细胞相比,过表达优势阴性HSF1的PC3细胞在中期大部分被阻滞,对微管蛋白聚合抑制剂秋水胺更敏感[13].因此,HSF1可能帮助癌细胞克服异常有丝分裂及其细胞后果。此外,已知HSF1是酵母纺锤极体复制所必需的[14].在癌细胞中,HSF1在丝氨酸216处被polo样激酶1 (PLK1)磷酸化,导致它隔离Cdc20。这种隔离使Cdc20远离后期促进复合体/环体降解系统,从而干扰有丝分裂退出并促进癌细胞中的染色体错分离[15,16].这些研究表明,HSF1的转激活活性不仅在有丝分裂失败的情况下保护细胞,而且可能直接调节有丝分裂相关机制。在本研究中,我们探讨了HSF1在有丝分裂过程中的转激活活性是否对纺锤体组装和细胞对抗有丝分裂药物的敏感性具有重要意义。我们的研究结果表明,HSF1的转激活活性是纺锤体精确组装所必需的,它的抑制可以增强不同抗有丝分裂药物诱导的纺锤体缺陷和细胞死亡。
结果
在有丝分裂过程中,S326的磷酸化和HSF1的转激活活性增加
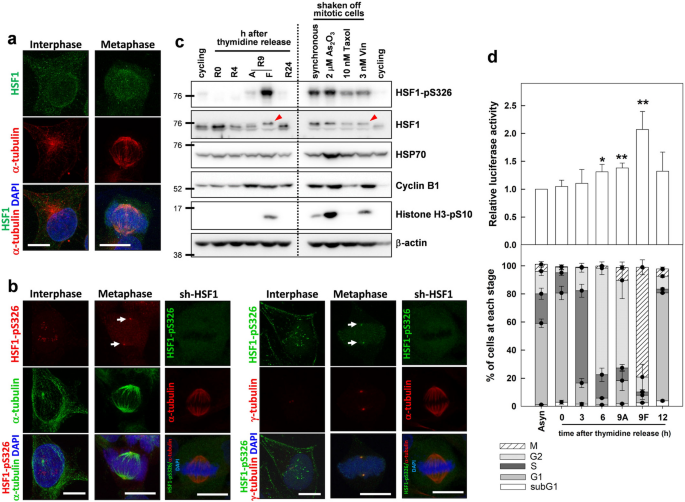
在有丝分裂过程中,HSF1已被证明与着丝粒和纺锤极共定位[15,16].因此,我们研究了HSF1是否在纺锤体组装中起作用。我们首先进行免疫荧光染色以检查HSF1在CGL2细胞(HeLa细胞/正常人成纤维细胞杂交体)中的细胞分布[17].HSF1在非应激期间期CGL2细胞中没有明显的分布(图。1但在有丝分裂CGL2细胞的纺锤体上观察到微弱的染色(图。1右面板)使用两种不同的HSF1抗体(ADI-SPA-901 Enzo Life Sciences;sc-9144圣克鲁斯科技公司)。两种抗体的结果相似。此外,无花果。1b显示,根据两种HSF1- ps326特异性抗体的免疫染色,丝氨酸326位点磷酸化的HSF1 (HSF1- ps326)显著积累在有丝分裂中心体(Fig. b)。1b左,Abcam ab76076染色;无花果。1b右侧用2092-5染色。HSF1缺失的细胞。1b. sh-HSF1)也用HSF1-pS326抗体进行染色,以检查抗体的特异性,结果显示,在耗尽的细胞中,phospho-HSF1的梭形极定位减弱,说明抗体具有特异性。免疫印迹分析显示HSF1-pS326蛋白显著升高(图。1c左)和HSF1的移动性转移(图。1c左,箭头)仅在双胸腺嘧啶阻滞释放9小时的培养物中分离的漂浮有丝分裂细胞(F)中。在附着细胞(A)或释放0或4小时的细胞中没有观察到这些影响,证实HSF1在S326位点磷酸化的诱导发生在有丝分裂过程中。细胞周期蛋白B1和丝氨酸10磷酸化的组蛋白H3 (H3- ps10)的表达升高证实了胸苷苷释放(R9A和R9F)后9小时细胞处于G2和有丝分裂阶段。这些发现与之前的一份报告一致,该报告显示HSF1在有丝分裂过程中分子量发生了变化[11].相应的,HSP70在漂浮有丝分裂细胞中的表达也略有增加。此外,HSF1-pS326和HSP70的水平在抗有丝分裂药物处理的有丝分裂细胞中升高。1c,对吧)。由于HSF1在S326位点的磷酸化对其转激活活性至关重要[18],我们的结果暗示HSF1可能在有丝分裂过程中具有转录活性。然而,在我们的研究中,在有丝分裂染色质的可及区域激活HSF1三聚体的数量可能太低,无法通过免疫荧光染色检测到。
HSF1的分布、表达和活性。一个代表性图像显示HSF1在CGL2细胞间期(左图)和中期(右图)的细胞分布。对数生长的细胞被固定,并用抗hsf1染色(绿色)。纺锤体微管用抗-α-微管蛋白反染(红色),染色体用DAPI反染(蓝色)。比例尺,10 μm。b具有代表性的图像显示了在间期和中期CGL2细胞中丝氨酸326位点磷酸化的HSF1 (HSF1- ps326)的细胞分布。用红色(左图,箭头)和绿色(右图,箭头)的两种HSF1-pS326抗体对细胞进行免疫染色,并分别用抗-α-微管蛋白或抗-γ-微管蛋白反染色。箭头表示HSF1-pS326抗体染色的斑点。用HSF1缺失的sh-HSF1细胞检测抗体特异性,并用相应的HSF1- ps326抗体(绿色部分)和α-微管蛋白(红色部分)免疫染色。cHSF1和HSF1- ps326在每个细胞周期阶段或药物阻断有丝分裂细胞中的水平。CGL2细胞在每个细胞周期阶段通过双胸苷激酶阻断和释放而富集,如本节所述方法,或按指示处理细胞24小时。然后用刮痧法收集细胞,或用抖落法收集有丝分裂细胞。收集的样本进行免疫印迹分析。红色箭头表示HSF1带移位。dHSF1在细胞周期各阶段的转激活活性。CGL2-A1A-Luc细胞在G1/S过渡时通过双胸腺嘧啶阻滞同步,然后在指定的时间从阻滞释放。然后收集细胞进行荧光素酶活性测定或流式细胞术分析。9A,胸苷激酶释放后9小时附着细胞。9F,胸苷激酶释放后9小时漂浮细胞。所示数据为三个独立实验的平均值±标准差。*p< 0.05和**p< 0.01的学生t测试与异步循环单元(Asyn)的比较
为了测试HSF1的转激活活性是否在有丝分裂阶段确实升高,在HSPA1A启动子的控制下,一个稳定的含有萤火虫荧光素酶的荧光素酶HSF1报告细胞CGL2细胞系[19]用于分析HSF1在每个细胞周期阶段的活性。数字1d(底部面板)显示了从双胸腺苷块释放后0、3、6、9和12小时的培养物中细胞周期每个阶段的细胞百分比。上面的面板显示了从双胸腺苷块释放后9小时富集的附着的G2 (9A)和漂浮的有丝分裂细胞(9F),其荧光素酶活性水平略高于其他细胞周期阶段的细胞。这一结果表明,HSF1的转激活活性在G2和有丝分裂阶段均有所增加,这与我们观察到的HSF1- ps326和HSP70在有丝分裂细胞中显著升高的结果是一致的(图1)。1c).综上所述,这些结果表明HSF1的转激活活性在有丝分裂过程中增加。
在有丝分裂过程中抑制HSF1的转激活活性可诱导纺锤体缺陷并干扰有丝分裂纺锤体的重组
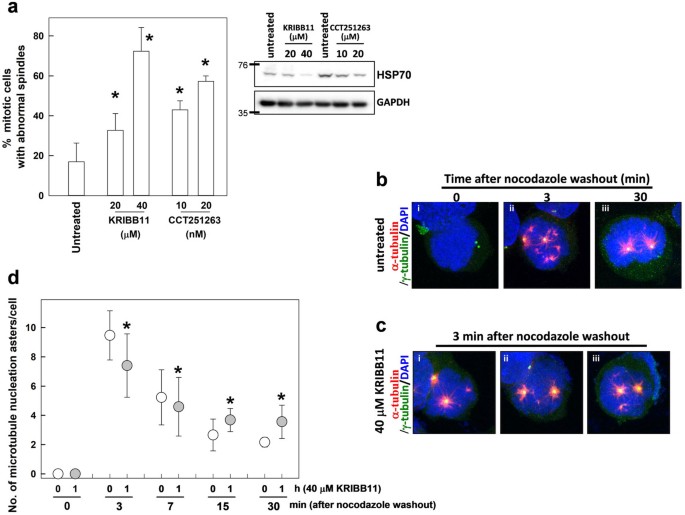
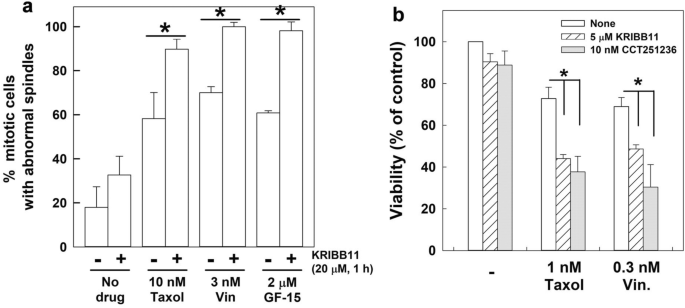
接下来,我们研究了HSF1的转激活活性是否需要在有丝分裂阶段进行纺锤体组装。为了抑制HSF1在有丝分裂阶段的转激活活性,并研究其对纺锤体组装的影响,用KRIBB11或CCT251236处理CGL2细胞1小时,这两者都是HSF1转激活的抑制剂[20.,21].然后立即分析有丝分裂细胞的有丝分裂纺锤体的组装。结果表明,KRIBB11或CCT251236处理1小时显著诱导有丝分裂纺锤体的缺陷。2a,左),表明HSF1的转激活活性是有丝分裂时纺锤体精确组装所必需的。将有丝分裂细胞从培养皿上抖下来收集,进行HSP70表达的免疫印迹分析。结果显示,HSP70在这些细胞中的表达明显降低(图1)。2a,右),表明HSF1活性被这些抑制剂降低。
在有丝分裂过程中抑制HSF1的转激活活性可诱导纺锤体异常并改变有丝分裂纺锤体的重组。一个在有丝分裂期处理KRIBB11和CCT251263可诱导有丝分裂纺锤体缺陷。用指示浓度的KRIBB11或CCT251263处理CGL2细胞1小时,并立即进行免疫荧光染色分析有丝分裂纺锤体。结果(平均±SD)来自三个独立实验中至少500个有丝分裂细胞。*p< 0.01的学生t-test与未处理对照组进行比较。处理后,也将有丝分裂细胞从板上抖下来,收集进行HSP70免疫印迹分析(右板)。b诺可达唑(3 μM作用0.5 h)冲洗0 (我), 3 (2)及30分钟(3).c40 μM KRIBB11处理CGL2细胞1 h;在KRIBB11处理的最后0.5 h,在3 μM的培养基中加入诺可达唑。然后完全洗去诺可达唑,在无药培养基中孵育细胞3分钟,然后立即固定并免疫染色α-微管蛋白(红色)和γ-微管蛋白(绿色)。用DAPI(蓝色)反染色。d细胞内微管紫菀的数量。从三个实验中确定的结果是每种条件下至少250个有丝分裂细胞的中位数±25个百分位。*p使用GraphPad Prism 9.1将每个中位数与未处理的kribb11对照中位数进行比较,Dunnett检验< 0.05
诺可达唑洗脱实验[22],以评估HSF1的转激活活性是否参与调控纺锤体组装的微管聚合。3 μM诺可达唑作用0.5 h后,有丝分裂的纺锤体完全解体,只剩下两个中心体(通过γ微管蛋白染色可见,图。2B-i,绿色),用抗α-和γ-微管蛋白抗体对有丝分裂纺锤体进行免疫荧光染色。在完全洗去诺可达唑并在无药培养基中重新孵育3分钟后,微管纤维(用α-微管蛋白染色可见,红色)逐渐在两个中心体周围形成大的紫癜,并在染色体内形成许多微小的紫癜。2b-ii)。30分钟后,染色体相关的微管母细胞消失,很可能合并到两个中心体母细胞中,双极有丝分裂纺锤体重组(图。2b-iii)。这一系列事件与先前的一份报告一致[23].然而,在KRIBB11存在的情况下,在诺可达唑洗脱后3分钟,染色体相关微管紫杉醇的数量明显低于非KRIBB11处理的细胞(图。2c和d)。此外,在诺可达唑冲洗后,kribb11处理的有丝分裂细胞中双极有丝分裂纺锤体的重组被推迟,因为在诺可达唑冲洗后15和30分钟,kribb11处理的细胞中微管孕母细胞的数量明显高于非kribb11处理的细胞(图)。2d).由于细胞依赖染色质驱动的微管组装形成双极纺锤体[23],这些结果表明HSF1的转激活活性是双极有丝分裂纺锤体组装所必需的。
HSF1的缺失诱导纺锤体异常,改变有丝分裂进程,并阻碍细胞增殖
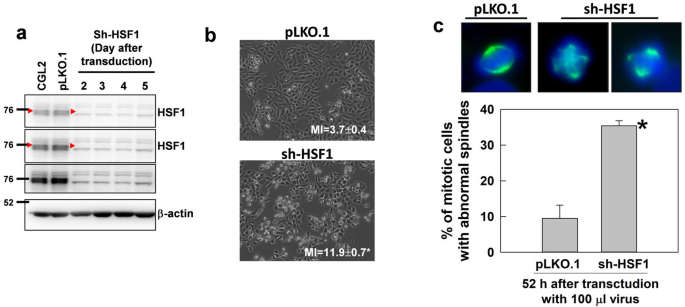
我们接下来测试了HSF1是否调节纺锤体组装,从而通过将含有HSF1特异性shRNA的病毒粒子转导CGL2细胞来影响细胞生长。数字3.a表明,含有靶向HSF1 shRNA的病毒粒子(sh-HSF1)转导CGL2细胞2-5天后,HSF1的表达有效降低。数字3.b显示对照病毒粒子(pLKO)转导后52 h时CGL2细胞的形态。1,上)和含有sh-HSF1的病毒粒子(下)。在HSF1缺失的培养物中,聚集细胞的部分和有丝分裂指数(MI)显著增加。3.b).此外,用α-微管蛋白抗体对有丝分裂纺锤体进行免疫荧光染色显示,在hsf1特异性shRNA转导细胞52 h后,可以检测到有丝分裂纺锤体的大量异常(图1)。3.c). MI的增加表明培养中有丝分裂细胞的积累或停滞,人们普遍认为有丝分裂的长度与细胞中有丝分裂错误的发生有关[11].因此,我们的结果可能表明HSF1水平降低的细胞更易发生有丝分裂错误。
HSF1的缺失导致纺锤体异常。一个HSF1的耗竭效率。用不含shRNA (pLKO.1)或hsf1特异性shRNA (sh-HSF1)的病毒粒子转导CGL2细胞。从转导后50小时开始,每天收集细胞,通过免疫印迹法分析HSF1耗损效率。红色箭头表示HSF1条带的位置。bCGL2细胞的代表性图像转导后52小时,病毒粒子不含shRNA (pLKO.1)或hsf1特异性shRNA (sh-HSF1)。在40倍放大的荧光显微镜下计数dapi染色的间期细胞和有丝分裂细胞来测定有丝分裂指数(MIs)。至少有1000个细胞被计数。所提供的数据是三个独立实验的平均值±SD。cHSF1耗竭导致纺锤体异常。细胞被转导如b免疫荧光染色进行有丝分裂纺锤体分析。代表性图像显示由含有pLKO的病毒粒子转导的CGL2细胞的有丝分裂纺锤体。1对照或HSF1 shRNA。结果(平均±SD)是从三个独立实验中至少300个有丝分裂细胞中确定的。*p< 0.01的学生t-测试与转导pLKO的细胞比较。1控制病毒粒子
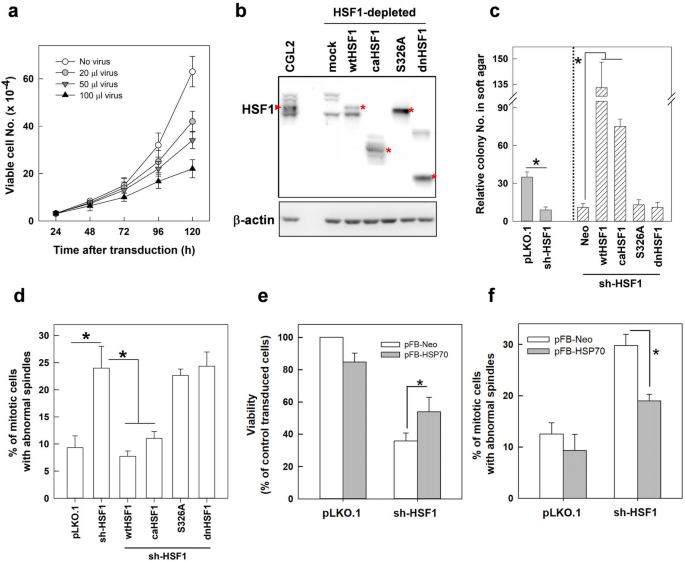
在hsf1特异性shRNA转导后52小时,诱导梭形体缺陷并改变有丝分裂进程,hsf1缺失细胞的增殖受到损害,与未转导的细胞相比,存活细胞显著减少(图1)。4a).此外,与那些转导为空对照病毒粒子的细胞相比,HSF1缺失的细胞中锚定独立细胞生长(AIG)也显著受损(图1)。4c离开,pLKO。1vs sh-HSF1). These results suggest that depletion of HSF1 might first induce defects in mitotic spindles, then it may impair mitosis progression and cell proliferation, consequently obstructing AIG.
HSF1的转激活活性是细胞增殖、AIG和有丝分裂纺锤体组装所必需的。一个HSF1耗竭使细胞增殖减弱。用不同体积的含HSF1 shRNAs或不含HSF1 shRNAs的病毒粒子转导细胞,然后每天用台盼蓝排除法分析细胞增殖情况。b免疫印迹分析CGL2细胞中内源性HSF1水平和HSF1缺失细胞中flag标记的野生型和突变型HSF1水平。红色星号表示每个HSF1在细胞中的表达位置。c而且dHSF1的耗竭抑制了AIG并诱发纺锤体异常。缺乏转激活活性的HSF1亚型过表达不能挽救HSF1耗损引起的AIG抑制和纺锤体缺陷。用含有fgal标记的野生型(wt) HSF1或突变型HSF1 cdna的病毒粒子转导HSF1-耗尽的细胞50小时,然后收集用于免疫印迹分析(b)、美国国际集团(AIG) (c)或纺锤体异常(d).e而且f过表达HSP70可减少HSF1耗损引起的细胞死亡,并挽救纺锤体缺陷。从至少三个独立实验的平均值±SD显示。*p< 0.01的学生t测验
然后在HSF1缺失的细胞中测试HSF1的转激活活性是否需要维持功能双极纺锤体和AIG。耗尽HSF1的CGL2细胞异位过表达野生型HSF1 (wtHSF1)、组成活性HSF1(∆202-316,caHSF1)、S326A取代HSF1或显性阴性HSF1(∆361-529,dnHSF1),如前面所述[19].每种HSF1突变体对HSP70表达的影响已有报道[19].免疫印迹法证实了各自的损耗和过表达效率(图。4b).分析HSF1野生型和突变型对HSF1缺失细胞诱导异常有丝分裂纺锤体和AIG的影响。数字4d显示,表达wtHSF1或caHSF1,而不表达S326A或dnhsf1,可显著减少HSF1损耗引起的异常有丝分裂纺锤体的诱导。HSF1的缺失也恢复了AIG的减少,并通过过表达wtHSF1或caHSF1而非S326A或dnHSF1进一步增强(图2)。4c)。诱导热休克蛋白70 (HSP70)编码于HSPA1A基因)也在HSF1缺失的CGL2细胞中异位过表达。结果表明,HSF1耗竭诱导的细胞死亡(图。4e,左)和纺锤体异常(图。4e,右)可以通过HSPA1A的过表达部分挽救。因此,我们认为HSF1的转激活活性是双极纺锤体组装和AIG所必需的,HSF1可能通过HSP70的表达部分调控有丝分裂纺锤体的组装。
抑制HSF1的转激活活性可使细胞对抗有丝分裂药物敏感
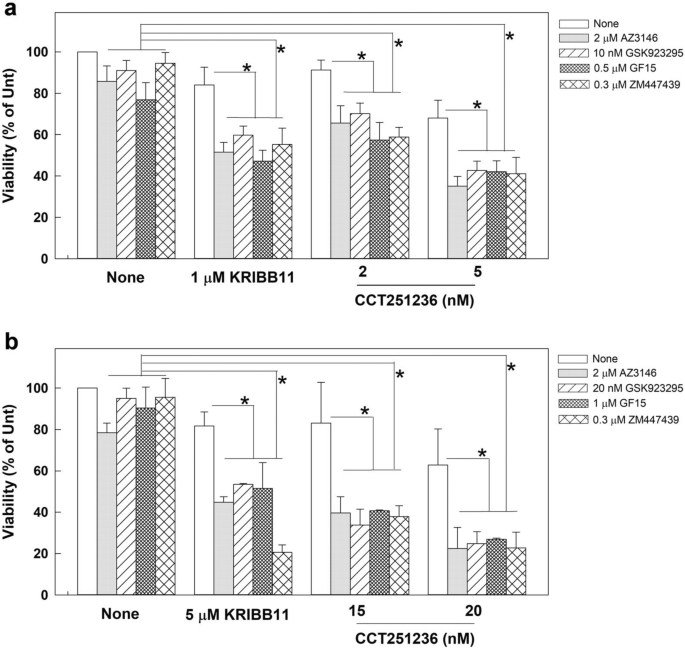
从抗有丝分裂药物处理的培养物中收集的有丝分裂细胞中,HSF1-pS326的水平升高。1c),我们接下来评估HSF1的转激活活性是否可以通过用KRIBB11和CCT251236处理细胞并监测纺锤体缺陷和细胞死亡来调节细胞对抗有丝分裂药物的反应。结果表明,与单独使用抗有丝分裂药物的相应处理相比,将CGL2细胞与KRIBB11、紫杉醇、长春碱或GF15(中心体聚集的一种有效抑制剂)共处理1小时可显著增强纺锤体异常(图。5a).此外,72h活力试验显示,KRIBB11或CCT251236也显著增加紫杉醇或长春碱诱导的细胞死亡水平(图1)。5b).一系列抗有丝分裂药物也进行了研究,包括AZ3146(一种单极纺锤体1激酶,MPS1的有效和特异性抑制剂),GSK923295(一种有丝分裂运动蛋白着丝粒相关蛋白- e, CENP-E的有效和选择性抑制剂),GF15(一种中心体聚类抑制剂),或ZM447439(极光b激酶,AURKB的有效和选择性抑制剂)。值得注意的是,每种浓度的抗有丝分裂药物在培养中只造成轻微的细胞毒性。然后我们对CGL2进行治疗。6a)或MDA-MB-231乳腺癌细胞(图。6b)使用每种抗有丝分裂药物加上指示的HSF1抑制剂,发现与单独使用抗有丝分裂药物或单独使用HSF1抑制剂相比,联合治疗显著降低了细胞活力(图。6).此外,根据Chou-Talalay的组合指数(CI)理论[24],我们联合治疗的CI均小于1,提示HSF1抑制剂可增强各抗有丝分裂药物的细胞毒性。这些结果表明,HSF1的转激活活性可能不仅是有丝分裂纺锤体的准确组装和成功的有丝分裂进程所必需的,而且可能保护有丝分裂细胞免受各种抗有丝分裂药物的影响。因此,抑制HSF1可能同时诱导纺锤体缺陷,抑制其细胞保护功能,使细胞对各种抗有丝分裂药物敏感。
讨论
在本研究中,我们发现HSF1的S326磷酸化和转激活活性在有丝分裂过程中升高(图1)。1c),并且在中期磷酸化hsf1定位于纺锤极(图。1b).然后,我们使用HSF1转激活抑制剂或HSF1缺失的细胞,并添加了组成性活性或显性阴性突变体,我们提供了证据,证明有丝分裂阶段HSF1的转激活活性是纺锤体组装所必需的。
HSF1在S326位点的磷酸化在其转激活中发挥关键作用[18,以及若干激酶,包括mTOR [25], MEK [26]和p38 MAPK [27,已经被证明可以进行这种磷酸化。已知这些激酶在有丝分裂过程中被激活[28,29];然而,它们是否可能诱导HSF1的有丝分裂激活还需要进一步的研究。mTOR在S2481位点的自磷酸化与mTOR催化活性相关[30.],活性mTOR在有丝分裂中心体和纺锤体上积累,可能作为有丝分裂纺锤体组装的调节因子[31].因此,有丝分裂过程中HSF1、mTOR和纺锤体组装之间的分子和功能联系可能值得进一步研究。此外,由于PLK1对有丝分裂中心体的成熟、有丝分裂纺锤体的组装和胞质分裂的影响,它在有丝分裂的进程中是必不可少的[32].PLK1在热应激下磷酸化HSF1的S419位点以诱导HSF1核易位[33].此外,PLK1在有丝分裂过程中磷酸化HSF1的S216位点[15,16].这种s216磷酸化的HSF1定位于纺锤极,并在有丝分裂早期与Cdc20结合,将Cdc20与后期促进复合物隔离,并影响有丝分裂进程。然而,这种plk1磷酸化,纺锤极定位的HSF1是否在纺锤装配中起作用尚未被证实。不管具体机制如何,我们的研究结果表明,在有丝分裂过程中抑制HSF1的转激活活性可以诱导纺锤体异常(图。2),表明HSF1可能在有丝分裂期间保持转录活性,以支持双极纺锤体组装。
已有研究表明,有丝分裂细胞的浓缩染色质仍然可以被HSF1和RNA聚合酶II访问,允许HSPs的下游表达[11].我们的研究结果表明,从胸苷激酶阻断-释放培养物中收集的有丝分裂细胞和通过各种抗有丝分裂药物治疗的有丝分裂细胞中,HSP70的表达升高。据报道,其他几种高敏感蛋白和伴侣蛋白的表达水平也在诺可达唑或秋凝胺阻滞的有丝分裂细胞中升高[34].HSP70调节有丝分裂中心体的功能[35,36], HSP90活性是姐妹染色单体凝聚和有丝分裂过程中染色体精确分离所必需的[37].也有报道称,一些参与控制有丝分裂进程的调控蛋白是由分子伴侣稳定的。细胞周期蛋白依赖性激酶1 (CDK1)是有丝分裂进入的引擎激酶,因为它驱动大量相互连接的信号级联[38];该蛋白已被证明与HSP90形成复合物,在有丝分裂和胞质分裂过程中介导信号转导[39].此外,微管蛋白已被证明与HSP70和t复合物多肽-1复合体,以便在有丝分裂装置的组装和拆卸过程中实现微管蛋白折叠[40].这些研究表明,一些HSPs和伴侣可能参与并需要纺锤体组装和有丝分裂的进程。因此,HSF1可能通过其作为HSPs和伴侣的主调节因子的功能来控制有丝分裂装置和有丝分裂的进程。另外,HSF1已被证实与叉头盒M1 (FoxM1)转录因子的启动子结合,以刺激其表达[41].由于FoxM1是参与G2/M过渡和有丝分裂装置构建的基因的转录所必需的(靶点包括细胞周期蛋白B1、Cdc20、CDK1和PLK1等)[42], HSF1也可能通过调节FoxM1的表达来控制纺锤体的组装和有丝分裂的进程。因此,HSF1可能通过直接和间接机制控制纺锤体组装和有丝分裂进程。
我们的结果还表明,抑制HSF1的转激活活性或HSF1的缺失首先诱导有丝分裂纺锤体组装缺陷,随后抑制细胞增殖和AIG。涉及癌基因和肿瘤抑制基因的信号级联的失调常导致中心体异常,并导致有丝分裂纺锤体的缺陷[43].随后的染色体错误分离和非整倍体已被证明可诱导有丝分裂突变,从而消除有丝分裂不合格的细胞[44];否则,在非整倍体子细胞中诱导蛋白质毒性,可能损害细胞增殖[45].因此,一些报告表明,伴侣蛋白或hsf1表达的增加不仅挽救了人类非整倍体细胞中的蛋白质折叠缺陷,而且还挽救了增殖缺陷[46]保护细胞免受有丝分裂性凋亡[47,48,49].此外,显性阴性HSF1结构的表达减少了前列腺癌细胞系中的非整倍体数量[13].由于非整倍体细胞主要产生于有丝分裂失败,这一发现表明抑制HSF1活性可能阻碍异常有丝分裂细胞的进展和生存。总之,这些研究表明,转化细胞可能依赖HSF1信号来应对有丝分裂失败,并维持细胞分裂、生存和增殖。因此,除了调节纺锤体组装,转录活性HSF1在有丝分裂和非整倍体伴随蛋白毒性过程中发挥细胞保护作用;因此,HSF1可能促进了AIG和肿瘤的发生。
我们还发现抑制KRIBB11或CCT251236的HSF1转激活活性可增强不同抗有丝分裂药物诱导的纺锤体缺陷和细胞死亡。我们测试的抗有丝分裂药物针对不同的蛋白,包括微管蛋白、MPS1、CENP-E和AURKB,并抑制中心体聚集。结果表明,HSF1对这些药物诱导的各种有丝分裂损伤具有普遍的保护作用。结果表明,HSF1在转录上激活了多药耐药1基因的表达[50],表明HSF1可能通过促进药物排斥来保护细胞。除了调节HSPs外,HSF1还控制编码其他蛋白质的基因的转录,这些蛋白参与了各种生理过程[4].因此,HSF1可能参与有丝分裂过程中的许多信号通路,包括纺锤体组装和细胞保护,以维持有丝分裂失败的细胞的生存。针对有丝分裂机制使用抗有丝分裂药物通常被用作许多癌症的一线治疗。然而,患者的反应往往是不可预测的,耐药性往往限制了这些药物的有效性。因此,我们的结果显示,抑制HSF1可以使癌细胞对抗有丝分裂药物敏感,这有可能启发改进临床治疗。
结论
总之,我们的研究结果表明,HSF1在有丝分裂过程中的转激活活性是纺锤体组装所必需的。抑制HSF1的转激活活性可损害纺锤体组装和有丝分裂进程,从而降低细胞活力和AIG。此外,抑制HSF1的转激活活性也会阻止其细胞保护功能,HSF1活性降低的细胞在使用各种抗有丝分裂药物治疗后,梭形体缺陷和死亡水平增加。因此,抑制HSF1可能同时诱导纺锤体缺陷,抑制其细胞保护功能,使细胞对各种抗有丝分裂药物敏感。
方法
细胞培养和化学物质
CGL2细胞由E. J. Stanbridge博士(加州大学欧文分校)提供。按照上述方法培养CGL2和MDA-MB-231细胞[19,51].通过G418选择转染pgl4 - a1a -1.3 3k质粒的CGL2细胞,建立稳定的HSF1荧光素酶报告细胞系(CGL2- a1a - luc) [19]是一种荧光素酶报告质粒,含有HSPA1A基因启动子中的热休克元件(HSE)。在G1期通过双胸腺嘧啶阻滞实现细胞周期同步[52].转入无胸腺嘧啶培养基后,细胞继续生长;用DNA流式细胞仪每隔2-4 h监测细胞周期进展。按照所述方法进行细胞活力测定[19].
AZ3146(开曼,安娜堡,美国),CCT251236(开曼),KRIBB11(默克Calbiochem, MA,美国),GF15(默克Calbiochem), GSK923295(开曼),紫杉醇(默克Calbiochem), vinblastine (Sigma, St. Louis, MO, USA),和ZM447439(开曼)在DMSO中制备,并在使用前在培养基中鲜稀释。
表达载体
编码野生型HSF1、组成活性HSF1(∆202-316,caHSF1)、S326A HSF1或显性阴性HSF1(∆361-529,dnHSF1)的逆转录病毒质粒按所述方法制备[19].所有HSF1野生型和突变型cdna序列均经DNA测序确认和验证。如前所述,用质粒转导或转染细胞[19].
细胞HSF1耗竭
如前所述,通过vsv - g假型基于慢病毒的短发夹RNA (shRNA)转导CGL2细胞,实现HSF1的耗损[19].用pLKO转导CGL2细胞。1- or shRNA-containing virions in growth medium supplemented with 10 μg/ml polybrene. At 24 h post-transduction, 2 μg/ml puromycin was added to culture medium to select for stable clones (CGL2-pLKO.1 and CGL2-shHSF1). Alternatively, cells were subjected to analysis after transduction for at least two days.
细胞周期进展及有丝分裂指数分析
如前所述,使用DNA流式细胞术监测细胞周期进展[52].通过直接显微镜观察dapi染色细胞或流式细胞术分析有丝分裂细胞的百分率。
免疫印迹
按照所述进行细胞裂解和免疫印迹[35].使用针对细胞周期蛋白B1 (Santa Cruz Biotechnology, Inc., Dallas, Texas)的抗体检测特定蛋白质,组蛋白H3在S10位点磷酸化(Cell Signaling Technology, Danvers, MA), HSF1 (Enzo Life Sciences, Lausen, Switzerland), HSF1在S326位点磷酸化(ab76076, Abcam, Cambridge, MA), HSP70 (GeneTex, Hsinchu, Taiwan)。β-Actin和GAPDH分别用抗-β-actin (Chemicon, Temecula, CA)和抗-GAPDH (Genetex)检测,作为加载对照。
免疫荧光染色
将细胞接种在玻璃盖上,37°C孵育24小时,用PBS洗涤两次,固定在PTEMF (20 mM PIPES, 4%多聚甲醛,0.2% trton - x, 10 mM EGTA和1 mM MgCl)中2) 15分钟,然后按所述免疫染色[35].使用的主要抗体包括抗-α-微管蛋白(T5168, Sigma, Saint Louis, MO或GTX112141, GeneTex),抗-γ-微管蛋白(T6557或T3559, Sigma),抗HSF1 (di - spa -901 Enzo Life Sciences, Lausen, Switzerland或SC-9144, Santa Cruz Technology), S326位点磷酸化的HSF1特异性抗体(HSP1-pS326, ab76076, Abcam或2092-5,Epitomics, Inc., Burlingame, CA),抗HSF1- ps303 /307 (2108-5, Epitomics, CA)。Alexa-Fluor 488或633结合山羊抗小鼠或抗兔IgG购自Invitrogen公司(Carlsbad, CA, USA)。所有一抗均以1:20稀释于含0.1% t20的磷酸盐缓冲盐水中。用0.1 μg/ml的4,6-二氨基-2-苯基吲哚(DAPI, Sigma)反染色。样品安装在SouthernBiotech (Birmingham, AL, USA)的Fluoromount-G中,并在共聚焦显微镜(Leica TCS-SP5, Mannheim, Germany)下检查。
诺考达唑冲刷试验
用诺可达唑洗脱法评价HSF1对有丝分裂纺锤体组装的影响。用3 μM诺可达唑溶解对照或kribb11处理的有丝分裂细胞纺锤体0.5 h后,迅速洗净诺可达唑,小心转移至37℃无药培养基中。在不同时间点(0、3、7、15、30 min)用PTEMF固定细胞15 min,并用抗-α-微管蛋白和抗-γ-微管蛋白抗体染色;用Alexa488或alexa633偶联二抗体染色观察微管蛋白。使用荧光显微镜(Zeiss Axioplan 2 Imaging MOT, Oberkochen, Germany)检测有丝分裂纺锤体的重新组装。
数据和材料的可用性
支持本研究结果的数据可根据合理要求从通讯作者处获得。
缩写
- 美国国际集团(AIG):
-
Anchorage-independent细胞生长
- AURKB:
-
极光a激酶
- CDK1:
-
细胞周期蛋白依赖性激酶1
- CENP-E:
-
有丝分裂运动素着丝粒相关蛋白e
- FoxM1:
-
Forkhead盒M1
- HSE:
-
热休克元素
- HSF1:
-
热冲击系数1
- HSP:
-
热休克蛋白
- 高铁:
-
热休克反应
- 小姐:
-
细胞有丝分裂指数
- MPS1:
-
单极纺锤体1激酶
- PLK1:
-
Polo-like激酶1
参考文献
李晓燕,李晓燕。HSF1在热应激反应中的调节作用:在衰老和疾病中的意义。生物化学,2011;80:1089-115。
热休克反应:死亡边缘的生命。摩尔细胞。2010;(2):253 - 66。
Gomez-Pastor R, Burchfiel ET, Thiele DJ。热休克转录因子的调控及其在生理和疾病中的作用。中国生物医学工程学报2018;19(1):4-19。
王晓燕,王晓燕,王晓燕。热冲击因子1在热冲击反应之外的作用。细胞分子生命科学,2018;75(16):2897-916。
热休克,或hsf1介导的蛋白质毒性应激,在癌症中的反应:从蛋白质组稳定性到肿瘤发生。国际生物学杂志,2018。https://doi.org/10.1098/rstb.2016.0525.
Mendillo ML, Santagata S, Koeva M, Bell GW, Hu R, Tamimi RM,等。HSF1驱动一种不同于热休克的转录程序,支持高度恶性的人类癌症。细胞。2012;150(3):549 - 62。
HSF1:肿瘤中蛋白酶平衡的守护者。细胞生物学动态,2016;26(1):17-28。
Schilling D, Kuhnel A, Konrad S, Tetzlaff F, Bayer C, Yaglom J,等。通过针对热休克反应使肿瘤细胞对辐射敏感。癌症。2015;360(2):294 - 301。
Desai S,刘铮,姚杰,Patel N,陈杰,吴勇,等。热休克因子1 (HSF1)通过对自噬相关蛋白7 (ATG7)的转录调控来控制耐药和自噬。中国生物医学工程学报,2013;29(5):563 - 566。
董B, Jaeger AM, Thiele DJ。抑制癌症热休克因子1:一个独特的治疗机会。药理进展2019;40(12):986-1005。
Elsing AN, Aspelin C, Bjork JK, Bergman HA, Himanen SV, Kallio MJ,等。HSF2的表达在有丝分裂中减少,从而使胁迫诱导转录和细胞存活。细胞生物学杂志,2014;206(6):735-49。
茅屋HM,坎平加HH,西本OC。Hsp70保护有丝分裂细胞免受热诱导的中心体损伤和分裂异常。分子生物学细胞。2005;16(8):3776-85。
王勇,王晓燕,何宏,龚军,等。热休克因子-1在前列腺癌细胞中的表达对非整倍体的抑制作用。中国生物化学杂志2004;279(31):32651-9。
酵母热休克转录因子(Hsf1)突变体在Hsc82/Hsp82合成和纺锤极体复制过程中均存在缺陷。细胞科学,1997;110(Pt 16): 1879-91。
Kim Lee YJ呃,Lee JS Jeoung D, Bae年代,Kwon SH, et al。HSF1作为有丝分裂的调节剂:Plk1对HSF1的磷酸化对有丝分裂的进展至关重要。可以研究》2008;68(18):7550 - 60。
李玉杰,李海杰,李俊杰,Jeoung D, Kang CM, Bae S,等。通过HSF1和Cdc20的直接相互作用,HSF1诱导有丝分裂退出失败和基因组不稳定的新功能。致癌基因。2008;27(21):2999 - 3009。
Stanbridge EJ, Flandermeyer RR, Daniels DW, Nelson-Rees WA。在人类细胞杂交种中与致瘤性表达相关的特异性染色体丢失。细胞生物学杂志。1981;7(6):699-712。
葛陶什,李晓燕,李晓燕。人热休克因子1在应激细胞中的磷酸化分析。学生物化学BMC。2005;4。
叶汉林,徐楠楠,郭海辉,吴永春。PI103对热休克反应的抑制增强了三氧化二砷的细胞毒性。Toxicol Sci。2012;128(1):126 - 36。
尹艳杰,金子,申KD,申DS,韩艳梅,李艳杰,等。KRIBB11通过破坏正向转录延伸因子b向HSP70启动子的招募,抑制热休克因子1的功能,从而抑制HSP70的合成。中国生物化学杂志,2011;286(3):1737-47。
Cheeseman MD, Chessum NE, Rye CS, Pasqua AE, Tucker MJ, Wilding B,等。从热休克转录因子1 (HSF1)表型筛选中发现化学探针双酰胺(CCT251236):一种口服生物可利用的有效匹林配体。中华医学化学杂志2017;60(1):180-201。
林桐,郭和宏,吴永春,潘涛,叶汉华。磷脂酰肌醇-5-磷酸4激酶聚集在纺锤极,阻止微管解聚。细胞Div。2019;14:9。
有丝分裂微管组装通路的顺序激活有利于双极纺锤体的形成。分子生物学杂志,2016;27(19):2935-45。
周TC。使用Chou-Talalay方法进行药物联合研究及其协同效应量化。可以研究》2010;70(2):440 - 6。
Chou SD, Prince T, Gong J, Calderwood SK. mTOR在蛋白毒性应激反应、HSF1活化和热休克蛋白合成中是必不可少的。PloS ONE。2012; 7 (6): e39679。
唐铮,戴思,何毅,Doty RA, Shultz LD, Sampson SB,等。MEK可以通过HSF1保护蛋白质组的稳定性,抑制肿瘤抑制性淀粉样蛋白的生成。细胞。2015;160(4):729 - 44。
Dayalan Naidu S, Sutherland C, Zhang Y, Risco A, de la Vega L, Caunt CJ,等。热冲击因子1是p38丝裂原激活蛋白激酶的底物。分子细胞生物学。2016;36(18):2403-17。
哈丁A,贾尔斯N,伯吉斯A,汉考克JF,加布里埃尔BG。有丝分裂特异性激活MEK1的机制。生物化学杂志,2003;278(19):16747-54。
李铮,张旭。参与自噬和有丝分裂的激酶。国际分子科学。2017。https://doi.org/10.3390/ijms18091884.
Soliman GA, acosta - jacquez HA, Dunlop EA, Ekim B, major NE, Tee AR等。mTOR Ser-2481自磷酸化监测mtorc特异性催化活性,阐明雷帕霉素的作用机制。中国生物化学杂志2010;285(11):7866-79。
Platani M, Trinkle-Mulcahy L, Porter M, Jeyaprakash AA, Earnshaw WC。Mio耗竭将mTOR调控与有丝分裂中心体Aurora A和Plk1激活联系起来。细胞生物学杂志,2015;210(1):45-62。
Combes G, Alharbi I, Braga LG, Elowe S.有丝分裂期间玩马球:PLK1领先。致癌基因。2017;36(34):4819 - 27所示。
金SA,尹志华,李硕,安SG。polo样激酶1磷酸化热休克转录因子1,并在热应激时介导其核易位。中国生物化学杂志2005;280(13):12653-7。
Azizi AA,苏康,Freilinger A, Gruber-Olipitz M,陈wq,杨建伟,等。神经母细胞瘤细胞系N1E-115中有丝分裂依赖蛋白的表达。蛋白质组学学报2008;7(8):3412-22。
方涛涛,郭海辉,潘涛,余方锋,叶汉华。HSP70调节有丝分裂中心体的功能。细胞分子生命科学,2016;73(20):3949-60。
方涛涛,郭海辉,徐淑贞,叶汉林。HSP70是核周物质正常组装和有丝分裂中心体功能所必需的。细胞Div。2019;十四4。
杨勇,王伟,李梅,高原,张伟,黄勇,等。NudCL2是Hsp90共伴侣蛋白,通过稳定内聚亚基来调节姐妹染色单体的内聚。细胞分子生命科学2019;76(2):381-95。
Crncec A,引发有丝分裂。593年2月。2019;(20):2868 - 88。
Muñoz MJ, Jimenez J.裂变酵母中Hsp90和Cdc2有丝分裂机制的遗传相互作用。Mol Gen Genet MGG。1999年,261(2):242 - 50。
Agueli C, Geraci F, Giudice G, Chimenti L, Cascino D, Sconzo G.一个70 kDa的热休克蛋白以atp依赖性的方式定位于纺锤体和孕球的中期纤维:一种新的伴侣作用被提出。生物化学学报,2001;36 (Pt 2): 433 - 433。
戴博,龚阿,静Z, Aldape KD,康诗,Sawaya R,等。叉头盒M1受热休克因子1调控,促进胶质瘤细胞在热休克应激下存活。中国生物化学杂志,2013;288(3):1634-42。
转录因子FOXM1(叉头盒M1):增殖特异性表达、转录因子功能、靶基因、小鼠模型和正常生物学作用。Adv Cancer Res. 2013; 118:97-398。
癌症中心体异常的原因和后果。生物学杂志,2014。https://doi.org/10.1098/rstb.2013.0467.
有丝分裂灾难:一种避免基因组不稳定性的机制。细胞生物学杂志,2011;12(6):385-92。
李晓燕,李晓燕。染色体错分离和非整倍体的短期和长期影响。中国生物医学工程学报2015;16(8):473-85。
Donnelly N, Passerini V, Dürrbaum M, Stingele S, Storchová Z. HSF1缺陷和hsp90依赖性蛋白折叠受损是非整倍体人类细胞的标志。EMBO j . 2014; 33(20): 2374 - 87。
soit DB, Basso AD, Olshen AB, Scher HI, Rosen N.热休克蛋白90功能抑制下调Akt激酶,使肿瘤对紫杉醇敏感。可以研究》2003;63(9):2139 - 44。
杉村M, Sagae S, Ishioka S, Nishioka Y, Tsukada K, Kudo R.紫杉醇诱导卵巢癌细胞系及其紫杉醇耐药克隆细胞凋亡的机制。肿瘤。2004;66(1):53 - 61。
吴永春,闫文英,李忠贤,叶汉林。热休克蛋白抑制剂17-DMAG和KNK437可增强三氧化二砷诱导的有丝分裂凋亡。药理学杂志,2009;36(2):231-8。
文基,蔡娥,李燕,李雅思。耐药癌细胞中ERK1/2的激活降低了FBXW7的表达,通过抑制HSF1的泛素降解使MDR1转录激活。《细胞死亡杂志》2020;11(5):395。
方涛涛,郭海辉,袁cj,姚建军,叶汉华。Mdivi-1诱导MDA-MB-231细胞的纺锤体异常并增强紫杉醇的细胞毒性。细胞死亡发现2021;7(1):118。
叶汉林,曾奕云,吴永春,李忠忠。在亚砷酸盐诱导的CGL-2细胞有丝分裂阻滞过程中中心体扩增的诱导。可以研究》2006;66(4):2098 - 106。
确认
作者感谢中国科学院细胞与有机体生物学研究所核心设施对共聚焦显微镜和流式细胞术的帮助。
资金
本研究由台湾中央研究院资助。
作者信息
作者和联系
贡献
HHK和ZRS进行了实验并对数据进行了分析。JYC为作品的构思做出了贡献。LHY贡献了工作的概念和设计,分析和解释数据,并起草了手稿。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
郭,HH。,Su, ZR., Chuang, JY.et al。热休克因子1的抑制诱导纺锤体异常并使细胞对抗有丝分裂药物敏感。细胞Div168(2021)。https://doi.org/10.1186/s13008-021-00075-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13008-021-00075-8
关键字
- HSF1
- 纺锤体组装
- 细胞死亡