摘要
背景
多细胞肿瘤球体是癌症和细胞生物学研究中日益引起人们兴趣的模型。它们允许在探索细胞周期和细胞分裂机制时考虑细胞的相互作用。然而,活体球体细胞分裂的3D成像在技术上具有挑战性,从未报道过。
结果
在这里,我们报道了基于表达组蛋白H2B荧光核报告蛋白的多细胞肿瘤球体工程的重大突破,并专门设计了样品holder,使用自制的选择平面照明显微镜来监测三维大球体中的活细胞分裂动态。
结论
正如使用抗有丝分裂药物紫杉醇所说明的那样,这一技术进步为三维细胞分裂过程的动力学研究铺平了道路,更普遍的是,作为球体模型,在集成系统中研究肿瘤细胞群体生物学。
背景
细胞增殖失调是肿瘤细胞的一个特征。细胞周期控制和细胞增殖的调控机制的知识是更好地理解其在肿瘤发生中的调控错误的后果,以及在癌症治疗中操纵它们的基础。这些机制的研究已经在很大程度上促进了靶向治疗的改进。然而,这些工作中的大多数都有一个主要的局限性,这可能是新治疗策略经常失败的原因。事实上,到目前为止,大多数(如果不是全部)研究都依赖于对单层快速生长的癌细胞系的体外分析。这些二维模型没有考虑组织异质性、细胞相互作用和肿瘤微环境,这些因素已被证明与肿瘤发展有重要关系[1,2].细胞周期控制机制也依赖于细胞-细胞和细胞-细胞外基质的相互作用。例如,有丝分裂时未来切割面的方向依赖于细胞骨架与内在皮层因子的相互作用,但也依赖于外部线索,包括细胞形状、细胞-细胞相互作用以及细胞与细胞外基质的粘附[3.,4].因此,研究在三维集成细胞环境下进行的有丝分裂将是非常有趣的。
由癌细胞生成的多细胞肿瘤球体(MCTS)是研究肿瘤增殖的三维模型。事实上,这些三维复杂的多细胞系统再现了实体肿瘤中发现的细胞-细胞和细胞-基质相互作用[5].此外,MCTS可以生长到几百微米的直径,逐渐发展出类似于肿瘤非血管化微区域的增殖细胞梯度:分裂细胞位于外层,静止细胞位于缺氧和接受很少营养物质的区域更中央[6,7].
尽管我们对控制细胞周期和细胞增殖的分子机制以及它们对肿瘤发生调控不当的后果有广泛的了解,但我们对肿瘤细胞在复杂的三维系统(如球体)中增殖的时空动态只有初步的了解。通过石蜡包埋或冷冻切片的免疫荧光显微镜或酶解细胞后的流式细胞术,可以检测球体内特定细胞标记物的表达,但这些方法不允许我们考虑球体的三维组织[8,9].一些研究报道了富含癌症干细胞的肿瘤球的3D成像,然而,这些都是由很少细胞组成的小球(直径< 150 μm) [10,11].所采用的策略不能应用于再现肿瘤组织的较大球体(>直径300 μm),并且它们与实时成像不兼容。事实上,在大型球体内的三维活细胞过程的动态研究在技术上仍然非常具有挑战性。
一种基于光片的显微镜方法被称为选择性平面照明显微镜(SPIM),非常适合于在3D中成像大型样品[12- - - - - -14].在SPIM中,在显微镜物镜的焦平面上,一层光照亮垂直于检测轴的样品,从而提供整个样品的光学切片。图像由CCD相机记录,一次一个平面,具有高时间分辨率,从而限制了光毒性,并促进了活样品的成像[15].此外,几个视图的组合允许合并从不同角度获得的数据,以产生3D图像[16].一项研究报道了使用SPIM成像化学固定的小球体BxPC-3细胞(一种人类胰腺癌细胞系),用荧光DNA染料DRAQ5染色[14],在[17].
在本出版物中,我们报告了SPIM 3D成像技术也适用于MCTS的实时成像的第一个演示,该MCTS已被设计用于表达荧光报告。因此,利用多细胞肿瘤球体模型在三维中探索癌细胞的细胞分裂和增殖动力学问题是一种引人注目的新方法。
结果
用单平面照明显微镜成像球体
为了在3D中研究大型活球体中的细胞过程,我们建立了一个单平面照明显微镜,其中光片是通过圆柱形透镜创建的(附加文件)1).根据Verveer和合作者获得的结果验证该设置的性能[14],我们首先对DRAQ5染色的人胰腺癌细胞系Capan-2的固定大球体(> 400 μm直径)进行3D成像(附加文件)2).另一个电影文件更详细地显示了这一点(附加文件3.).横向和轴向分辨率足够高,可以清楚地识别200 μm深的球体的所有核,我们还能够区分有丝分裂细胞中的浓缩染色体。然后,我们可以通过旋转SPIM中的样本来可视化球体整个体积中的核,获得各种视图的z-stack图像,然后合并它们(附加文件)2摄氏度).这些结果表明,这种设置很好地适应图像,在3D中,球体内的单个细胞大到足以包括细胞异质性沿增殖梯度分布。
H2B-HcRed表达球体的成像
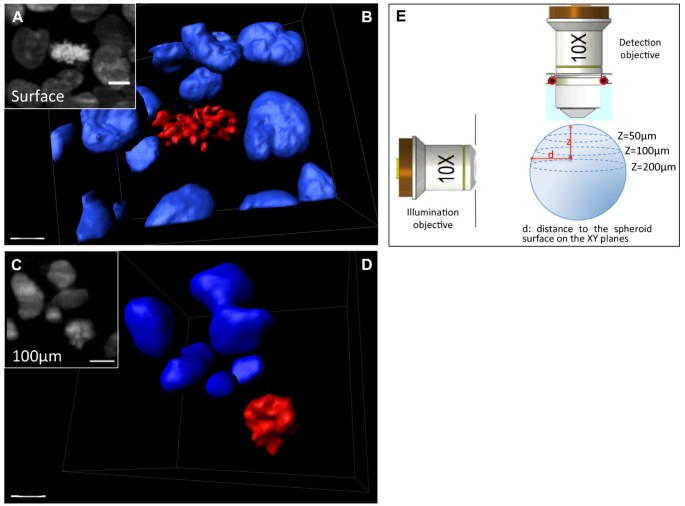
DRAQ5 DNA染色不适合MCTS活细胞增殖成像,因为其穿透深层的能力较差,且长期孵育后具有毒性。因此,我们产生了稳定表达荧光报告蛋白的细胞系(HCT116,一种人结肠癌):组蛋白H2B与远红荧光蛋白HcRed的融合[18].荧光融合蛋白与H2B的表达已被证明有助于研究细胞发育过程中的命运[19- - - - - -21].工程球体保留了亲本细胞系的所有生物学特征(数据未显示)。我们选择了一个克隆,其中只有一个细胞亚群在细胞核中表达H2B-HcRed蛋白(图2)1)从而使SPIM成像和大的表达h2b - hcred球体的分割更易于管理。SPIM的横向和轴向分辨率使我们能够在深度达200 μm的球状体中识别核1).然后通过0°和180°的两层叠加融合,可以看到球体整个体积中的核(图1 d,附加文件4).
成像球体内的有丝分裂细胞
有丝分裂是细胞周期中一个细胞分裂成两个子细胞的阶段。在有丝分裂过程中,细胞的微管网络被重组形成有丝分裂纺锤体,它首先将复制和浓缩的染色体排列在细胞中心,然后将一组染色体分离到子细胞形成的每个极点。在表达HCT116细胞的h2b - hcred球体中,SPIM可以很容易且清楚地识别染色体浓缩的有丝分裂细胞(图2,附加文件4),与间期细胞的圆形细胞核相比,它们具有较高的荧光强度和熟悉的浓缩染色体形状(图2,其他文件5而且6).这可以在三维重建中看到,通过提取荧光强度的等表面,可以看到在z-堆叠中包含有丝分裂细胞的区域的体积中的单个荧光物体(图2 b,附加文件7).这些数据证明了SPIM成像在多细胞三维肿瘤模型中细胞分裂研究的实用性。许多参与有丝分裂进程的基因产物与肿瘤发生有关[22].SPIM提供了一种方法来研究这些基因突变对染色体排列、未来切割面的位置和方向的影响,以及外部线索的作用,如细胞-细胞相互作用和细胞外基质的粘附,同时考虑到癌细胞的多细胞环境[4,23,24].
表达h2b - hcred的固定球体内的间期核和有丝分裂核的成像和三维重建。A:附加文件中z-stack的一帧放大4在z = 30 μm处检测到球体表面有丝分裂细胞。比例尺,15 μm。B: a所示框架对应的堆叠区域三维重建:蓝色等值面对应间期核,红色等值面对应有丝分裂浓缩染色体。比例尺:7 μm。C: z-堆叠区域在z = 150 μm处的放大图,显示距离球体表面100 μm处有丝分裂细胞。比例尺,10 μm。D:三维重建c对应的叠加区域比例尺:7 μm。E:示意图,显示有丝分裂细胞的位置是如何根据球体表面和检测轴上的z位置来定义的。
球体内细胞分裂的时间延迟成像
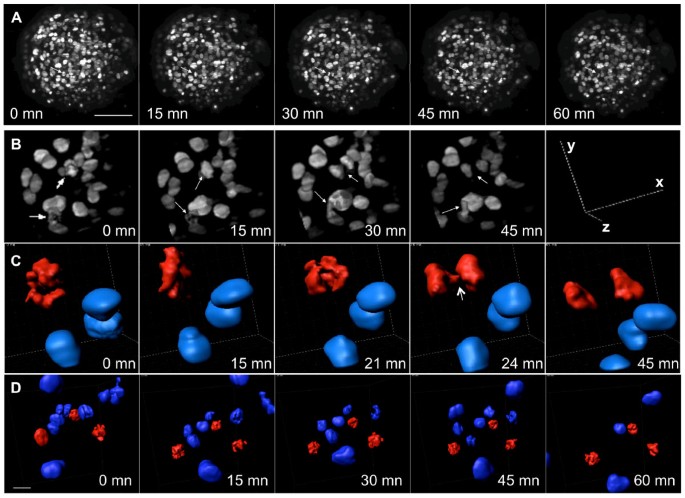
与SPIM技术相关的低光漂白和光毒性与各种生物体的活样本成像兼容,几个小组最近的工作[15,19,25].此前已经在果蝇、斑马鱼和海胆胚胎上使用SPIM进行了活体成像实验,这些实验不需要严格控制的环境条件。然而,对于许多模型系统,生理环境的严格控制对于活细胞成像实验至关重要。为了检验SPIM是否可以应用于人类MCTS细胞周期过程的实时3D成像研究,我们调整了SPIM设置,在延时实验期间将温度保持在37°C,大气二氧化碳浓度保持在5%(球体生长所需的条件)。我们还开发了由折射率接近水的生物相容性材料制成的样品夹,其中球体可以在没有机械应力的情况下生长,从而避免了在SPIM中通常用于呈现样品的琼脂糖包埋程序中看到的对细胞增殖的区域影响(附加文件)8) [26,27].有了这些改进,我们能够在三维成像和几个小时的H2B-HcRed在球体的细胞核(图3.,附加文件9),观察染色体分离和卵裂计划方向(图3.,其他文件10而且11).在如此大的多细胞球体中显示活细胞分裂动态和细胞行为的三维图像以前没有发表过。这些结果为SPIM可用于三维研究人类癌细胞生物学提供了原理证明。然而,随着时间的推移,必须考虑对环境条件控制、样品保存和堆栈注册的改进,以优化系统。
SPIM活体球体成像。A:在指定时间记录的h2b - hcred表达球体z层的最大投影。图片取自附加文件9。采用SPIM (10×物镜,NA = 0.3),每3 min记录100片切片,切片间距为1 μm。白色箭头显示正在分裂的细胞。比例尺,100 μm。B:在指定时间椭球体放大区域的三维可视化。有丝分裂的进程可以在两个细胞中看到(箭头)。C: 4D堆叠中一个有丝分裂细胞间期核(蓝色)和浓缩染色体(红色)的三维重建。箭头表示姐妹染色单体分离。比例尺,10 μm。D:紫杉醇处理的球体区域三维重建,显示三个有丝分裂细胞(红色)在有丝分裂中被阻断超过60分钟。 Scale bar, 20 μm.
实时spim成像在抗癌药物活性监测中的应用
为了充分证明3D延时SPIM的潜力,我们监测了一种抗有丝分裂药物紫杉醇对球形有丝分裂动力学的影响。该微管稳定剂广泛应用于临床[28,29].紫杉醇诱导了有丝分裂的阻断,并伴有浓缩染色体的持续动态运动,这些染色体没有在细胞中心对齐(图3 d,其他文件12而且13).这些数据表明,SPIM三维动态成像球体可以用于评估假定的抗肿瘤药物的活性。
结论
这项研究证明了使用SPIM在大球体中观察活细胞分裂动态的可行性,这些球体再现了肿瘤微区域的细胞组织,包括细胞异质性,细胞-细胞和细胞-微环境的相互作用。SPIM研究控制大球体内细胞增殖的机制应该带来无法从二维单层细胞培养模型中获得的宝贵信息。此外,本研究中报道的策略,连同图像分析的未来发展,将对系统癌症生物学的研究产生突出的兴趣。
方法
SPIM设置
额外的文件1显示了在这项工作中使用的选择平面照明显微镜。该装置由两个相互垂直的水平光轴组成:一个用于选择性平面激发的光片照明轴和一个检测轴。这种自制的SPIM装置配备了一个紧凑的激光发射器(法国Errol),由三个DPSS激光器(491 nm、532 nm和595 nm)的输出与二向色镜结合成一个单一的多波长光束。四通道声光可调滤波器(AOTF)具有单独的消隐通道,可精确控制每束激光的照明强度。AOTF的输出被耦合到光纤中。光片是用一个圆柱透镜共轭到一个照明物镜(10× NA 0.25)获得的。样品被放置在充满水介质的腔内的光片中。光通过浸没物镜(10× NA 0.3)收集。检测物镜安装在与滤光轮和冷却CCD相机(Roper Scientific)连接的生理室中。生理室是用光敏环氧树脂(Cresilas)的立体光刻工艺制造的。 Movements of the sample holder (x, y, z and rotation) were performed by a fully motorized stage (Physics Instruments), thus allowing multiview imaging. An incubator was fitted above the instrument to control the temperature and CO2 concentration around the sample (PECON controllers). The whole system was fully controlled by AMISPIM software that we developed specifically for this task by using the Labview development environment. This software allows manual or automated control of all the parameters and devices connected to the instrument (three lasers, motorized stage, camera, shutter, filter wheel, temperature monitoring, CO2 control, data acquisition and management).
球体的产生和染色
Capan-2胰腺癌细胞在含有10% FCS、2 mmol/l谷氨酰胺和1%青霉素/链霉素的DMEM/F12 (Invitrogen, France)中培养,环境湿度为5% CO2, 37℃。球状体的制备如前所述[30.].简单地说,将100 μl 10,000个细胞/ml的DMEM/F12悬浮液添加2 nM EGF (Invitrogen)和2% B27 (Invitrogen),放置在poly- hema涂层的96孔板(10 mg/ml, Sigma)的每孔中。在200 g下离心6分钟,然后在37°C下孵育。球体的直径是用校准的目镜划线测量的。当球体直径达到400 μm时,用PBS冲洗,在4%中性缓冲的福尔马林(Sigma)中固定2-20小时,然后在PBS稀释的DRAQ5 (Ozyme, 1:1000)中孵育,RNAse A (Sigma)存在(1mg /ml)。
我们构建了一个含有h2b串联HcRed融合蛋白和湿霉素抗性基因的pcDNA3质粒。该质粒转染HCT116细胞(Jet PEI试剂,Polyplus转染)。转染后1天,选择稳定结合质粒的细胞加入潮霉素(0.2 mg/ml)。如上所述,从该细胞系中获得球体。
固定样品安装的SPIM
球体被放置在1%低熔点琼脂糖冷却到40°C。将该混合物吸入50 μl的玻璃毛细管(Sigma)中,在4°C下冷却几分钟。然后将毛细管固定在theta-stage上,并放置在充满pbs的生理室中(附加文件)1).然后用合适的柱塞从毛细管中挤出琼脂糖柱,将琼脂糖嵌入样品置于物镜前。
用于延时数据采集的样品夹制备
样品夹由Phytagel™(也称为Appliedgel或Gelrite, Sigma)制成,这是一种阴离子线性四糖,在盐离子存在时聚合成凝胶。在PBS中制备了10 g/l的Phytagel溶液并进行高压灭菌。使用前,将Phytagel溶液在微波中熔化,然后用于填充无针尖Combitip注射器(1250 μl, Gilson),如附加文件所述8。然后用含有10% FCS和1%青霉素/链霉素的Optimem (Invitrogen)培养基填充成型室。球体被放置在模腔,然后固定到一个Combitip从尖端已被切除(附加文件8).更多信息请访问http://www.ip3d.fr/IP3D/SPIM/SPIM.html。然后将该组件放置在充满含有10% FCS和青霉素/链霉素的Optimem培养基的生理室中。在延时采集之前,生理室浸泡在漂白剂溶液中,以避免任何污染。为了研究紫杉醇处理的效果,球体在含有100 nM紫杉醇(Sigma)的培养基中孵育数小时,然后进行延时数据采集,然后转移到充满含有100 nM紫杉醇的培养基的样品夹中。生理室也充满同样的介质。
数据采集
使用10× NA 0.3水浸透镜(徕卡)为整个椭球体成像提供合适的工作距离,并提供足以看到单个核的3D分辨率。曝光时间为200-500毫秒。DRAQ5或HcRed荧光用595 nm激光激发,用593长通滤波器检测。体素大小为0.645 × 0.645 × 1 μm。在37°C和5% CO2条件下进行活体成像。
图像处理
图像处理使用开源图像处理包Fiji软件。多视图注册和融合使用SPIM注册插件(附加文件14) [16].使用3D拼接和3D查看器插件获得融合堆的三维可视化。延时采集过程中不同时间点之间发生的漂移通过使用TJ位移变换插件进行补偿。
为了进行三维重建,首先使用专用算法去除影响SPIM图像的条纹。条纹被建模为白噪声的卷积产品由一个基本的条纹样图案。然后使用Maximum a Posteriori模型对图像进行降噪,从而导致非线性优化问题。这个软件是按需提供的。采用IMARIS 7.0.0软件(Bitplane)对有丝分裂细胞进行三维重建。
参考文献
Wang F, Hansen RK, Radisky D, Yoneda T, Barcellos-Hoff MH, Petersen OW, Turley EA, Bissell MJ:在三维环境中通过改变信号通路来改变癌细胞的表型逆转或死亡。国家癌症研究所杂志2002年,94:1494 - 1503。10.1093 / jnci / 94.19.1494
Wang F, Weaver VM, Petersen OW, Larabell CA, Dedhar S, Briand P, Lupu R, Bissell MJ:在三维基底膜乳房培养中β -整合素和表皮生长因子受体的相互作用:上皮生物学的不同视角。美国国家科学院院刊1998年,95:14821 - 14826。10.1073 / pnas.95.25.14821
Minc N, Burgess D, Chang F:单元几何形状对分割面定位的影响。细胞2011年,144:414 - 426。10.1016 / j.cell.2011.01.016
Thery M, Racine V, Pepin A, Piel M, Chen Y, Sibarita JB, Bornens M:细胞外基质引导细胞分裂轴的方向。Nat细胞生物学2005年,7:947 - 953。10.1038 / ncb1307
脱砂B, Jardillier J:多细胞耐药:临床耐药的范例?肿瘤学/血液学的重要评论2000年,36:193 - 207。10.1016 / s1040 - 8428 (00) 00086 - x
Hirschhaeuser F, Menne H, Dittfeld C, West J, muller - klieser W, Kunz-Schughart LA:多细胞肿瘤球体:一种被低估的工具正在再次崛起。生物科技J》2010年,148:3日- 15日。10.1016 / j.jbiotec.2010.01.012
萨瑟兰RM:肿瘤微区细胞与环境的相互作用:多细胞球形模型。科学(纽约,纽约州)1988年,240:177 - 184。10.1126 / science.2451290
Dubessy C, Merlin JM, marshal C, Guillemin F:球状体在放射生物学和光动力治疗中的应用。肿瘤学/血液学的重要评论2000年,36:179 - 192。10.1016 / s1040 - 8428 (00) 00085 - 8
洛布若伊斯五世,弗朗吉亚C,乔赞S,特鲁歇一世,男仆A:在HCT116多细胞肿瘤球体中,SAHA的细胞周期和凋亡效应受到细胞微环境的调控。欧元癌症2009年,45:2402 - 2411。10.1016 / j.ejca.2009.05.026
Robertson FM, Ogasawara MA, Ye Z, Chu K, Pickei R, Debeb BG, Woodward WA, Hittelman WN, Cristofanilli M, Barsky SH:肿瘤干细胞表型丰富的三维肿瘤球体的成像和分析。生物分子筛选杂志2010年,15:820 - 829。10.1177 / 1087057110376541
魏斯瓦尔德LB,吉尼布蒂埃JM,里尚S,贝勒特D,索巴美亚B,腾格尔-玛丽V:肿瘤球中的原位蛋白表达:共聚焦显微镜免疫染色方案的开发。BMC癌症2010年,10:106.10.1186 / 1471-2407-10-106
豪斯肯J, Stainier DY:发育生物学中的选择性平面照明显微技术。发展2009年,136:1963 - 1975。10.1242 / dev.022426
Huisken J, Swoger J, Del Bene F, Wittbrodt J, Stelzer EH:用选择性平面照明显微镜对活胚胎深部进行光学切片。科学(纽约,纽约州)2004年,305:1007 - 1009。10.1126 / science.1100035
Verveer PJ, Swoger J, Pampaloni F, Greger K, Marcello M, Stelzer EH:大型标本的高分辨率三维成像与光片显微技术。自然方法2007年,4:311 - 313。
Arrenberg AB, Stainier DY, Baier H, Huisken J:心功能的光遗传学控制。科学(纽约,纽约州)2010年,330:971 - 974。10.1126 / science.1195929
Preibisch S Saalfeld S Schindelin J Tomancak P:基于珠子的选择性平面照明显微数据配准软件。自然方法2010年,7:418 - 419。10.1038 / nmeth0610 - 418
Pampaloni F, Reynaud EG, Stelzer EH:第三维度是细胞培养和活组织之间的桥梁。自然评论2007年,8:839 - 845。10.1038 / nrm2236
Gurskaya NG, Fradkov AF, Terskikh A, Matz MV, Labas YA, Martynov VI, Yanushevich YG, Lukyanov KA, Lukyanov SA:gfp样色蛋白作为远红荧光蛋白的来源。2月列托人2001年,507:16 - 20。10.1016 / s0014 - 5793 (01) 02930 - 1
Keller PJ, Schmidt AD, Santella A, Khairy K, Bao Z, Wittbrodt J, Stelzer EH:快速,高对比度成像动物发育扫描光片基于结构照明显微镜。自然方法2010年,7:637 - 642。10.1038 / nmeth.1476
Morin X Jaouen F Durbec P:g蛋白调节因子LGN对平面分裂的控制维持了鸡神经上皮中的祖细胞。Nat >2007年,10:1440 - 1448。10.1038 / nn1984
Olivier N, Luengo-Oroz MA, Duloquin L, Faure E, Savy T, Veilleux I, Solinas X, Debarre D, Bourgine P, Santos A,等。:利用无标记非线性显微镜重建早期斑马鱼胚胎的细胞系。科学(纽约,纽约州)2010年,329:967 - 971。10.1126 / science.1189428
方X,张鹏:非整倍体与肿瘤发生。Semin细胞发育生物学2011.
Gibson WT, Veldhuis JH, Rubinstein B, Cartwright HN, Perrimon N, Brodland GW, Nagpal R, Gibson MC:局部上皮拓扑控制有丝分裂分裂平面。细胞2011年,144:427 - 438。10.1016 / j.cell.2010.12.035
皮斯JC,蒂纳尔JS:癌症中有丝分裂纺锤体定向错误——偏离了方向,进入了火焰。细胞科学杂志2011年,124:1007 - 1016。10.1242 / jcs.081406
斯沃格J,穆佐帕M,洛佩斯-席尔H,夏普J:利用SPIM进行斑马鱼器官发生研究的4D回顾性谱系追踪。J Biophotonics2011年,4:122 - 134。10.1002 / jbio.201000087
郑刚,谢俊,Jain RK, Munn LL:微环境机械应激通过抑制癌细胞增殖和诱导细胞凋亡来控制肿瘤球体的大小和形态。《公共科学图书馆•综合》2009年,4:e4632。10.1371 / journal.pone.0004632
Helmlinger G, Netti PA, Lichtenbeld HC, Melder RJ, Jain RK:固体胁迫抑制多细胞肿瘤球体的生长。生物科技Nat》1997年,15:778 - 783。10.1038 / nbt0897 - 778
Rello-Varona S, Kepp O, Vitale I, Michaud M, Senovilla L, Jemaa M, Joza N, Galluzzi L, caststedo M, Kroemer G:一种自动荧光视频显微镜检测有丝分裂突变的方法。细胞死亡2010年,1:e25。10.1038 / cddis.2010.6
Shi J, Orth JD, Mitchison T:针对微管和驱动蛋白-5的抗有丝分裂药物反应的细胞类型变化。癌症研究2008年,68:3269 - 3276。0008 - 5472. - 10.1158 / - 07 - 6699
伊瓦斯库A,库比斯M:快速生成用于高通量细胞功能和毒性分析的单肿瘤球体。生物分子筛选杂志2006年,11:922 - 932。10.1177 / 1087057106292763
确认
非常感谢我们小组成员对这个项目的讨论和支持。感谢C. Featherstone对稿件的校对和建议。AM由grouement d'Intérêt Scientifique“Infrastructure en Biologie Santé et Agronomie”资助。这项工作得到了法国国家科学研究中心、l'Université Paul Sabatier、la Région Midi-Pyrénées、l’association pour la Recherche sur le Cancer、le Cancéropôle Grand Sud-Ouest和la foundation InNaBioSanté的支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
CF、VL和JF进行了成像实验。GG贡献了SPIM显微镜组件。AM开发并编写了AMISPIM软件。JF和PW开发了专用的成像处理。
CL、VL和BD构思了这项研究,并参与了设计和协调,并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。
电子辅助材料
13008 _2011_146_moesm1_esm.pdf
附加文件1:选择性平面照明显微镜(SPIM)设置。A: SPIM系统的原理图。SPIM设置的横向(B)和顶部(C)视图。绿色路径对应于照明轴,垂直的红色路径对应于检测轴。样品通过生理室(PC)的θ级(θS)悬浮,并位于检测目标的焦平面上。它可以在x、y、z轴上移动和旋转(θ轴,c中蓝色箭头)。T:望远镜;M:镜子;CL:圆柱透镜;TL:筒形透镜;IO:照明物镜; PC: physiological chamber; XS: X-stage; YS: Y-stage; ZS: Z-stage, θS: θstage; F and FW: filter wheel. D: The physiological chamber was designed using the Open source Blender software (top) and then manufactured by stereolithography of a photosensitive epoxy resin (bottom). The two tinny holes on the top of the chamber (red circles) allow to inject CO2 directly in the physiological chamber at the surface of the culture medium. (PDF 463 KB)
13008 _2011_146_moesm2_esm.pdf
附加文件2:用DRAQ5™标记的Capan-2人胰腺癌细胞的SPIM图像。答:与球面内指定深度处的XY光学切片对应的原始图像。比例尺50 μm。白色箭头表示位于球体内几个细胞层深度的分裂细胞。B:在130 μm深度处的XY平面,XZ和ZY平面平行于检测轴,虚线表示Y和X位置(标尺为50 μm)。插入对应于XY切片上白色方块区域的增大,显示有丝分裂细胞。比例尺为5 μm。沿x轴观测到的信号的逐渐损失是由光散射和球体的吸收引起的,这减弱了光片的照明。平行于光片的水平条纹(x轴)是特定于SPIM技术的样本依赖工件。C:在不同角度(0-315°)以90°的增量步骤记录的四个堆栈的多视图重建的3D可视化。 The corresponding stack is shown in Additional file14。(pdf 139kb)
13008 _2011_146_moesm3_esm。AVI
附加文件3:带有DRAQ5™标记的Capan-2细胞球体的三维SPIM成像。这段视频展示了250片z-stack,片间距为1 μm。箭头表示有丝分裂细胞。激光595 nm;照明物镜10× NA = 0.25;检测目标10× NA = 0.3。比例尺50 μm。(avi5mb)
13008 _2011_146_moesm4_esm。AVI
附加文件4:表达h2b - hcred球体的三维SPIM成像。电影显示两个合并的z堆栈在0°和180°。每个z-stack记录200个切片,切片间距为1 μm。箭头表示有丝分裂细胞。(avi5mb)
13008 _2011_146_moesm5_esm。AVI
附加文件5:表达h2b - hcred球体内有丝分裂细胞的三维SPIM成像。这个电影展示了有丝分裂细胞的28个切片。这些图像对应于附加文件中显示的z-堆栈中的一个区域4。(avi2mb)
13008 _2011_146_moesm6_esm。AVI
附加文件6:附加文件中显示的堆栈的两个区域的三维可视化5。箭头表示有丝分裂细胞。该可视化是通过斐济软件的3D查看器插件获得的。(avi1mb)
13008 _2011_146_moesm7_esm。AVI
附加文件7:表达h2b - hcred球体内有丝分裂细胞的三维重建。附加文件右侧显示的堆栈三维重建的可视化6(蓝色等值面,间相核;红色等值面,有丝分裂浓缩染色体)。(avi 7mb)
13008 _2011_146_moesm8_esm.pdf
附加文件8:用于延时采集的样品架制备。A:样品夹是用1.25 ml Combitip准备的,并从针尖中取出。在Combitip中吸入Phytagel溶液(PBS中10 g/l),并在样品容器中聚合后形成。B:样品架(灰色阴影)通过轻轻施加压力,然后悬浮在一个柱塞上,转移到显微镜的生理室。柱塞由Combitip制成,尖端被切断,留下一个空白空间(浅灰色)。C:放大的Phytagel样品架,显示由Combitip柱塞尖端形状产生的空腔。将培养基放入腔体中,在腔体中可以生长出球体。欲了解更多关于样品夹制备的详细信息,请在此处下载图解协议:http://www.ip3d.fr/IP3D/SPIM/SPIM.html(pdf 22kb)
13008 _2011_146_moesm9_esm。AVI
附加文件9:活体球体的SPIM成像。表达H2B-HcRed的活球体的SPIM成像。每3分钟记录100片z -stack,片间距为1 μm (10× objective, NA = 0.3)。z-stack的最大投影显示为每个时间点。(avi555kb)
13008 _2011_146_moesm10_esm。AVI
附加文件10:三维可视化的两个细胞的分裂。附加文件放大区域的三维可视化9显示两个细胞有丝分裂的过程。该可视化是通过斐济软件的3D查看器插件获得的。箭头表示两个分裂的单元格。(avi254kb)
13008 _2011_146_moesm11_esm。AVI
附加文件11:两个细胞分裂的三维重建。附加文件中显示的堆叠区域中对应于有丝分裂染色体(红色)和间期核(蓝色)3D重建的等值面可视化9。(avi 531 kb)
13008 _2011_146_moesm12_esm。AVI
附加文件12:紫杉醇处理的表达h2b - hcred的活球体的SPIM成像。每3分钟以1 μm的切片间距记录200个z层。对于每个时间点,显示每个堆栈放大区域的最大投影(10×物镜,NA = 0.3)。箭头表示有丝分裂细胞。(avi193kb)
13008 _2011_146_moesm13_esm。AVI
附加文件13:紫杉醇处理后有丝分裂细胞的三维重建。等值面的可视化对应于附加文件中显示的叠加区域的3D重建12。(avi 997 kb)
13008 _2011_146_moesm14_esm。AVI
附加文件14:通过DRAQ5染色的球体来叠加注册和融合的多视图。在附加文件中显示的重建球体堆叠的单个平面2摄氏度。(avi5mb)
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
洛伦佐,C.,弗朗吉亚,C.,乔兰德,R.。et al。用光片显微镜监测三维大球形肿瘤模型中的活细胞分裂动态。细胞Div6, 22(2011)。https://doi.org/10.1186/1747-1028-6-22
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1747-1028-6-22
关键字
- 光片
- 浓缩的染色体
- 人类胰腺癌细胞系
- 多细胞肿瘤球体
- 抗有丝分裂的药物