摘要
H2A的单泛素化是哺乳动物细胞中主要的组蛋白修饰。理解单泛素化H2A (uH2A)如何在染色质环境下调节基于dna的过程是一个具有挑战性的问题。过去几年的工作将uH2A与发育调节蛋白Polycomb组蛋白的转录抑制联系起来。近年来,人们发现了一些能够催化H2A中泛素去除的哺乳动物去泛素化酶(dub)。这些研究提供了令人信服的证据,证明H2A去泛素化与基因激活有关。此外,uH2A调控酶在细胞对DNA损伤的反应和细胞周期进程中起着至关重要的作用。在这篇综述中,我们将讨论uH2A生物学的新见解,重点是H2A dub。
背景
泛素的偶联(Ub)通过atp依赖性的Ub激活酶(E1)、Ub偶联酶(E2)和Ub连接酶(E3)的协同作用发生[1].含有76个氨基酸的Ub蛋白可通过多种方式与靶蛋白结合,赋予Ub介导的信号通路以高度的多样性潜力[2].作为单体,Ub可以与靶蛋白上的一个(单泛素化)或多个赖氨酸(多重单泛素化)连接。此外,Ub有7个赖氨酸残基,这些残基可以被修饰成多泛素链。赖氨酸48连接的Ub链通常针对蛋白质进行蛋白水解破坏。相比之下,单泛素化以及通过赖氨酸63形成的链在各种过程中具有调节作用,包括内吞作用、DNA修复、转录和染色质调节[2].泛素信号由所谓的“泛素受体”转导,这些蛋白质利用泛素结合域与泛素化靶标相互作用[3.].
影响DNA的过程,如转录、DNA复制、DNA修复和有丝分裂,都具有在染色质环境中进行DNA交易的能力。组蛋白是在染色质的基本单位——核小体中压缩DNA的基本蛋白质。在核小体核心粒子中,(H3-H4)2的四聚体与H2A-H2B的两个二聚体两侧形成组蛋白八聚体,在组蛋白八聚体周围包裹了146 bp的DNA [4].核心组蛋白与DNA相互作用,并通过组蛋白折叠结构域相互作用。此外,它们的非结构n端或c端(在H2A和H2B的情况下)“尾巴”从核小体突出,为各种酶的共价修饰提供位点。组蛋白修饰既直接起作用(影响核小体之间的接触),也间接起作用(通过招募非组蛋白蛋白),以协调染色质环境[5].很明显,共价修饰("标记")可以相互影响,它们的组合被提议组成一种"组蛋白编码",以调节染色质为基础的过程[6].
组蛋白H2A的单泛素化是哺乳动物细胞中最丰富的组蛋白修饰之一。泛素化位点被定位在H2A羧基末端的赖氨酸119 (K119)上,单泛素化H2A (uH2A)估计包含H2A的5-15%。组蛋白H2B在K120处单泛素化,约占总H2B的1% [7- - - - - -10].尽管H2A是第一个被证明泛素化的蛋白质,但长期以来uH2A的功能一直不为人知。直到最近,才发现Polycomb蛋白复合体Ring1A/B-Bmi1是一种主要的E3连接酶,靶向H2A,与uH2A基因沉默和肿瘤发展密切相关[11- - - - - -14];回顾于[15].越来越多的证据支持uH2A在维持基因组完整性方面的额外作用,进一步强调了这种修饰对肿瘤细胞生长的潜在影响[16- - - - - -21].
H2A的泛素化是动态的,正如uH2A的整体水平在细胞周期中变化的观察所表明的那样[22- - - - - -25].因此,最近报道了几种哺乳动物H2A去泛素化酶(dub)的存在。其中包括两个不同蛋白酶家族的成员[26].特别是2A-DUB属于JAMM/MPN+家族,而USP3、Ubp-M (USP16)、USP21和USP22属于USP(泛素特异性蛋白酶)家族[17,24,25,27- - - - - -29)(表1).在这篇综述中,我们讨论了uH2A如何调节转录的新发现,以及uH2A在DNA损伤信号转导和细胞周期进展中的新作用。重点将放在从H2A dub中学到的教训上。
基因抑制的uH2A
uH2A在转录中的作用一直存在争议(综述在[9,10])。直到最近,Polycomb抑制性复合体PRC1作为H2A泛素连接酶的表征强烈地将这种修饰与发育控制基因的沉默和x -失活联系起来。含有RING结构域的Ring1A和Ring1B(人体内的RING1和RNF2)是复合物中活跃的E3连接酶组分,负责大块单泛素化H2A的沉积([11- - - - - -14];回顾于[15)(表2).与抑制作用一致的是,在Ring1A/B缺陷细胞中,polycomb抑制启动子中的uH2A水平降低,这伴随着靶基因表达的诱导[11,13].除了PRC1外,在包含E2F-6的单独抑制复合物中也发现了Ring1B [30.]和Fbxl10 (JHD1B)和BcoR辅助抑制因子[31,32),分别。
通过不同的方法,最近的研究表明,uH2A的dub在基因激活中发挥功能作用,为uH2A拮抗转录提供了独立的证据。在本节中,我们将简要总结H2A DUBs Ubp-M (USP16)、USP21、2A-DUB和USP22在基因表达调控方面的研究结果[24,25,27- - - - - -29)(表1).接下来将更详细地讨论uH2A在不同转录阶段的潜在影响。最后,将从这些研究和其他研究中提出uh2a介导的抑制机制方面的线索。
H2A DUBs:对uh2a介导的转录抑制的新见解
Ubp-M (USP16)
从HeLa细胞中广泛生化纯化H2A去泛素活性,确定Ubp-M为负责酶[24].同意后,在体外Ubp-M对uH2A的活性此前已有报道[33].通过双染色质免疫沉淀实验,在Ubp-M敲除(KD) HeLa细胞中,Joo等.显示了同种异体(Hox)基因启动子上uH2A水平的增加,HoxD10,伴随基因抑制。野生型而非催化型突变体Ubp-M可以挽救HoxD10表达式[24].的在活的有机体内通过观察Ubp-M抗体的注射,提示Ubp-M介导Hox基因激活的相关性非洲爪蟾蜍胚胎导致了对HoxD10后侧发育的表达和缺陷。这种前后转化表型与polycomb -拮抗功能一致(见[15])。总之,这些数据表明Ubp-M通过H2A去泛素化抵消了Polycomb蛋白在Hox基因抑制中的作用。
USP21
Nakagawa及其同事使用肝脏再生作为模型系统[25].通过检测肝切除术后的基因表达变化,作者发现USP21表达上调。由于肝脏再生与整体uH2A的减少相关,USP21被假设为在这一过程中针对H2A进行去泛素化。确认了USP21 DUB对H2A的活性在体外.uH2A抑制作用的证据来自于在体外在转录分析中,用uH2A重组的染色质模板抑制了转录产物的形成。在活的有机体内肝脏中USP21的过表达与低水平的uH2A和一种基因的表达增加相关,Serpina6在正常的肝细胞再生过程中,该基因被下调。
2 a-dub
2A-DUB被鉴定为报告基因上雄激素受体(AR)转激活活性的阳性调控因子,其特征为组蛋白H2A DUB在体外而且在活的有机体内[27].2A-DUB是目前识别的uH2A蛋白酶中唯一的,具有JAMM/MPN+结构域,以及SANT和swm结构域,常在DNA和染色质相关蛋白中发现[26,27].2A-DUB的敲除导致双氢睾酮诱导的前列腺癌细胞系基因表达减弱,证实了内源性蛋白ar的协同调节作用。2A-DUB与p/CAF组蛋白乙酰转移酶相关。这导致了组蛋白乙酰化和H2A去泛素化之间可能的联系的研究。组蛋白乙酰化(在体外)和p/CAF (在活的有机体内)促进H2A去泛素化(图1).但p/CAF并未明显影响2A-DUB与启动子的结合,说明2A-DUB并没有被p/CAF直接募集。相反,依赖于p/CAF的乙酰化可能直接或间接地影响2A-DUB活性。
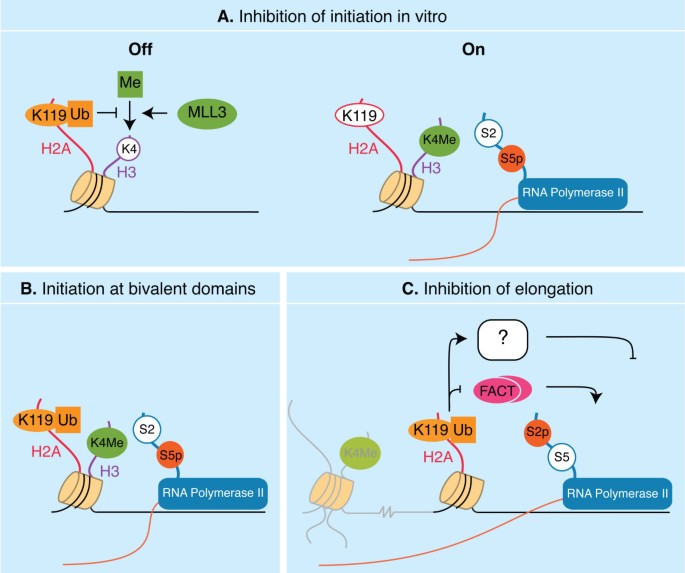
单泛素H2A (uH2A)和其他组蛋白修饰之间的串扰.在转录调节(A-C), DNA损伤反应(D)和细胞周期进展(E)的功能含义被说明。一个.H3/H4乙酰化通过2A-DUB刺激uH2A去泛素化在体外将这些转录调控中的修饰联系起来。B.uH2A阻止MLL3对H3K4的甲基化在体外.这可能是uH2A负面影响转录启动的机制之一。C.uH2A整体水平的升高与连接子组蛋白H1的低磷酸化相关,这与敲除H2A dub之一2A-DUB时观察到的结果一致。H1的磷酸化被认为有利于增强该组蛋白的染色质分离。uH2A可能通过促进/稳定H1与核小体的联系,减少染色质动力学,从而对转录产生负面影响。D.组蛋白磷酸化和泛素化在电离辐射(IR)的DNA损伤信号传导中协同作用。在IR中,H2AX的磷酸化导致了MDC1的募集和磷酸化。磷酸化的MDC1通过FHA结构域招募RNF8。RNF8随后聚泛素化H2A和H2AX。此外,tip60依赖的H2AX在K5上的乙酰化有利于H2AX在IR上的聚泛化。E.uH2A通过AuroraB激酶抑制H3 S10的磷酸化在体外,为调节G2/M的过渡提供了一种潜在的机制在活的有机体内.标签“Ub”、“Ac”、“Me”和“P”分别指单泛基化、乙酰化、二甲基化和三甲基化以及磷酸化。
USP22
H2B是已知的唯一泛素化的组蛋白酿酒酵母[34].单泛素化H2B (uH2B)是高度动态的,顺序泛素化和去泛素化是高效转录所必需的(在[10])。一种能够去泛素化H2B的DUB, Ubp8,存在于酵母SAGA共激活复合体中。最近的两篇论文表明,哺乳动物的SAGA复合体中含有一个Ubp8的同源物DUB USP22 [28,29],也被保存在果蝇[35].除了H2B, USP22还去泛素化H2A在体外[29].对于Ubp8,有报道USP22起激活作用。已知SAGA复合体对靶基因的招募依赖于序列特异性转录因子[36,37].因此,Zhang和同事发现USP22以myc依赖的方式被招募到myc靶基因[28].
uH2A会影响转录的特定步骤吗?
RNA聚合酶II介导的转录可细分为三个阶段:起始、延伸和终止。这些阶段与不同的组蛋白修饰以及RNA聚合酶II最大亚基的c端结构域(CTD)七肽重复的特定磷酸化模式有关。起始与H3K4二甲基化和三甲基化以及CTD丝氨酸5磷酸化(s5pCTD)相关,而H3K36三甲基化和CTD丝氨酸2磷酸化(s2pCTD)与延伸相关[38].在体外而且在活的有机体内采用了一些方法来解决uH2A是否影响转录起始或延伸。
首先,uH2A参与转录起始步骤是由在体外中川及其同事的研究[25].GAL4-VP16驱动转录在重组染色质模板上测定果蝇核提取物作为RNA聚合酶II的来源。如前所述,如果在添加RNA聚合酶之前组装染色质模板,uH2A会抑制转录。在类似的重构染色质模板上,作者发现uH2A通过甲基转移酶MLL3阻止H3K4二甲基化和三甲基化,而usp21介导的去泛素化可以缓解这种抑制(图1 b).重要的是,尽管存在uH2A,染色质与组蛋白H3 (H3K4R)的特定突变体组合,允许启动。在这些条件下,伸长正常发生,表明uH2A不抑制转录本身但它更可能是通过阻止H3K4甲基化而起作用,从而启动转录(图2).
在活的有机体内这一结论的支持来自朱的研究等.在2A-DUB [27].表达PSA基因被诱导,作者检查了染色质的变化PSA启动子,通过详细的ChIP实验,AR激活。AR激活导致uH2A的减少,同时启动子上S5pCTD的水平增加,因此,转录起始增加。所有这些事件都依赖于2A-DUB。虽然没有检测H3K4Me的水平,但这项研究表明uH2A限制了启动在活的有机体内也
其次,最近两篇关于H2A E3连接酶Ring1A/B和2A-HUB的论文研究了uH2A和转录延伸之间的联系[39,40].
Stock和同事检查了小鼠ES细胞中环1a和B的条件缺失和H2A单泛素化的全局丢失所抑制的基因的染色质变化[39].这些基因的启动子已被证明与活性(H3K4Me)和非活性(H3K27Me, uH2A)染色质的组蛋白标记相关,因此被称为双价[39,41,42,在[43].股票等.结果表明,在野生型细胞中,这些基因的编码区5'区域的低水平转录是可以检测到的。这一结果表明,尽管存在Ring1A/B和uH2A,转录还是被启动了2 b).事实上,在这些启动子中,S5pCTD RNA聚合酶的水平与积极转录的基因相当。鉴于RNA聚合酶II被证明在Ring1A/B缺失时与启动子下游区域相关联,数据支持一个模型,即依赖于ring1b的uH2A在延伸阶段阻碍转录(图2摄氏度).
一种新的H2A环型E3连接酶2A-HUB的表征进一步支持了uH2A参与启动下游的转录事件[40)(表2).2A-HUB基因的抑制会刺激细胞的伸长,但不会启动靶基因的转录,激昂的演说.uH2A主要存在于的启动子激昂的演说,而不是分布在双价基因的启动子和外显子区域。因此,在……的情况下激昂的演说, uH2A可能调节起始到延伸的过渡,这一过程称为启动子逃逸。
综上所述,目前还不清楚uH2A在哪个阶段影响转录周期。值得注意的是,目前的数据已经获得了不同的在活的有机体内而且在体外系统。例如,uH2A抑制H3K4甲基化在体外,而根据定义,这些标记共存于ES细胞的双价启动子中在活的有机体内.这表明uH2A对H3K4甲基化有严格的抑制作用在体外在二价启动子上被绕过了在活的有机体内,允许入会。如果这种解释是正确的,它将预测可能有不同类别的目标基因,由专门的机制调节。另外,我们可以想象,在活的有机体内, uH2A可能作为一个“着陆平台”,用于招募尚未分离的含有泛素结合域的调控蛋白(图2摄氏度).这些蛋白的鉴定对于理解uh2a介导的调控机制至关重要。最后,不能排除DUBs和E3连接酶靶向H2A对转录阶段的影响部分独立于其酶促功能。
组蛋白串扰和染色质动力学
DUBs USP21和2A-DUB的研究表明,uH2A可能影响其他组蛋白的翻译后修饰,包括H3K4甲基化(如前所述)和H1磷酸化[25,27)(图1 b而且1 c).uH2B和H3甲基化之间的这种“跨组蛋白”串扰已经得到了很好的表征[10].我们之前讨论过uH2A如何负面影响H3K4甲基化。这里我们将报道uH2A-H1的相互作用。此外,我们将提出一个明确的机制,涉及组蛋白伴侣FACT的发现。
H2A的c端尾部含有K119泛素化位点,可到达核小体中的连接子组蛋白H1 [4].含有wt或其泛素化突变体K119R的核小体的免疫沉淀显示,H1优先与wt H2A相关,这表明H2A的泛素化促进了与H1的相互作用[40].这一点已经得到证明在体外[44].H1可以磷酸化:一种与增强H1动力学和染色质分离有关的修饰[45].Zhou和他的同事报告说,在2A-DUB敲除细胞中,uH2A的全球增加与磷酸化H1的减少有关[40].敲除Ring1B的作用正好相反。总的来说,这些发现表明uH2A阻碍H1从染色质的排出,这通常与有利于转录的开放染色质构象有关(图1 c).
最后,uH2A和组蛋白伴侣蛋白之间的功能联系FACT (足总cilitatesChromatinT征兵)已被提议[40].事实复合体已被证明促进延伸,可能是通过去除H2A/H2B二聚体,从而使RNA聚合酶II通过染色质移动[46].染色质与FACT的联系激昂的演说2A-HUB基因的下调会刺激uH2A基因的表达。生物化学上,FACT主要与非泛素化H2A相关。一个可能的结论是uH2A阻止了事实关联。H2A去泛素化将允许FACT结合并促进延伸。需要更详细的生化分析来阐明uH2A-FACT相互作用的机制含义。罗森菲尔德实验室的2A-DUB和2A-HUB研究的一个重要意义是,H2A的泛素化可能影响核小体动力学(在DNA损伤反应部分也讨论过),以及高阶染色质结构。
综上所述,上述研究强调了H2A DUBs在基因表达中的积极作用。此外,尽管有一些冗余,[27- - - - - -29], Ubp-M、USP21、USP22和2A-DUB似乎参与了特定转录程序的调控(表51).为了理解dub如何调节转录以及它们的活动有多具体,重要的问题是:i)这些酶在染色体的哪里结合,ii)它们调节哪些基因。基因表达谱和全基因组鉴定在活的有机体内dub的DNA结合位点(ChIP on ChIP, ChIP - seq或DamID技术)在未来几年将需要并需要大量的努力。由于很难开发出针对uH2A的高度特异性抗体,另外一个挑战是绘制包含uH2A的染色体区域。最后,将这些数据与组蛋白修饰和关键染色质修饰物(包括组蛋白E3连接酶、甲基转移酶、去甲基化酶和重塑酶)的全基因组染色质关联数据进行整合,可能会进一步深入了解组蛋白修饰之间复杂的串扰。
uH2A: DNA损伤的标志?
基因组完整性是通过DNA修复过程和DNA损伤检查点路径之间的功能相互作用来维持的,它们负责阻止细胞周期,以实现忠实的修复[47].组蛋白修饰在DNA损伤反应(DDR)和DNA修复中都起着至关重要的作用。它们可以通过i)促进DDR信号通路或ii)影响染色质折叠/组织发挥作用。第二种模式主要通过控制效应蛋白的结合来实现,其中染色质重塑因子能够改变组蛋白- dna的接触[48].
越来越多的证据表明,组蛋白泛素化是DNA损伤反应的一部分。研究酿酒酵母提示泛素化H2B在紫外线刺激时检查点激活中的作用[49]以及在减数分裂过程中某些染色体位点上DNA双链断裂(dsb)的形成[50].在哺乳动物细胞中,紫外线照射可显示H2A、H3和H4的单泛素化增加[16,21,51];回顾于[52].最近对DUB USP3和E3/E2连接酶复合体RNF8-Ubc13这两种新型组蛋白修饰物的表征支持uH2A在基因组维护中发挥更广泛的作用[17- - - - - -19,53- - - - - -55].在这里,我们将讨论uH2A在这些研究中对电离辐射(IR)的响应的参与。
IR诱导DNA损伤信号/修复因子重新定位到IRIF (IR诱导的核病灶)。除了蛋白质积累外,IRIF还反映了双链DNA断裂(dsb)的染色质重排和组蛋白翻译后修饰[56,57].组蛋白H2A变体H2AX (γH2AX)被ATM(突变性毛细血管扩张失调)、ATR (ATM和rad3相关)和DNA- pk (DNA依赖蛋白激酶)检查点激酶磷酸化是对DNA损伤响应的早期事件,代表了IR上最强大的组蛋白修饰[47].γH2AX有助于几种介质/修复因子在病变周围的染色质上的有效积累和保留,包括MDC1、BRCA1、53BP1和ATM [58,59].
一些泛素化事件发生在dsb修复位点,如IRIF泛素化底物的局部积累所示[53,60- - - - - -62].然而,直到最近,使用抗uH2A抗体的免疫荧光研究发现,在全球红外和局部激光介导的微照射早期,uH2A在含有γ h2ax的核病灶处积累[17,19].哪些种类的泛素化H2A聚集在dsb ?免疫纯化内源性或异位表达的H2A或H2AX发现,暴露于高IR剂量的细胞中寡聚和多泛素化物种增多[18- - - - - -20.,53].蔚等.表明H2AX在IR上以二泛素化为主。值得注意的是,H2AX双泛素化依赖于其S139磷酸化位点,这表明磷酸化是泛素化的先决条件[18].至于泛素化位点,目前尚不清楚除了经典赖氨酸119外,其他赖氨酸的泛素化是否也参与DSB反应[18,20.].这些研究表明,ir诱导的H2A/H2AX泛素标记包含多种泛素化物种,这与稳态uH2A不同。
在ir反应过程中,组蛋白泛素标记是如何设置的?
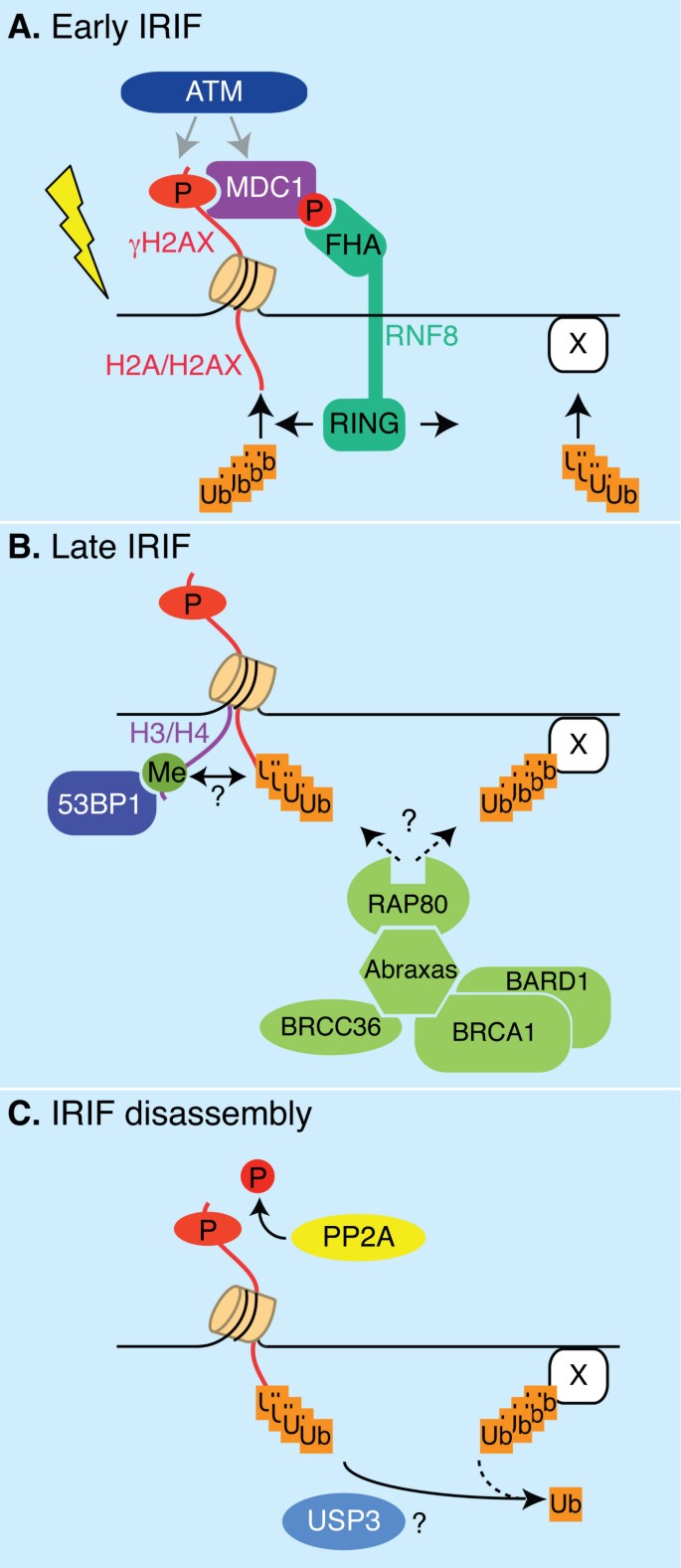
最近四项独立研究发现RNF8是E3连接酶,负责对dsb反应中的H2A/H2AX泛素化[18,19,54,55].RNF8在IR上的dsb处迅速积累,与早期IRIF标记物(即γH2AX、ATM、MRN复合体和中介蛋白MDC1)一起[19].磷酸苏酰基结合的FHA结构域和环指结构域的存在使RNF8能够在irif上将磷酸化与泛素化信号连接起来(图1 d).四个实验室提供的数据与ATM从H2AX磷酸化开始的信号级联是一致的(图3.).这一步是众所周知的,它允许MDC1的直接募集和随后的ATM磷酸化[59].通过其FHA结构域,RNF8又可以在dsb上与磷酸- mdc1结合,在那里催化泛素化事件,其中H2A和H2AX泛素化(图1)3).在IRIF, RNF8可能与泛素结合酶Ubc13协同作用,Ubc13是先前报道的RNF8的相互作用因子[18,53- - - - - -55,63].最后,BRCA1和53BP1在dsb的招募和保留需要rnf8 - ubc13依赖的泛素化[18,19,54,55)(图3 b).除了组蛋白泛素化外,IRIF的泛素信号可能包括多种复杂的泛素化事件,这也表明,为了高效的泛素积累,第二种E3连接酶活性BRCA1的部分需求也表明了这一点[60,62].这些可能包括组蛋白或其他底物上泛素化信号的扩增,以及E3酶的自泛素化作为自调节机制[64,65].RNF8和BRCA1都可以促进组蛋白的自泛素化和泛素化在体外[19,63,66,67].
电离辐射诱发核靶点信号网络.一个.IR后早期,受损的DNA触发ATM激活,从而磷酸化断裂位点附近的H2AX和MDC1。RNF8通过与磷酸化的MDC1结合募集到IRIF。RNF8在局部泛素化H2A, H2AX和可能的其他尚未确定的蛋白质(“X”)。B.53BP1和BRCA1的募集需要rnf8依赖的泛素偶联。BRCA1存在于包含BARD1、Abraxas/CCDC98、BRCC36和RAP80的蛋白复合体中。BRCA1的招募需要RAP80结合泛素。然而,泛素化底物RAP80与(组蛋白或其他蛋白质)结合的性质仍不清楚。除了BRCA1,泛素化还允许53BP1(与甲基化的H3/H4结合)通过一种未知的机制募集。C.IRIF的拆卸可能涉及到PP2A对γH2AX的去磷酸化。DUB USP3是IRIF去除共轭泛素的候选蛋白。
这些研究揭示了ATM信号与双链断裂时组蛋白H2A和H2AX泛素化之间令人兴奋的联系。uH2A是否直接参与了IRIF DDR因子的招募仍有待确定。
uh2a介导的DDR机制
含有泛素相互作用基序(UIM)的蛋白质Rap80是在IRIF中履行泛素受体功能的一个很好的候选者。Rap80最初被证明可以将Rap80-ccd98/abraxas-BRCA1复合体招募到dsb上的泛素共轭物[61,68,69)(图3 b).最近,研究表明Rap80在IRIF中的积累依赖于功能性RNF8-Ubc13蛋白[18,19,54,55].在体外而且在活的有机体内Rap80优先与赖氨酸63-异肽连接的四红素聚合物结合,较少与k6连接的链结合[61].重要的是,Rap80泛素结合的特性与以下发现非常吻合:i)通过赖氨酸63形成的链先前已被证明调节DNA修复过程等[60, ii)通过k63连接的泛素化,IRIF上的泛素焦点最有效地形成[61和iii) Ubc13是唯一能够通过K63催化多泛素化的E2 [70],是RNF8的E2伙伴[63].尽管这些证据与Rap80将RNF8-Ubc13在IRIF的泛素化与DDR介导因子BRCA1相一致,但仍需要研究Rap80与泛素化的H2A/H2AX的潜在直接结合。
值得注意的是,H2A泛素化可能通过其他机制影响DDR。一种似是而非的可能性是uH2A/H2AX可能促进染色质的更全面的改变,已知发生在dsb [57,71,允许暴露其他组蛋白标记。这一机制可能与53BP1到IRIF的再定位有关,正如53BP1与甲基化组蛋白结合的研究结果所表明的那样[72,73],其招聘独立于Rap80 [18,19,55,68].有趣的是,Ikura和他的同事报告了微照射部位H2AX的移动性增强和聚泛素化的H2AX从染色质快速释放[20.].H2AX泛素化和组蛋白释放依赖于TIP60及其乙酰化靶标H2AX K5(图5)1 d).果蝇Tip60可以乙酰化H2Av(果蝇H2AX),并促进其与未磷酸化的H2Av的交换[74].这项工作提示了泛素化可能促进组蛋白动力学/去除的机制。
dsb中uH2A标记的去除:USP3的作用?
染色质翻译后修饰被清除,蛋白质组合被拆卸,以及修复完成后检查点被关闭的机制是一个有趣的开放问题。我们小组最近的工作表明,USP3,以前被认为是DUB [75,显示出对uH2A和uH2B的去泛素活性在活的有机体内[17].USP3似乎通过两种主要方式参与DDR:对IR的响应和正常的s期进展(如下文所述)。在IR下,包含uH2A、泛素和γH2AX的IRIF持续存在于USP3敲除细胞中[17].先前发表的结果表明,去磷酸化和H2AX的去除是有效修复和恢复细胞周期所必需的[76- - - - - -78].一致的是,USP3敲除细胞在G2/M转变中显著延迟。总之,这些数据表明,去除dsb周围染色质上的泛素化标记对于协调IRIF的拆卸、γH2AX去磷酸化和细胞周期恢复是必要的(图3 c).不同于酿酒酵母[77,78], H2AX被磷酸酶PP2A去磷酸化被认为发生在染色质上,因为这种酶定位于IRIF [76].USP3是否以及如何与PP2A串扰,例如通过影响后者的招募或活动,目前尚不清楚。虽然在IRIF中USP3似乎有利于底物(其中uH2A)的去泛素化,但我们无法检测到USP3在这些病灶的局部积累(未发表的结果)。这可能是由于USP3在催化作用下迅速释放其染色质底物的结果,这是由光漂白(FRAP)后的荧光恢复和免疫共沉淀测定的[17].此外,USP3 DUB活性可能需要“脱离染色质”或可能是间接的。为了更好地理解USP3介导的DDR的分子机制,需要分离USP3相互作用的伙伴和潜在的其他底物,以及确定USP3是否以及如何被调节。
含有DUB的JAMM结构域BRCC36也可能在dsb中发挥作用:它是BRCA1 A复合体(与RAP80和Abraxas一起)的一部分,定位于IRIF并正调控BRCA1/BARD1 E3连接酶[55,61,79,80].然而,BRCC36在IRIF中的作用尚不清楚,其对泛素化组蛋白的活性尚未被研究。
总之,H2A的新E3连接酶(RNF8)和DUB活性(USP3)的发现为我们提供了有价值的工具来处理染色质上泛素介导的信号。我们可以设想几种实验方法来阐明uH2A/ uh2ax介导的DDR的分子机制。这些包括:i)核小体上E3 (RNF8, BRCA1)和DUB活性(USP3,其他?)的生化表征;ii)在H2A/H2AX上识别ir诱导的泛素化位点;iii) uH2A/uH2AX结合蛋白的分离;iv) DSB周围泛素标记范围的定义。此外,利用蛋白质组学方法对染色质上泛素化蛋白和泛素受体的复杂混合物进行表征,将有可能揭示DDR中的新角色。
uH2A和细胞周期
组蛋白修饰在细胞周期过程中染色质包装的调控中起着关键作用。在G0-G1/S过渡期间,需要去除抑制性组蛋白标记以允许S期基因的表达[30.,81].全基因组染色质重排发生在s期,以提供复制机制的可及性,并恢复新合成DNA的表观遗传景观(见[82])。最后,在有丝分裂和细胞分裂过程中染色质冷凝和解冷凝是必需的(在[5])。
与大多数组蛋白标志一样,泛素化是细胞周期调控的。uH2A最初被报道在静息(G0)和分化细胞中减少[22].后来,Vassilev等.描述了一种能够识别uH2A的单克隆抗体。使用这种抗体,作者报告说非增殖细胞显示的uH2A水平比增殖细胞低。此外,检测到uH2A与PCNA复制位点的部分共定位,提示uH2A在细胞增殖/DNA复制中的作用[83].有趣的是,uH2A和(异常)细胞生长之间的联系也正在显现在活的有机体内.与正常组织相比,在肝脏再生模型和原发性前列腺肿瘤中观察到uH2A的动态变化[25,27].在增殖细胞中,uH2A在整个细胞周期中都存在,但在G2/M过渡期间被下调,在浓缩染色体上不存在[23,24].
h2a - dub:在细胞周期调节中的特定作用?
在靶向H2A的dub中,USP22、Ubp-M和USP3与细胞周期进程有关。这些酶的下调一致导致不同人类细胞系的生长障碍,尽管方式不同:i)通过shrna介导的USP22的下调,p53缺陷的H1299细胞和正常的人类成纤维细胞都在G1中积累[28];ii) usp3缺失的U2OS细胞s期进展明显延迟,有丝分裂指数低[17];iii) HeLa细胞中稳定的Ubp-M敲除导致G2/M细胞比例下降[24].另外两种H2A dub 2A-DUB和USP21对细胞周期进展的潜在影响尚未得到研究[25,27].
如前所述,uH2A在功能上与转录调控和DNA损伤信号通路相关。uH2A是通过细胞周期基因的转录调控或DDR激活影响细胞增殖,还是通过直接机制?数据表明,间接和直接的机制可能都是相关的。
首先,USP22被描述为SAGA复合体中的转录协同激活因子(参见前面关于转录的段落)[28,29].因此,USP22对G1/S转变的抑制作用可能依赖于其转录活性。此外,myc驱动的转录和转化需要USP22。鉴于USP22及其果蝇的同系物“直系果蝇”似乎调节了一大批基因,因此需要进行基因表达分析和遗传学研究,以确定参与细胞周期进展的关键USP22靶基因[28,29,35].
第二,我们小组的数据指出了USP3可能影响细胞周期的一个独特机制。USP3-KD细胞中的s期延迟伴随自发的γH2AX聚焦、DNA断裂的积累和ATM-和atr介导的检查点反应的完全激活[17].在USP3 KD上观察到特定的表型,包括i)合并BrdU的能力降低,见证DNA合成受损,ii)复制蛋白A (RPA)包裹的单链DNA的存在,iii) ATR-Chk1通路的激活。这些特征与经历复制应激的USP3 KD细胞一致,表明在这些细胞中s期延迟和G2/M阻滞与DDR激活密切相关。USP3是否直接影响DNA复制过程/机制,还是通过uh2a介导的DDR信号,目前是研究的主题。在胸腺嘧啶诱导的复制应激以及外源性DNA损伤(如前所述)时,USP3 KD细胞中持续存在的γH2AX和uH2A DNA损伤焦点支持USP3参与泛素(uH2A)介导的信号传导(F. Nicassio和E. Citterio未发表的结果)。最后,观察到usp3缺失细胞中的γH2AX焦点与s期的开始相一致,这表明DDR激活需要DNA复制(F. Nicassio和E. Citterio未发表的结果)。研究USP3如何影响复制动态可能有助于理解USP3/uH2A在复制分叉的作用及其与s期检查点的功能相互作用。
第三,H2A在G2/M过渡过程中全局去泛素化,这与H3在S10位点的磷酸化有关,这是有丝分裂的一个标志[24].有趣的是,Joo等.表明Ubp-M是有丝分裂H2A去泛素化所必需的,而抑制Ubp-M会导致G2/M延迟。此外,在体外利用重组核小体进行的实验显示,uH2A抑制了AuroraB对丝氨酸10上H3的磷酸化,至少部分是通过阻止激酶与核小体的结合(图1 e).UbpM对H2A去泛素化可以缓解对AuroraB的抑制。由于染色体凝结需要AuroraB对H3S10的磷酸化在体外结果提出了令人兴奋的可能性,ubp -M介导的H2A去泛素化可能通过直接机制影响G2/M的过渡。进一步的调查将会证实这是否属实在活的有机体内.
有趣的是,尽管靶向相同的底物,H2A dub在细胞周期调节中的作用显示特异性。目前还不清楚这种特异性是由于除了H2A之外的其他蛋白质靶点,还是其他机制。因此,评估不同的H2A dub是否可以在细胞周期进展中挽救彼此的缺陷将是有趣的。
最后,H2A E3连接酶Ring1B和RNF8明显与细胞增殖有关。不同小组的研究支持RNF8在有丝分裂中的功能作用,显示其对有丝分裂退出的要求[84,85].RNF8对有丝分裂的影响是否依赖于H2A的泛素化仍有待研究。至于Ring1B,其在小鼠中的缺失与胃泌停止和胚胎死亡有关[86].由于Ring1B的缺失强烈影响其靶基因的表达,因此很难区分Ring1B对细胞周期进展的直接和间接影响[86,87].敲低Ring1B导致U2OS细胞周期阻滞[11].更详细地分析这种表型以评估细胞周期的哪个阶段受到影响将是有趣的。
结束语
总之,讨论的数据表明uH2A对细胞生理学的几个重要方面有影响。尽管最近的工作提供了关键的见解,但我们才刚刚开始破译uH2A的作用。有趣的是,尽管有共同的底物,单个H2A dub似乎表现出不同的功能角色。在这方面,我们将提出有关活性调节、招募和底物特异性的关键问题,这些问题的解决预计将大大提高我们对dub如何影响H2A多效性功能的认识。
如何调节H2A dub的活性?与调控的、非催化的蛋白亚基和翻译后修饰的相互作用已被证实可调节DUB活性,包括USP7、USP1和USP28的活性[88- - - - - -93].类似的机制可能适用于H2A dub。USP22显示在体外H2A DUB活性仅在SAGA背景下,这表明复合物的其他亚基对其活性的调节很重要[27,29].已报道过UbpM的磷酸化(USP16)和2A-DUB的单泛素化[24,27,33].然而,这些观察结果的功能意义仍有待阐明。
H2A dub是如何被招募到特定的染色体位点的?如前所述,在USP22和2A-DUB的情况下,对其各自目标基因的局部募集已被证明依赖于它们所处蛋白质复合物的组成部分(USP22为SAGA),以及特定的转录因子[27- - - - - -29].两种dub, 2A-DUB和USP22与HATs相关的发现表明这类酶之间有重要的功能相互作用。其他dub(络合物)的生化纯化尚未进行。
H2A dub是否针对其他底物进行去泛素化?除H2A外,USP3和USP22也能去泛素化H2B [17,28,29,35].此外,USP22可能需要额外的非组蛋白去泛素化,这表明在其果蝇同系物失去功能时,其他泛素化蛋白的积累[94].针对多个衬底的能力在dub中并不是前所未有的[90,93].为了更好地理解H2A dub的功能,确定假定的额外关键底物是必不可少的。
最后,多项观察表明,H2A(去)泛素化影响染色质动力学,部分是通过FACT和Tip60等组蛋白伴侣的作用[20.,27,40].这可能是转录、DDR和DNA复制过程中促进染色质重组的一种常见模式,解释了H2A dub和uH2A发挥作用的过程的多样性。研究H2A泛素化对组蛋白迁移率的影响以及定义uH2A如何影响染色质重塑复合物/组蛋白伴侣的活性是很重要的。这篇综述中描述的DUBs和E3连接酶以及潜在的新连接酶的鉴定无疑将极大地促进这类分析。
参考文献
Pickart CM, Eddins MJ:泛素:结构,功能,机制。生物化学生物物理学报2004年,1695:55 - 72。10.1016 / j.bbamcr.2004.09.019
沃尔克T,西吉斯蒙德S,佩尼戈L,波罗S:泛素化代码:信号问题。细胞Div2007年,2:11.10.1186 / 1747-1028-2-11
希克L,舒伯特HL,希尔CP:Ubiquitin-binding域。Nat Rev Mol细胞生物学2005年,6:610 - 621。10.1038 / nrm1701
Luger K, Mader AW, Richmond RK, Sargent DF, Richmond TJ:核小体核粒子在2.8 A分辨率下的晶体结构。自然1997年,389:251 - 260。10.1038/38444
Kouzarides老师:染色质修饰及其功能。细胞2007年,128:693 - 705。10.1016 / j.cell.2007.02.005
Jenuwein T, Allis CD:翻译组蛋白编码。科学2001年,293:1074 - 1080。10.1126 / science.1063127
戈尔德诺普夫IL,泰勒CW,鲍姆RM,约曼LC,奥尔森MO,普雷斯泰科AW,布希H:“组蛋白样”非组蛋白染色体蛋白A24的分离与鉴定。J生物化学1975年,250:7182 - 7187。
索恩·AW,索蒂埃P,布里安德·G,克兰-罗宾逊C:泛素化组蛋白H2B的结构。EMBO J1987年,6:1005 - 1010。
张Y:组蛋白泛素化和去泛素化的转录调控。基因开发2003年,17:2733 - 2740。10.1101 / gad.1156403
Shilatifard答:甲基化和泛素化修饰染色质:在基因表达调控中的意义。Annu Rev生物化学2006年,75:243 - 269。10.1146 / annurev.biochem.75.103004.142422
王宏,王磊,Erdjument-Bromage H, Vidal M, Tempst P, Jones RS,张勇:组蛋白H2A泛素化在Polycomb沉默中的作用。自然2004年,431:873 - 878。10.1038 / nature02985
de Napoles M, mermooud JE, Wakao R, Tang YA, Endoh M, Appanah R, Nesterova TB, Silva J, Otte AP, Vidal M, Koseki H, Brockdorff N:多梳组蛋白Ring1A/B连接组蛋白H2A的泛素化与遗传基因沉默和X失活。Dev细胞2004年,7:663 - 676。10.1016 / j.devcel.2004.10.005
曹锐,筑田勇,尹泽:Bmi-1和Ring1A在H2A泛素化和hox基因沉默中的作用。分子细胞2005年,20:845 - 854。10.1016 / j.molcel.2005.12.002
Buchwald G, van der Stoop P, Weichenrieder O, Perrakis A, van Lohuizen M, Sixma TK:多梳蛋白Bmi1和Ring1b的Ring-Ring复合物的结构和e3 -连接酶活性。Embo J2006年,25:2465 - 2474。10.1038 / sj.emboj.7601144
Sparmann A, van Lohuizen M:多梳消声器控制细胞命运,发展和癌症。Nat Rev癌症2006年,6:846 - 856。10.1038 / nrc1991
Bergink S, Salomons FA, Hoogstraten D, Groothuis TA, de Waard H, Wu J, Yuan L, Citterio E, Houtsmuller AB, Neefjes J, Hoeijmakers JH, Vermeulen W, Dantuma NP:DNA损伤触发核苷酸切除修复依赖的组蛋白H2A单泛基化。基因开发2006年,20:1343 - 1352。10.1101 / gad.373706
Nicassio F, Corrado N, Vissers JH, Areces LB, Bergink S, Marteijn JA, ge维特B, Houtsmuller AB, Vermeulen W, Di Fiore PP, Citterio E:人类USP3是S期进展和基因组稳定性所需的染色质修饰物。咕咕叫杂志2007年,17:1972 - 1977。10.1016 / j.cub.2007.10.034
Huen MS, Grant R, Manke I, Minn K, Yu X, Yaffe MB,陈婧:RNF8通过组蛋白泛素化和检查点蛋白组装转导dna损伤信号。细胞2007年,131:901 - 914。10.1016 / j.cell.2007.09.041
梅兰N, Bekker-Jensen S,福斯特普H,梅兰德F,巴泰克J,卢卡斯C,卢卡斯J:RNF8在DNA双链断裂处泛素化组蛋白,促进修复蛋白的组装。细胞2007年,131:887 - 900。10.1016 / j.cell.2007.09.040
伊库拉T、田代S、Kakino A、岛H、Jacob N、阿木母R、约德K、泉S、仓冈I、田中K、木村H、伊库拉M、西久保S、伊藤T、武藤A、宫川K、武田S、费希尔R、五岚K、神谷K:H2AX的乙酰化和泛素化增强了染色质动力学。摩尔细胞生物学2007年,27日:7028 - 7040。10.1128 / MCB.00579-07
Kapetanaki MG, Guerrero-Santoro J, Bisi DC, Hsieh CL, Rapic-Otrin V, Levine AS:DDB1-CUL4ADDB2泛素连接酶在着色性干皮病E组中缺失,并靶向uv损伤DNA位点的组蛋白H2A。美国国家科学研究院2006年,103:2588 - 2593。10.1073 / pnas.0511160103
温施,哈斯,洛:肌发生过程中组蛋白的合成和泛素化。开发生物1987年,119:85 - 93。10.1016 / 0012 - 1606 (87) 90209 - 0
Mueller RD, Yasuda H, Hatch CL, Bonner WM, Bradbury EM:多头绒泡菌泛素化组蛋白2A和2B的鉴定。这些蛋白在中期消失,在后期重新出现。J生物化学1985年,260:5147 - 5153。
朱海燕,翟亮,杨超,聂松,Erdjument-Bromage H, Tempst P,常超,王浩:通过H2A去泛素化调控细胞周期进展和基因表达。自然2007年,449:1068 - 1072。10.1038 / nature06256
中川T、嘉谷T、东哥S、益子N、大丹H、久川Y、曲次T、松山T、伊仓T、村松M、伊藤T:组蛋白H2A的去泛素化通过与H3K4二甲基化和三甲基化的跨组蛋白交联激活转录起始。基因开发2008年,22:37-49。10.1101 / gad.1609708
Nijman SM, Luna-Vargas MP, Velds A, Brummelkamp TR, Dirac AM, Sixma TK, Bernards R:去泛素化酶的基因组和功能目录。细胞2005年,123:773 - 786。10.1016 / j.cell.2005.11.007
朱鹏,周伟,王杰,Puc J, Ohgi KA, erdjumt - bromage H, Tempst P, Glass CK, Rosenfeld MG:组蛋白H2A去泛素酶复合体在转录调控中协调组蛋白乙酰化和H1解离。摩尔细胞2007年,27日:609 - 621。10.1016 / j.molcel.2007.07.024
张xy、Varthi M、Sykes SM、Phillips C、Warzecha C、Zhu W、Wyce A、Thorne AW、Berger SL、McMahon SB:假定的癌症干细胞标记物USP22是激活转录和细胞周期进展所需的人类SAGA复合体的一个亚基。摩尔细胞2008年,29日:102 - 111。10.1016 / j.molcel.2007.12.015
赵颖,郎G,伊藤S, Bonnet J, Metzger E,泽watsubashi S,铃木E, Le Guezennec X, Stunnenberg HG, Krasnov A, Georgieva SG, Schule R, Takeyama K,加藤S, Tora L, Devys D:TFTC/STAGA模块介导组蛋白H2A和H2B去泛素化,协同激活核受体,抵消异染色质沉默。摩尔细胞2008年,29日:92 - 101。10.1016 / j.molcel.2007.12.011
小川H、石黑K、高巴茨S、利文斯顿DM、中谷Y:一种具有染色质修饰物的复合体,占据G0细胞中E2F和myc响应基因。科学2002年,296:1132 - 1136。10.1126 / science.1069861
桑切斯C、桑切斯I、德默斯JA、罗德里格斯P、斯特鲁布里斯J、维达尔M:对Ring1B/Rnf2互作物的蛋白质组学分析发现了一种与Fbxl10/Jhdm1B组蛋白去甲基化酶和Bcl6互作辅抑制因子的新型复合体。摩尔细胞蛋白质组学2007年,6:820 - 834。10.1074 / mcp.M600275-MCP200
吉尔哈特MD,科克伦CM,沃姆斯塔德JA,巴德维尔VJ:在一种新的bor复合体中发现了Polycomb基团和SCF泛素连接酶,该复合体被招募到BCL6靶标上。摩尔细胞生物学2006年,26日:6880 - 6889。10.1128 / MCB.00630-06
蔡思思,巴比特RW,马尔切西VT:一种突变的去泛素化酶(Ubp-M)与有丝分裂染色体结合并阻止细胞分裂。美国国家科学研究院1999年,96:2828 - 2833。10.1073 / pnas.96.6.2828
Robzyk K, Recht J, Osley MA:酵母中组蛋白H2B的rad6依赖性泛素化。科学2000,287:501 - 504。10.1126 / science.287.5452.501
Weake VM, Lee KK, Guelman S, Lin CH, Seidel C, Abmayr SM, Workman JL:在果蝇视觉系统中,saga介导的H2B去泛素化控制神经元连接的发展。Embo J2008年,27日:394 - 405。10.1038 / sj.emboj.7601966
Brown CE, Howe L, Sousa K, Alley SC, Carrozza MJ, Tan S, Workman JL:通过直接激活剂与atm相关的Tra1亚基相互作用募集HAT复合体。科学2001年,292:2333 - 2337。10.1126 / science.1060214
Park J, Kunjibettu S, McMahon SB, Cole MD:trap的atm相关结构域是组蛋白乙酰转移酶募集和myc依赖性肿瘤发生所必需的。基因开发2001年,15:1619 - 1624。10.1101 / gad.900101
Li B, Carey M, Workman JL:染色质在转录过程中的作用细胞2007年,128:707 - 719。10.1016 / j.cell.2007.01.015
股票JK,贾德罗西S,卡萨诺瓦M,布鲁克斯E,维达尔M, Koseki H,布罗克多夫N,费舍尔AG, Pombo A:环1介导的H2A泛素化抑制小鼠ES细胞中双价基因的稳定RNA聚合酶II。Nat细胞生物学2007年,9:1428 - 1435。10.1038 / ncb1663
周伟,朱鹏,王杰,Pascual G, Ohgi KA, Lozach J, Glass CK, Rosenfeld MG:组蛋白H2A单泛素化通过抑制RNA聚合酶II转录伸长抑制转录。摩尔细胞2008年,29日:69 - 80。10.1016 / j.molcel.2007.11.002
Bernstein BE、Mikkelsen TS、Xie X、Kamal M、Huebert DJ、Cuff J、Fry B、Meissner A、Wernig M、Plath K、Jaenisch R、Wagschal A、Feil R、Schreiber SL、Lander ES:双价染色质结构标志着胚胎干细胞的关键发育基因。细胞2006年,125:315 - 326。10.1016 / j.cell.2006.02.041
Azuara V, Perry P, Sauer S, Spivakov M, Jorgensen HF, John RM, Gouti M, Casanova M, Warnes G, Merkenschlager M, Fisher AG:多能细胞系的染色质特征。Nat细胞生物学2006年,8:532 - 538。10.1038 / ncb1403
Pietersen, van Lohuizen多梳阻遏子对干细胞的调控:延迟承诺。Curr意见细胞生物学2008年,20:201 - 207。10.1016 / j.ceb.2008.01.004
Jason LJ, Finn RM, Lindsey G, Ausio J:组蛋白H2A泛素化并不排除组蛋白H1的结合,但它促进了组蛋白H1与核小体的结合。J生物化学2005年,280:4975 - 4982。10.1074 / jbc.M410203200
孔特拉斯A,黑尔TK,斯坦图恩DL,罗森JM,曼奇尼MA,埃雷拉RE:组蛋白H1的动态迁移能力由细胞周期蛋白/CDK磷酸化调节。摩尔细胞生物学2003年,23:8626 - 8636。10.1128 / mcb.23.23.8626 - 8636.2003
Reinberg D, Sims RJ III:事实上的核小体动力学。J生物化学2006年,281:23297 - 23301。10.1074 / jbc.R600007200
示罗Y:ATM和相关蛋白激酶:保护基因组完整性。Nat Rev癌症2003年,3:155 - 168。10.1038 / nrc1011
唐斯JA,努森茨威格MC,努森茨威格A:染色质动力学和遗传信息的保存。自然2007年,447:951 - 958。10.1038 / nature05980
Giannattasio M, Lazzaro F, Plevani P, Muzi-Falconi M:DNA损伤检查点反应需要Rad6-Bre1的组蛋白H2B泛素化和Dot1的H3甲基化。J生物化学2005年,280:9879 - 9886。10.1074 / jbc.M414453200
山下K,筱原M,筱原A:rad6 - bre1介导的组蛋白H2B泛素化调节减数分裂过程中双链断裂的形成。美国国家科学研究院2004年,101:11380 - 11385。10.1073 / pnas.0400078101
王辉、翟磊、徐杰、朱海英、Jackson S、Erdjument-Bromage H、Tempst P、熊颖、张颖:cul4 - db - roc1泛素连接酶的组蛋白H3和H4泛素化促进了细胞对DNA损伤的反应。摩尔细胞2006年,22:383 - 394。10.1016 / j.molcel.2006.03.035
Bergink S, jasper NG, Vermeulen W:泛素化调节紫外线诱导的DNA损伤反应。DNA修复(Amst)2007年,6:1231 - 1242。10.1016 / j.dnarep.2007.01.012
赵光宇、Sonoda E、Barber LJ、冈H、村川Y、山田k、伊仓T、王X、小林M、山本K、博尔顿SJ、武田S:泛素结合酶Ubc13在启动同源重组中的关键作用。摩尔细胞2007年,25:663 - 675。10.1016 / j.molcel.2007.01.029
科拉斯NK、查普曼JR、中田S、伊兰科J、查万R、斯威尼FD、帕尼尔S、门德兹M、威尔登海因J、汤姆森TM、佩尔蒂埃L、杰克逊SP、杜罗彻D:RNF8泛素连接酶对dna损伤反应的编排。科学2007年,318:1637 - 1640。10.1126 / science.1150034
王波,Elledge SJ:Ubc13/Rnf8泛素连接酶在DNA损伤时控制Rap80/Abraxas/Brca1/Brcc36复合体的聚焦形成。美国国家科学研究院2007年,104:20759 - 20763。10.1073 / pnas.0710061104
Bekker-Jensen S, Lukas C, Kitagawa R, Melander F, Kastan MB, Bartek J, Lukas J:响应DNA链断裂的哺乳动物基因组监测机制的空间组织。细胞生物学2006年,173:195 - 206。10.1083 / jcb.200510130
Kruhlak MJ, Celeste A, Dellaire G, Fernandez-Capetillo O, Muller WG, McNally JG, bazet - jones DP, Nussenzweig A:活细胞中DNA双链断裂部位染色质结构和流动性的变化。细胞生物学2006年,172:823 - 834。10.1083 / jcb.200510015
Celeste A, Fernandez-Capetillo O, Kruhlak MJ, Pilch DR, Staudt DW, Lee A, Bonner RF, Bonner WM, Nussenzweig A:组蛋白H2AX磷酸化对DNA断裂的初始识别是可有可无的。Nat细胞生物学2003年,5:675 - 679。10.1038 / ncb1004
Stucki M, Clapperton JA, Mohammad D, Yaffe MB, Smerdon SJ, Jackson SP:MDC1直接结合磷酸化的组蛋白H2AX,调节细胞对DNA双链断裂的反应。细胞2005年,123:1213 - 1226。10.1016 / j.cell.2005.09.038
黄TT, D'Andrea AD:通过泛素化调节DNA修复。Nat Rev Mol细胞生物学2006年,7:323 - 334。10.1038 / nrm1908
Sobhian B、Shao G、Lilli DR、Culhane AC、Moreau LA、Xia B、Livingston DM、Greenberg RA:RAP80靶向BRCA1 DNA损伤位点的特定泛素结构。科学2007年,316:1198 - 1202。10.1126 / science.1139516
Polanowska J, Martin JS, Garcia-Muse T, Petalcorin MI, Boulton SJ:在DNA损伤位点激活brca1依赖性泛素化的保守途径。Embo J2006年,25:2178 - 2188。10.1038 / sj.emboj.7601102
Plans V、Scheper J、Soler M、Loukili N、Okano Y、Thomson TM:无名指蛋白RNF8招募UBC13进行赖氨酸63基自泛素化。细胞生物化学2006年,97:572 - 582。10.1002 / jcb.20587
Lorick KL, Jensen JP, Fang S, Ong AM,畑山S, Weissman AM:无名指介导泛素结合酶(E2)依赖的泛素化。美国国家科学研究院1999年,96:11364 - 11369。10.1073 / pnas.96.20.11364
沃尔克T,奥德里尼B,马斯佩罗E, Confalonieri S,卡瓦拉罗E,迪菲奥雷PP,波罗S:偶联单泛素化的分子机制。Nat细胞生物学2006年,8:1246 - 1254。10.1038 / ncb1484
Christensen DE, Brzovic PS, Klevit RE:E2-BRCA1环的相互作用决定了单或特异性多泛素链的合成。Nat结构Mol Biol2007年,14:941 - 948。10.1038 / nsmb1295
Mallery DL, Vandenberg CJ, Hiom K:泛素素链激活BRCA1/BARD1复合体E3连接酶功能。Embo J2002年,21:6755 - 6762。10.1093 / emboj / cdf691
Kim H, Chen J, Yu X:泛素结合蛋白RAP80介导brca1依赖的DNA损伤反应。科学2007年,316:1202 - 1205。10.1126 / science.1139621
王B,松冈S, Ballif BA,张D, Smogorzewska A, Gygi SP, Elledge SJ:Abraxas和RAP80形成了DNA损伤反应所需的BRCA1蛋白复合体。科学2007年,316:1194 - 1198。10.1126 / science.1139476
Hofmann RM, Pickart CM:非规范的mms2编码的泛素结合酶在组装用于DNA修复的新型泛素链中的功能。细胞1999年,96:645 - 653。10.1016 / s0092 - 8674 (00) 80575 - 9
齐夫Y、比埃洛波斯基D、加兰特Y、卢卡斯C、塔亚Y、舒尔茨DC、卢卡斯J、贝克-延森S、巴泰克J、夏伊洛Y:染色质弛缓响应DNA双链断裂是由一个新的ATM-和KAP-1依赖通路调节。Nat细胞生物学2006年,8:870 - 876。10.1038 / ncb1446
Huyen Y, Zgheib O, Ditullio RA Jr., Gorgoulis VG, Zacharatos P, Petty TJ, Sheston EA, Mellert HS, Stavridi ES, Halazonetis TD:组蛋白H3的甲基化赖氨酸79靶向DNA双链断裂53BP1。自然2004年,432:406 - 411。10.1038 / nature03114
Botuyan MV、Lee J、Ward IM、Kim JE、Thompson JR、Chen J、Mer G:DNA修复过程中53BP1和Crb2对H4-K20组蛋白甲基化状态特异性识别的结构基础。细胞2006年,127:1361 - 1373。10.1016 / j.cell.2006.10.043
库什·T,弗洛伦斯·L,麦克唐纳·WH,斯旺森SK,格拉泽RL,耶茨JR三世,阿布迈尔·SM,沃什伯恩议员,沃克曼JL:通过Tip60乙酰化在DNA病变处进行选择性组蛋白变体交换是必需的。科学2004年,306:2084 - 2087。10.1126 / science.1103455
斜模KE, Eyre HJ, Wang XW, Sutherland GR, Baker RT:一种新的人类泛素特异性蛋白酶USP3的鉴定和染色体定位。J生物化学1999年,274:26878 - 26884。10.1074 / jbc.274.38.26878
乔杜里D,基奥MC,石井H,彼得森CL,布拉托夫斯基S,利伯曼J:- h2ax去磷酸化蛋白磷酸酶2A促进DNA双链断裂修复。摩尔细胞2005年,20:801 - 809。10.1016 / j.molcel.2005.10.003
Tsukuda T, Fleming AB, Nickoloff JA, Osley MA:酿酒酵母DNA双链断裂位点染色质重塑。自然2005年,438:379 - 383。10.1038 / nature04148
Keogh MC, Kim JA, Downey M, Fillingham J, Chowdhury D, Harrison JC, Onishi M, Datta N, Galicia S, Emili A, Lieberman J, Shen X, Buratowski S, Haber JE, Durocher D, Greenblatt JF, Krogan NJ:一个去磷酸化gammaH2AX的磷酸酶复合物调节DNA损伤检查点恢复。自然2006年,439:497 - 501。10.1038 / nature04384
董y、马哈基米、陈X、库奇NS、戈德温AK、谢赫哈塔R:BRCC是一种包含BRCA1和BRCA2的全酶复合体,通过信号体样亚基的调节及其在DNA修复中的作用。摩尔细胞2003年,12:1087 - 1099。10.1016 / s1097 - 2765 (03) 00424 - 6
Chen X, Arciero CA, Wang C, Broccoli D, Godwin AK:BRCC36是电离辐射诱导的BRCA1磷酸化和核病灶形成所必需的。癌症Res2006年,66:5039 - 5046。10.1158 / 0008 - 5472. - 05 - 4194
Rayman JB, Takahashi Y, indjean VB, Dannenberg JH, Catchpole S, Watson RJ, te Riele H, Dynlacht BD:E2F通过募集HDAC1/mSin3B辅抑制复合物介导体内细胞周期依赖性的转录抑制。基因开发2002年,16:933 - 947。10.1101 / gad.969202
Groth A, Rocha W, Verreault A, Almouzni G:DNA复制和修复过程中的染色质挑战。细胞2007年,128:721 - 733。10.1016 / j.cell.2007.01.030
Vassilev AP, Rasmussen HH, Christensen EI, Nielsen S, Celis JE:泛素化组蛋白H2A水平在转化的人类细胞中高度上调:部分s期细胞中uH2A簇和PCNA/cyclin病灶局部共定位。细胞科学1995年,108:1205 - 1215。
Tuttle RL, Bothos J, Summers MK, Luca FC, Halazonetis TD:有丝分裂停止1/无名指8缺陷蛋白是一种拮抗人类有丝分裂退出网络的检查点蛋白。Mol Cancer Res2007年,5:1304 - 1311。1541 - 7786. - 10.1158 / mcr - 07 - 0388
方案五,格拉雷博洛M,汤姆森TM:RNF8泛素连接酶对有丝分裂退出的调控。致癌基因2008年,27日:1355 - 1365。10.1038 / sj.onc.1210782
冯肯JW,罗伦BA,罗菲斯M,德弗里斯S,范胡芬E,马里诺S,德尚J,范罗惠岑M:Rnf2 (Ring1b)缺乏导致胃泌停止和细胞周期抑制。美国国家科学研究院2003年,100:2468 - 2473。10.1073 / pnas.0434312100
Leeb M, Wutz A:在胚胎细胞中,Ring1B对发育控制基因和PRC1蛋白的调控至关重要,而不是X失活。细胞生物学2007年,178:219 - 229。10.1083 / jcb.200612127
van der Knaap JA, Kumar BR, Moshkin YM, Langenberg K, Krijgsveld J, Heck AJ, Karch F, Verrijzer CP:GMP合成酶通过表观遗传消声器USP7刺激组蛋白H2B去泛素化。摩尔细胞2005年,17:695 - 707。10.1016 / j.molcel.2005.02.013
Cohn MA、Kowal P、Yang K、Haas W、Huang TT、Gygi SP、D’andrea AD:含有uaf1的多亚基蛋白复合物调节Fanconi贫血途径。摩尔细胞2007年,28日:786 - 797。10.1016 / j.molcel.2007.09.031
黄TT, Nijman SM, Mirchandani KD, Galardy PJ, Cohn MA, Haas W, Gygi SP, Ploegh HL, Bernards R, D'Andrea AD:DUB自裂解对单泛素化PCNA的调控。Nat细胞生物学2006年,8:339 - 347。
波波夫N,赫罗德S,利亚马萨雷斯M,舒莱因C,埃勒斯M:Fbw7和Usp28调节myc蛋白的稳定性以响应DNA损伤。细胞周期2007年,6:2327 - 2331。
Stegmeier F、Rape M、Draviam VM、Nalepa G、Sowa ME、Ang XL、McDonald ER III、Li MZ、Hannon GJ、Sorger PK、Kirschner MW、Harper JW、Elledge SJ:后期启动由拮抗泛素化和去泛素化活性调控。自然2007年,446:876 - 881。10.1038 / nature05694
Nijman SM, Huang TT, Dirac AM, Brummelkamp TR, Kerkhoven RM, D'Andrea AD, Bernards R:去泛素化酶USP1调节Fanconi贫血途径。摩尔细胞2005年,17:331 - 339。10.1016 / j.molcel.2005.01.008
波克B,费舍尔S,甘宁D,齐普斯基SL,萨莱克I:胶质细胞在果蝇视觉系统发育过程中介导视网膜轴突靶层选择。神经元2001年,29日:99 - 113。10.1016 / s0896 - 6273 (01) 00183 - 0
确认
这项工作得到了荷兰癌症协会(KWF)对EC和MvL的支持,意大利癌症研究协会(AIRC)、欧洲共同体(VI框架)、意大利卫生部、教育和大学、法拉利基金会、Monzino基金会和carplo基金会对PPDF的支持,以及Ernst Schering基金会对JHAV的支持。
作者信息
作者和隶属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
JHAV, FN和EC撰写了这篇论文。JHAV设计了这些数字。所有作者都对论文中阐述的观点做出了贡献,并阅读并批准了最终稿件。
Joseph HA Vissers, Francesco Nicassio对这项工作也做出了同样的贡献。
权利与权限
开放获取本文由BioMed Central Ltd.授权发布。这是一篇开放获取文章,根据创作共用授权协议(https://creativecommons.org/licenses/by/2.0),它允许在任何媒体上不受限制地使用、分发和复制,只要原著被恰当地引用。
关于本文
引用本文
维瑟斯,j.h.,尼克西奥,F.,范·洛惠岑,M.。et al。泛素化组蛋白H2A的多面性:来自dub的见解。细胞Div3.8(2008)。https://doi.org/10.1186/1747-1028-3-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1747-1028-3-8
关键字
- 组蛋白修饰
- 电离辐射
- 光漂白后的荧光恢复
- H3K4甲基化
- 泛素化位点