Unni N, Arteaga CL。mTORC1和mTORC2双重治疗阻断在癌症临床可行吗?JAMA Oncol, 2019。https://doi.org/10.1001/jamaoncol.2019.2525(印刷前Epub).
文章PubMed谷歌学者
Dowling RJ, Topisirovic I, Fonseca BD, Sonenberg N.剖析mTOR的作用:来自mTOR抑制剂的教训。生物化学学报,2010;1804(3):433-9。
文章中科院PubMed谷歌学者
这本书TP。依赖于tor的自噬控制:咬食的手。中国生物医学杂志,2010;22(2):157-68。
文章中科院PubMed谷歌学者
张晓燕,李晓燕,张晓燕。生长信号整合对癌症、糖尿病和衰老的影响。中国生物医学工程学报。2011;12(1):21-35。
文章中科院PubMed谷歌学者
Saxton RA, Sabatini DM. mTOR信号在生长、代谢和疾病中的作用。细胞。2017;168(6):960 - 76。
文章中科院PubMed公共医学中心谷歌学者
莫斯曼D,公园S,大厅MN。mTOR信号转导和细胞代谢是癌症的相互决定因素。中华癌症杂志,2018;18(12):744-57。
文章中科院PubMed谷歌学者
郭波,李东,杜玲,朱晓霞。piRNAs在肿瘤中的生物学作用及其潜在意义。癌症转移2020年修订版。https://doi.org/10.1007/s10555-020-09863-0(印刷前Epub).
文章PubMed谷歌学者
谢晓平,刘勇,王志刚,王志刚,等。mTOR信号转译景观指导癌症起始和转移。大自然。2012;485(7396):55 - 61。
文章中科院PubMed公共医学中心谷歌学者
李文敏,李文敏,李文敏,李文敏。PI3K/PTEN/AKT/TSC/mTORC1信号通路的研究进展。皮肤科杂志,2017;35(1):51-60。
文章中科院PubMed公共医学中心谷歌学者
林海杰,克罗平,杨建林。PI3K/PTEN/Akt/mTOR信号通路在人类癌症治疗中的当前临床调控中国临床肿瘤学杂志,2015;29(4):379 - 379。
文章中科院PubMed谷歌学者
侯伟,刘娟,陈萍,王华,叶建斌,强峰。中国肝细胞癌患者RAS/RAF和PI3K/PTEN通路关键基因突变分析。生态学报,2014;8(3):1249-54。
文章中科院PubMed公共医学中心谷歌学者
张勇,张静,徐坤,肖忠,孙洁,徐洁,等。PTEN/PI3K/mTOR/B7-H1信号通路调控胰腺癌细胞进展和免疫抵抗杂志。2013;60(127):1766 - 72。
中科院PubMed谷歌学者
陈建军,王强,付晓华,黄晓华,陈小林,曹丽强,等。PI3K/PTEN/AKT/mTOR通路参与肝细胞癌侵袭转移:与MMP-9相关国际肝病杂志,2009;39(2):177-86。
文章中科院PubMed谷歌学者
陈s, Fisher RC, Signs S, Molina LA, Shenoy AK, Lopez MC,等。在过表达pi3kr2的结肠癌干细胞中,抑制PI3K/Akt/mTOR信号通路可通过凋亡抑制肿瘤生长。Oncotarget。2017;8(31):50476 - 88。
PubMed谷歌学者
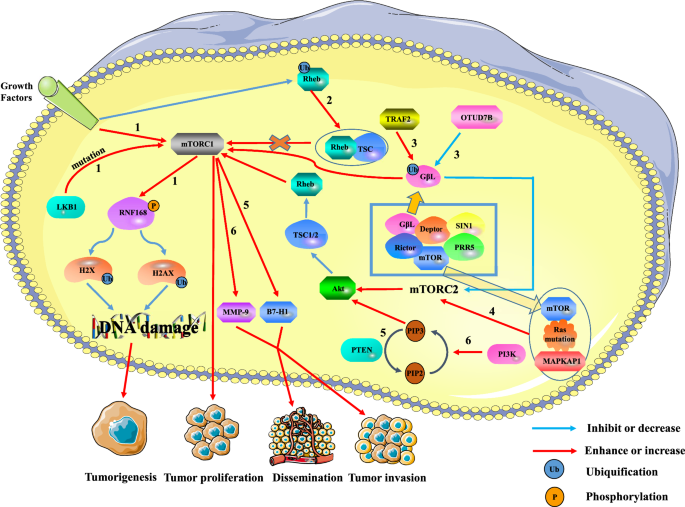
谢欣,胡辉,童欣,李琳,刘霞,陈敏,等。mTOR-S6K通路通过靶向RNF168将生长信号通路与DNA损伤反应联系起来。中国生物医学工程学报,2018;20(3):320-31。
文章中科院PubMed公共医学中心谷歌学者
邓玲,陈琳,赵玲,徐勇,彭旭,王旭,等。Rheb的泛素化调控生长因子诱导的mTORC1激活。中国生物医学工程学报,2019;29(2):136-50。
文章中科院PubMed谷歌学者
王波,杰哲,朱d, Ordureau A,刘鹏,甘伟,等。TRAF2和OTUD7B控制着一个依赖于泛素的开关,调节mTORC2信号。大自然。2017;545(7654):365 - 9。
文章中科院PubMed公共医学中心谷歌学者
Kovalski JR, Bhaduri A, Zehnder AM, Neela PH, Che Y, Wozniak GG,等。致癌Ras的功能近端蛋白质组包括mTORC2。中国生物医学工程学报。2019;43 (4):830-44.e12
文章中科院PubMed公共医学中心谷歌学者
刘娟,李东,罗红,朱霞。环状rna:癌症中的明星分子。Mol Aspects Med. 2019; 70:141-52。
文章中科院PubMed谷歌学者
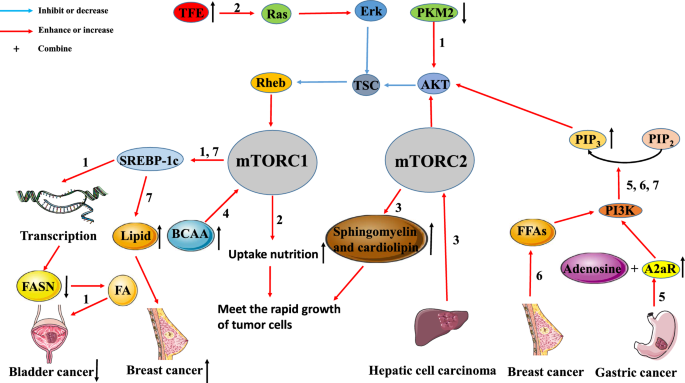
Ricoult SJ, Yecies JL, Ben-Sahra I, Manning BD.致癌PI3K和K-Ras通过mTORC1和SREBP刺激脂质合成。致癌基因。2016;35(10):1250 - 60。
文章中科院PubMed谷歌学者
陶涛,苏强,徐松,邓杰,周松,庄勇,等。下调PKM2通过AKT/mTOR/SREBP-1c轴降低膀胱癌细胞FASN表达。中国生物医学工程学报。2019;34(3):344 - 344。
文章中科院PubMed谷歌学者
Di Malta C, Siciliano D, Calcagni A, Monfregola J, Punzi S, Pastore N,等。RagD GTPase的转录激活控制mTORC1并促进癌症生长。科学。2017;356(6343):1188 - 92。
文章PubMed公共医学中心中科院谷歌学者
Guri Y, Colombi M, Dazert E, Hindupur SK, Roszik J, Moes S等。mTORC2通过脂质合成促进肿瘤发生。中国癌症杂志,2017;32(6):807-23.e12。
文章中科院PubMed谷歌学者
朱霞,张军,范伟,王峰,姚华,王忠,等。rs391957变体顺式调节癌基因GRP78的表达有助于肝细胞癌的风险。致癌作用。2013;34(6):1273 - 80。
文章中科院PubMed谷歌学者
李志强,李志强,李志强,等。在癌变过程中BCAA分解代谢的缺失会增强mTORC1的活性,并促进肿瘤的发展和进展。中国生物医学工程学报。2019;29(5):1151-65.e6。
文章中科院PubMed公共医学中心谷歌学者
石磊,吴震,苗军,杜松,艾松,徐娥,等。腺苷与腺苷受体A2a相互作用通过增强PI3K-AKT-mTOR信号通路促进胃癌转移。《Mol生物细胞》,2019。https://doi.org/10.1091/mbc.E19030136.
文章PubMed公共医学中心谷歌学者
Madak-Erdogan Z, Band S, Zhao YC, Smith BP, Kulkoyluoglu-Cotul E, Zuo Q,等。在肥胖相关的乳腺癌中,游离脂肪酸通过雌激素受体和mTOR信号重新连接癌症代谢。癌症杂志2019;79(10):2494-510。
中科院PubMed谷歌学者
谭松,李东,朱霞。癌症免疫治疗:利弊及超越。Biomed Pharmacother, 2020;124:109821。
文章PubMed谷歌学者
杨凯,Blanco DB,陈旭,Dash P, Neale G, Rosencrance C,等。代谢信号指导着α - T细胞和γ - T细胞的相互谱系决定。免疫科学,2018。https://doi.org/10.1126/sciimmunol.aas9818.
文章PubMed公共医学中心谷歌学者
刘志刚,刘志刚,李志刚,等。Roquin抑制PI3K-mTOR信号通路抑制T辅助细胞分化和Treg向Tfr细胞的转化。免疫力。2017;(6):1067 - 82. - e12汽油。
文章中科院PubMed谷歌学者
Pollizzi KN, Patel CH, Sun IH, Oh MH, Waickman AT, Wen J,等。mTORC1和mTORC2选择性调控CD8(+) T细胞分化。中国临床医学杂志,2015;29(5):529 - 529。
文章PubMed公共医学中心谷歌学者
王峰,孟M,莫B,杨勇,纪勇,黄鹏,等。mTORC1和mTORC2之间的串扰改变细胞因子信号通路,以控制NK成熟和效应器功能。地理学报。2018;9(1):4874。
文章PubMed公共医学中心中科院谷歌学者
陈丽玲,林宏伟,孙云云,叶景春,洪兴华,陈建军,等。mTOR抑制剂可通过调节肿瘤微环境中的树突状细胞功能增强DNA疫苗的抗肿瘤作用。癌症。2019;11(5):617。
文章中科院公共医学中心谷歌学者
杨志华,T玉林,W一波,D伟,尹灿,X家豪,等。缺氧通过靶向microRNA-30c和mTOR降低人胃癌巨噬细胞糖酵解和M1百分比。中国生物医学工程学报,2019;29(4):344 - 344。
PubMed公共医学中心谷歌学者
朱霞,林mcm,范伟,田玲,王娟,吴世生,等。GRP78内含子多态性提高非小细胞肺癌化疗预测。胸部。2012;141(6):1466 - 72。
文章中科院PubMed谷歌学者
丹多I, Pacchiana R, Pozza ED, Cataldo I, Bruno S, Conti P,等。UCP2抑制诱导ROS/Akt/mTOR轴:GAPDH核易位在吉尼平/依维莫司抗癌协同作用中的作用中国生物医学杂志,2017;113:176-89。
文章中科院PubMed谷歌学者
姚勇,周东,石东,张华,詹松,邵旭,等。GLI1过表达与AKT-mTOR通路结合促进胃癌细胞增殖和迁移,诱导耐药。2019; 111:993-1004。
文章中科院PubMed谷歌学者
朱霞,罗红,徐云。转录组分析发现一个重要的候选基因参与肺腺癌淋巴结转移和预后。细胞生物学,2019;9:92。
文章PubMed公共医学中心中科院谷歌学者
朱欣,高松,罗红,范伟,郭松,姚红,等。应激相关染色体区域9q33.3有助于降低肺鳞状细胞癌的风险。中华外科杂志,2014;9(7):1041-7。
文章中科院谷歌学者
森涛,佟鹏,刁林,李林,范勇,霍夫J,等。靶向AXL和mTOR通路克服了小细胞肺癌对WEE1抑制的原发性和获得性耐药。临床癌症杂志,2017;23(20):6239-53。
文章中科院PubMed公共医学中心谷歌学者
叶玲,蒲超,唐杰,王勇,王超,邱忠,等。跨膜-4 l - 6家族成员-1 (TM4SF1)通过调节DDR1/Akt/ERK-mTOR轴促进非小细胞肺癌的增殖、侵袭和化疗耐药。呼吸科学,2019;20(1):106。
文章PubMed公共医学中心中科院谷歌学者
唐智,李东,侯松,朱霞。肿瘤外泌体的临床意义、应用及挑战。国际癌症杂志,2019。https://doi.org/10.1002/ijc.32762(印刷前Epub).
文章PubMed公共医学中心谷歌学者
石桥K, Haber T, Breuksch I, Gebhard S, Sugino T, Kubo H,等。IL-6受体阻断联合治疗肾癌TKI耐药Oncotarget。2017;8(33):55230 - 45。
文章PubMed公共医学中心谷歌学者
Sen S, Meric-Bernstam F, Hong DS, Hess KR, Subbiah V. brafv600突变非黑素瘤中共同发生的基因组改变及其与无进展生存的关系。中华泌尿外科杂志。2017。https://doi.org/10.1093/jnci/djx094.
文章PubMed公共医学中心谷歌学者
赵晓明,陈晓明,陈晓明,等。治疗诱导的肿瘤分泌组促进耐药和肿瘤进展。自然。2015;520(7547):368 - 72。
文章中科院PubMed公共医学中心谷歌学者
唐霞,黄燕,雷军,罗红,朱霞。单细胞测序的新进展及医学应用。细胞生物学。2019;9:53。
文章PubMed公共医学中心谷歌学者
周勇,王勇,周伟,陈涛,吴强,chutturhoon VK,等。YAP通过RAC1-ROS-mTOR途径促进多药耐药并抑制肝细胞癌自噬相关细胞死亡。《癌症杂志》2019;19:179。
文章PubMed公共医学中心中科院谷歌学者
李凯,罗红,黄玲,罗红,朱霞。微卫星不稳定性:肿瘤医生应该知道的东西。Cancer Cell Int. 2020;20:16。
文章PubMed公共医学中心谷歌学者
孙勇,艾建忠,金旭,刘瑞麟,林涛,徐辉,等。IL-8通过激活mTOR信号通路保护前列腺癌细胞免受gsk -3beta诱导的氧化应激。前列腺癌。2019;79(10):1180 - 90。
文章中科院PubMed谷歌学者
邹震,陈娟,刘安,周霞,宋强,贾超,等mTORC2通过C - myc依赖性上调E2F1促进细胞存活。中国生物医学工程学报,2015;29(1):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
杨颖,陈东,刘红,杨凯。口腔鳞癌lncRNA CASC9表达升高通过AKT/mTOR通路抑制自噬介导的细胞凋亡促进肿瘤进展。细胞死亡,2019;10(2):41。
文章PubMed公共医学中心中科院谷歌学者
Rodrik-Outmezguine VS, Okaniwa M, Yao Z, Novotny CJ, McWhirter C, Banaji A,等。新一代mTOR抑制剂克服mTOR耐药突变。大自然。2016;534(7606):272 - 6。
文章中科院PubMed公共医学中心谷歌学者
Nguyen TL, Nokin MJ, Egorov M, Tome M, Bodineau C, Di Primo C,等。通过取代磷脂酸抑制mTOR可特异性地增强癌细胞的细胞毒性。癌症决议2018;78(18):5384-97。
文章中科院PubMed谷歌学者
Bendell JC, Varghese AM, Hyman DM, Bauer TM, Pant S, Callies S,等。LY3023414(一种口服PI3K/mTOR双重抑制剂)在晚期癌症患者中的首次人类一期研究。临床癌症杂志2018;24(14):3253-62。
文章中科院PubMed谷歌学者
张晓霞,陈春霞,王超,张晓霞,等。一种新型双AMPK激活剂/mTOR抑制剂抑制甲状腺癌细胞生长。中国临床内分泌杂志,2015;30(5):344 - 344。
文章PubMed公共医学中心中科院谷歌学者
Piselli P, Taborelli M, Cimaglia C, Serraino D, Italian T,癌症队列s:意大利肾移植后卡波西肉瘤发病率降低和mtor抑制剂的作用:1997-2016。中华肿瘤学杂志,2019;35(2):597-8。
文章中科院PubMed谷歌学者
朴丽丽,金惠辉,赵耀文,闵德伟,千SK,林玉杰,等。WNT/ β -连环蛋白信号通路的激活导致PIK3CA突变的结直肠癌细胞对双PI3K/mTOR抑制剂产生耐药性。中华癌症杂志,2019;44(2):389-401。
文章中科院PubMed谷歌学者
唐娟,徐震,黄玲,罗华,朱霞。模式生物转录调控研究进展及临床意义。开放生物学,2019;9(11):190183。
文章PubMed公共医学中心谷歌学者
Caumanns JJ, Berns K, Wisman GBA, Fehrmann RSN, Tomar T, Klip H,等。整合kinome分析确定mTORC1/2抑制作为卵巢透明细胞癌的治疗策略。临床癌症杂志2018;24(16):3928-40。
文章PubMed公共医学中心谷歌学者
刘志强,刘志强,刘志强,等。侵袭性放射性碘难治性甲状腺癌依维莫司反应的基因组相关性:一项II期研究。临床癌症杂志2018;24(7):1546-53。
文章中科院PubMed谷歌学者
吴娟,刘志强,刘志强,等。在胰腺癌中靶向mTOR依赖。肠道。2014;63(9):1481 - 9。
文章中科院PubMed谷歌学者
柯飞,许莱格尔,吴林杰,马德林,史密,冯·鲍姆加滕,等。替西罗莫司治疗复发/难治性原发性中枢神经系统淋巴瘤的II期临床研究。中华临床肿瘤学杂志,2016;34(15):1757-63。
文章中科院PubMed谷歌学者
Orr-Asman MA, Chu Z, Jiang M, Worley M, LaSance K, Koch SE,等。mTOR激酶抑制可有效降低rapalog治疗进展的神经内分泌肿瘤的进展并延迟心脏损害。中华肿瘤杂志,2017;16(11):2432-41。
文章中科院PubMed谷歌学者
Goldman KN, Chenette D, Arju R, Duncan FE, Keefe DL, Grifo JA,等。mTORC1/2抑制在基因毒性化疗中保护卵巢功能和生育能力。美国国家科学研究院。2017, 114(12): 3186 - 91。
文章中科院PubMed公共医学中心谷歌学者
王涛,谢松,罗蓉,石林,白萍,王旭,等。肾上皮样血管平滑肌脂肪瘤对依维莫司敏感的两种新的TSC2突变。癌症生物学杂志,2020;21(1):4-11。
文章中科院PubMed谷歌学者
Roldan-Romero JM, Beuselinck B, Santos M, Rodriguez-Moreno JF, Lanillos J, Calsina B,等。TSC1、TSC2和MTOR中PTEN的表达和突变与肾细胞癌患者对rapalogs的反应相关。国际癌症杂志,2020;46(5):1435-44。
文章中科院PubMed谷歌学者
Maroto P, Anguera G, Roldan-Romero JM, Apellaniz-Ruiz M, Algaba F, Boonman J,等。厌色性肾细胞癌患者双等位基因TSC2突变对temsirolimus反应异常。中华肿瘤学杂志,2018;16(4):352-8。
文章谷歌学者
TSC1/2突变作为转移性肾细胞癌依维莫司反应的标记:一个案例研究。中华癌症杂志。2019;56(3):274-5。
文章PubMed谷歌学者
梁波,丁红,黄玲,罗红,朱霞。GWAS在癌症中的应用进展与挑战。Mol Genet Genom, 2020。https://doi.org/10.1007/s00438-020-01647-z(印刷前Epub).
文章谷歌学者
Kwiatkowski DJ, Choueiri TK, Fay AP, Rini BI, Thorner AR, de Velasco G,等。TSC1、TSC2和MTOR突变与转移性肾细胞癌患者对rapallog的反应相关。临床癌症杂志2016;22(10):2445-522。
文章中科院PubMed公共医学中心谷歌学者
何德华,陈丽林,赵宜涛,徐金杰,潘瑞涛,张TT,等。TSC1/2突变定义了具有侵袭性行为和治疗意义的HCC分子亚群。肠道。2017;66(8):1496 - 506。
文章中科院PubMed谷歌学者
Levine DA, Dizon DS, Carlson JW, Filiaci VL, Powell MA, Secord AA,等。子宫内膜癌反应的预测性生物标志物:来自NRG肿瘤学/妇科肿瘤学组研究86P的结果。妇科肿瘤学杂志2018;149:12-3。
文章谷歌学者
万鑫,王志强,王志强,王志强。雷帕霉素通过igf - 1r依赖机制诱导Akt信号的反馈激活。致癌基因。2007;26(13):1932 - 40。
文章中科院PubMed谷歌学者
梁霞,李东,冷松,朱霞。基于rna的肿瘤药物治疗:从实验到临床再到临床。Biomed Pharmacother, 2020;125:109997。
文章中科院PubMed谷歌学者
Motzer RJ, Hutson TE, Glen H, Michaelson MD, Molina A, Eisen T,等。Lenvatinib、依维莫司和联合治疗转移性肾细胞癌:一项随机、2期、开放标签、多中心试验《医学杂志》2015;16(15):1473-82。
文章中科院PubMed谷歌学者
Mohan S, Vander Broek R, Shah S, Eytan DF, Pierce ML, Carlson SG,等。MEK抑制剂PD-0325901克服了对PI3K/mTOR抑制剂PF-5212384的耐药性,并增强了人头颈部鳞状细胞癌的抗肿瘤作用。临床癌症杂志,2015;21(17):3946-56。
文章中科院PubMed公共医学中心谷歌学者
张辉,李xx,杨勇,张勇,王友友,郑新富。肝细胞癌中雄激素受体过表达及雷帕霉素交叉作用的意义和机制。肝脏病学。2018;67(6):2271 - 86。
文章中科院PubMed谷歌学者
陈思敏,郭春林,史俊杰,徐玉春,陈勇,沈一云,等。HSP90抑制剂AUY922取消了mTOR抑制剂AZD8055对RTKs的上调,增强了其在人乳腺癌中的抗增殖活性。中华肿瘤学杂志,2014;35(10):344 - 344。
文章中科院PubMed谷歌学者
李志刚,李志刚,李志刚,李志刚,等。依维莫司联合紫杉醇和卡铂作为一线治疗转移性大细胞神经内分泌肺癌:一项多中心II期试验中国科学院学报,2017;28(8):1898-902。
文章中科院PubMed谷歌学者
海杰,刘松,布夫林,杜凯,陈涛,王霞,等。WEE1和mTOR抑制在kras驱动的突变型肺癌中的协同作用临床癌症杂志2017;23(22):6993-7005。
文章中科院PubMed公共医学中心谷歌学者
王震,郭俊,韩旭,薛明,王伟,米林,等。二甲双胍通过抑制ApoE(−/−)小鼠PI3K/AKT/mTOR/自噬通路的激活来抑制AAA的病理生理。细胞生物学,2019;9:68。
文章PubMed公共医学中心中科院谷歌学者