摘要
背景
量化SARS-CoV-2的研究主要集中在上呼吸道或血浆病毒RNA,与临床结果不一致。血浆病毒抗原水平与临床结果之间的关系以前没有研究过。我们的目的是研究血浆SARS-CoV-2核衣壳抗原(n -抗原)浓度与宿主反应标志物和临床结果之间的关系。
方法
在2020年3月至2021年8月期间入院的COVID-19住院患者的前瞻性观察队列中,从256名受试者中收集的第一份研究血浆样本(D0)中测量了SARS-CoV-2 n抗原浓度。评估了血浆n抗原与组织损伤、凝血和炎症的血浆生物标志物之间的等级相关性。采用改良的世界卫生组织(WHO)序数量表,检验入组n抗原血浆浓度与一周临床恶化主要结局之间的相关性。采用多元logistic回归检验入组血浆n抗原浓度与ICU入院、28天机械通气和28天死亡的次要结局之间的相关性。还测试了外部来源的n抗原≥1000 pg/mL的“高抗原”截断点对预后的区分。
结果
84%的研究参与者在D0上检测到n抗原。血浆n抗原水平与RAGE显著相关(r= 0.61), il-10 (r= 0.59), IP-10 (r= 0.59,调整后p对于所有相关性= 0.01)。对于一周临床状态的主要结局,血浆n抗原水平每增加500 pg/mL, WHO正常状态越差,校正OR为1.05 (95% CI 1.03-1.08)。与基线相比,D0血浆n抗原≥1000 pg/mL的敏感性为77%,特异性为59% (AUROC 0.68),阳性预测值为23%,阴性预测值为93%。D0 n抗原浓度与ICU入院和28天机械通气独立相关,但与28天死亡无关。
结论
血浆n抗原水平易于测量,可为了解COVID-19的发病机制和预后提供重要依据。在住院早期测量n抗原水平可以改善风险分层,特别是对于识别不太可能发展为严重疾病的患者。
背景
炎症、器官和组织损伤以及凝血的血浆生物标志物已被研究作为COVID-19疾病的致病性和预后生物标志物[1,2,3.,4,5,6].尽管这些生物标志物为病毒介导的细胞和组织损伤机制以及宿主对SARS-CoV-2的反应提供了深入了解,但它们并不能直接衡量病毒负担。如果不同时量化病毒RNA或蛋白质,就很难理解非病毒血浆生物标志物与病毒感染的关系。
SARS-CoV-2感染中的病毒负担通常通过测量上呼吸道中的病毒RNA或蛋白质来量化。在一些研究中,上呼吸道病毒载量较高预示着较差的结果[7,8,9,10],而另一些则没有显示出独立的关联[11].上呼吸道的病毒载量通常与血浆中的病毒产物没有很强的相关性[12,13,14,15].血浆病毒负担可能提供额外的价值。先前的研究已经确定,循环SARS-CoV-2病毒RNA的检测与基线疾病严重程度和临床结果相关[12,16,17,18,19,20.,21].
血浆中的病毒RNA也与炎症和组织损伤的生物标志物相关[12,19,20.,22,23].然而,循环的SARS-CoV-2 RNA通常无法检测到,特别是在早期或非危的COVID-19中[17,24,25,26].人们对检测血液中病毒蛋白抗原的实用性越来越感兴趣,这种抗原可在症状出现后2周内检测到[27,28,29,30.]并且即使在症状轻微或轻微的患者中也可量化[28,29,30.,31].然而,目前关于血液中SARS-CoV-2病毒抗原检测与疾病严重程度和结局之间的关系的研究有限[32,33,34,35,36,37].
本研究的目的是调查研究入组时(D0)血浆中检测到的SARS-CoV-2核衣壳抗原(n -抗原)水平与(1)组织损伤和宿主反应的生物标志物与COVID-19之间的关系,以及(2)短期临床恶化和机械通气和死亡长达28天的长期结果之间的关系。我们假设D0血浆n抗原浓度与炎症、组织损伤和凝血等生物标志物以及疾病严重程度相关。
方法
研究设计
COVID-19有效治疗的多表型(COMET)研究是一项前瞻性招募的观察队列研究,研究对象是来自加利福尼亚州旧金山三家医院的确诊或疑似COVID-19患者。60名受试者共同参与了COVID-19队列免疫表型评估(IMPACC)研究,两项研究方案一致[38].在线补充中提供了完整的纳入和排除标准。简单地说,确诊或疑似COVID-19感染的18岁或以上住院患者在入院72小时内有资格参加COMET。在入组时(D0)和住院期间的第4、7和14天收集血浆。本研究的其他纳入标准是pcr证实的COVID-19感染和足够的血浆容量来测量病毒抗原浓度。排除标准为入院时计划的舒适护理、已知怀孕或监禁。主要临床结果为第7天的临床状态,由世界卫生组织(WHO)序号量表测量(详见附加文件)1).次要结局为入组时未入住ICU的参与者的任何重症监护病房(ICU)、第28天的有创机械通气(MV)和第28天的死亡。从研究参与者或指定的代理决策者那里获得知情同意。机构审查委员会批准了15名研究参与者放弃同意,他们由于在研究期间死亡或在三次尝试后无法联系到参与者或他们的代理人而无法获得直接同意。这项研究得到了加州大学旧金山分校机构审查委员会、IRB 20-30497以及COMET和IMPACC科学领导委员会的批准。
样品采集和测量
研究入组时(入院后72小时内)采集的edta抗凝血在室温1000 g下离心10分钟,血浆收集并在−80℃保存。采用单分子免疫珠法(Quanterix, Billerica, MA, USA)测定血浆中SARS-CoV-2病毒核衣壳蛋白(n -抗原)水平。n抗原浓度低于检测下限3 pg/mL时,被赋值为2.9 pg/mL。血浆白介素(IL)-6、IL-8、IL-18、IL-10、干扰素- γ诱导蛋白(IP)-10、表面活性剂蛋白D (SPD)、晚期糖基化终产物受体(RAGE)、血管生成素-2 (Ang-2)和可溶性肿瘤坏死因子受体(sTNFR)-1采用多重磁珠免疫分析法(Luminex, R&D Systems, Minneapolis, MN, USA)测定,蛋白C采用ELISA法(Helena Laboratories, Beaumont, TX)测定。
统计分析
连续变量以均值(SD)或中位数(IQR)表示,并通过未配对进行比较t如果不是正态分布,则采用Wilcoxon秩和检验。分类变量以n(百分比)表示,并通过卡方检验或Fisher精确检验进行比较。采用Spearman秩相关检验血浆n抗原浓度与其他血浆生物标志物之间的关系,并对多重比较进行Bonferroni校正。
为了评估每增加500 pg/mL的n抗原浓度与一周的临床状况之间的关系,以修正的有序量表为因变量拟合比例优势模型。在最初的8点WHO序数量表上,一周观察量很少(少于样本的约5%)的类别被分解用于序数回归,从而形成5类序数量表(附加文件)1:表S1),范围从1(流动)至5(机械通气或死亡)。独立的logistic回归模型适用于评估在D0时未入住ICU的研究参与者中,每500 pg/mL n抗原浓度升高与ICU入院与28天机械通气(MV)或死亡之间的关系。如果调整变量预先确定与COVID严重程度或结果相关,在病毒抗原四分位数之间存在显著差异,并且/或可能影响病毒载量,则选择调整变量。对所有模型的年龄、性别、体重指数(BMI)、种族(白人/非白人)、症状持续时间(天)、是否存在糖尿病、是否存在高血压、免疫抑制(定义为> 4周服用20mg强的松等量药物、其他免疫抑制药物、艾滋病毒诊断或骨髓/实体器官移植)、吸烟状况(目前是否吸烟)、瑞德西韦治疗、入组前到入组后21天内1天以上和1周内类固醇治疗、入组日期、D0为8点WHO序数量表。对接种疫苗后一周的临床状态和ICU入院情况进行模型调整。28天机械通气和死亡模型没有根据疫苗状态进行调整,因为没有接种疫苗的参与者在28天死亡或机械通气。
我们评估了外部定义的单个n抗原截断值≥1000 pg/mL对于一周内临床恶化的预后价值,该临床恶化定义为按原始量表测量的WHO序数状态更糟、ICU入院和28天MV或死亡。这是bamlanivimab治疗住院COVID-19的临界值,其中有证据表明,当血浆n抗原高于/低于1000 pg/mL时,治疗效果有差异趋势[13].计算各结果的敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV)。拟合单独的未调整逻辑回归模型,并估计受试者工作曲线(AUROC)下面积。我们还使用每个结果的最佳约登指数测试了内部衍生截断的敏感性、特异性、PPV和NPV。
所有的分析都是两面性的p值< 0.05被认为是显著的。使用Stata版本17.0 (College Station, TX)进行统计分析。
结果
基线特征、病毒n抗原浓度和血浆生物标志物
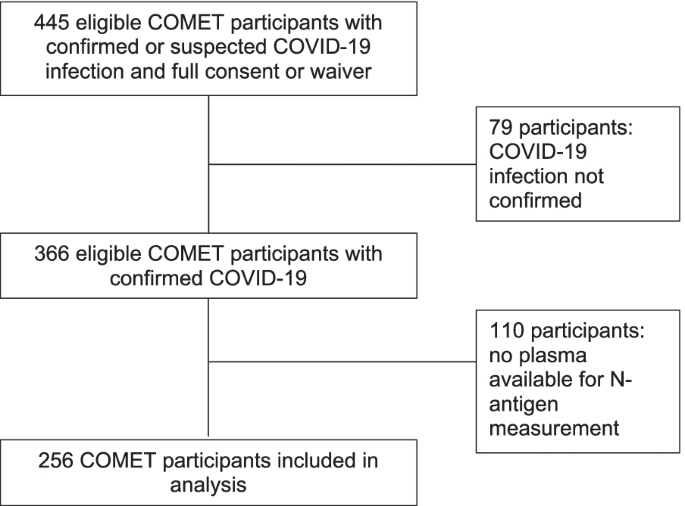
256名covid - 19阳性COMET受试者的血浆容量足以进行病毒n抗原测量(图2)。1),于2020年3月至2021年8月期间连续入学。研究参与者的基线特征见表1.71%的参与者接受瑞德西韦治疗,43%的参与者接受全身类固醇治疗(在入组前1天和入组前一周或之后),4%的患者接受托珠单抗治疗,< 1%的患者在住院期间的任何时间接受单克隆抗体治疗。
在84%的参与者中,n抗原高于检测下限(3 pg/mL)。基线WHO序数量表检测到n抗原水平的受试者百分比无显著差异(p= 0.33),尽管在D0插管的患者(78%可检测)与未插管的患者(86%可检测)相比,有较低的可检测百分比趋势。在有症状持续时间记录的受试者中,检测到n抗原的受试者的中位症状持续时间(8天)比未检测到n抗原的受试者(11天)短。p= 0.015)。当仅限于症状持续时间为14天或更短的参与者时,91%的参与者可检测到血浆病毒抗原水平,而症状持续时间大于14天的参与者可检测到血浆病毒抗原水平的比例为57%。
血浆n抗原浓度的总体分布是右偏的(附加文件1:图S1),中位数为735 pg/mL(范围2.9-80,108;差24 - 4574)。在D0时,WHO排序类别的基线病毒抗原浓度无显著差异。在病毒抗原浓度的四分位数之间比较基线特征(附加文件)1:表S2)。白人患者比例(p= 0.004),中位症状持续时间(p< 0.001),以及基线氧饱和度(p= 0.042)在病毒抗原四分位数上下降,而高血压参与者的比例增加(p= 0.043)。男性病毒抗原浓度中位数(537,IQR 15-3838 pg/mL)低于女性(1327,IQR 50-5115 pg/mL),但这种比较没有统计学意义(p= 0.16)。
目前吸烟者的n抗原浓度明显较低(n= 21)比目前不吸烟的人(n= 235) (43 [IQR 9-1060] pg/mL vs 804 [IQR 27-4887] pg/mL,p= 0.04,(附加文件1:图S2)。中位症状持续时间、年龄、BMI以及高血压和糖尿病等共病在吸烟者和非吸烟者之间没有显著差异,尽管男性的差异更大(n= 17, 81%的吸烟者和9%的男性吸烟者)比女性(n= 4, 19%的吸烟者和4%的女性)。
n抗原与血浆蛋白、细胞因子和趋化因子的关系
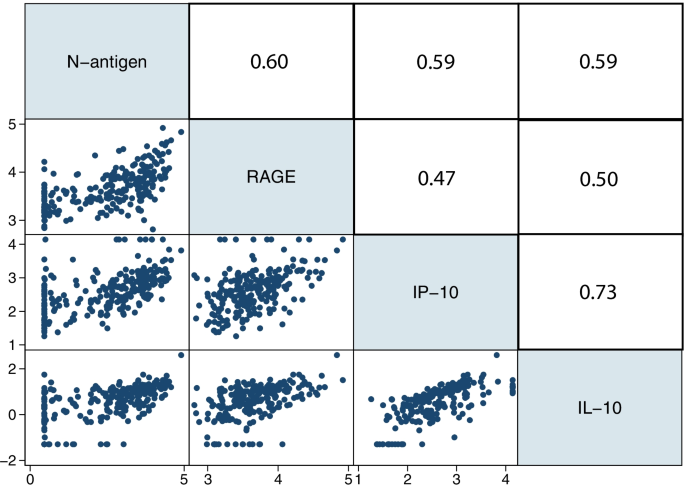
之前已经对一些参与者测量了来自D0样本的额外血浆蛋白、细胞因子和趋化因子。检测了病毒n抗原与10种选定蛋白质、细胞因子和趋化因子在D0时的相关性。经过多次比较校正后,RAGE、IL-10和IP-10与病毒n抗原浓度显著相关(图2)。2).IL-10和IP-10相关性最强,RAGE与IL-10和IP-10相关性中等。经多次比较校正后,其他生物标志物与n抗原浓度无显著相关性。所有测量的血浆蛋白、细胞因子和趋化因子在病毒n抗原四分位的分布显示在附加文件中1:表S3。血浆n抗原水平与炎症(c反应蛋白[CRP]、乳酸脱氢酶[LDH]和铁蛋白)或凝血功能失调(d -二聚体)的早期临床实验室标志物(D0或D1)之间也没有相关性。
n抗原与临床结果的关系
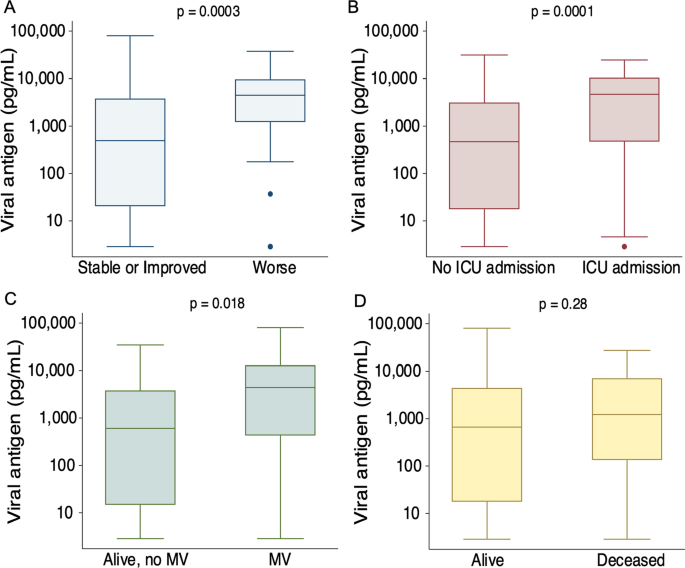
接下来,我们测试了D0时血浆n抗原浓度与一周内临床状态之间的关系,该关系由改良的WHO 5点顺序量表定义(见方法)。256名参与者中有254人完成了一周的结果数据。两名参与者在一周前被转移到另一家医院,随后的临床状况未知。在研究入组一周后,35名临床状态较差的参与者的血浆n抗原浓度明显高于稳定或改善的参与者(4507 [IQR 1225-9665] pg/mL vs. 483 [IQR 15-3811] pg/mL, p = 0.0003,图。3.a).在比例概率模型与修正的序数结果(附加文件1:表S1),在未调整(OR 1.05, 95% CI 1.03-1.07)和完全调整(OR 1.05, 95% CI 1.02-1.08)模型中,D0血浆n -抗原浓度每增加500 pg/mL与较差的一周结局显著相关(表S1)2).168名参与者在入组时未入住ICU,其中40人随后入住ICU。我们检测了这些参与者中D0血浆n抗原与他们住院期间任何ICU入院之间的相关性。曾入住ICU的患者血浆N-抗原浓度中位数为4697 (IQR 482-10,410) pg/mL,而从未入住ICU的128名患者中位数为471 (IQR 18-3142) pg/mL (p= 0.0001,图3.b).受试者血浆n抗原浓度每增加500 pg/mL,未调整OR为1.08 (95% CI 1.04-1.12),完全调整OR为1.16 (95% CI 1.07-1.25,表2)申请加护病房。
在28天,22名参与者进行了机械通气,23人死亡,199人仍然住院,没有插管,或活着出院,没有机械通气,12人在28天被转移到另一个急性设施,情况不明。在有完整28天预后数据的参与者中,28天机械通气的患者D0 n -抗原中位浓度为4413 (IQR 432-12,941) pg/mL,而存活且无创通气的患者中位浓度为574 (14-3811)pg/mL (p= 0.018,图3.c).虽然死亡参与者的D0病毒n抗原浓度在数值上高于28天存活的参与者(1225 [IQR 135-7105] pg/mL),但这种差异没有统计学意义(651 [IQR 15-4404] pg/mL,p= 0.28,图3.d)。
受试者血浆n抗原浓度每增加500 pg/mL,未调整OR为1.04 (95% CI 1.01-1.06),完全调整OR为1.03 (95% CI 1.00-1.05,表2)进行机械通气。n抗原浓度每增加500 pg/mL,未调整OR为1.01 (95% CI 0.98-1.03),调整OR为0.99(0.96-1.02)。
高D0血浆n抗原的预后鉴别
我们测试了D0时体外定义的高血浆n抗原浓度(1000 pg/mL或以上)临界值对风险分层的预后效用。为了产生敏感性/特异性和受试者工作曲线下面积(AUROC),一周结果使用比入组时更好或更差的有序量表的二分结果。ICU和28天机械通气或死亡结局与上述回归模型相同。46%的参与者D0血浆n抗原浓度为1000 pg/mL或更高。每种临床结果的敏感性、特异性、阴性预测值和阳性预测值(NPV和PPV)见表3..在补充结果(附加文件)中可以找到通过最佳约登指数对每个结果的内部推导截断值的预后鉴别性的比较,以及在多变量模型中与每个结果相关的内部推导的特定结果截断值的优势比1:表S4, S5)。对于28天机械通气的结果,内部推导的截止值优于外部推导的截止值。对于其他结果,内部推导的临界值仅略微改善预后区分或与1000 pg/mL无统计学差异。
讨论
本研究结果支持了测量血浆中SARS-CoV-2核衣壳抗原水平作为检测病毒产物传播到血液中的可靠方法的潜在价值,这种传播对临床结果具有生物学相关性和预后价值。血浆病毒n抗原浓度作为COVID-19的致病性和预后生物标志物,比血浆病毒RNA有几个优势。先前的研究发现,在汇总估计中,SARSCoV-2 RNA的可检测率约为10-34% [17,26];提高检测灵敏度可能需要先进的实验室技术,而这些技术很难应用于临床[39].尽管血浆RNA在一些研究中与临床结果相关,但它也最容易在重症患者中检测到[12,18,19,25,40],限制了SARS-CoV-2 RNA在早期或非危重疾病患者中的预后效用。相比之下,在我们的研究中,85%的研究参与者中检测到血浆n抗原,在入组前症状14天或更少的参与者中检测到血浆n抗原的比例为91%,这与之前的研究结果一致[13,27,28,41].在各种疾病严重程度的血浆中也可检测到n抗原,在入选时没有机械通气的研究参与者中检测到n抗原的趋势更高,可能是因为这些患者症状持续时间较长或之前接受了抗病毒治疗。
虽然血浆SARS-CoV-2 RNA浓度通常与炎症和血管损伤标志物有关[12,19],我们发现血浆n抗原水平与炎症(IL-6、IL-8、sTNFR-1)、凝血(蛋白C)和内皮损伤(Ang-2)标志物相关性较弱或无相关性。同样,n抗原水平与作为临床护理的一部分测量的炎症和凝血异常标志物(LDH,铁蛋白,CRP和d -二聚体)无关。然而,n抗原水平与RAGE、IL-10和IP-10相关。D0 RAGE升高,I型肺细胞损伤的标志[42,43],支持了最近的证据,即COVID-19的发病机制可能由肺泡上皮损伤介导[44],可能是后续内皮损伤和炎症反应的早期前哨事件[1].先前的研究还发现,与其他呼吸衰竭原因相比,IP-10和IL-10作为病毒感染(包括COVID-19)的生物标志物更具特异性[45].n抗原与IL-10之间的联系是否反映了一种适当的代偿反应,以减轻免疫介导的组织损伤[46]或SARS-CoV-2抑制宿主清除病毒的适应性特征[47]需要进一步研究。
在该队列中,当前吸烟者的基线血浆n抗原浓度显著低于非吸烟者或前吸烟者。这些差异不能用年龄或合并症等基线特征的差异来解释,症状出现前的持续时间也没有显著差异。吸烟者以男性为主,在我们的队列中,男性的病毒抗原浓度低于女性,这可以部分解释所观察到的差异。在我们的队列中,吸烟者的绝对人数很少,约占样本的9%,低于美国成年吸烟者的百分比,但与旧金山的成人吸烟率相似[48,49].尽管如此,这些结果与吸烟者患严重COVID-19风险较低的报告一致[50].
除了对COVID-19生物学的深入了解外,这项研究的结果还表明血浆n抗原水平在临床预后中的重要作用。我们的结果表明,早期血浆n抗原水平可能有助于临床恶化的风险分层(一周和ICU入院时的临床恶化)。血浆中病毒n抗原水平与机械通气之间未调整的相关性具有统计学意义,但完全调整的相关性未达到统计学意义的阈值,尽管存在显著的相关性趋势。虽然我们没有观察到高抗原水平与死亡率之间的关联,但我们注意到我们的队列相对年轻,中位年龄为57岁。在年龄较大且死亡率较高的队列中,或随访时间超过28天的队列中,可能会观察到n抗原浓度与死亡率之间的关联。高n抗原浓度对不良临床结果的敏感性大于特异性。重要的是,低n抗原浓度对不良结果具有良好的阴性预测价值。这些发现表明,除了临床信息外,患者住院期间早期的血浆n抗原浓度可用于识别那些不太可能发展为严重疾病或死亡的患者。血浆n抗原浓度可在数小时内测量,在随机单克隆抗体试验中抗原水平差异治疗反应的证据背景下,它可能是联合预后和预测性临床试验丰富的有价值的生物标志物[13,51].
我们研究的优势包括前瞻性纳入具有不同疾病严重程度的多样化观察队列。与其他关于血浆中n抗原水平的研究相比,我们的结果是定量的[37].研究参与者在临床和生物学上都表现良好。研究参与者来自三级护理中心和安全网医院,我们的研究人群接受的治疗反映了大流行期间不断变化的护理标准。
我们的研究也有局限性。虽然我们的研究结果深入了解了循环SARS-CoV-2病毒抗原的临床和生物学重要性,但它并不能解释为什么更严重疾病的患者血浆n抗原水平会升高。可能的机制包括病毒在肺中不受控制的复制、肺泡上皮-毛细血管屏障的破坏、上呼吸道和下呼吸道受感染上皮细胞的凋亡以及循环白细胞的直接感染[52].驱动系统病毒抗原传播的机制的特征和这些机制的治疗意义是必要的。入组前的症状持续时间没有限制,一些参与者是从另一家医院转来的,这可能会混淆入组血浆SARS-CoV-2 n抗原水平与初始疾病严重程度之间的关系。此外,我们的研究对象相对年轻。在我们的研究人群中,delta和omicron变体和omicron亚变体的表现不太可能,因为登记的时间轴是在这些变体在北美广泛流行之前。也有可能由于转移到其他机构的研究参与者,约5%的28天结果数据缺失导致了结果的偏倚。与完全随访的患者相比,转移的患者有更高的基线和1周严重程度,n抗原水平更有可能高于1000 pg/mL的临界值。这可能会使28天的结果数据偏向null。最后,预后鉴别的截止值仅能产生假设,需要在其他队列中进一步验证。
结论
总之,在COVID-19患者的血浆中,可以很容易地测量SARS-CoV-2 n抗原水平,而不依赖于基线疾病严重程度。结合其他血浆生物标志物,特别是血浆RAGE水平升高,n抗原水平为COVID-19肺炎的发病机制提供了重要的生物学见解,可能强调肺泡上皮细胞损伤的作用。此外,在住院后不久测量n抗原水平可以改善临床使用和丰富临床试验的风险分层。
数据可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- Ang-2:
-
Angiopoietin-2
- AUROC:
-
接收机工作曲线下的面积
- 体重指数:
-
身体质量指数
- CKD:
-
慢性肾病
- c反应蛋白:
-
c反应蛋白
- 彗星:
-
COVID-19多表型治疗有效
- HFNO:
-
高流量鼻氧
- 加护病房:
-
重症监护室
- IL:
-
白介素
- IMPACC:
-
COVID-19队列的免疫分型评估
- 知识产权:
-
干扰素诱导蛋白
- LDH:
-
乳酸脱氢酶
- 净现值:
-
负预测值
- PPV:
-
阳性预测值
- 愤怒:
-
晚期糖基化终产物sTNFR-1受体:可溶性肿瘤坏死因子受体1
- 人:
-
世界卫生组织
- MV:
-
有创机械通气
参考文献
Leisman DE, Mehta A, Thompson BT, Charland NC, Gonye ALK, Gushterova I, Kays KR, Khanna HK, LaSalle TJ, Lavin-Parsons KM,等。重症COVID-19的肺泡、内皮细胞和器官损伤标志物动态美国J呼吸危重护理医学。2021;205:507-19。
Leisman DE, Ronner L, Pinotti R, Taylor MD, Sinha P, Calfee CS, Hirayama AV, Mastroiani F, Turtle CJ, Harhay MO,等。重症和危重型COVID-19的细胞因子升高:快速系统综述、荟萃分析和与其他炎症综合征的比较中国呼吸医学杂志,2020;8(12):1233-44。
Abers MS, Delmonte OM, Ricotta EE, Fintzi J, Fink DL, de Jesus AAA, Zarember KA, Alehashemi S, Oikonomou V, Desai JV,等。基于免疫的生物标志物特征与COVID-19患者的死亡率相关。JCI Insight, 2021。https://doi.org/10.1172/jci.insight.144455.
Calvet J, Berenguer-Llergo A, Gay M, Massanella M, Domingo P, Llop M, Sanchez-Jimenez E, Arevalo M, Carrillo J, Albinana N,等。入院时COVID-19相关肺炎进展和临床管理的生物标志物候选。科学通报2022;12(1):640。
Herold T, Jurinovic V, Arnreich C, Lipworth BJ, Hellmuth JC, von Bergwelt-Baildon M, Klein M, Weinberger T. IL-6和CRP水平升高预测COVID-19需要机械通气。中华过敏临床免疫杂志,2020;26 (1):344 - 344 e344。
Meizlish ML, Pine AB, Bishai JD, Goshua G, Nadelmann ER, Simonov M, Chang CH, Zhang H, Shallow M, Bahel P,等。中性粒细胞激活特征预测COVID-19的危重疾病和死亡率。《血液杂志》2021;5(5):1164-77。
Magleby R, Westblade LF, Trzebucki A, Simon MS, Rajan M, Park J, Goyal P, Safford MM, Satlin MJ。2019年严重急性呼吸综合征冠状病毒2型病毒载量对冠状病毒病住院患者插管风险和死亡率的影响中国生物医学工程学报,2015;29(4):344 - 344。
Knudtzen FC, Jensen TG, Lindvig SO, Rasmussen LD, Madsen LW, Hoegh SV, Bek-Thomsen M, Laursen CB, Nielsen SL, Johansen IS。SARS-CoV-2病毒载量作为COVID-19门诊和住院患者疾病严重程度的预测因素:一项前瞻性队列研究PLoS ONE。2021; 16 (10): e0258421。
Boyapati A, Wipperman MF, Ehmann PJ, Hamon S, Lederer DJ, Waldron A, Flanagan JJ, Karayusuf E, Bhore R, Nivens MC,等。基线严重急性呼吸综合征病毒载量与2019年冠状病毒疾病严重程度和临床结果相关:2/3期试验的事后分析中华流行病学杂志,2011;26(4):344 - 344。
de la Calle C, Lalueza A, Mancheno-Losa M, Maestro-de la Calle G, laura - tamayo J, Arrieta E, Garcia-Reyne A, Losada I, de Miguel B, Diaz-Simon R,等。入院时病毒载量对SARS-CoV-2感染住院患者呼吸衰竭发展的影响中国临床微生物学杂志,2016;29(6):339 - 339。
Salto-Alejandre S, Berastegui-Cabrera J, camachoo - martinez P, Infante-Dominguez C, Carretero-Ledesma M, Crespo-Rivas JC, Marquez E, Lomas JM, Bueno C, Amaya R,等。鼻咽拭子SARS-CoV-2病毒载量不是不良预后的独立预测因子。科学通报2021;11(1):12931。
Fajnzylber J, Regan J, Coxen K, Corry H, Wong C, Rosenthal A, Worrall D, Giguel F, piechokka - trocha A, Atyeo C,等。SARS-CoV-2病毒载量与疾病严重程度和死亡率增加有关。网络学报。2020;11(1):5493。
activo - tico Bamlanivimab研究组,Lundgren JD, Grund B, Barkauskas CE, Holland TL, Gottlieb RL, Sandkovsky U, Brown SM, Knowlton KU, Self WH,等。COVID-19住院患者根据基线抗体和抗原水平对中和单克隆抗体的反应 :一项随机对照试验。中华医学杂志(英文版);2002;
Berastegui-Cabrera J, Salto-Alejandre S, Valerio M, Perez-Palacios P, Revillas FAL, abelda - alonso G, Oteo-Revuelta JA, Carretero-Ledesma M, Munoz P, Pascual A,等。SARS-CoV-2 RNAemia与严重的慢性基础疾病有关,但与鼻咽病毒载量无关。中华流行病学杂志,2011;32 (3):e38-41。
陈琳,王刚,龙霞,侯辉,魏健,曹勇,谭杰,刘伟,黄玲,孟F,等。血液病毒载量动态与2019冠状病毒病(COVID-19)患者的临床结果密切相关:一项前瞻性队列研究。中华分子病理学杂志,2021;23(1):10-8。
Hagman K, Hedenstierna M, gillle - johnson P, Hammas B, Grabbe M, Dillner J, Ursing J.血清中严重急性呼吸综合征冠状病毒2 rna作为2019年冠状病毒疾病严重结局的预测因素:一项回顾性队列研究。中国生物医学工程学报,2015;29(3):344 - 344。
Andersson MI, Arancibia-Carcamo CV, Auckland K, Baillie JK, Barnes E, Beneke T, Bibi S, Brooks T, Carroll M, Crook D,等。在COVID-19患者血液制品中检测到的SARS-CoV-2 RNA与传染性病毒无关。Wellcome Open res 2020;5:181。
Veyer D, Kerneis S, Poulet G, Wack M, Robillard N, Taly V, L 'Honneur AS, Rozenberg F, Laurent-Puig P, Belec L,等。高灵敏度定量血浆严重急性呼吸综合征冠状病毒2 RNA揭示了其潜在的临床价值。中国生物医学工程学报,2015;29(3):344 - 344。
Bermejo-Martin JF, Gonzalez-Rivera M, Almansa R, Micheloud D, Tedim AP, Dominguez-Gil M, Resino S, Martin-Fernandez M, Ryan Murua P, Perez-Garcia F,等。血浆中的病毒RNA载量与COVID-19的危重疾病和调节失调的宿主反应有关。重症监护。2020;24(1):691。
Prebensen C, Myhre PL, Jonassen C, Rangberg A, Blomfeldt A, Svensson M, Omland T, Berdal JE。2019年冠状病毒病住院患者重症监护病房入院和死亡率与血浆中严重急性呼吸综合征冠状病毒2 RNA相关。中国生物医学工程学报,2015;29(3):344 - 344。
Heinrich F, Nentwich MF, Bibiza-Freiwald E, Norz D, Roedl K, Christner M, Hoffmann A, Olearo F, Kluge S, Aepfelbacher M,等。SARS-CoV-2血液RNA载量预测COVID-19危重患者的预后。开放论坛感染杂志2021;8(11):ofab509。
陈晓,赵斌,曲勇,陈勇,熊杰,冯勇,门冬,黄强,刘勇,杨波,等。2019年冠状病毒病危重患者血清检测到的严重急性呼吸综合征冠状病毒2型病毒载量(RNAemia)与白细胞介素6水平大幅升高密切相关。中华流行病学杂志,2020;21(8):337 - 344。
Jacobs JL, Bain W, Naqvi A, Staines B, Castanha PMS, Yang H, Boltz VF, barat - boyes S, Marques ETA, Mitchell SL,等。SARS-CoV-2病毒血症与COVID-19严重程度相关,可预测临床结果。中国生物医学工程学报,2015;29(3):344 - 344。https://doi.org/10.1093/cid/ciab686.
Brunet-Ratnasingham E, Anand SP, Gantner P, Dyachenko A, Moquin-Beaudry G, Brassard N, Beaudoin-Bussieres G, Pagliuzza A, Gasser R, Benlarbi M,等。综合免疫病毒学分析验证了血浆SARS-CoV-2 RNA作为COVID-19死亡率的早期预测因子。科学通报2021;7(48):eabj5629。
Nijhuis RHT, Russcher A, de Jong GJ, Jong E, Herder GJM, Remijn JA, Verweij SP.急诊就诊的COVID-19患者血浆中SARS-CoV-2的低患病率。中国临床病毒杂志。2020;133:104655。
唐凯,吴林,罗勇,龚波。2019年冠状病毒病患者SARS-CoV-2 RNAemia定量评估及转归。中国医学病毒学杂志,2021;29(5):366 - 366。
Ahava MJ, Kurkela S, Kuivanen S, Lappalainen M, Jarva H, Jaaskelainen AJ。从血清中检测SARS-CoV-2核衣壳抗原可帮助判断COVID-19感染时间。中国生物医学工程杂志。
Hingrat QL, Visseaux B, Laouenan C, Tubiana S, Bouadma L, Yazdanpanah Y, Duval X, Burdet C, Ichou H, Damond F,等。急性COVID-19患者血液中SARS-CoV-2 n抗原的检测提供了一种敏感的新标记和新的检测方法。临床微生物感染杂志,2020;27(5):789.e1-5。https://doi.org/10.1016/j.cmi.2020.11.025.
邓强,叶刚,潘艳,谢伟,杨刚,李智,李艳。新型冠状病毒2n蛋白抗原化学发光免疫分析法用于COVID-19急性期诊断的一线检测:一项回顾性队列研究。Front Med(洛桑)。2021; 8:676560。
Thudium RF, Stoico MP, Hogdall E, Hogh J, Krarup HB, Larsen MAH, Madsen PH, Nielsen SD, Ostrowski SR, Palombini A,等。通过SARS-CoV-2核衣壳蛋白血液样本抗原检测对COVID-19进行早期实验室诊断。中国临床微生物学杂志。2021;39 (10):e0100121。
Shan D, Johnson JM, Fernandes SC, Suib H, Hwang S, Wuelfing D, Mendes M, Holdridge M, Burke EM, Beauregard K,等。n蛋白在无症状和有症状的SARS-CoV-2感染期间早期出现在血液、干血和唾液中。自然科学学报。2021;12(1):1931。
张勇,周杰,周杰,张勇,张晓东,张晓东,张晓东,张晓东,张晓东,张晓东,张晓东,等。采用超灵敏定量免疫分析法检测儿童急性COVID-19或misc患者血浆中SARS-CoV-2抗原。临床感染疾病。2022;33:34。
超灵敏的SARS-CoV-2抗原和抗体序列分析用于了解COVID-19重症患者的疾病进展。临床医学杂志,2020;66(12):1562-72。
Martin-Vicente M, Almansa R, Martinez I, Tedim AP, Bustamante E, Tamayo L, Aldecoa C, Gomez JM, Renedo G, Berezo JA,等。抗sars - cov - 2s抗体水平低预示着COVID-19危重患者的死亡率和病毒成分在血液中的传播增加。中华临床医学杂志(英文版);
Olea B, Albert E, Torres I, Gozalbo-Rovira R, Carbonell N, Ferreres J, Poujois S, Costa R, Colomina J, Rodriguez-Diaz J,等。重症成年COVID-19患者的SARS-CoV-2 n抗原血症:频率及其与炎症和组织损伤生物标志物的相关性中国医学病毒学杂志,2002,22(1):1 - 8。
王华,Hogan CA, Verghese M, Solis D, Sibai M, Huang C, Roltgen K, Stevens BA, Yamamoto F, Sahoo MK,等。SARS-CoV-2核衣壳血浆抗原用于COVID-19诊断和监测。中国生物医学工程学报,2016;29(1):344 - 344。
Almansa R, Eiros JM, de Gonzalo-Calvo D, Postigo T, Ortega A, Lopez-Izquierdo R, Moncusi-Moix A, Gort-Paniello C, Dominguez-Gil M, Fuente A,等。通过快速横向流动试验检测n抗原血症可预测COVID-19患者90天死亡率:一项前瞻性队列研究临床微生物感染,2022。https://doi.org/10.1016/j.cmi.2022.05.023.
Impacc手稿写作小组,国际新闻社委员会。COVID-19队列免疫表型评估(IMPACC):一项前瞻性纵向研究。免疫科学,2021。https://doi.org/10.1126/sciimmunol.abf3733.
黄忠,宁波,杨hs, Youngquist BM,牛A, Lyon CJ, Beddingfield BJ, Fears AC, Monk CH, Murrell AE,等。敏感追踪SARS-CoV-2感染所有阶段的循环病毒RNA。J clinin Invest, 2021。https://doi.org/10.1172/JCI146031.
Kawasuji H,森永Y,谷田H,吉田Y,武高Y,金田M,村井Y,木本K,上野A,宫岛Y,等。具有较高鼻咽病毒载量的SARS-CoV-2 RNAemia与COVID-19患者的疾病严重程度和死亡率密切相关。中国医学病毒学杂志,2002,22(1):1 - 5。
brassen CL, Christensen H, Olsen DA, Kahns S, Andersen RF, Madsen JB, Lassen A, Kierkegaard H, Jensen A, Sydenham TV等。每日监测血液中SARS-CoV-2抗原和RNA、IL-6、CRP和补体C3d等病毒载量,可预测COVID-19住院患者的预后。中华临床医学杂志,2021;39(12):1988-97。
福田Y,田中A,本马T,金子K,宇野T,藤原A,内田Y,铃木S,小谷T,佐原h2/ FiO2重症监护室急性低氧性呼吸衰竭伴双侧混浊的比率。PLoS ONE。2021; 16 (1): e0245927。
Yamakawa N, Uchida T, Matthay MA, Makita K.体外和原位肺泡上皮细胞晚期糖基化终产物受体的蛋白水解释放。中国生物医学工程杂志,2011;30(4):516-525。
威克KD,西格尔L,尼顿JD,奥德米森C,朗格伦J,杜瓦RL,莱恩HC,汤普森BT,马修MA。RAGE在非插管住院的COVID-19患者中具有潜在的发病和预后价值。JCI Insight, 2022年。https://doi.org/10.1172/jci.insight.157499.
Hue S, Beldi-Ferchiou A, Bendib I, Surenaud M, Fourati S, Frapard T, Rivoal S, Razazi K, Carteaux G, delfauo - larue MH,等。COVID-19急性呼吸窘迫综合征患者先天性免疫反应失控和适应性免疫反应受损美国呼吸危重症护理杂志。2020;202(11):1509-19。
张伯伦TC,梅亚良,利利JP。COVID-19中白细胞介素-10水平升高:促炎反应增强或抗炎作用受损?Front Immunol. 2021;12:677008。
Mick E, Kamm J, Pisco AO, Ratnasiri K, Babik JM, Castaneda G, DeRisi JL, Detweiler AM, Hao SL, Kangelaris KN,等。上呼吸道基因表达显示,与其他呼吸道病毒相比,SARS-CoV-2的免疫反应受到抑制。网络学报。2020;11(1):5854。
Cornelius M, Wang T, Jamal A, Loretan C, Neff L.成人烟草制品使用情况:美国,2019年。MMWR Morb Mortal Wkly代表2020;69:1736-42。
烟草使用和接触。http://www.sfhip.org/chna/community-health-data/tobacco-use-and-exposure/.
Angus DC, Derde L, al - beidh F, Annane D, Arabi Y, Beane A, van Bentum-Puijk W, Berry L, Bhimani Z, Bonten M,等。氢化可的松对重症COVID-19患者死亡率和器官支持的影响:REMAP-CAP COVID-19皮质类固醇域随机临床试验《美国医学协会杂志》上。324(13): 1317 - 2020; 29。
activo - tico Ly- CoV555研究组,Lundgren JD, Grund B, Barkauskas CE, Holland TL, Gottlieb RL, Sandkovsky U, Brown SM, Knowlton KU, Self WH,等。新型冠状病毒肺炎住院患者的中和单克隆抗体。中华实用医学杂志,2015;26(4):344 - 344。
Junqueira C, Crespo A, Ranjbar S, de Lacerda LB, Lewandrowski M, Ingber J, Parry B, Ravid S, Clark S, Schrimpf MR,等。fcgamma介导的SARS-CoV-2单核细胞感染激活炎症。大自然。2022;606:576 - 84。
确认
我们感谢COMET联盟的成员。未被列为作者的成员的姓名和隶属关系在附加文件中提供1.我们也感谢博士。来自IMPACC蛋白质组学核心的Benoit Fatou, Kinga Smolen, Hanno Steen, Patrick van Zalm和Arthur Viode分享了他们在质谱检测方面的数据。
COMET联盟成员和附属机构
由美子Abe-Jones:加州大学旧金山分校医院医学部。Alexander Beagle:美国加州大学旧金山分校医学系。Sharvari Bhide:加州大学旧金山分校扎克伯格总医院和创伤中心医学部肺和重症监护医学部。Gabriela K. Fragiadakis:美国加州大学旧金山分校风湿学系医学系,加州大学旧金山分校CoLabs,加州大学旧金山分校Bakar ImmunoX项目,加州大学旧金山分校,加州94143。Ana Gonzalez:加州大学旧金山分校扎克伯格旧金山总医院和创伤中心医学部肺和重症监护医学部。Omid Jamdar:海伦·迪勒家族综合癌症中心,加州大学旧金山分校,美国。诺曼·琼斯:核心免疫实验室。美国加州大学旧金山分校实验医学部。Tasha Lea:美国加州大学旧金山分校病理科。Carolyn Leroux:美国加州大学旧金山分校医学系肺与重症监护医学部。 Jeff Milush: Core Immunology Laboratory. Division of Experimental Medicine, University of California San Francisco, California, USA.Logan Pierce: Division of Hospital Medicine, University of California, San Francisco, California. Priya Prasad: Division of Hospital Medicine, University of California, San Francisco, California. Sadeed Rashid: Helen Diller Family Comprehensive Cancer Center, University of California, San Francisco, CA, USA. Nicklaus Rodriguez: Helen Diller Family Comprehensive Cancer Center, University of California, San Francisco, CA, USA. Austin Sigman: Division of Pulmonary and Critical Care Medicine, Department of Medicine, University of California San Francisco, San Francisco, California, USA. Luz Torres Altamirano: Helen Diller Family Comprehensive Cancer Center, University of California, San Francisco, CA, USA. Alyssa Ward: Division of Rheumatology, Department of Medicine, University of California San Francisco, San Francisco, California, USA. Michael Wilson: Weill Institute for Neurosciences, Department of Neurology, University of California, San Francisco.
资金
该项目部分由美国国立卫生研究院(U19AI077439,支持NIAID COVID-19队列免疫分型评估[IMPACC]网络的UCSF部分)资助,部分由基因泰克(TSK-020586)资助。
作者信息
作者及隶属关系
财团
贡献
CSC, AL, MAM和KDW构思并设计了这项研究。KDW进行了数据分析,撰写了手稿的初稿,并创建了图表。AW是主要的数据管理器。SC是主要的项目经理。RG、AJ、SSC、VN和DL为研究协调人。CJ进行了非病毒蛋白质生物标志物测量。RD和HCL进行核衣壳测量。PS对研究设计做出了贡献,并提供了重要的修订。KNK, CMH和KDL担任医师领导。AL, DJE, CRL, MFK和PGW是COMET执行委员会的成员,他们审查并批准了本文的提交。 All authors critically reviewed the manuscript and approved the submission. All authors read and approved the final manuscript.
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了加州大学旧金山分校机构审查委员会、IRB 20-30497以及COMET和IMPACC科学领导委员会的批准。从研究参与者或指定的代理决策者那里获得知情同意。机构审查委员会授予因研究期间死亡或在三次尝试后无法联系到参与者或其代理人而无法获得直接同意的研究参与者放弃同意。
发表同意书
不适用。
相互竞争的利益
除以下项目资助外,作者还宣布:KDW获得了NIH 5T32GM008440-24的资助。AL、DJE、CRL、MFK和PGL担任COMET执行委员会成员。RD获HHSN261201500003I资助。CMH得到了NIH NHLBI 5K23HL133495和DOD W81XWH-171-0631的支持。KDL从AM Pharma、Biomerieux、BOA Medical、Neumora、Seastar等公司收取咨询费,并持有Amgen的股份。PGW从Genentech获得COVID-19研究的赠款资金,并从赛诺菲、Regeneron、阿斯利康、格伦马克制药和Theravance获得咨询费。CSC获得了NIH的资助支持,并报告了罗氏/基因泰克和拜耳的资助和个人费用,以及夸克制药、Gen1e生命科学、Vasomune、Quantum Leap医疗保健协作、Janssen和Cellenkos的个人费用。MAM获得NIH/NHLBI R35HL140026、NIH/NIAID OT2HL156812、Genetech-Roche和Quantum对ispi - ards的资助,以及Citius、诺华、强生、吉利德和Pliant的顾问费。AW, SAC, RG, AJ, SSC, VN, DL, CJ, HCL和PS没有竞争利益需要披露。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
在线补充。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
威克,k.d.,莱利格多维茨,A.,威尔莫,A.。et al。血浆SARS-CoV-2核衣壳抗原水平与住院COVID-19患者病情进展相关。暴击治疗26, 278(2022)。https://doi.org/10.1186/s13054-022-04153-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13054-022-04153-3