摘要
背景
有关重症脓毒症患儿维生素A状况的资料很少。血清维生素A水平与败血症的临床结果之间的关系尚未得到很好的评估。本研究的目的是评估重症脓毒症患儿维生素A缺乏的患病率及其与临床结果的关系。
方法
儿童重症监护室收治的脓毒症危重儿童参与了这项前瞻性研究。来自儿科外科的性别和年龄匹配的近似健康儿童被纳入对照组。所有患者在入院后24小时内采集血液样本,测量血清维生素A状态。我们比较了脓毒症组和对照组的维生素A状况。此外,我们还比较了脓毒症患者缺乏维生素A和没有缺乏维生素A的两个亚组的临床特征。采用单变量和多变量方法评估维生素A缺乏与感染性休克之间的关系。
结果
160名脓毒症儿童和49名接近健康的儿童被纳入这项研究。研究组94名(58.8%)受试者发现维生素A缺乏,对照组6名(12.2%)受试者(P< 0.001)。在脓毒症患者中,维生素A缺乏症患者的28天死亡率和住院死亡率均不显著高于非维生素A缺乏症患者(P> 0.05)。然而,维生素A水平与化脓性VAD患儿较高的PRISM评分呈负相关(r=−0.260,P= 0.012)。维生素A缺乏与感染性休克相关,未调整优势比(OR)为3.297(95%可信区间(CI), 1.169 ~ 9.300;P= 0.024)。在logistic模型中,维生素a缺乏(OR, 4.630;95% ci, 1.027-20.866;P= 0.046),降钙素原(OR 1.029;95% ci, 1.009-1.048;P= 0.003),儿科死亡风险评分(OR, 1.132;95% ci, 1.009-1.228;P= 0.003)与感染性休克独立相关。
结论
脓毒症患儿维生素A缺乏症的患病率较高。维生素A缺乏可能是脓毒症危重儿童死亡的一个标志。
试验注册
Clinicaltrials.gov, NCT03598127
背景
维生素A (VA)及其衍生物都是一组不饱和的营养有机化合物,在胚胎发育、生长、视力、生殖和免疫系统中发挥重要作用[1,2,3.].维甲酸(RA)是VA的活性代谢物,据报道可促进抗炎调节性T细胞(Treg)分化并抑制白介素(IL)-6诱导的促炎T辅助17 (Th17)细胞,从而平衡促炎免疫和抗炎免疫[4].除了众所周知的严重VA缺乏症(VAD)的夜盲症外,大量文献提供了VAD因儿童感染风险增加而与不良健康结果相关的证据。VAD可在多个层面上影响免疫,包括扰乱胃肠粘膜屏障的完整性,减少单核细胞和自然杀伤细胞(NK)数量,损害巨噬细胞、树突状细胞和中性粒细胞的功能[1,5,6,7].我们之前的研究显示VAD与干扰素-α (IFN-α)和肠病毒71 (EV71)免疫球蛋白M (IgM)浓度降低有关,导致EV71感染儿童的免疫力下降和病情严重程度增加[8,9].虽然VAD在普通人群中已经是一个几十年来备受关注的问题,但目前还没有关于重症败血症儿童VA状况的数据。
败血症是一种由宿主对感染反应失调引起的危及生命的器官功能障碍,每年在全世界造成数百万人死亡,死亡率超过25%。值得注意的是,败血症是儿童死亡的常见原因。据报道,儿童严重败血症的死亡率高达34.6% [10].据透露,超过50%的学龄前儿童死亡是由于可能导致败血症的严重传染病[11].据报道,在过去的几十年里,严重败血症的发病率稳步上升[12].脓毒症作为一个公共卫生问题,多年来对广泛的卫生保健资源造成了重大负担。据报道,它是一种复杂的免疫疾病,其特征是早期的高炎症性免疫反应和后期的免疫抑制[13,14,15].大多数脓毒症死亡是由于机会性病原体重叠感染或免疫抑制引起的潜伏病毒再激活[16].
VA是一种免疫调节剂,它的缺乏可能导致促炎因子和抗炎因子之间的不平衡和免疫功能受损,这在败血症中被发现。有一个生物学的基本原理,VAD可能是与败血症患者的不良临床结果相关的一个促成因素。重要的是,VAD在儿童中非常普遍,尤其是学龄前儿童。然而,关于VAD与败血症之间的相关性的数据很少。我们推测VAD可能在儿童败血症的发病机制和进展中发挥重要作用。因此,本研究的目的是评估VAD在重症脓毒症患儿中的患病率以及VAD与临床结果之间的关系。
方法
本前瞻性研究于2018年2月至2019年1月在四川大学华西医院进行。本研究得到四川大学华西医院伦理委员会的批准,并符合《赫尔辛基宣言》。在启动研究相关程序之前,儿童的法定监护人被告知该研究,并提供书面知情同意书。0个月至192个月的儿童重症监护室(PICU)患者因败血症(定义为国际小儿败血症共识会议:败血症的定义和儿科器官功能障碍)连续报名[17].从儿科外科招募了性别和年龄匹配的无败血症的近似健康儿童作为对照组。大约健康的儿童被定义为接受常规儿科手术的患者,包括包皮环切术、腹股沟疝修补术或小型良性肿瘤切除术。排除标准为早产儿和低出生体重(LBW)婴儿,年龄为> - 18岁,有潜在器官功能障碍,接受过化疗或放疗,恶性血液系统疾病,原发性或获得性免疫缺陷,以及不顾医生建议且预后不确定的出院。没有对这些儿童进行额外的干预。孩子们的合法授权代表并不知道他们的VA水平。所有的治疗师都对这项研究一无所知。这次试验被登记在公共数据库中ClinicalTrials.gov(NCT03598127)。
所有患者在入院前24小时内采集血液样本,然后进行肠内营养和/或肠外营养。VA对光敏感。因此,静脉血采集后立即送入铝箔包管。接下来,样品在3000转/分下离心5分钟,分离血清。将血清置于标记的Eppendorf试管中,并在- 80°C冷冻,直到用高效液相色谱法分析血清样本的VA浓度。血清VA水平低于20 μg/dl被认为缺乏[18].所有招募的患者在入院时记录人口统计学数据。从脓毒症患者中收集了以下数据:儿童死亡风险(PRISM)评分(入院后24小时内)、体温、乳酸水平以及基本的血液学和生化测试结果。收集脓毒症患者的临床相关资料,包括感染来源、血培养阳性、机械通气时间、PICU住院时间、严重脓毒症或脓毒症休克发作、出院时死亡率、28天死亡率等。根据国际共识的定义[17],出现急性呼吸窘迫综合征、心血管器官功能障碍或两种或两种以上其他急性器官功能障碍的脓毒症定义为严重脓毒症。伴有心血管功能障碍的败血症定义为败血性休克。器官功能障碍的定义亦根据国际共识[17].
使用SPSS 22.0 for Windows (SPSS Inc.,芝加哥,伊利诺伊州,美国)进行统计分析。具有正态分布或非正态分布的数据分别被描述为25%和75%四分位数(四分位数范围)的平均值和标准差(SD)或中位数。分类变量以计数(百分比)表示。采用Student 's法分析具有正态分布的连续变量t测试。P数值在执行多重操作时采用Bonferroni校正方法进行调整t测试。无正态分布的数据采用非参数检验(Mann-WhitneyU测试)。采用卡方检验或Fisher精确检验对分类数据进行分析。用Pearson相关检验变量间的相关性。我们使用单变量和多变量方法来评估维生素A缺乏和感染性休克之间的关系。一个P值< 0.05为有统计学意义。因素P单因素分析中< 0.10者进行多因素回归分析。
结果
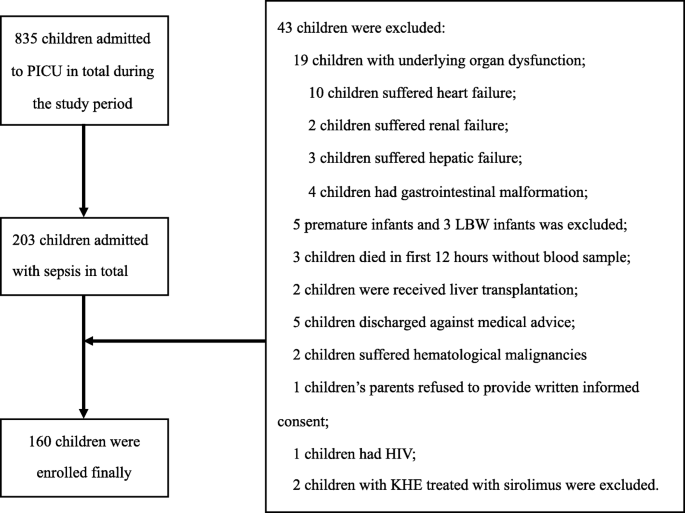
在研究期间,共有203名儿童因脓毒症入院,最终有160名脓毒症患者被纳入本研究(图2)。1).49名来自儿科外科的健康对照受试者也被纳入研究。脓毒症组和对照组的人口学特征见表1.两组间的人口学特征无显著性差异。脓毒症患儿平均VA水平明显低于对照组(0.192±0.106 mg/L vs. 0.339±0.119 mg/L;P< 0.001)。败血症组VAD患病率为58.8%,对照组为12.2%。P< 0.001。在败血症组中,56.9%为男孩,中位年龄为12个月,77.5%的儿童小于60个月。在脓毒性VAD患者中,76.6%的患者年龄小于60个月。最有可能的感染源是胃肠道系统,其次是肺部系统。重度脓毒症29例(18.1%),脓毒症休克15.6%。在严重脓毒症和脓毒症休克亚组中,VAD的发生率分别为79.3%和80.0%(附加文件1和表3.).
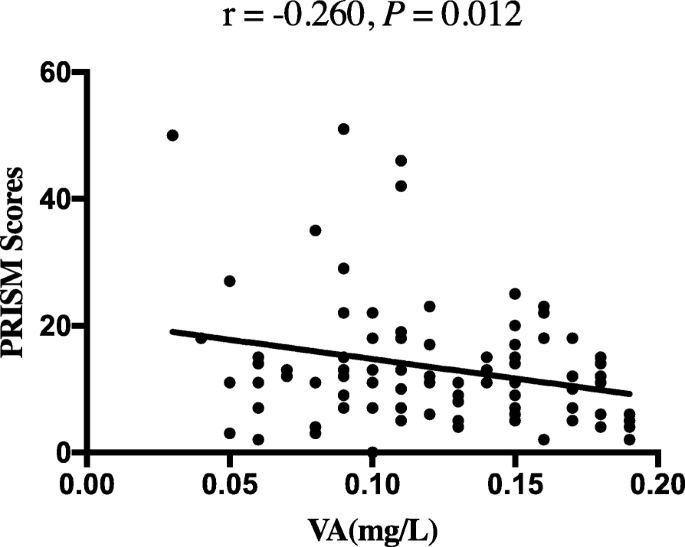
在有和没有VAD的脓毒症患者中,PRISM评分、体温、降钙素原(PCT)、乳酸水平、白细胞(WBC)计数、通气时间、住院时间和PICU住院时间无显著差异。血培养阳性率差异无统计学意义。与无VAD的脓毒症患者相比,VAD患者的低血糖发生率更高(4.5% vs. 18.1%;P= 0.011),血清白蛋白水平较低(31.64±6.68 vs 28.64±6.25,P= 0.004)。VAD患者的住院死亡率和28天死亡率并不显著高于无VAD患者(P> 0.05)。此外,与无VAD的脓毒症患者相比,VAD患者严重脓毒症的发生率显著升高(9.1% vs 24.5%;P= 0.013);VAD患者感染性休克的发生率也较高(7.6% vs 21.3%;P= 0.019)。我们还发现VAD患者的血小板(PLT)计数低于无VAD患者(P= 0.007)2).在患有VAD的脓毒症儿童中,较低的维生素A水平与较高的PRISM评分相关(r=−0.260,P= 0.012)(图2).我们还发现VA水平与血清白蛋白水平相关(r= 0.322,P< 0.001)。
感染性休克患者与非感染性休克患者的比较见表3..年龄、体重和性别在两个亚组中的分布相似。脓毒性休克患儿的PRISM评分、PCT水平、乳酸水平中位数高于未发生休克的患儿,PLT计数较低。脓毒性休克组白细胞计数较低,但差异不显著。脓毒性休克患者低血糖发生率明显高于非脓毒性休克患者,但两组血培养阳性率无显著性差异。感染性休克患儿通气时间、ICU天数和住院天数较长,住院和28天死亡率较高。
采用单因素分析比较感染性休克患者与非感染性休克患者(表2)4).变量与P< 0.10被认为是脓毒性休克的重要因素,包括VAD、低血糖、PRISM溃疡、温度、PCT、PLT和乳酸水平。基于单因素分析中明显的统计学差异,多因素回归分析结果显示VAD(优势比(OR) 4.630;95%置信区间(CI) 1.027-20.866;P= 0.046), PCT(或1.029;95% ci 1.009-1.048;P= 0.003), PRISM得分(OR 1.132;95% ci 1.009-1.228;P= 0.003)与感染性休克独立相关(表4).PLT对感染性休克具有保护作用(OR 0.994;95% ci 0.988-0.999;P= 0.045)。单变量和多变量方法也用于分析严重脓毒症的危险因素,并确定了VAD对严重脓毒症的独立影响(附加文件1和附加文件2).
讨论
在本研究中,我们发现大多数脓毒症患者为男孩,年龄小于60个月。研究人群的总死亡率为4.4%。其他研究人员也报告了类似的发现[10,19].我们的研究表明,PICU中伴有败血症的危重儿童,特别是严重败血症和/或脓毒症休克的儿童,VAD的患病率明显高于接近健康的受试者。VAD是一个全球性健康问题。世界卫生组织发起的一项调查显示,近2亿学龄前儿童和2000万孕妇受到VAD的影响。调查人员还发现,520万学龄前儿童和980万孕妇患有夜盲症[18].在中国,一项针对8669名0 - 6岁儿童的全国性调查显示,VAD的患病率为11.7% [20.].
近几十年来,大量文献提供了VAD与儿童死亡率之间关联的证据[21,22,23].在印度尼西亚进行的一项针对大量人口的研究报告显示,在过去6个月内未接受VA胶囊的儿童更有可能受到感染[24].一项涉及近3000名儿童的前瞻性研究表明,与正常VA儿童相比,VAD儿童肠道感染的风险高出2.17倍,呼吸道感染的风险高出2.36倍[25].此外,我们之前的研究结果显示,手足口病患儿大多表现为VA功能不全,这与他们免疫力下降、病情加重有关[8].值得注意的是,这些研究大多数是在非洲和东南亚进行的,这表明这些地区的VAD患病率很高,世卫组织VAD全球数据库显示了这一点[18].
我们的目的之一是揭示VAD与脓毒症儿童临床结果之间的关系。我们发现有VAD的脓毒症患儿的住院死亡率和28天死亡率均高于无VAD的患儿,尽管差异不显著。此外,我们的数据表明,在脓毒症患儿中,较低的维生素A水平与较高的PRISM评分和较低的白蛋白水平相关。值得注意的是,我们发现VAD患者更有可能遭受严重的败血症和感染性休克,这可能直接导致不良结果。此外,经过多变量模型的变量调整,VAD与感染性休克和严重脓毒症具有独立的相关性,而脓毒症涉及多个器官。
脓毒症早期表现为高炎症,可导致脓毒症相关多器官功能衰竭和死亡。在本研究中,VAD被发现与脓毒症休克和严重脓毒症独立相关。可以想象,由于VA在平衡促炎免疫和抗炎免疫方面的重要性,VAD可能部分地促进了脓毒症的高炎症反应。VA可通过增加Smad3的表达和磷酸化以及叉头盒蛋白3 (Foxp3)的表达来增强抗炎调节性T细胞分化,而抑制il -6驱动的促炎TH17细胞的诱导[4,26].有报道VA对IL-6具有剂量依赖的拮抗作用,IL-6在全身炎症反应综合征过程中发挥重要作用[4,27].此外,在VAD的情况下,炎症反应加剧,这对于早期脓毒症患者是不利的条件[28],并且在人类和动物模型中,当它们接受RA治疗时,炎症反应均出现下调[29].此外,在之前的研究中,VA水平与c反应蛋白水平呈负相关,也证实了VAD与高炎症反应有关[30.].在本研究中,虽然没有显著差异,但我们发现VAD患者的PCT水平略高于非VAD患者(表2).
本研究的另一个发现是PLT计数与感染性休克呈负相关。在以前的研究中也有类似的观察结果[31,32,33].在这些研究中,血小板减少被认为是脓毒症患者的一个强烈的负面预后标志,并与疾病严重程度相关。有趣的是,我们发现患有VAD的脓毒症儿童的PLT水平明显低于没有VAD的儿童。有证据表明,全反式RA可通过在人血小板中表达的RA受体α调节无核人血小板中的合成事件[34].在这方面,VAD可能通过调节PLT在脓毒症中发挥另一作用。
VAD在脓毒症后期也可能起特定作用。在这种情况下,免疫系统功能障碍的状态使患者暴露在叠加感染的高风险中。VAD可损害覆盖消化道、呼吸道和尿道的上皮细胞的屏障功能,在败血症的情况下更容易受到损害,从而增加感染的风险[1].此外,已证明在人类和动物模型中,VAD可削弱重建受损粘膜完整性的能力[1].在这种情况下,病原体可以更容易地穿透粘膜屏障[35,36].此外,VAD可导致正常中性粒细胞发育紊乱[6]并损害趋化和吞噬功能,从而减少对血液中细菌的清除[37].也有证据表明VAD可降低巨噬细胞杀灭细菌和吞噬作用的能力[38].这些发现可能解释了为什么在目前的研究中,患有VAD的儿童比没有VAD的儿童白细胞计数更低。
根据目前的研究,VAD与败血症之间似乎存在广泛的相互作用。VAD与脓毒症的关系有待进一步研究。此外,维生素A补充(VAS)的介入研究在对抗脓毒症中也很有价值,因为VA可能有助于缓解高炎症期不受控制的炎症反应,并有助于恢复免疫抑制期的免疫功能。此外,世界卫生组织建议VAS作为一种有益的、具有成本效益的干预措施,以防止儿童的发病率和死亡率。据报道,VAS可将VAD儿童的死亡率降低34% [39].根据Cochrane数据库,VAS可将全因死亡风险降低24% [40].
传染病可导致营养吸收和利用受损和直接营养损失[41,42,43]以及重症监护室营养补充不足的常见情况。在这方面,VA的尿视黄醇损失可能是巨大的。疾病严重程度越高,尿视黄醇浓度越高[44,45].此外,虽然没有关于ICU患者VA状况的数据,但一项前瞻性队列研究显示,ICU患者第7天的维生素D状况明显低于入院时[46].因此,当疾病持续存在时,VAD在脓毒症患儿中的患病率可能高于当前研究显示的水平。
我们的研究有几个局限性。首先,并非所有受试者在入学前都有VA状况。目前尚不确定该结果是否代表已存在的VAD,因为感染可降低VA水平[1].其次,仅在入院后不久评估一次VA浓度。因此,PICU期间VA状态的变化基本未知。因此,血清VA状态的波动范围可能在一定程度上是VAD与脓毒症相互作用的决定因素。第三,目前的研究规模较小,且所有患者都来自一个医疗中心,这可能会导致选择偏差。
结论
总之,我们发现VAD与严重脓毒症、脓毒症休克和更高的PRISM评分相关。我们的研究表明VAD可能是脓毒症危重儿童死亡率的一个标志。这些发现提示研究人员应更加注意入住PICU的脓毒症儿童的VAD,特别是患有严重脓毒症和/或脓毒症休克的儿童。由于VAS在免疫调节中的重要作用,有可能成为脓毒症的潜在治疗手段。目前,还没有关于这个问题的数据。需要进一步的研究来评估和验证这种可能性,目的是更好地了解VA摄入量对脓毒症儿童结局的影响。
数据和材料的可用性
本研究中用于分析的数据集可根据合理要求从通讯作者处获得。
缩写
- 置信区间:
-
置信区间
- EV71病毒:
-
肠道病毒71
- 干扰素-α:
-
干扰素-α
- IgM:
-
免疫球蛋白M
- il - 6:
-
白介素- 6
- 激光焊:
-
出生体重低
- NK细胞:
-
自然杀伤细胞
- 或者:
-
优势比
- PCT:
-
原降钙素
- PICU:
-
小儿重症监护室
- PLT:
-
血小板
- 棱镜:
-
儿科死亡风险
- 类风湿性关节炎:
-
视黄酸
- Th17:
-
辅助T细胞17
- Treg:
-
调节性T细胞
- 弗吉尼亚州:
-
维他命A
- 监督:
-
缺乏维生素A
- 白细胞:
-
白细胞计数
- 人:
-
世界卫生组织
参考文献
Stephensen CB。维生素A感染和免疫功能2001; 21:167-92。
Clagett-Dame M, DeLuca HF。维生素A在哺乳动物繁殖和胚胎发育中的作用《营养学》2002;22:347-81。
维甲酸的发展:朝向整合的观点。Nat Rev Genet, 2008; 97:541-53。
穆西达D, Park Y, Kim G, Turovskaya O, Scott I, Kronenberg M,等。维甲酸介导的相互TH17和调节性T细胞分化。科学。2007;3175835:256-60。
罗斯AC,斯蒂芬森CB。维生素A和类维生素A在抗病毒反应中的作用。王志强,1996;9:979 - 85。
Twining SS,舒尔特DP,威尔逊PM,鱼BL, Moulder JE。维生素A缺乏改变大鼠中性粒细胞功能。李文杰,1997;
Amit-Romach E, Uni Z, Cheled S, Berkovich Z, Reifen R.维生素a缺乏饮食对大鼠胃肠道细菌种群和先天免疫相关基因的影响生物化学学报。2009;201:70-7。
陈松,杨颖,闫旭,陈杰,于宏,王伟。维生素A状态对手足口病患儿抗病毒免疫的影响。临床营养学杂志2012;314:543-8。
陈松,杨颖,徐娟,苏玲,王伟。全反式维甲酸对肠道病毒71型体外感染的影响。中国生物医学工程学报,2014;
王勇,孙波,岳辉,林霞,李波,杨霞,等。中国地区医院小儿败血症流行病学调查儿科重症监护医学。2014;159:814-20。
刘玲,Johnson HL, Cousens S, Perin J, Scott S, Lawn JE,等。全球、区域和国家儿童死亡原因:2010年更新的系统分析,包括自2000年以来的时间趋势。《柳叶刀》杂志。2012;3799832:2151 - 61。
Hartman ME, Linde-Zwirble WT, Angus DC, Watson RS.儿童严重脓毒症流行病学趋势*。儿科危重症护理医学。2013;147:686-93。
霍奇基斯RS,卡尔IE。脓毒症的病理生理及治疗。中华外科杂志,2003;
stens -Kurosawa DJ, Osuchowski MF, Valentine C, Kurosawa S, Remick DG。脓毒症的发病机制。《病理学年鉴》2011;6:19-48。
霍奇基斯RS, Monneret G, Payen D.免疫抑制在败血症:对疾病的新认识和新的治疗方法。《柳叶刀》传染病杂志2013;133:260-8。
基恩C,耶尔基奇M,拉菲JG。基于干细胞的败血症治疗。麻醉学。2017;1276:1017-34。
Goldstein B, Giroir B, Randolph A.国际小儿败血症共识会议:败血症的定义和儿科器官功能障碍。儿科危重症护理医学。2005;61:2-8。
谁。1995-2005年高危人群维生素A缺乏症全球流行情况:世卫组织维生素A缺乏症全球数据库。日内瓦:世界卫生组织;2009.https://apps.who.int/iris/bitstream/handle/10665/44110/9789241598019_eng.pdf?sequence=1.2019年3月25日
Watson RS, Carcillo JA, Linde-Zwirble WT, Clermont G, Lidicker J, Angus DC。美国儿童严重败血症的流行病学。美国呼吸危重症护理杂志。2003;1675:695-701。
谭志,马刚,林林,刘超,刘勇,姜杰,等。中国8 669名儿童亚临床维生素A缺乏症患病率及影响因素分析中华育方学刊。2002;363:161-3。
Sommer A, Katz J, Tarwotjo I.先前存在轻度维生素A缺乏的儿童呼吸系统疾病和腹泻的风险增加。《中国日报》,1984;
王志刚,王志刚,王志刚,王志刚,等。泰国东北部学龄前和学龄儿童轻度维生素A缺乏与呼吸道疾病和腹泻的风险美国流行病学杂志。1990;1312:332-9。
Sommer A, Tarwotjo I, Katz J.腹泻和呼吸道疾病后干眼症的风险增加。林志伟。1987;29(5):377 - 388。
Berger SG, de Pee S, Bloem MW, Halati S, Semba RD.在印度尼西亚农村地区,为儿童生存而定期分发维生素A胶囊的儿童,营养不良和发病率较高。《科学》,2007;13:1328 - 33。
Thornton KA, mora - plaza M, Marin C, Villamor E.维生素A缺乏与学龄儿童胃肠道和呼吸道疾病有关。中国营养学杂志,2014;
肖山,金华,郭涛,刘思明,吴佳佳,林波,等。维甲酸通过增强tgf -beta驱动的Smad3信号通路和抑制IL-6和IL-23受体表达,增加Foxp3+调节性T细胞,抑制Th17细胞的发育。中华免疫杂志,2008;18(2):377 - 382。
田中平,Narazaki M, Kishimoto T. IL-6阻断对细胞因子风暴的免疫治疗意义。免疫疗法。2016;88:959 - 70。
Wiedermann U, Chen XJ, Enerback L, Hanson LA, Kahu H, Dahlgren UI。缺乏维生素A会增加炎症反应。中华免疫杂志,1996;46:478 - 84。
白安,吕娜,郭艳,刘忠,陈娟,彭哲。全反式维甲酸通过改变Treg/Th17表达谱下调人溃疡性结肠炎和小鼠结肠炎的炎症反应。中华生物医学杂志。2009;864:959-69。
Corcoran TB, O'Neill议员,Webb SA, Ho KM。危重病人的炎症、维生素缺乏和器官衰竭。麻醉重症监护。2009;375:740-7。
thierry - antier N, Binquet C, Vinault S, Meziani F, Boisrame-Helms J, Quenot JP。血小板减少是感染性休克的早期预后标志吗?危重护理医学。2016;444:764-72。
Claushuis TA, van Vught LA, Scicluna BP, Wiewel MA, Klein Klouwenberg PM, Hoogendijk AJ,等。在危重脓毒症患者中,血小板减少与宿主反应失调有关。血。2016;12724:3062 - 72。
de Stoppelaar SF, van t Veer C, van der Poll t .血小板在败血症中的作用。血栓血肿。2014;1124:666-77。
Schwertz H, Rowley JW, Zimmerman GA, Weyrich AS, Rondina MT.视黄酸受体- α调节人类血小板合成事件。中华血液学杂志。2017;1512:2408-18。
Thurnham DI, Northrop-Clewes CA, McCullough FS, Das BS, Lunn PG.冈比亚和印度婴儿的先天免疫、肠道完整性和维生素A。中华传染病杂志2000;182(增刊1):S23-8。
Wiedermann U, Hanson LA, Bremell T, Kahu H, Dahlgren UI。维生素a缺乏大鼠大肠杆菌易位增加和关节炎发展。感染Immun 1995; 638:3062-8。
Ongsakul M, Sirisinha S, Lamb AJ。维生素a缺乏大鼠的血液细菌清除和吞噬活性受损。生物医学,1985;1782:204-8。
Wiedermann U, Tarkowski A, Bremell T, Hanson LA, Kahu H, Dahlgren UI。缺乏维生素A易导致金黄色葡萄球菌感染。《感染Immun》1996;641:209-14。
Sommer A, Tarwotjo I, Djunaedi E, West KP Jr, Loeden AA, Tilden R,等。补充维生素A对儿童死亡率的影响。随机对照社区试验。《柳叶刀》杂志。1986;18491:1169 - 73。
Imdad A, Mayo-Wilson E, Herzer K, Bhutta ZA。补充维生素A,预防6个月至5岁儿童的发病率和死亡率。Cochrane Database Syst Rev. 2017;3:Cd008524。
所有营养素缺乏的五种可能原因:以维生素B缺乏为例。柯林。纳特。1973;261:77-86。
引起营养不良的腹泻病。美国热带医学杂志,1992;471 Pt 2:16-27。
所罗门西北。胃肠道病原体损害人体营养状况的途径。寄生虫学。1993;107(增刊):S19-35。
Stephensen CB, Alvarez JO, Kohatsu J, Hardmeier R, Kennedy JI Jr, Gammon RB Jr.急性感染时,维生素A随尿液排出。《中华医学会杂志》1994;3:388 - 92。
Mitra AK, Alvarez JO, Guay-Woodford L, Fuchs GJ, Wahed MA, Stephensen CB。志贺氏菌病患儿尿视黄醇排泄与肾功能。李志刚,李志刚。1998;
李志强,李志强,李志强,李志强,等。危重症患者维生素d-甲状旁腺-钙轴的显著扰动与不良临床结局。重症监护医学2013;392:267-74。
确认
我们要感谢患者父母的合作和支持,感谢他们同意发表这篇手稿,也感谢护理人员采集血液样本。
资金
本项目由国家自然科学基金(81400862、81401606、81701880)、四川省科技计划重点项目(No . 2019YFS0322)、四川大学优秀青年科学基金(No . 2015SU04A15)资助。
作者信息
作者及隶属关系
贡献
SYC, YJ, XPZ和XLL设计了这项研究。SYC、XPZ、LWC和LPD管理数据及其质量。YJ、XPZ、KYY进行统计分析。所有作者均参与了数据解释。XPZ起草了手稿。YSC和YJ对修订作出了重大贡献。所有作者都仔细阅读了手稿,并批准了最终版本。
相应的作者
道德声明
伦理批准并同意参与
本研究的伦理批准由四川大学华西医院伦理委员会提供。研究儿童的所有父母或其代理人都获得了书面知情同意。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
张旭,杨凯,陈磊,张晓明。et al。患有败血症的危重儿童缺乏维生素A。暴击治疗23, 267(2019)。https://doi.org/10.1186/s13054-019-2548-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13054-019-2548-9
关键字
- 脓毒症
- 儿科
- 维他命A
- 缺乏维生素A