摘要
细胞外囊泡是细胞通讯的重要媒介。它们封装了各种分子货物,如蛋白质、脂质和核酸,包括mirna、lncrna、环状rna和信使rna,并通过这些分子信号的转移可以改变受体细胞的代谢表型。新研究表明,细胞外囊泡信号在心血管疾病和相关危险因素(如2型糖尿病和肥胖)的发生和进展中起着重要作用。妊娠糖尿病(GDM)是在妊娠期间发生的高血糖症,增加了母亲和婴儿未来发生肥胖、糖代谢受损和心血管疾病的风险。现有的证据表明,母体代谢的变化和暴露于高血糖的宫内环境可以重新编程胎儿基因组,留下代谢印记,定义终身健康和疾病易感性。了解导致GDM母亲所生儿童更易患代谢障碍的因素对于实施GDM预防策略至关重要。在这篇综述中,我们讨论了目前有关GDM中心血管疾病的胎儿编程和心血管疾病表观遗传编程中细胞外囊泡(EV)信号的影响的文献,以确定GDM中EV信号与婴儿心血管疾病发展之间的潜在联系。
简介
心血管疾病(CVD)是全世界发病率和死亡率的主要原因[1].易患心血管疾病的危险因素包括高血压和多种代谢紊乱,如肥胖、血脂异常和胰岛素抵抗(包括2型糖尿病)。2型糖尿病发病率的惊人增长现在使年轻人容易更早发生代谢并发症,并增加疾病负担[2].
心血管疾病被认为是成人生活方式选择(即,可改变的风险因素)和遗传倾向(即,不可改变的风险因素)的结果。然而,改变生活方式以减少风险因素的尝试并没有降低心血管疾病的高发病率。3.,4,5].此外,与糖尿病和肥胖相关的基因多态性无法解释儿童肥胖和2型糖尿病的增加,这两者都是心血管疾病的危险因素[6].相比之下,有大量证据支持产前和产后暴露于环境风险因素与决定终生疾病易感性有关[7,8,9,10,11].例如,妊娠合并妊娠期糖尿病(GDM)的新生儿在成年后患2型糖尿病和心血管疾病的风险增加[12].尽管GDM发病率高,且与妊娠并发症有关,但GDM的潜在病理生理学及其对胎儿代谢的影响尚不清楚。目前的数据表明,胎儿对母体营养过剩有反应,GDM影响胎盘和胎儿的细胞、分子和表观遗传途径,使后代易患随后的代谢性疾病[13,14,15].因此,糖尿病妊娠的影响可以被认为是一种代际恶性循环,其对后代的影响远远超出了新生儿期[16].
最近的研究发现了新的细胞外泡(EV)信号通路,包括外泌体信号,介导母胎通信。ev是细胞释放的囊泡,含有蛋白质和miRNAs等生物活性分子,一旦释放,就能够调节细胞近端和远端功能[17].国际细胞外囊泡学会(ISEV)认可“细胞外囊泡”(EV)作为从细胞中自然释放、由脂质双分子层分隔、无核且不能复制的颗粒的通用名称。然而,有不同的ev亚型,如核内体起源的ev被称为“外泌体”,从质膜中萌发的ev被称为“外泌体或微泡或微粒”,死亡或凋亡细胞释放的ev被称为“凋亡小体”。这些EV亚型具有重叠的物理和生化特征,因此很难根据EV的物理和生化特征将其分配到特定的生物发生途径[18].因此,在这篇综述中,我们将使用术语小型电动汽车(sev),当它们小于200纳米时,中型或大型电动汽车(m/l EVs),当大于200纳米时。
妊娠期间,已在母体和胎儿房室中发现ev,并记录了其浓度、含量和生物活性的妊娠变化[19].现在已经证实,EV信号在细胞间通信和调节细胞功能中是一个重要的通路[20.].最重要的是,EV信号在代谢障碍的病理生理学中发挥着关键作用,是代谢器官间分子串扰的关键介质[21,22,23,24,25].现有数据表明EV信号在妊娠期母体代谢变化和GDM发展中的不可避免的影响[26,27,28,29,30.,31有趣的是,母体在妊娠期间代谢的变化调节了胎儿生命期间的表观遗传规划,留下了决定终生健康和疾病易感性的代谢印记[32,33,34,35,36].这篇综述的重点是讨论gdm诱导的EV信号变化可能导致出生后代谢综合征和CVD的作用。
GDM与儿童心血管疾病的临床关系
心血管疾病是全世界死亡率和发病率的主要原因[1,其影响在糖尿病患者中显著加重[37].尽管在一些国家,心血管疾病的发病率和死亡率有所下降,但在过去十年中,儿童和青年中的心血管疾病患病率却有所上升[3.,4].成年糖尿病患者发生心血管疾病的风险高于非糖尿病患者,且心血管疾病的风险随着空腹血糖浓度的增加而增加,甚至在达到诊断阈值浓度之前[38].国际糖尿病联合会(IDF)估计,世界上有4.25亿糖尿病患者,预计到2040年这一数字将达到6.42亿。值得注意的是,91%的病例为2型糖尿病[39].2型糖尿病发病率的增加与遗传、环境和代谢风险因素的相互作用有关。与此建议一致的是,孕妇在怀孕前和怀孕期间的条件调节,包括GDM的发生[40],易患随后的产妇2型糖尿病和心血管疾病[41,42对后代的糖尿病和心血管疾病也有影响[43,44,45,46].更好地理解这种联系对于降低儿童和年轻人患心血管疾病的风险至关重要。
妊娠期糖尿病是妊娠最常见的并发症之一,被定义为在妊娠期开始或首次诊断为葡萄糖不耐受[47,48].GDM的全球患病率估计在1 - 14%之间,取决于诊断标准,而研究人群[49].最近的研究发现,GDM患病率的增加与城市化的增加、体育活动的减少、怀孕期间体重的过度增加以及暴露于致肥环境有关[50,51,52].
脂类和碳水化合物代谢的改变是GDM女性的常见症状。几项研究报告称,在子宫内暴露于GDM的儿童存在较高的心脏代谢风险,认为它是葡萄糖不耐受和心血管疾病的独立风险因素[53,54].产前暴露于母体糖尿病与后代的先天性心脏病、肥胖和糖尿病有关[55,56].因此,在胎儿发育的关键时期暴露于改变的代谢状态可能会产生长期影响,产生代谢记忆,增加成年时心血管疾病的风险[43,57,58,59,60].
与GDM易使后代罹患CVD的假设相一致的是,GDM母亲所生的孩子中CVD风险的生物标志物(包括血脂、肥胖或超重、血压变化和胰岛素抵抗)很明显[12,42,44,61,62,63,64].此外,妊娠并发GDM的儿童(3岁及以上)会增加收缩压和舒张压[12,53]、血浆高密度脂蛋白(HDL)浓度低、高甘油三酯血症[65],葡萄糖不耐受[63],或胰岛素抵抗[53,63,66,以及肥胖的增加[12,63,67,68].
妊娠并发GDM的青春期子代,血压、血脂异常[69]和葡萄糖耐量[70,71],高胆固醇浓度(女性)和收缩压升高(男性),以及2型糖尿病或糖尿病前期的倾向[72已被报道过。GDM母亲所生的后代患代谢综合征的风险较高,可归因于GDM导致的胎儿肥胖或出生体重增加[73].由于肥胖是直接导致血脂异常、2型糖尿病、高血压和心血管疾病的主要危险因素[74],出生体重增加和肥胖可能是儿童和成年早期代谢障碍发展的促成因素。与出生体重无关,宫内高胰岛素血症与代谢综合征发病率增加17倍和超重增加10倍有关[62].母亲患有GDM的4至5岁儿童中可观察到超重,并与出生体重增加、母亲肥胖有关[75],和/或童年生活方式的改变[76].出生体重高的儿童如果处于糖尿病或母体肥胖的宫内环境中,发生代谢综合征的风险会增加[56,77].
此外,妊娠合并GDM和母亲肥胖会增加后代患代谢综合征的风险,包括心血管疾病[69,76,78,79,80].孕产妇pre-gestational [66,81,82]和妊娠体重是体重指数(BMI)和体脂总百分比的强预测因子[67雌性而非雄性后代[42].产前暴露于GDM并伴有母体肥胖或超重是后代高BMI的高危因素[79,83].然而,对于后代超重和肥胖的发展,母亲肥胖的风险高于GDM [76,80].此外,在一项更大的研究中,在40年的时间里对243.2万名儿童进行了研究,GDM妊娠的后代早发CVD的几率增加了29% [78与产妇肥胖等共病相关的发病率进一步增加[78].表格1总结了妊娠期糖尿病在后代中的临床后果及其对CVD发展的影响。
母体高血糖导致胎盘向胎儿转移葡萄糖和氨基酸增加,导致胎儿高胰岛素血症。这种胎儿胰岛素血症可导致胎儿过度生长、肥胖和低血糖等短期后果[84].这也会引起胎儿心血管功能的改变,其特征是内皮功能障碍标志物(e -选择素和VCAM1)和瘦素浓度升高[44,主动脉内膜-中膜厚度增加,动脉硬化[85].现有数据支持这一假设,即宫内暴露于高胰岛素血症和高血糖会对后代的基因表达和已知的CVD风险因素产生持久影响[85].因此,在生命早期暴露于不利的代谢环境中,会留下决定个人长期健康的印记[86].令人信服的数据表明,表观遗传机制调节了这些影响,并将其随后传递给后代[87,88].
心血管疾病发展的胎儿规划
直到最近,人们普遍认为,慢性代谢性疾病的发生是遗传基因和终生接触次优生活方式因素(例如,缺乏活动、饮食)的结果。然而,这些因素只能解释10%的慢性非传染性疾病的起源[89].同样,与糖尿病和肥胖相关的基因多态性也不能解释儿童肥胖和2型糖尿病的显著增加,这是心血管疾病的危险因素[6].此外,与母体发病前出生的兄弟姐妹相比,母体发病后出生的儿童患肥胖症和2型糖尿病的风险可能更高[90].这一观察结果具有重要意义,因为它确定了母亲的糖尿病是后代肥胖和2型糖尿病的独立促成因素。此外,它符合《健康和疾病的发展起源》的宗旨[43以及表观遗传学在胎儿适应母体代谢状态中的作用[91].
表观遗传调控被定义为对环境刺激的反应中基因表达的可遗传变化,但不包括核苷酸序列的变化[92,93,94].表观遗传修饰包括:CpG岛上的DNA甲基化[95,96]、组蛋白翻译后修饰和非编码RNA(如miRNA)的表达调控[97,98].表观遗传模式的改变可导致基因表达受损,而基因表达受损本身可产生许多下游影响,包括疾病风险的改变、应激反应和细胞代谢的改变[99,One hundred.,101].
如上所述,GDM使后代易患慢性疾病。这可能发生的一种机制是胎儿代谢重编程,包括表观遗传变化[102].与血糖正常妊娠的婴儿相比,GDM妊娠婴儿的脐带血和/或胎盘中发现了不同的DNA甲基化谱[15,34,36,103,104,105].差异甲基化基因包括与心血管疾病、代谢性疾病特别是2型糖尿病以及免疫和内分泌疾病相关的基因[51,103].
例如,瘦素,一种与能量平衡和食欲有关的脂肪因子,在妊娠合并GDM的胎盘组织中被差异甲基化[106,并依赖于葡萄糖浓度[107].胎盘组织中瘦素甲基化与瘦素mRNA丰度降低有关[108]并降低孕妇血清和脐带血中的瘦素浓度。ogtt后2小时瘦素浓度与葡萄糖浓度呈负相关。这些数据强调了子宫内效应通路,GDM可能诱导长期表观遗传修饰代谢,增加晚年肥胖的可能性。类似地,gdm响应通路已被报道用于其他代谢通路基因,包括MEST(人类中胚层特异性转录本,一种涉及胎儿和胎盘生长的基因)和ABCA1 (atp结合盒家族成员)。
MEST是一种与胎盘发育有关的印迹基因。在妊娠前三个月,中胚层特异性转录物同源蛋白MEST的翻译产物在绒毛外滋养细胞中高度表达[109].MEST甲基化异常与胎盘失调和妊娠并发症相关[109].与血糖正常妊娠的胎盘组织和脐带血相比,GDM妊娠的胎盘组织和脐带血中MEST的甲基化明显降低[32].MEST甲基化降低也是肥胖成人的特征。在小鼠中,MEST差异甲基化结构域的丢失与胎盘内三酰甘油的积累和线粒体功能异常密切相关[110].为了支持MEST在脂质代谢中的作用,转基因小鼠中过表达MEST会增加脂肪细胞的大小[111],而全球降低MEST则可减少肥胖[112].在GDM的背景下,MEST甲基化的降低可能改变胎盘功能和脂质代谢,对后代表观基因组产生长期影响,并导致终生肥胖倾向[32,113].
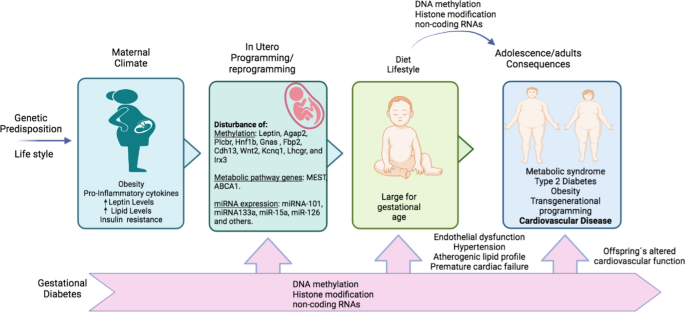
ABCA1转运体基因中的DNA甲基化先前已被证实与心血管疾病有关。ABCA1是将胆固醇从细胞转移到载脂蛋白a -1 (apo-A1)的转运体,它有助于新生HDL的形成[114].在Houde及其合作者的一项研究中,评估了GDM孕妇胎盘和脐带血中母体代谢谱与ABCA1转运体基因甲基化水平之间的关系[35].结果表明,母体一侧胎盘ABCA1基因的甲基化水平与诊断OGTT 2小时观察到的母体高密度脂蛋白胆固醇水平和葡萄糖水平相关。在胎儿一侧的胎盘中,ABCA1基因的甲基化水平与脐带血中的甘油三酯水平相关。胎盘两侧DNA甲基化的变异性也与ABCA1 mRNA水平相关。相比之下,脐带血ABCA1基因甲基化水平与OGTT后2 h产妇血糖水平呈负相关[35].这些结果表明,对子宫环境的表观遗传适应可能有助于触发对血脂异常的长期易感性和发展CVD(图。1).
在动物模型中,GDM母亲后代的胰腺显示出与糖脂代谢相关的信号通路相关的几个基因的DNA甲基化模式发生变化,如Agap2、Plcbr、Hnf1b、Gnas、Fbp2、Cdh13、Wnt2、Kcnq1、Lhcgr和Irx3 [115].这表明,胰腺基因组中DNA甲基化谱的变化与代谢改变有关,并增加了成年后罹患2型糖尿病、肥胖和心血管风险的易感性[115].
DNA甲基化并不是GDM中唯一的表观遗传机制。最近,miRNAs也被研究为GDM表观遗传修饰的可能中介。在GDM期间,母体高血糖有利于葡萄糖通过胎儿胎盘循环从母体转移到胎儿,诱导胎儿微循环和宏观循环内皮功能障碍,这与增加发展为2型糖尿病和CVD的易感性有关[116].暴露于高糖水平已被提出可诱导对内皮功能产生负面影响的表观遗传变化。从GDM孕妇获得的人脐静脉内皮细胞(HUVEC)细胞上进行的试验表明,高糖和GDM都通过增加miRNA-101的表达和减少组蛋白甲基转移酶增强子zester同源物-2 (EZH2-ß)的表达介导内皮功能障碍,从而减少组蛋白3中lysine 27的三甲基化[117].这些结果还表明,抑制miRNA-101可以重建细胞功能,增加EZH2-ß的表达,并有利于细胞存活。因此,miRNA-101/EZH2 ß比值的改变可能与GDM中观察到的内皮功能障碍有关。
此外,已确定心肌发生的一个关键事件发生在怀孕期间,在此期间,胎儿接触代谢性疾病可能会显著改变出生后肌肉的发育和代谢[118,119].miRNA133a已被证明参与肌肉分化和调节肌肉细胞的线粒体功能。miRNA133a表达的改变与严重肌病和线粒体功能障碍有关[120].此外,在胎儿发育过程中暴露于GDM的小鼠模型显示肌肉脂肪毒性,这可以通过双酰基甘油积累、胰岛素抵抗、miR-133a表达降低和Nix表达升高来证明[121,是一种已知的细胞自噬和程序性细胞死亡的中介因子[122].
miR-15家族成员可以改变胰岛素信号通路中不同蛋白质的表达或功能,从而影响胰岛素的敏感性和分泌。巧合的是,在26 - 35岁的人群中,其母亲之前被诊断为GDM的骨骼肌活检显示miR-15a和miR-15b在骨骼肌中表达增加。此外,miR-15a表达与空腹血糖、2小时血糖和HbA1c水平呈正相关,这可能有助于代谢性疾病的发展和心血管高风险[123].
miRNAs参与了关键代谢和炎症途径的表观遗传调控,它们的表达在面对应激情况或代谢适应时被修改[124].大多数细胞选择性地分泌mirna。此外,分泌到血液中的mirna的变化与几种病理有关,它们被认为是健康或疾病状态的潜在生物标志物[125,126].在许多出版物中,已经观察到在糖尿病前期和糖尿病患者中循环miRNA图谱的变化,如miR-192和miR-193b水平的升高,miR-126和miRNA15a水平的下降等[127,128,129].
最近的一项meta分析发现,包括miR-21、miR-29a、miR-34a、miR-103、miR-107、miR-126、miR-132、miR-142-3p、miR-144和miR-375在内的40种循环miRNAs在2型糖尿病中显著失调[130].另一项研究表明miRNA水平下降;miR-20b、miR-21、miR-24、miR-15a、miR-126、miR-191、miR-197、miR-223、miR-320和miR-486在2型糖尿病中的表达,以及miR-28-3p的适度升高[131].
这些结果强烈表明,miRNAs作为2I型糖尿病治疗干预的诊断和后续生物标志物的潜在效用[132,133].由于单个miRNA可以靶向多个基因,而且多个miRNA具有共同的靶点,因此miRNA特别适合于分析代谢途径和过程。在循环中,可以发现mirna与蛋白质复合物结合[134),高密度脂蛋白(135]或在电动汽车内[136].含有mirna的ev已被证明参与肿瘤进展和化疗耐药[137,以及动脉粥样硬化的发展[138]和糖尿病[139],以及其他病理[140,141].
心血管疾病表观遗传规划中的细胞外泡泡信号
糖尿病的发生与胰岛素敏感组织的改变有关。这会导致葡萄糖不耐受或前驱糖尿病状态,当胰腺β细胞无法应对胰岛素需求增加时,最终产生显性糖尿病[142].不同组织之间的通讯对于维持葡萄糖稳态至关重要[143].细胞可通过分泌ev与邻近细胞或远处细胞进行通信[144].如前所述,“EVs”一词描述的是一类小的膜包围的囊泡(30-2000纳米),其中包含多种信使生物分子,如脂质、蛋白质和核酸,它们是细胞起源的代谢和功能状态的代表。大多数细胞类型会释放这些囊泡,这些囊泡能够跨越生物屏障,因此可以在各种液体中找到,包括血液、尿液、唾液、母乳和脑脊液等[145].细胞可以分泌不同类型的ev,根据其亚细胞来源和大小进行分类[146].最小的ev被称为外泌体(50 - 150nm),它产生于核内体或多泡体(MVB)内,并在这些腔室与质膜融合时分泌。其他的ev要大得多,如微泡(200 - 1000nm)和凋亡小体(超过1000nm),两者都是由质膜发芽形成的[147].ev表达自己的表面分子,这使它们能够靶向特定的受体细胞。ev一旦与靶细胞结合,可通过受体-配体相互作用诱导信号,或可通过内吞作用和/或吞噬作用内化,或可与靶细胞的膜融合传递其内容物,从而改变受体细胞的生理状态[148].
ev可以转移蛋白质和核酸(小而长的非编码RNA),在受体细胞中介导表观遗传编程,包括DNA甲基化、组蛋白修饰和RNA的转录后调节[149,150].DNA甲基化是指在DNA胞嘧啶残基上添加甲基,将其转化为5-甲基胞嘧啶,这是由DNA甲基转移酶(DNMT)介导的。DNA甲基化导致长期稳定的基因沉默,去甲基化导致基因转录上调。ev可转移介导靶细胞DNA甲基化的分子因子[151].例如,白血病细胞衍生的EVs含有断点簇区域- abelson白血病基因人类同源物1 (BCR-ABL1) mRNA,当它转移到正常细胞时,会上调甲基转移酶和全局DNA高甲基化,导致恶性转化[149].来自内皮细胞的sev传递靶向受体细胞中DNA甲基转移酶1 (DNMT1)的miRNAs (miR-21-5p和miR-217),并抑制与细胞增殖相关的基因,使受体细胞衰老表型[150].衰老信号的转移在年龄相关心血管疾病和糖尿病的发展中起着关键作用。
组蛋白的转录后修饰,特别是乙酰化和甲基化可以调节基因转录[151].ev可能参与了介导这些组蛋白修饰和调节染色质重塑的因子的转移。例如,在缺血性心脏病中,sev介导的热休克因子1 (HSF1)转移与miR-34的启动子区域相互作用,并改变组蛋白3的甲基化谱。这通过HSF1/miR-34a/热休克蛋白(HSP)70通路下调miR-34表达并挽救心肌细胞凋亡[152].同时,脑肿瘤细胞分泌的ev携带Histone H1连接子,可与DNA结合,调节DNA甲基化和组蛋白修饰,介导肿瘤发生[153].
长链非编码rna (lncRNA)由约200个核苷酸组成,可调节核结构,从而改变基因转录[154].在动脉粥样硬化和心肌梗死等心血管疾病中,sev介导的lncRNA转移及其对靶细胞基因表达的功能影响已被报道。鉴于脂质诱导的炎症是CVD的特征性特征,暴露于LDL的细胞分泌含有lncRNA生长抑制特异性(GAS)5的sev,并调节靶细胞(巨噬细胞和内皮细胞)的凋亡,并促进动脉粥样硬化的病理[155].此外,含有来自内皮细胞的lncRNA转移相关肺腺癌转录本1 (MALAT1)的sev激活树突状细胞中的核因子红系2相关因子(NRF2)信号,加速其成熟并发展到动脉粥样硬化状态[156].此外,含有内皮细胞sev的MALAT1激活M2巨噬细胞极化[157中性粒细胞细胞外陷阱的形成,并有助于动脉粥样硬化的病理[158].在心肌梗死中,含有来自心肌细胞的sev的MALAT1减弱靶细胞中miR-92a的表达,并有助于新生血管的形成[159].此外,sEV介导的lncRNA H19转移可调节miR-675的表达并激活促血管生成因子,从而在心肌梗死中产生心脏保护作用[160].另一方面,来自缺氧心肌细胞的sev在ncRNA AK139128中富集,刺激细胞凋亡并加剧大鼠心肌梗死模型[161].
lncrna与胰岛素抵抗状态(如糖尿病)的病理生理学有关。例如,通过sEVs传递lncRNA-p3134可以通过促进β细胞中Pdx-1、MafA、GLUT2和Tcf712等关键调控因子,正向调节葡萄糖刺激的胰岛素分泌。据报道,与血糖正常的受试者相比,2型糖尿病患者血清ev中lncRNA的浓缩[162].这可能是在胰岛素抵抗状态下增加β细胞功能的一种代偿机制。糖尿病并发症中lncRNA sEV转移的保护机制也有报道[163].在糖尿病视网膜病变中,间充质干细胞衍生的EVs将lncRNA SNHG7转移到视网膜微血管内皮细胞,从而负调控miR-3aa-5p/X-box结合蛋白(XBP)1轴。通过靶向miR-3aa-5p/XBP1轴,sEV lncRNA SNHG7抑制高糖诱导的内皮间质转变和管的形成,并损害糖尿病视网膜病变的发病机制[163].此外,从间充质干细胞到成纤维细胞的lncRNA H19的sEV转移靶向miR-152-3p/PTEN通路。这负向调节miR-152-3p的表达,进而上调PTEN的表达,导致增殖和迁移增加,减少凋亡,进而促进糖尿病伤口愈合[164].如前所述,衰老是CVD的一个危险因素,有报道称间充质干细胞来源的sev通过lncRNA MALAT1的转移来预防衰老引起的心血管功能障碍。sEV介导的MALAT1转移抑制NF-kB/肿瘤坏死因子(TNF)-α信号通路,并损害衰老过程[165].此外,在2型糖尿病患者中,循环中的sEV MALAT1水平显著降低[166].
在基因转录和蛋白质翻译中具有调节作用的另一个非编码rna子集是环状rna,它是共价闭合rna,可以充当miRNA海绵。新的证据表明,sEV相关的环状RNA在CVD和相关代谢障碍中的作用。血清sev中的环状RNA circRNA - 0006896与颈动脉斑块不稳定有关,这是缺血性心脏病的一个关键事件。内皮细胞中sEV相关的circRNA - 0006896的转移导致miR-1264表达降低,DNMT1水平升高,导致内皮细胞增殖和迁移以及颈动脉斑块不稳定[167].高糖刺激的内皮细胞分泌含有环状RNA circRNA-0077930的sev,当传递给血管平滑肌细胞时,会导致血管衰老[168].sEV环状RNA circ_DLGAP4促进糖尿病肾病的细胞增殖和纤维化,并通过海绵miR-143和靶向ERBB3/NF-kB/基质金属蛋白酶(MMP)-2轴加重糖尿病并发症[169].
另一方面,长度为19-24个核苷酸的miRNAs可以通过rna诱导的基因沉默在转录后水平上调节基因表达,这可以被认为是表观遗传学更广泛定义下的表观遗传学机制[170].ev在miRNAs转移中的作用已被证实[171,172], EV-miRNAs在CVD的发展和病理生理学中发挥着关键作用,包括促进与CVD相关的风险因素的发展,如糖尿病和肥胖。糖尿病性心脏病以心脏微血管内皮细胞损伤和心肌细胞功能障碍为特征。在糖尿病初期,高血糖可导致内皮功能障碍,进而导致严重的血管并发症[173].有报道称,尽管血糖控制良好,但由于诱导的基因表达变化,血管损伤持续存在,这种现象被称为代谢记忆,影响不同的细胞类型[174].目前,一系列研究表明含有EVs的miRNA可以调节基因表达,调节内皮功能、炎症和细胞衰老等心血管功能的关键现象[175].miR-126是2型糖尿病中研究最广泛的miRNA,据报道与血管功能的维持有关[176和内皮功能[131].高糖水平已被证明可降低内皮细胞凋亡小体中的miR-126水平。同样,糖尿病患者循环囊泡中miR-126的含量降低[131].这一发现至关重要,因为miR-126已被证明在血管内皮修复中发挥重要作用[177].一份使用细胞内皮模型的报告显示,高血糖通过影响miRNA-126-3p的含量和内皮微粒的功能,削弱了潜在的细胞间通信保护机制[177].与健康对照组相比,从Goto-Kakizaki (GK)糖尿病大鼠心肌细胞中分离出的ev含有更高水平的miR-320和较低水平的miR-126 [178].特别是,含有miRNA-320的ev导致迁移和增殖能力下降,以及邻近心脏内皮细胞的血管生成减少。这些事件可能是通过这些ev与受体细胞靶基因(如IGF-1、Hsp20和Ets2)的负向相互作用而发生的,这些基因破坏了这些细胞的血管生成功能[178].糖尿病小鼠过表达Hsp20可显著减弱心功能障碍和心血管肥厚[179].有趣的是,从过表达Hsp20的小鼠中获得的心肌细胞源性sev具有高水平的p-Akt、Hsp20、survivin和超氧化物歧化酶(SOD)1,并在体外对高血糖引发的细胞死亡具有保护作用[179].
García及其合作者证明,在葡萄糖饥饿条件下,H9C2心肌细胞增加sEV分泌,其miRNA和蛋白质含量依赖于葡萄糖浓度[180].在饥饿条件下,ev富含葡萄糖转运蛋白和参与葡萄糖代谢的酶,这导致心脏内皮细胞葡萄糖摄取和糖酵解的速度加快[180].此外,另一篇报道描述了来自心肌细胞的sev改变内皮细胞的功能,并刺激血管生成,而血管生成依赖于葡萄糖浓度[181].
此外,高糖水平导致哺乳动物无菌20样激酶1 (Mst1)激酶在糖尿病心脏内皮细胞和心肌细胞sev中的表达增加。此外,由于Mst1作为自噬和凋亡的调节因子,其表达的增加与糖尿病心脏病有关[182].有趣的是,暴露于从糖尿病心脏内皮细胞获得的sev的心肌细胞显示葡萄糖摄取减少,因为Mst1中断了GLUT4到膜的易位,从而影响心肌细胞代谢[182].此外,一些报道显示Mst1通过抑制sirtuin 3 (Sirt3)的表达促进糖尿病心肌病的发展[183],在线粒体内稳态中发挥关键作用,并对糖尿病性心肌病的发生和发展具有保护作用[184].另一方面,肥胖往往与代谢疾病和心血管风险有关。在动物模型中,与来自瘦动物的血浆sev的miRNA谱相比,肥胖已被证明会增加miR-122、miR-192、miR-27a-3p和miR-27b-3p的水平。有趣的是,用从肥胖小鼠中分离出的sev治疗瘦弱小鼠可诱导葡萄糖不耐受和胰岛素抵抗。此外,转染肥胖相关miRNA模拟物的对照sev在瘦弱小鼠中强烈诱导葡萄糖不耐受,并产生中心性肥胖和肝脏脂肪变性[185],从而导致心血管损伤。表格2综述了心血管疾病中EV信号的主要功能研究,以及相关的危险因素。
ev在GDM表观遗传规划中的潜在作用
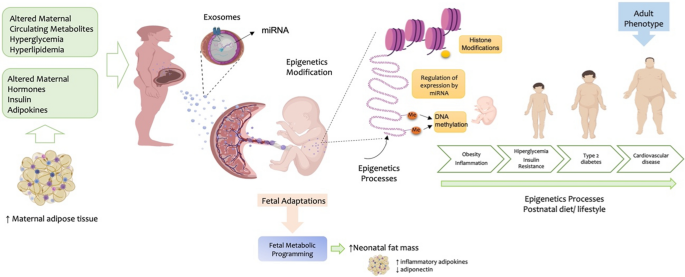
母体葡萄糖是维持胎儿生长发育的主要营养物质。GDM或未确诊的2/ 1型糖尿病中,由于胰岛素抵抗过度和胰岛素分泌不足导致母亲高血糖,导致胎盘向胎儿的葡萄糖转移增加。胎儿胰腺长时间暴露于高水平葡萄糖会导致高胰岛素血症,其特征是脂肪生成和脂肪储存增加,且呈性别依赖性[186].GDM对后代造成的短期后果,如巨大儿和新生儿低血糖,都是母体向胎儿循环中葡萄糖供应过剩的结果。此外,在子宫内暴露于GDM代谢环境的改变可能导致长期的后代后果,如胰岛素抵抗增加、肥胖和心血管风险[60,61,71,72,187,188,189],通过影响胎儿发育过程中的表观遗传规划。
Barker等人首次观察到宫内环境对胎儿患慢性疾病风险的影响。[190].该研究报告称,胎龄小但胎盘大的婴儿在胎儿期有循环适应,这使他们在成年后患CVD的风险很高[43,190].此外,人类群体研究表明,母亲的营养状况可以规划胎儿的胰腺β细胞功能,并降低成年后发生代谢紊乱的风险[191,192].表观遗传失调是新生儿子宫环境暴露与成年后健康之间的显著联系。例如,在第二次世界大战期间产前暴露于荷兰饥荒的个体中,60年后发现,与未暴露于母体营养不良的同性别同胞相比,他们有明显的表观遗传变化,其形式是胰岛素样生长因子(IGF)2基因的DNA甲基化降低[193].此外,在动物模型中研究了在妊娠期间操纵母亲的饮食,并分析了胎儿的表观遗传修饰,为代谢性疾病的发育起源提供了见解[7,194,195].例如,怀孕小鼠饮食中甲基补充剂的改变改变了胎儿的DNA甲基化,并导致相关的表型变化[7,194],表明母亲的营养状况影响胎儿的长期健康。有许多研究报告胎盘和脐带血的表观遗传变化[15,35,36,108,196,197,198与GDM相关。然而,GDM对后代代谢组织(如肝脏、胰腺、脂肪组织和骨骼肌)表观遗传格局的影响尚不清楚,因为这不太可能是可行的,除非在临床需要获得活检的患者中。总的来说,这表明与GDM相关的胎盘营养转运和宫内条件的改变会影响后代的表观基因组,以及在以后的生活中对疾病的易感性。
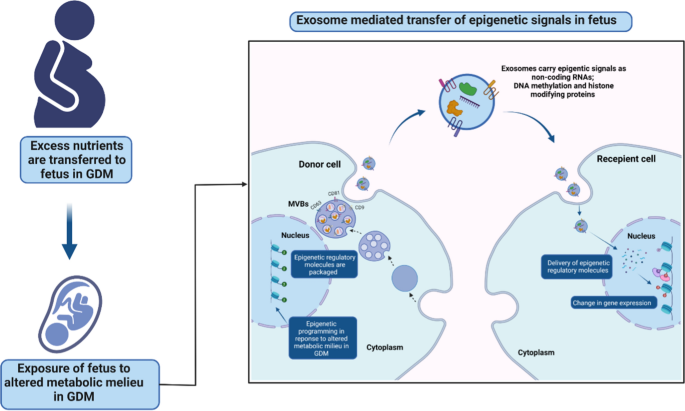
ev领域正在迅速发展,人们不断探索这些纳米囊泡在各种生物过程中的新作用[144].ev携带大量生物分子,如蛋白质、核酸和脂类,介导受体细胞中基因表达和表型反应的改变[144,146].ev可以通过转移非编码rna(包括mirna和长链非编码rna)成为表观遗传信号的关键介质,可修饰参与DNA甲基化和组蛋白修饰的蛋白质[157,158,161,163,164,165,167,168,169,199].据报道,ev参与介导健康妊娠和GDM复杂化的代谢适应的关键生物过程[17,26,28,29,30.,31].妊娠期研究最多的ev是来自母体不同组织的总循环ev [19,26,27,30.].此外,来自胎盘的ev在母体和胎儿系统之间形成了一个关键的链接,因此研究它们参与生理和病理过程[19,28,29].然而,由于无法获得胎儿ev,缺乏对胎儿起源ev的研究,因此对其对靶组织的作用认识存在差距。由于ev可以作为表观遗传信号的介质,来自胎儿组织的ev可以潜在地在胎儿器官之间传播代谢信号,并介导GDM中对宫内代谢暴露改变的响应表观遗传编程。
另一个关键问题是,母体ev是否能够跨越胎盘屏障,将表观遗传信号传递给胎儿细胞。尽管,有报道称脐带血中存在胎盘ev [19],来自母体一侧胎盘的ev通过胎盘屏障到达胎儿血液的机制尚不清楚。未来在体外环境和动物模型的研究应该调查表观遗传修饰物的转移是否以及如何影响未来疾病的易感性,包括GDM母亲所生的后代对CVD的易感性。数字2显示ev介导的表观遗传信号转移可能导致暴露于GDM的胎儿受体细胞的表观遗传重编程。
结论与未来方向
代谢障碍的发展取决于遗传和表观遗传因素。遗传因素是那些引起个体DNA序列变化的因素,而表观遗传因素涉及DNA序列变化以外的因素的遗传控制。外部环境对基因和疾病发展的影响涉及基因组对外部线索的反应的表观遗传规划。在怀孕期间,由于肥胖、2型糖尿病和GDM等代谢障碍的存在而导致的母亲代谢的变化可能对母亲和后代产生重要的长期影响。现有的流行病学数据表明,母体宫内血糖环境可以表观遗传学上重新规划胎儿未来代谢疾病的发展,包括心血管疾病风险的增加。越来越多的证据表明母体和胎儿起源的ev是GDM发展的关键参与者,以及与GDM相关的母体和胎儿病理。GDM描述了总循环ev和胎盘ev的浓度、载重和生物活性的变化。然而,没有明确的证据表明EV信号直接参与了代谢性疾病的胎儿编程。
一般来说,ev被报道是代谢障碍病理的关键角色。据报道,ev介导的细胞间分子转移在介导与CVD的发展和进展相关的代谢、炎症和血管事件中起着关键作用。最重要的是,新出现的研究表明,外部环境的变化导致ev的分子负载的变化,而改变的分子负载,当转移到受体细胞时,可以表观遗传编程这些细胞具有改变的代谢表型。细胞间表观遗传信号通过ev的转移已在心血管疾病和相关风险因素如2型糖尿病和肥胖中得到证实。因此,了解妊娠期间EV信号通路对胎儿代谢疾病发展的影响,如CVD,是未来研究的肥沃领域。对于阻止或减缓CVD和相关病理的发展和进展的干预措施的开发,有关促成胎儿编程的因素的知识是必不可少的。3.).
数据和材料的可用性
不适用。
参考文献
麦克莱伦M,布朗N,卡利夫RM,华纳JJ。行动呼吁:心血管疾病的紧迫挑战:来自美国心脏协会的总统咨询。循环。2019;139 (9):e44-54。
奥玛扎巴尔V,奈尔S,埃尔菲基O,阿瓜约C,所罗门C,祖尼加FA。胰岛素抵抗与心血管疾病发展之间的关系Cardiovasc Diabetol。2018;17(1):122。
George MG, Tong X, Kuklina EV, Labarthe DR. 1995-2008年儿童和青壮年中风住院和相关危险因素的趋势安神经。2011;70(5):713 - 21所示。
George MG, Tong X, Bowman BA。青年人中心血管危险因素和中风的患病率。JAMA神经。2017;74(6):695 - 703。
anderson C, Vasan RS.青年人心血管疾病的流行病学。2018;15(4): 230-40。
Manolio TA, Collins FS, Cox NJ, Goldstein DB, Hindorff LA, Hunter DJ, McCarthy MI, Ramos EM, Cardon LR, Chakravarti A,等。寻找复杂疾病缺失的遗传力。大自然。2009;461(7265):747 - 53年。
母体表观遗传学和甲基补充影响Avy/a小鼠刺豚鼠基因表达。美国实验生物学学会联合会j . 1998; 12(11): 949 - 57。
Waterland RA, Jirtle RL。转座因子:早期营养对表观遗传基因调控的作用靶点。分子细胞生物学,2003;23(15):5293-300。
Dolinoy DC, Weidman JR, Waterland RA, Jirtle RL。母株染料木素通过改变胎儿表观基因组改变Avy小鼠后代的毛色和防止肥胖。《环境健康展望》,2006;114(4):567-72。
安威博士,库普·阿斯,尤祖姆库M,斯金纳MK.内分泌干扰物与男性生育能力的表观遗传跨代作用。科学。2005;308(5727):1466 - 9。
Yajnik CS。在印度和其他亚洲国家,胰岛素抵抗和2型糖尿病的早期生命起源。J减轻。2004;134(1):205 - 10。
Wright CS, Rifas-Shiman SL, Rich-Edwards JW, Taveras EM, Gillman MW, Oken E.宫内妊娠糖尿病、儿童肥胖和血压暴露。中华物理学报。2009;22(2):215-20。
母体脂质与胎儿过度生长:从脂肪中制造脂肪。其他。2018;40(10):1638 - 47。
Elliott HR, Sharp GC, Relton CL, Lawlor DA。表观遗传学与妊娠期糖尿病:表观遗传学流行病学研究综述及其在探索表观遗传学中介和改善预测方面的应用。Diabetologia。2019;62(12):2171 - 8。
Howe CG, Cox B, Fore R, Jungius J, Kvist T, Lent S, Miles HE, Salas LA, Rifas-Shiman S, Starling AP,等。孕妇妊娠期糖尿病和新生儿DNA甲基化:来自妊娠和儿童表观遗传学协会的发现。糖尿病护理。2020;43(1):98 - 105。
Alejandro EU, Mamerto TP, Chung G, Villavieja A, Gaus NL, Morgan E, Pineda-Cortel MRB。妊娠期糖尿病:糖尿病恶性循环的先兆。国际分子生物学杂志2020;21(14):5003。
Adam S, Elfeky O, Kinhal V, Dutta S, Lai A, Jayabalan N, Nuzhat Z, Palma C, Rice GE, Salomon C.综述:孕母细胞外囊泡通信与妊娠并发症的关系。胎盘。2017;54:83-8。
Théry C, Witwer KW, Aikawa E, Alcaraz MJ, Anderson JD, Andriantsitohaina R, Antoniou A, Arab T, Archer F, Atkin-Smith GK,等。2018年细胞外囊泡研究最低信息(MISEV2018):国际细胞外囊泡学会立场声明和MISEV2014指南的更新。中国生物医学工程学报。2018;7(1):1535750。
Miranda J, Paules C, Nair S, Lai A, Palma C, Scholz-Romero K, Rice GE, Gratacos E, Crispi F, Salomon C胎盘外泌体在宫内生长限制液活组织检查中母体和胎儿循环中的分布。胎盘。2018;64:34-43。
李晓燕,李晓燕。外泌体在妊娠中作为母体和胎儿之间的信使。国际分子生物学杂志2020;21(12):4264。
Ying W, Riopel M, Bandyopadhyay G, Dong Y, Birmingham A, Seo JB, Ofrecio JM, Wollam J, hernandez - caretero A, Fu W,等。脂肪组织巨噬细胞来源的外泌体miRNAs可调节体内和体外胰岛素敏感性。细胞。2017;171 (2):372 - 384. - e312。
Ying W, Gao H, Dos Reis FCG, Bandyopadhyay G, Ofrecio JM, Luo Z, Ji Y, Jin Z, Ly C, Olefsky JM。MiR-690是一种来自m2极化巨噬细胞的外泌体来源的miRNA,改善肥胖小鼠的胰岛素敏感性。细胞金属底座。2021;33 (4):781 - 790. - e785。
Castaño C, Kalko S, Novials A, Párrizas M.肥胖相关的外泌体miRNAs调节小鼠葡萄糖和脂质代谢。中国生物医学工程学报,2018;29(6):759 - 762。
季勇,罗铮,高浩,Dos Reis FCG, Bandyopadhyay G,金Z, Manda KA, Isaac R,杨明,付伟,等。早期肥胖小鼠肝细胞来源的外泌体通过miR-3075促进胰岛素敏感性。Nat金属底座。2021;3(9):1163 - 74。
Whitham M, Parker BL, Friedrichsen M, Hingst JR, Hjorth M, Hughes WE, Egan CL, Cron L, Watt KI, Kuchel RP,等。细胞外囊泡为运动时的组织串扰提供了一种手段。细胞金属底座。2018;27 (1):237 - 251. - e234。
Salomon C, Scholz-Romero K, Sarker S, Sweeney E, Kobayashi M, Correa P, Longo S, Duncombe G, Mitchell MD, Rice GE,等。妊娠期糖尿病与妊娠期母体循环中胎盘源性外泌体的浓度和生物活性的变化有关。糖尿病。2016;65(3):598 - 609。
James-Allan LB, Rosario FJ, Barner K, Lai A, Guanzon D, McIntyre HD, Lappas M, Powell TL, Salomon C, Jansson T.正常妊娠和妊娠糖尿病中细胞外小泡调节葡萄糖稳态的研究。美国实验生物学学会联合会j . 2020; 34(4): 5724 - 39。
Rice GE, Scholz-Romero K, Sweeney E, Peiris H, Kobayashi M, Duncombe G, Mitchell MD, Salomon C.葡萄糖对妊娠早期滋养层细胞外泌体释放和生物活性的影响。中华临床内分泌杂志2015;100(10):E1280-1288。
Nair S, Jayabalan N, Guanzon D, Palma C, Scholz-Romero K, Elfeky O, Zuniga F, Ormazabal V, Diaz E, Rice GE,等。妊娠期糖尿病人胎盘外泌体携带一组与骨骼肌胰岛素敏感性相关的特异性mirna。中国科学。2018;132(22):2451 - 67。
Nair S, Guanzon D, Jayabalan N, Lai A, Scholz-Romero K, Kalita de Croft P, Ormazabal V, Palma C, Diaz E, McCarthy EA,等。细胞外小泡相关的miRNAs是对妊娠期糖尿病的适应性反应。中华医学杂志2021;19(1):360。
Jayabalan N, Lai A, Ormazabal V, Adam S, Guanzon D, Palma C, Scholz-Romero K, Lim R, Jansson T, McIntyre HD,等。脂肪组织外泌体蛋白质组学资料揭示了妊娠糖尿病中胎盘葡萄糖代谢的作用。中华内分泌杂志。2018;104(5):1735-52。
El Hajj N, Pliushch G, Schneider E, Dittrich M, Muller T, Korenkov M, Aretz M, Zechner U, Lehnen H, Haaf T妊娠糖尿病宫内暴露对MEST DNA甲基化的代谢规划。糖尿病。2013;62(4):1320 - 8。
Pinney SE, Joshi A, Yin V, Min SW, Rashid C, Condon DE, Wang PZ。暴露于妊娠期糖尿病丰富了人类羊膜细胞转录组和甲基组中的免疫相关通路。中华内分泌杂志2020;105(10):3250-64。
Haertle L, El Hajj N, Dittrich M, Muller T, Nanda I, Lehnen H, Haaf T。妊娠期糖尿病脐带血甲基化的表观遗传特征。Epigenet。2017;28。
Houde AA, Guay SP, Desgagne V, Hivert MF, Baillargeon JP, St-Pierre J, Perron P, Gaudet D, Brisson D, Bouchard L.胎盘和脐血ABCA1 DNA甲基化谱对母体代谢状态的适应表观遗传学。2013;8(12):1289 - 302。
范纳S,马修斯C,洛R,斯玛特M,希尔曼S,福L,辛哈A,威廉姆斯D,拉扬VK, Hitman GA。孕妇妊娠期糖尿病与暴露后代胎盘和脐带血全基因组DNA甲基化变异有关。中国分子生物学杂志。2015;24(11):3021-9。
C, Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, Ingelsson E, Lawlor DA, Selvin E,等。糖尿病、空腹血糖浓度和血管疾病风险:102项前瞻性研究的协同meta分析柳叶刀》。2010;375(9733):2215 - 22所示。
Singh GM, Danaei G, Farzadfar F, Stevens GA, Woodward M, Wormser D, Kaptoge S, Whitlock G, Qiao Q, Lewington S,等。代谢危险因素对心血管疾病和糖尿病的年龄特异性定量影响:综合分析PLoS ONE。2013; 8 (7): e65174。
艾纳森TR, Acs A,路德维希C,潘顿UH。心血管疾病在2型糖尿病中的患病率:2007-2017年来自世界各地的科学证据的系统文献综述。Cardiovasc Diabetol。2018;17(1):83。
Fletcher B, Gulanick M, Lamendola C. 2型糖尿病的危险因素。中华心血管杂志2002;16(2):17-23。
Andraweera P, Roberts CT, Leemaqz S, McCowan L, Myers J, Kenny LC, Walker J, Poston L, Dekker G, Consortium S。中国免疫学杂志2018;128:16-22。
谭文华、马荣伟、尾崎锐、李爱梅、陈曼敏、袁丽丽、劳特思、杨欣、何春春、图天奴,等。子宫内暴露于母体高血糖会增加子代儿童心脏代谢风险。糖尿病护理。2017;40(5):679 - 86。
巴克DJ。冠心病的胎儿起源。BMJ。1995, 311(6998): 171 - 4。
West NA, Crume TL, Maligie MA, Dabelea D.宫内暴露于母体糖尿病儿童的心血管危险因素。Diabetologia。2011年,54(3):504 - 7。
妊娠期母亲糖尿病与成年早期后代肥胖的关系:来自248,293个家庭的280,866名男性的前瞻性队列同胞研究循环。2011;123(3):258 - 65。
Reynolds RM, Allan KM, Raja EA, Bhattacharya S, McNeill G, Hannaford PC, Sarwar N, Lee AJ, Bhattacharya S, Norman JE。妊娠期母亲肥胖与成年后代心血管事件过早死亡:随访1 323 275人年。BMJ。2013; 347: f4539。
美国糖尿病A. 2015年初级保健提供者糖尿病医疗保健标准删节。中国糖尿病。2015;33(2):97 - 111。
美国糖尿病协会。糖尿病的分类和诊断。糖尿病护理。2016;39(增刊1):S13-22。
Kanguru L, Bezawada N, Hussein J, Bell J.低收入和中等收入国家妊娠期糖尿病负担的系统综述。全球健康行动。2014;7:23987。
Gibson KS, Waters TP, Catalano PM。妊娠期糖尿病的孕妇体重增加。比较。Gynecol。2012;119(3):560 - 5。
Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, Gaudet D, Hivert MF, Brisson D, Bouchard L.妊娠糖尿病表观遗传影响主要参与代谢疾病的基因。表观遗传学。2013;8(9):935 - 43。
Ruchat SM, Mottola MF。体育活动在预防和治疗妊娠期糖尿病中的重要作用。Diabetes Metab Res Rev. 2013;29(5): 334-46。
谭文华、马仁仁、杨旭、柯兆超、汤志强、Cockram CS、Sahota DS、Rogers MS、陈锦江。子宫内暴露于母体妊娠糖尿病的儿童的葡萄糖不耐受和心脏代谢风险。儿科。2008;122(6):1229 - 34。
科尔斯N,帕特尔BP,伯肯C,汉利AJ, Retnakaran R,汉密尔顿JK。宫内妊娠期糖尿病暴露儿童胰岛素抵抗的决定因素。Pediatr糖尿病。2020;21(7):1150 - 8。
Oyen N, Diaz LJ, Leirgul E, Boyd HA, Priest J, Mathiesen ER, Quertermous T, Wohlfahrt J, Melbye M.孕前糖尿病与子代先天性心脏病风险:一项全国性队列研究。循环。2016;133(23):2243 - 53。
Boney CM, Verma A, Tucker R, Vohr BR。儿童代谢综合征:与出生体重、产妇肥胖和妊娠糖尿病的关系儿科。2005;115 (3):e290 - 296。
Catalano点。妊娠期糖尿病和母体肥胖对母体及其后代的影响。中国卫生发展杂志2010;1(4):208-15。
Bateson P, Barker D, Clutton-Brock T, Deb D, D’udine B, Foley RA, Gluckman P, Godfrey K, Kirkwood T, Lahr MM,等。发育可塑性与人类健康。大自然。2004;430(6998):419 - 21所示。
Drake AJ, Reynolds RM。母体肥胖对子代肥胖和心脏代谢疾病风险的影响繁殖。2010;140(3):387 - 98。
Kampmann FB, Thuesen ACB, Hjort L, Olsen SF, Pires SM, Tetens I, Grunnet LG。暴露于妊娠期糖尿病比出生时的体型更能预测儿童的代谢障碍特征。中华临床内分泌杂志2019;104(5):1766-76。
Lowe WL Jr, Scholtens DM, Lowe LP, Kuang A, Nodzenski M, Talbot O, Catalano PM, Linder B, Brickman WJ, Clayton P,等。妊娠期糖尿病与母体糖代谢紊乱和儿童肥胖的关系。《美国医学协会杂志》上。2018年,320(10):1005 - 16所示。
谭文华、马仁仁、杨旭、李爱明、柯国超、孔亚平、劳婷婷、陈慧敏、林志强、陈锦江。暴露于母体妊娠糖尿病的青少年的葡萄糖不耐受和心脏代谢风险:一项15年随访研究糖尿病护理。2010;33(6):1382 - 4。
Malcolm JC, Lawson ML, Gaboury I, Lough G, Keely E.低危人群妊娠期糖尿病母亲后代的糖耐量。Diabet医学。2006;23(5):565 - 70。
高敏,曹松,李宁,刘静,吕莹,李静,杨旭。不同发育阶段妊娠糖尿病妇女后代超重的风险:对超过50万后代的荟萃分析。Obes Rev. 2022;23(3): e13395。
Keely EJ, Malcolm JC, Hadjiyannakis S, Gaboury I, Lough G, Lawson ML.妊娠糖尿病妊娠后代胰岛素抵抗代谢标志物的患病率。Pediatr糖尿病。2008;9(1):53-9。
Boerschmann H, Pfluger M, Henneberger L, Ziegler AG, Hummel s妊娠糖尿病母亲的后代超重和胰岛素抵抗的患病率和预测因素糖尿病护理。2010;33(8):1845 - 9。
Egeland总经理,Meltzer SJ。追随母亲的脚步?妊娠糖尿病后15年,母女患胰岛素抵抗和心血管疾病的风险Diabet医学。2010;27(3):257 - 65。
顾勇,卢杰,李伟,刘浩,王磊,冷杰,李伟,张松,王松,托米勒托杰,等。母体妊娠期糖尿病和妊娠期高血压疾病与后代超重的联合关系。性面前。2019;10:645。
Kaseva N, Vaarasmaki M, Sundvall J, Matinolli HM, Sipola M, Tikanmaki M, Heinonen K, Lano A, Wehkalampi K, Wolke D,等。妊娠期糖尿病而不是妊娠前超重预示着20年后后代的心脏代谢标志物。中国临床内分泌杂志2019;104(7):2785-95。
Holder T, Giannini C, Santoro N, Pierpont B, Shaw M, Duran E, Caprio S, Weiss R.妊娠期糖尿病母亲的青春期子代的低性格指数:青少年糖耐量受损的风险标志。57 Diabetologia。2014;(11):2413 - 20。
Lowe WL Jr, Scholtens DM, Kuang A, Linder B, Lawrence JM, Lebenthal Y, McCance D, Hamilton J, Nodzenski M, Talbot O,等。高血糖与不良妊娠结局随访研究(HAPO FUS):母体妊娠糖尿病与儿童糖代谢。糖尿病护理。2019;42(3):372 - 80。
Clausen TD, Mathiesen ER, Hansen T, Pedersen O, Jensen DM, Lauenborg J, Damm p妊娠期糖尿病或1型糖尿病妇女成年后代中2型糖尿病和糖尿病前期的高患病率:宫内高血糖的作用糖尿病护理。2008;31(2):340 - 6。
高血糖和不良妊娠结局。中华医学杂志2008;358(19):1991-2002。
腹部肥胖、代谢综合征和心血管疾病之间的联系。中华医学会心血管杂志2007;17(4):319-26。
石霞,王东,林明,苏伟,王磊,肖峰,黄鹏,刘伟,曾杰,宋浩,等。母体妊娠期糖尿病与子代1 ~ 4岁体重指数的关系。Endocr Pract。2020;26(6):619 - 26所示。
Hammoud NM, de Valk HW, Biesma DH, Visser GH。糖尿病妊娠的4- 5岁子代宫内肥胖和BMI新生儿学。2017;111(2):177 - 81。
Patel BP, McLellan SS, Hanley AJ, Retnakaran R, Hamilton JK。2岁宫内暴露于妊娠糖尿病的儿童营养风险评分更高,与5岁时胰岛素抵抗的稳态模型评估的关系。《糖尿病杂志》2021;45(5):390-4。
余燕,Arah OA, Liew Z, Cnattingius S, Olsen J, Sorensen HT,秦刚,李娟。孕妇妊娠期糖尿病与子代早发心血管疾病的人群队列研究,随访40年。BMJ。2019; 367: l6398。
戈麦斯D,冯·克里斯R,迪利厄斯M,曼斯曼U,纳斯特M,斯图伯特M,朗哈默L,哈斯NA,奈兹H,奥伯梅尔V,等。妊娠糖尿病阴性检测后肥胖孕妇妊娠晚期血糖异常和未来儿童期超重风险:来自纵向母婴队列研究的中期分析《公共科学图书馆·医学》2018;15(10):e1002681。
Pirkola J, Pouta A, Bloigu A, Hartikainen AL, Laitinen J, Jarvelin MR, Vaarasmaki M.孕期暴露于孕妇孕前超重和妊娠期糖尿病的16岁超重和腹部肥胖风险糖尿病护理。2010;33(5):1115 - 21所示。
Pham MT, Brubaker K, Pruett K, Caughey AB.妊娠期糖尿病母亲的蹒跚学步后代的儿童肥胖风险。比较。Gynecol。2013;121(5):976 - 82。
Hammoud NM, Visser GHA, van Rossem L, Biesma DH, Wit JM, de Valk HW。妊娠期糖尿病妇女后代的长期BMI和生长特征。Diabetologia。2018;61(5):1037 - 45。
Kaseva N, Vaarasmaki M, Matinolli HM, Sipola-Leppanen M, Tikanmaki M, Heinonen K, Lano A, Wolke D, Andersson S, Jarvelin MR,等。孕前超重或肥胖和妊娠期糖尿病是20年后后代身体组成的预测因素:来自两项出生队列研究的证据。中华医学杂志。2018;42(4):872-9。
如果产妇患有妊娠糖尿病,儿科医生应该注意哪些新生儿并发症?世界糖尿病杂志2015;6(5):734-43。
萨拉姆NA,帕姆格伦VAC,辛格RD,约翰CM,汤普森JA。糖尿病妊娠宫内环境下血管功能障碍的规划。国际分子科学杂志2018;19(11):3665。
Gluckman PD, Hanson MA, Buklijas T.健康和疾病发展起源的概念框架。2010;1(1): 6-18。
Godfrey KM, Gluckman PD, Hanson MA。代谢性疾病的发展起源:生命历程和代际观点。内分泌代谢趋势杂志2010;21(4):199-205。
遗传学和表观遗传学:对妊娠期糖尿病的新认识。内分泌杂志。2020;11:602477。
基因组学,2型糖尿病和肥胖。中华医学杂志2010;363(24):2339-50。
Damm P, Houshmand-Oeregaard A, Kelstrup L, Lauenborg J, Mathiesen ER, Clausen TD。妊娠期糖尿病及其对母亲和后代的长期影响:来自丹麦的观点。Diabetologia。2016;59(7):1396 - 9。
Pereira TJ, Moyce BL, Kereliuk SM, Dolinsky VW。母亲营养过剩和妊娠期糖尿病对子代代谢健康结果规划的影响:实验证据生物化学细胞生物学杂志2015;93(5):438-51。
Jones PA, Takai D. DNA甲基化在哺乳动物表观遗传学中的作用。科学。2001;293(5532):1068 - 70。
凯利南PA,范伯格AP。新兴的表观基因组学科学。中华医学杂志。2006;15:R95-101。
表观遗传学的进展将遗传与环境和疾病联系起来。自然。2019;571(7766):489 - 99。
Unnikrishnan A, Freeman WM, Jackson J, Wren JD, Porter H, Richardson A. DNA甲基化在衰老表观遗传学中的作用。杂志。2019;195:172 - 85。
Lister R, Pelizzola M, Dowen RH, Hawkins RD, Hon G, Tonti-Filippini J, Nery JR, Lee L, Ye Z, Ngo QM,等。碱基分辨率下的人类DNA甲基组表现出广泛的表观基因组差异。大自然。2009;462(7271):315 - 22所示。
Barski A, Jothi R, Cuddapah S, Cui K, Roh TY, Schones DE, Zhao K。染色质是miRNA和蛋白质编码基因的表达。基因组研究》2009;19(10):1742 - 51。
Sato F, Tsuchiya S, Meltzer SJ, Shimizu K. MicroRNAs与表观遗传学。278年2月j . 2011;(10): 1598 - 609。
Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC。妊娠大鼠膳食蛋白质限制诱导和叶酸补充可阻止后代肝脏基因表达的表观遗传修饰。J减轻。2005;135(6):1382 - 6。
McGowan PO, Sasaki A, D 'Alessio AC, Dymov S, Labonte B, Szyf M, Turecki G, Meaney MJ。人类大脑中糖皮质激素受体的表观遗传调控与童年虐待有关。Nat >。2009;12(3):342 - 8。
Tammen SA, friiso S, Choi SW。表观遗传学:先天和后天的联系。中华医学杂志2013;34(4):753-64。
子宫内暴露于妊娠糖尿病对肥胖和糖尿病的表观遗传规划。Nutr Rev. 2013;71(增刊1):S88-94。
Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, Bauer J, Ong KK, Constancia M, Lowe WL等。母体妊娠期糖尿病和宫内生长抑制对子代甲基化模式的影响提示与继发2型糖尿病风险相关的共同基因和途径。美国实验生物学学会联合会j . 2014; 28(11): 4868 - 79。
Kasuga Y, Kawai T, Miyakoshi K, Saisho Y, Tamagawa M, Hasegawa K, Ikenoue S, Ochiai D, Hida M, Tanaka M,等。妊娠期糖尿病母亲所生新生儿的表观遗传变化可能与新生儿低血糖有关。内分泌杂志。2021;12:690648。
Tobi EW, Juvinao-Quintero DL, Ronkainen J, Ott R, Alfano R, Canouil M, Geurtsen ML, Khamis A, Kupers LK, Lim IY,等。妊娠期产妇血糖失调与新生儿血液DNA甲基化:表观基因组相关性研究的meta分析糖尿病护理。2022;45(3):614 - 23所示。
Lesseur C, Armstrong DA, Paquette AG, Li Z, Padbury JF, Marsit CJ。孕妇肥胖和妊娠糖尿病与胎盘瘦素DNA甲基化有关。中华妇产科杂志2014;211(6):654。
阿拉德C, Desgagne V, Patenaude J, Lacroix M, Guillemette L,巴蒂斯塔MC, Doyon M, Menard J, Ardilouze JL, Perron P等。孟德尔随机化支持产妇高血糖与新生儿瘦素基因表观遗传调控之间的因果关系。表观遗传学。2015;10(4):342 - 51。
Bouchard L, Thibault S, Guay SP, Santure M, Monpetit A, St-Pierre J, Perron P, Brisson d瘦素基因对妊娠期糖代谢受损的表观遗传适应。糖尿病护理。2010;33(11):2436 - 41。
彭伟,陈勇,罗旭,单宁,兰X, Olson D,张宏,丁亚斌,齐海斌。DNA甲基化相关的MEST/PEG1表达抑制有助于膜外滋养层细胞的侵袭。胎盘。2016;46:92 - 101。
Himes KP, Young A, Koppes E, Stolz D, Barak Y, Sadovsky Y, Chaillet JR.小鼠遗传基因组印迹丢失导致胎盘脂质代谢严重中断。胎盘。2015;36(4):389 - 96。
高桥M, Kamei Y, Ezaki O. Mest/Peg1印迹基因使脂肪细胞增大,是脂肪细胞大小的标记物。中国生理内分泌杂志2005;28 (1):E117-124。
Nikonova L, Koza RA, Mendoza T, Chao PM, Curley JP, Kozak LP。中胚层特异性转录与正能量平衡下的脂肪量膨胀有关。美国实验生物学学会联合会j . 2008; 22(11): 3925 - 37。
Joyce BT,刘宏,王丽,王杰,郑勇,Nannini D, Drong A, Shiau S,李伟,冷杰,等。妊娠期糖尿病与巨大儿之间新的表观遗传联系。表观基因组学。2021;13(15):1221 - 30。
陈晓燕,陈晓燕,陈晓燕。转基因小鼠体内ABCA1基因功能的研究。动脉血栓血管生物学杂志2003;23(6):965-71。
朱铮,陈鑫,肖燕,文杰,陈杰,王坤,陈刚。妊娠糖尿病对子代小鼠胰腺DNA甲基化谱的影响。《糖尿病并发症杂志》2019;33(1):15-22。
Sobrevia L, Abarzua F, Nien JK, Salomon C, Westermeier F, Puebla C, Cifuentes F, Guzman-Gutierrez E, Leiva A, Casanello p。胎盘。2011;32 17 (2):s159 - 164。
Floris I, Descamps B, Vardeu A, Mitic T, Posadino AM, Shantikumar S, sara - newby G, Capobianco G, Mangialardi G, Howard L,等。妊娠期糖尿病损害胎儿内皮细胞功能的机制涉及微rna -101和组蛋白甲基转移酶增强子zester同源物-2。动脉血栓血管生物学杂志2015;35(3):664-74。
欧文斯GK,库马尔MS, Wamhoff BR。血管平滑肌细胞分化在发育和疾病中的分子调控。杂志启;2004 84(3):767 - 801。
Bayol SA, Simbi BH, stickkland NC。母体在妊娠期和哺乳期的自助餐厅饮食促进了大鼠后代的肥胖,并损害了断奶时的骨骼肌发育和代谢。物理学报2005;567(Pt 3): 951-61。
刘娜,Bezprozvannaya S, Shelton JM, Frisard MI, Hulver MW, McMillan RP, Wu Y, Voelker KA, Grange RW, Richardson JA,等。缺乏microRNA 133a的小鼠会发生动力蛋白2依赖性的中心核肌病。中华临床杂志。2011;21(8):3258-68。
莫卧儿W, Nguyen L, Pustylnik S, da Silva Rosa SC, Piotrowski S, Chapman D, Du M, Alli NS, Grigull J, Halayko AJ,等。保守的MADS-box磷酸化基序调节骨骼、心脏和平滑肌细胞的分化和线粒体功能。细胞死亡杂志2015;6:e1944。
张杰,聂PA。BNIP3和NIX在细胞死亡、自噬和自噬中的作用。细胞死亡差异。2009;16(7):939-46。
Houshmand-Oeregaard A, Schrolkamp M, Kelstrup L, Hansen NS, Hjort L, Thuesen ACB, Broholm C, Mathiesen ER, Clausen TD, Vaag A,等。妊娠糖尿病女性成年后代骨骼肌中microRNA-15a和microRNA-15b的表达增加。中华医学杂志。2018;27(10):1763-71。
张晓东,张晓东,张晓东,等。糖尿病的表观遗传与microrna调控。肾移植。2009;24(4):1088-96。
陈晓,巴勇,马琳,蔡晓,尹勇,王凯,郭杰,张勇,陈杰,郭旭,等。血清中microRNAs的表征:诊断癌症和其他疾病的一类新型生物标志物。细胞研究》2008;18(10):997 - 1006。
循环微rna作为代谢性疾病的生物标志物。最佳实践与临床内分泌meta。2016;30(5):591-601。
Parrizas M, Brugnara L, Esteban Y, Gonzalez-Franquesa, Canivell S, Murillo S, Gordillo-Bastidas E, Cusso R, Cadefau JA, Garcia-Roves PM等。循环中的miR-192和miR-193b是糖尿病前期的标记物,并受运动干预的调节。中华临床内分泌杂志2015;100(3):E407-415。
刘颖,高刚,杨超,周凯,沈斌,梁红,蒋旭。循环microRNA-126 (miR-126)在筛查糖尿病前期和新诊断2型糖尿病中的作用。国际分子生物学杂志2014;15(6):10567-77。
Al-Kafaji G, Al-Mahroos G, Alsayed NA, Hasan ZA, Nawaz S, Bakhiet M.外周血microRNA-15a是2型糖尿病和糖尿病前期的潜在生物标志物。中华医学杂志2015;12(5):7485-90。
朱辉,梁文伟。2型糖尿病中microRNA生物标志物的鉴定:对照分析研究的meta分析Diabetologia。58 2015;(5):900 - 11。
Zampetaki A, Kiechl S, Drozdov I, Willeit P, Mayr U, Prokopi M, Mayr A, Weger S, Oberhollenzer F, Bonora E等。血浆microRNA分析显示内皮细胞miR-126和其他microRNA在2型糖尿病中缺失。中国保监会研究》2010;107(6):810 - 7。
孔亮,朱军,韩伟,蒋曦,徐敏,赵颖,董强,庞铮,管强,高磊,等。血清microrna在糖尿病前期和新诊断的2型糖尿病中的意义:一项临床研究。Acta Diabetol。2011;48(1):61 - 9。
颜姝,王婷,黄松,狄艳,黄艳,刘旭,罗铮,韩伟,安斌。糖尿病前期和新诊断2型糖尿病患者血浆中microrna的差异表达。Acta Diabetol。2016;53(5):693 - 702。
Arroyo JD, Chevillet JR, Kroh EM, Ruf IK, Pritchard CC, Gibson DF, Mitchell PS, Bennett CF, Pogosova-Agadjanyan EL, Stirewalt DL,等。Argonaute2复合物携带一组不依赖于人血浆中的囊泡的循环微rna。美国国家科学研究院。2011年,108(12):5003 - 8。
Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT。MicroRNAs在血浆中运输,并通过高密度脂蛋白运送到受体细胞。细胞生物学杂志,2011;13(4):423-33。
yoyoshioka Y, Katsuda T, Ochiya T。细胞外囊泡和包膜miRNAs作为新型液体活检的新兴癌症生物标志物。中华临床医学杂志2018;48(10):869-76。
沈敏,董超,阮鑫,闫伟,曹敏,Pizzo D,吴旭,杨磊,刘磊,任鑫,等。化疗诱导的细胞外囊泡miRNAs通过靶向ONECUT2促进乳腺癌干性。实用癌症杂志2019;79(14):3608 - 21所示。
阮马,Karunakaran D, Geoffrion M, Cheng HS, Tandoc K, Perisic Matic L, Hedin U, Maegdefessel L, Fish JE, Rayner KJ。引起动脉粥样硬化的巨噬细胞分泌的胞外囊泡转移微rna抑制细胞迁移。动脉血栓血管生物学杂志2018;38(1):49-63。
Pardo F, Villalobos-Labra R, Sobrevia B, Toledo F, Sobrevia L.细胞外泡在肥胖和糖尿病中的作用。医学杂志。2018;60:81-91。
长野T, Katsurada M, Dokuni R, Hazama D, Kiriu T, Umezawa K, Kobayashi K, Nishimura Y.细胞外囊泡在支气管哮喘中的重要作用。国际分子科学杂志2019;20(10):2589。
付辉,胡丹,张丽,唐鹏。细胞外囊泡在类风湿性关节炎中的作用。摩尔Immunol。2018;93:125-32。
Weir GC, Bonner-Weir S.发展为糖尿病过程中β细胞功能障碍的五个阶段。,85糖尿病。2004;53 (24):S16-21。
DeFronzo RA, Ferrannini E, Groop L, Henry RR, Herman WH, Holst JJ, Hu FB, Kahn CR, Raz I, Shulman GI,等。2型糖尿病。《Nat Rev Dis引物》2015;1:15019。
细胞外囊泡的通讯:我们在哪里,我们需要去哪里。细胞。2016;164(6):1226 - 32。
El Andaloussi S, Mager I, Breakefield XO, Wood MJ。细胞外囊泡:生物学和新兴的治疗机会。中国药品科学进展2013;12(5):347-435。
Colombo M, Raposo G, Thery C.外泌体和其他细胞外泡的生物发生、分泌和细胞间相互作用。细胞发育生物学杂志2014;30:255-89。
Crescitelli R, Lasser C, Szabo TG, Kittel A, Eldh M, Dianzani I, Buzas EI, Lotvall J.细胞外囊泡亚群中不同的RNA谱:凋亡小体,微囊泡和外泌体。中华医学杂志。2013;2:20677。
细胞外囊泡:外泌体、微囊泡和朋友。细胞生物学杂志,2013;200(4):373-83。
朱晓,尤勇,李强,曾春,付芳,郭安,张辉,邹鹏,钟智,王辉,等。bcr - abl1阳性微泡通过基因组不稳定性转化正常造血移植:对供体细胞白血病的影响白血病。2014;28(8):1666 - 75。
Mensà E,盖奇尼M,朱利安尼A,巴卡利尼MG,拉米尼D,柯里昂G,费瑞辛M,富尔根齐G,格拉iotti L,普拉蒂奇佐F,等。小的细胞外囊泡将miR-21和miR-217作为促衰老效应因子传递到内皮细胞。中国生物医学工程学报,2020;9(1):1725285。
Morgan HD, Santos F, Green K, Dean W, Reik W.哺乳动物表观遗传重编程。中国分子生物学杂志,2005;14(增刊1):e47-58。
冯勇,黄伟,孟W, Jegga AG,王勇,蔡伟,金华伟,Pasha Z,文智,饶福,等。热休克提高了Sca-1+干细胞的存活率,并通过外泌体转移引导缺血心肌细胞向促生存表型转变:这是HSF1/miR-34a/HSP70通路的关键作用。干细胞。2014;32(2):462 - 72。
Schiera G, Di Liegro CM, Saladino P, Pitti R, Savettieri G, Proia P, Di Liegro I.少突胶质细胞瘤细胞合成分化特异性连接子组蛋白H1˚,并通过脱落囊泡释放到细胞外环境。中华口腔医学杂志2013;43(6):1771-6。
长链非编码RNA功能的多维机制。基因组医学杂志。2017;18(1):206。
陈亮,杨伟,郭颖,陈伟,郑鹏,曾杰,童伟。外泌体lncRNA GAS5调节动脉粥样硬化中巨噬细胞和血管内皮细胞凋亡。PLoS ONE。2017; 12 (9): e0185406。
李红,朱旭,胡丽,李强,马娟,颜娟。ox- ldl处理的血管内皮细胞外泌体MALAT1缺失诱导树突状细胞成熟,动脉粥样硬化发展。细胞周期。2019;18(18):2255 - 67。
黄晨,韩娟,吴艳,李松,王强,林伟,朱娟。氧化低密度脂蛋白处理内皮细胞外泌体MALAT1促进M2巨噬细胞极化。Mol Med 2018;18(1): 509-15。
高红,王鑫,林超,安智,余杰,曹宏,范莹,梁旭。ox- ldl处理内皮细胞衍生的外泌体MALAT1诱导中性粒细胞胞外陷阱加重动脉粥样硬化。生物化学杂志。2020;401(3):367 - 76。
施贵刚,王宝文,方文杰,潘秋明,林秋明。高压氧诱导的长链非编码RNA MALAT1外泌体抑制急性心肌梗死大鼠模型中MicroRNA-92a的表达。中华细胞医学杂志2020;24(22):12945-54。
黄鹏,王亮,李强,田旭,徐军,徐军,熊勇,陈刚,钱宏,金超,等。阿托伐他汀通过上调长链非编码RNA H19增强间充质干细胞来源外泌体治疗急性心肌梗死的疗效Cardiovasc研究》2019;116(2):353 - 67。
缺氧心肌细胞外泌体lncRNA AK139128促进心脏成纤维细胞凋亡,抑制细胞增殖。国际J纳米医学。2020;15:3363。
阮艳,林宁,马青,陈瑞,张铮,文伟,陈华,孙杰。2型糖尿病患者循环lncrna分析发现影响糖代谢和胰岛β细胞功能的新基因。细胞物理与生物化学。2018;46(1):335-50。
曹霞,薛德龙,狄颖,李涛,田雅杰,宋颖。msc来源的外泌体lncRNA SNHG7通过miR-34a-5p/XBP1轴抑制糖尿病视网膜病变内皮-间质转变和管的形成。生命科学,2021;272:119232。
李斌,栾松,陈娟,周莹,王婷,李智,傅莹,翟安,毕晨。msc来源的外泌体lncRNA H19通过microRNA-152-3p上调PTEN促进糖尿病足溃疡创面愈合。分子Ther核酸,2020;19:814-26。
朱斌,张磊,梁超,刘斌,潘旭,王勇,张勇,张勇,谢伟,闫斌,等。干细胞来源的外泌体通过一种新的外泌体/lncRNA MALAT1/NF-κB/TNF-α信号通路预防衰老诱导的心功能障碍。Oxid Med Cell Longev. 2019;2019:9739258。
Tello-Flores VA, Valladares-Salgado A, Ramírez-Vargas MA, Cruz M, del Moral-Hernández O, Cahua-Pablo JÁ, Ramírez M, Hernández-Sotelo D, Armenta-Solis A, Flores-Alfaro e与2型糖尿病相关的血清或血清外泌体产生的MALAT1和H19水平的改变。非编码RNA Res. 2020;5(2): 71-6。
文艳,春艳,连志强,雍志伟,兰玉梅,欢莉,席春春,Juan LS, Qing ZW,贾晨。circRNA-0006896-miR1264-DNMT1轴通过调节动脉粥样硬化中内皮细胞的行为在颈动脉斑块失稳中发挥重要作用。Mol Med rep 2021;23(5): 1-13。
王松,詹杰,林鑫,王艳,王艳,刘艳。高血糖刺激的血管内皮细胞外泌体CircRNA-0077930调控血管平滑肌细胞衰老。细胞生物化学功能,2020;38(8):1056-68。
白松,熊旭,唐博,纪涛,李霞,曲霞,李伟。外泌体circ_DLGAP4通过海绵miR-143和靶向ERBB3/NF-κB/MMP-2轴促进糖尿病肾病进展。细胞死亡杂志2020;11(11):1-13。
普拉特AJ,麦克雷IJ。rna诱导沉默复合体:一种多功能基因沉默机器。中国生物医学工程学报,2009;28(6):694 - 694。
莫里马,路德维希RG,加西亚-马丁R, Brandão BB,卡恩CR.细胞外miRNAs:从生物标志物到生理和疾病的中介。细胞金属底座。2019;30(4):656 - 73。
艾萨克R,赖斯FCG,应W,奥莱夫斯基JM。外泌体作为代谢中细胞间串扰的介质。细胞金属底座。2021;33(9):1744 - 62。
Hink U, Li H, Mollnau H, Oelze M, Matheis E, Hartmann M, Skatchkov M, Thaiss F, Stahl RA, Warnholtz A,等。糖尿病内皮功能障碍的潜在机制。中国保监会研究》2001;88 (2):E14-22。
Ceriello A.糖尿病的新挑战:“代谢记忆”。Vascul杂志。2012;57(5 - 6):133 - 8。
Prattichizzo F, Giuliani A, De Nigris V, Pujadas G, Ceka A, La Sala L, Genovese S, Testa R, Procopio AD, Olivieri F等。细胞外microrna和内皮性高血糖记忆:一个治疗机会?中华糖尿病杂志。2016;18(9):855-67。
Bijkerk R, van Solingen C, de Boer HC, van der Pol P, Khairoun M, de Bruin RG, van Oeveren-Rietdijk AM, Lievers E, Schlagwein N, van Gijlswijk DJ等。造血microRNA-126通过促进血管完整性保护肾缺血/再灌注损伤。中国寄生虫病杂志,2014;25(8):1710-22。
Jansen F, Yang X, Hoelscher M, Cattelan A, Schmitz T, Proebsting S, Wenzel D, Vosen S, Franklin BS, Fleischmann BK,等。内皮微粒介导的MicroRNA-126转移通过SPRED1促进血管内皮细胞修复,并在葡萄糖损伤的内皮微粒中被废除。循环。2013;128(18):2026 - 38。
王曦,黄伟,刘刚,蔡伟,Millard RW,王颖,常杰,彭涛,范志昌。心肌细胞通过miR-320的外体转移到内皮细胞介导2型糖尿病大鼠的抗血管生成。中华分子医学杂志。2014;74:139-50。
王鑫,顾宏,黄伟,彭杰,李勇,杨磊,秦达,Essandoh K,王勇,彭太,等。hsp20介导的心肌细胞外泌体生物生成的激活改善糖尿病小鼠的心功能和血管生成。糖尿病。2016;65(10):3111 - 28。
Garcia NA, Moncayo-Arlandi J, Sepulveda P, Diez-Juan A.心肌细胞外泌体通过GLUT转运体和糖酵解酶的直接转移调节内皮细胞的糖酵解通量。Cardiovasc研究》2016;109(3):397 - 408。
Garcia NA, Ontoria-Oviedo I, Gonzalez-King H, Diez-Juan A, Sepulveda P.心肌细胞葡萄糖饥饿增强外泌体分泌,促进内皮细胞血管生成。PLoS ONE。2015; 10 (9): e0138849。
胡娟,王松,熊铮,程铮,杨铮,林杰,王涛,冯旭,高鄂,王辉,等。外泌体Mst1从心脏微血管内皮细胞转移到心肌细胞可恶化糖尿病心肌病。生物化学生物物理学报分子基础杂志2018;1864(11):3639-49。
王松,赵铮,范勇,张明,冯旭,林杰,胡娟,程卓,孙超,刘涛,等。Mst1抑制Sirt3的表达,并通过抑制帕金森依赖性的线粒体分裂导致糖尿病心肌病。生物化学生物物理学报分子基础学报2019;1865(7):1905-14。
于伟,高斌,李楠,王杰,邱超,张刚,刘敏,张锐,李超,季刚,等。Sirt3缺乏加剧糖尿病心功能障碍:foxo3a -帕金森介导的自噬作用。生物化学生物物理学报分子基础杂志2017;1863(8):1973-83。
casano C, Kalko S, Novials A, Parrizas M.肥胖相关的外泌体miRNAs调节小鼠的糖和脂代谢。美国国家科学研究院。2018; 115(48): 12158 - 63。
埃德尔M,卡萨波B,瓦德萨克C,哈斯J,卡塔拉诺PM,德索耶G,范波佩尔MN。新生儿脐血胰岛素与皮下脂肪组织相关性的性别差异。中华医学杂志。2016;40(3):538-42。
Grunnet LG, Hansen S, Hjort L, Madsen CM, Kampmann FB, Thuesen ACB, Granstrømi C, Strøm M, Maslova E, Frikke-Schmidt R,等。妊娠期糖尿病妇女青春期后代的肥胖、代谢障碍特征和女性青春期提前:丹麦全国出生队列中的一项临床研究糖尿病护理。2017;40(12):1746 - 55。
Silverman BL, Rizzo T, Green OC, Cho NH, Winter RJ, Ogata ES, Richards GE, Metzger BE。糖尿病母亲后代的长期前瞻性评价。糖尿病。1991;40 17(2):121 - 5。
Dabelea D, Hanson RL, Lindsay RS, Pettitt DJ, Imperatore G, Gabir MM, Roumain J, Bennett PH, Knowler WC。宫内暴露于糖尿病会传递2型糖尿病和肥胖的风险:一项关于不和谐兄弟姐妹的研究。糖尿病。2000;49(12):2208 - 11所示。
Barker DJ, Bull AR, Osmond C, Simmonds SJ。胎儿和胎盘的大小与成年期高血压的风险。BMJ。1990, 301(6746): 259 - 62。
2型(非胰岛素依赖型)糖尿病:节俭表型假说。国际流行病学杂志2013;42(5):1215-22。
Nielsen JH, Haase TN, Jaksch C, Nalla A, Søstrup B, Nalla AA, Larsen L, Rasmussen M, Dalgaard LT, Gaarn LW。胎儿和新生儿环境对β细胞功能和糖尿病发展的影响。中华妇产科杂志2014;93(11):1109-22。
hejmans BT, Tobi EW, Stein AD, Putter H, Blauw GJ, Susser ES, Slagboom PE, Lumey LH。持久的表观遗传差异与人类产前暴露于饥荒有关。中国生物医学工程学报,2008;38(4):369 - 369。
Cooney CA, Dave AA, Wolff GL.母系甲基补充对小鼠后代表观遗传变异和DNA甲基化的影响。中国化学杂志,2002;32(8增刊):2393 - 400s。
Kaminen-Ahola N, Ahola A, Maga M, Mallitt KA, Fahey P, Cox TC, Whitelaw E, Chong s母体乙醇消耗改变小鼠模型后代的表观基因型和表型。科学通报,2010;6(1):e1000811。
谢曦,高红,曾伟,陈松,冯琳,邓丹,乔凤燕,廖琳,McCormick K,宁强。过氧化物酶体增殖体激活受体-γ共激活子-1α启动子胎盘DNA甲基化与母体妊娠血糖水平相关。Sci。2015;129(4):385 - 94。
卡德纳斯A, Gagné-Ouellet V,阿拉德C,布里森D,佩隆P,布沙尔L,希维特M-F。妊娠期胎盘DNA甲基化对母体血糖反应的适应。糖尿病。2018;67(8):1673 - 83。
颜健,苏瑞,张伟,魏燕,王超,林玲,冯红,杨慧。宫内高血糖暴露过大儿脐带血中Rho鸟嘌呤核苷酸交换因子11 (ARHGEF11)的表观遗传改变。中华母婴新生儿医学杂志2021;34(3):422-31。
任小霞,童勇,邱勇,叶超,吴娜,熊晓强,王俊杰,韩勇,周亚波,张芳,等。体外成纤维细胞衍生的细胞外囊泡中的MiR155-5p通过抑制血管紧张素转换酶的表达抑制血管平滑肌细胞增殖。中国生物医学工程学报,2020;9(1):1698795。
Nehring I, Chmitorz A, Reulen H, von Kries R, Ensenauer R.妊娠期糖尿病预测儿童超重和腹围独立于母亲肥胖的风险。Diabet医学。2013;30(12):1449 - 56。
李浩,张慧卿,朴泓,赵宁华。有妊娠糖尿病病史的母亲的后代心血管疾病危险因素的早期表现中华糖尿病杂志2007;78(2):238-45。
Perng W, Hockett CW, Sauder KA, Dabelea D.青年宫内暴露于妊娠糖尿病和心血管危险因素:EPOCH队列的纵向分析。儿科学。2020;15(5):e12611。
Kelstrup L, Clausen TD, Mathiesen ER, Hansen T, Holst JJ, Damm P.妊娠期暴露于母亲糖尿病的成年子代的肠促胰岛素和胰高血糖素水平。中华临床内分泌杂志2015;100(5):1967-75。
李娟,谭敏,向强,周智,闫华。凝血酶激活的血小板源外泌体通过microRNA-223调节血栓-炎症反应中内皮细胞ICAM-1的表达。Thromb杂志2017;154:96 - 105。
冯燕,黄伟,Wani M, Yu X, Ashraf M.缺血预处理通过miR-22靶向Mecp2,通过分泌外泌体增强干细胞的保护作用。PLoS ONE。2014; 9 (2): e88685。
李松,高原,刘勇,李娟,杨旭,胡锐,刘军,张勇,左凯,李凯。肌成纤维细胞衍生的外泌体有助于心房颤动敏感底物的形成。心脏病。2020;145(5):324 - 32。
李娟,薛辉,李涛,褚旭,辛东,熊勇,邱伟,高旭,钱明,徐静,等。来自间充质干细胞的外泌体通过miR-let7介导的M2巨噬细胞浸润和极化减弱ApoE(-/-)小鼠动脉粥样硬化的进展。生物化学与生物物理学报2019;510(4):565-72。
确认
不适用。
资金
本研究得到国家卫生和医学研究委员会(NHMRC 1195451)和国家Desarrollo Fondo Científico y Tecnológico (FONDECYT 11190522)的支持。
作者信息
作者和联系
贡献
VO和SN进行了文献综述,对概念和设计做出了贡献,并撰写了综述的初稿。CS、FC和DM对文章的构思和设计做出了贡献,并对稿件的草稿进行了严格的审查。所有作者阅读并批准了最终稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
欧玛嘉宝(V.),奈尔(S.), Carrión, F。et al。妊娠期糖尿病与心血管疾病之间的联系:细胞外囊泡的潜在作用。Cardiovasc Diabetol21174(2022)。https://doi.org/10.1186/s12933-022-01597-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12933-022-01597-3
关键字
- 心血管病
- 妊娠期糖尿病
- 胎盘
- 细胞外囊泡
- 细胞通讯