摘要
背景
二甲双胍被广泛用于治疗糖尿病,人们对将这种药物“重新利用”用于预防或治疗癌症很感兴趣。然而,二甲双胍代谢作用的机制仍然知之甚少。
方法
我们对细胞和分离的线粒体进行了呼吸测量和稳定同位素示踪分析,以研究二甲双胍对线粒体功能的影响。
结果
我们表明二甲双胍减少线粒体呼吸,导致线粒体呼吸的比例增加,致力于解偶联反应。因此,二甲双胍处理的细胞变得能量效率低下,并通过柠檬酸循环显示出有氧糖酵解增加和葡萄糖代谢减少。先前的研究提出了二甲双胍作用的线粒体复合体I或各种细胞质靶点,但我们发现该化合物限制了分离线粒体的呼吸和柠檬酸循环活性,这表明至少对于这些作用,线粒体是主要靶点。最后,我们证明暴露于二甲双胍的癌细胞比未转化的细胞表现出更大的有氧糖酵解代偿性增加,突出了它们的代谢脆弱性。在癌细胞中预防这种代偿性代谢事件会显著损害生存。
结论
总之,这些结果表明二甲双胍直接作用于线粒体以限制呼吸,细胞对二甲双胍的敏感性取决于它们应对能量压力的能力。
背景
双胍类药物二甲双胍已被公认为治疗II型糖尿病的重要药物[1- - - - - -3.]。药物流行病学证据[4,5]和实验室模型[6,7表明二甲双胍可能具有抗肿瘤作用,这引起了人们对该药物分子作用的新兴趣[8]。一种流行的观点是二甲双胍作为电子传递链络合物I的抑制剂。然而,二甲双胍直接作用于线粒体抑制复合体I的观点是有争议的[9- - - - - -15]。最近关于癌细胞对二甲双胍直接作用的敏感性的研究进一步突出了围绕二甲双胍作用方式的争议。这些研究表明,线粒体功能缺陷的癌细胞(rho0细胞)对二甲双胍的作用很敏感[11],并且与没有这些突变的癌细胞相比,携带复合体I突变的癌细胞对二甲双胍的作用更敏感[16]。
虽然关于二甲双胍作用的分子机制存在争议,但人们普遍认为该药物会引起能量应激,并导致各种细胞谱系特异性的继发性效应。在糖尿病的情况下,肝脏是一个重要的靶器官。口服二甲双胍后,该器官通过门静脉循环暴露于相对高浓度的二甲双胍中,肝细胞表达高水平的药物内流所需的膜转运蛋白[17]。二甲双胍诱导的肝细胞能量应激导致糖异生减少[18- - - - - -20.],从而改善高血糖和高胰岛素血症。这些代谢行为也代表了一种与胰岛素反应性癌症相关的候选机制[21]。最近的研究表明,二甲双胍治疗通过抑制线粒体甘油磷酸脱氢酶改变肝细胞氧化还原状态[22]。
了解二甲双胍对能量代谢的作用,特别是对线粒体功能的作用,对于“重新利用”该化合物在肿瘤学中的可能应用非常重要。越来越多的证据表明,线粒体代谢通过提供ATP和可用于合成代谢反应的代谢中间体,在支持肿瘤生长中起着重要作用[23]。此外,功能性线粒体复合体I已被证明对促进有氧糖酵解和Warburg效应至关重要[24]。为了支持这些观点,PGC-1α或ERRα这两种已知的线粒体代谢中枢调节因子已被证明可促进肝癌、结肠癌、乳腺癌、前列腺癌和黑色素瘤的生长[25- - - - - -29]。在这里,我们证明了二甲双胍对细胞和分离线粒体的线粒体生物能量学的影响。
方法
动物、细胞和试剂
野生型雄性C57BL/6J小鼠购自Jackson实验室(Bar Harbour, ME, USA)。NT2196和NMuMG细胞由William Muller博士(McGill University, montracimal, Canada)提供,在其他地方有描述[30.]。MCF7和MCF10A细胞购自ATCC。除非另有说明,所有试剂均购自Sigma-Aldrich。
细胞培养
除非另有说明,所有细胞培养材料均购自Wisent公司。NT2196和NMuMG细胞按照先前发表的方法生长[30.]。MCF7细胞在含有10%胎牛血清,并添加青霉素和链霉素的Dulbecco 's Modified Eagle Medium (DMEM)培养基中培养。MCF10A细胞在添加5%马血清、20 ng/mL人表皮生长因子(hEGF)、0.5 μg/mL氢化可的松、10 μg/mL胰岛素、青霉素和链霉素的DMEM/Ham’s F12 50/50混合培养基中生长。所有细胞在37℃,5% CO条件下生长2热模,系列II水套CO2孵化器)。在比较葡萄糖或半乳糖培养基中生长对呼吸影响的实验中,MCF7细胞在标准葡萄糖DMEM或半乳糖(25 mM)培养基中培养,该培养基与DMEM具有相同的成分,只是葡萄糖已被半乳糖取代。细胞在葡萄糖或半乳糖培养基中培养20 - 25天。然后用ddH处理细胞20(对照组)或二甲双胍(0.5 mM)持续24小时,之后按先前描述的方法评估呼吸[31]。
细胞增殖
将固定数量的细胞镀于6孔板(9.6 cm)中2/)。每隔24小时取出培养基,用ddH处理细胞20(对照)或二甲双胍(0.5 mM和5.0 mM)。在相应的时间点(24,48和72小时),取出培养基并储存在试管中(收集漂浮细胞);将贴壁细胞用磷酸盐缓冲盐水(PBS)洗涤,胰蛋白酶化,重悬于收集的培养基中,以2,500 rpm离心5分钟。取出培养基(并用于乳酸和葡萄糖的测量;取出培养基(在二甲双胍存在的情况下用于乳酸和葡萄糖的折叠变化测量),重悬细胞颗粒,将细胞颗粒重悬在已知体积的新鲜培养基中。使用台盼蓝染色(0.4%,Gibco)和TC10自动细胞计数器(Bio-Rad)获得总细胞和活细胞计数。
乳酸和葡萄糖浓度
MCF10A、MCF7、NT2196和NMuMG细胞在6孔板(9.6 cm)中生长2/好吧)到60%的流利度。取出每孔中的培养基,以13000 rpm的转速离心10分钟,去除细胞碎片,放入新管中,用Nova BioProfile 400分析仪进行分析。只含有培养基而不含细胞的孔也用这种方法作为空白进行分析。为了计算细胞数,如上所述对细胞进行计数。为了计算乳酸产量和葡萄糖消耗,在每个条件下乳酸或葡萄糖的浓度从空白孔中减去,然后将该值归一化为总细胞计数。
呼吸
使用Digital Model 10 Clark电极(Rank Brothers, Cambridge, UK)对培养细胞或分离线粒体进行呼吸测量。用培养的细胞在各自的生长培养基中进行呼吸,用分离的线粒体在KHEB (120 mM KCl, 5 mM KH)中进行呼吸2阿宝4, 3 mM 4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES), 1 mM乙二醇四乙酸(EGTA)和0.3%牛血清白蛋白(BSA) (w/v), pH 7.2)测定培养基。使用DigitizeIt软件(版本1.5)对分离线粒体的呼吸痕迹进行数字化。该软件使用在痕迹上发现的背景曲纸作为参考,从痕迹中提取值。简单地说,导入呼吸轨迹,根据轨迹图纸上的相应值手动定义坐标轴,并由软件生成数据值,使用GraphPad Prism 5软件绘制。
骨骼肌线粒体的分离
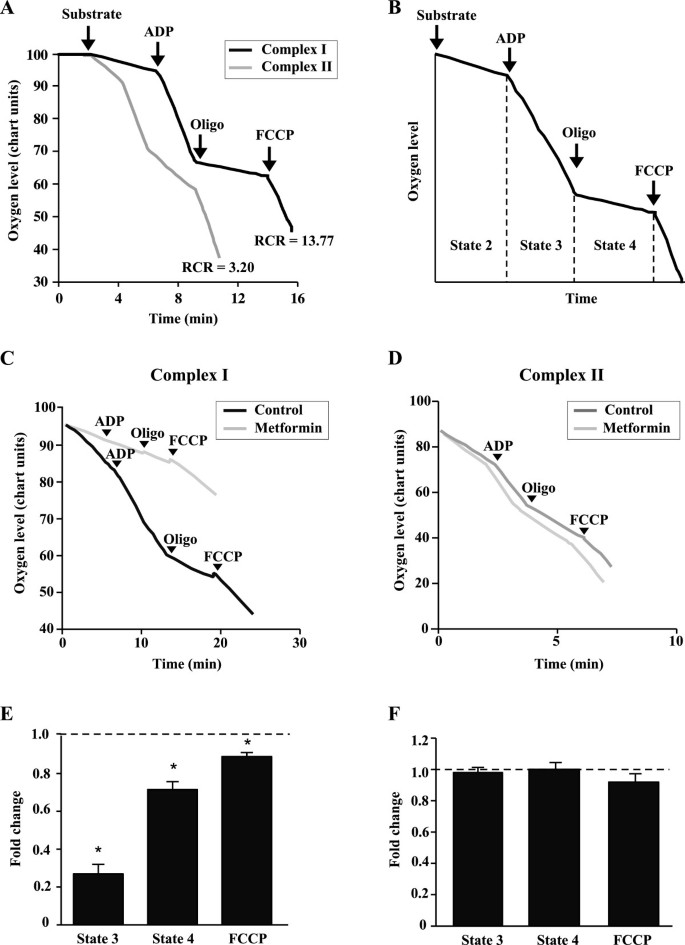
经麦吉尔大学动物保护委员会批准,小鼠在大约6个月大时被处死。从骨骼肌中分离线粒体,如前所述[32]。通过量化呼吸控制率(RCR)值来评估线粒体悬液的完整性,该值由ADP(状态3)存在时的耗氧量除以寡霉素(状态4)存在时的耗氧量得到。只有在对照条件下RCR值大于3的线粒体悬液才被使用。
用二甲双胍和呼吸治疗细胞
NT2196、NMuMG、MFC10A和MCF7细胞在ddH存在下生长20(对照)或特定剂量的二甲双胍24小时。1 × 106细胞用于呼吸测量。耦合呼吸和非耦合呼吸的计算按[31]。简单地说,耦合呼吸是通过减去少霉素不敏感的总呼吸(2.5 μg/mL/1 × 10)来计算的6细胞呼吸。不耦合呼吸代表寡霉素不敏感呼吸。非线粒体呼吸表示对粘噻唑(10 μM)不敏感的呼吸。细胞未显示可检测到的非线粒体呼吸。
二甲双胍和呼吸治疗分离线粒体悬液
二甲双胍孵育实验中,线粒体(0.6 mg/mL)在37°C的KHEB培养基中,在温度控制的水浴(Fisher Scientific, Isotemp 3006S)中,在复合物I(等摩尔30 mM苹果酸盐和丙酮酸盐)或复合物II (25 mM琥珀酸盐和50 μM鱼藤酮)底物中,在ddH的存在下孵育20(对照组)或10mm二甲双胍30分钟。每10分钟重悬一次样品。30分钟后,用400 μL KHEB培养基(最终等摩尔浓度为6 mM苹果酸和丙酮酸或5 mM琥珀酸和10 μM鱼藤酮,不含或不含2 mM二甲双胍)稀释100 μL反应。立即记录呼吸作用,随后加入ADP (500 μM,状态3)、寡霉素(2.5 μg寡霉素/mg线粒体蛋白,状态4)和FCCP (1.5 μM)。
细胞和分离线粒体的稳定同位素示踪分析
MCF10A和MCF7细胞培养于6孔板(9.6 cm)中2/well)到80%的流畅度,之后是ddH2培养基中加入0(对照)或二甲双胍(0.5 mM, 5.0 mM) 24小时。媒体随后被换成了[U-13C]葡萄糖(剑桥同位素实验室,图克斯伯里,MA, USA, CLM-1396, 99%原子)13C)标记培养基1小时。然后用4°C生理盐水(9 g/L NaCl)冲洗细胞一次,用80%甲醇(<20°C)淬火。将小鼠骨骼肌分离的线粒体重悬于浓度为1.5 mg/mL的KHEB培养基中。样品在37°C的温度控制水浴(Fisher Scientific, Isotemp 3006S)中,在1 mM苹果酸盐和1 mM [U-]存在下孵育13C]丙酮酸30分钟,或者在ddH存在的情况下20(对照)或5mm二甲双胍。然后样品在80%甲醇(<20°C)中淬火。剩下的步骤与细胞和线粒体提取物相同。代谢物提取通过超声在4°C(10分钟,30秒开,30秒关,高设置,Diagenode Bioruptor)进行。提取液通过离心(14000 rpm, 4°C)清除,上清液在-4°C的冷阱(Labconco)中干燥过夜。将微丸用含甲氧基胺-盐酸吡啶(10 mg/mL)超声和涡流溶解,离心后丢弃。样品在70℃(甲氧基肟)条件下孵育30分钟,然后用MTBSTFA在70℃条件下衍生1 h。然后,1 μL进样于按[33]。使用Chemstation软件(Agilent, Santa Clara, USA)进行数据分析。质量同位素分布分析根据[34,35]。
结果
与未转化的细胞相比,癌细胞将更多的呼吸作用用于解偶联反应
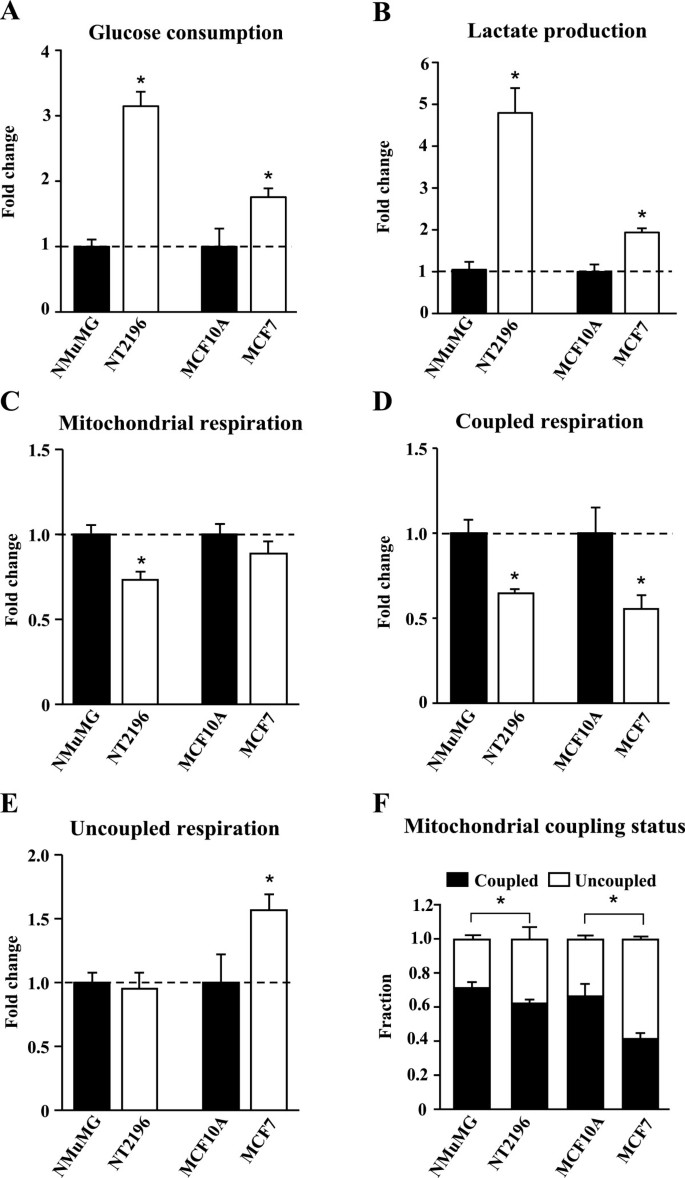
为了评估乳腺癌细胞对有氧糖酵解和线粒体呼吸产生ATP的依赖性,我们将小鼠和人类乳腺癌细胞系与未转化的对照组的这些参数进行了比较。我们使用表达致癌Neu/ErbB2的NT2196细胞及其亲本NMuMG细胞作为小鼠细胞系模型。对于人类细胞模型,我们使用MCF7癌细胞和MCF10A上皮细胞作为比较对照。NT2196和MCF7癌细胞都显示出更高的葡萄糖消耗(图2)1A)和乳酸生成(图1B)与他们各自的控制相比。这些数据证实,与未转化的细胞相比,癌细胞中的有氧糖酵解升高。接下来,我们评估了乳腺癌细胞和非转化对照组的线粒体呼吸作用。线粒体呼吸作用可以是耦合的(与ATP的产生有关),也可以是非耦合的(驱动质子泄漏反应)。NT2196癌细胞与NMuMG对照细胞相比,线粒体呼吸减少(图2)1C)。线粒体呼吸的减少是由于耦合呼吸的减少(图2)1小鼠癌细胞(NT2196)与其亲代对照之间的非偶联呼吸相似,而人类乳腺癌细胞(MCF7)的非偶联呼吸与对照细胞相比有所增加(图2)1E).耦合呼吸(图1D)在MCF7细胞中也比对照组减少,导致总体线粒体呼吸与对照组相比没有显著变化(图2)1C).接下来,我们通过计算线粒体呼吸与ATP产生耦合和不耦合的比例来量化线粒体偶联状态。与对照组相比,乳腺癌细胞投入了更大比例的线粒体呼吸来驱动解偶联反应(图2)1相反,对照细胞将更大比例的线粒体呼吸用于支持ATP的产生(图2)1综上所述,这些数据表明这些乳腺癌细胞比对照组有更高的有氧糖酵解速率,并且它们的线粒体有利于解偶联反应。
与未转化的细胞相比,癌细胞中的线粒体呼吸与ATP的产生更不耦合。在小鼠乳腺癌细胞(NT2196)和亲代对照(NMuMG)以及人类乳腺癌细胞(MCF7)和非转化对照(MCF10A)中,对有氧糖酵解和线粒体呼吸进行了量化。(一)葡萄糖消耗和(B)癌细胞的乳酸产量表现为对照的两倍变化。(C)线粒体呼吸总量,(D)耦合呼吸和(E)癌细胞中的非偶联呼吸表现为对照的倍变化。(F)通过将耦合或非耦合呼吸的速率除以总线粒体呼吸的速率来计算用于耦合和非耦合呼吸的线粒体呼吸的比例。耦合呼吸是用来驱动ATP合成的呼吸作用。不耦合呼吸作用被用来驱动质子泄漏反应。数据以均数±SEM表示。n = 3。*P< 0.05,学生t -测试,其中*表示非转换控件的重要更改。
二甲双胍引起非偶联呼吸比例的剂量依赖性增加
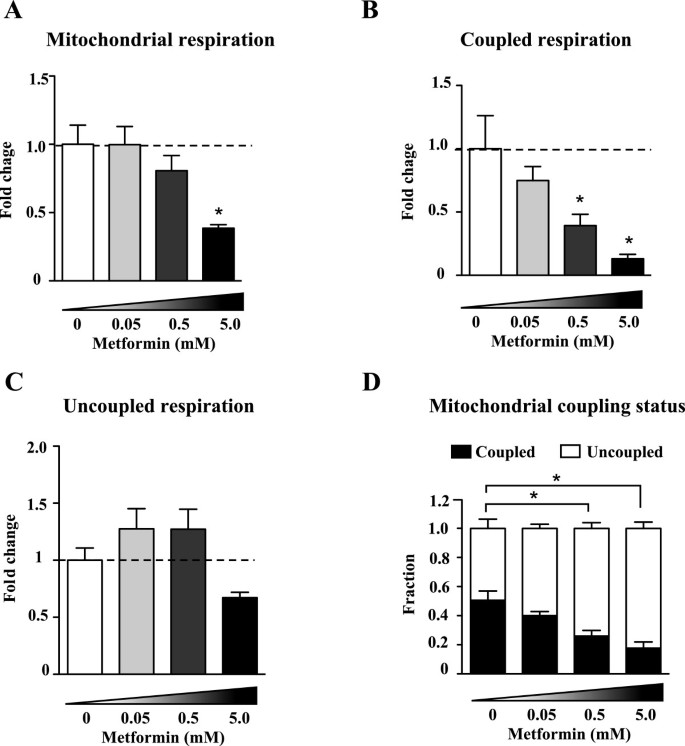
二甲双胍导致MCF7癌细胞的呼吸量呈剂量依赖性下降(图2)2A)。呼吸的减少是由于用于ATP合成的呼吸速率的降低(图2)2B)。低剂量二甲双胍不影响解偶联呼吸速率,但在5 mM时下降(图2)2C)。随着二甲双胍剂量的增加,偶联呼吸速率降低,而非偶联呼吸基本不受影响,这一事实导致乳腺癌细胞将越来越多的呼吸比例用于非偶联反应(图2)2综上所述,这些结果表明二甲双胍降低了线粒体呼吸,并对线粒体产生ATP的能力产生了深远的影响。
二甲双胍对线粒体呼吸的剂量依赖性影响。(一)总计(B)耦合和(C)ddH处理24小时后MCF7细胞的解耦呼吸2O(对照)或不同浓度的二甲双胍(0.05、0.5和5.0 mM)。折叠变化表示未处理样品的呼吸变化。(D)线粒体呼吸作用于耦合呼吸和非耦合呼吸的比例计算如图所示1.数据以均数±SEM表示。N = 4 ~ 5。*P<0.05,单因素方差分析后进行Dunnet多重比较检验。
二甲双胍导致癌细胞中有氧糖酵解比未转化的对照组更大的上调
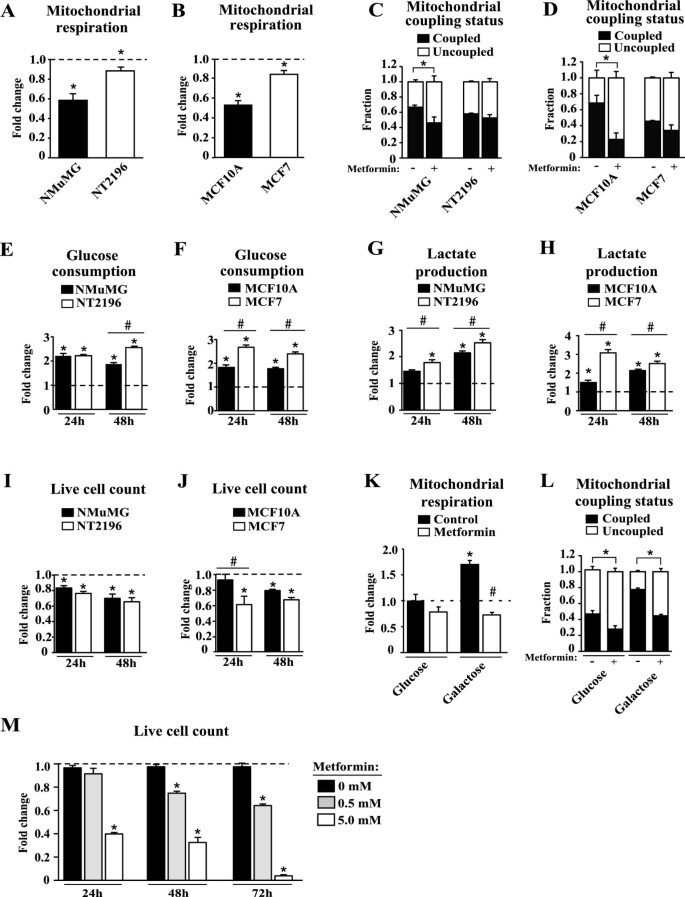
由于二甲双胍对乳腺癌细胞线粒体代谢有显著影响(图2)2),然后我们比较了这种药物在癌细胞和未转化的对照组之间的效果,因为它们在线粒体代谢方面表现出差异(图2)1)。二甲双胍导致乳腺癌细胞和未转化对照组的线粒体呼吸减少(图2)3.A、B)。然而,与乳腺癌细胞相比,未转化细胞的呼吸减少幅度更大(图2)3.A、B)。二甲双胍在急性治疗(15分钟潜伏期)时也引起呼吸减少[见附加文件]1、附加文件2小鼠对照细胞(NMuMG)中:图S1],而小鼠乳腺癌细胞(NT2196)中未观察到变化。此外,二甲双胍引起线粒体偶联状态的转变,有利于非偶联呼吸,与癌细胞相比,非转化细胞的程度更大(图2)3.C, D)。暴露于二甲双胍后,癌细胞和未转化的对照组均显示有氧糖酵解升高(图2)3.情况)。糖酵解的上调将减轻二甲双胍引起的线粒体ATP产生的下降。在二甲双胍的存在下,癌细胞的有氧糖酵解比对照组明显增加(图2)3.情况)。尽管癌细胞有氧糖酵解的代偿性增加更大,但二甲双胍治疗对癌细胞增殖的影响与对照组相同,甚至更大(图2)3.I, J)。事实上,NMuMG和NT2196的增殖受到二甲双胍处理的影响相似(图2)3.1),而MCF7在较早时间点受到的影响大于MCF10A(图2)3.J)。然而,与未处理的情况相比,所有细胞系在二甲双胍存在的情况下都表现出细胞增殖减少(图2)3.I, J)。总的来说,癌细胞糖酵解的代偿性增加未能在二甲双胍的存在下获得生存优势,这表明这些细胞在二甲双胍的作用下比未转化的对照组受到更大的能量压力,这与转化与ATP需求增加有关的观点是一致的。
细胞对二甲双胍的敏感性取决于参与有氧糖酵解的能力。(a - b)在二甲双胍治疗(0.5mM)后,总呼吸表现为与未治疗条件相比的倍数变化。(c - d)在未治疗和治疗的情况下,线粒体偶联状态表示作为总线粒体呼吸的一部分的偶联和非偶联呼吸。(E-F)葡萄糖的消耗,(G-H)乳酸生成和(i j)二甲双胍(5mm)处理24小时或48小时的活细胞计数表示为未处理条件下的翻倍变化。(K)ddH存在下MCF7细胞在葡萄糖或半乳糖培养基中生长的线粒体呼吸作用20(对照)或二甲双胍(0.5 mM) 24小时。数据归一化为MCF7细胞在无二甲双胍存在的情况下的呼吸速率。(左)线粒体呼吸作用于偶联呼吸和非偶联呼吸的分数计算如C-D所示。(M)在半乳糖培养基中,二甲双胍(0.5或5.0 mM)处理24,48和72小时,MCF7细胞的活细胞计数表示为未处理条件下的两倍变化。为(模拟)数据以均数±SEM表示。N = 4,其中*P< 0.05,学生的t -测试。为(E-J, L, M),数据以均数±SEM表示。N = 3, #和*P< 0.05,学生的t -其中*表示与未处理条件相比的显著变化,#表示指示细胞系之间的显著变化。为(K),数据以均数±SEM表示。N = 3, #和*P< 0.05,学生的t -其中*表示与葡萄糖不含二甲双胍时MCF7细胞呼吸速率相比有显著变化,#表示与半乳糖不含二甲双胍时MCF7细胞呼吸速率相比有显著变化。
这些数据的一个重要含义是,持续向细胞供应葡萄糖对于通过促进有氧糖酵解来减轻二甲双胍引起的能量应激至关重要。因此,我们测试了那些被迫完全依赖线粒体代谢产生ATP的细胞是否对二甲双胍更敏感。我们在用半乳糖代替葡萄糖的培养基中培养人乳腺癌细胞(MCF7) [36]。与在葡萄糖培养基中生长的MCF7细胞相比,在半乳糖培养基中生长的MCF7细胞显示出大约两倍的线粒体呼吸增加(图2)3.重要的是,在半乳糖培养基中生长的MCF7细胞比在葡萄糖培养基中生长的MCF7细胞将更大比例的呼吸用于ATP的产生(图2)3.这些结果验证了实验设计,表明与在葡萄糖中生长的细胞相比,在半乳糖存在下生长的癌细胞增加了线粒体呼吸,并提高了用于支持ATP生产的线粒体呼吸的比例(图1)3.K, L)。二甲双胍导致葡萄糖培养基中生长的MCF7细胞呼吸减少约20%(图2)3.然而,当MCF7细胞在半乳糖培养基中生长时,二甲双胍对线粒体呼吸的影响更深远,二甲双胍治疗后,线粒体呼吸减少了两倍以上(图2)3.二甲双胍导致在葡萄糖或半乳糖中生长的MCF7细胞的非偶联呼吸比例显著增加(图2)3.然而,二甲双胍对半乳糖中生长的MCF7细胞的非偶联呼吸比例的影响要比葡萄糖大得多,因为在基线时,这些细胞比葡萄糖中生长的MCF7细胞更偶联(图2)3.重要的是,在半乳糖培养基中生长的MCF7细胞,暴露于5 mM二甲双胍中48小时,比在葡萄糖培养基中生长的MCF7细胞表现出明显更多的细胞死亡(图1)3.J, M)。总之,这些结果表明,由于限制葡萄糖水平而不能进行有氧糖酵解的细胞完全依赖线粒体来产生ATP,因此更容易受到二甲双胍的影响。
二甲双胍通过柠檬酸循环减少葡萄糖代谢
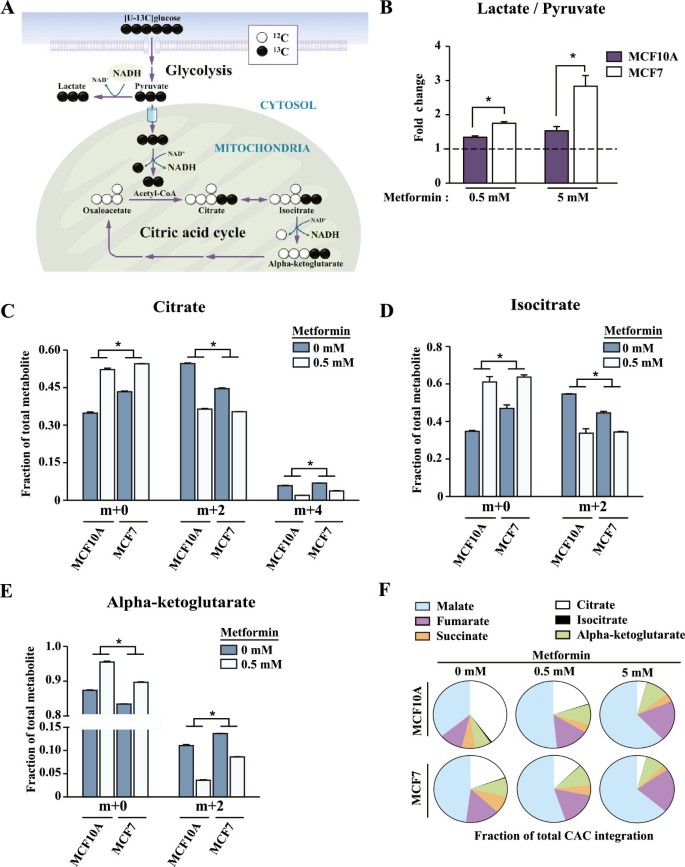
二甲双胍导致乳腺癌细胞以及未转化对照组的线粒体呼吸减少(图2)2和3.)。鉴于电子传递链的活性与柠檬酸循环之间的密切联系[33,37,38],我们研究了二甲双胍通过柠檬酸循环对MCF10A和MCF7细胞葡萄糖代谢的影响。为了解决这个问题,我们使用[U-]进行了稳定同位素示踪分析136个碳(m + 6)标记的葡萄糖。葡萄糖(m + 6)通过糖酵解生成丙酮酸(m + 3)4A)。然后,丙酮酸(m + 3)可以通过有氧糖酵解转化为乳酸(m + 3),或者通过线粒体代谢转化为柠檬酸循环中间体(m + 2)(图2)4A)。二甲双胍通过MCF7癌细胞和对照组的柠檬酸循环,降低了柠檬酸盐、异柠檬酸盐和α -酮戊二酸盐(m + 2)的标记(图2)4一部)。这些数据表明,与未处理的细胞相比,二甲双胍处理的细胞进入线粒体代谢的葡萄糖更少。此外,暴露于二甲双胍后,柠檬酸循环中间体在柠檬酸循环中所占的比例发生了很大变化(图2)4事实上,二甲双胍处理的细胞在柠檬酸循环中表现出柠檬酸盐的减少和苹果酸盐的增加(图2)4F).与MCF7细胞相比,MCF10A细胞在二甲双胍处理后表现出更剧烈的柠檬酸循环重排,这支持了线粒体代谢高的细胞对二甲双胍代谢反应更强的观点。与线粒体中葡萄糖代谢的减少相反,二甲双胍引起癌细胞和对照组细胞内乳酸与丙酮酸比值的增加,说明二甲双胍刺激有氧糖酵解(图2)4B).这一结果与图中数据一致3.使用不同的技术。在全球范围内,这些实验表明,用二甲双胍处理的癌细胞增加了糖酵解的活性,同时降低了线粒体柠檬酸循环的活性。
二甲双胍通过柠檬酸循环降低葡萄糖代谢。(一)图示葡萄糖碳流进入糖酵解和柠檬酸循环(CAC)。示踪代谢物如[U-]的使用13C]葡萄糖中所有碳(12C,白色)被13C(黑色圆圈)允许通过气相色谱/质谱(GC/MS)分析和同位素富集来测量CAC活性。(B-F)ddH处理MCF7和MCF10A细胞2O(对照组)或二甲双胍(0.5 mM或5.0 mM) 24小时。然后用[U-]孵育细胞13C]葡萄糖(m + 6) 1小时。(B)二甲双胍治疗诱导的细胞内乳酸与丙酮酸比值,显示为与未治疗条件相比的倍数变化。(C)柠檬酸(m + 2)和(m + 4)富集;(D),异柠檬酸盐(m + 2)(E)α -酮戊二酸(m + 2)与[U-]孵育13[C]葡萄糖和定量的质量同位素分布。(F)二甲双胍治疗后CAC中间体重组。每个单独CAC中间体的所有同位素体的离子强度之和归一化为所有组合CAC中间体的所有同位素体的离子强度之和。为抵扣,数据以均数±扫描电镜(SEM)表示,其中3个独立实验分别用于对照和0.5 mM二甲双胍处理,2个独立实验用于5.0 mM二甲双胍处理。*P< 0.05,学生的t以及。为F,数据为一项代表性实验的平均值,该实验分为三次,分别为对照和0.5 mM二甲双胍处理的三个独立实验,以及5.0 mM二甲双胍处理的两个独立实验。CAC:柠檬酸循环。
二甲双胍降低分离线粒体的呼吸作用
二甲双胍对细胞线粒体代谢有深远的影响(图2)2,3.和4)。为了评估二甲双胍是否可以直接作用于线粒体,我们使用从小鼠骨骼肌中分离的线粒体测试了二甲双胍对分离线粒体悬液呼吸的影响(图2)5)或MCF10A和MCF7单元[参见附加文件]1、附加文件2:图S2和S3]。用RCR值来评估线粒体悬液的质量,RCR值是通过将线粒体积极合成ATP(状态3)时的耗氧量除以它们驱动质子泄漏反应(状态4)时的耗氧量得到的[39]。从小鼠骨骼肌中分离的线粒体悬液质量高,RCR值在10以上(图2)5A、B)。
二甲双胍直接作用于线粒体抑制呼吸。(a - b)小鼠骨骼肌分离线粒体实验设计。用复合物I(苹果酸盐和丙酮酸盐)或复合物II(琥珀酸盐和鱼藤酮)底物孵育线粒体。典型的呼吸控制率(RCR)值显示了线粒体在复合体I或复合体II底物上呼吸。有底物存在的呼吸作用称为状态2。有ADP存在时线粒体利用ADP制造ATP的呼吸作用称为状态3。低霉素存在时,线粒体驱动质子泄漏反应的呼吸作用称为状态4。FCCP刺激非耦合呼吸,代表最大呼吸量。RCR值通过将状态3的呼吸速率除以状态4的呼吸速率来计算,并指示线粒体悬液的完整性。(氟)从小鼠骨骼肌中分离的线粒体与配合物I孵育(C, E)或复合体II(D, F)底物并用ddH处理2O(对照)或二甲双胍(2mm)(E-F).呼吸速率表示为与未经处理的线粒体的折叠差异。数据以均数±SEM表示。n = 3。*P< 0.05,学生的t -测试。
为了探究二甲双胍对线粒体的影响,我们使用了与复合物I或II底物孵育的线粒体。比较二甲双胍对与复合体I或复合体II底物培养的线粒体呼吸速率的影响,可以确定二甲双胍是否作用于复合体I或复合体II,因为复合体III到V都参与复合体I和复合体II依赖的呼吸。二甲双胍降低了状态3和状态4呼吸,以及线粒体在复合体I底物上呼吸的最大呼吸量(图2)5C,E),但当线粒体在复合体II底物上呼吸时,对这些参数没有显著影响(图2)5D, F)。最后,二甲双胍还能显著降低MCF7和MCF10A细胞分离线粒体中复合体i依赖性呼吸1、附加文件2:图S2和S3]。总之,这些结果表明二甲双胍可以直接作用于线粒体并限制复杂的i依赖呼吸。
二甲双胍降低了分离线粒体的柠檬酸循环活性
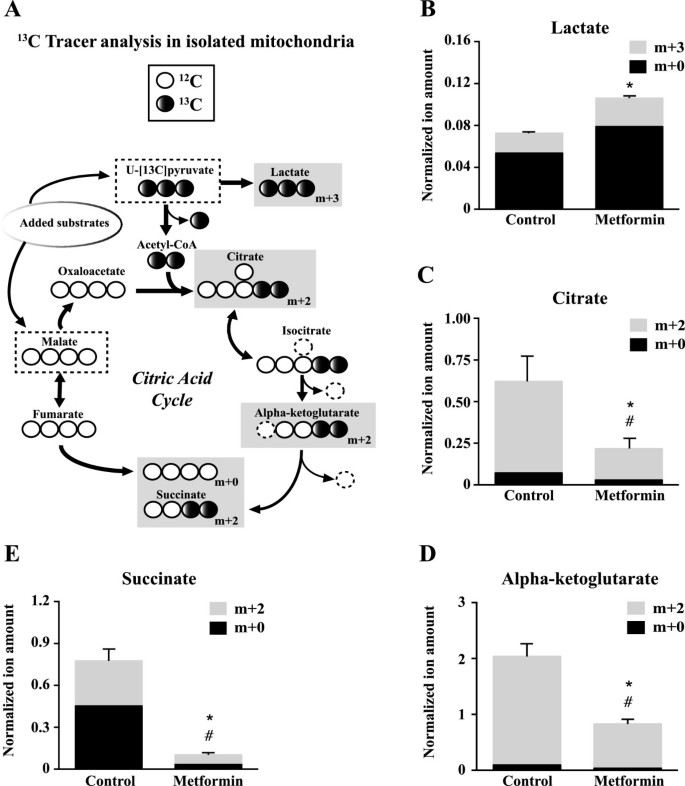
鉴于二甲双胍可以直接抑制分离线粒体中复杂i依赖的呼吸,我们评估了二甲双胍是否可以通过在完整细胞中观察到的柠檬酸循环影响底物的代谢(图2)4)。为了做到这一点,我们在分离的线粒体中进行了稳定同位素示踪实验[34]。线粒体用标记物孵育丙酮酸盐(m + 3)和未标记的苹果酸盐(图6一个)。丙酮酸(m + 3)生成m + 2个柠檬酸循环中间体(图2)6一个)。鉴于乳酸脱氢酶与骨骼肌线粒体相关,丙酮酸(m + 3)也可生成乳酸(m + 3) [40]。二甲双胍降低了m + 2柠檬酸盐、α -酮戊二酸盐和琥珀酸盐的生成(图2)6C-E),说明丙酮酸通过柠檬酸循环的代谢减少。在二甲双胍治疗期间,柠檬酸循环中丙酮酸用量的减少伴随着乳酸生成的增加(m + 3;数字6B),证明丙酮酸从线粒体代谢中转移。因此,经过二甲双胍处理后,完整细胞中丙酮酸通过柠檬酸循环的代谢减少(图2)4)可以在分离的线粒体中捕获(图2)6)。
二甲双胍抑制离体线粒体中柠檬酸循环活性。线粒体用[U-]孵育13[C]丙酮酸盐(m + 3)和未标记苹果酸盐在ddH存在下2O(对照组)或二甲双胍(5mm)治疗30分钟。(一)稳定同位素示踪剂实验示意图,使用的底物均匀标记为[U-]13[C]丙酮酸和未标示的苹果酸。在B-E中分析的代谢物被放入灰色盒子中,其中同位素富集写为m + k在哪里k的数量是多少?13C(黑色圆圈)。(B)乳酸的富集(m + 3);(C)柠檬酸盐(m + 2);(D)-酮戊二酸盐(m + 2)和(E)琥珀酸盐(m + 2),通过GC/MS分析质量分布。数据以标准化离子量表示,离子量代表质量同位素体分布(MID) ×校正面积的值。数据以均数±SEM表示。n = 3。*P< 0.05,学生的t-test (m + 2或m + 3)。#P< 0.05,学生的t-test (m + 0)。
讨论
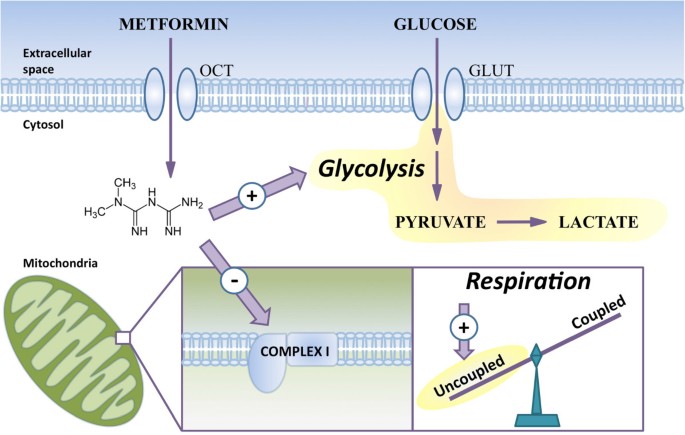
尽管二甲双胍广泛用于治疗II型糖尿病,并且正在研究其在癌症治疗中的可能效用,但其对细胞和线粒体代谢的影响尚不完全清楚。我们发现二甲双胍直接作用于线粒体,抑制复合i介导的线粒体呼吸和柠檬酸循环功能。与我们从分离的线粒体中获得的结果一致,二甲双胍处理的细胞通过柠檬酸循环显示葡萄糖代谢减少,此外还显示线粒体呼吸的总体减少,以及有利于解偶联反应的转变。因此,线粒体代谢变得能量效率低下,细胞通过增加有氧糖酵解来补偿ATP产生的这种限制(图2)7)。
我们的研究结果证实,线粒体是二甲双胍的关键靶点,尽管有报道称其在细胞质中起作用[11,13]。这与先前的证据一致,即复合物I具有抑制作用,同时线粒体基质内带正电荷的药物在膜电位驱动下积聚[14]。我们的数据反对二甲双胍对线粒体的间接作用[9]。当这篇手稿还在准备的时候,Chandel小组的一项研究表明,二甲双胍能够限制肿瘤的生长在活的有机体内取决于线粒体复合体I [41]。此外,Hirst小组的一项研究表明,二甲双胍可以限制纯化复合物I的活性[42]。这些论文支持我们的数据,显示二甲双胍对线粒体呼吸的直接影响。
有临床[43]和实验性的[44证据表明,与许多抗糖尿病药物相比,二甲双胍的使用与适度的体重减轻有关。这与我们观察到的二甲双胍导致线粒体代谢效率低下是一致的,正如不耦合呼吸的比例增加所证明的那样。经典解偶联剂也会导致线粒体代谢效率低下,并已被证明能显著减轻体重,但其毒性太大,不适合临床使用。45]。有趣的是,最近的临床前研究表明,将解偶联剂DNP靶向肝脏(由于口服给药后的药代动力学,肝脏是受二甲双胍影响最大的器官)可降低毒性[46]。然而,重要的是要认识到,尽管二甲双胍导致线粒体代谢效率低下,但不应将其视为经典的解偶联剂。
最近有研究表明,对低糖更敏感的癌细胞在氧化磷酸化(OXPHOS)调控上存在缺陷,对双胍类化合物更敏感[16]。由于细胞需要依赖由线粒体代谢的替代燃料来源,因此低糖条件对显示强大线粒体能力的细胞是有利的[38,47]。此外,由于双胍类药物抑制线粒体代谢,加剧了对低糖敏感的细胞的OXPHOS缺陷,这解释了它们在低糖条件下对二甲双胍更敏感的原因[16]。我们发现,在没有葡萄糖和有半乳糖的情况下培养的细胞显示出线粒体代谢增加,并且对二甲双胍的影响比在有葡萄糖的情况下培养的细胞明显更敏感。也有研究表明,在没有葡萄糖和谷氨酰胺存在的情况下生长的癌细胞比在有葡萄糖存在的情况下生长的细胞更受二甲双胍治疗的影响[48]。总之,这些数据支持二甲双胍抑制OXPHOS的观点,因此,被迫依赖OXPHOS的细胞更容易受到二甲双胍作用的影响。此外,这些数据表明,在抑制OXPHOS的情况下,癌细胞通过增加糖酵解来进行补偿。我们证明,当二甲双胍抑制OXPHOS时,无论是在分离的线粒体中还是在完整的细胞中,柠檬酸循环都被抑制,并接受更少的葡萄糖碳,从而有利于乳酸的产生。重要的是,如果这种补偿受到葡萄糖缺乏或抑制驱动糖酵解的癌基因的限制[29,49],即使存在其他需要线粒体功能生成ATP的营养物质,细胞的生存能力也会受到威胁。
虽然使用二甲双胍在癌症中诱导能量应激的概念很有吸引力,但必须考虑药代动力学问题。传统的抗糖尿病剂量的二甲双胍在肿瘤组织中达到有效浓度是不清楚的。许多癌症表达细胞表面转运分子,如OCT1,这是细胞在低环境药物浓度下摄取所必需的,其水平远低于药物活性所在的肝脏。然而,一旦进入细胞,来自癌细胞的线粒体的更大的膜电位[50,51与来自未转化细胞的线粒体相比,线粒体应该促进二甲双胍的摄取。因此,尽管高剂量的二甲双胍有一些在活的有机体内抗肿瘤活性[8],它可能被认为是药物动力学优化的“先导化合物”,可能应用于肿瘤学。
结论
我们证明二甲双胍直接作用于线粒体以限制柠檬酸循环活性和OXPHOS,正如在分离的线粒体和完整细胞中所证明的那样。二甲双胍介导的线粒体功能下降伴随着糖酵解代偿性增加。因此,细胞对二甲双胍的敏感性取决于它们进行有氧糖酵解的能力。因此,双胍类化合物可以潜在地用于肿瘤学,利用癌细胞的代谢脆弱性。
缩写
- BSA:
-
牛血清白蛋白
- CAC:
-
柠檬酸循环
- DMEM:
-
Dulbecco 's Modified Eagle Medium
- EGTA:
-
乙二醇四乙酸
- GC / MS:
-
气相色谱/质谱分析
- 玫瑰:
-
(4) - 2-hydroxyethyl 1-piperazineethanesulfonic酸
- 高能:
-
人表皮生长因子
- 中期:
-
质量同位素分布
- 10月:
-
有机阳离子转运体
- OXPHOS:
-
氧化磷酸化
- PBS:
-
磷酸盐缓冲盐水
- 软:
-
呼吸控制比
- SIM卡:
-
单离子监测。
参考文献
Bosi E:二甲双胍——治疗2型糖尿病的黄金标准:证据告诉我们什么?中国糖尿病杂志,2009,11(增刊2):3-8。
张建军,张建军,张建军。二甲双胍:一种新型口服双胍类药物。中华医学杂志,1996,18:363 -371。10.1016 / s0149 - 2918(96) 80017 - 8。讨论359年
Turner RC:英国前瞻性糖尿病研究。复习一下。糖尿病护理,1998,21(增刊3):C35-C38。
Evans JM, Donnelly LA, Emslie-Smith AM, Alessi DR, Morris AD:二甲双胍降低糖尿病患者患癌症的风险。BMJ。[j] .中国科学:地球科学。10.1136 / bmj.38415.708634.F7。
Giovannucci E, Harlan DM, Archer MC, Bergenstal RM, Gapstur SM, Habel LA, Pollak M, Regensteiner JG, Yee D:糖尿病与癌症的共识报告。中国临床医学杂志,2010,32(1):391 - 391。10.3322 / caac.20078。
Ben Sahra I, Laurent K, Loubat A, Giorgetti-Peraldi S, Colosetti P, Auberger P, Tanti JF, Le Marchand-Brustel Y, Bost F:降糖药二甲双胍通过降低细胞周期蛋白D1水平发挥体内外抗肿瘤作用。中华肿瘤医学杂志,2008,27(2):376 - 386。10.1038 / sj.onc.1211024。
Zakikhani M, Dowling R, Fantus IG, Sonenberg N, Pollak M:二甲双胍对乳腺癌细胞AMP激酶依赖性生长抑制剂的作用。中国癌症杂志,2006,32(6):1069 - 1073。10.1158 / 0008 - 5472. - 06 - 1500。
双胍类化合物在肿瘤中的潜在应用。[J] .临床医学杂志,2013,23(3):393 - 397。10.1172 / JCI67232。
李建军,张建军,李建军,等。二甲双胍对呼吸链复合物的抑制作用研究[J] .中国生物医学工程学报,2002,25(3):444 - 444。10.1074 / jbc.275.1.223。
王丽丽,王丽丽,王丽丽,等。二脲类化合物氧化磷酸化的研究。生物化学学报,2002,23(3):394 - 394。
刘霞,Chhipa RR, Pooya S, Wortman M, Yachyshin S, Chow LM, Kumar A, Zhou xin, Sun Y, Quinn B, McPherson C, VVarnick RE, Kendler A, Girl S, Poels J, Norga K, Viollet B, Grabowski GA, Dasgupta B:独立于AMPK的AMPK受体拮抗剂对mTOR和细胞周期的调控机制。中国科学:自然科学版,2014,31(1):435- 444。10.1073 / pnas.1311121111。
王洪辉,薛磊,姜浩,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。糖尿病,2012,61:1423-1433。10.2337 / db11 - 0961。
欧阳军,张建军,张建军。二甲双胍通过抑制AMP脱氨酶激活AMP激酶。生物化学学报,2011,28(6):1158 - 1158。10.1074 / jbc.M110.121806。
Owen MR, Doran E, Halestrap AP:二甲双胍通过抑制线粒体呼吸链复合物1发挥其抗糖尿病作用的证据。中国生物医学工程学报,2009,32(3):344 - 344。
李建军,李建军,李建军,等。二甲双胍与铜离子结合特性的生物分子作用模式。生物化学学报,2014,35(3):787-795。10.1021 / bi401444n。
Birsoy K, Possemato R, Lorbeer FK, Bayraktar EC, Thiru P, Yucel B,王涛,陈文文,Clish CB, Sabatini DM:肿瘤细胞对葡萄糖限制和双胍类药物敏感性的代谢决定因素。自然科学,2014,38(8):108-112。10.1038 / nature13110。
李建军,李建军,李建军,李建军,等。有机阳离子转运体(OCT)在肠道中的定位及药物特异性研究。中国生物医学工程学报,2005,33(2):591 - 596。10.1016 / j.bcp.2005.09.011。
Foretz M, Hebrard S, Leclerc J, Zarrinpashneh E, Soty M, Mithieux G, Sakamoto K, Andreelli F, Viollet B:二甲双胍通过降低肝脏能量状态独立抑制LKB1/AMPK通路的肝脏糖异生。中国临床医学杂志,2010,32(2):555 - 569。10.1172 / JCI40671。
Hundal RS, Krssak M, Dufour S, Laurent D, Lebon V, Chandramouli V, Inzucchi SE, Schumann WC, Petersen KF, Landau BR, Shulman GI:二甲双胍降低2型糖尿病血糖生成的机制。糖尿病杂志,2000,49:2063-2069。10.2337 / diabetes.49.12.2063。
肖瑞杰,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军。科学通报,2005,31(3):442 - 446。10.1126 / science.1120781。
研究二甲双胍预防和治疗癌症:开始的结束。中华癌症杂志,2012,(2):778-790。2159 - 8290. - 10.1158 / cd - 12 - 0263。
Madiraju AK, Erion DM, Rahimi Y, Zhang XM, Braddock DT, Albright RA, Prigaro BJ, Wood JL, Bhanot S, MacDonald MJ, Jurczak MJ, Camporez JP, Lee HY, Cline GVV, Samuel VT, Kibbey RG, Shulman GI:二甲双胍通过抑制线粒体甘油磷酸脱氢酶抑制糖异生。自然,2014,51(5):542-546。10.1038 / nature13270。
王志强,王志强,王志强,等。肿瘤细胞代谢重编程的研究进展。中华内分泌杂志,2012,23:552-559。10.1016 / j.tem.2012.06.009。
Calabrese C, Iommarini L, Kurelac I, Calvaruso MA, Capristo M, Lollini PL, Nanni P, Bergamini C, Nicoletti G, Giovanni CD, Ghelli A, Giorgio V, caratzzolo MF, Marzano F, Manzari C, Betts CM, Carelli V, Ceccarelli C, Attimonelli M, Romeo G, Fato R, Rugolo M, Tullo A, Gasparre G, Porcelli AM:呼吸复合物I在线粒体缺陷肿瘤细胞中诱导Warburg基因表达的必要条件。中国癌症杂志,2013,31(1):11-10.1186/2049-3002-1-11。
Bhalla K, Hwang BJ, Dewi RE, Ou L, Twaddel W, Fang HB, Vafai SB, Vazquez F, Puigserver P, Boros L, Girnun GD: pgc1 α通过诱导脂肪生成基因表达促进肿瘤生长。中国癌症杂志,2011,31(1):688 - 698。10.1158 / 0008 - 5472. - 11 - 1011。
Deblois G, Chahrour G, Perry MC, Sylvain-Drolet G, Muller WJ, Giguere V: erα和pgc -1 β对ERBB2扩增子转录调控促进乳腺肿瘤发生的作用。中国癌症杂志,2010,32(2):387 - 387。10.1158 / 0008 - 5472. - 10 - 2840。
Klimcakova E, Chenard V, McGuirk S, Germain D, Avizonis D, Muller WJ, St-Pierre J: PGC-1alpha通过调节ErbB2/ neu诱导的乳腺肿瘤的生长。中国癌症杂志,2012,32(2):538- 546。10.1158 / 0008 - 5472. - 11 - 2967。
Tennakoon JB,石勇,韩建军,Tsouko E, White MA, Burns AR,张安,夏霞,Ilkayeva OR, Xin L, Ittmann MM, Rick FG, Schally AV, Frigo DE:雄激素通过ampk - pgc -1 α介导的代谢开关调节前列腺癌细胞的生长。癌症基因,2013,doi:10.1038/onc.2013.463
Vazquez F, Lim JH, Chim H, Bhalla K, Girnun G, Pierce K, Clish CB, Granter SR, Widlund HR, Spiegelman BM, Puigserver P:人类黑色素瘤中线粒体容量增加和氧化应激抵抗的pgc1 α表达亚群。中华肿瘤杂志,2013,23(3):387 - 391。10.1016 / j.ccr.2012.11.020。
Ursini-Siegel J, Rajput AB, Lu H, Sanguin-Gendreau V, Zuo D, Papavasiliou V, Lavoie C, Turpin J, Cianflone K, Huntsman DG, Muller WJ: DecR1表达升高对ErbB2/ neu诱导的乳腺肿瘤的影响。中国生物医学工程学报,2007,27(2):661 - 671。10.1128 / MCB.00686-07。
Fantin VR, St-Pierre J, Leder P: ldl - a表达衰减揭示糖酵解、线粒体生理和肿瘤维持之间的联系。癌症杂志,2006,9:425-434。10.1016 / j.ccr.2006.04.023。
王晓明,王晓明,王晓明,等。pgc -1 α对线粒体电子传递链超氧化物生成速率和结构的影响。中国生物医学工程学报,2011,31(1):444 - 444。10.1016 / j.freeradbiomed.2011.08.036。
Mamer O, Gravel SP, Choiniere L, Chenard V, St-Pierre J, Avizonis D:利用单一稳定同位素稀释分析、硼氘化钠还原和选择离子监测GC/MS分析柠檬酸循环有机酸中间体的完整目标剖面。代谢组学。2013,9:1019-1030。10.1007 / s11306 - 013 - 0521 - 1。
李建军,李建军,李建军,等。动物线粒体稳定性同位素示踪分析。中国生物医学工程学报,2014,41(4):663 - 668。10.3390 / metabo4020166。
Morita M, Gravel SP, Chenard V, Sikstrorn K, Zheng L, Alain T, Gandin V, Avizonis D, Arguello M, Zakaria C, McLaughlan S, Nouet Y, Pause A, Pollak M, Gottlieb E, Larsson O, St-Pierre J, Topisirovic I, Sonenberg N: 4E-BP依赖的线粒体活性和生物发生的翻译调控。中国生物医学工程学报,2013,18(4):698-711。10.1016 / j.cmet.2013.10.001。
李建军,李建军,李建军,李建军,李建军,李建军。线粒体氧化能力的研究进展。中华医学杂志,2004,(4):985-993。10.1158 / 0008 - 5472. - 03 - 1101。
Fendt SM, Bell EL, Keibler MA, Olenchock BA, Mayers JR, Wasylenko TM, Vokes NI, Guarente L, Vander Heiden MG, Stephanopoulos G:细胞中α -酮戊二酸与柠檬酸盐比值的还原性谷氨酰胺代谢功能。网络通讯,2013,4:2236-
Mullen AR, Wheaton WW, Jin ES, Chen PH, Sullivan LB,程涛,杨勇,Linehan WM, Chandel NS, DeBerardinis RJ:还原羧基化对线粒体缺陷肿瘤细胞生长的影响。自然科学,2012,48(1):385-388。
Brand MD, Nicholls DG:评估细胞线粒体功能障碍。中国生物医学工程学报,2011,35(4):557 - 557。10.1042 / BJ20110162。
Elustondo PA, White AE, Hughes ME, Brebner K, Pavlov E, Kane DA:乳酸脱氢酶(LDH)与骨骼肌线粒体的物理和功能关联。生物化学学报,2013,28(2):559 - 563。10.1074 / jbc.M113.476648。
Wheaton WW, Weinberg SE, Hamanaka RB, Soberanes S, Sullivan LB, Anso E, Glasauer A, Dufour E, Mutlu GM, Budigner GS, Chandel NS:二甲双胍抑制肿瘤细胞线粒体复合物I的作用。eLife。2014, 3: e02242-
王丽娟,王丽娟,王丽娟,等。二甲双胍对线粒体氧化磷酸化的影响。生化杂志。2014年,doi: 10.1042 / BJ20140620
王晓明,李晓明,李晓明,李晓明,李晓明,糖尿病预防项目研究:生活方式干预和二甲双胍对2型糖尿病发病率的影响。中华医学杂志,2002,34(4):393- 393。
王晓明,李晓明,李晓明,李晓明,李晓明,糖尿病预防项目研究:生活方式干预和二甲双胍对2型糖尿病发病率的影响。中华医学杂志,2002,34(4):393- 393。
张建军,张建军,张建军,等。2,4-二硝基苯酚(DNP)的临床研究进展。中华医学杂志,2011,7(7):205-212。10.1007 / s13181 - 011 - 0162 - 6。
Perry RJ, Kim T,张晓明,Lee HY, Pesta D, Popov VB, Zhang D, Rahimi Y, Jurczak MJ, Cline GW, Spiegel DA, Shulman GI:肝脏靶向线粒体解偶联剂对高甘油三酯血症、脂肪肝和胰岛素抵抗的逆转作用。中国生物医学工程学报,2013,18(4):744 -748。10.1016 / j.cmet.2013.10.004。
杨春梅,张建军,张建军,张建军,张建军。谷氨酸脱氢酶对胶质母细胞瘤细胞糖代谢和Akt信号通路的影响。中国癌症杂志,2009,29(6):786 - 793。0008 - 5472. - 10.1158 / - 09 - 2266。
Javeshghani S, Zakikhani M, Austin S, Bazile M, Blouin MJ, Topisirovic I, St-Pierre J, Pollak MN:碳源和myc表达对二甲双胍抗肿瘤作用的影响。中国癌症杂志,2012,32(2):657 - 667。10.1158 / 0008 - 5472. - 12 - 2907。
Haq R, Shoag J, Andreu-Perez P, Yokoyama S, Edelman H, Rowe GC, Frederick DT, Hurley AD, Nellore A, Kung AL, Wargo JA, Song JS, Fisher DE, Arany Z, Widlund HR:致癌BRAF通过pgc1α和MITF调控氧化代谢。癌症杂志,2013,23(3):302-315。10.1016 / j.ccr.2013.02.003。
Chen LB:活细胞线粒体膜电位。中国生物医学工程学报,1998,4(4):559 - 561。10.1146 / annurev.cb.04.110188.001103。
李建平,李建平,李建平:线粒体毒性化合物在肿瘤治疗中的应用。中华肿瘤医学杂志,2006,25(4):487 - 497。10.1038 / sj.onc.1209599。
致谢
这项工作得到了加拿大卫生研究院(资助号为MOP-106603)和Terry Fox基金会(资助号为TFF-116128)的资助。我们感谢麦吉尔大学癌症综合研究培训计划(MICRTP)(给SA, M219196C0G), Maysie MacSporran奖学金(给SA, F201699C10), Canderel(给SPG)和qusamac - sant
作者信息
作者及单位
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
SA, SPG, MP和JSP计划实验。SA进行线粒体分离、呼吸实验和细胞培养实验。SPG对细胞和分离的线粒体进行了稳定同位素示踪分析,SA、SPG和JSP对数据进行了分析。所有作者都对数据的解释和写作做出了贡献,所有人都阅读并批准了最终的手稿。
电子补充资料
40170 _2014_130_moesm1_esm.pdf
附加文件1:补充实验程序。二甲双胍和呼吸对培养细胞的急性治疗。从培养细胞中分离线粒体。分离线粒体的孵育和监测呼吸。(pdf 78kb)
40170 _2014_130_moesm2_esm.pdf
附加文件2:图S1:与图相关3.A和图3.B;二甲双胍急剧降低细胞呼吸。悬浮细胞分别用ddH处理2O(对照)或二甲双胍(5mm),在37℃的环境中浸泡15分钟2室。立即检测(A)线粒体、(B)偶联呼吸和(C)非偶联呼吸。N = 3, *P< 0.05,学生的t以及。耗氧率表示每1 × 10分钟归一化的耗氧变化(图表单位)6细胞,其中1个图表单位是0.2%的氧气。图S2。与图4;二甲双胍减少从培养细胞中分离的线粒体的呼吸作用。(A-B)从MCF10A和MCF7细胞分离的线粒体与任一ddH孵育2O(对照)或二甲双胍(10 mM)在37°C水浴中,在复合物I底物(苹果酸盐和丙酮酸盐)存在下,浸泡30分钟。立即测试呼吸作用(状态2),然后添加ADP(状态3)和寡霉素(状态4),如痕量上方的箭头所示。(C-D)折叠变化值表示孵育但未经处理的线粒体的折叠变化。N = 3, *P< 0.05,学生的t以及。图S3。与图4;二甲双胍在分离的线粒体中以时间依赖性的方式减少呼吸作用。从小鼠骨骼肌中分离的线粒体在37°C的呼吸室中孵育,在复合底物I的存在下:苹果酸盐、丙酮酸盐和寡霉素(状态4),并添加任一ddH2O(对照)或二甲双胍(10 mM),并在t = 0时立即记录(A)。(B)记录期结束时(t = 20 min)呼吸的变化以倍数变化值表示。在状态2条件下(苹果酸盐和丙酮酸盐)(C)重复实验,并从孵育但未处理的线粒体计算折叠变化值(D)。N = 3, *P< 0.05,学生的t以及。(pdf 96 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Andrzejewski, S., Gravel, SP., Pollak, M.。et al。二甲双胍直接作用于线粒体,改变细胞生物能量学。癌症金属底座2, 12(2014)。https://doi.org/10.1186/2049-3002-2-12
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/2049-3002-2-12
关键字
- 二甲双胍
- 线粒体
- 呼吸
- 复杂的我
- 癌症
- 新陈代谢
- 柠檬酸循环