摘要
背景
乳香的挥发分(Boswellia骶骨提取油胶,制备纳米乳,并对肺癌A549细胞进行抗肺癌作用试验。首先,用水蒸馏的方法分离出挥发性成分(精油),通过气相色谱法分析其主要挥发性成分。然后,在丙二醇(PG)的存在下,将油配制成两种不同的水基纳米乳液,并在配方步骤中作为助表面活性剂使用。研究了纯挥发油及其主要挥发物(α-蒎烯)、两种纳米乳剂和参考药物(阿霉素)对肺癌A549细胞和WI-38正常肺细胞的抑制作用。评估包括细胞毒性(MTT和IC)50)、凋亡(流式细胞分析),以及与凋亡和存活途径相关的一些内在和外在基因的遗传评估。
结果
乳香精油的色谱分析表明,α-蒎烯是乳香精油的主要挥发性成分,约占乳香精油的60%。采用低能技术对油进行乳化,得到的纳米乳液具有主要的强粒子密度(85-90%),z平均直径低于20.0 nm。乳香油纳米乳对肺癌A549细胞的细胞毒活性在不同潜伏期均优于无PG纳米乳、α-蒎烯纳米乳和参比药物阿霉素纳米乳。流式细胞分析还表明,含pg的纳米乳对癌细胞的诱导凋亡作用优于其他配方和纯油。研究发现,同样的纳米乳可上调促凋亡基因[DR5、FAAD、Caspase 8 (Cas8)、p53和Bax],下调抗凋亡和复发基因(Bcl-2、NF-kB和STAT-3)。最重要的是,含pg的纳米乳对正常WI-38肺细胞的细胞毒性作用最小。
结论
这些结果表明,乳香精油(富含α-蒎烯)及其pg -纳米乳是一种很有潜力的植物源辅助剂,可增强系统抗肺癌药物的活性。
背景
肺癌约占全球所有新发癌症病例的13%,无论男女。2021).它分为两个主要的组织学组,包括小细胞肺癌,占所有肺癌的15%,和非小细胞肺癌,占所有肺癌的85% (Suster和Mino-Kenudson)2020).后者进一步分为腺癌、鳞状细胞癌和大细胞癌三个亚组(Rodriguez-Canales等。2016).
肺癌的初级治疗依赖于手术治疗(Hoy等。2019).此外,术后患者可能接受额外的辅助治疗(Passiglia等。2021).这包括化疗(Li et al。2022)、放射治疗(Khalifa et al。2021)、免疫疗法(Xue et al。2022)、激素疗法(Titan et al。2020)和靶向治疗(Tan et al。2022).
除了前面提到的肺癌治疗中采用的系统程序外,植物化学物也作为辅助剂出现,可以补充参与治疗方案(Nguyen et al。2021;辛格et al。2021;Bittoni et al。2021).植物化学物质是从植物中提取的化合物,从很早以前就在民间医学中使用。如今,不同的植物性抗癌药物在药物标记中被商业化,包括vinplastine,依托泊苷,紫杉醇和喜树碱(黄等。2021;Omara et al。2020).与合成药物相比,这些药物具有天然同一性、效率相当、副作用小等优点。
乳香油胶树脂被认为是一种很有前途的植物化学物质来源,具有多种药用特性(Kieliszek等。2020).油胶是一种渗出物,通过敲打一些属的树木的树干而获得Boswellia.乳香的抗癌活性植物化学原理被确定为乳香酸(Katragunta et al。2019).它们是在乳香的非挥发性部分中发现的五环萜类分子家族。该家族由6个成员组成,显示出不同的抗炎药物活性(Börner等。2021),阿莱希默(Siddiqui et al.)。2021),不同类型的癌症(Efferth和Oesch,2020),包括肺癌(Lv et al。2020).
除了非挥发性成分中的乳香酸外,乳香还含有一种挥发性油成分(称为精油),占油胶的5-15% (Mertens等。2009).不同种类的乳香精油(FEO)显示出作为癌症相关疲劳的支持性治疗的潜力(Reis and Jones2018).此外,不同的研究报道了FEO通过不同的机制途径对各种类型癌细胞的抑制活性(Hakkim et al。2020;任等。2018;Suhail et al。2011).
尽管上述研究的多样性与其他同类研究相比(Yoo et al。2020),我们注意到目前还没有关于FEO的结论性研究,而FEO是专门针对肺癌的。
全世界肺癌新病例、死亡病例和残疾调整生命年的数量都在上升。例如,与1990年相比,2017年这一数字增长了两倍(邓等人。2020).因此,本研究拟就此方向进行体外综合研究,进一步揭示FEO作为潜在的抑癌植物化学物质的活性。本研究还将评估FEO纳米乳配方对其抗癌活性的影响,包括凋亡和基因调控,包括控制生存途径。纳米乳被用作输送系统,因为它的水基性质允许静脉给药、更好的细胞毒性、增强的治疗特性、在血液中的循环时间长,以及其他治疗好处(Wilson等。2022;Ceramella et al。2021).这是由于它们的颗粒尺寸小,通常在100纳米范围内。常用的制备纳米乳的方法包括低能量(Edris2021)和高能(Falleh et al。2021)技术。在目前的工作中,由于低能量技术的不同优点,在前面的参考文献中已经讨论了。
材料和方法
材料
乳香oleogum (Boswellia骶骨),等级为“Hougari, Fig.”1“是从位于阿曼苏丹国佐法尔地区萨拉拉市的“鲁班市场”购买的。
Cremophor®RH40 (PEG-40氢化蓖麻油)和丙二醇(PG)从美国Sigma Aldrich购买。葵花籽油是从当地市场获得的。
肺癌A549细胞株和正常肺WI-38细胞株购自VCSERA提供的American Type Culture Collection (ATCC)。
FEO精油的分离
采用水蒸馏法分离乳香精油。将不同批次的乳香胶(每批100克)磨成翅粉,并与1000毫升蒸馏水混合(每批)于配备clevenger型仪器的5L圆底烧瓶中。使用电热套(电热EM 3000/CE)将胶粉和水连续煮沸2.5小时。蒸馏过程结束时,蒸汽被浓缩,精油作为上层从Clevenger装置的侧臂上收集。最后,收集的油在无水硫酸钠上干燥,称重,并在- 4°C保存在深色玻璃小瓶中,直到分析。
FEO挥发性成分的表征
采用气相色谱法(GC-FID)和气相色谱-质谱法(GC-MS)对FEO的主要挥发性成分进行分离和鉴定。安装火焰电离检测器的气相色谱仪为美国Berkin Elmer Auto system XL。GC - ms分析采用美国安捷伦8890型GC、5977B GC/MSD系统。我们之前的研究(Abd-Rabou和Edris)详细描述了该过程的细节,包括分析条件、分离毛细管柱的规范,以及挥发性化合物的识别方法2021).
FEO纳米乳液的制备
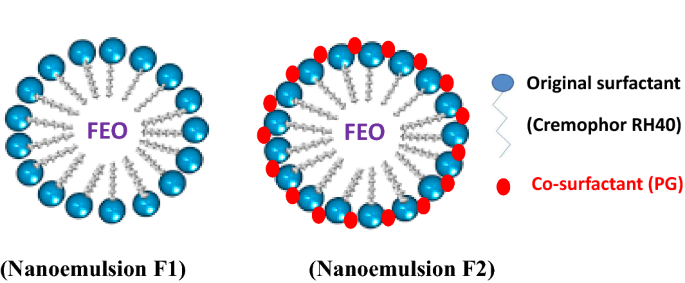
制备了两种FEO纳米乳(F1)和(F2),以评价其抗肺癌活性。纳米乳F1由FEO(5.0%)、葵花籽油(1.0%)、Cremophor RH40(6.0%)和水(88.0%)组成。同样,纳米乳F2由FEO(5.0%)、葵花籽油(1.0%)、Cremophor RH40(6.0%)、水(87.0%)和额外的成分,即丙二醇PG(1.0%)作为助表面活性剂组成。
采用低能乳化技术制备了两种纳米乳液。简单地说,除了水之外,所有的成分都被紧密地混合在玻璃小瓶中,然后用磁棒轻轻搅动滴定到水中,形成自发的FEO纳米乳液。在我们之前的研究(Abd-Rabou和Edris)中指出了乳化过程的详细描述2021).
FEO纳米乳液的表征
目视检查
用肉眼在明亮的白光下观察纳米乳样品,以检测其透明度和乳白色的一般外观,这是纳米乳形成的初步迹象。在6个月的贮存期内定期进行目视检查。
粒度分析
在室温下平衡1周后,使用动态光散射仪器Zetasizer (Nano-ZS ZEN3600型,Nanoseries, Malvern Instruments, UK)测量纳米乳液的粒径。样品制备和测量条件的细节在我们之前的相关调查(Abd-Rabou和Edris2021).
透射电镜(TEM)
采用透射电镜(Philips CM-10 FEI, In。,希尔斯伯勒,OR,美国)。将每种纳米乳的50 μ l滴入formvar涂层的铜网格中,晾干。然后,用2% w/v醋酸铀酰作为阴性染色剂对样品进行染色。使用埃及NRC的数字显微镜和软成像查看器软件(电子显微镜联合服务)进行图像捕获和分析。
物理稳定性
将每一种新制备的纳米乳液取等量(10毫升)的样品置于透明的螺旋盖玻璃小瓶中,并在室温(25°C±2)下直立放置6个月。在此期间,对样品进行定期目视检查,以观察物理不稳定性的任何方面,如油分离或乳化。在贮藏期结束时再次进行粒度分析,以进一步确认纳米乳颗粒的稳定性。
癌症细胞培养
肺癌A549细胞系和正常肺WI-38细胞系在添加10%热灭活胎牛血清(Gibco)、100 U/ml的链霉素和100 U/ml的青霉素(Gibco)的RPMI 1640培养基(Gibco)中培养,37℃,5%湿润CO2的气氛。
细胞增殖实验
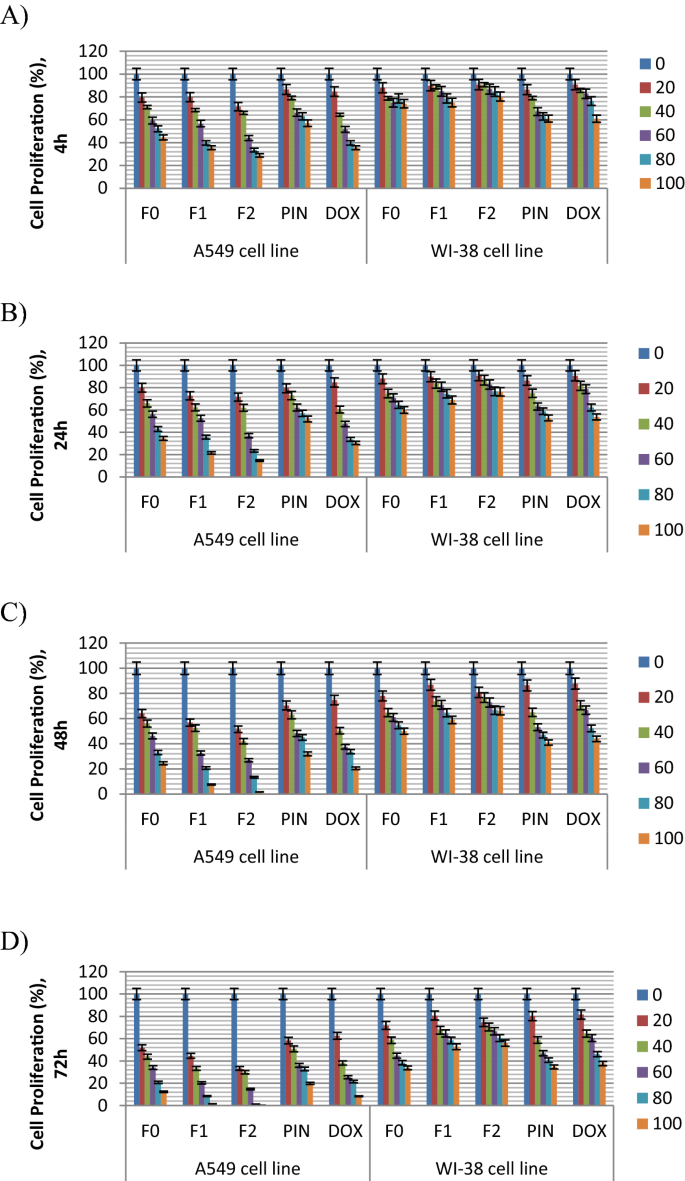
所有配方均采用MTT细胞毒性试验(van Meerloo等。2011)使用肺癌A549细胞和正常肺WI-38细胞。细胞以1 × 10的密度接种于96孔板中4细胞/孔孵育4 h、24 h、48 h和72 h。然后,分别用0、20、40、60、80和100 μ g/ml FEO(记为F0)、FEO纳米乳(F1、F2)、α-蒎烯(记为PIN)和参比药物阿霉素(记为DOX)处理细胞。另一方面,对照细胞用加入PBS的培养基处理。用MTT试剂1 mg/ml, 37℃孵育4 h后弃用。用100毫升DMSO溶解形成的福马赞晶体,然后孵育和摇晃。最后,用多板读卡器在吸光度a处进行比色分析540nm。计算细胞增殖率(%),并与对照组进行比较。
测定半抑菌浓度及倍变
半最大抑制浓度(IC50)值,通过使用多项式浓度-响应曲线拟合模型(OriginPro 8软件)绘制A549和WI-38细胞存活率与样品浓度的比值。IC的折叠变化50计算所有细胞的FEO纳米乳相对于干净的未配制的纯FEO (F0)和阳性对照(参考药物,DOX)的值。
基于流式细胞术的细胞凋亡分析
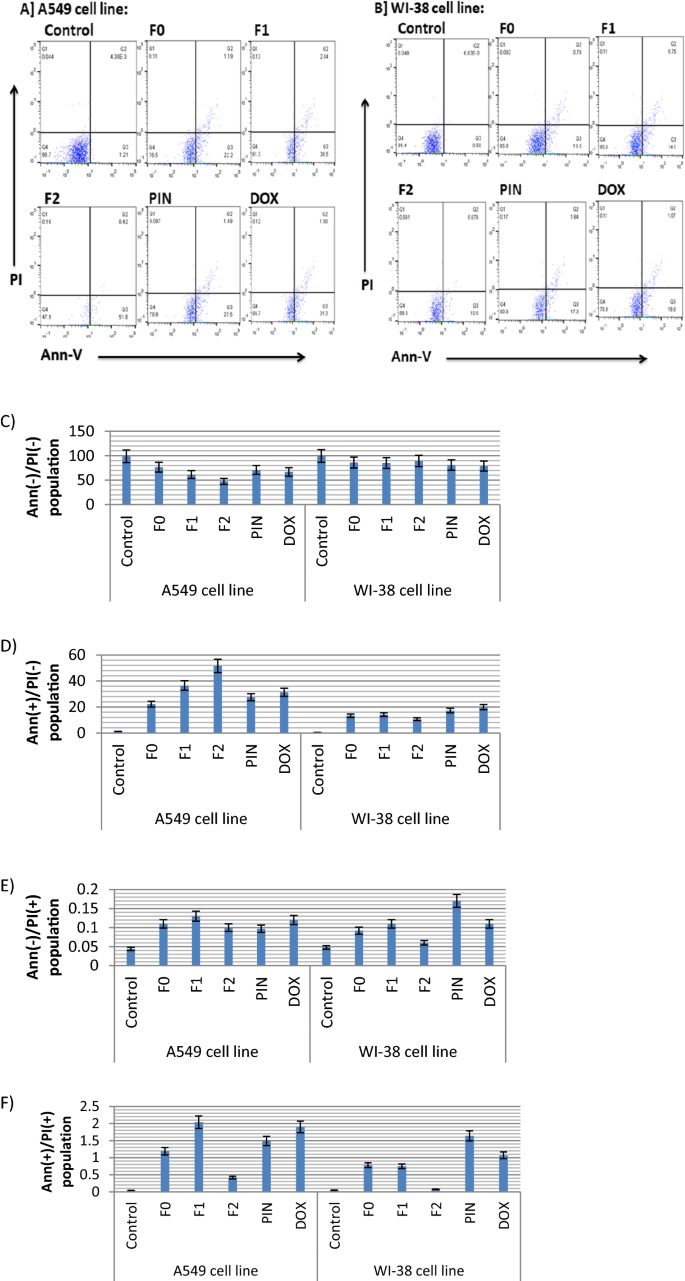
流式细胞术检测早期和晚期凋亡细胞分布及健康人群。肺癌细胞A549与正常WI-38细胞按1 × 10密度进行转染6细胞孵育24 h。细胞用IC处理50对F0、F1、F2、PIN和DOX进行孵育24 h。1天后,所有细胞均用Annexin V FITC和碘化丙啶(PI)染色(Thermo Scientific)。用流式细胞仪(Beckman Coulter Instrument, USA)分析处理和未处理细胞的凋亡情况。每个样本记录了25,000个事件。用流式细胞仪测量细胞凋亡分布,并用FlowJo-V10软件进行分析。
定量逆转录聚合酶链反应(qRTPCR)
总RNA提取:以1 × 10的密度提取A549和WI-38细胞总RNA6细胞使用Invitrogen RNA纯化试剂盒(Thermo Fisher)根据制造商的协议。细胞应用IC50用Nanodrop Technologies以260/280的比例评估RNA的浓度和纯度。
RNA转化为cDNA: 1 μg总RNA使用RevertAid第一链cDNA合成试剂盒(美国赛默飞世尔科学公司)按照制造商说明合成第一链cDNA。
Real-Time PCR反应:除了每个基因的正向引物和反向引物外,还使用购买于(Qiagen, USA)的MiScript SYBR Green PCR试剂盒进行实时定量PCR。DR5、FAAD、Caspase 8 (Cas8)、p53、Bax、Bcl-2、NF-kB和STAT-3基因的正向(F)和反向(R)引物相对于GAPDH作为管家基因的核酸序列见表1.
Real-time PCR混合液由SYBR PCR Master Mix 10 μl、F引物1 μl、R引物1 μl、cDNA 1 μl和Rnase-free水7 μl组成,总体积为20 μl。扩增条件和循环计数为初始qPCR步骤的温度为95℃,持续15分钟,然后在95℃变性30 s, 55℃退火30 s, 72℃延伸30 s,循环35次。在qPCR后进行融化曲线,以显示感兴趣基因的特异性扩增。使用比较2−ΔΔCtGAPDH基因来规范表达水平。ΔΔCT为平均值ΔCT(治疗组)与平均值ΔCT(对照组)之差,其中ΔCT为每个样本中感兴趣CT基因的平均值与CT内控基因的平均值之差。
ROS标记物的测定
一氧化氮(NO)
使用F0、F1、F2、PIN和DOX处理后,根据Abd-Rabou等(2020).一氧化氮(NO)被迅速氧化成亚硝酸盐和硝酸盐,用来定量生产NO。两株细胞均在96孔板中培养,培养密度为1 × 104细胞/。第二天,IC50在培养基中加入所建议的处理剂量。硝酸盐还原酶首先用于将硝酸盐转化为亚硝酸盐。然后,用Griess试剂将亚硝酸盐转化为深紫色偶氮化合物。偶氮发色团的含量准确反映了样品中NO的含量。最后,使用microplate reader (BMG Labtech, Germany)在540 nm处测量光密度。
诱导型一氧化氮合酶(iNOS)
A549和WI-38细胞经F0、F1、F2、PIN、DOX处理后,采用酶联免疫吸附测定试剂盒(武汉法恩生物技术有限公司)测定iNOS酶活性。所提供的微量滴定板已预先涂有靶材。在反应过程中,样品或标准物中的靶物与固相载体上的固定数量的靶物竞争靶物特异性生物素化检测抗体上的位点。将多余的偶联物和未结合的样品或标准物从培养皿中洗掉,将HRP-Streptavidin (SABC)添加到每个微孔中孵育。然后将底物溶液添加到每个孔中。终止酶-底物反应,在吸光度A处用分光光度法测定颜色变化450nm。然后通过比较样品的吸光度和标准曲线来确定样品中iNOS的浓度。
统计分析
FEO分离、分析和纳米乳配方的结果平均至少有两次重复±标准差(SD)。另一方面,生物活性的结果(以图表表示)采用单因素方差分析(SPSS程序,版本21)进行。所有图表中的条形都表示为三个不同实验的平均值(n= 3)±sd。治疗组与对照组差异显著,p值< 0.05。
结果与讨论
乳香精油(FEO)的表征
乳香油胶的蒸馏得到一种无色透明的精油,具有类似于其母油胶的辛辣木质香气。FEO的产率为5%±0.05 (w/w),这与文献表明的产率在5% ~ 15%之间的结果一致(Mertens et al.)。2009).表格2GC-FID和GC-MS分析表明,α-蒎烯是FEO的主要成分(约60%)。这一结果与Woolley等人的结果一致。2012),他们之前证实这种化合物是FEO的主要挥发性化合物(68%),并专门与乳香有关,乳香属于Boswellia骶骨物种。另一方面,Van Vuuren等人(2010的α-蒎烯含量较低b .骶骨同一物种(Al-Harrasi和Al-Saidi)的FEO值也在18%到22%之间,甚至更低(5.3%)2008).事实上,α-蒎烯的含量不仅在属的17种植物中存在显著差异Boswellia(莫顿等。2009),但也有不同b .骶骨物种(Van Vuuren et al。2010).这是由于地理位置、气候、收获条件的变化以及其他因素(Mikhaeil等。2003).因此,重要的是将本研究报告的FEO抗肺癌活性结果与表2所示的化学成分联系起来,而不是将其推广到任何其他成分b .骶骨物种。
FEO纳米乳液的表征
采用低能乳化技术制备了FEO纳米乳液F1和F2两种配方。该技术简单,不需要高剪切设备制作,只需要对与系统界面特性相关的一些参数进行精细管理。包括表面活性剂的种类、表面活性剂与精油的比例、奥斯特瓦尔德成熟抑制剂和助表面活性剂(Edris2021).配制后对纳米乳液(F1和F2)的目视检查表明,这两种纳米乳液都表现出半透明的蓝色荧光(图)。1b).显示廷德尔散射效应,这是一个视觉特征,表明纳米颗粒的形成。在室温下储存期间,两种纳米乳液趋于逐渐平衡,直到呈现出透明透明的外观(图5)。1c),证实了直径< 100 nm FEO纳米粒子主要种群的存在。在室温下储存6个月,未发现相分离、云雾或不透明的迹象,表明重力分离的高动力学稳定性。
数字1d为FEO纳米乳在零时间和储存6个月后的粒径分布。在零时间(左),两种纳米乳剂均表现出双峰粒径分布,颗粒分布在两个居群中。第一个是粒子密集度为10.0 ~ 20.0 nm的主要居群(85% ~ 90%),第二个是粒子密集度为> 100 nm的次要居群(9 ~ 12%)。无助表面活性剂(PG)制备的F1纳米乳的z均值(d. nm)为95.57±0.3,多分散指数为0.162。含1% PG的纳米乳F2的z-均值(d.nm)为28.7±1.9,多分散指数为0.32。
TEM照片(图。1e)确定F1和F2的主要纳米尺寸种群(< 100 nm)。
储存6个月后(图。1D,右),大量的纳米颗粒(10-20 nm)仍然存在,表明没有聚集和高稳定性。有趣的是,纳米乳F2在储存后的尺寸分布有所改善,以至于它与F1的尺寸分布重叠,变成了几乎相同的图案。这表明在贮存过程中,颗粒不断平衡,直到达到最终的粒径分布模式。这种行为在图中得到了直观的证实。1b, c和我们之前的调查(Abd-Rabou和Edris2021).
细胞毒性评估
评价了纯非配制FEO (F0)及其两种配制纳米乳剂(F1和F2)、FEO主要挥发性成分α-蒎烯(PIN)和阳性对照阿霉素(DOX)对肺癌A549细胞和正常肺WI-38细胞的细胞毒性作用。前者细胞系通常用作乳香非挥发性部分(乳香酸)体外细胞毒性评估的模型,乳香非挥发性部分(乳香酸)是肺癌治疗的潜在候选者(Minghe et al. 2020)。本研究的细胞毒性效应通过两个术语进行评估和表示,即细胞增殖百分比(图1)。2模拟)和集成电路50值(表3.).这两种评价的结果连同讨论和合理化将在下一篇文章中介绍。
纯未配制FEO (F0)的细胞毒性
结果如图。2结果显示,F0治疗4 h后,A549细胞增殖率呈剂量依赖性和时间依赖性显著降低(P < 0.05)(图5)。2a), 24小时(图。2b), 48 h。2c), 72h。2d)潜伏期。FEO (F0)以100 μ g FEO/ml孵育4 h后,对A549癌细胞和正常WI-38肺细胞增殖的抑制作用分别为44.54%和74.02%(图1)。2a). 100µg/ml培养72 h后细胞毒性效应最高,肿瘤A549和正常WI-38肺细胞增殖分别达到12.33%和33.77%(图1)。2d)。
关于F0在IC方面的细胞毒性50,表2的结果表明,在72h的孵育期后,FEO转染量为34.60µg/ml,可清除一半(50%)肺癌A549细胞。而对于WI-38正常细胞株,则需要50.30µg/ml才能达到同样的效果。结果在表3.也表明肺癌细胞对FEO比正常肺细胞更敏感。这一观察结果也被报道为FEO(属于同一骶骨(Suhail et al。2011).然而,我们希望将我们的结果与相关研究进行比较,这些研究也评估了FEO对肺癌A549细胞的抑制作用,而不是任何其他类型的癌细胞。不幸的是,这些关键的调查很少,这使得我们的研究成为展示FEO(来自)潜力的倡议(第一份报告)b .骶骨)是一种对肺癌非小细胞(A549)具有细胞毒性的植物性挥发油。
一般来说,植物提取物的生物活性与其化学成分和活性原理直接相关。FEO主要挥发性成分为α-蒎烯(PIN),占精油总成分的60%左右(见表1)2).这种挥发性单萜化合物显示出对不同类型癌细胞的细胞毒性活性(Kumar等。2021;赵等。2018;陈等人。2015).它通过诱导细胞周期阻滞和细胞凋亡发挥活性。在以往对肺癌细胞的研究中,有报道α-蒎烯(单个)对肺癌A549细胞无明显的细胞毒性(Zhang et al.)。2015).然而,α-蒎烯与协议规定的抗肺癌药物如紫杉醇联合使用,通过协同作用增强了药物对这些癌细胞的细胞毒性(同文献)。
基于该通知,目前研究的作者将单个α-蒎烯(PIN)与FEO一起纳入细胞毒性评价(图1)。2模拟和表2),比较他们的活动。结果表明,FEO (F0)在4 ~ 72 h后抑制癌细胞增殖率较PIN高,具有较高的细胞毒作用。这个结果也是通过IC确认的50评估(表3.),表明仅经过4小时的潜伏期IC50F0为64.1,PIN为72.4,变化倍数为0.88。
72小时后,IC50F0和PIN分别降至34.6和41.2,变化倍数为0.84。结果表明,α-蒎烯含量约为60%的FEO对A549肺癌细胞的细胞毒性大于单纯的α-蒎烯。这很可能是由于FEO中固有的α-蒎烯和其他邻近的挥发性成分之间的协同作用,这些挥发性成分共同构成了油。在此,我们想指出的是,80.1%的FEO挥发性化合物被识别出来(表2),而19.9%的次要化合物仍然未知,它们可能也参与了FEO的抗肺癌活性。
即使IC的折叠变化50年代FEO与PIN的差仅为0.8,制备纳米乳形式的FEO会增加该值,使FEO与纯α-蒎烯不可交换,这将在下一篇文章中说明。
FEO纳米乳(F1)的细胞毒性
水基纳米乳剂可通过静脉注射的水媒(如血液)给药和给药亲脂性药物。此外,药物纳米颗粒可以增强药物的细胞毒性活性,因为纳米颗粒能更好地扩散到癌细胞中,这在我们之前的研究中得到了证实(Abd-Rabou和Edris2021).因此,本研究中的FEO是在两种水基纳米乳液中配制的,分别为F1和F2。如前所述,这两种乳液的共表面活性剂丙二醇(PG)的含量不同。
对于F1(无PG配制),我们发现该纳米乳在100 μ g FEO/ml培养4 h后,对肺癌细胞增殖的抑制作用达到35.59%(图1)。2a).这种对癌细胞增殖的抑制作用几乎等同于对照药物DOX的抑制作用(35.60%),但低于α-蒎烯(57.2%)。而在相同条件下,正常肺细胞受F1影响较小,细胞增殖率保持在75.02%。两种细胞的增殖均逐渐受到时间依赖性的抑制,在孵育72 h后达到最高抑制水平。此时,F1对肺癌细胞增殖有明显抑制作用,在最高试验剂量下,其增殖率仅为1.61%。这说明与BIN和参比药物DOX相比,BIN和DOX的细胞毒性作用更强,细胞增殖率分别为19.8%和8.3%。与此同时,纳米乳F1在孵育72 h后对正常肺细胞增殖的影响较小(52.77%)(图1)。1d)。
根据这些结果,表3.也证实了之前的发现,其中IC50孵育72 h后,F1、BIN和DOX的µ分别为22.22、41.2和32.09 g FEO/ml。另一方面,IC50在相同条件下,正常肺细胞的F1µg FEO/ml为65.70。
比较纯未配制FEO (F0)和FEO纳米乳(F1)的细胞毒性,可以清楚地观察到后者由于纳米颗粒的含量而增强了细胞毒性。肺癌细胞在孵育72 h后几乎停止增殖(图。2d)用纳米乳F1。这表明细胞毒性高于F0,在相同的潜伏期后细胞增殖达到12.3%。
更有趣的是,F1纳米乳的细胞毒性超过了参照药物DOX,其中约8.3%的肺癌细胞在药物孵育72 h后仍在增殖。
关于IC的细胞毒性50值,表2表明在整个孵育过程中,F1纳米乳的该值始终低于F0、PIN和DOX。
FEO纳米乳的细胞毒性(F2)
FEO纳米乳F2的组成与F1相同,但在配方中加入了额外的成分1.0% PG。该化合物通常用作辅助表面活性剂,以促进纳米乳的形成(Edris2021).然而,我们注意到,即使不使用PG,也可以制备FEO纳米乳,就像纳米乳F1一样。这一观察结果表明,FEO具有容易形成纳米乳的固有倾向。这可能是由于所选表面活性剂(Cremophor RH40)与精油成分(FEO)之间的相容性,在亲水性亲脂性平衡的意义上(Tokuoka等。1993).
在本节中,我们将评估在纳米乳F2中加入PG后,与未配制的FEO (F0)、无PG纳米乳(F1)、α-蒎烯(PIN)和药物(DOX)相比,细胞毒性是否有任何差异。
数字2a提示F2在所有潜伏期对肺癌细胞增殖的抑制程度均高于F0、F1、PIN和DOX。培养48 h后,浓度最高的F2纳米乳对癌细胞增殖有较强的抑制作用,而F0、F1、PIN和DOX处理的细胞仍以24.4%、7.5%、31.9%和20.5%的速率增殖(图1)。2c).经过72小时的潜伏期,F1和F2是经过测试的唯一能够(几乎完全)抑制癌细胞增殖的纳米乳剂配方(图)。2d)。
结果见表3.确认了之前的数据,其中IC50孵育72 h后,F1和F2的FEOµg /ml最低,分别为22.22和14.88 g /ml。
从同一表中可以看出,F2的fold change (FC1)最高,F2比F0增加了2.32倍,比药物DOX增加了2.16倍(FC2)。对于正常肺WI-38细胞,F2比F0减少0.94倍(FC1), F2比DOX减少0.93倍(FC2)。
从上述结果可以看出,PG对FEO纳米乳(F2)的细胞毒性有显著的提高作用。其作用机制可能与之前Zhao等人所报道的类似。2013)用于抗多药耐药癌细胞的pg -脂质体输送系统。他们假设PG有潜力提高膜的通透性,增加脂质体的流动性和灵活性,使其更容易变形,更容易被癌细胞吸收。关于PG在纳米乳中的掺入,据报道,这种化合物具有在油和水相之间的界面层形成乳液的主要表面活性剂的能力(Garti等。2001).定位(图。3.)会形成比单一表面活性剂更灵活的混合表面活性剂膜。这一行为赋予了纳米乳F2中的FEO纳米颗粒更大的灵活性和流动性,使其比F1更容易穿透癌细胞的细胞壁,正如F2增强的细胞毒性所预测的那样。
值得指出的是,在之前的调查中,赵等人(2013另一方面,在我们目前的研究中,纳米乳F2只使用了1.0%的PG,这初步表明FEO纳米乳中更多的PG可能具有比目前研究报道的更强的细胞毒性作用。然而,这个假设必须通过我们计划在下一个项目中进行的补充调查来验证。
FEO及其纳米乳对正常肺细胞WI-38的细胞毒性和安全性研究
化疗药物的主要缺点是缺乏选择性,导致对正常组织的有害作用。因此,寻找一种只针对癌细胞而不影响正常细胞的肿瘤特异性疗法是一个先决条件。在此基础上,本研究还对FEO和其他试验配方的细胞毒性与正常WI-38肺细胞进行了比较,以评估这些配方的安全性。
数字2a提示孵育4 h后,药物DOX和α-蒎烯PIN在最高剂量时对正常肺细胞的细胞毒性更强,细胞增殖抑制率均达到60.9%。F0、F1和F2对正常肺细胞的细胞毒性较低,细胞增殖率显著提高(分别为74.0%、75.0%和80.2%)。72 h后,DOX和PIN的细胞毒性进一步增强,正常细胞增殖能力分别下降至37.6%和34.7%。而0、F1和F2的细胞毒作用相对较小,细胞增殖率较高,分别达到33.7%、52.7%和56.0%。表格3.说明F1和F2对正常肺细胞有更大的安全限制,其中IC50孵育72 h后,FEOµ(65.70和66.34 g /ml)最高。
因此,很明显,FEO纳米乳F2在所有测试化合物中对正常肺细胞的细胞毒性相对最小。有趣的是,正如前面所示,同样的纳米乳对肺癌细胞也表现出了最高的细胞毒性,说明了纳米乳F2的特殊态度。数据表3.关于IC的细胞毒性50数值证实了同样的结果。
众所周知,p53激活通过调节细胞周期检查点(s期或m期)保护正常细胞免受化疗的细胞毒性。这一想法为开发新的抗癌候选药物(如本研究中的纳米乳F2)打开了治疗的窗口,它可以上调p53基因的表达。一个方向是诱导癌细胞凋亡,而另一个方向是通过调节正常细胞的细胞周期检查点(Cheok2012).
细胞凋亡
本节在研究了FEO及其两种纳米乳对肺癌A549和正常肺WI-38细胞的细胞毒性作用后,探讨了其杀死肺癌细胞的机制途径。该方法通过流式细胞术分析以及促凋亡基因(DR5、FAAD、Caspase 8 (Cas8)、p53和Bax)和抗凋亡基因(Bcl-2、NF-kB和STAT-3)标记的遗传表达来实现。
流仪结果
流式细胞分析是一种基于激光的技术,用于检测和测量一群细胞的物理和化学特征。它是研究细胞程序性死亡(凋亡)最流行的应用之一。肺癌A549和正常肺WI-38细胞凋亡图(图。4a, b)及其图形表示(图。4c-f)用不同FEO配方处理后,呈现。
从无花果。4a, b,可见肺癌A549细胞在阴性膜联蛋白V/阴性PI象限的计数百分比分别在F0、F1和F2治疗后逐渐降低。数字4c为不同处理后未凋亡的肺癌A549细胞,分别用F0、F1和F2处理后细胞数量逐渐显著减少,其中以F2纳米乳减少最多(47.4%)。因此,肺癌A549细胞中有超过一半的细胞发生了凋亡。另一方面,纯α-蒎烯(PIN)和药物(DOX)对未凋亡的A549细胞的抑制作用与F0的作用近似(约70%)。
在正常肺WI-38细胞中,F2(89.3%)和F1(85.0%)的未凋亡细胞数量没有显著减少。因此,正常细胞向凋亡转变的比例非常低(约10.0%)。
数字4d为Annexin V染色的细胞,即早期凋亡细胞,说明FEO纳米乳F2后加F1对肺癌A549细胞诱导的早期凋亡最高,F2诱导的早期凋亡比例最高(51.6%)。数字4e为经碘化丙啶染色的细胞,即坏死细胞,说明F1、DOX、F0对A549细胞的坏死作用较小,其中F1纳米乳的坏死率最高(0.13%)。数字4f为Annexin V和碘化丙啶染色的细胞,即晚期凋亡细胞。从图中可以看出,F2、F1、PIN和DOX诱导A549细胞凋亡,其中F1的凋亡率最高(2.04%)。
一些精油可以促进线粒体膜的去极化,导致膜的通透性异常,导致自由基、细胞色素c、钙离子和蛋白质等促凋亡因子的泄漏,诱导细胞凋亡(Yaman et al.)。2021).据报道,芳香植物中的一些萜类化合物(如α-蒎烯)可诱导细胞膜电位的快速损失,激活caspase 3、6和7,最终诱导细胞凋亡(Bock和Tait)2020).与这一发现平行的是,Zhang等人(2015)表明α-蒎烯和β-蒎烯联合治疗对肺A549细胞凋亡具有协同作用。
基因表达
DR5、FAAD、Cas8、p53基因表达
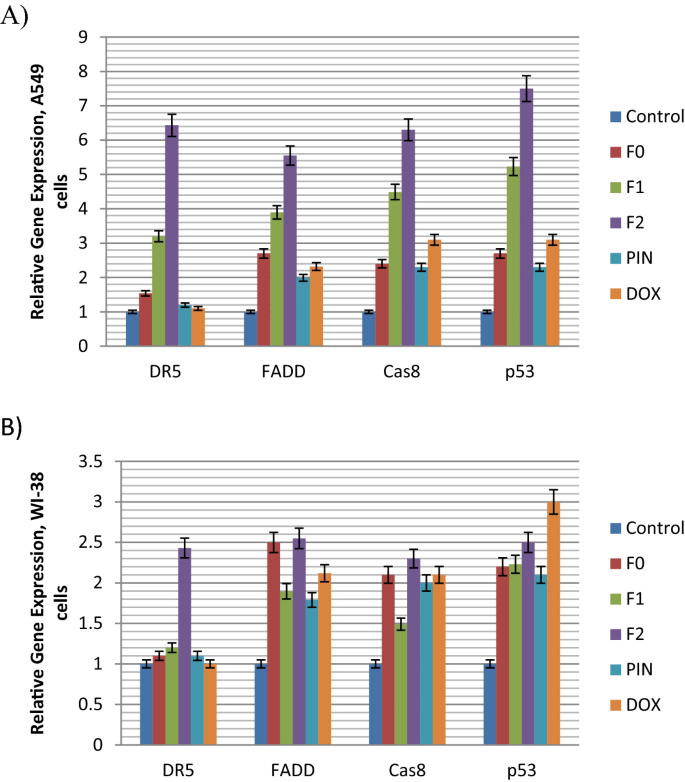
本研究评估了促凋亡(DR5、FAAD、Caspase 8 (Cas8)、p53和Bax)和抗凋亡(Bcl-2、NF-kB和STAT-3)基因标记的遗传表达(图4)。5,6,7)以支持从先前讨论的凋亡图中得到的结果(图。4).这些基因被称为外源性凋亡基因,不同于内源性Bax和Bcl-2基因,这些在目前的调查中也被研究过,(下一节)。
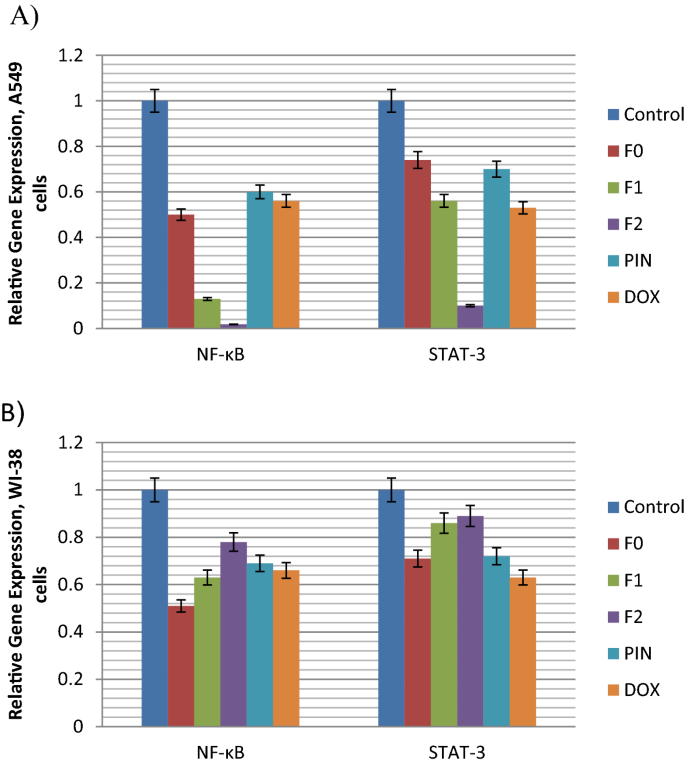
跟踪肺癌A549细胞的凋亡通路(图。5a)揭示F0、F1、F2和PIN上调了促凋亡死亡受体DR5的表达。与对照组(1)相比,只有F2的相对基因表达量显著增加(6.43)。对于正常肺WI-38细胞,与肺癌A549细胞相比,F2诱导DR5基因表达的程度也较低(2.43)(图1)。5b).这一结果表明F2通过dr5介导的凋亡通路对肺癌细胞起杀伤作用。这一数据与之前的一项研究(Lu et al。2008),提示乳香非挥发份乳香果酸可通过激活dr5介导的凋亡通路抑制前列腺癌细胞生长并诱导其凋亡。
在肺癌A549细胞中,使用FEO纳米乳剂(F1和F2)激活DR5可以通过细胞内死亡域(DD)产生凋亡信号(Gasparian等)。2009).随后是受体聚集,导致fas相关蛋白与死亡结构域(FADD)的招募(Abbas和Larisch)2020).在本研究中,FADD在肺癌A549细胞中均被上调,与对照组相比,纳米乳F2(5.55)的基因表达量最高(图1)。5一个)。
FADD适配器蛋白招募前caspase-8形成死亡诱导信号复合体(DISC)称为初级复合体。pro-caspase-8的募集导致其激活,随后caspase-3、-6和-7的切割导致膜起泡、DNA碎片和核收缩(Abbas和Larisch2020).因此,在本研究中,肺癌A549细胞中caspase-8被所有测试配方上调,与对照组(1)相比,F2中caspase-8上调率最高(6.3)(图1)。5a).该数据也得到了之前相同研究的支持(Lu et al.)。2008这表明乳香乳香酸通过激活caspase-8诱导细胞凋亡,caspase-8与死亡受体(DR5)水平升高相关,而与Fas或DR4水平升高无关。
P53被认为是一种主要的肿瘤抑制因子。p53的主要功能是通过控制细胞死亡途径预防癌症(Refaat等。2014).p53的激活对癌细胞的死亡和正常细胞的存活都是必不可少的(Cheok2012).在本研究中,在肺癌A549细胞中,使用所有测试配方后p53上调,与对照组相比,纳米乳F2的比例最高(7.5%)(图1)。5一个)。
数字5B显示在正常肺细胞中有一些促凋亡基因的上调,但其程度远低于在癌肺细胞中观察到的高度显著的上调。
Bax和Bcl-2基因表达
凋亡的内在途径中,激活的caspase-8需要Bax和Bcl-2基因参与线粒体应答。在该通路中,活性caspase-8上调bcl -2相关X蛋白(Bax),然后转移到线粒体。这导致线粒体膜极化的改变和细胞色素c的释放(Flores-Romero等2022)形成一种叫做凋亡体的结构。这种凋亡对其他caspase(9,3,6,7)的激活是必不可少的(Refaat et al。2014).在目前的研究中,我们发现肺癌A549细胞中Bax水平上调,而Bcl-2基因水平下调,与对照组相比,所有测试配方治疗后(图5)。6).
促凋亡基因(Bax)和抗凋亡基因(Bcl-2)的基因表达比例对于确认任何新治疗方法的凋亡效果都是非常重要的(图1)。6).因此,本研究计算了该比值,见表4.肺癌A549细胞数据(图。6a)表明与正常肺细胞相比,FEO纳米乳F2的Bax遗传水平最高(7.8),Bcl-2遗传水平最低(0.1)(图1)。6b). FEO纳米乳F1的Bax遗传水平较高(3.6),Bcl-2遗传水平最低(0.35)。F1和F2在WI-38正常细胞上Bax和Bcl-2基因水平变化不显著(约为1)。
Bax/Bcl-2比值高于(> 1)表示诱导凋亡,低于(< 1)表示抑制凋亡,见表4.从表中可以看出,与正常细胞相比,纳米乳F1的比例低于F2。纳米乳F2的Bax/Bcl-2比值最高,对肺癌A549细胞和正常WI-38细胞的Bax/Bcl-2比值分别为78.50和1.54。另一方面,F1的活性仅次于F2,肺癌细胞和正常细胞的Bax/Bcl-2比值分别为10.00和1.5。
与FEO纳米乳(F1和F2)相比,F0、PIN和DOX也能提高Bax/Bcl-2的比例,但提高的方式非常低。肺癌细胞与正常肺细胞比较,F0、PIN、DOX的Bax/Bcl-2比值无明显变化(表2)4).
总的来说,精油能够改变Bcl-2和Bcl-2的表达水平伯灵顿导致细胞色素C释放和诱导癌细胞凋亡的基因(Cha et al。2009).这是通过激活caspase 9和3来实现的,这反过来又会导致细胞凋亡。抗凋亡Bcl-2蛋白通过精油对癌细胞的作用而下调。
NF-kB和STAT-3基因的表达
化疗耐药的产生是癌症治疗后可能出现的一个众所周知的现象。它通过诱导一些生存(抗凋亡)基因,如NF-kB和STAT-3,导致癌症的复发。因此,抑制这些基因是一种很有吸引力的治疗策略,并纳入了本研究。
数字7a表明,肺癌A549细胞中NF-kB和STAT3基因在所有配方处理后均被下调,其中FEO纳米乳F2的下调量最高(分别为0.018和0.1),与对照组(1.0)相比。另一方面,Fig。7B在正常肺细胞中存在一些不显著的生存基因下调,但下调程度远低于癌肺细胞。
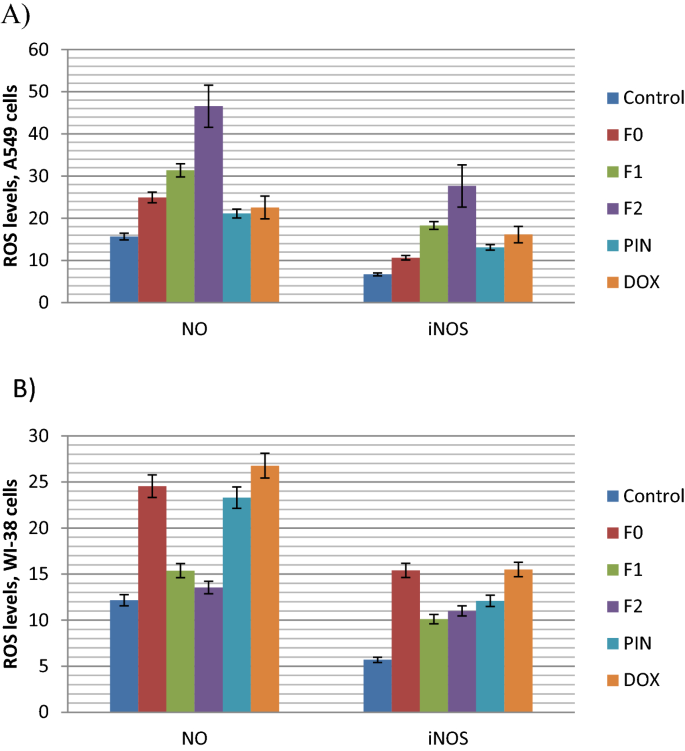
活性氧种类的评价
活性氧(ROS)如一氧化氮(NO)会导致DNA损伤和p53激活。这导致DR5直接上调(外部凋亡途径)(Kannappan等。2010),或激活Bax上调(固有凋亡通路)(Park等。2013).此外,DR5激活剂可以通过下调NF-kB和STAT途径发挥作用(Nazim等2020).
因此,我们通过测定一氧化氮(NO)及其酶、诱导型一氧化氮合成酶(iNOS)等ROS标记物的含量,研究这两种FEO纳米乳诱导ROS介导的细胞凋亡的潜力。数字8显示了肺癌和正常细胞在不同配方与对照治疗后产生的NO和iNOS水平。两种ROS标记物(NO和iNOS)均显著升高(P< 0.05),与未处理对照(15.6和6.7)相比,F2纳米乳显著性显著(分别为46.54和27.64)。另一方面,与未处理的对照(分别为15.6和6.7)相比,F1纳米乳也诱导这两种标记物显著升高,但幅度较小(分别为31.37和18.39)。
两种FEO纳米乳均显示正常肺WI-38细胞中NO和iNOS水平无显著升高(图1)。8b).这一结果表明纳米乳剂激活了iNOS酶,在肺癌A549细胞中诱导no介导的细胞凋亡,而在正常肺WI-38细胞中没有。
一般来说,据报道,精油可通过增加ROS的产生来诱导癌细胞死亡。这一现象导致细胞死亡介导的凋亡(seure et al。2011).此外,一些萜烯(如α-蒎烯)抑制细胞增殖,诱导氧化应激,增加ROS形成,并引起细胞凋亡(Wang et al.)。2021).
结论
乳香精油中富含α-蒎烯Boswella骶骨油树胶具有促进肺癌A549细胞凋亡和防止复发的作用。在丙二醇作为共同表面活性剂的水基纳米乳液中,该油的配方大大增强了其对肺癌细胞的细胞毒性,而对正常细胞的影响最小。本研究的结果可能有助于从乳香的挥发分中开发一种植物基植物化学物质,这种化学物质有可能用作肺癌化疗的辅助剂。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
Abbas R, Larisch S(2020)靶向XIAP促进癌细胞死亡——ARTS和SMAC的故事。细胞9 (3):663 - 677
Abd-Rabou A, Edris A(2021)细胞毒性、凋亡和遗传评价黑种草精油纳米乳对人肝细胞癌细胞株的抑制作用。癌症纳米技术12:28-50
Abd-Rabou A, Ahmed H, Shalby A(2020)在抗乳腺癌和结肠癌的纳米平台中,硒克服了阿霉素耐药性。生物印迹医学文献93(2):377-389
Al-Harrasi A, Al-Saidi S(2008)植物认证油胶树脂精油的植物化学分析Boswellia骶骨(阿曼Luban)。分子13:2181 - 2189
Bittoni M, Bibi A, Williams N, Mendelson M, Grainger E等人(2021)P4003一项富含植物化学物质的饮食干预试验预防肺癌:在高风险肺筛查诊所的实施。中华胸外科杂志16(3):S470-S471
Bock F, Tait S(2020)线粒体是细胞死亡的多面调控因子。细胞生物学21(2):85-100
Börner F, Werner M, Ertelt J, Meins J, Abdel-Tawab M等人(2021)乳香类药物调节炎症的乳香酸含量和相关药理活性分析。系统地14:660 - 672
陶粒J, Groo A, Iacopetta D, S´eguy S等人(2021)提高抗癌性能的制胜策略独联体基于纳米乳液配方的铂和槲皮素。药物输送科学与技术,66:102907
车东,文娥,金燕,车华,李燕(2009)茵陈蒿通过线粒体应激和mapk刺激信号通路介导的caspase激活诱导KB细胞凋亡。食品科学74:T75-T81
陈伟,刘颖,李明,毛杰等(2015)α-蒎烯通过诱导G2/M细胞周期阻滞对人肝癌细胞的抗肿瘤作用。中国药理学杂志27(3):332-338
Cheok C(2012)保护正常细胞免受化疗的细胞毒性。细胞周期11:2227 - 2232
邓勇,赵鹏,周丽,项东等(2020)全球、区域和国家层面的气管、支气管和肺癌流行病学趋势:一项基于人群的研究。《血液病杂志》13:98-113
Edris A(2021)利用低能技术开发和表征食品应用的无乙醇绿薄荷精油纳米乳。Gras y Aceit 72: e431-e431
Efferth T, Oesch F(2020)乳香的抗炎和抗癌活性:靶点、治疗方法和毒性。Semin Cancer biology 80:39-57
Falleh H, Ben Jemaa M, Neves M, Mitsutoshi H等人(2021)薄荷和紫薇纳米乳剂:配方、稳定性和抗菌活性。纳米级152:112377
Flores-Romero H, Hohorst L, John M等(2022)bcl -2家族蛋白tBID可作为凋亡的bax样效应因子。EMBO J 41: e108690
Garti N, Yaghmur A, Leser M, Clement V, Watzke H(2001)多元醇和乙醇存在下油/水食品级微乳液的增溶性改善。农业食品化学49:2552-2562
Gasparian E, Chernyak V, Dolgikh A, Yagolovich V, Popova N等(2009)新TRAIL突变体DR5-A和DR5-B对死亡受体5的选择性提高。细胞死亡:778 - 787
Hakkim L, Bakshi A, Khan S, Nasef M等(2020)乳香精油通过下调Bcl-2/Bax级联信号抑制黑素瘤癌,并通过I期和II期药物代谢酶改善肝毒性。Oncotarget 11 (23): 2259 - 2261
Hoy H, Lynch T, Beck M(2019)肺癌的外科治疗。危重护理护士诊所北Am 31(3): 303-313
黄敏,陆杰,丁杰(2021)天然产物在癌症治疗中的应用:过去、现在和未来。Nat Prod Bioprosp 11:5-13
Kannappan R, Ravindran J, Prasad S, Sung B等(2010)γ -生育三烯醇通过活性氧/细胞外信号调节激酶/p53介导的死亡受体上调促进trail诱导的凋亡。Mol Canc Ther:2196 - 2207
Katragunta K, Siva B, Kondepudi N, Vadaparthi R等人(2019)使用UPLC-Q-Tof-MSe对含有沙河榆提取物的草药配方中的沙河榆酸进行评估,并对次生代谢物进行综合表征。J pharma Anal 9:414-422
Khalifa J, Lerouge D, Le Péchoux C, Pourel N et al(2021)原发性肺癌的放射治疗Radiothérapie des cancer primitifs du poumon。癌症/ radiotherapie 26:231 - 243
Kieliszek M, Edris A, Kot A, Piwowarek K(2020)一些芳香植物及其代谢产物的生物活性,重点是促进健康的特性。分子25:2478 - 2497
Kumar A, Dev K, Sourirajan A(2021)迷迭香(Rosmarinus officinalis L.)、柠檬香(Cymbopogon citratus)精油Stapf。,而且the phyto-compounds, delta-carene and alpha-pinene mediate cell cycle arrest at G2/M transition in budding yeast Saccharomyces cerevisiae. South Afr J Botan 141:296–305
Li A, Flores K, Canavan M, Boffa D等(2022)T4非小细胞肺癌伴伴同侧肺结节的辅助化疗。Ann Thorac外科113:421-428
陆敏,夏玲,华红,景艳(2008)乙酰酮- - -乳酸菌酸通过死亡受体5介导途径诱导前列腺癌细胞凋亡。癌症Res 68:1180 - 1186
吕敏,邵松,张强,庄曦,乔涛(2020)乙酰11-酮酮-β-乳香酸在非小细胞肺癌细胞中通过细胞周期阻滞、诱导凋亡和抑制自噬作用发挥抗癌作用。Onco目标Ther 13:33 - 744
Mahalingam D, Szegezdi E, Keane M, de Jong S, Samali A (2009) TRAIL受体信号与调节:我们在正确的TRAIL上吗?癌症治疗Rev 35:280-288
莫滕斯M, Buettnera A, Kirchhoff E(2009)乳香挥发性成分:综述。趋势Fragr 24:279 - 300
米哈伊尔,马图克·T,巴德里亚·A,阿米尔·M(2003)乳香油的化学和免疫调节活性。中国生物工程学报(英文版
Nazim U, Yin H, Park S(2020)斑斑鱼素下调c-FLIP和上调DR-5通过自噬通量致敏trail介导的前列腺癌细胞凋亡。Int J Mol Med:280 - 288
Nguyen T, Kumar V, Ponnusamy V, Mai T等人(2021):用于非小细胞肺癌(NSCLC)治疗的纳米级制剂的临床前和临床应用的抗癌效果评估。过程104:55 - 75
Omara T, Kiprop A(2020)乌干达用于传统癌症治疗的药用植物:民族植物学调查综述。植物化学抗柱9:3529081
Park J, Choi S, Yoo H, Kwon K(2013)小分子MDM2抑制剂Nutlin-3通过p53介导的PUMA上调和ros介导的DR5上调,使Caki细胞对trail诱导的凋亡敏感。Anticanc药物24:260 - 269
Passiglia F, Bertaglia V, Reale M, Delcuratolo M等(2021)肺癌辅助治疗的重大突破:展望未来。癌症治疗Rev 101:102308
Refaat A, Abd-Rabou A, Reda A (2014) TRAIL组合:癌症治疗的新“追踪”(综述)。肿瘤防治杂志列托人7:1327 - 1332
Reis D, Jones T(2018)乳香精油作为癌症相关疲劳的支持性治疗:一个案例研究。Holist Nurs Pract 32:14 - 142
任鹏,任霞,程丽,徐磊(2018)乳香、松针和天竺葵精油通过调节乳腺癌AMPK/mTOR通路抑制肿瘤进展。肿瘤防治杂志代表39:129 - 137
罗德里格斯- canales J, Parra-Cuentas E, Wistuba I(2016)肺癌的诊断和分子分类。癌症治疗Res 170:25-46
Siddiqui A, Shah Z, Jahan R, Othman I, Kumari Y(2021)胃酸在阿尔茨海默病中的机制作用:强调抗炎特性。生物医学Pharmacother 144:112250
Siegel R, Miller K, Fuchs H, Jemal A(2021)癌症统计。CA Cancer J Clin 71:7-33
Singh J, Luqman S, Meena A(2021)植物化学物质在肺癌的预测、预后和诊断生物标志物中的新作用。食品化学毒理学144:111592
苏乌尔J, Marrot L, Perez P等(2011)Aniba rosaeodora精油对表皮样癌细胞的诱导凋亡作用。Mutat Res 718:24-32
苏海尔M,吴伟,曹阿,Mondalek G等(2011)Boswellia骶骨精油诱导人乳腺癌细胞特异性凋亡,抑制肿瘤侵袭性。BMC补充Altern Med 11:129-142
Suster D, Mino-Kenudson M(2020)原发性非小细胞肺癌的分子病理学。Arch Med Res 51(8): 784-798
Tan A, Tan S, Zhou S, Peters S等(2022)癌基因驱动型肺癌的靶向治疗在早期单臂与晚期随机临床试验中的疗效比较分析。癌症治疗Rev 104:102354
Titan A, He H, Lui N, Liou D等(2020)激素替代治疗对肺癌发病率和死亡率的影响。胸心血管外科杂志159:1546-1556
德冈Y,内山H,安倍M(1993)表面活性剂/水/合成香水三元体系的相图。胶体高分子学报,272:317-323
van Meerloo J, Kaspers G, clos J(2011)细胞敏感性测定:MTT法。方法Mol Biol 731:237-245
Van Vuuren F, Kamatou G, Viljoen A(2010) 20种商业乳香精油样品的挥发性成分和抗菌活性。南部J Botan 76:686-769
王锐,尚娟,赵旭(2021)α -蒎烯通过氧化应激和PI3K/AKT/NF-κB信号通路诱导MDA-MB-231人乳腺癌细胞凋亡。国际药典17:391-399
李勇,杨刚,赵春(2022)纳米乳在药物输送中的应用。颗粒64:85 - 97
Woolley L, Suhail M, Smith L, Boren E, Taylor C等(2012)Boswellia骶骨而且Boswellia carterii精油的气相色谱和手性气相色谱-质谱分析。J色谱A 1261:158-163
薛涛,赵旭,赵凯,陆燕,姚静等(2022)肺癌免疫治疗:聚焦CAR -T细胞治疗。癌症23:100791
亚曼C, Sari Y, Atmaca S, Eroglu Z等(2021)一些芳香植物和药用植物精油的化学成分和生物学效应。物理学报(5):699-706
Yoo Y, Lee J, Jung E, Park M等(2020)植物精油对A549和Detroit 551细胞的细胞毒性数据。数据短暂32:106186
张铮,郭松,刘鑫,高鑫(2015)α-蒎烯、β-蒎烯与紫杉醇协同抗非小细胞肺癌(NSCLC)。药品条例(stuttg) 65:214-218
赵颖,戴丹,吕晨,陈磊等(2013)载丙二醇脂质体表阿霉素能显著克服乳腺癌多药耐药。癌症列托人330:74 - 83
赵艳,陈锐,王艳,杨艳(2018)α-蒎烯抑制人前列腺癌异种移植小鼠模型生长。Chemother 63:1-7
确认
没有承认。
资金
科学、技术和创新资助局(STDF)与埃及知识银行(EKB)合作提供开放获取资金。
作者信息
作者和联系
贡献
AAA-R和AEE共同参与了稿件的设计、数据整理、撰写和修改。AEE负责植物提取物的提取、表征以及纳米乳液的配方和表征。AAA-R负责细胞培养、癌细胞增殖和传代、抗癌活性、凋亡实验和基因表达的评价。两位作者都阅读并批准了最终稿。
相应的作者
道德声明
伦理批准和同意参与
埃及开罗国家研究中心医学研究所当局批准了处理细胞系的伦理许可。
同意出版
不适用。
相互竞争的利益
我们声明作者没有BMC定义的竞争利益,也没有其他可能被认为影响本文报告的结果和/或讨论的利益。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。欲查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
乳香精油纳米乳特异性诱导肺癌细胞凋亡和抑制生存途径。癌症纳米1322岁(2022年)。https://doi.org/10.1186/s12645-022-00128-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12645-022-00128-9
关键字
- 乳香
- 精油
- 肺癌
- Nanoemulsion
- 细胞凋亡
- 基因表达
- 重现的抑制