摘要
带电粒子束癌症放射治疗,称为粒子疗法,是一种新的治疗方法,与传统的放射治疗相比有很大的优势。由于离子具有特定的弹道特性和较高的生物有效性,它们优于x射线。世界上许多医疗中心开始主要使用质子,但也有碳离子作为医疗光束。一些研究正试图降低成本/效益比,扩大治疗适应症的范围。粒子疗法的一个主要限制是,在到达肿瘤之前,离子轨迹入口的健康组织中存在低但显著的损伤。因此,提高肿瘤的靶向性,在恶性肿瘤中集中辐射效应是一个重大挑战。一种基于靶向肿瘤的纳米粒子的新策略,在十多年前被提出,以提高传统光子治疗的性能。最近,粒子疗法也出现了类似的进展,研究数量正在爆炸式增长。在这篇论文中,我们回顾了实验结果,以及理论和模拟研究,阐明了这一策略的有希望的结果和基础机制。几个实验提供了一致的证据表明,在纳米粒子的存在下,离子辐射效应显著增强。 In view of implementing this strategy for cancer treatment, simulation studies have begun to establish the rationale and the specificity of this effect. In addition, these studies will help to outline a list of possible mechanisms and to predict the impact of ion beams and nanoparticle characteristics. Many questions remain unsolved, but the findings of these first studies are encouraging and open new challenges. After summarizing the main results in the field, we propose a roadmap to pursue future research with the aim to strengthen the potential interplay between particle therapy and nanomedicine.
简介
50%的癌症治疗采用常规放射治疗。基于高能光子穿越全身的特性,这种非侵入性方法被用于治疗深部肿瘤。然而,由于光子的相互作用不是组织特异性的,当健康组织受损时,可能会引起严重的副作用甚至继发性癌症。因此,开发新的策略和提高辐射效应的肿瘤选择性是一个重大挑战。
由于初级(电子)过程的放大,用高z化合物富集肿瘤已被提出作为一种改善辐射效应的新策略。为了避免与辐射致敏药物混淆,那些使细胞对辐射更敏感的化合物,如DNA修复抑制剂、氧转运剂[见劳伦斯等人。2003)],在这篇综述中,我们使用术语“纳米放射性增强剂”(NRE)来区分这些化合物。
无线电增强的原理第一次被证明是使用金属络合物来增加高能光子的效应[见Kobayashi等人。2010)以供审阅]。然而,这些化合物的临床应用由于缺乏肿瘤选择性而受到限制。因此,纳米粒子(NPs)被认为是一种更有效的手段,可以提高肿瘤活性产物的浓度,从而提高辐射效应的肿瘤靶向性。NPs的选择性传递是由于当系统足够小(直径<200 nm)能够穿透肿瘤血管壁时,增强的渗透性和保留效应(EPR) (Jäger等)。2013).当纳米颗粒与肿瘤特异性制剂(如抗体或其他多肽)功能化时,也可以实现肿瘤靶向。2013)以供审阅]。因此,放射疗法与纳米医学的结合开创了一系列新的治疗方法(Kong et al。2008).Hainfeld等人(2008)首次表明,1.9纳米金核NPs可以延长160 kV x射线处理小鼠的寿命。黄金NPs是目前研究得最透彻的制剂[见她等人。2017和(Haume et al。2016)以供审阅]。其他复杂的NPs,由铪等重元素组成(Maggiorella et al。2012)和钆(桑西等人。2014)分别由Nanobiotix公司(Paris, France)和NH TherAguix公司(Villeurbanne, France)开发,已经被转移到临床。
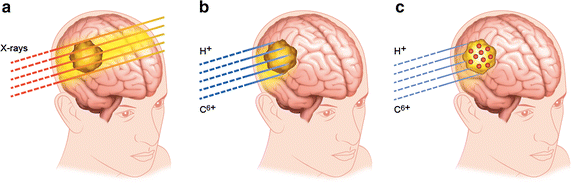
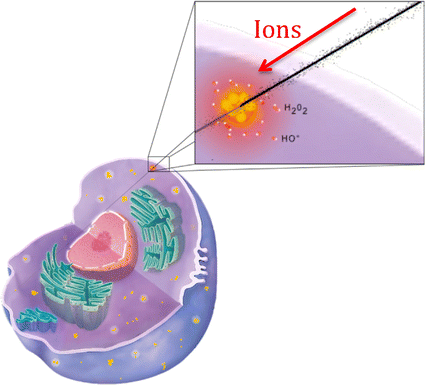
虽然传统的放射治疗已经有了极大的改进(例如IMRT技术),但对于位于敏感器官附近的肿瘤(如眼睛、大脑、颈部)的治疗以及对周围组织损伤可能造成严重后果的儿科病例的治疗,使用高穿透性光子仍然至关重要。后者主要与照射的几何形状(例如,在髓母细胞瘤的典型颅脊髓照射中,对脊柱的剂量是极其危险的)和患者的年轻年龄有关,这强调了后期的风险效应(Armstrong等。2010).此外,常规放疗无法根除罕见但侵袭性很强的放射抵抗性癌症,如胶质母细胞瘤和脊索瘤,对这些癌症的治疗效果仍然很差。对于这些情况,高能离子如质子(质子治疗)和碳离子(碳治疗)被提议作为替代方案(Durante et al。2017).离子束(70-400 MeV/amu)的主要优势来自于其穿透组织长达数厘米的特性,并在其轨迹的末端沉积最大能量,此时介质的电离截面非常大,且其初始能量依赖于其深度,在深度剂量曲线中形成所谓的布拉格峰(Schardt等人)。2010).因此,激光束可以通过调节其能量来瞄准肿瘤,而不损伤位于更深位置的组织(见图)。1)]。此外,由于离子束辐射与x射线相比具有更大的相对生物有效性(RBE),因为离子束辐射更密集的电离特性,在相同的交付剂量下提供更大的细胞杀伤能力(Scifoni2015),粒子疗法也是治疗耐辐射肿瘤最有效的方法(Ares et al。2009;Schlaff等人。2014;Kamada等人。2015;杜兰特等人。2017).在某些情况下,碳离子的效率是x射线的四倍(吕弗勒和杜兰特)2013;Kamada等人。2015).因此,至少在一些适应症方面,粒子治疗被认为优于常规放疗(Baumann等。2016),尽管成本很高,但质子治疗和碳治疗的新中心正在世界范围内发展。事实上,截至2017年4月,除了已经投入运营的74个中心外,还有83个新的中心已经开始建设(例如在美国达拉斯和中国兰州),至少还有40个中心(例如在澳大利亚、印度、丹麦和荷兰)正处于规划阶段(见Jermann)2015;Zietman2016)浏览最新的影印评论,并在PTCOG专门网站浏览最新资料:https://www.ptcog.ch/index.php/facilities-in-operation].
粒子疗法有两种不同的方式。一种是被动调制的宽波束模态,它由一个具有扩展布拉格峰(SOBP)的面向目标的波束组成。第二种是最近的铅笔波束主动扫描模式,用几毫米的波束在肿瘤上逐点扫描,调节每个深度切片的能量(Schardt等。2010).由于它的光束通过光束线材料的衰减更大,与铅笔光束相比,宽光束模式通常提供更大的入口通道剂量(Shiomi et al。2016).
因此,由于光束的物理轮廓,在到达肿瘤之前,离子在组织中沉积了低但显著的剂量(见图)。1B .不可避免。此外,对周围组织的损伤可能是由运动和一系列其他不确定因素引起的。
为了克服这些限制,在肿瘤中添加NREs被认为是一种具有挑战性的策略,它可以在局部放大离子辐射的影响,从而减少患者的总剂量。特别是造影剂的使用,提供了跟踪造影剂的生物分布以及在治疗前或治疗中对肿瘤成像的可能性。虽然纳米医学在传统放射治疗中正在接近临床阶段,但只有少数研究致力于高z NREs与离子束模式的结合。
这篇综述总结了首次实验和模型研究,展示和初步描述了不同的辐射增强剂的效果,包括金属配合物和NPs,用于提高粒子束处理的性能,如质子、氦和碳离子辐射。第一节揭示了关于(i)由不同离子辐射(氦、碳、铁)激活的铂配合物的作用的主要结果,(ii)与质子辐射结合的金NPs,以及(iii)与碳辐射结合的铂NPs和钆基纳米剂(AGuiX)。在第二节中,收集了离子辐射致辐射增强的最新建模和模拟研究成果,并对已知结果和有待解决的未决问题进行了总结。
实验研究概述
铂配合物与各种离子辐射的结合
这一策略的原理首先通过铂配合物(氯三吡啶铂,PtTC)作为放射性增强剂进行了证明(如下所示)。考虑到纳米级生物损伤对活细胞是最致命的,放大这些类型的损伤是该策略的主要挑战。因此,DNA质粒被作为纳米生物探针用于检测和量化纳米生物损伤的诱导。Usami et al. (2005)首次证明,当氦离子(143 MeV/amu初始能量和线性能量转移(LET)为2.24 keV μm时,铂基配合物的存在强烈地放大了这类损伤的诱导−1)被用作电离辐射(Usami et al。2005).结果表明,离子辐射效应的放大是由活性氧(ROS)的产生介导的(间接效应),>为90%。因此,高z介质对离子辐射的放大可以解释为(i)高z原子由于库仑相互作用而被轨道上的入射离子或电子激活,(ii)去激发和电子发射以及(iii)介质中自由基的产生。
之后,同一组观察到医学的影响碳离子(276伏/阿姆河,13 keV /μm和109伏/阿姆河,25.6 keV /μm)和铁离子(400伏/阿姆河,200 keV /μm)也可能是用来改善治疗(Usami et al。2007).这里再次证明了水自由基的重要作用。有趣的是,高LET铁离子的辐射增强效果较低。这归因于由于羟自由基的过量生产而导致的间接影响的减少,羟自由基重组并产生过氧化物(Hirayama et al。2009).
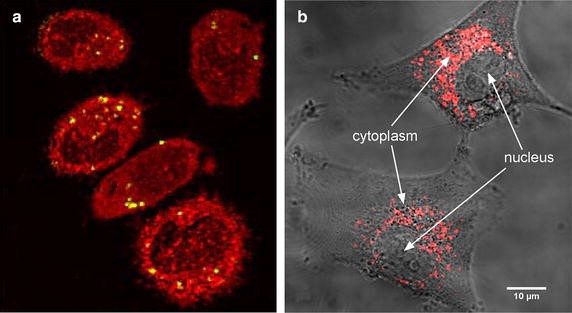
这些分子尺度实验之后是细胞尺度的原理证明研究。同样的铂配合物(氯三吡啶铂)在体外放大碳离子效应的效果(Usami等。2008年,一个).本研究证实了羟基自由基在其中起主要作用。有趣的是,我们发现每个履带的增强效能在履带端(高LET)更大,而从简单的机械论证,人们会期望相反,即更像光子的(低LET)条件下有更大的相对效应(详见下一节)。更重要的是,显微镜测量首次表明,尽管辐射增强剂的定位在细胞的细胞质而不是细胞核,但细胞杀伤增强了(见图。2a).这是一个主要的结果,它已经表明由电离辐射激活的高z剂的无线电增强从细胞的细胞质开始(见图。3.一个可能的模型)。
(改编自(Porcel et al。2014))
由细胞质中的纳米粒子引发的纳米级冲击示意图
这些研究为利用高z配合物提高粒子治疗的性能开辟了前景。他们阐明了辐射效应增强的假定的早期机制,特别是羟基自由基的作用。不幸的是,这些复合物不是肿瘤特异性的,也不能被医学成像(CT和MRI)检测到,不适合临床转移。
作为一种替代方案,纳米技术为靶向肿瘤开辟了新的视角。纳米粒子结合粒子辐射的影响已通过高能质子和医用碳离子进行了探测(见下文)。
纳米粒子与质子辐射的结合
Kim等人首次证实了高z纳米颗粒改善质子辐射性能的有效性。2010).他们观察到,由金或铁组成的小纳米颗粒(直径1.9-14 nm)增强了快速质子(45mev束,原始布拉格峰,在入口,LET未指定)治疗的CT26小鼠肿瘤的消退。他们还观察到,在体外实验中,当CT 26细胞加载纳米颗粒时,细胞杀伤增强。因此,该小组证明了在体内的影响与增加的细胞杀伤密切相关。这显示了细胞尺度对身体尺度影响的影响。作者提出的机制被证明是有争议的。质子诱导x射线发射(PIXE)不能作为辐射效应放大的主要过程(Dollinger)2011).事实上,纳米粒子被PIXE诱导的x射线激活的概率被证明是非常低的,正如Dollinger (2011).
黄金增强质子辐射效应的效率已被Polf等人在体外证实。2011).当负载含有金的噬菌体纳米支架(直径44 nm,每个细胞1 ng金),并在160 MeV质子照射下,细胞位于一个大(10 cm) SOBP中,平均LET约为12 keV/μm时,该小组观察到前列腺肿瘤细胞死亡率显著增加(RBE分别为15-19%,存活率为50%)。Kim等人(2012)之后证实,40 MeV质子(100-300 mg金/kg完全肿瘤消退>37%)治疗的肿瘤消退放大和小鼠存活率与肿瘤细胞中的ROS产生有关(Kim et al.)。2012).这一发现与上述铂配合物研究的结论完全一致。
珍妮斯等人(2014)发现50 nm柠檬酸包覆金纳米颗粒不能放大3 MeV质子对RT112膀胱癌细胞的作用(Jeynes et al。2014).然而,Li等人。2016)使用表皮样癌细胞(a431)观察到,当细胞负载5或10纳米PEG胺包覆金纳米颗粒时,2 MeV质子有更大的影响(Li等人)。2016).令人惊讶的是,纳米颗粒被发现位于细胞核中,这与其他大多数使用金纳米颗粒的研究不同。2016)]。他们强调了羟基自由基的重要作用。有趣的是,NPs的效应随着光束LET的增加而增加(在10和25 keV/μm LET光束下,放大因子分别为25 - 40%)。
最近用150 MeV质子激活的铂和钆纳米粒子进行的分子尺度实验突出了纳米生物损伤的放大效应(Schlathölter等。2016).这里再次显示了羟基自由基的作用。更重要的是,发现在离子轨迹的末端,无线电增强效应更大。
总之,这些研究加强了使用NREs在肿瘤中轨道端集中质子辐射效应的前景。
纳米粒子与碳离子的结合
Lacombe (Porcel et al。2010)是第一个证明小(3纳米)金属纳米颗粒能放大医疗碳束效果的机构(由日本千叶强子治疗中心HIMAC提供)。在分子尺度上,利用290 MeV/amu碳离子在两个let(13和110 keV/μm)下激活的铂纳米颗粒(涂有聚丙烯酸,PAA)实现了这一过程(Porcel等人)。2010).这里再次强调了ROS在纳米生物损伤放大中的作用。正如在下一节机制分析中更详细提到的,纳米粒子可能被带电粒子(入射离子或轨道的二次电子)通过库仑相互作用(包括电离和表面等离子体激元通道)激活。自由基的产生是由于纳米粒子释放的电子的相互作用,也由于从周围水分子中捕获电子。有趣的是,纳米颗粒结构的显著作用被观察到,金属纳米颗粒被发现比金属配合物在相同浓度下更有效。这是由于放射性增强剂对体积的影响,就纳米粒子而言,放射性增强剂的体积是几纳米量级的。在这个纳米体积中产生的电子和连续ROS团簇的发射有利于诱导复杂损伤。相比之下,分子剂对电子发射的放大体积较小,对纳米级分子损伤的诱导效率较低。因此,纳米粒子不仅增加了破裂的数量,而且提高了辐射效果的质量。
生物对这种早期纳米尺度扰动的反应可能是不同的,是几个细胞研究的主题。
考尔等人(2013)观察到装载金纳米颗粒的肿瘤细胞(HeLa)中碳离子辐射的放大(Kaur et al。2013).在62 MeV、290 keV/μm LET的碳离子束照射下,获得了接近40% RBE的剂量增强因子(DEF)。这应该与1 MeV伽马辐射激活纳米颗粒所获得的效果进行比较。与Polf等人的质子束照射相比,得到了更高的效果。2011).然而,由于研究小组使用了不同的细胞模型,细胞摄取和细胞敏感性很可能发挥了重要作用。
然后用钆基纳米剂(来自法国里昂Nano-H的AGuiX)证实了医疗碳辐射效应的放大。这些治疗剂具有独特的多模态特性,包括改善MRI对比度和增强辐射效应(Porcel等。2014).该研究表明,碳离子辐射(SOBP束290 MeV/amu)诱导的细胞杀伤即使在低浓度钆也会增强。细胞和分子的影响与ROS作用之间的关系也被显示出来。值得注意的是,钆基纳米颗粒位于细胞质中(见图)。2b (Stefančíková等。2014)],这证实了细胞杀伤的增强是在细胞质中开始的(可能通过自由基簇的产生)。本研究为在碳治疗中引入治疗学开创了先机。
最近,有报道称,装载14纳米金纳米颗粒并经碳离子辐照的HeLa细胞对细胞的杀伤增强(Liu等。2015).他们确定这种增强并不随着纳米粒子浓度的增加而增加,这表明这种效果与物理剂量无关。这证实了Porcel等人的结论(2014)和Mc Mahon等(2011),他们规定纳米粒子的作用是由于电子扰动和ROS产生在纳米尺寸的体积内受到限制,从而增加了辐射的毒性。在这里,纳米颗粒再次被发现位于细胞质中。
表中列出了第一部分中所报告的实验研究的详尽摘要1.
模拟研究
在光子照射的情况下,首次进行了纳米粒子诱导辐射增强的纳米机制建模。在这种情况下,辐射效应的放大是用在靠近核反应堆的地方剂量的纳米级增强来解释的。这是由McMahon等人证实的。2011),最近由Brown和Currell (2017),从而通过采用局部效应模型(Local Effect Model, LEM) (Scholz and Kraft)来解释几次实验的结果1996)最初是为离子束开发的。该模型在其简单的表述(LEM I)中预测,较高的密集电离(LET)辐射会导致较高的细胞杀伤,与生物靶上较高的空间电离浓度相关,然后诱导更严重的损伤,以更大的概率诱导致死效应,而不是细胞死亡。可以看出,简单地包括由俄热电子引起的剂量的高局部增强可以导致对径向剂量的显著影响,然后通过敏化增强比(SER)来量化诱导细胞杀伤的增加,即在某种程度上类似于RBE (McMahon et al.)给出相同的生物效应的剂量的比率。2011).
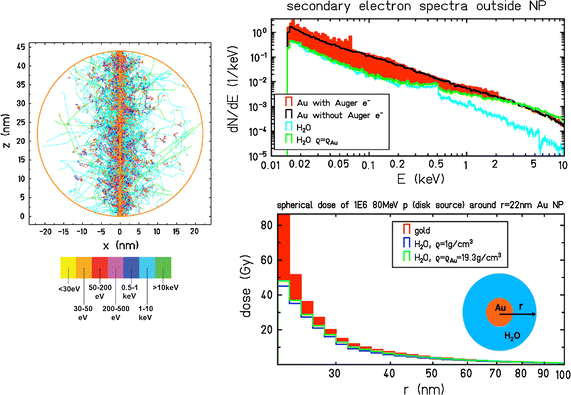
在离子束照射的情况下,观察到纳米颗粒在分子(DNA损伤)、体外(细胞杀伤)和体内(小鼠肿瘤回归)水平上的辐射效应增强,如前一节所述并列于表中1.然而,对光子的局部剂量增强的机制解释与对离子的不一样。在光子的研究中,与水中的光子辐照相比,NP的存在会引起径向剂量分布的大幅增加,这足以证明严重损害的当量存在相当大的差异。然而,在离子的情况下,剂量已经沿着轨道高度局域化,需要极高的局域剂量才能诱发对损伤浓度的额外影响,甚至不考虑过度杀伤效应。在这种情况下,辐射效应的增强还没有得到充分的理解。针对这一问题的第一项研究(Wälzlein等。2014)使用粒子轨迹结构代码TRAX (Krämer和Kraft1994),以分析质子束穿过的高z纳米粒子(Au、Pt、Ag、Fe和Gd)可能的剂量增强(见图。4).研究发现,纳米粒子周围的局部剂量有相应的增加,但相对增强比光子照射下观察到的要小得多。此外,在离子穿过纳米粒子的条件下进行了模拟,质子治疗采用典型的通量(106到109厘米−2)是非常罕见的。因此,在离子穿越的情况下,剂量增强效应应以这种极低的发生概率(≈10)来加权−3到10−4).总的来说,这将导致总体剂量增强效应显著降低。这项研究表明,与其他高z材料相比,金和铂在作为剂量增强剂方面具有更大的作用。更重要的是,它表明,对于质子辐射,可以观察到显著的剂量增强效应,主要是由于俄歇电子和连续级联。然而,这一过程并不足以证明任何整体的宏观效应,如在几个实验中观察到的那些。
高z NPs对离子辐射的放大效应可以用其他机制来解释,如x射线表明的辐射化学途径的修饰和辐射损伤中自由基介导成分的增强(Sicard-Roselli等人)。2014).
高和郑(2014)研究了不同的质子能量,发现大量的电子逃离纳米粒子以获得较低的初级离子能量。与高能质子(Gao和Zheng)诱导的电子相比,这些电子具有更低的能量和更短的范围2014).林等人。2014)试图建立质子和不同类型光子辐射之间的优点的比较数字(Lin et al。2014),提出了一个生物效应计算模型(Lin et al.)。2015)基于局部效应模型。该结果指出,与光子相比,质子需要更多的纳米粒子吸收,以便观察到类似的增强效果。对于能量较低的质子,这个浓度应该更高,以便发射的较低范围的电子到达并影响敏感的细胞成分。
Verkhovtsev等(2015年,一个,b)提出了通过表面等离子体激元激发的新通道的想法,这被证明与次级电子的大量产生有很强的联系,因此提出了剂量增强的新途径[Verkhovtsev等人。2015年,一个,b].作者表明,与直接电离相比,1 MeV质子的发射电子能谱增加了一个数量级。
使用蒙特卡罗计算的其他研究只关注由于吸收的物理剂量而引起的宏观剂量增强(Ahmad et al。2016;Cho等人。2016).研究发现,对于NP浓度的现实值,这种影响非常小。
最近的一项研究(Martínez-Rovira和Prezado2015)证实,仅基于电子产生的物理增强的纳米剂量增强不能解释实验中观察到的放大效应,还应考虑辐射化学或生物途径(Wälzlein等。2014).Verkhovtsev等人对质子与NP相互作用的蒙特卡洛研究进行了总结。2017).
最近的一项研究试图利用GEANT4和GEANT4- dna (Tran et al。2016).尽管该模型低估了在低能量下的二次电子产生,但本研究强调了一个有趣的“辐射溶解增强因子”,即由于金NP的存在而增加的自由基产生,它随着入射粒子的能量而增加。
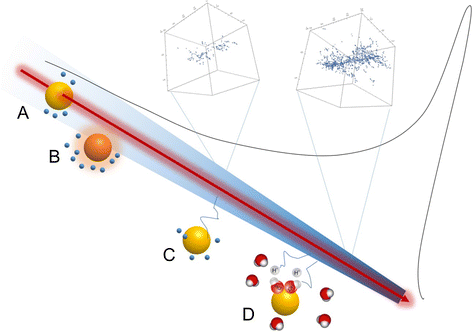
在无花果。5,我们展示了一个方案,总结了这些研究中提出的所有机制。
因此,尽管有几个问题已经得到了解答,但用新粒子增强离子束效应的模型还只是处于初始阶段。进一步的研究有很大的需要。特别是在输入放射性生物学效应之前,首先要验证的参数是纯物理过程的横截面,这是模拟代码中需要的。虽然许多研究都集中在检测生物效应上,但物理学本身仍有待完全阐明。例如,金等高z材料的弹性截面和非弹性截面还没有被详细表征,出现了相关的差异,例如在使用标准利弗莫尔库时(Wälzlein等。2014).这一方向的研究目前正在进行中,为TRAX中使用的截面集的有效性提供了部分确认(Hespeels等人)。2017).
至于寻找无线电增强的理想条件,只模拟了入射质子的影响,没有迹象表明轨道结构效应的可能趋势,因此强调了离子类型依赖性(超越纯LET),正如RBE所证明的那样(弗里德里希等人)。2013).至于纯能量(或LET)依赖,尽管有一些迹象,仍然没有一个完整的解释增强效应。特别是,从实验来看,这种依赖性似乎与直觉相反,它指向较高的LET有更大的效应,而人们应该预期更“类光子”的辐射类型有更大的增强。从这些研究中产生的挑战可能会刺激研究,不仅要阐明具体的机制,而且要重新考虑辐射生物损伤的一般范式(Scifoni2015).
此外,介质的氧化作用(通过氧增强率- oer量化)可能是重要的。带有离子束的OER具有很强的特性,随着LET的升高而降低(Furusawa et al。2000).到目前为止,还没有考虑与纳米粒子存在相关的OER效应,除了一项关于光子的研究,在该研究中缺氧细胞似乎没有被NPs致敏(Jain et al。2014).然而,这种效果可能与离子束不同,而且使用NPs额外敏化缺氧细胞的潜力是非常吸引人的。最后,但并非最不重要的是,有必要明确研究由细胞质中NPs介导的放射增强的情况。事实上,正如上面所讨论的,从之前的大多数研究来看,现在几乎可以确定,位于细胞质中的纳米增敏剂可以诱导细胞杀伤的增强(Usami et al.)。2008 b;Porcel等人。2010;Stefančíková等。2014),尽管如前所述,一些研究也在细胞核中发现了NPs (Li et al。2016).这种类型的研究最初是针对光子的,指出线粒体可能是敏感的目标(McMahon等。2017).在离子的情况下,这些目标将有一个完全不同的,可能更复杂的情况。
结论与展望
纳米制剂用于改善粒子治疗的性能的发展才刚刚开始。一些研究已经证明了这一策略的可行性,但纳米粒子的疗效必须进一步优化,才能使放射肿瘤学家对其产生临床兴趣。
使用几种纳米颗粒获得的结果已经很有前景,但还需要付出更大的努力来提高活性肿瘤靶向性、肾脏清除和通过医学成像(CT或MRI)检测这些制剂。未来的纳米制剂将有多种设计(如纳米粒子、纳米笼、纳米载体等)。2010;Yu等人。2012;Kunz-Schughart等人。2017)],并将提供独特的视角,以结合不同的形式使用同一化合物。例如,能够作用于免疫系统的NPs,如被提议用于某些癌症治疗的NPs (Dimitriou et al。2017;Ebner等人。2017),将会对粒子疗法特别感兴趣。
与此同时,预测评估所需要的与离子辐射效应增强有关的机制序列尚未完全揭示,但一些清晰的图像正在出现。然而,为了适当地模拟强化效果并在治疗计划中引入这一概念,将需要在物理步骤之后对辐射化学进行明确的描述。
粒子疗法和纳米医学的结合是一个新时代。它的发展取决于不同群体在开发具有竞争力的纳米制剂和预测模型方面分享专业知识的能力。在这方面,一个名为玛丽·居里ITN“ARGENT”的欧洲合作研究项目(http://itn-argent.eu)已经启动(Bolsa Ferruz等人。2017).
缩写
- 东航:
-
原子能中心
- 赵:
-
中华仓鼠卵巢
- CPBM:
-
光子生物医学中心
- CTCF:
-
校正总细胞荧光
- DMEM:
-
杜尔贝科改良鹰培养基
- EL4:
-
小鼠淋巴瘤细胞系
- “绿带运动”:
-
多形性成胶质细胞瘤
- GdBN:
-
提醒纳米颗粒
- GdBN-Cy5.5:
-
用菁5.5标记的GdBN
- 哈佛商学院:
-
汉克平衡盐溶液
- 鳗鱼:
-
电子能量损失能谱
- 英孚:
-
增强因子
- FITC:
-
异硫氰酸荧光素
- ICP:
-
电感耦合等离子体
- 让:
-
线性能量转移
- NPs:
-
纳米粒子
- SD:
-
标准偏差
- 科幻小说:
-
幸存的分数
- SR-DUV:
-
同步辐射深紫外线
- SQ20B:
-
人头颈鳞状细胞癌细胞系
- 透射电镜:
-
透射电子显微镜
- U87:
-
人胶质母细胞瘤细胞系
参考文献
Ahmad R, Royle G, Lourenco A,等。高z纳米材料在质子治疗中的作用研究。2016; 61:4537-50。doi:10.1088 / 0031 - 9155/61/12/4537.
阿瑞斯C,拥抱EB,洛马克斯AJ,等。点扫描质子辐射治疗颅底脊索瘤和软骨肉瘤的有效性和安全性:第一份长期报告。国际放射肿瘤生物学杂志2009;75:1111-8。doi:10.1016 / j.ijrobp.2008.12.055.
阿姆斯特朗GT,斯托瓦尔M,罗宾逊LL。儿童癌症成年幸存者中辐射暴露的长期影响:来自儿童癌症幸存者研究的结果。Radiat Res. 2010; 174:840-50。doi:10.1667 / RR1903.1.
鲍曼,郭文华,王文华,等。精准医疗时代的放射肿瘤学。Nat Rev Cancer。2016;16:234-49。
Bolsa Ferruz M, ivoevv V, Haume K,等。电离辐射和纳米粒子的新研究:ARGENT项目。纳米尺度的洞察离子束癌症研究。2017。doi:10.1007 / 978 - 3 - 319 - 43030 - 0 - _12.
布朗JMC,柯雷尔FJ。基于局部效应模型的纳米粒子放射敏化实验数据插值框架。癌症纳米技术。2017;8:1。doi:10.1186 / s12645 - 016 - 0025 - 6.
赵杰,gonzales - lepera C, Manohar N,等。物理因素对金纳米颗粒介导的质子剂量增强的定量研究。中华医学杂志2016;61:2562-81。doi:10.1088 / 0031 - 9155/61/6/2562.
Dimitriou NM, Tsekenis G, Balanikas EC,等。金纳米颗粒、辐射和免疫系统:这一新联盟对癌症治疗的物理机制和生物相互作用的当前洞察。2017。doi:10.1016 / j.pharmthera.2017.03.006.
金属纳米粒子结合粒子诱发x射线发射效应的治疗应用。纳米技术。2011;22:248001。doi:10.1088 / 0957 - 4484/22/24/248001讨论(248002).
杜朗特M, Orecchia R,吕弗勒JS。带电粒子治疗在癌症中的临床应用和未来展望。Nat Rev Clin Oncol, 2017。doi:10.1038 / nrclinonc.2017.30.
Ebner DK, Tinganelli W, Helm A,等。粒子辐射在癌症治疗中的免疫调节潜力。Front Immunol. 2017;8:99。doi:10.3389 / fimmu.2017.00099.
刘瑞。纳米粒子的智能靶向。Curr Pharm Des. 2013; 19:6315-29。doi:10.2174 / 13816128113199990375.
细胞存活对粒子种类的依赖性:明显且不可忽略。化学学报,2013;52:589-603。doi:10.3109 / 0284186 x.2013.767984.
古泽毅,福寿K,青木M,等。通过加速(3)He-, (12)C-和(20)ne -离子束灭活三种不同细胞系的好氧和缺氧细胞。Radiat Res. 2000; 154:485-96。
高健,郑莹。质子束照射下纳米金粒子产生二次电子的蒙特卡罗研究。国际肿瘤杂志。2014;2:25 5。doi:10.14319 / ijcto.0202.5.
Hainfeld JF, Dilmanian FA, Slatkin DN, Smilowitz HM。金纳米颗粒增强放疗效果。中国药理学杂志2008;60:977-85。doi:10.1211 / jpp.60.8.0005.
王晓燕,王晓燕,王晓燕,等。纳米金用于癌症放疗的研究进展。癌症纳米技术。2016;7:8。doi:10.1186 / s12645 - 016 - 0021 - x.
她的S, Jaffray DA, Allen C.金纳米颗粒在癌症放射治疗中的应用:机制和最新进展。Adv Drug delivery Rev. 2017; 109:84-101。doi:10.1016 / j.addr.2015.12.012.
李晓东,李晓东,李晓东,等。质子撞击碳和金膜后的背散射电子发射:实验和模拟。核仪器方法物理研究B部分束流与物质原子的相互作用。2017;401:8-17。doi:10.1016 / j.nimb.2017.04.032.
平山R,松本Y, Kase Y,等。DMSO对暴露于氦离子束的饱和氮哺乳动物细胞的辐射保护作用。放射物理化学。2009;78:1175-8。doi:10.1016 / j.radphyschem.2009.07.006.
Horcajada P, Chalati T, Serre C,等。多孔金属-有机骨架纳米载体作为潜在的药物传输和成像平台。Nat Mater. 2010; 9:172-8。doi:10.1038 / nmat2608.
Jäger E, Jäger A, Chytil P,等。通过hpma基共聚物和可降解聚酯的自组装,使用核壳纳米粒子进行联合化疗。J控制释放。2013;165:153-61。doi:10.1016 / j.jconrel.2012.11.009.
Jain S, Coulter JA, Butterworth KT,等。金纳米颗粒在低氧条件下的细胞吸收、毒性和放射敏化。Radiother Oncol. 2014; 110:342-7。doi:10.1016 / j.radonc.2013.12.013.
Jermann M. 2014年粒子治疗统计。Int J Part Ther. 2015; 2:50-4。
Jeynes JCG, Merchant MJ, Spindler A,等。使用自由基清除剂和不同能量质子的金纳米粒子辐射增敏机制的研究。中华医学杂志2014;59:6431-43。doi:10.1088 / 0031 - 9155/59/21/6431.
王晓燕,王晓燕,王晓燕,等。日本碳离子放射治疗20年临床经验评估。《柳叶刀》杂志2015;16:e93-100。doi:10.1016 / s1470 - 2045 (14) 70412 - 7.
王晓燕,王晓燕,王晓燕,等。葡萄糖包覆金纳米颗粒对HeLa细胞光子和离子辐射增敏作用的体外研究。核仪器方法物理研究B组束与物质原子的相互作用。2013;301:7-11。doi:10.1016 / j.nimb.2013.02.015.
金金奎,徐淑娟,金洪涛,等。通过质子照射纳米辐射体对金属纳米粒子的作用增强质子在小鼠肿瘤中的治疗。中华医学杂志2012;57:8309-23。doi:10.1088 / 0031 - 9155/57/24/8309.
金金奎,徐世杰,金金瑞h,等。金属纳米粒子结合粒子诱发x射线发射效应的治疗应用。纳米技术。2010;21:425102。doi:10.1088 / 0957 - 4484/21/42/425102.
小林K, Usami N, Porcel E,等。重元素辐射效应的增强。Mutat Res. 2010; 704:123-31。doi:10.1016 / j.mrrev.2010.01.002.
孔涛,曾杰,王旭,等。金纳米颗粒局部附着对乳腺癌细胞辐射毒性的增强。小。2008;4:1537-43。doi:10.1002 / smll.200700794.
Krämer M,卡夫G.重离子轨道结构的计算。Radiat Environ Bioph. 1994; 33:91-109。
Kunz-Schughart LA, Dubrovska A, Peitzsch C,等。纳米颗粒用于放射肿瘤学:使命,愿景,挑战。生物材料。2017;120:155 - 84。doi:10.1016 / j.biomaterials.2016.12.010.
Lawrence TS, Blackstock AW, McGinn C.常规化疗药物的放射增敏作用机制。Semin Radiat Oncol. 2003; 13:13-21。doi:10.1053 / srao.2003.50002.
李山,彭宁克斯,Karmani L,等。金纳米颗粒在质子辐照中的let依赖性放射增敏效应。纳米技术。2016;27:455101。doi:10.1088 / 0957 - 4484/27/45/455101.
林勇,王晓东,王晓东,等。纳米金颗粒增强质子治疗放射治疗的生物模型。中华医学杂志2015;60:4149-68。doi:10.1088 / 0031 - 9155/60/10/4149.
林勇,McMahon SJ, Scarpelli M,等。比较金纳米粒子增强放疗与质子、兆压光子和千压光子:蒙特卡洛模拟。中华医学杂志2014;59:7675-89。
刘宇,刘旭,金旭,等。辐射增强效应与暴露于低和高let辐射下的金纳米颗粒浓度的相关性。中华医学杂志2015;31:210-8。doi:10.1016 / j.ejmp.2015.01.006.
刘宇,刘旭,金旭,等。15 nm柠檬酸包覆金纳米粒子暴露于70 keV/m碳离子的辐射增强。纳米科学与技术,2016;16:2365-70。doi:10.1166 / jnn.2016.10917.
Loeffler JS, Durante M.带电粒子治疗优化,挑战和未来方向。Nat Rev clinin Oncol. 2013; 10:411-24。doi:10.1038 / nrclinonc.2013.79.
马乔雷拉L, Barouch G, Devaux C,等。氧化铪纳米粒子的纳米放射治疗。future Oncol. 2012; 8:1167-81。doi:10.2217 / fon.12.96.
Martínez-Rovira I, Prezado Y.质子治疗和纳米粒子联合的局部剂量增强的评价。中华医学杂志2015;42:6703-10。doi:10.1118/1.4934370.
McMahon SJ, Hyland WB, Muir MF,等。辐照重原子纳米粒子附近纳米尺度能量沉积的生物学后果。Sci rep 2011;1:18。doi:10.1038 / srep00018.
McMahon SJ, McNamara AL, Schuemann J,等。线粒体作为金纳米颗粒辐射致敏的靶点。J物理:Conf Ser. 2017;777:12008。doi:10.1088 / 1742 - 6596/777/1/012008.
王晓东,王晓东,王晓东,等。金纳米颗粒的细胞摄取及其作为定位显微镜标记的行为。中国生物医学工程学报,2016;38(1):54 - 54。doi:10.1016 / j.bpj.2016.01.004.
Polf JC, Bronk LF, Driessen WHP,等。内化金纳米颗粒在肿瘤细胞中质子放射治疗的相对生物有效性增强。应用物理学报,2011;98:193702。doi:10.1063/1.3589914.
波赛尔E,李S, Usami N,等。伽马射线和快离子辐射下的纳米增敏。J物理学报:Conf Ser 2012;373:12006。doi:10.1088 / 1742 - 6596/373/1/012006.
李文华,李文华,李文华,等。铂纳米颗粒:未来癌症治疗的有前途的材料?纳米技术。2010;21:85103。
Porcel E, Tillement O, Lux F,等。钆基纳米颗粒提高强子治疗性能。中国生物医学杂志2014;10:1601-8。doi:10.1016 / j.nano.2014.05.005.
李文华,李文华,李文华,等。利用治疗性钆基纳米探针提高放疗疗效。放射学杂志。2014;87:20140134。doi:10.1259 / bjr.20140134.
Schardt D, Elsässer T, Schulz-Ertner D.重离子肿瘤治疗:物理和放射生物学的好处。现代物理学报2010;82:383-425。doi:10.1103 / RevModPhys.82.383.
Schlaff CD, Krauze A, Belard A,等。重来:碳离子治疗在放射生物学和临床背景下。Radiat Oncol. 2014;9:88。doi:10.1186 / 1748 - 717 x - 9 - 88.
Schlathölter T, Lacombe S,尤斯塔斯P,等。用含金属纳米粒子改进质子治疗:纳米尺度的见解。国际纳米医学杂志2016;11:1549。doi:10.2147 / IJN.S99410.
轨道结构与重带电粒子生物效应的计算。Adv Sp Res. 1996; 18:5-14。
带电粒子的辐射生物物理方面:从纳米尺度到治疗。Mod Phys Lett A. 2015;30:1540019。
杨志刚,张志刚,张志刚,等。碳离子被动照射与扫描照射治疗胰腺癌的比较。Radiother Oncol. 2016; 119:326-30。doi:10.1016 / j.radonc.2016.04.026.
西卡尔德-罗塞利C, Brun E, Gilles M,等。辐照纳米粒子溶液中产生羟基自由基的新机制。小。2014;10:3338-46。
Stefančíková L,李文华,李文华,等。钆基纳米颗粒在胶质母细胞瘤细胞中的细胞定位和相关的放射致敏作用。癌症纳米技术。2014;5:6。doi:10.1186 / s12645 - 014 - 0006 - 6.
寺川一,石井K,山崎H,等。质子联合顺铂治疗小鼠实体瘤的PIXE分析。x射线光谱。2011;40:198-201。doi:10.1002 / xrs.1338.
Tran HN, Karamitros M, Ivanchenko VN,等。MeV质子辐照下纳米金颗粒吸收剂量和辐射解产率增强的Monte Carlo模拟。核仪器方法物理研究B段束流与物质原子相互作用。2016;373:126-39。doi:10.1016 / j.nimb.2016.01.017.
Usami N, Furusawa Y, Kobayashi K等。他快2 +负载含铂分子的DNA的离子辐照。国际放射生物学杂志2005;81:515-22。doi:10.1080 / 09553000500304318.
Usami N, Furusawa Y, Kobayashi K等。哺乳动物细胞装载的含铂分子对快速原子离子敏感。国际放射生物学杂志2008a。doi:10.1080 / 09553000802199846.
Usami N, Furusawa Y, Kobayashi K等。哺乳动物细胞装载的含铂分子对快速原子离子敏感。国际放射生物学杂志2008b; 84:603-11。doi:10.1080 / 09553000802199846.
Usami N, Kobayashi K, Furusawa Y等。快速原子离子C(6 +)和Fe(26 +)对载铂分子DNA的辐照。国际放射生物学杂志2007;83:569-76。doi:10.1080 / 09553000701447130.
Verkhovtsev A, Korol AV, Solov 'yov AV.原子团簇和纳米颗粒的辐照诱导过程。离子束癌症治疗的纳米级见解。Cham:施普林格国际出版;2017.p . 237 - 76。
Verkhovtsev AV, Korol AV, Solov 'yov AV。揭示了敏化纳米粒子提高低能电子产率的机理。物理学报2015a;114:63401。doi:10.1103 / PhysRevLett.114.063401.
Verkhovtsev AV, Korol AV, Solov 'yov AV。快速离子照射敏化金纳米颗粒产生电子。化学学报,2015b; 119:11000-13。doi:10.1021 / jp511419n.
Wälzlein C, Scifoni E, Krämer M, Durante M.质子辐照重原子纳米粒子的剂量增强模拟。中华医学杂志2014;59:1441-58。doi:10.1088 / 0031 - 9155/59/6/1441.
俞敏明,Park J, Jon S.多功能纳米颗粒在癌症成像和治疗中的靶向策略。开展。2012;2:3-44。doi:10.7150 / thno.3463.
粒子疗法在“引爆点”:红色杂志特别版的介绍。国际放射肿瘤学杂志2016;95:1-3。doi:10.1016 / j.ijrobp.2016.02.056.
作者的贡献
SL和ES在同一层次上参与了手稿的编写。EP协助SL完成最终稿件,所有作者阅读并认可了最终稿件。
作者的信息
S. Lacombe,巴黎南德大学教授,是离子与金属系统和生物系统的相互作用以及纳米粒子粒子治疗改进方面的专家,也是FP7-MSCA-PEOPLE-ITN-ARGENT项目的协调员。E. Porcel是医学物理学家,也是粒子疗法的专家。E. Scifoni博士,INFN研究员,粒子治疗生物物理建模和治疗计划专家。
确认
作者感谢欧盟委员会(FP7-MSCA-PEOPLE-ITN-ARGENT (No. 606381)和Université Paris-Saclay为纳米疗法研究计划提供的资助。他们还感谢Michael S. Dubow教授的校样阅读。
相互竞争的利益
本手稿的作者没有施普林格定义的竞争利益;他们没有任何其他利益影响本文的结果和讨论。
数据和材料的可用性
不适用。
发表同意书
不适用。
伦理批准和同意参与
不适用。
资金
这项工作由FP7-MSCA-PEOPLE-ITN-ARGENT项目(No. 606381)和Université Paris-Saclay IRS NanoTheRad资助。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
作者信息
作者和隶属关系
相应的作者
权利与权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。
关于本文
引用本文
Lacombe, S. Porcel, E. & Scifoni, E.粒子治疗和纳米医学:技术现状和研究视角。癌症纳米8, 9(2017)。https://doi.org/10.1186/s12645-017-0029-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12645-017-0029-x
关键字
- 粒子治疗
- 质子治疗
- 碳疗法
- 放射线增减
- Radio-enhancement
- 抗辐射性
- 纳米
- Theranostic
- 纳米粒子